Контрольная работа | Тест по химии (11 класс) по теме:
1. Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера б) водород и азот в) калий и кислород г) кремний и водород
2. Наименее полярной является связь:
а) C-H б) C-Cl в) C-F г) C-Br
3. Атомную кристаллическую решётку имеет:
а) сода б) вода в) алмаз г) парафин
4.Вещество, между атомами которого существует водородная связь:
а) этан б) фторид натрия в) этанол г) углекислый газ
5. Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в молекуле:
а) Ch4NO2 б) Nh5NO2 в) C5H8 г) h3O
6. Атом является структурной частицей в кристаллической решетке
а) метана б) водорода
в) кислорода г) кремния
7. Кристаллическая решетка графита
Кристаллическая решетка графита
а) ионная б) молекулярная
в) атомная г) металлическая
8. В каком соединении ковалентная связь между атомами образуется по донорно- акцепторному механизму?
а) KCl б) CCl4 в) Nh5Cl г) CaCl2
9. Химические элементы расположены в порядке уменьшения электроотрицательности в ряду:
а) N — O — F — Ne б) B — Al — Ga — In
в) S — Se — P — O г) As — Se — S — Cl
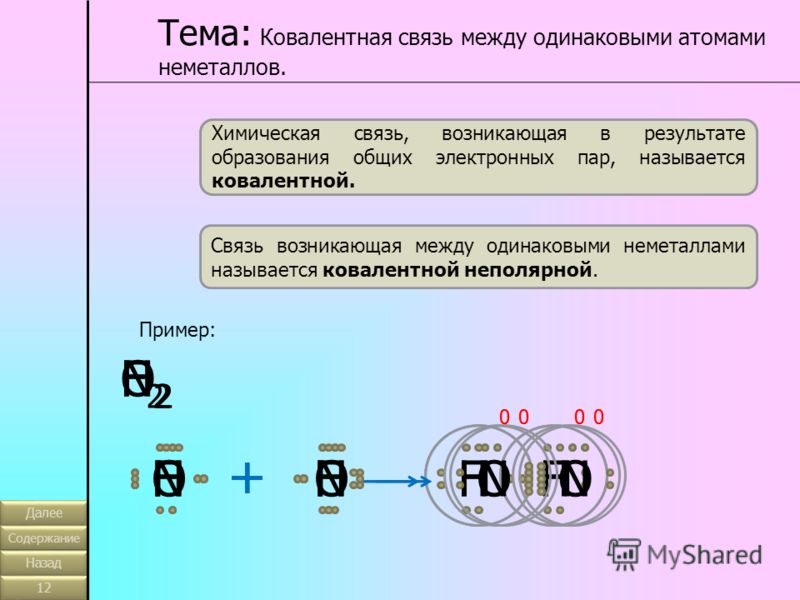
10. Соединением с ковалентной неполярной связью является:
а) N2O б) S8 в) Na2O г) SO2
11. В каком ряду все вещества имеют ковалентную полярную связь?
а) HCl, NaCl, Cl2 б) h3O, Nh4, Ch5
в) O2, h3O, CO2 г) NaBr, HBr, CO
12 Связь между атомами двух химических элементов, резко отличающихся по электроотрицательности, являются:
а) ковалентной неполярной б) ионной
в) ковалентной полярной г) металлической
13. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку
Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку
а) хлорид натрия;
б) оксид кремния;
в) алмаз;
г) углекислый газ.
14. К веществам с атомной кристаллической решеткой относятся
а) натрий, фтор, оксид серы (IV)
б) свинец, азотная кислота, оксид магния
в) бор, алмаз, карбид кремния
г) хлорид калия, белый фосфор, йод.
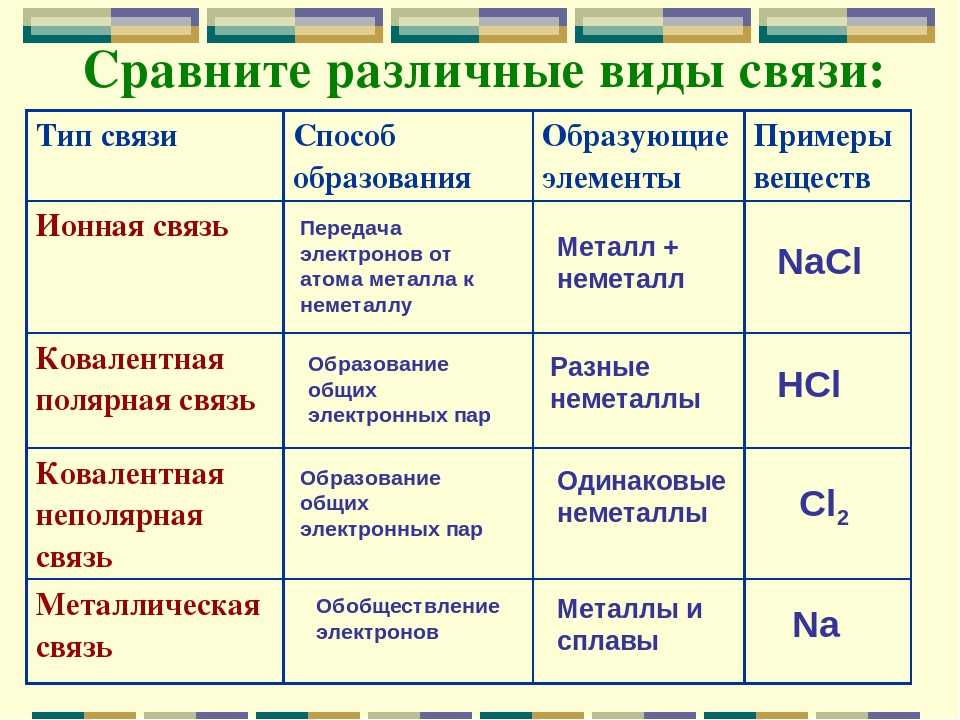
15. Установите соответствие между видом связи в веществе и формулой вещества:
ВИД СВЯЗИ НАЗВАНИЕ ВЕЩЕСТВА
А) ковалентная неполярная 1) PCl3
Б) ковалентная полярная 2) P4
В) ионная 3) Mg
Г) металлическая 4) Na2O
16. Определите вид связи и напишите электронные и графические формулы веществ: C2h3, Br2, K3N.
Ионная химическая связь — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 1
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
где n — число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы:
3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.
4. Дополните таблицу «Ионная связь».
ЧАСТЬ 2
1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из
2. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.
Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.
3. Верны ли следующие утверждения?
3) верно только Б
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
2) водород и фосфор
3) алюминий и фтор
4) водород и азот
Составьте схемы образования химической связи между выбранными элементами.
5. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи:
Выберите химические элементы «А» и «Б» из следующего списка: кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Подходят для данной схемы кальций и хлор, магний и хлор, кальций и бром, магний и бром.
7. Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможности Интернета.
Хлорид натрия – вещество с ионной связью, без него нет жизни, хотя, когда его много – это тоже нехорошо. Даже есть такая народная сказка, где рассказывается о том, что принцесса любила своего отца короля так сильно, как соль, за что была изгнана из королевства. Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль – есть жизнь, но её потребление должно быть в меру. Потому что чрезмерное потребление соли сильно вредит здоровью. Избыток соли в организме приводит к заболеванию почек, меняет цвет кожи, задерживает излишнюю жидкость в организме, что приводит к отёкам и нагрузке на сердце.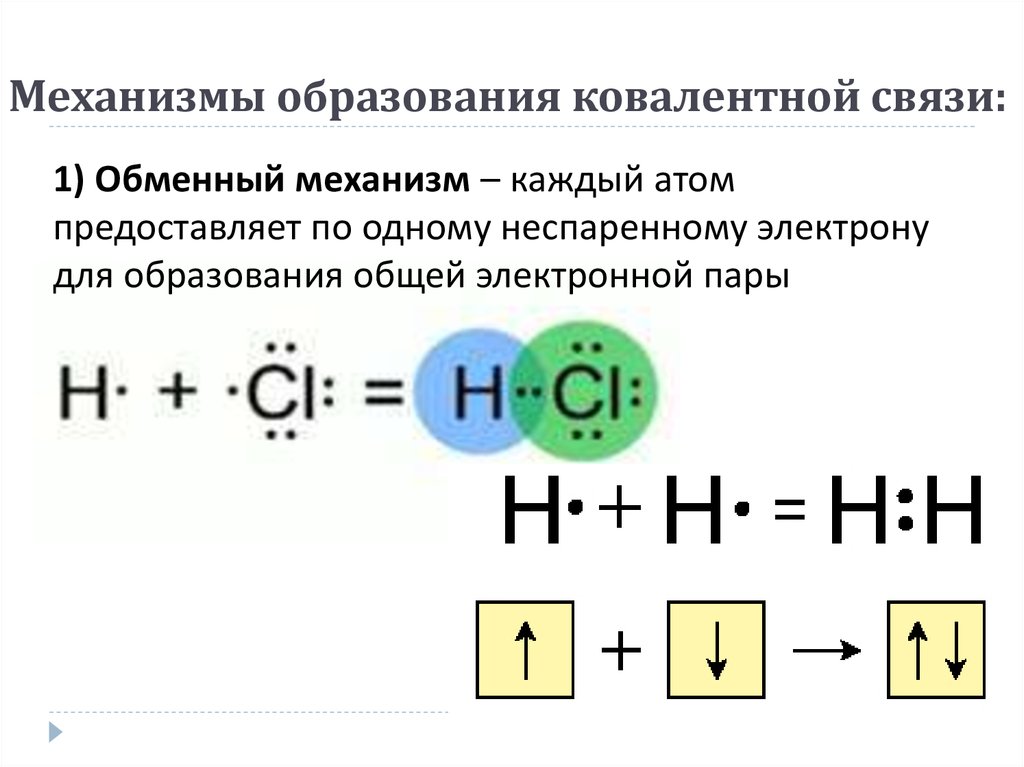
против ионных связей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1979
Существует два типа атомных связей — ионные связи и ковалентные связи. Они различаются по своему строению и свойствам. Ковалентные связи состоят из пар электронов, общих для двух атомов, и связывают атомы в фиксированной ориентации. Для их разрушения требуются относительно высокие энергии (50 – 200 ккал/моль).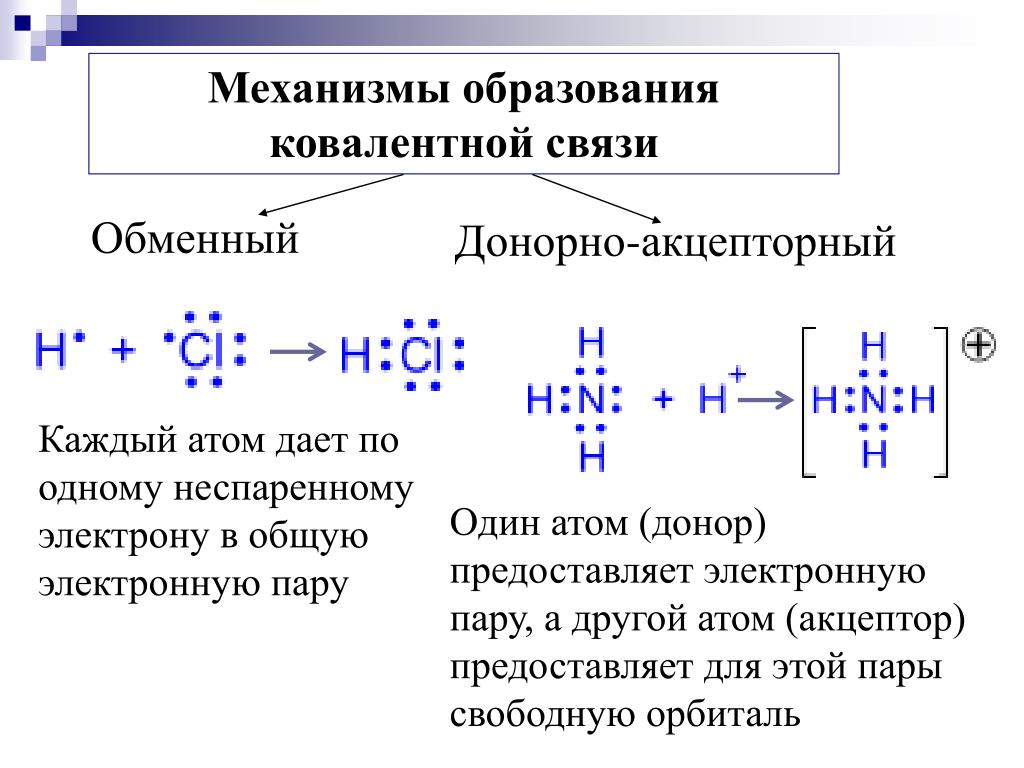
| Ковалентные связи | Ионные связи | |
|---|---|---|
| Состояние при комнатной температуре: | Жидкие или газообразные | Твердый |
| Полярность: | Высокий | |
| Формирование: | Ковалентная связь образуется между двумя неметаллами, имеющими одинаковую электроотрицательность.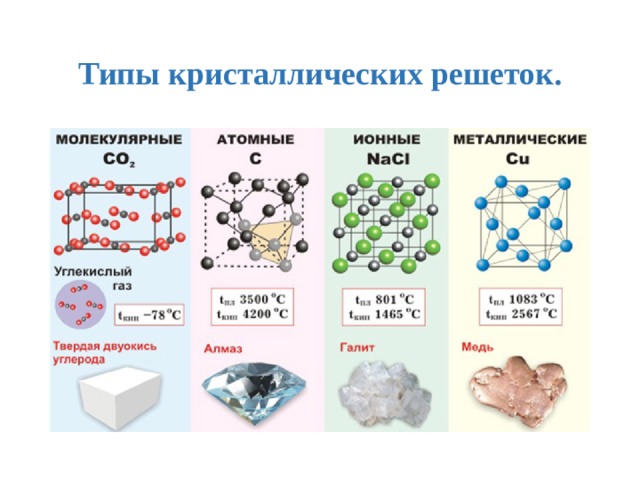 Ни один из атомов не является «достаточно сильным», чтобы притягивать электроны от другого. Для стабилизации они делят свои электроны с внешней молекулярной орбиты с другими Ни один из атомов не является «достаточно сильным», чтобы притягивать электроны от другого. Для стабилизации они делят свои электроны с внешней молекулярной орбиты с другими | Ионная связь образуется между металлом и неметаллом. Неметаллы (-ve ион) «сильнее» металла (+ve ион) и могут очень легко получать электроны из металла. Эти два противоположных иона притягиваются друг к другу и образуют ионную связь. |
| Форма: | Определенная форма | Нет определенной формы |
| Температура плавления: | низкий | Высокий |
| Что это?: | Ковалентная связь — это форма химической связи между двумя неметаллическими атомами, которая характеризуется общими парами электронов между атомами и другими ковалентными связями. | Ионная связь, также известная как электровалентная связь, представляет собой тип связи, образованной в результате электростатического притяжения между противоположно заряженными ионами в химическом соединении. Эти виды связей возникают в основном между металлическим и неметаллическим атомом. |
| Температура кипения: | Низкий | Высокий |
| Примеры: | Метан (CH 4 ), Соляная кислота (HCl) | Хлорид натрия (NaCl), серная кислота (H 2 SO 4 ) |
| Встречается между: | Два неметалла | Один металлический и один неметаллический |
- Контент взят с http://www.
 diffen.com
diffen.com
Covalent Bonds vs Ionic Bonds распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги

Ионные и ковалентные связи — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 839
Существует множество типов химических связей и сил, связывающих молекулы вместе. Два самых основных типа связей характеризуются как ионные или ковалентные. При ионной связи атомы передают друг другу электроны. Для ионных связей требуется как минимум один донор электронов и один акцептор электронов. Напротив, атомы с одинаковой электроотрицательностью имеют общие электроны в ковалентных связях, потому что ни один из атомов не притягивает и не отталкивает общие электроны.
Введение
Ионная связь представляет собой полный перенос валентных электронов между атомами. Это тип химической связи, при которой образуются два противоположно заряженных иона. В ионных связях металл теряет электроны, становясь положительно заряженным катионом, тогда как неметалл принимает эти электроны, становясь отрицательно заряженным анионом. Ионные связи требуют донора электронов, часто металла, и акцептора электронов, неметалла.
Это тип химической связи, при которой образуются два противоположно заряженных иона. В ионных связях металл теряет электроны, становясь положительно заряженным катионом, тогда как неметалл принимает эти электроны, становясь отрицательно заряженным анионом. Ионные связи требуют донора электронов, часто металла, и акцептора электронов, неметалла.
Ионная связь наблюдается потому, что металлы имеют мало электронов на самых внешних орбиталях. Потеряв эти электроны, эти металлы могут достичь конфигурации благородного газа и удовлетворить правилу октета. Точно так же неметаллы, которые имеют около 8 электронов в своих валентных оболочках, склонны легко принимать электроны для достижения конфигурации благородного газа. При ионной связи можно отдать или получить более 1 электрона, чтобы удовлетворить правилу октетов. Заряды аниона и катиона соответствуют количеству отданных или полученных электронов. В ионных связях чистый заряд соединения должен быть равен нулю.
Эта молекула натрия отдает одинокий электрон на своей валентной орбитали для достижения конфигурации октета. Это создает положительно заряженный катион из-за потери электрона.
Это создает положительно заряженный катион из-за потери электрона.
Этот атом хлора получает один электрон для достижения конфигурации октета, что создает отрицательно заряженный анион.
Прогнозируемая общая энергия процесса ионной связи, которая включает энергию ионизации металла и сродство к электрону неметалла, обычно положительна, что указывает на то, что реакция является эндотермической и неблагоприятной. Однако эта реакция весьма благоприятна из-за электростатического притяжения между частицами. При идеальном межатомном расстоянии притяжение между этими частицами высвобождает достаточно энергии, чтобы облегчить реакцию. Большинство ионных соединений склонны диссоциировать в полярных растворителях, потому что они часто являются полярными. Это явление связано с противоположными зарядами каждого иона.
Пример \(\PageIndex{1}\): Соли хлорида
В этом примере атом натрия отдает свой 1 валентный электрон атому хлора. Это создает катион натрия и анион хлора.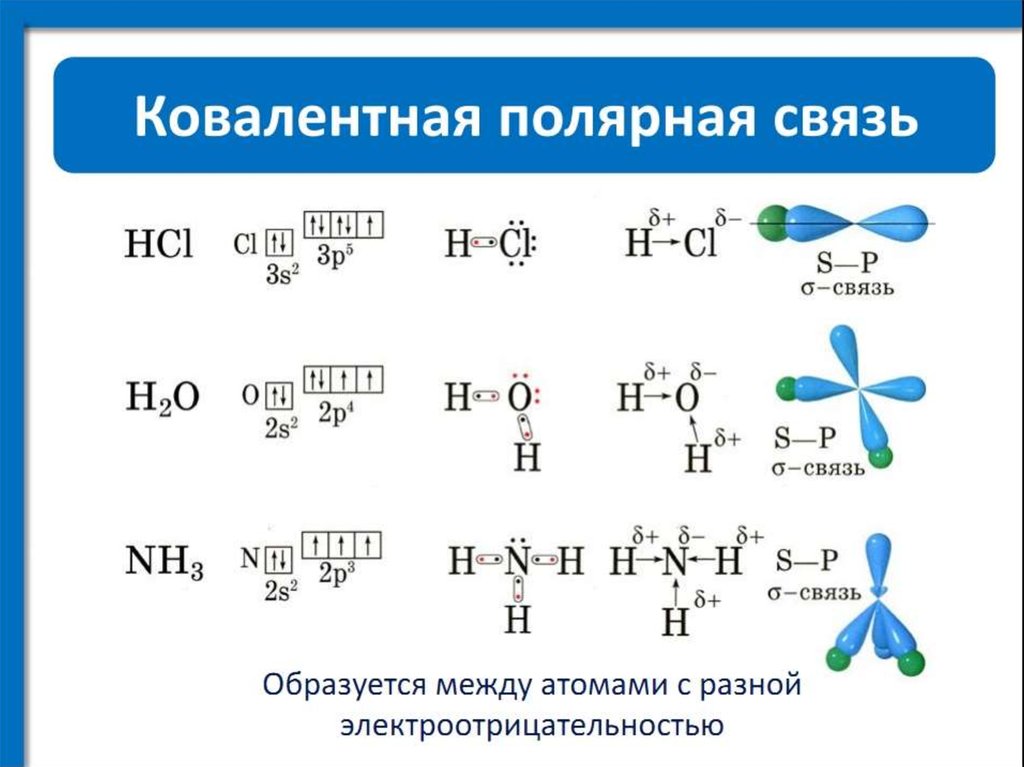 Обратите внимание, что суммарный заряд полученного соединения равен 0,
Обратите внимание, что суммарный заряд полученного соединения равен 0,
В этом примере атом магния отдает оба своих валентных электрона атомам хлора. Каждый атом хлора может принять только 1 электрон, прежде чем он сможет достичь своей конфигурации благородного газа; следовательно, 2 атома хлора необходимы, чтобы принять 2 электрона, пожертвованных магнием. Обратите внимание, что чистый заряд соединения равен 0,9.0024
Ковалентная связь
Ковалентная связь — это совместное использование электронов между атомами. Этот тип связи возникает между двумя атомами одного и того же элемента или элементов, близких друг к другу в периодической таблице. Эта связь происходит в основном между неметаллами; однако его также можно наблюдать между неметаллами и металлами.
Если атомы имеют одинаковую электроотрицательность (одинаковое сродство к электронам), наиболее вероятны ковалентные связи. Поскольку оба атома имеют одинаковое сродство к электронам и ни один из них не склонен отдавать их, они делят электроны, чтобы достичь конфигурации октетов и стать более стабильными.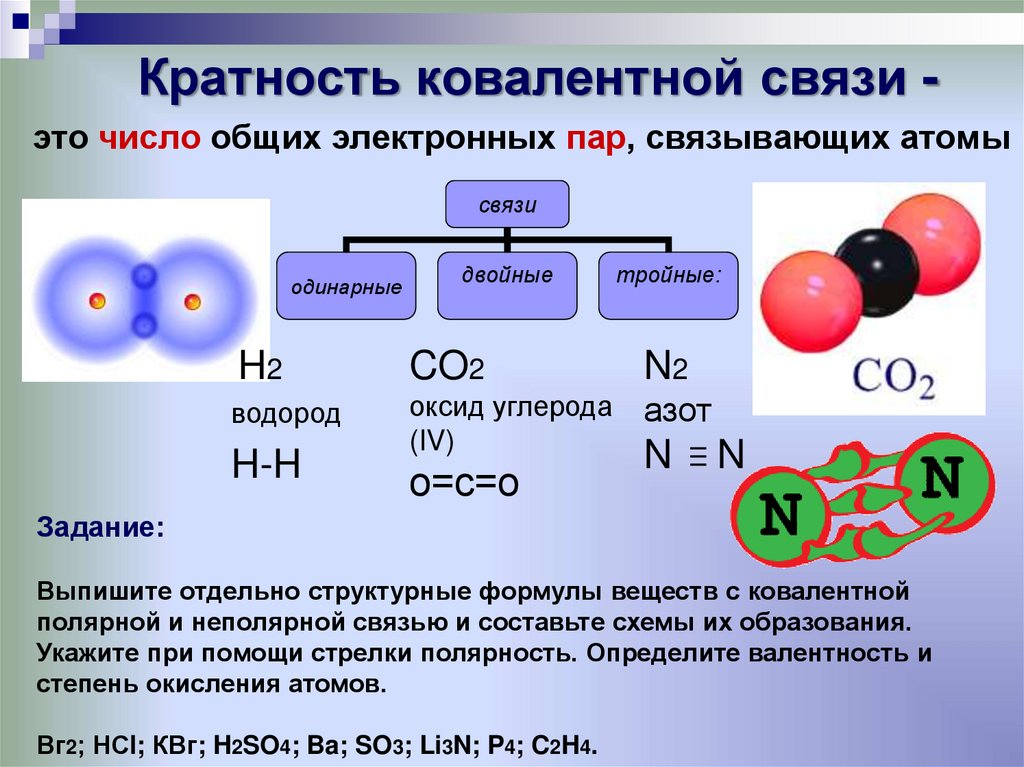 Кроме того, энергия ионизации атома слишком велика, а сродство атома к электрону слишком мало для возникновения ионной связи. Например: углерод не образует ионных связей, потому что у него 4 валентных электрона, половина октета. Для образования ионных связей молекулы углерода должны либо получить, либо потерять 4 электрона. Это крайне неблагоприятно; поэтому молекулы углерода делят свои 4 валентных электрона через одинарные, двойные и тройные связи, так что каждый атом может достигать конфигураций благородного газа. Ковалентные связи включают взаимодействия сигма- и пи-орбиталей; следовательно, ковалентные связи приводят к образованию одинарных, двойных, тройных и четверных связей.
Кроме того, энергия ионизации атома слишком велика, а сродство атома к электрону слишком мало для возникновения ионной связи. Например: углерод не образует ионных связей, потому что у него 4 валентных электрона, половина октета. Для образования ионных связей молекулы углерода должны либо получить, либо потерять 4 электрона. Это крайне неблагоприятно; поэтому молекулы углерода делят свои 4 валентных электрона через одинарные, двойные и тройные связи, так что каждый атом может достигать конфигураций благородного газа. Ковалентные связи включают взаимодействия сигма- и пи-орбиталей; следовательно, ковалентные связи приводят к образованию одинарных, двойных, тройных и четверных связей.
Пример \(\PageIndex{2}\): \(PCl_3\)
В этом примере атом фосфора делит свои три неспаренных электрона с тремя атомами хлора. В конечном продукте все четыре из этих молекул имеют 8 валентных электронов и удовлетворяют правилу октетов.
Связь в органической химии
Ионная и ковалентная связи являются двумя крайностями связи.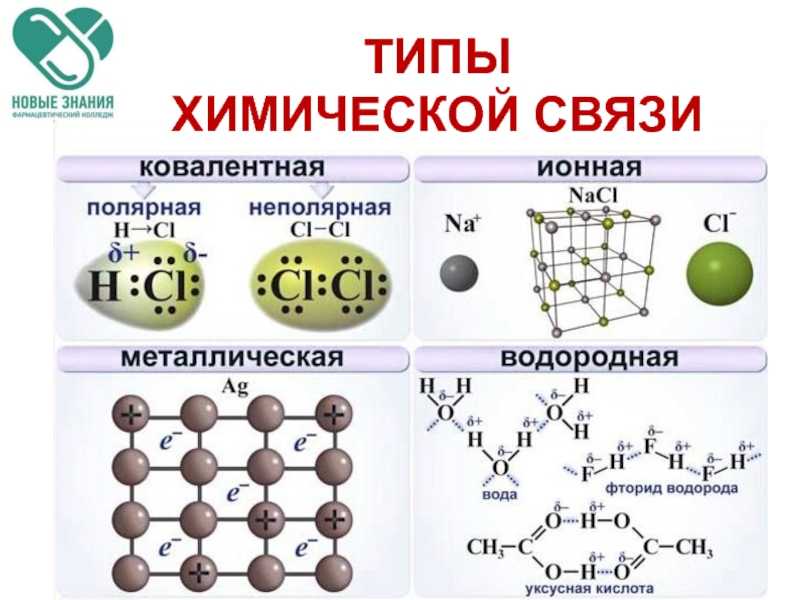 Полярная ковалентная связь является промежуточным типом связи между двумя крайностями. Некоторые ионные связи содержат ковалентные характеристики, а некоторые ковалентные связи являются частично ионными. Например, большинство соединений на основе углерода связаны ковалентно, но также могут быть частично ионными. Полярность — это мера разделения зарядов в соединении. Полярность соединения зависит от симметрии соединения и различий в электроотрицательности между атомами. Полярность возникает, когда элементы, толкающие электроны, находящиеся в левой части таблицы Менделеева, обмениваются электронами с элементами, притягивающими электроны, в правой части таблицы. Это создает спектр полярности, с ионным (полярным) на одном конце, ковалентным (неполярным) на другом и полярно-ковалентным посередине.
Полярная ковалентная связь является промежуточным типом связи между двумя крайностями. Некоторые ионные связи содержат ковалентные характеристики, а некоторые ковалентные связи являются частично ионными. Например, большинство соединений на основе углерода связаны ковалентно, но также могут быть частично ионными. Полярность — это мера разделения зарядов в соединении. Полярность соединения зависит от симметрии соединения и различий в электроотрицательности между атомами. Полярность возникает, когда элементы, толкающие электроны, находящиеся в левой части таблицы Менделеева, обмениваются электронами с элементами, притягивающими электроны, в правой части таблицы. Это создает спектр полярности, с ионным (полярным) на одном конце, ковалентным (неполярным) на другом и полярно-ковалентным посередине.
Обе эти связи важны в органической химии. Ионные связи важны, потому что они позволяют синтезировать определенные органические соединения. Ученые могут манипулировать ионными свойствами и этими взаимодействиями, чтобы формировать желаемые продукты.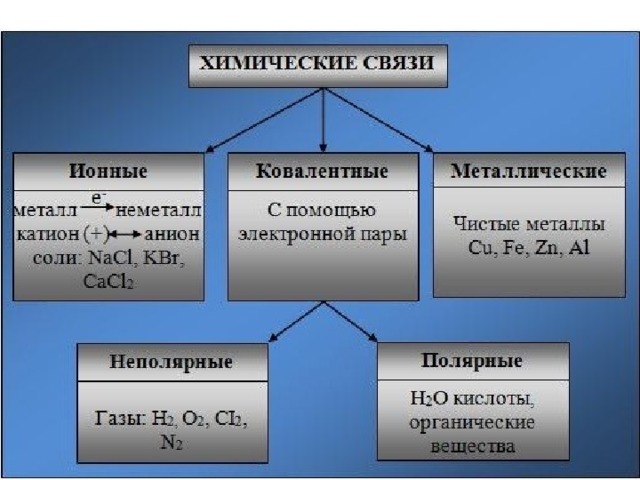 Ковалентные связи особенно важны, поскольку большинство молекул углерода взаимодействуют главным образом посредством ковалентных связей. Ковалентная связь позволяет молекулам делиться электронами с другими молекулами, создавая длинные цепочки соединений и усложняя жизнь.
Ковалентные связи особенно важны, поскольку большинство молекул углерода взаимодействуют главным образом посредством ковалентных связей. Ковалентная связь позволяет молекулам делиться электронами с другими молекулами, создавая длинные цепочки соединений и усложняя жизнь.
Ссылки
- Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия Структура и функции . Нью-Йорк: WH Freeman, 2007. .
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения . Река Аппер-Сэдл, Нью-Джерси: Pearson Education, 2007. .
- Браун, Теодор Л., Юджин Х. Лемей и Брюс Э. Берстен. Химия: основная наука . 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1994.
Проблемы
1. Являются ли эти соединения ионными или ковалентными?
2. В следующих реакциях укажите, связаны ли реагенты и продукты ионной или ковалентной связью.
а)
б) Пояснение: Какова природа связи между натрием и амидом? Какая связь образуется между углеродной цепью аниона и натрием?
c)
Растворы
- 1) Слева направо: Ковалентный, Ионный, Ионный, Ковалентный, Ковалентный, Ковалентный, Ионный.

- 2a) Все продукты и реагенты являются ионными.
- 2b) Слева направо: ковалентная, ионная, ионная, ковалентная, ионная, ковалентная, ковалентная, ионная.
- 2c) Все продукты и реагенты ковалентны.
Ionic and Covalent Bonds распространяется в соответствии с лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.


 diffen.com
diffen.com
Leave A Comment