Периодический закон и система Д.И. Менделеева
1. Слева направо по периоду (см. Таблица Менделеева):
-
- металлические свойства простых веществ ослабевают (уменьшаются)
- неметаллические свойства усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент — фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
-
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
4. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
5. К амфотерным оксидам относятся Al
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be — Mg — Ca ?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li — Be — B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F — O — N?
Как изменяется электроотрицательность в ряду F — O — N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As — P — N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li — Na — K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O — S — Se?
Как изменяются окислительные свойства в ряду O — S — Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si — Al — Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 —> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1.
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3.
В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5.
В ряду химических элементов As, P, N 1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность
3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7.
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
Дидактический материал Тренировочные тесты ЕГЭ по химии
Закономерности изменения свойств химических элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.
1. В ряду Na —>Mg —>Al —>Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические свойства элементов 2. У элементов подгруппы углерода с увеличением атомного номера уменьшается 1) атомный радиус 2) заряд ядра атома 3) число валентных электронов в атомах 4) электроотрицательность 3. В ряду элементов азот — кислород — фтор возрастает 1) валентность по водороду 2) число энергетических уровней 3) число внешних электронов 4) число неспаренных электронов 4. В ряду химических элементов бор — углерод — азот возрастает 1) способность атома отдавать электроны 2) высшая степень окисления 3) низшая степень окисления 4) радиус атома 5. 1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду N2O5 —> P2O5 —> As2O5 —> Sb2O5 1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически 7. В порядке возрастания неметаллических свойств элементы расположены в ряду: 1) O,N,C,B 2) Cl,S,P,Si 3) C,Si,Ge,Sn 4) B,C,O,F 8. В порядке усиления металлических свойств элементы расположены в ряду: 1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg 9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса? 1) Si,P, S.C1 2) O,S,Se,Te 3) At,I,Br,Cl 4) Mg,Al,Si, P 10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2? 1) бор 2) калий 3) сера 4) хром
11. 1) уменьшением радиуса атомов 2) увеличением числа энергетических уровней в атомах 3) уменьшением числа протонов в ядрах атомов 4) увеличением числа валентных электронов 12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4? 1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства 1) возрастают 2) убывают 3) не изменяются 4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств? 1) Mg, Ca, Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются) 1) атомный радиус элементов 2) число валентных электронов в атомах 3) электроотрицательность элементов 4) кислотные свойства гидроксидов
16. 1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел: 1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома 1) увеличивается и в периодах, и в группах 2) уменьшается и в периодах, и в группах 3) увеличивается в периодах, а в группах уменьшается 4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Rb,K,Na,Li 2) Na,Mg,Al, S 3) F, Cl, Br, I 4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет 1) натрий 2) алюминий 3) фосфор 4) сера
21. 1) уменьшением радиуса атомов 2) увеличением числа энергетических уровней в атомах 3) уменьшением числа протонов в ядрах атомов 4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается 1) число валентных электронов в атомах 2) атомный радиус элементов 3) электроотрицательность элементов 4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует 1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует 1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует 1) магний 2) стронций 3) барий 4) кадмий
26. 1) Sn 2) А1 3) С 4) S
27. Кислотный характер наиболее выражен у высшего оксида, образованного 1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
29.
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют 1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. Cl ® S ® P ® Si 1) уменьшается число электронных слоев в атомах 2) увеличивается число внешних электронов в а томах 3) возрастают радиусы атомов 4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у 1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом 1) олова 2} кремния 3) свинца 4) углерода
35. В ряду химических элементов Li —>Be —> B —> C 1) увеличивается число валентных электронов в атомах 2) уменьшается число электронных слоев а атомах 3) уменьшается число протонов в ядрах атомов 4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом 1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63. 1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
39. В порядке увеличения восстановительной способности металлы расположены в ряду: 1) K,Al,Cr,Sn 2) Sn,Cr,Al,Zn 4) Au,Al,Ca,Li
40. возрастает их 1) атомный радиус 2) восстановительная способность 3) химическая активность 4) электроотрицательность
41. У магния металлические свойства выражены 1) слабее, чем у бериллия 2) сильнее, чем у алюминия 3) сильнее, чем у кальция 4) сильнее, чем у натрия
42. В порядке уменьшения восстановительных свойств металлы расположены в ряду: 1) Al,Zn,Fe 2) Al,Na,K
43. Наибольший радиус имеет атом 1) лития 2) натрия 3) кальция 4) калия 44. У элементов II А группы сверху вниз 1) уменьшаются радиусы атомов, 2) увеличивается число валентных электронов в атоме 3) увеличиваются радиусы атомов 4) уменьшается число валентных электронов в атоме
45. Сила оснований возрастает в ряду: 1) Ве(ОН)2, Mg(OH)2, Ca(OH)2 2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2 3) Са(ОН)2, Mg(OH)2, Ве(ОН)2 46. 1) усиливаются окислительные свойства 2) ослабевают восстановительные свойства 3) увеличиваются радиусы атомов 4) уменьшаются радиусы атомов
47. Валентные электроны наиболее легко отдают атомы 1) алюминия 2) натрия 3) бериллия 4) магния
48. Восстановительные свойства наиболее выражены у 1) алюминия 2) магния 3) натрия 4) калия
49. Основные свойства веществ ослабевают в ряду: 1) NaОН —> КОН —>RbOH 2) А1(ОН)3 —>Mg(OH)2 —> NaOH 3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2 4) В(ОН)3 —>Ве(ОН)2 —> LiOH
50. Верны ли следующие суждения? А. И хром, и железо образуют устойчивые оксиды в степени окисления +3. Б. Оксид хрома (III) является амфотерным. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
51. А. Только s-элементы содержит IA группа. Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
52. Оксид хрома (VI) является 1) основным 2) кислотным 3) амфотерным 4) несолеобразующим
53. Только основные свойства проявляет 1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
54. Сильные окислительные свойства характерны для 1) оксида меди (I) 2) оксида железа (II) 3) оксида хрома (III) 4) оксида хрома (VI)
55. Верны ли следующие суждения об оксидах железа? А. Степень окисления железа в высшем оксиде равна + 3. Б. Высший оксид железа относится к основным оксидам. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
56. CrO — Сr2О3 — СrОз происходит 1) уменьшение степени окисления хрома 2) усиление восстановительных свойств 3) увеличение массовой доли хрома 4) усиление кислотных свойств
57. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче выражены металлические свойства элемента. Б. Чем сильнее выражены металлические свойства элемента, тем более основный характер имеет его гидроксид.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
58. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных электронов и слабое их притяжение к ядру. Б. Чем выше степень окисления металла в его гидроксиде, тем более основными свойствами обладает гидроксид.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
59. А. Атомы металла могут образовывать только ионные связи. Б. Оксиды и гидроксиды металлов всегда имеют основный характер. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
60. Верны ли следующие суждения о неметаллах? А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах. Б. Все неметаллы являются р-элементами. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 61. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается 1) радиус 2) окислительная способность 3) восстановительная способность 4) число неспаренных электронов
62. Соединения состава NaHЭO3 и NaHЭO4 может образовать 1) углерод 2) сера 3) хлор 4) фосфор 63. 1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3 64 Соединения состава КЭО2 и КЭО3 образует элемент 1) азот 2) фосфор 3) сера 4) марганец 65. Способность атомов химических элементов принимать электроны усиливается в ряду: 1)F —>O —>N 2) N —>F —>О 3) N —>O —>F 4) O —>N —>F 66. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны: 1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
67. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с 1) водородом и железом 2) углеродом и цинком 3) хлором и фтором 4) натрием и кислородом
68. электроотрицательность элементов 1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, потом увеличивается
69. В ряду элементов мышьяк —>селен —> бром возрастает 1) атомный радиус 2) число неспаренных электронов в атоме 3) число электронных слоев в атоме 4) электроотрицательность
70. Водородное соединение состава Н2Э2 образует 1) углерод 2) кремний 3) бор 4) азот
71. Высшему гидроксиду элемента VIIA группы соответствует формула 1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
72. Фосфор проявляет окислительные свойства при реакции с 1) кальцием 2) серой 3) хлором 4) кислородом
73. 1) НС1O 2) НС1O2 3) НСlO3 4) HClO4
74. Характерными степенями окисления хлора в его соединениях являются: 1) -1, +1, +3, +5, +7 2) — 2, +4, +6, +8 3) -3, +3, +5 4) -1, +2, +5
75. Кислотные свойства наиболее выражены у высшего гидроксида 1) азота 2) фосфора 3) мышьяка 4) сурьмы
76. Только восстановительные свойства азот проявляет в соединении 1) N2 2) NНз 3) NО2 4) НNОз
77. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ? А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами. Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4). 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
78. Верны ли следующие суждения о соединениях натрия и бериллия? А. Оксид натрия проявляет основные свойства Б. Гидроксид бериллия проявляет амфотерные свойства 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2, 39-4, 40-4, 41-2, 42-1, 43-4, 44-3, 45-1, 46-3, 47-2, 48-4, 49-3, 50-3, 51-1, 52-2, 53-2, 54-4, 55-1, 56-4, 57-2, 58-1, 59-4, 60-1, 61-2, 62-2, 63-1,64-1, 65-3, 66-2, 67-4, 68-1, 69-4, 70-1, 71-4, 72-1, 73-4, 74-1, 74-3, 76-2, 77-4, 78-3 |
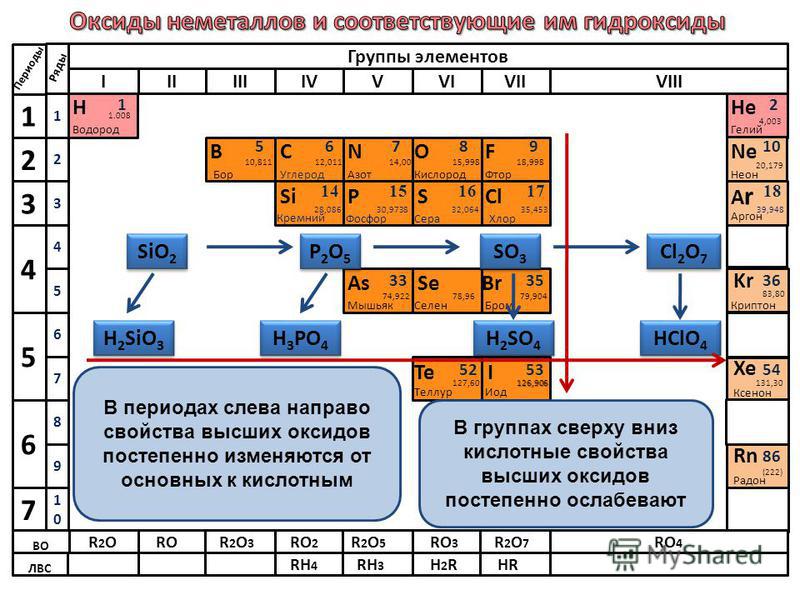
Как меняется природа оксидов элементов при движении слева направо в периоде периодической таблицы?
Физические и химические свойства элементов в современной таблице Менделеева показывают регулярное изменение периодов и групп таблицы Менделеева.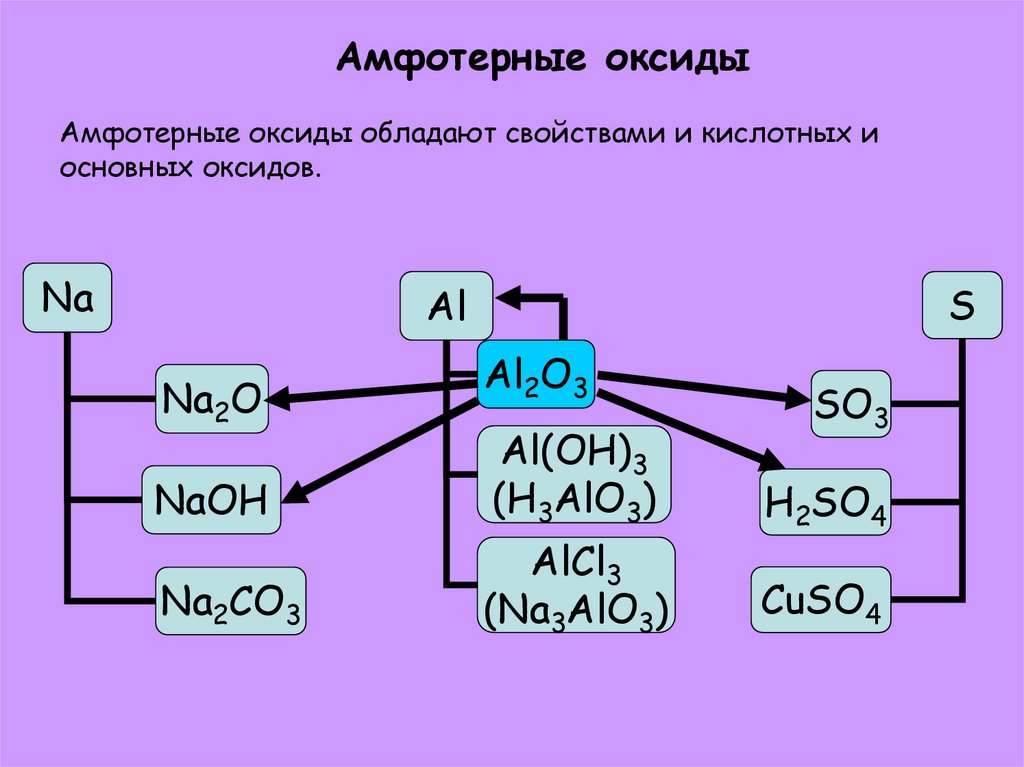 При движении слева направо в периоде меняются некоторые характеристики элементов, такие как число валентных электронов, валентность, размер атома, металлический характер, химическая реакционная способность и тип оксидов. При перемещении сверху вниз в группе эти свойства также меняются. Эти характеристики элементов периодической таблицы более подробно рассматриваются ниже.
При движении слева направо в периоде меняются некоторые характеристики элементов, такие как число валентных электронов, валентность, размер атома, металлический характер, химическая реакционная способность и тип оксидов. При перемещении сверху вниз в группе эти свойства также меняются. Эти характеристики элементов периодической таблицы более подробно рассматриваются ниже.
Периоды — это горизонтальные ряды элементов в периодической таблице. В полной форме периодической таблицы есть семь периодов. Атомные номера элементов в периодической таблице идут последовательно. Как показано ниже, каждый период имеет разное количество элементов.
- В первом периоде два элемента. «Очень короткое время» — вот как это описывается.
- Во втором периоде восемь элементов. Его называют коротким периодом.
- В третьем периоде восемь элементов. Он также известен как короткий период.
- В четвертом периоде 18 элементов.
 Его называют долгим периодом.
Его называют долгим периодом. - В пятом периоде 18 элементов. Его называют долгим периодом.
- В шестом периоде 32 элемента. Его также называют долгим периодом.
Остальные элементы находятся в седьмом периоде. Это незавершенная работа. Количество элементов в периоде определяется максимальным числом электронов, которые могут быть размещены в различных оболочках атома.
ГруппыГруппы — это вертикальные столбцы периодической таблицы. В полной форме периодической таблицы есть 18 групп. Количество групп варьируется от одной до восемнадцати. Элементы в данной группе не имеют последовательных атомных номеров. Группа 1 расположена в левой части таблицы Менделеева, а группа 18 — в правой.
Современная периодическая таблица
Различные характеристики периодов и групп
- Валентные электроны в период — Количество валентных электронов, или самых удаленных электронов, в элементах увеличивается с 1 до 8 по мере продвижения периода слева направо, хотя оно увеличивается с 1 до 2 в первом периоде.

- Валентные электроны в группе – Количество валентных электронов в группе элементов периодической таблицы одинаково для всех элементов этой группы. Например, все элементы в группе 1 периодической таблицы, такие как литий и натрий, содержат один валентный электрон в каждом атоме.
- Валентность в периоде — Валентность элементов увеличивается от 1 до 4, а затем снижается до нуля при движении слева направо в каждом коротком периоде. Число самых удаленных электронов, необходимых элементу для достижения наиболее близкой конфигурации благородного газа, известно как валентность.
- Валентность в группе — Все элементы в группе имеют одинаковую валентность, потому что число валентных электронов, определяющих валентность, одинаково. Например, элементы группы 1, такие как литий, натрий и калий, содержат один валентный электрон, следовательно, все они имеют одинаковую валентность единицы.

- Размер атомов в периоде — Размер атомов или размер атома уменьшается при движении слева направо в периоде таблицы Менделеева. Поскольку атомный радиус представляет собой размер атома, можно утверждать, что при движении слева направо в периоде таблицы Менделеева атомный радиус уменьшается.
- Размер атомов в группе- Размер атомов или атомный размер увеличивается по мере продвижения вниз по периодической таблице в группе. Например, когда мы идем сверху вниз в группе 1, размер атомов постепенно увеличивается от лития до франция.
- Металлический характер в периоде- Металлический характер элементов уменьшается при движении слева направо в течение периода, но неметаллический характер увеличивается. Например, металлический характер уменьшается от натрия к магнию к алюминию в третьем периоде, кремний является металлоидом, а неметаллический характер увеличивается от фосфора к сере и к хлору.
- Металлический характер в группе- Металлический характер элементов увеличивается по мере продвижения вниз по периодической таблице в группах.
 Каждый раз, когда мы перемещаемся вниз по таблице Менделеева, добавляется еще одна электронная оболочка, и размер атома увеличивается. Например, металлический характер превращения лития во франций увеличивается по мере того, как мы спускаемся в группу 1 периодической таблицы.
Каждый раз, когда мы перемещаемся вниз по таблице Менделеева, добавляется еще одна электронная оболочка, и размер атома увеличивается. Например, металлический характер превращения лития во франций увеличивается по мере того, как мы спускаемся в группу 1 периодической таблицы. - Химическая активность в период — Химическая активность элементов уменьшается, а затем увеличивается по мере движения слева направо. Например, относительно реакционноспособным элементом в третьем периоде является натрий, менее реакционноспособен магний, а еще менее реакционноспособен алюминий. В третьем периоде кремний является наименее химически активным элементом. Фосфор теперь довольно реактивен, в то время как сера все еще реактивна, а хлор чрезвычайно реактивен.
- Химическая активность в группе — Химическая активность металлов увеличивается по мере их продвижения по периодической таблице в группах. Химическая активность неметаллов уменьшается по мере их продвижения по периодической таблице.

Природа оксидов, перемещающихся в течение периода
Тенденция к потере электронов уменьшается по мере прохождения периода, и, следовательно, металлический характер уменьшается. Поскольку оксиды неметаллов являются кислотными. В результате основной характер уменьшается слева направо с течением времени. В результате по мере продвижения периода слева направо основная природа оксидов уменьшается, а кислотная природа оксидов увеличивается. В качестве примера рассмотрим элементы третьего периода.
Na | Mg | Al | Si | P | S | Cl |
Очень базовый | Амфотерический | Высококислый | ||||
Оксид. . Оксиды алюминия и кремния по своей природе амфотерны. Оксиды фосфора кислые, оксиды серы гораздо более кислые, а оксиды хлора чрезвычайно кислые. В результате можно констатировать, что по мере движения таблицы Менделеева слева направо в третьем периоде основная природа оксидов элементов уменьшается, а кислотная природа оксидов увеличивается.
. Оксиды алюминия и кремния по своей природе амфотерны. Оксиды фосфора кислые, оксиды серы гораздо более кислые, а оксиды хлора чрезвычайно кислые. В результате можно констатировать, что по мере движения таблицы Менделеева слева направо в третьем периоде основная природа оксидов элементов уменьшается, а кислотная природа оксидов увеличивается.
Тенденция к потере электронов уменьшается с течением периода, и, следовательно, металлический характер уменьшается. Поскольку оксиды неметаллов являются кислотными. В результате основной характер уменьшается по мере продвижения слева направо, тогда как основной характер увеличивается по мере продвижения вниз из-за увеличения металлического характера.
Металлы реагируют с кислородом с образованием основных соединений кислорода. Большинство этих соединений имеют ионную природу. Когда группы 1, 2 и лантаноиды реагируют с молекулярным кислородом, они образуют основные соединения кислорода. При синтезе этих молекул выделяется много энергии. За некоторыми исключениями, эти соединения легко реагируют с водой. Когда неметаллы реагируют с кислородом, они образуют кислотные оксидные комплексы, связанные между собой ковалентными связями. Ангидриды кислот — другое название этих химических веществ. За исключением некоторых соединений, которые имеют высокие температуры плавления и образуют большие молекулы, ангидриды кислот имеют низкие температуры плавления и кипения.
За некоторыми исключениями, эти соединения легко реагируют с водой. Когда неметаллы реагируют с кислородом, они образуют кислотные оксидные комплексы, связанные между собой ковалентными связями. Ангидриды кислот — другое название этих химических веществ. За исключением некоторых соединений, которые имеют высокие температуры плавления и образуют большие молекулы, ангидриды кислот имеют низкие температуры плавления и кипения.
Природа оксидов, перемещающихся по группе
Электроположительное свойство центрального атома оксида определяет, является ли оксид кислотным или основным в целом. Оксид становится более основным по мере того, как центральный атом становится более электроположительным, а оксид становится более кислым по мере того, как центральный атом становится более электроотрицательным.
Как мы все знаем, электроотрицательность — это способность элемента притягивать пары электронов. В результате, поскольку электроотрицательность уменьшается вниз по группе, кислотный характер оксидов «уменьшается вниз по группе». Точно так же более электроположительные металлы имеют больше основного оксида в своем естественном состоянии. Когда неметалл более электроотрицательный, он имеет более высокую концентрацию кислого оксида в своем естественном состоянии. Поскольку «расстояние между ядром и электроном валентной оболочки увеличивается по мере продвижения вниз по группе, электроотрицательность уменьшается. В результате объяснения, приведенного выше, мы можем заключить, что основной характер группы возрастает сверху вниз.
Точно так же более электроположительные металлы имеют больше основного оксида в своем естественном состоянии. Когда неметалл более электроотрицательный, он имеет более высокую концентрацию кислого оксида в своем естественном состоянии. Поскольку «расстояние между ядром и электроном валентной оболочки увеличивается по мере продвижения вниз по группе, электроотрицательность уменьшается. В результате объяснения, приведенного выше, мы можем заключить, что основной характер группы возрастает сверху вниз.
Оксиды металлов имеют основной характер, тогда как оксиды неметаллов имеют кислотную природу. Это означает, что по мере продвижения вниз по таблице Менделеева основной характер оксидов становится сильнее, а кислотный — слабее. В результате природа оксидов элементов не меняется при движении вниз по таблице Менделеева. Оксиды всех элементов группы имеют одинаковую природу. Например, все элементы группы 1 образуют основные оксиды, такие как литий, натрий и калий, а все элементы группы 17 образуют кислотные оксиды, такие как фтор, хлор и бром.
Примеры вопросов
Вопрос 1: Назовите элемент, химические свойства которого схожи с натрием.
Ответ:
Химические свойства элементов, принадлежащих к одной группе, одинаковы. Калий будет демонстрировать такие же химические свойства, как и натрий, поскольку и калий, и натрий принадлежат к одной и той же группе.
Вопрос 2: Элемент принадлежит ко второй группе периодической таблицы, это металл или неметалл?
Ответ:
Металлический характер элементов уменьшается при движении слева направо в течение периода, но неметаллический характер увеличивается. Это означает, что все элементы в левой части периодической таблицы являются металлами. . Поскольку данный элемент относится ко второй группе, значит, он принадлежит к левой части таблицы Менделеева. Следовательно, этот элемент является металлом.
Вопрос 3: К какому периоду относятся элементы с электронными конфигурациями 2, 6?
Ответ:
Количество оболочек в электронной конфигурации элемента говорит о том, к какому периоду принадлежит элемент.
Данная электронная конфигурация 2, 6 имеет две оболочки, поэтому данный элемент относится ко второму периоду.
Вопрос 4: В каких периодах или группах есть элементы с последовательными атомными номерами?
Ответ:
В современной периодической таблице периоды имеют элементы с последовательными атомными номерами.
Вопрос 5: Назовите два свойства элементов, которые не меняются при спуске по группе.
Ответ:
Все элементы в группе имеют одинаковую валентность, потому что число валентных электронов, определяющих валентность, одинаково. Также природа оксидов элементов не меняется при движении вниз по периодической таблице. Следовательно, два свойства, которые не меняются при движении вниз по группе, — это валентность элементов и природа оксидов.

 В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит: В ряду химических элементов Be, Mg, Ca, Sr
В ряду химических элементов Be, Mg, Ca, Sr
 В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3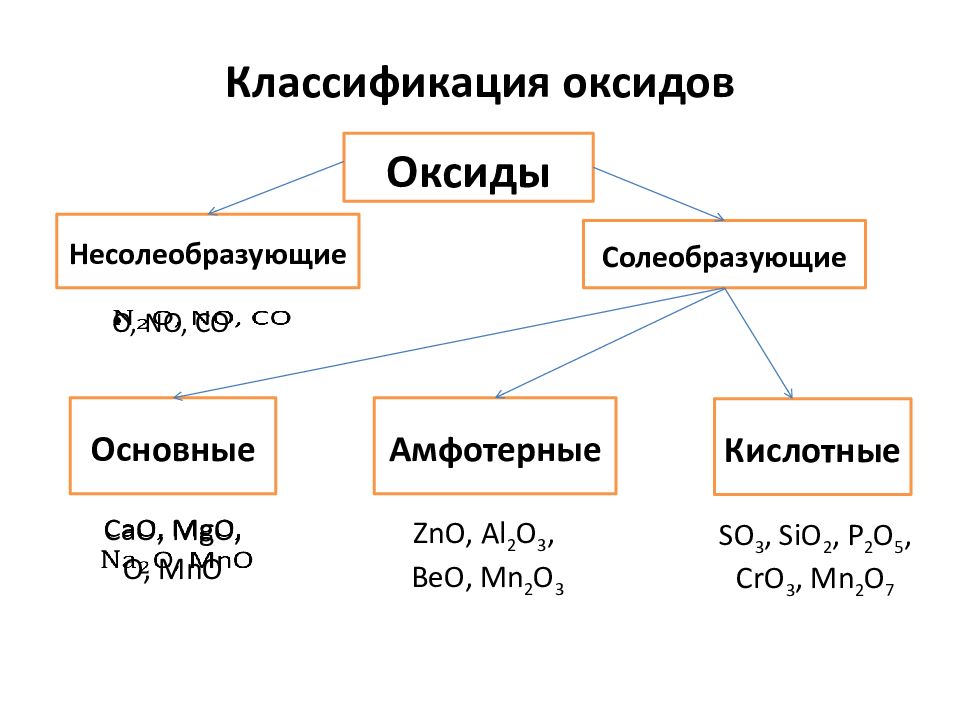 И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.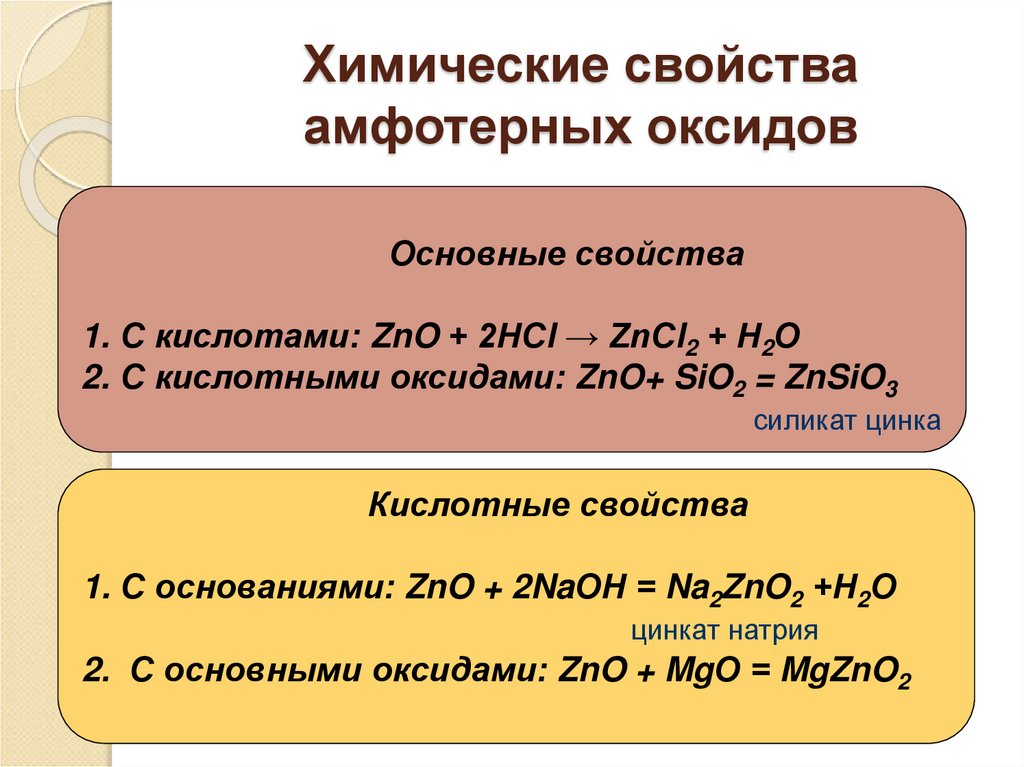 Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
Какой элемент имеет более выраженные неметаллические свойства, чем кремний? В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с В порядке увеличения электроотрицательности химические элементы расположены в раду:
В порядке увеличения электроотрицательности химические элементы расположены в раду: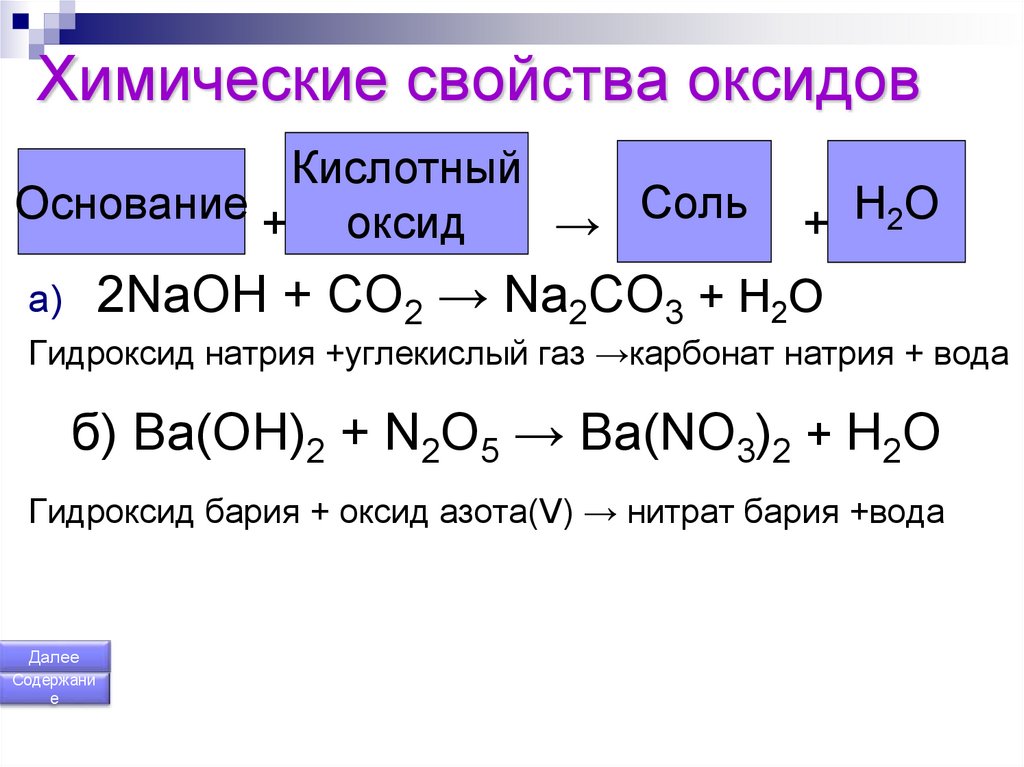 В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
Кислотный характер наиболее выражен у высшего оксида, образованного элементом: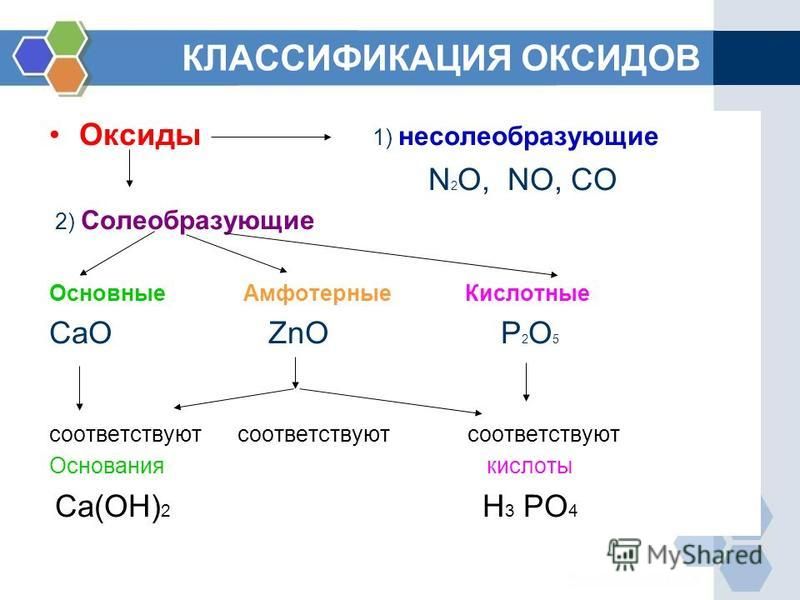 Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент В ряду элементов
В ряду элементов s2Зр63d1 имеет ион
s2Зр63d1 имеет ион В ряду элементов: натрий —>магний —>алюминий
В ряду элементов: натрий —>магний —>алюминий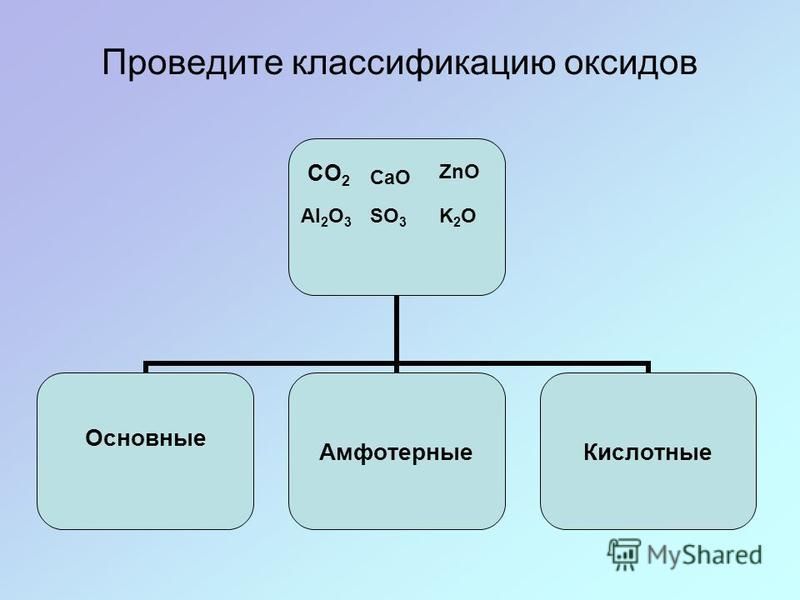 У элементов I А группы сверху вниз
У элементов I А группы сверху вниз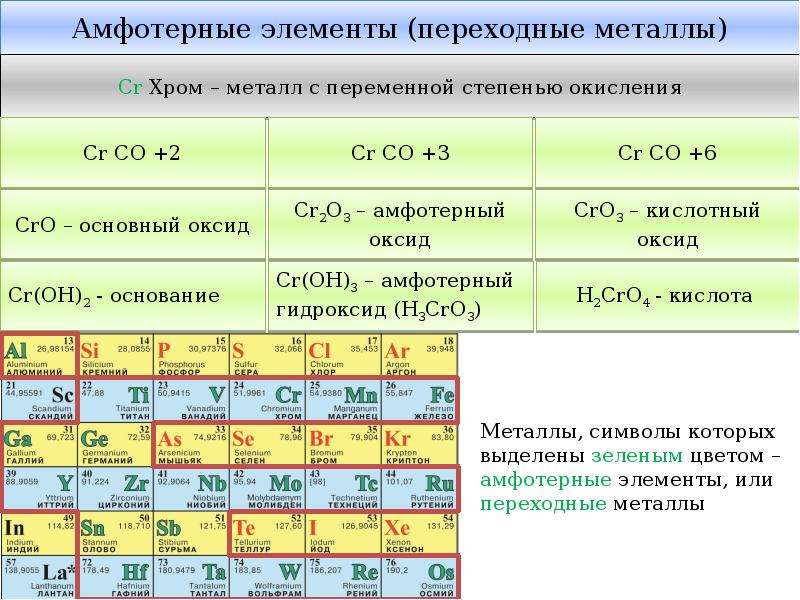 Верны ли следующие суждения?
Верны ли следующие суждения? В ряду оксидов
В ряду оксидов Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах: Наиболее сильными кислотными свойствами обладает
Наиболее сильными кислотными свойствами обладает В ряду: Si —>Р —> S —> С1
В ряду: Si —>Р —> S —> С1 При взаимодействии высшего оксида хлора с водой образуется кислота
При взаимодействии высшего оксида хлора с водой образуется кислота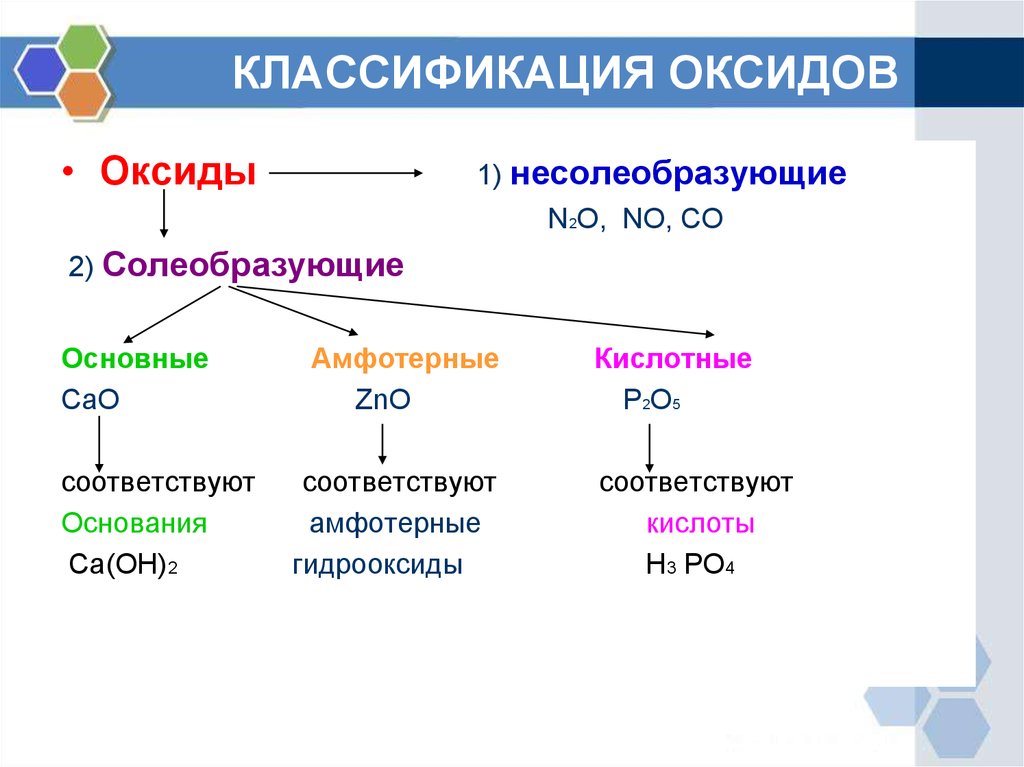
 Его называют долгим периодом.
Его называют долгим периодом.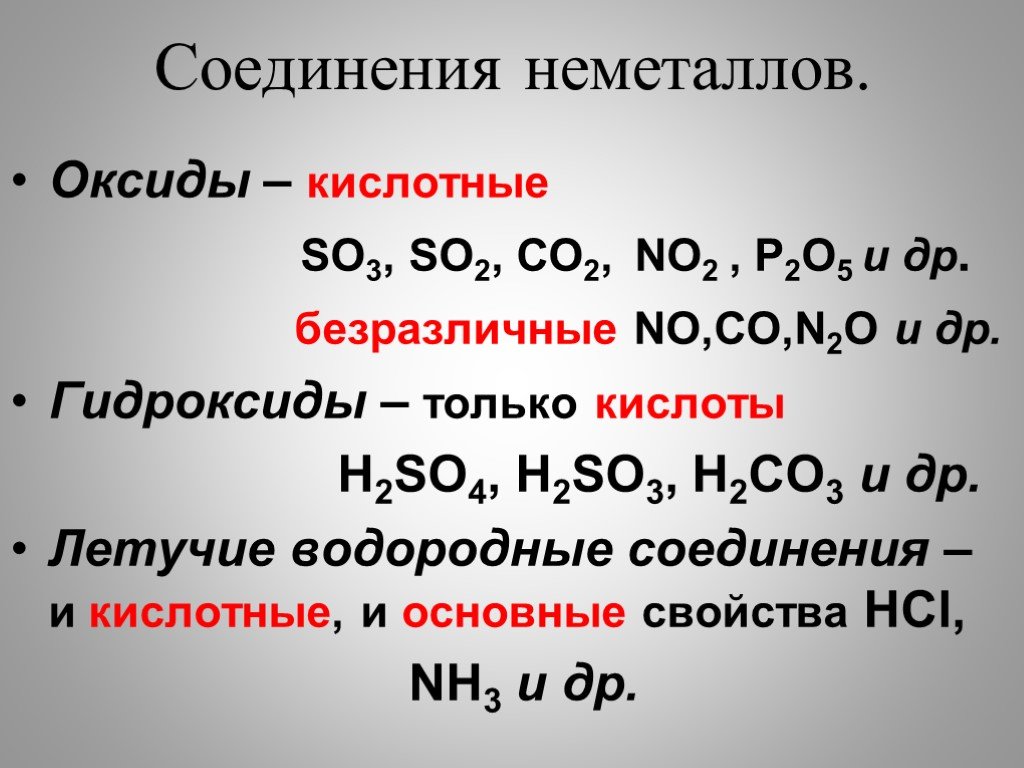

 Каждый раз, когда мы перемещаемся вниз по таблице Менделеева, добавляется еще одна электронная оболочка, и размер атома увеличивается. Например, металлический характер превращения лития во франций увеличивается по мере того, как мы спускаемся в группу 1 периодической таблицы.
Каждый раз, когда мы перемещаемся вниз по таблице Менделеева, добавляется еще одна электронная оболочка, и размер атома увеличивается. Например, металлический характер превращения лития во франций увеличивается по мере того, как мы спускаемся в группу 1 периодической таблицы.
 Данная электронная конфигурация 2, 6 имеет две оболочки, поэтому данный элемент относится ко второму периоду.
Данная электронная конфигурация 2, 6 имеет две оболочки, поэтому данный элемент относится ко второму периоду.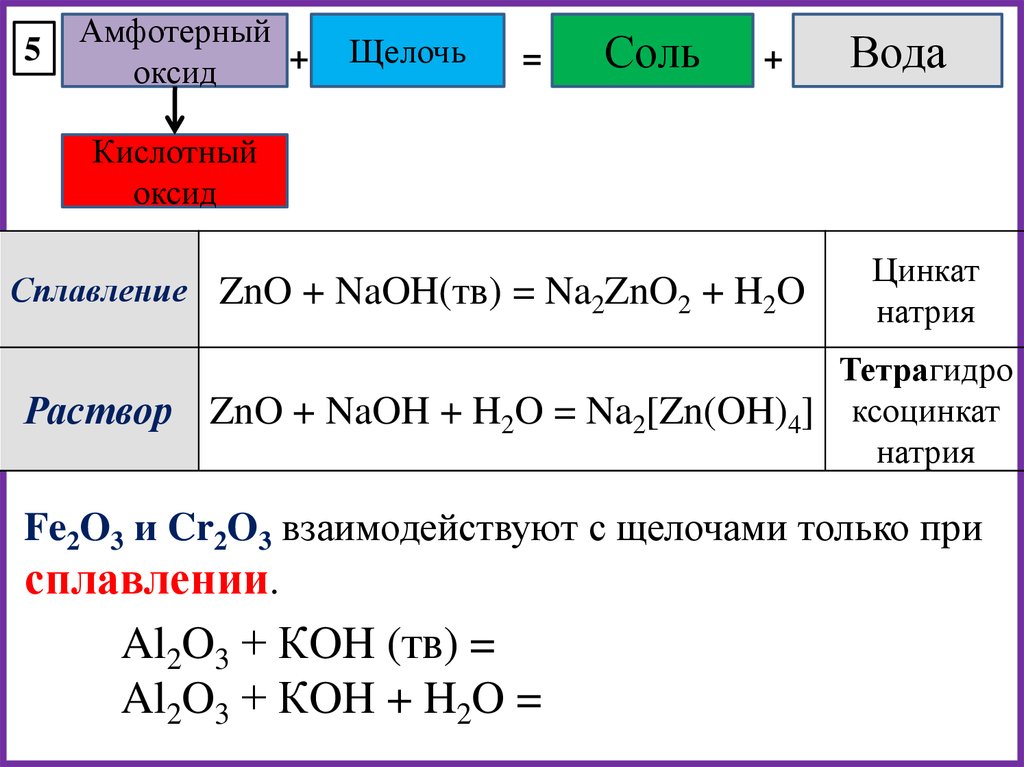 Очевидно, что аргон не используется, поскольку он не образует оксид.
Очевидно, что аргон не используется, поскольку он не образует оксид.
 Не упускайте из виду общую тенденцию периода в отношении высших оксидов, когда смотрите на все эти детали.
Не упускайте из виду общую тенденцию периода в отношении высших оксидов, когда смотрите на все эти детали. В зависимости от его концентрации pH будет около 14,9.0003
В зависимости от его концентрации pH будет около 14,9.0003
 Одна из этих форм очень нереактивна. Он химически известен как альфа-Al 9.0271 2 O 3 и производится при высоких температурах.
Одна из этих форм очень нереактивна. Он химически известен как альфа-Al 9.0271 2 O 3 и производится при высоких температурах.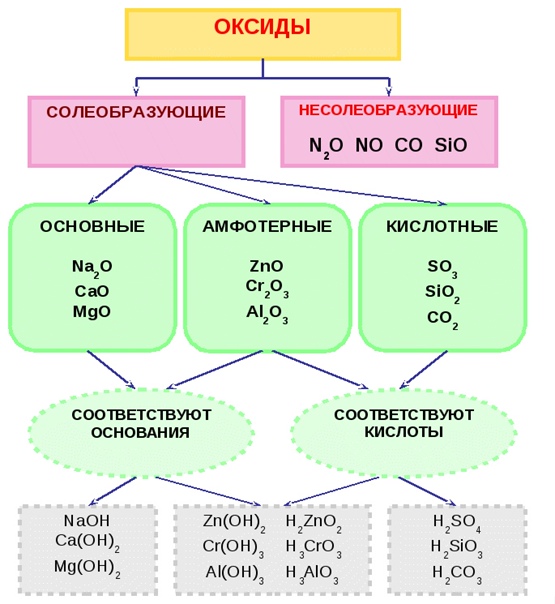

 Они варьируются от NaAlO 2 (который представляет собой дегидратированную форму соединения в уравнении) до Na 3 Al(OH) 6 (который является совершенно другим продуктом).
Они варьируются от NaAlO 2 (который представляет собой дегидратированную форму соединения в уравнении) до Na 3 Al(OH) 6 (который является совершенно другим продуктом).





 В каждом случае это просто зависит от пропорций двух используемых реагентов.
В каждом случае это просто зависит от пропорций двух используемых реагентов.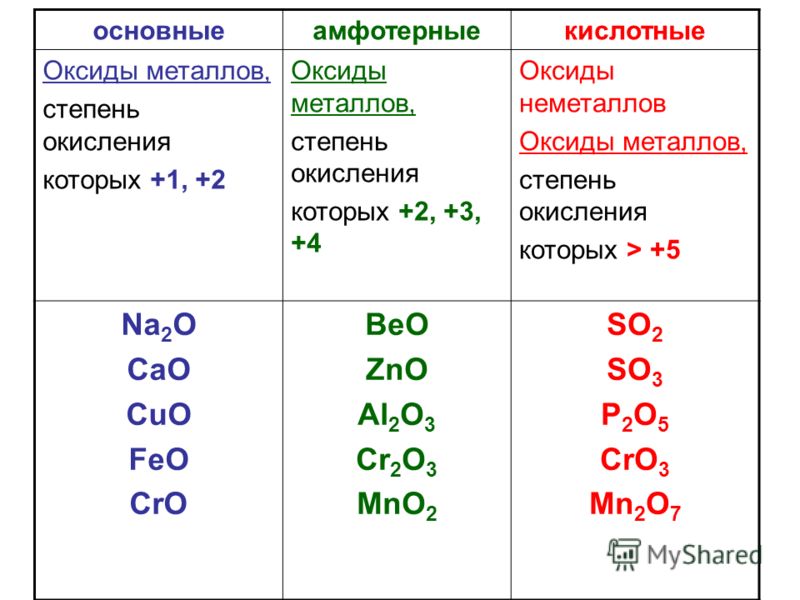 Знайте, как работать с ними, если вам нужно.
Знайте, как работать с ними, если вам нужно.  2. У меня нет возможности узнать, какой из них правильный.
2. У меня нет возможности узнать, какой из них правильный.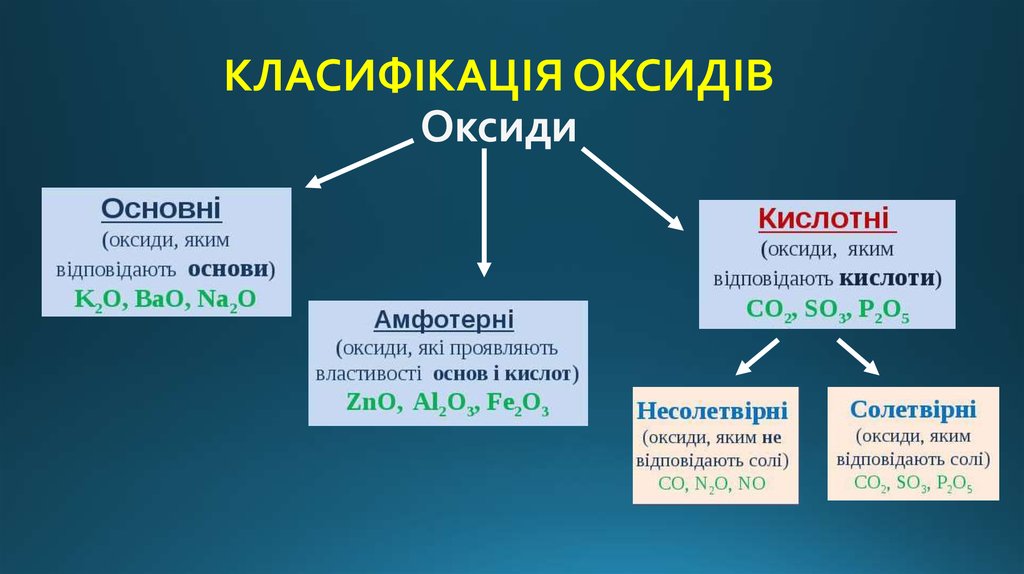 В данном случае мы реагируем с оксидом напрямую с гидроксидом натрия, потому что именно так мы, скорее всего, и поступим.
В данном случае мы реагируем с оксидом напрямую с гидроксидом натрия, потому что именно так мы, скорее всего, и поступим. 
 ) + SO 4 2- (водн.)
) + SO 4 2- (водн.)
 ниже). . Вы можете применить те же рассуждения и к другим кислотам на этой странице.
ниже). . Вы можете применить те же рассуждения и к другим кислотам на этой странице.

Leave A Comment