Какие факторы влияют на скорость диффузии?
Диффузия лежит в основе многих явлений, известных нам из повседневной жизни. Иногда эти явления благотворны, иногда — совсем наоборот. Например, благодаря диффузии ароматные молекулы цветов распространяются по воздуху, чтобы насекомые могли их найти и опылить. Однако диффузия также ответственна за распространение загрязняющих воздух веществ и образование смога (рис. 1.), который угрожает людям даже на большом расстоянии от дымоходов, выделяющих вредные вещества. Несомненно, важно знать: от чего зависит скорость диффузии и какие вещества диффундируют быстрее, а какие медленнее.
Рис. 1. Смог — это туман, смешанный с дымом и выхлопными газами. Знаете ли вы, что состояние воздуха в России и Беларуси контролируется на постоянной основе и может быть проверено в любое время с помощью одной из многочисленных так называемых «карт загрязнения», доступных в Интернете?Диффузия на микроскопическом и макроскопическом уровне
Частицы жидкостей и газов хаотично движутся с большими скоростями, постоянно меняя направления и значения своих скоростей при столкновениях. Это движение называется тепловым движением.
Это движение называется тепловым движением.
Диффузия — это распространение и смешивание молекул вследствие теплового движения.
Примерами диффузии являются: распространение запахов в неподвижном воздухе, смешивание воды и молока, налитых в один сосуд, или выравнивание по всему объему водоема концентрации попавших в него примесей.
На рис. 2. показаны цветные чернила, налитые в сосуд с водой. Цветные пятна распространяются и меняют форму, пока в конечном итоге вся вода не станет однородно окрашенной.
В макроскопическом масштабе диффузия — это необратимый процесс, который приводит к выравниванию концентраций различных компонентов жидкости или газа. На микроскопическом уровне диффузия обусловлена хаотическими, тепловыми движениями молекул.
Движение каждой молекулы совершенно случайно — не выделяется ни одно направление. Эффект тщательного перемешивания вещества обусловлен тем, что огромное количество молекул движется беспорядочно.
Рис. 2. Диффузия цветных чернил в воде
2. Диффузия цветных чернил в водеОт чего зависит скорость диффузии?
Когда частицы имеют высокую скорость и, следовательно, высокую кинетическую энергию, они могут преодолевать большие расстояния за короткое время. Мерой средней кинетической энергии частиц является температура по абсолютной шкале. Отсюда вывод: диффузия происходит быстрее при более высоких температурах. Другими словами, скорость диффузии зависит от температуры.
В домашних условиях можно провести небольшой опыт и убедится в этом. Например, взять 2 стакана воды. В одном будет вода комнатной температуры (22 0С), а во втором подогретая до 50 0С. Если мы добавим любой пищевой краситель в каждый из стаканов, то увидим, как скорость диффузии пищевого красителя зависит от температуры воды в стакане. То есть мы увидим как более теплая вода значительно быстрее окрашивается.
Однако помните, что две частицы с одинаковыми кинетическими энергиями, но разными массами имеют разные скорости. Чем меньше масса частицы, тем больше ее скорость. Это следует из формулы для кинетической энергии: Ek = m * v2 / 2 .
Чем меньше масса частицы, тем больше ее скорость. Это следует из формулы для кинетической энергии: Ek = m * v2 / 2 .
Поэтому при одинаковой температуре частицы меньшей массы будут диффундировать (распространяться) быстрее, чем частицы большей массы.
Скорость диффузии тем больше, чем меньше молекулярный вес диффундирующих веществ.
Скорость диффузии выше в средах, молекулы которых совершают направленное движение. Например, молоко быстрее смешается с кофе, если его размешать ложкой. Этот пример иллюстрирует так называемую принудительную диффузию. Явление принудительной диффузии часто используется хищниками, которые приближаются с подветренной стороны (т.е. со стороны, с которой — с точки зрения хищника — дует ветер) и незаметны для своей жертвы.
На скорость диффузии также влияет то, как часто молекула сталкивается с другими молекулами. Столкновения происходят реже, если средний свободный пробег, т.е. среднее расстояние, пройденное молекулой между последовательными столкновениями, больше. Меньшее количество столкновений означает более быстрый процесс диффузии. Конечно, средний свободный путь молекул зависит от состояния агрегации вещества.
Меньшее количество столкновений означает более быстрый процесс диффузии. Конечно, средний свободный путь молекул зависит от состояния агрегации вещества.
Диффузия зависит от агрегатного состояния и свойств среды, в которой она происходит.
В газах молекулы находятся на большом расстоянии друг от друга и сталкиваются гораздо реже, чем в жидкостях. Их средний свободный пробег относительно велик. По этой причине диффузия в газах происходит быстро. Из повседневного опыта мы знаем, что запахи распространяются по помещению за считанные секунды или минуты. Снижение давления газа означает, что на единицу объема приходится меньше молекул и столкновения происходят реже, чем при высоком давлении. При снижении давления средний свободный пробег частиц увеличивается, и диффузия происходит быстрее.
В жидкостях молекулы находятся на меньшем расстоянии друг от друга, чем в газах, и сталкиваются чаще. Диффузия в жидкостях происходит медленнее, чем в газах. Мы сталкиваемся с этим явлением каждый день, например, когда солим суп или добавляем сахар в чай. Даже без перемешивания через некоторое время концентрация сахара в чае или соли в супе выравнивается за счет диффузии, но это занимает много времени, и нужно много терпения, чтобы увидеть, как процесс подходит к концу.
Даже без перемешивания через некоторое время концентрация сахара в чае или соли в супе выравнивается за счет диффузии, но это занимает много времени, и нужно много терпения, чтобы увидеть, как процесс подходит к концу.
Диффузия в твердых телах самая медленная. В твердых телах молекулы образуют кристаллическую решетку и не могут свободно двигаться, а лишь колеблются вокруг своих равновесных положений. Однако, когда поверхности двух различных твердых тел приводятся в контакт друг с другом, молекулы другого твердого тела могут быть обнаружены в каждом из них через некоторое время.
Диффузия является причиной изменения расположения атомов в кристаллической решетке. Случается, что молекула на границе между двумя телами случайно получает более высокую кинетическую энергию, что позволяет ей покинуть свое положение и перейти к соседнему телу.
Список использованной литературы
- Перышкин А.В. Физика. 7 кл. – 14-е изд., стереотип. – М.: Дрофа, 2010.
- Перышкин А.
 В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.
В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.
24. Факторы, влияющие на скорость диффузии. Роль диффузии в процессах переноса веществ в биологических системах
Диффузия зависит от температуры. Скорость диффузии будет увеличиваться с увеличением температуры, потому что при повышении температуры будет увеличиваться скорость движения молекул, то есть молекулы будут быстрее перемешиваться. Агрегатное состояние вещества тоже будет влиять на то, от чего зависит диффузия, а именно на скорость диффузии. Тепловая диффузия зависит от вида молекул. Например, если предмет металлический, то тепловая диффузия протекает быстрее, в отличие от того, если бы этот предмет был сделан из синтетического материала. Очень медленно протекает диффузия между твердыми материалами.
Роль диффузии в процессах переноса веществ в биологических системах
Явление
диффузии играет очень важную роль в
процессах перемещения различных
питетельных в-в и продуктов обмена в
тканевых жидкостях.
В живых организмах диффузия тесно связана со многими биологическими явлениями. Скорость многих физико-химич процессов в организме зависит прежде всего от скорости диффузии реагирующих веществ. Общая кинетика биологич. явлений определяется наиболее медленным их этапом- диффузией реагентов,а не биохимич. реакциями, протекающими при участии ферментов с очень большой скоростью.
Каждая
клетка организма представляет сложнейшую
систему различных в-в, существенно
влияющую на направление и скорость
диффузии различных в-в. Изменение
функционального состояния клетки, тесно
связанное с общими регуляторными
механизмами живых организмов,
сопровождается изменением состояния
фаз, их объемов, величины поверхности
раздела между ними. Всё это приводит к
определённым изменениям в диффузии
различных веществ. Интенсивность
обменных реакций также оказывает
регулирующее влияние на диффузию.
Повышение обменных процессов усиливает
использование диффундирующих реагентов
и ведёт к накоплению продуктов реакций,что
в свою очередь повышает градиенты их
концентраций и увеличивает диффузию,
понижение интенсивности обменных
процессов действует в обратном
направлении.
25.Коллигативные свойства разбавленных растворов электролитов
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
26. Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
,
где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
(р-ля) – мольная доля растворителя;
(раств. в-ва) – количество растворенного
вещества, моль;
в-ва) – количество растворенного
вещества, моль;
(р-ля) – количество вещества растворителя, моль.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
,
где tкип – повышение температуры кипения раствора, С;
Кэ – эбуллиоскопическая константы растворителя, (кгС)/моль;
Кк – криоскопическая константы растворителя, (кгС)/моль;
b – моляльная концентрация, моль/кг;
(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного
вещества, г/моль.
в-ва) – молярная масса растворенного
вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и t
tкип.(р-ра) = tкип.(р-ля) + tкип. tзам.(р-ра) = tзам.(р-ля) – tзам.
Четыре вещи, влияющие на скорость диффузии
••• Ачисата Хамсуван/iStock/GettyImages
Обновлено 16 февраля 2020 г.
Диффузия происходит из-за случайного движения частиц. Обычно это происходит из-за градиента концентрации, что означает, что молекулы перемещаются из области с высокой концентрацией в область с более низкой концентрацией.
Пример показан на изображении выше. Когда в раствор добавляют краситель, он со временем диффундирует. Сначала вы видите голубые полосы, движущиеся по раствору, пока, наконец, весь раствор не станет синим, потому что концентрация красителя везде одинакова. В этот момент, хотя молекулы красителя все еще движутся, вы не сможете этого заметить, поскольку синий краситель распространился и окрасил весь объем жидкости.
В этот момент, хотя молекулы красителя все еще движутся, вы не сможете этого заметить, поскольку синий краситель распространился и окрасил весь объем жидкости.
Диффузия, таким образом, является пассивным процессом (это означает, что он не требует ввода энергии). Вещество перемещается из области высокой концентрации в область меньшей концентрации. Это движение продолжается до тех пор, пока концентрация вещества не выровняется. Как только концентрация выровняется, вещество все еще движется, но больше не имеет градиента концентрации. Это состояние называется динамическим равновесием .
Молекулы постоянно движутся из-за количества тепловой энергии, которой они обладают. На это движение влияет размер частицы и среда, в которой находится частица. Частицы всегда будут перемещаться в среде, но на общую скорость диффузии могут влиять многие факторы.
Концентрация : Диффузия молекул полностью зависит от перемещения из области с более высокой концентрацией в область с более низкой концентрацией.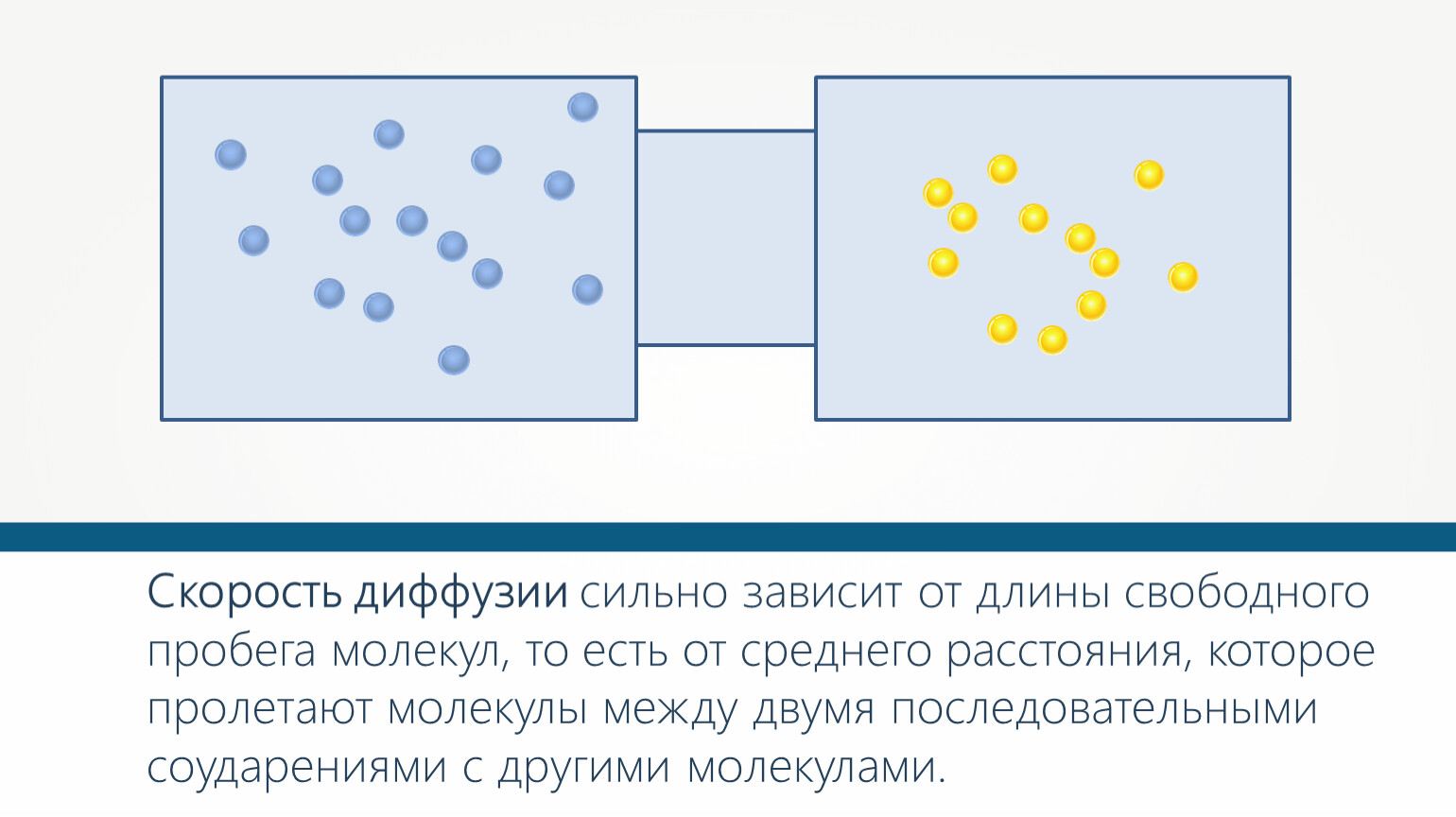 Другими словами, диффузия происходит по градиенту концентрации рассматриваемой молекулы. Если разница в концентрации выше, то молекулы будут быстрее спускаться по градиенту концентрации. Если разница в концентрации не так велика, молекулы не будут двигаться так быстро, и скорость диффузии уменьшится.
Другими словами, диффузия происходит по градиенту концентрации рассматриваемой молекулы. Если разница в концентрации выше, то молекулы будут быстрее спускаться по градиенту концентрации. Если разница в концентрации не так велика, молекулы не будут двигаться так быстро, и скорость диффузии уменьшится.
Температура: Частицы движутся за счет связанной с ними кинетической энергии. По мере повышения температуры кинетическая энергия, связанная с каждой частицей, также увеличивается. В результате частицы будут двигаться быстрее. Если они могут двигаться быстрее, то они могут и диффундировать быстрее. И наоборот, когда кинетическая энергия, связанная с молекулами, уменьшается, уменьшается и их движение. В результате скорость диффузии будет ниже.
Масса частицы: Более тяжелые частицы будут двигаться медленнее и поэтому будут иметь меньшую скорость диффузии. С другой стороны, более мелкие частицы будут диффундировать быстрее, потому что они могут двигаться быстрее. Как и все факторы, влияющие на диффузию, движение частицы имеет первостепенное значение для определения того, замедляется или ускоряется диффузия.
Как и все факторы, влияющие на диффузию, движение частицы имеет первостепенное значение для определения того, замедляется или ускоряется диффузия.
Свойства растворителя: Вязкость и плотность сильно влияют на диффузию. Если среда, через которую должна диффундировать данная частица, очень плотная или вязкая, то частице будет труднее диффундировать через нее. Так скорость диффузии будет меньше. Если среда менее плотная или менее вязкая, то частицы смогут двигаться быстрее и будут быстрее диффундировать.
Все факторы, влияющие на диффузию, могут иметь комбинированный эффект. Например, небольшой ион может диффундировать через вязкий раствор быстрее, чем крупная молекула сахара. Ион имеет меньший размер и поэтому способен двигаться быстрее. Большая молекула сахара движется медленнее из-за своего размера. Вязкость раствора влияет на оба, но усугубляет замедленную диффузию, которой подвергается более крупная молекула.
Любой фактор, ускоряющий движение частиц в среде, приводит к более высокой скорости диффузии.

Статьи по теме
Ссылки
- Биология LibreTexts: 5.2C: Диффузия
- OpenStax Химия: 9.4 ЭФФУЗИЯ И ДИФФУЗИЯ ГАЗОВ 9 0045
Об авторе
Рити Гупта имеет степень бакалавра биохимии с отличием Университета Орегона и доктор биологических наук Университета Джона Хопкинса. Она интересуется астробиологией и пилотируемыми космическими полетами. Она имеет более чем 10-летний опыт научных исследований в области биологии. В настоящее время она ведет занятия по биохимии, биологии, биофизике, астробиологии, а также готовит к экзаменам по биологии и химии в средней школе.
ДИФФУЗИЯ ЧЕРЕЗ КЛЕТОЧНУЮ МЕМБРАНУ
ДИФФУЗИЯ ЧЕРЕЗ КЛЕТОЧНУЮ МЕМБРАНУДИФФУЗИЯ ЧЕРЕЗ КЛЕТОЧНУЮ МЕМБРАНУ
Введение: Вещества, такие как вода, ионы и молекулы, необходимые для клеточных процессов, могут проникать и покидать клетки посредством пассивного процесса, такого как диффузия. Диффузия — это случайное движение молекул, но имеющее чистое направление к областям.
Простая пассивная диффузия
возникает, когда небольшие молекулы проходят через двойной липидный слой клеточной мембраны. Облегченная диффузия зависит от белков-переносчиков, встроенных в мембрану. определенные вещества для прохождения, которые не могут диффундировать через клеточную мембрану.Важность: На скорость диффузии влияют свойства клетки, диффундирующей молекулы и окружающего раствора. Мы можем использовать простые уравнения и графики, чтобы исследовать, как определенные молекулы и их концентрация влияют на скорость диффузии. Мы также можем сравнить простую и облегченную диффузию.
Вопрос: Как различаются скорости простой и облегченной диффузии в зависимости от градиента концентрации?
Простое распространение
Переменные:
п | количество молекул внутри клетки (моль) |
т | время (секунды) |
Р | константа проницаемости для конкретной молекулы (см/с) |
А | площадь поверхности клеточной мембраны (см |
С | концентрация диффундирующей молекулы (моль/см 3 ) |
х | ширина клеточной мембраны (см) |
Метод
: скорость простой диффузии может быть выражена модификацией закона Фика для небольших неполярных молекул. Скорость диффузии, dn/dt, представляет собой изменение количества диффундирующих молекул внутри клетки с течением времени.
Скорость диффузии, dn/dt, представляет собой изменение количества диффундирующих молекул внутри клетки с течением времени.
Поскольку чистое движение диффундирующих молекул зависит от
градиент концентрации, скорость диффузии прямо пропорциональна
градиент концентрации (dC/dx) через мембрану. Концентрация
градиент, dC/dx, представляет собой разницу в концентрации молекул внутри и вне клетки.
через клеточную мембрану шириной dx. Это эквивалентно (C
Мы можем описать скорость диффузии как прямо пропорциональную градиенту концентрации с помощью следующего уравнения:
, где A — площадь мембраны, а P — константа проницаемости. P представляет собой константу, связывающую легкость проникновения молекулы в клетку в зависимости от размера молекулы и растворимости в липидах.
P представляет собой константу, связывающую легкость проникновения молекулы в клетку в зависимости от размера молекулы и растворимости в липидах.
Обратите внимание, что когда A и P являются константами, это уравнение просто описывает линию, где dn/dt является функцией dC/dx. Если мы построим график зависимости скорости диффузии от градиента концентрации, мы получим простую линейную функцию.
Интерпретация: обратите внимание, что скорость диффузии увеличивается по мере градиент концентрации увеличивается. Если концентрация молекул вне клетки очень высока по сравнению с концентрацией внутри клетки, скорость диффузии также будет высокой. Если внутренний и внешние концентрации одинаковы (низкий градиент концентрации), скорость диффузии будет низкой.
Облегченное распространение
Переменные:
п | число молекул внутри клетки |
т | время (секунды) |
В макс. | константа насыщения (моль/см 3 /сек) |
К | константа определения скорости насыщения (моль/см 4 ) |
С | концентрация диффундирующей молекулы (моль/см 3 ) |
х | ширина клеточной мембраны (см) |
Метод: В отличие от простой диффузии, облегченная диффузия включает ограниченное количество белков-носителей. При низких концентрациях молекулы проходят через белки-носители аналогично простой диффузии. При высоком растворении
концентрации, однако все белки заняты диффундирующими молекулами. Дальнейшее увеличение концентрации растворенного вещества не изменит скорость диффузии. Другими словами, существует некоторая максимальная скорость диффузии (Vmax), когда все носители про
подростки
насыщены. Поэтому мы не можем использовать простое линейное уравнение для описания скорости диффузии. Скорость диффузии будет увеличиваться с увеличением концентрации растворенного вещества, но должна асимптотически приближаться к скорости насыщения, V макс . Как быстро
лы
белки-носители становятся насыщенными, можно описать переменной K, градиентом концентрации, при котором скорость диффузии составляет 1/2 Vmax. K и Vmax зависят от свойств диффундирующей молекулы, таких как ее проницаемость (P), а также
площадь поверхности (A) ячейки, но для упрощения мы приводим уравнение как:
Поэтому мы не можем использовать простое линейное уравнение для описания скорости диффузии. Скорость диффузии будет увеличиваться с увеличением концентрации растворенного вещества, но должна асимптотически приближаться к скорости насыщения, V макс . Как быстро
лы
белки-носители становятся насыщенными, можно описать переменной K, градиентом концентрации, при котором скорость диффузии составляет 1/2 Vmax. K и Vmax зависят от свойств диффундирующей молекулы, таких как ее проницаемость (P), а также
площадь поверхности (A) ячейки, но для упрощения мы приводим уравнение как:
Мы можем построить график зависимости dn/dt от dC/dx, чтобы увидеть, как скорость диффузии изменяется с увеличением концентрации растворенного вещества вне клетки.
Интерпретация: Изобразив это уравнение в виде графика, мы видим, что при низких
концентрации
растворенного вещества скорость диффузии в клетку происходит почти линейно, как и при простой диффузии. Обратите внимание, что при низких концентрациях растворенного вещества наклон намного круче, чем при простой диффузии.
Облегченная диффузия может увеличить скорость диффузии определенных молекул при низких концентрациях. Однако скорость облегченной диффузии выравнивается с увеличением концентрации растворенного вещества. Дополнительное увеличение внешней концентрации растворенного вещества
не может увеличить скорость диффузии после насыщения белков-носителей.
Обратите внимание, что при низких концентрациях растворенного вещества наклон намного круче, чем при простой диффузии.
Облегченная диффузия может увеличить скорость диффузии определенных молекул при низких концентрациях. Однако скорость облегченной диффузии выравнивается с увеличением концентрации растворенного вещества. Дополнительное увеличение внешней концентрации растворенного вещества
не может увеличить скорость диффузии после насыщения белков-носителей.
Вывод: Пассивная диффузия растворенного вещества в клетку линейно связана с концентрацией растворенного вещества вне клетки. Белки-носители увеличивают скорость диффузии, позволяя большему количеству растворенного вещества проникать в клетку. облегченная диффузия, однако приближается к максимальной скорости, когда белки-носители насыщаются растворенным веществом.
Дополнительные вопросы:
Простая диффузия
1. Мы построили график зависимости dn/dt от dC/dx. Каков наклон этой линии? Что биологически означает увеличение или уменьшение наклона?
2. Теперь предположим, что градиент концентрации является постоянным. Как изменяется скорость диффузии (dn/dt) в зависимости от площади поверхности (A) клетки и проницаемости (P) диффундирующей молекулы? Постройте график dn/dt как функцию от A или P и опишите
функция.
Теперь предположим, что градиент концентрации является постоянным. Как изменяется скорость диффузии (dn/dt) в зависимости от площади поверхности (A) клетки и проницаемости (P) диффундирующей молекулы? Постройте график dn/dt как функцию от A или P и опишите
функция.
Облегченная диффузия
1. Посмотрите на уравнение облегченной диффузии и найдите горизонтальную асимптоту. Что происходит с dn/dt, когда dC/dx приближается к бесконечности?
2. Попробуйте изобразить это уравнение с различными значениями K. Как это изменит концентрацию, при которой происходит насыщение белков-носителей?
3. Сравните простую и облегченную диффузию глюкозы в эритроциты, построив график скорости диффузия (микромоль в час) в зависимости от внешней концентрации глюкозы (ммоль/см 3 ). Для облегчения диффузия, V max = 500 микромолей в час и K = 1,5 ммоль/см 3 . Для простая диффузия, А х Р 3 см 3 /час.
Источники: Дарнелл, Дж.

 В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.
В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.

Leave A Comment