Рибосомы
☰
Рибосомы являются важнейшими органоидами клетки, так как на них протекает процесс трансляции — синтез полипептида на матричной РНК (мРНК). Другими словами, рибосомы служат местом белкового синтеза.
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку), состоят из двух частей – субъединиц. В состав субчастиц входят рибосомальные РНК (рРНК) и рибосомные белки, т. е. рибосомы по химическому составу являются рибонуклеопротеидами. Однако в них также присутствует небольшое количество низкомолекулярных соединений. Из-за многочисленности рибосом, рРНК составляет более половины от всей РНК клетки.
Одну из субъединиц называют «малой», вторую – «большой».
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую полисому (полирибосому).
Характеристика рибосом, типы, структура, функции / биология | Thpanorama
рибосомы они являются наиболее распространенными клеточными органеллами и участвуют в синтезе белков. Они не окружены мембраной и образованы двумя типами субъединиц: большой и малой, как правило, большая субъединица почти вдвое меньше.
Прокариотическая линия имеет 70S рибосомы, состоящие из большой 50S субъединицы и небольшой 30S. Аналогично, рибосомы эукариотической линии состоят из большой субъединицы 60S и маленькой 40S субъединицы..
Рибосома является аналогом фабрики в движении, способной считывать РНК-мессенджер, переводить ее в аминокислоты и связывать их пептидными связями..
Рибосомы эквивалентны почти 10% от общего количества бактерий и более 80% от общего количества РНК. В случае эукариот их не так много по сравнению с другими белками, но их количество больше..
В 1950 году исследователь Джордж Паладе впервые визуализировал рибосомы, и это открытие было удостоено Нобелевской премии по физиологии и медицине..
индекс
- 1 Общая характеристика
- 2 Структура
- 3 типа
- 3.1 Рибосомы у прокариот
- 3.2 Рибосомы у эукариот
- 3.3 Рибосомы в Аркеасе
- 3.4 Коэффициент седиментации
- 4 функции
- 4.1 Трансляция белков
- 4.2 Передача РНК
- 4.3 Химические стадии синтеза белка
- 4.4 Рибосомы и антибиотики
- 5 Синтез рибосом
- 5.1 Рибосомные РНК-гены
- 6 Происхождение и эволюция
- 7 ссылок
Общие характеристики
Рибосомы являются важными компонентами всех клеток и связаны с синтезом белка. Они очень маленькие по размеру, поэтому их можно визуализировать только в свете электронного микроскопа..
Рибосомы свободны в цитоплазме клетки, они прикреплены к шероховатой эндоплазматической сети — рибосомы дают «морщинистый» вид — и в некоторых органеллах, таких как митохондрии и хлоропласты..
Рибосомы, прикрепленные к мембранам, ответственны за синтез белков, которые будут вставлены в плазматическую мембрану или отправлены наружу клетки..
Свободные рибосомы, которые не связаны с какой-либо структурой в цитоплазме, синтезируют белки, предназначение которых находится внутри клетки. Наконец, рибосомы митохондрий синтезируют белки для митохондриального использования..
Таким же образом несколько рибосом могут соединяться и образовывать «полирибосомы», образуя цепь, связанную с РНК-мессенджером, синтезируя один и тот же белок, многократно и одновременно
Все они состоят из двух подразделений: одно называется большим или большим, а другое маленьким или меньшим.
Некоторые авторы считают, что рибосомы являются не мембранными органеллами, поскольку им не хватает этих липидных структур, хотя другие исследователи сами не считают их органеллами..
структура
Рибосомы представляют собой небольшие клеточные структуры (от 29 до 32 нм, в зависимости от группы организмов), округлые и плотные, состоящие из рибосомальной РНК и белковых молекул, которые связаны друг с другом..
Наиболее изученными являются рибосомы эубактерий, архей и эукариот. В первой линии рибосомы проще и меньше. Эукариотические рибосомы, с другой стороны, являются более сложными и более крупными. У архей рибосомы в некоторых аспектах больше похожи на обе группы.
Рибосомы позвоночных и покрытосеменных (цветковых растений) особенно сложны.
Каждая рибосомная субъединица состоит в основном из рибосомальной РНК и большого разнообразия белков. Большая субъединица может состоять из небольших молекул РНК, в дополнение к рибосомальной РНК.
Белки связаны с рибосомальной РНК в определенных регионах, следуя порядку. В рибосомах можно дифференцировать несколько активных сайтов, таких как каталитические зоны.
Рибосомная РНК имеет решающее значение для клетки, и это можно увидеть в ее последовательности, которая практически не изменилась в ходе эволюции, отражая высокое селективное давление против любых изменений.
тип
Рибосомы у прокариот
Бактерии, как Кишечная палочка, имеют более 15000 рибосом (в пропорциях это эквивалентно почти четверти сухой массы бактериальной клетки).
Рибосомы в бактериях имеют диаметр около 18 нм и состоят из 65% рибосомальной РНК и только 35% белков различных размеров, от 6000 до 75000 кДа..
Большая субъединица называется 50S, а маленькая 30S, которые в совокупности образуют структуру 70S с молекулярной массой 2,5 × 10.6 кД.
Субъединица 30S вытянута и не симметрична, тогда как 50S толще и короче.
Небольшая субъединица Кишечная палочка он состоит из 16S рибосомальной РНК (1542 основания) и 21 белка, а в большой субъединице — 23S рибосомальной РНК (2904 основания), 5S (1542 основания) и 31 белка. Белки, которые их составляют, являются основными, и их количество варьируется в зависимости от структуры..
Молекулы рибосомальной РНК вместе с белками группируются во вторичной структуре подобно другим типам РНК..
Рибосомы у эукариот
Рибосомы у эукариот (80S) крупнее, с более высоким содержанием РНК и белка. РНК длиннее и называются 18S и 28S. Как и у прокариот, в составе рибосом доминирует рибосомная РНК.
У этих организмов рибосома имеет молекулярную массу 4,2 × 10.6 кДа, и он разбит на 40S и 60S субъединицу.
Субъединица 40S содержит одну молекулу РНК, 18S (1874 основания) и около 33 белков. Аналогично, субъединица 60S содержит 28S РНК (4718 оснований), 5,8S (160 оснований) и 5S (120 оснований). Кроме того, он состоит из основных белков и кислотных белков..
Рибосомы в Аркеасе
Археи представляют собой группу микроскопических организмов, которые напоминают бактерии, но они отличаются по многим характеристикам, которые составляют отдельный домен. Они живут в разных условиях и способны колонизировать экстремальные условия.
Типы рибосом, обнаруженные у архей, сходны с рибосомами эукариотических организмов, хотя они также имеют определенные характеристики бактериальных рибосом..
Он имеет три типа молекул рибосомальной РНК: 16S, 23S и 5S, связанные с 50 или 70 белками, в зависимости от вида исследования. По размеру рибосомы архей ближе к бактериальным (70S с двумя субъединицами 30S и 50S), но по своей первичной
Рибосома — Википедия
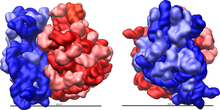
Рибосо́ма — важнейший немембранный органоид живой клетки, служащий для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
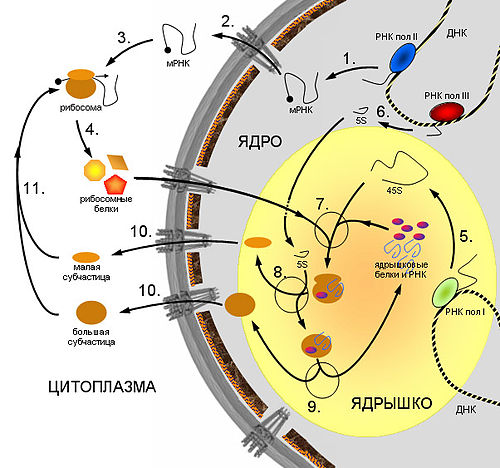 Схема синтеза рибосом в клетках эукариот.
Схема синтеза рибосом в клетках эукариот. 1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Состав рибосомы
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания
- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V. 330. P. 1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977—980.
Литература
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Рибосома — это… Что такое Рибосома?
 Рибосома
РибосомаРибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
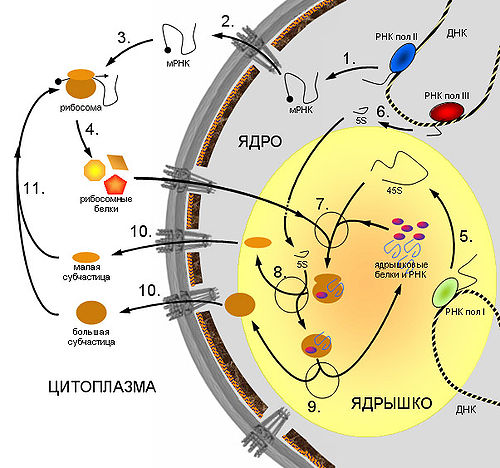 Схема синтеза рибосом в клетках эукариот.
Схема синтеза рибосом в клетках эукариот.1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Примечания
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V.330. P.1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977–980.
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
структура и биохимический состав — Студопедия
Строение рибосомы.Она состоит из мембраны, цитоплазмы, органоидов, которые в них расположены, а также ядра (кроме прокариотов), в котором находятся молекулы ДНК. Кроме того, над мембраной имеется дополнительная защитная структура. В животных клетках это гликокаликс, во всех остальных — клеточная стенка. У растений она состоит из целлюлозы, у грибов — из хитина, у бактерий — из муреина. Мембрана состоит из трех слоев: двух фосфолипидных и белкового между ними. Рибосомы обнаружены в клетках всех организмов. Это микроскопические тельца округлой формы диаметром 15-20 нм. Каждая рибосома состоит из двух неодинаковых по размерам частиц, малой и большой.
В одной клетке содержится много тысяч рибосом, они располагаются либо на мембранах гранулярной эндоплазматической сети, либо свободно лежат в цитоплазме. В состав рибосом входят белки и РНК. Функция рибосом — это синтез белка. Синтез белка — сложный процесс, который осуществляется не одной рибосомой, а целой группой, включающей до нескольких десятков объединенных рибосом. Такую группу рибосом называют полисомой. Синтезированные белки сначала накапливаются в каналах и полостях эндоплазматической сети, а затем транспортируются к органоидам и участкам клетки, где они потребляютя. Эндоплазматическая сеть и рибосомы, расположенные на ее мембранах, представляют собой единый аппарат биосинтеза и транспортировки белков.
Химический состав рибосом В составе рибосом эукариотического типа 4 молекулы рРНК и около 100 молекул белка, прокариотическоготипа — 3 молекулы рРНК и около 55 молекул белка. Во время биосинтеза белка рибосомы могут «работать» поодиночке или объединяться в комплексы — полирибосомы (полисомы). В таких комплексах они связаны друг с другом одной молекулой иРНК. Прокариотические клетки имеют рибосомы только 70S-типа. Эукариотические клетки имеют рибосомы как 80S-типа (шероховатые мембраны ЭПС, цитоплазма), так и 70S-типа (митохондрии, хлоропласты).Субъединицы рибосомы эукариот образуются в ядрышке. Объединение субъединиц в целую рибосому происходит в цитоплазме, как правило, во время биосинтеза белка.
Функция рибосом: сборка полипептидной цепочки (синтез белка).
Различают единичные рибосомы и комплексные рибосомы (полисомы). Рибосомы могут располагаться свободно в гиалоплазме и быть связанными с мембранами эндоплазматической сети
Структурная организация и функции хромосом и рибосом.
Вся информация о человеке хранится в хромасомах. Хромосомы по своей химической природе являются нуклеопротеодами. Нуклеопротеиды состоят из белковой части (гистоны, протамины) и простетической группы (НК).Высокополимерные ДНК в комплексе с молекулами белков и составляют хромасому. Молекула ДНК за счет остатков фосфорной кислоты заряжается отрицательно и присоединяет к своей поверхности положительно заряженные белки, образую сложный белок дезоксирибонуклеопротеид называемый хроматином. Спираль ДНК соединяется с группами из 8 молекул гистона и образует нуклеосомы — частицы, имеющие вид нанизанных на нитку бусинок. Эти нуклеосом и соединяющие их участки ДНК плотно упакованы в виде спирали толщиной в 36 нм. На каждый виток спирали приходится примерно 6 нуклеосом, которые по своим размерам и другим признакам соответствуют хромомере хромосом. Все хромосомы состоят из двух хромомер и соеденены друг с другом центральными двумя нитями ДНК.
Функции хромосом заключается:
В хранении наследственной информации. Хромосомы являются носителями генетической информации.
— В передаче наследственной информации. Наследственная информация передается путем репликации молекулы ДНК.
— В реализации наследственной информации. Благодаря воспроизводству того или иного типа и-РНК и соответственно того или иного типа белка осуществляется контроль над всеми процессами жизнедеятельности клетки и всего организма.
Сформулированы основные принципы структурной организации рибосомы: 1) рибосома построена из двух неравных субчастиц; 2) высокополимерная РНК каждой рибосомной субчастицы компактно свернута специфическим образом, формируя структурное ядро рибосомной субчастицы; 3) разнообразные рибосомные белки собраны на ядре РНК как на каркасе, так что каждый белок узнает свою посадочную площадку.
Рибосомы представляют собой субклеточные частицы с козффициенто седиментации 80S и молекулярной массой 4,5 млн. Они состоят из двух субъединиц — большой (60S) и малой (40S). Каждая из субъединиц содержит РНК и белки.
Функции рибосом: синтез белков.
Характеристика ферментов класса трансфераз.
2 класс ферментов — трансферазы. Ферменты этого класса катализируют перенос функциональных групп и делятся по этому принципу на 8 подклассов:
· переносит одноуглеродные остатки (метил-, метелин-)
· переносят альдегидные или кетоновые группы
· переносят ацильные (кислотные) остатки
· переносят гликозильные остатки
· переносят алкильные или арильные группы
· переносят азотсодержащие группы (амино-, амидино-)
· переносят фофорсодержащие группы
· переносят серосодержащие группы (тиогруппы)
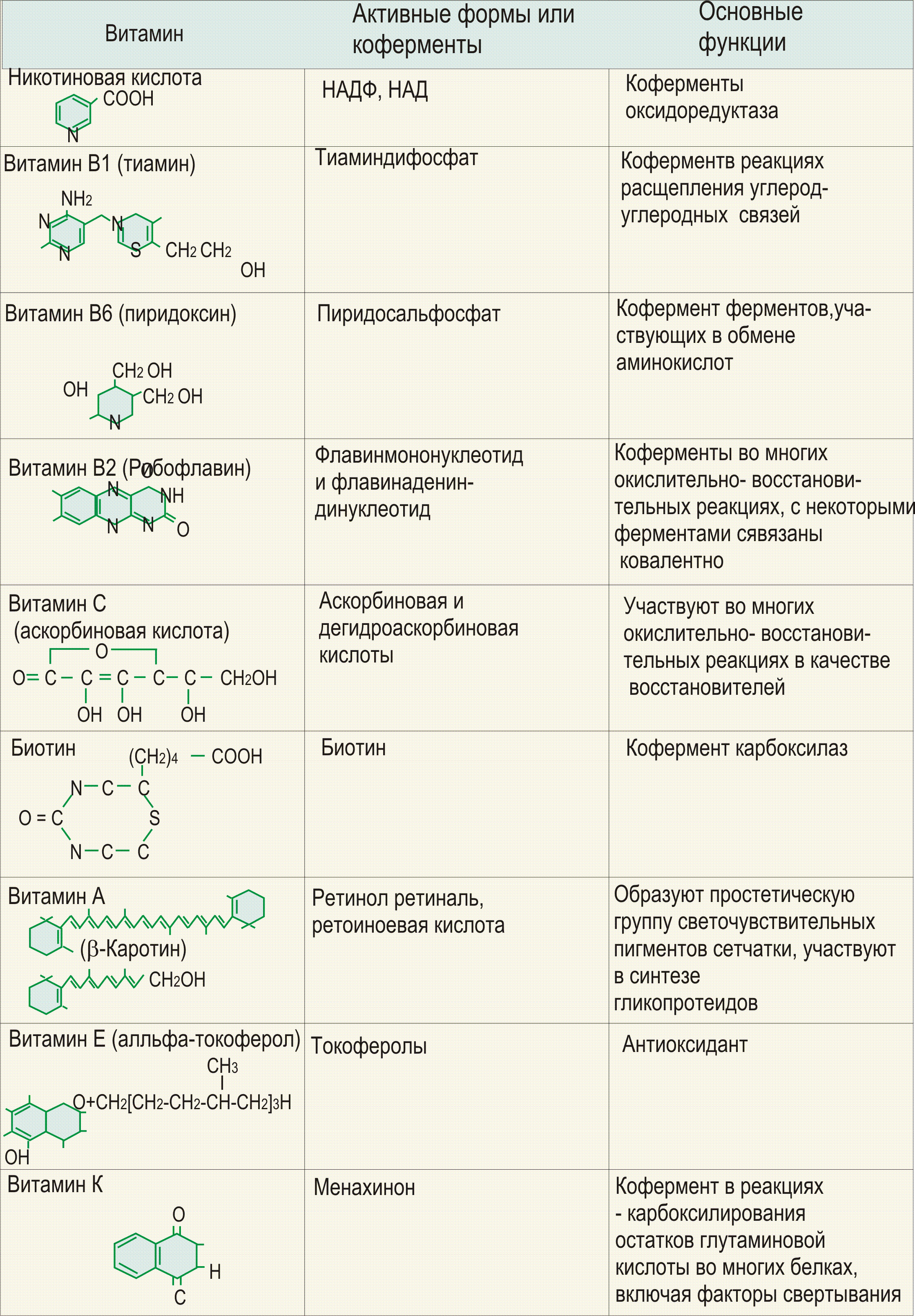
Строение, пищевые источники и биологические функции витамина РР.
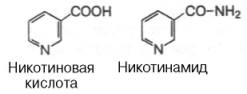
Витамин PP существует в двух формах — никотиновой кислоты и никотиномида.
Источники
Говяжья печень, дрожжи, брокколи, морковь, сыр, кукурузная мука, листья одуванчика, финики, яйца, рыба, молоко, арахис, свинина, картофель, помидоры, проростки пшеницы, продукты из цельных злаков.
Травы, богатые витамином PP: люцерна, корень лопуха, котовник кошачий, кайенский перец, ромашка, песчанка, очанка, семя фенхеля, пажитник сенной, женьшень, хмель, хвощ, коровяк, крапива, овес, петрушка, мята перечная, листья малины, красный клевер, плоды шиповника, шалфей, щавель.
Действие
Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме.
Рибосомы-строение, химический состав, функции. Свободные рибосомы, полирибосомы, их связь с другими структурными компонентами клетки
Строение рибосомы. Рибосомы обнаружены в клетках всех организмов. Это микроскопические тельца округлой формы диаметром 15-20 нм. Каждая рибосома состоит из двух неодинаковых по размерам частиц, малой и большой.
В одной клетке содержится много тысяч рибосом, они располагаются либо на мембранах гранулярной эндоплазматической сети, либо свободно лежат в цитоплазме. В состав рибосом входят белки и РНК. Функция рибосом — это синтез белка. Синтез белка — сложный процесс, который осуществляется не одной рибосомой, а целой группой, включающей до нескольких десятков объединенных рибосом. Такую группу рибосом называют полисомой. Синтезированные белки сначала накапливаются в каналах и полостях эндоплазматической сети, а затем транспортируются к органоидам и участкам клетки, где они потребляютя. Эндоплазматическая сеть и рибосомы, расположенные на ее мембранах, представляют собой единый аппарат биосинтеза и транспортировки белков.
Химический состав рибосом В составе рибосом эукариотического типа 4 молекулы рРНК и около 100 молекул белка, прокариотического типа — 3 молекулы рРНК и около 55 молекул белка. Во время биосинтеза белка рибосомы могут «работать» поодиночке или объединяться в комплексы — полирибосомы (полисомы). В таких комплексах они связаны друг с другом одной молекулой иРНК. Прокариотические клетки имеют рибосомы только 70S-типа. Эукариотические клетки имеют рибосомы как 80S-типа (шероховатые мембраны ЭПС, цитоплазма), так и 70S-типа (митохондрии, хлоропласты).Субъединицы рибосомы эукариот образуются в ядрышке. Объединение субъединиц в целую рибосому происходит в цитоплазме, как правило, во время биосинтеза белка.
Функция рибосом: сборка полипептидной цепочки (синтез белка).
Свободные рибосомы, полирибосомы, их связь с другими структурными компонентами клетки.
Различают единичные рибосомы и комплексные рибосомы (полисомы). Рибосомы могут располагаться свободно в гиалоплазме и быть связанными с мембранами эндоплазматической сети. Свободные рибосомы образуют белки в основном на собственные нужды клетки, связанные обеспечивают синтез белков “” на экспорт”.
11) Центриоли-строение, функции в интерфазе и во время деления клетки. Микротрубочки, микрофибриллы и микрофиламенты, их химический состав и функциональная характеристика.
Строение: В некоторых объектах удавалось наблюдать центриоли, обычно расположенные в паре (диплосома), и окруженные зоной более светлой цитоплазмы, от которой радиально отходят тонкие фибриллы (центросфера). Совокупность центриолей и центросферы называют клеточным центром.
Чаще всего пара центриолей лежит вблизи ядра. Каждая центриоль построена из цилиндрических элементов (микротрубочек), образованных в результате полимеризации белка тубулина. Девять триплетов микротрубочек расположены по окружности.
ФункцииЦентриоли принимают участие в формировании цитоплазматических микротрубочек во время деления клетки и в регуляции образования митотического веретена. В клетках высших растений и большинства грибов центриолей нет, и митотическое веретено образуется там иным способом. Кроме того, ученые полагают, что ферменты клеточного центра принимают участие в процессе перемещения дочерних хромосом к разным полюсам в анафазе митоза.
Цикл развитияОбычно в течение клеточного цикла центриоль удваивается один раз. Рядом с каждой половинкой «материнской» центриоли достраивается «дочерний» цилиндрик; происходит это, как правило, в течение S-периода интерфазы. В профазе митоза две центриоли расходятся к полюсам клетки и формируют две центросомы. Центросомы в свою очередь служат ЦОМТами (центрами организации микротрубочек) веретена деления. Однако от этой общей схемы существует масса отклонений. Во многих клетках центриоли многократно удваиваются за один клеточный цикл. При созревании яйцеклеток у подавляющего большинства животных центриоли разрушаются (при этом многие белки, входящие в состав центросом, по-прежнему присутствуют в клетке). При образовании сперматозоидов, напротив, деградирует центросома; одна из центриолей превращается в базальное тельце жгутика, а вторая сохраняется интактной. Однако у мыши и других грызунов (в отличие от остальных изученных млекопитающих), а также у улиток деградируют и обе центриоли сперматозоидов. После оплодотворения новые центриоли возникают в зиготе либо за счет удвоения центриоли, внесенной сперматозоидом, либо за счет образования заново[1].
микротрубочек.- основными функциями микротрубочек является структурная и опорная функции. Существуют структуры, в которых цитоскелет образуется за счет микротрубочек, например, тромбоциты. Кроме того микротрубочки объединяются с белками МАР и могут участвовать в выполнении многих важных функций в клетке. МАР-белки способны регулировать сборку и разборку микротрубочек,
строение Микротрубочки состоят из белков-тубулинов и ассоциированных с ними белков. Молекула тубулина представляет собой гетеродимер, состоящий из двух разных субъедениц: из и которые при ассоциации образуют собственно белок тубулин, изначально поляризованный. При полимеризации молекулы тубулина объединяются таким образом, что с одного белка ассоциируется -субъеденица следующего белка и т.д. Следовательно, отдельные протофибриллы возникают как полярные нити, и соответственно вся микротрубочка тоже является полярной структурой, имеющей быстро растущий плюс-конец и медленно растущий минус-конец.
Микрофибриллы- или промежуточные филаменты, представляют собой тонкие (10 нм) неветвящиеся нити, локализующиеся преимущественно в кортикальном (подмембранном) слое цитоплазмы. Они состоят из белка, но разного в разных клетках (в эпителиальных клетках кератина, в фибробластах виментина, в мышечных клетках десмина и другие). Функциональная роль микрофибрилл состоит в участии, наряду с микротрубочками, в формировании клеточного каркаса, выполняя опорную функцию. В некоторых клетках (эпидермоциты кожи) микрофибриллы объединяются в пучки и образуют тонофибриллы, которые рассматриваются как специальные органеллы, выполняющие опорную роль.
Микрофиламенты еще более тонкие нитчатые структуры (5-7 нм), состоящие из сократительных белков (актина, миозина, тропомиозина), неодинаковых в разных клетках. Локализуются преимущественно в кортикальном слое цитоплазмы. В совокупности микрофиламенты составляют сократительный аппарат клетки, обеспечивающий различные виды движений:
- перемещение органелл;
- ток гиалоплазмы;
- изменение клеточной поверхности;
- образование псевдоподий и перемещение клетки.
Структура рибосомы — Biology Wise
Структура рибосомы
Нравится? Поделись!

Рибосомы — это небольшие органеллы клетки, обладающие плотной структурой, которые помогают в производстве белка. Это нуклеопротеиды, берущие свое начало в ядрышке. Расскажите о них подробнее.
Основными компонентами рибосом являются белки и РНК. Изготовление протеина — их основная задача. Его присутствие обычно отмечается в ER (Endoplasmic Reticulum).Однако в цитоплазме разбросаны рибосомы по всей площади. Они, как клеточные органеллы, являются наиболее важным элементом любой клетки, будь то растение или животное.
Хотели бы вы написать нам? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Честь открытия рибосомы принадлежит Джорджу Паладе, клеточному биологу из Румынии, с помощью «электронного микроскопа». Его теория, согласно которой рибосомы представляют собой гранулы или плотные элементы, принесла ему Нобелевскую премию.В 1958 году Ричард Б. Робертс дал органеллам название «рибосома». Только с 1970-х годов была известна его молекулярная структура. Однако в 2000 году с помощью микроскопа более высокого разрешения была обнаружена более совершенная структура.
происхождение
Он присутствует во всех эукариотах и прокариотах и является наиболее важным компонентом, поскольку он производит белок, который требуется в различных энергетических процессах клетки. По распространенности рибосомы можно разделить на две категории:
Свободные рибосомы
Они путешествуют в цитоплазме независимо.Белки этого типа используются для биологических процессов внутри клетки.
Рибосомы с мембраной
Категории, связанные с мембраной, образованы белком, синтезированным рибосомами. Вновь созданные цепи полипептидов вводятся в ЭР через рибосомы. После этого эти цепочки отправляются в выбранный пункт назначения. Белки, полученные с их помощью, используются в клетках или удаляются посредством экзоцитоза.
Рибосомы, связанные с мембраной или свободные, имеют схожие функции и структуру.Их дифференцируют по наличию или отсутствию сигнальной последовательности, которая нацелена на ER в изготовленных полипептидных цепях.
Конструктивные особенности

Диаметр рибосомы 20 нм. Их состав можно разделить на две части — 2/3 части р-РНК (рибосомальной РНК) и 1/3 части РНП (рибосомный белок или белок рибонуклепа). Полипептидная цепь производится путем трансляции мРНК (информационная РНК) с помощью аминокислот, которые доставляет тРНК (транспортная РНК).Поскольку их активная часть состоит из субструктур РНК, их также называют рибозимами.
Структура рибосомы и ее субъединиц почти одинакова как у эукариот, так и у прокариот.
Рибосомы прокариот — это 70S, каждая из которых включает 30S (маленькие) и 50S (большие) субъединицы. 50S дополнительно включает 5S субъединицу РНК (состоящую почти из 120 нуклеотидов) вместе с субъединицами 23S РНК (почти 2900 нуклеотидов) и 34 белковые субъединицы. Если оценивается 30S, отмечается субъединица РНК, содержащая 1540 нуклеотидов, которые связаны через 21 единицу белка.
Хотели бы вы написать нам? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Рибосомы у эукариот — это 80S субъединицы, каждая из которых состоит из 40S (малых) и 60S (больших) субъединиц. 60S включает 5S субъединицу РНК (почти 120 нуклеотидов) вместе с единицами 28S РНК (почти 4700 нуклеотидов), субъединицу 5.8S (около 160 нуклеотидов) и ~ 49 единиц белка. 40S содержит 18S РНК (приблизительно 1900 нуклеотидов) и ~ 33 единицы белка.
Рибосомы, воспринимаемые митохондриями и хлоропластами эукариот, состоят из более крупных и мелких субъединиц, связанных вместе с несколькими молекулами белка в одной частице 70S. Частицы 70S считаются потомками бактерий и обнаруживают сходство с прокариотическими рибосомами.
Рибосомы бывают разных размеров. Однако их общая структура похожа. РНК, которые присутствуют в большем разнообразии и имеют несколько более продолжительное и непрерывное распределение.Такое распределение образованных из них петель не нарушает и не трансформирует баланс внутри органеллы. РНК выполняет все действия рибосомы, основанные на катализаторах, а белок, расположенный на поверхности, стабилизирует органеллы.
Различия в рибосомах эукариот и прокариот полезны для фармацевтов. Они производят антибиотики, используя непохожесть, что помогает в устранении инфекций бактериальной природы, не оказывая вредного воздействия на соседние клетки.Категория 70S (потомки бактерий) восприимчивы к этим антибиотикам. В митохондриях есть рибосомы, похожие по природе на 70S и бактерии. Однако их структура, ограниченная двойной непроницаемой мембраной, не позволяет антибиотикам воздействовать на органеллы.
Функция
Синтез белка происходит в рибосомах. Содержимое РНК рибосомы трансформируется в белковые молекулы. Клеткам, которым для правильного функционирования требуется большое количество белка, требуется сравнительно больше этих клеточных органелл.
Значение синтеза белка можно легко наблюдать в клетках по наличию множества рибосом, независимо перемещающихся в клетке. У эукариот синтез трех р-РНК происходит внутри ядрышка, в то время как четвертая синтезируется вне ядрышка и затем передается в ядрышко для их сборки. Белки перемещаются в ядрышко и представляют собой комбинацию из 4 р-РНК, и этот белок участвует в образовании больших и малых субъединиц, которые представляют собой две структуры рибосом.Перед изготовлением белка субъединицы объединяются вне ядра. Синтез прокариот происходит в цитоплазме. В отсутствие рибосом сообщения не могут быть прочитаны, и изготовление белка невозможно.
Похожие сообщения
- Процесс клонирования человека
В последнее время идет большая дискуссия по поводу процесса клонирования человека. Является ли это этичным или неэтичным, генетическое клонирование всегда рассматривается как величайшая проблема в генетическом…
- Преимущества клонирования человека
Ожидается, что преимущества клонирования человека будут многочисленны для человечества, хотя его потенциал не совсем ясен.Давайте посмотрим на такой потенциал и достигнутые преимущества.
Получайте обновления прямо на ваш почтовый ящик
Подпишитесь, чтобы получать самые свежие и лучшие статьи с нашего сайта автоматически каждую неделю (плюс-минус) … прямо на ваш почтовый ящик. ,Минутку …
Включите файлы cookie и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер в ближайшее время перенаправит вас на запрошенный контент.
Подождите до 5 секунд…
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! [ ]) + !! [] + !! []) + (+ [] + (!! []) — []) + (+ [] + (!! []) + !! [] +! ! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] + (!! [!]) — []) + (+ [ ] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [ ])) + (+ [] + (!! []) — []) + (+ !! []) + (+ [] + (!! []) + !! [] + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !! [] + !! [] + !!] [] ) + (! + [] + (!! []) — []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + ( ! + [] — (!! [])) + (! + [] + (!! []) + !! [])) / + (! (+ [] + (!! []) + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! []) + (! + [ ] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ !! []) + (+ [] + (!! [!]) — []) + (+ [] — (!! [] )))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! []) + (+ [] + (!! []) — (! + [] + (!! []) []) + + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] +! ! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] — (!! []!)) + (+ [] + (! ! []) + !! [] + !! []) + (+ [] — (!! [])) + (+ [] + (!! []) + !! []) + (! + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] +! ! [] + !! []) + (+ [] + (!! [!]) + !! [] + !! [] + !! []) + (+ [] — (!! [] )) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! []) + (+ [] — (!! [])) + + !! [] + !! []) + ((+ [] + (!! []!)! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] + (!! []) + !! [])) / + ((+ [] + (!! [!]) + !! [] + []) + (+ [] — (!! []) ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ !! []) + (! + [] + ( !! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []) ) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! [] ) + + !! []) + (+ [] + (!! []!) (+ [] + (!! []) — (! + [] + (!! []) []) + + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !! [] + !! [] + !!] [] + !! []) + (+ !! [])) / + ((+ [] + (!! [!]) — [] + []) + (+ [] — (!! []) ) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [ ]) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []))
+ ((! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) +! ! [] + !! [] + !! []) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [] + !! [ ]) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] +! ! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! []))
.Рибосома | цитология | Britannica
Рибосома , частица, которая присутствует в большом количестве во всех живых клетках и служит местом синтеза белка. Рибосомы встречаются как в виде свободных частиц в прокариотических и эукариотических клетках, так и в виде частиц, прикрепленных к мембранам эндоплазматического ретикулума в эукариотических клетках. Маленькие частицы, которые стали известны как рибосомы, были впервые описаны в 1955 году американским клеточным биологом румынского происхождения Джорджем Паладе, который обнаружил, что они часто связаны с эндоплазматическим ретикулумом в эукариотических клетках.
Рибосомы на внешней поверхности эндоплазматического ретикулума играют важную роль в синтезе белков внутри клеток. Encyclopædia Britannica, Inc.Рибосомы чрезвычайно многочисленны в клетках. Например, одна активно реплицирующаяся эукариотическая клетка может содержать до 10 миллионов рибосом. У бактерии Escherichia coli (прокариот) количество рибосом может достигать 15 000, что составляет до четверти общей массы клетки. Размер рибосом внутри клеток варьируется в зависимости от типа клетки и таких факторов, как то, находится ли клетка в покое или реплицируется.Средняя рибосома E. coli , наиболее охарактеризованный образец, имеет диаметр около 200 ангстрем (около 20 нм).
Синтез белка ДНК в ядре клетки несет генетический код, который состоит из последовательностей аденина (A), тимина (T), гуанина (G) и цитозина (C) (рис. 1). РНК, которая содержит урацил (U) вместо тимина, переносит код на участки образования белков в клетке. Чтобы создать РНК, ДНК соединяет свои основания с основаниями «свободных» нуклеотидов (рис. 2).Информационная РНК (мРНК) затем перемещается к рибосомам в цитоплазме клетки, где происходит синтез белка (рис. 3). Основные триплеты транспортной РНК (тРНК) соединяются с таковыми из мРНК и в то же время откладывают свои аминокислоты на растущей белковой цепи. Наконец, синтезированный белок высвобождается для выполнения своей задачи в клетке или в другом месте тела. Encyclopdia Britannica, Inc.Рибосомы состоят из рибосомных белков и рибосомальной РНК (рРНК). У прокариот рибосомы примерно на 40 процентов состоят из белка и на 60 процентов рРНК.У эукариот рибосомы примерно наполовину состоят из белка и наполовину из рРНК. Рибосомы обычно состоят из трех или четырех молекул рРНК и примерно от 40 до 80 различных рибосомных белков.
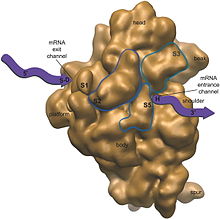
Каждая рибосома состоит из двух субъединиц, большей и меньшей, каждая из которых имеет характерную форму. Субъединицы обычно называют их скоростью осаждения, которая измеряется в единицах Сведберга (S), в центробежном поле. Маленькие и большие субъединицы эукариот обозначаются 40S и 60S соответственно, в то время как прокариоты содержат небольшую субъединицу 30S и большую субъединицу 50S.
Получите эксклюзивный доступ к контенту нашего 1768 First Edition с подпиской. Подпишитесь сегодняРибосомы — это места, где информация, содержащаяся в генетическом коде, преобразуется в белковые молекулы. Рибосомные молекулы информационной РНК (мРНК) определяют порядок молекул транспортной РНК (тРНК), которые связаны с триплетами нуклеотидов (кодонами). Порядок молекул тРНК в конечном итоге определяет аминокислотную последовательность белка. Молекулы рРНК катализируют реакцию пептидилтрансферазы, которая образует пептидные связи между аминокислотами, связывая их вместе с образованием белков.Вновь образованные белки отделяются от участка рибосомы и мигрируют в другие части клетки для использования.
.Минутку …
Включите файлы cookie и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер в ближайшее время перенаправит вас на запрошенный контент.
Подождите до 5 секунд…
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! [ ]) + !! [] + !! []) + (+ [] + (!! []) — []) + (+ [] + (!! []) + !! [] +! ! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [ ]) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [ ] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) + !! [] + !! [] + !! []) + (+ [] — (!! []) ) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (!! [!]) — []) + (+ [] + ( !! []) + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! [] ) + !! [] + []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [ ] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [ ] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + []) + (+ [] — (!! [])) + (+ [] + (!! []) — (! + [] + (!! []) []) + + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) +! ! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [ ]) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] +! ! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) — []) + (+ [] — (!! [])))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] + (!! [!]) — []) + (+ [] — (!! []!)) + (+ [ ] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! []) — (! + [] + (!! []) []) + + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (+ !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + + (+ [] + (!! []!)! ! [] + !! []) + (+ !! [
,
Leave A Comment