СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
26.03.2023
Рыбы, амфибии, рептилии…
В весенние каникулы в СУНЦ прошел практикум по зоологии позвоночных животных.
23.03.2023
Лицеисты-биологи в «Сириусе»
В образовательном центре «Сириус» проходит мартовская образовательная программа по биологии.
22.03.2023
«Февромарт» в общежитии
В общежитии традиционно «Битвой века» отметили День защитника Отечества и 8 Марта.
13.03.2023
Мы и гвозди забивать умеем!
Команда СУНЦ УрФУ победила в студенческих инженерных соревнованиях.
10.03.2023
Успех на региональном этапе
Учащиеся СУНЦ УрФУ получили 330 дипломов победителей и призеров регионального этапа Всероссийской олимпиады школьников.
08.03.2023
«Ты — женщина, и этим ты права…»
6 марта в СУНЦ состоялся концерт, посвящённый Международному женскому дню.
Больше новостей
Видеогалерея:
Мужчины СУНЦ о 8 Марта (2023)
Концерт к 8 Марта (2023)
Поздравление с Днем защитника Отечества (2023)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
ОГЭ №2, вопрос 1-16 — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) кислород → фтор → неон
2) кремний → сера → хлор
3) селен → сера → кислород
4) алюминий → магний → натрий
3
Неметаллические свойства фосфора выражены сильнее,
чем неметаллические свойства
1) азота
2) кислорода
3) серы
4) кремния
4
В каком ряду химические элементы расположены в порядке
возрастания их атомного радиуса?
1) C → N→ O
2) Si →Al →Mg
3) S→ P→ N
4) Br →Cl →F
5
От кислотных к основным меняются свойства оксидов в ряду
1) CaO →SiO2→ SO3
2) Na2O→ MgO→ Al2O3
3) CO2→Al2O3 →MgO
4)SO3→ P2O5→ SiO2
Наиболее сильными основными свойствами обладает оксид
1) магния
2) бериллия
3) алюминия
4) натрия
Наиболее сильными кислотными свойствами обладает высший оксид
1) фосфора
2) кремния
3) хлора
4) алюминия
8
Атомный радиус химических элементов уменьшается в
ряду
1) Si →Al →Mg
2) Be→Al →C
3) As→ P→ N
4) F→ Cl→ Br
9
От основных к кислотным меняются свойства оксидов в
ряду
1) N2O5→ P2O5 →As2O5
2) Li2O→ Na2O →K2O
3) MgO →SiO2 →SO3
4) CO2→ B2O3→ Li2O
10
Основные свойства оксида магния выражены сильнее, чем
основные свойства
1) оксида бериллия
2) оксида натрия
3) оксида кальция
4) оксида калия
11
ряду
1) фосфор → кремний → алюминий
2) фтор → хлор → бром
3) селен → сера → кислород
4) азот → фосфор → мышьяк
12
Неметаллические свойства углерода выражены сильнее,
чем неметаллические свойства
1) кислорода
2) кремния
3) азота
4) фтора
13
Металлические свойства магния выражены сильнее, чем
металлические свойства
1) кальция
2) бериллия
3) калия
4) бария
14
Неметаллические свойства серы выражены сильнее, чем неметаллические свойства
1) селена
2) фтора
3) кислорода
4) хлора
15
В главных подгруппах Периодической системы с увеличением заряда ядра атомов химических элементов
2) уменьшаются металлические свойства
3) изменяется валентность в водородных соединениях
4) остается постоянной высшая валентность
16
Порядковый номер химического элемента в Периодической
системе Д.
 И. Менделеева соответствует:
И. Менделеева соответствует:1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего
электронного слоя
4) числу электронных слоев в атоме
English Русский Правила
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ПЕРИОДА 3 На этой странице объясняется взаимосвязь между физическими свойствами оксидов элементов 3-го периода (от натрия до хлора) и их структурой. Очевидно, что аргон не используется, поскольку он не образует оксид. Краткий обзор тенденций Оксиды Оксиды, которые мы рассмотрим:
Эти оксиды в верхнем ряду известны как 9. | ||||||||||||||||
Примечание: Если вы не уверены в степенях окисления (числах окисления), вы найдете их обсуждение, если перейдете по этой ссылке. | ||||||||||||||||
Конструкции Тенденция в структуре от металлических оксидов, содержащих гигантские структуры ионов слева от периода, через гигантский ковалентный оксид (диоксид кремния) в середине к молекулярным оксидам справа. Температуры плавления и кипения Гигантские структуры (оксиды металлов и диоксид кремния) будут иметь высокие температуры плавления и кипения, поскольку для разрыва прочных связей (ионных или ковалентных), действующих в трех измерениях, требуется много энергии. Оксиды фосфора, серы и хлора состоят из отдельных молекул — одни маленькие и простые; другие полимерные. Силы притяжения между этими молекулами будут представлять собой дисперсию Ван-дер-Ваальса и диполь-дипольные взаимодействия. Они различаются по размеру в зависимости от размера, формы и полярности различных молекул, но всегда будут намного слабее, чем ионные или ковалентные связи, которые необходимо разорвать в гигантской структуре. Эти оксиды, как правило, представляют собой газы, жидкости или твердые вещества с низкой температурой плавления. Электропроводность Ни один из этих оксидов не имеет свободных или подвижных электронов. Это означает, что ни один из них не будет проводить электричество, когда он твердый. Однако ионные оксиды могут подвергаться электролизу в расплавленном состоянии. Они могут проводить электричество из-за движения ионов к электродам и разряда ионов, когда они туда попадают. | ||||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много подробностей о структуре различных оксидов. Не упускайте из виду общие тенденции того периода, когда вы смотрите на все эти детали. | ||||||||||||||||
Оксиды металлов Конструкции Оксиды натрия, магния и алюминия состоят из гигантских структур, содержащих ионы металлов и ионы оксидов . Оксид магния имеет структуру, аналогичную хлориду натрия. Два других имеют более сложное расположение ионов, выходящее за рамки учебных программ этого уровня (уровень UK A или его эквиваленты). | ||||||||||||||||
Примечание: Вы можете найти структуру хлорида натрия (такую же, как структура оксида магния), перейдя по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | ||||||||||||||||
Температуры плавления и кипения Между ионами каждого из этих оксидов существует сильное притяжение, и для разрушения этого притяжения требуется много тепловой энергии. | ||||||||||||||||
Проблемы! Здесь я намеревался привести значения для каждого из оксидов, надеясь показать, что температуры плавления и кипения увеличиваются по мере увеличения заряда положительного иона от 1+ в натрии до 3+ в алюминии. Можно было бы ожидать, что чем больше заряд, тем больше аттракционов. К сожалению, оксид с самой высокой температурой плавления и кипения — это оксид магния, не оксид алюминия! Так что эта теория пошла прахом! Причина этого, вероятно, заключается в увеличении электроотрицательности при переходе от натрия к магнию и алюминию. Это означало бы, что разница электроотрицательностей между металлом и кислородом уменьшается. Меньшая разница означает, что связь не будет такой чисто ионной. Также вероятно, что расплавленный оксид алюминия содержит сложные ионы, содержащие как алюминий, так и кислород, а не простые ионы алюминия и оксида. Все это, конечно, означает, что вы на самом деле не сравниваете подобное с подобным, поэтому не обязательно ожидать четкой тенденции. Другие проблемы, с которыми я столкнулся, связаны с оксидом натрия. В большинстве источников говорится, что он возгоняется (превращается из твердого состояния в пар) при 1275°C. Однако обычно надежные Webelements дают температуру плавления 1132°C, за которой следует температура разложения (до кипения) 1950°C. В других источниках говорится о его разложении (до натрия и пероксида натрия) выше 400°С. Я понятия не имею, какова правда об этом, хотя я подозреваю, что значение точки плавления Webelements, вероятно, для давления выше атмосферного давления (хотя об этом не говорится). | ||||||||||||||||
Электропроводность Ни один из них не проводит электричество в твердом состоянии, но возможен электролиз , если они находятся в расплавленном состоянии. Они проводят электричество из-за движения и разряда присутствующих ионов. Единственный важный пример этого — электролиз оксида алюминия при производстве алюминия. Возможность электролиза расплавленного оксида натрия зависит, конечно, от того, плавится ли он на самом деле, а не сублимируется или разлагается при обычных обстоятельствах. Если он сублимируется, вы не получите никакой жидкости для электролиза! Оксиды магния и алюминия имеют слишком высокую температуру плавления, чтобы их можно было подвергнуть электролизу в простой лаборатории. | ||||||||||||||||
Примечание: Вы найдете полную информацию об электролизе оксида алюминия при извлечении алюминия, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | ||||||||||||||||
Диоксид кремния (оксид кремния(IV)) Конструкция Электроотрицательность элементов увеличивается по мере прохождения периода, и к тому времени, когда вы доберетесь до кремния, разницы в электроотрицательности между кремнием и кислородом будет недостаточно для образования ионной связи. | ||||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | ||||||||||||||||
Существуют три различные кристаллические формы диоксида кремния. Самый простой для запоминания и рисования основан на ромбовидной структуре. Кристаллический кремний имеет ту же структуру, что и алмаз. Чтобы превратить его в диоксид кремния, все, что вам нужно сделать, это изменить структуру кремния, включив в него несколько атомов кислорода. Обратите внимание, что каждый атом кремния связан со своими соседями атомом кислорода. Не забывайте, что это всего лишь крошечная часть гигантской структуры, простирающейся во всех трех измерениях. | ||||||||||||||||
Примечание: Если вы хотите быть суетливым, валентные углы Si-O-Si на этой диаграмме неверны.  На самом деле «мост» от одного атома кремния к соседнему расположен не по прямой линии, а в виде буквы «V» (подобной форме вокруг атома кислорода в молекуле воды). Чрезвычайно сложно изобразить это убедительно и аккуратно на диаграмме с таким количеством атомов. Упрощение вполне приемлемо. На самом деле «мост» от одного атома кремния к соседнему расположен не по прямой линии, а в виде буквы «V» (подобной форме вокруг атома кислорода в молекуле воды). Чрезвычайно сложно изобразить это убедительно и аккуратно на диаграмме с таким количеством атомов. Упрощение вполне приемлемо.Если вам нужна помощь в рисовании этой структуры, вы найдете предложение, перейдя по этой ссылке Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | ||||||||||||||||
Температуры плавления и кипения Диоксид кремния имеет высокую температуру плавления, варьирующуюся в зависимости от конкретной структуры (помните, что данная структура является лишь одной из трех возможных структур), но все они составляют около 1700°C. Очень прочные ковалентные связи кремний-кислород должны быть разрушены по всей структуре, прежде чем произойдет плавление. Диоксид кремния кипит при 2230°С. Поскольку вы говорите о другой форме связи, нет смысла пытаться сравнивать эти значения напрямую с оксидами металлов. Электропроводность Диоксид кремния не имеет подвижных электронов или ионов, поэтому он не проводит электричество ни в твердом, ни в жидком состоянии. Молекулярные оксиды Фосфор, сера и хлор образуют оксиды, состоящие из молекул. Некоторые из этих молекул довольно просты, другие полимерны. Мы просто рассмотрим некоторые из самых простых. Температуры плавления и кипения этих оксидов будут намного ниже, чем у оксидов металлов или диоксида кремния. Межмолекулярные силы, удерживающие одну молекулу от соседей, будут дисперсионными силами Ван-дер-Ваальса или диполь-дипольными взаимодействиями. Сила их будет варьироваться в зависимости от размера молекул. Ни один из этих оксидов не проводит электричество ни в твердом, ни в жидком состоянии. Оксиды фосфора Фосфор имеет два общих оксида: оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора(III) Оксид фосфора(III) представляет собой белое твердое вещество, плавящееся при 24°C и кипящее при 173°C. Структура его молекулы лучше всего изучена, начиная с молекулы P 4 , которая представляет собой небольшой тетраэдр. Разорвите его, чтобы увидеть связи. . . . . . а затем заменить связи новыми связями, связывающими атомы фосфора через атомы кислорода. Они будут иметь V-образную форму (скорее как в воде), но вы, вероятно, не будете оштрафованы, если нарисуете их на прямой линии между атомами фосфора на экзамене. Фосфор использует только три своих внешних электрона (3 неспаренных p-электрона) для образования связей с атомами кислорода. Оксид фосфора(V) Оксид фосфора(V) также представляет собой белое твердое вещество, сублимирующее (превращающееся прямо из твердого состояния в пар) при 300°C. В этом случае фосфор использует для связи все пять своих внешних электронов. Твердый оксид фосфора(V) существует в нескольких различных формах, некоторые из которых являются полимерными. Мы сосредоточимся на простой молекулярной форме, которая также присутствует в паре. Легче всего рисовать, начиная с P 4 O 6 . Остальные четыре атома кислорода присоединены к четырем атомам фосфора двойными связями. | ||||||||||||||||
Примечание: Если вы посмотрите внимательно, форма этой молекулы очень похожа на то, как мы обычно рисуем повторяющуюся единицу в гигантской алмазной структуре. Однако не путайте их! Молекула P 4 O 10 останавливается здесь. | ||||||||||||||||
Оксиды серы Сера имеет два общих оксида: диоксид серы (оксид серы (IV)), SO 2 , и триоксид серы (оксид серы (VI)), SO 3 . Диоксид серы Диоксид серы представляет собой бесцветный газ при комнатной температуре с легко узнаваемым запахом удушья. Он состоит из простых молекул SO 2 . Сера использует 4 своих внешних электрона для образования двойных связей с кислородом, оставляя два других в виде неподеленной пары на сере. Изогнутая форма SO 2 обусловлена этой одиночной парой. Триоксид серы Чистый триоксид серы представляет собой белое твердое вещество с низкой температурой плавления и кипения. Он очень быстро реагирует с водяным паром в воздухе с образованием серной кислоты. Газообразный триоксид серы состоит из простых молекул SO 3 , в связывании которых участвуют все шесть внешних электронов серы. Существуют различные формы твердого триоксида серы. Простейшим из них является тример S 3 O 9 , в котором три молекулы SO 3 соединены и образуют кольцо. Существуют и другие полимерные формы, в которых молекулы SO 3 объединяются в длинные цепочки. Например: | ||||||||||||||||
Примечание: Трудно представить это убедительно. На самом деле, на каждом атоме серы один из атомов кислорода с двойными связями выходит из диаграммы к вам, а другой возвращается от вас. | ||||||||||||||||
Тот факт, что простые молекулы соединяются таким образом, образуя более крупные структуры, делает триоксид серы твердым, а не газообразным. | ||||||||||||||||
Примечание: Маловероятно, что вам понадобятся эти прочные конструкции для целей уровня UK A или его эквивалентов. Если вы сомневаетесь, проверьте свою программу и прошлые работы. Если у вас нет ни одного из них, перейдите по этой ссылке, чтобы узнать, как их получить. | ||||||||||||||||
Оксиды хлора Хлор образует несколько оксидов. Здесь мы просто рассматриваем два из них (единственные, упомянутые в любой из программ Великобритании) — оксид хлора (I), Cl 9.0028 2 O и оксид хлора (VII), Cl 2 O 7 . Оксид хлора(I) Оксид хлора(I) представляет собой желтовато-красный газ при комнатной температуре. Он состоит из простых небольших молекул. В этой молекуле нет ничего удивительного, и ее физические свойства как раз такие, какие вы ожидаете от молекулы такого размера. Оксид хлора(VII) В оксиде хлора (VII) хлор использует все свои семь внешних электронов в связях с кислородом. Оксид хлора(VII) представляет собой бесцветную маслянистую жидкость при комнатной температуре. На схеме для простоты я нарисовал стандартную структурную формулу. Фактически, форма тетраэдрическая вокруг обоих хлоров и V-образная вокруг центрального кислорода.
В меню Период 3 . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2005 г. (изменено в октябре 2014 г.) | ||||||||||||||||
1. Na2O > MgO > Al2O3 > CuO 2. MgO > Al2O3 > CuO > Na2O 3. Al2O3 > MgO > CuO > Na2O 4. CuO > Na2O > MgO > Al2O3 Практические вопросы NEET, MCQ, вопросы прошлого года (PYQ) ), вопросы NCERT, банк вопросов, вопросы класса 11 и класса 12 и PDF-файл, решенный с ответами
Select Subject:
Botany Chemistry Physics Zoology
The order of basic character of given oxides is:
1. Na 2 O> MGO> AL 2 O 3 > CUO
2. MGO> AL 2 O 3 > CUO> NA 2 o
3. AL 2 O 3 9008
3. AL 2 O 3 O 3. AL 2 O 3 O 3. AL 2 O 3 O. 3. AL 2 O 3 .0029 > MgO > CuO > Na 2 O
AL 2 O 3 O 3. AL 2 O 3 O 3. AL 2 O 3 O. 3. AL 2 O 3 .0029 > MgO > CuO > Na 2 O4. CuO > Na 2 O > MgO > Al 2 O 3
Q19:
68
% From NCERT
(1)
(2)
(3)
(4)
Подтема соединения: |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
Переменная степень окисления проявляется в чем из следующего? 1. Na
Na
2. Cu
3. Mg
4. Al
Q20:
77
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Современная периодическая таблица и периодичность |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & XII th Physics, Chemistry & Biology
6 The light the metal table это:1.
H
2. MG
3. CA
4. LI
Q21:
от NCERT
(1)
9065 (2) 5 (4)
8 (2) 5 9065(2) 9065 9000 (2).
Подтема: Современная периодическая таблица и периодичность |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology
Электронная конфигурация, представляющая d -элемент блока:
1. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6
2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
3. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
4. 1s 2 2s 2 2p6 3s 2 3p 6 4s 2
Q22:
76
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Электронная конфигурация |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
Наиболее распространенная степень окисления церия (Ce):1. +5, +3
2. +5, +4
3. +3, +4
4. +3, +5
Q23:
From NCERT
(1)
(2)
(3)
(4)
Подтема: Электронная конфигурация |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology
6 Электронная конфигурация атом имеет наименьшую энтальпию ионизации?1. 1с 2 ,2с 2 2п 5
2. 1s 2 ,2s 2 2p 3
3. 1s 2 ,2s 2 2p6,3s 1
4. 1s 2 ,2s 2 2p 6
Q24:
80
% From NCERT
(1)
(2)
(3)
(4)
Subtopic : Энергия ионизации (IE) |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & XII th Physics, Chemistry & Biology
Общая тенденция для элементов обеих групп I и II в периодической таблице по мере увеличения атомного номера:
1. Окислительная способность увеличивается
2. Атомный радиус увеличивается
3. Максимальная валентность увеличивается
4 . Reactivity with water decreases
Q25:
82
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Размер атома |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Разница между ионами и атомами:
charge
4. All of these
Q26:
87
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Современная периодическая таблица и периодичность |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн Аудио/Видео/Текст Решения через Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Ожидаемая тенденция изменения атомного радиуса вниз по группе:
1
2. Непрерывное увеличение
3. Периодическое увеличение с последующим уменьшением
4. Периодическое уменьшение с последующим увеличением
Q27:
86
% From NCERT
(1)
(2)
(3)
(4)
Subtopic: Atomic Size |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.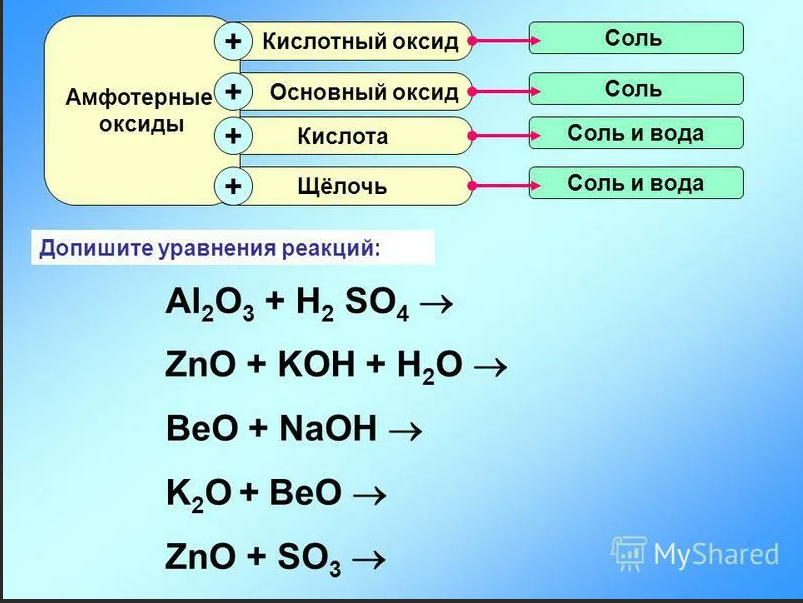
NEET 2023 - Целевая партия - Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получить NeetPrep's уникальные MCQ Books с онлайн Audio/Video/Text Solutions с помощью Telegram Bot
NEET MCQ Books для XI TH & XII TH Физика, Химия и Биология
Anlement R 9127 высший оксид R 2 O 5 . R относится к:
1. 13 группа
2. 15 группа
3. 16 группа
4. 2 группа
Q28:
74
% From NCERT
(1)
(2)
(3)
(4)
Subtopic: Nature соединения |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.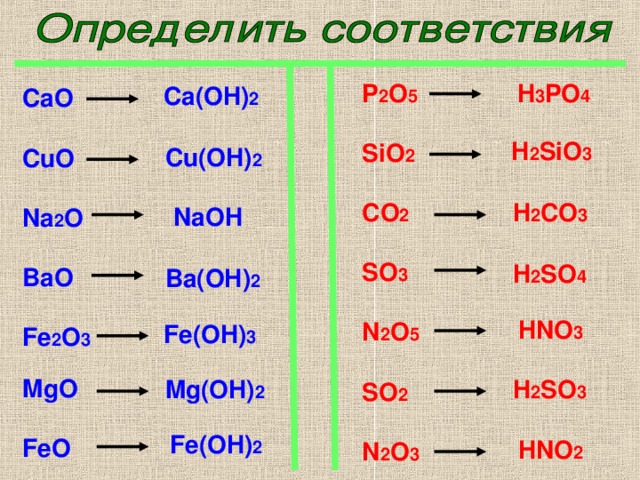

 0006 высшие оксиды различных элементов. Это оксиды, в которых элементы периода 3 находятся в самых высоких степенях окисления. В этих оксидах в связывании участвуют все внешние электроны элемента Периода 3 — от одного с натрием до всех семи внешних электронов хлора.
0006 высшие оксиды различных элементов. Это оксиды, в которых элементы периода 3 находятся в самых высоких степенях окисления. В этих оксидах в связывании участвуют все внешние электроны элемента Периода 3 — от одного с натрием до всех семи внешних электронов хлора.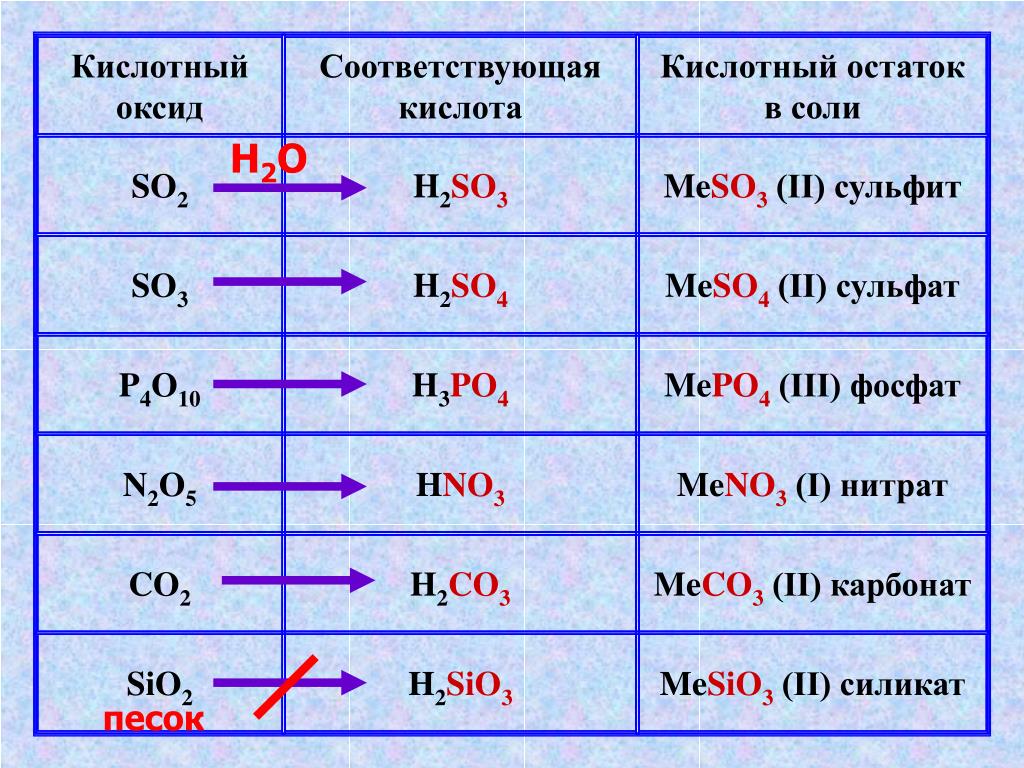

 Поэтому эти оксиды имеют высокие температуры плавления и кипения.
Поэтому эти оксиды имеют высокие температуры плавления и кипения.

 Диоксид кремния представляет собой гигантскую ковалентную структуру .
Диоксид кремния представляет собой гигантскую ковалентную структуру . Что вы можете с уверенностью сказать, так это то, что, поскольку оксиды металлов и диоксид кремния имеют гигантскую структуру, все температуры плавления и кипения высокие.
Что вы можете с уверенностью сказать, так это то, что, поскольку оксиды металлов и диоксид кремния имеют гигантскую структуру, все температуры плавления и кипения высокие. Ни один из них не содержит ионов или свободных электронов.
Ни один из них не содержит ионов или свободных электронов.
 Это не что-то вроде гигантской структуры — это все, что есть. В алмазе, конечно, структура почти бесконечно продолжается в трех измерениях.
Это не что-то вроде гигантской структуры — это все, что есть. В алмазе, конечно, структура почти бесконечно продолжается в трех измерениях.  Это означает, что если вы сделаете что-то в лаборатории, то увидите, что это белый осадок, который резко дымит во влажном воздухе (образуя туман из капель серной кислоты).
Это означает, что если вы сделаете что-то в лаборатории, то увидите, что это белый осадок, который резко дымит во влажном воздухе (образуя туман из капель серной кислоты).
 В результате образуется гораздо более крупная молекула, поэтому можно ожидать, что ее температура плавления и температура кипения будут выше, чем у оксида хлора (I).
В результате образуется гораздо более крупная молекула, поэтому можно ожидать, что ее температура плавления и температура кипения будут выше, чем у оксида хлора (I). . .
. .  H
H
Leave A Comment