Оксиды – Opiq
Peatükk 1.1 (Химия. 9 кл.)
Оксиды являются одними из самых распространённых соединений в природе. Они образуют большинство химических элементов. Только редкие элементы (такие, как инертные газы и некоторые драгоценные металлы, например золото) не образуют устойчивых оксидов.
Куприт — это минерал из оксида меди(I). Из-за красивого блеска и красного цвета граната, куприт мог бы быть драгоценным камнем, но он недостаточно твёрдый. По твёрдости куприт напоминает известняк.
Общая характеристика оксидов
Магнетит – это минерал, имеющий химическую формулу Fe3O4. Магнетит притягивается магнитом и сам может быть магнитом. Из природных минералов магнетит обладает самыми сильными магнитными свойствами
Жемчужное ожерелье из гематита, или оксида железа(III)
Оксиды – вещества, которые состоят из двух элементов, один из которых – кислород (степень окисления – II).
Свойства оксидов находятся в зависимости от общих свойств соответствующих химических элементов. Если мы знаем свойства оксидов, то сможем сделать выводы о свойствах других соединений, даже если до этого мы их подробно не рассматривали и не заучивали эти свойства наизусть.
CO₂
H₂O
NaCl
H₂SO₄
H₂CO₃
Fe₂O₃
H₂S
SiO₂
Подумай!
- Почему оксиды являются одними из самых распространённых соединений на Земле?
- Какие встречающиеся в природе оксиды ты знаешь?
Названия оксидов
Если у элемента в соединении только одна возможная степень окисления (элементы из групп IA, IIA и некоторые элементы из группы IIIA), то название их оксида состоит из слова оксид и названия металла.
- Na2O – оксид натрия
Есть два способа различить оксиды одного и того же элемента, который может иметь разные степени окисления.
Fe
Na
Mg
Al
K
Ag
Mn
Ca
Cr
Li
Co
Sn
1 окта-пента-моно-дека-
2 моно-тетра-ди-гепта-
3 пента-гекто-три-дека-
4 ди-окта-тетра-гекса-
5 пента-гепта-дека-ди-
6 пента-окта-гекса-гепта-
7 тетра-гепта-дека-гекса-
8 ди-тетра-нона-окта-
1.
 В названии обозначают степень окисления элемента.
В названии обозначают степень окисления элемента.Этот способ используют, прежде всего, чтобы дать названия оксидам металлов, хотя в наше время его применяют и для неметаллических оксидов.
- Fe2O3 – оксид железа(III) (читается: оксид-железа-три).
- N2O5 – оксид азота(V) (читается: оксид-азота-пять).
2. Число атомов элементов обозначают с помощью приставок.
Этот способ распространен в случае оксидов неметаллов.
- N2O3 – триоксид диазота.
- Ag2O оксид серебраоксид серебра(I)оксид серебра(II)оксид серебра(III)
- CuO оксид медиоксид меди(I)оксид меди(II)оксид меди(III)
- Cu2O оксид медиоксид меди(I)оксид меди(II)оксид меди(III)
- Na2O оксид натрияоксид натрия(I)оксид натрия(II)оксид натрия(III)
- CO2 оксид углеродаоксид диуглеродадиоксид углерода
- SO3 оксид серыдиоксид серытриоксид серыоксид трисеры
- N2O оксид азотаоксид диазотадиоксид азота
- N2O5 оксид азотаоксид диазотапентаоксид диазотагексаоксид диазота
Классификация оксидов
Большинство оксидов обладает основными или кислыми свойствами.
Большинство оксидов металлов имеют основные свойства, и большинство неметаллических оксидов имеют кислотные свойства.
BeO – лёгкое (ρ = 3,0 г/см3 ) химически стойкое вещество с высокой температурой плавления (~ 2500 °С). Поэтому его можно использовать, например, в качестве материала для корпуса ракеты
- Оксиды металлов обычно являются кислотными.нейтральными.основными.сильнокислотными.сильноосновными.
- Оксиды неметаллов обычно являются кислотными.нейтральными.основными.сильнокислотными.сильноосновными.
- Оксиды щелочных и щелочноземельных металлов являются кислотными.нейтральными.основными.сильнокислотными.сильноосновными.
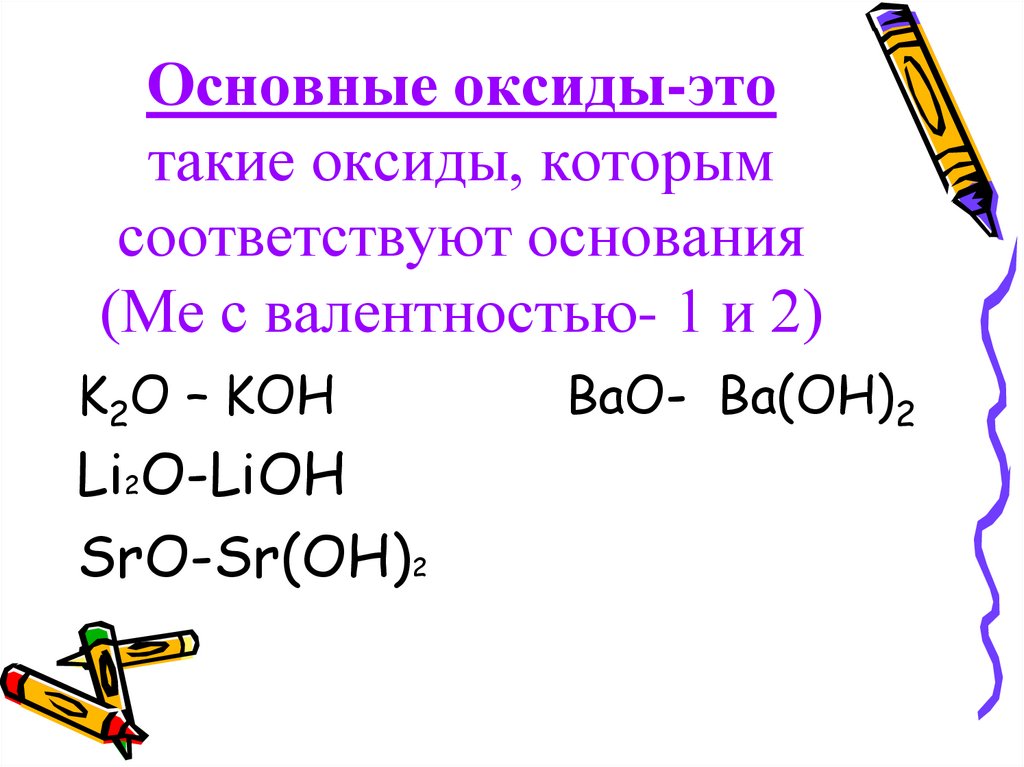
Основные оксиды
Основные оксиды имеют основные свойства и реагируют с кислотами.
Деревянные дома в Швеции часто окрашены в красный цвет, который содержит мелкие частицы гематита (Fe2O3)
Кристаллы корунда (сапфир и рубин)
Оксид цинка используют в качестве белого пигмента
Бóльшая часть оксидов металлов обладает основными свойствами. Оксиды активных металлов (щелочных и щелочноземельных) – сильноосновные. Оксиды малоактивных металлов имеют слабоосновные свойства, например, CrO, FeO, NiO, CuO.
Оксиды активных металлов (щелочных и щелочноземельных) – сильноосновные. Оксиды малоактивных металлов имеют слабоосновные свойства, например, CrO, FeO, NiO, CuO.
Сильноосновные | |
Оксиды | Гидроксиды |
Активно реагируют с водой, образуя щёлочь. | Хорошо растворимые в воде сильные основания (щёлочи). |
Li2O, Na2O, CaO, BaO | LiOH, NaOH, Ca(OH)2, Ba(OH)2 |
Слабоосновные | |
Оксиды | Гидроксиды |
Практически не реагируют с водой. | Практически нерастворимые в воде слабые основания. |
CrO, FeO, NiO, CuO | Cr(OH)2, Fe(OH)2, Ni(OH)2, Cu(OH)2 |
Все оксиды металлов – это твёрдые немолекулярные вещества. Оксиды менее активных металлов являются химически устойчивыми веществами. Многие из них используются при изготовлении красок в качестве красящего пигмента. Например, Cr2O3 используется для изготовления зелёных, а Fe2O3 для изготовления жёлтых и коричневых красок.
Большинство малоактивных оксидов металлов – довольно твёрдые вещества с высокой температурой плавления. Особенной твёрдостью обладает, например, Al2O3 (корунд), большие прозрачные кристаллы которого известны как драгоценные камни, например, красный рубин и синий сапфир.
реагируют с основаниями.
реагируют с кислотами.
соответствуют определённому гидроксиду.
соответствуют определённой кислоте.
хорошо растворяются в воде.
При записи химической формулы не забудь переключить шрифт на клавиатуре с русского на латинский.
Li2O –
MnO –
CaO –
Co2O3 –
Кислотные оксиды
Кислотные оксиды обладают кислыми свойствами и реагируют с основаниями.
Большинство оксидов неметаллических элементов имеет кислые свойства. Бóльшая часть неметаллических оксидов состоит из молекул (исключением является SiO2, который относится к немолекулярным оксидам). Молекулярные оксиды, молекулы которых малы, являются в обычных условиях газами (например, SO2, CO2, NO и др.), а при молекулах большого размера – твёрдыми веществами (например, P4O10).
Молекулярные оксиды, молекулы которых малы, являются в обычных условиях газами (например, SO2, CO2, NO и др.), а при молекулах большого размера – твёрдыми веществами (например, P4O10).
Вода (то есть оксид диводорода) – один из тех немногих оксидов, который при обычных условиях представляет собой жидкость.
На песчаном пляже много песка (дикосида кремния) и воды (оксида диводорода)
Диоксид углерода, или углекислый газ представляет собой кислотный оксид. Твёрдый углекислый газ (CO2) называется сухим льдом
реагируют с основаниями.
реагируют с кислотами.
соответствуют определённому гидроксиду.
соответствуют определённой кислоте.

в основном реагируют с водой с образованием кислоты.
При записи химической формулы не забудь переключить шрифт на клавиатуре с русского на латинский.
SO2 –
CO2 –
SO3 –
P4O10 –
Я знаю, что …
- Оксид состоит из двух элементов, одним из которых является кислород (в степени окисления –II).
- Классификация оксидов по химическим свойствам
Основные оксиды | |
сильноосновные реагируют с водой | слабоосновные с водой не реагируют |
Li2O, Na2O, CaO, BaO | CrO, Fe2O3, CuO, ZnO |
Кислотные оксиды | |
реагируют с водой | с водой не реагируют |
SO2, NO2, CO2, P4O10 | SiO2 |
- Основные оксиды обладают основными свойствами, реагируют с кислотами.

- Кислотные оксиды обладают кислыми свойствами, реагируют с основаниями.
Вопросы
- Почему важно упоминать окисление в названиях оксидов?
- Какими свойствами должны обладать вещества, чтобы их можно было использовать в качестве
а) цветного пигмента,
б) драгоценного камня? - Что такое основной оксид?
- Чем различаются сильноосновные и слабоосновные оксиды?
- Что такое кислотный оксид?
Химические свойства оксидов
Оксиды бывают:
- солеобразующие
- основные (Na2O, MgO),
- кислотные (SO3, CO2, Mn2O7),
- амфотерные (Al2O3, ZnO)
- несолеобразующие (NO, N2O, CO)
1. Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
2. Кислотные оксиды реагируют с водой (кроме SiO2), щелочами, основными оксидами.
3. Амфотерные оксиды реагируют с кислотами, щелочами, кислоными оксидами, основными оксидами (при сплавлении)
4. Несолеобразующие оксиды — не реагируют ни с водой, ни с кислотами, ни со щелочами.
Давайте порассуждаем вместе
1. Какое из веществ взаимодействует с водой при комнатной температуре?
1) оксид кремния (IV)
2) оксид меди (II)
3) оксид серы (VI)
4) сера
Ответ: №3, т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
2. Какое из веществ не взаимодействует с соляной кислотой
1) оксид углерода (IV)
2) оксид кальция
3) нитрат серебра
4) кальций
Ответ: №1, т. к. с кислотами не взаимодействует кислотный оксид CO2
3. Оксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) гидроксидом натрия
3) водой
4) хлороводородом
Ответ: №2, т.к. основные оксиды не реагируют со щелочами.
4. Соляная кислота реагирует с каждым из оксидов
1) CaO и CO2 2) SO3 и SiO2
3) CO и NO
4) MgO и ZnO
Ответ: №4 с кислотами реагируют основные (MgO) и амфотерные оксиды (ZnO)
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
5. Оксид магния реагирует с каждым из веществ
1) HCl и SO3
2) SO3 и NaOH
3) NaOH и H2О
4) H2SO4 и KCl
Ответ: №1, т.
к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
6. Оксид серы (IV) реагирует с
1) NaOH
2) NaCl
3) H2SO4
4) P2O5
Ответ: №1, т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
7. С водным раствором гидроксида калия реагируют
1) алюминий
2) медь
3) натрий
4) сульфат меди (II)
5) сульфат натрия
Ответ: 1, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
CuSO4 — растворимая соль, со щелочью дает осадок Cu(OH)2 синего цвета CuSO4 + 2KOH = Cu(OH)2 + K2SO4
8.
1) алюминий
2) медь
3) оксид меди (II)
4) хлорид калия
5) хлорид бария
Ответ: 1, 3, 5, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
CuO — основный оксид, реагирует с кислотами CuO + H2SO4 = CuSO
4 + H2O BaCl2 — растворимая соль, дает с серной кислотой белый осадок сульфата бария BaCl2 + H2SO4 = 2HCl + BaSO4
9. С водными растворами каких веществ реагирует углекислый газ
1) хлорид натрия
2) карбонат натрия
3) гидроксид кальция
4) соляная кислота
5) гидроксид натрия
Ответ: 2, 3, 5, т.
к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3 Ca(OH)2 и NaOH — щелочи реагируют с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O ; 2NaOH + CO2 = Na2CO3 + H2O
10. С водным раствором гидроксида натрия реагируют
1) алюминий
2) хлор
3) оксид железа (II)
4) оксид серы (IV)
5) серебро
Ответ: 1, 2, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cl2 — активный неметалл — галоген реагирует со щелочью и на холоду и при нагревании
Cl2 + 2NaOH = NaCl + NaClO + h3O (холод)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (нагрев)
SO2 — кислотный оксид реагирует со щелочью SO2 + 2NaOH = Na2SO3 + H2O
11.
1) медь
2) углекислый газ
3) оксид магния
4) серная кислота
5) оксид алюминия
Ответ: 1,3, 5, т.к. азотная кислота сильный окислитель, она реагирует даже с металлами, стоящими после водорода, выделяя оксиды азота
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
MgO и Al2O3 — основный и амфотерный оксиды соответственно, они реагируют с кислотами с образованием соли и воды
MgO + 2HNO3 = Mg(NO3)2 + H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
12. Оксид железа (II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Ответ: №2, т.
к. основные оксиды реагируют с кислотами FeO + 2HBr = FeBr2 = H2O
Видео-урок: Реакции оксидов
Стенограмма видео
В этом видео мы узнаем, что
оксид и какие оксиды являются кислотными, основными, амфотерными и нейтральными. Мы рассмотрим некоторые химические
уравнения реакции некоторых оксидов с кислотами. Во-первых, давайте спросим себя, что такое
оксид? Оксид – это соединение, которое
содержит кислород элемента, связанный с другим элементом. Например, в углекислом газе
кислород связан с углеродом. Некоторые часто встречающиеся оксиды
о которых вы, возможно, слышали, это оксид железа (III), который является основным компонентом
ржавчина, двуокись серы, которая иногда используется в качестве пищевого консерванта, диазот
монооксид, который является названием ИЮПАК и чье обычное название — закись азота, это
веселящий газ, вода, диоксид кремния или кремнезем, который является основным компонентом песка,
оксид алюминия и оксид магния.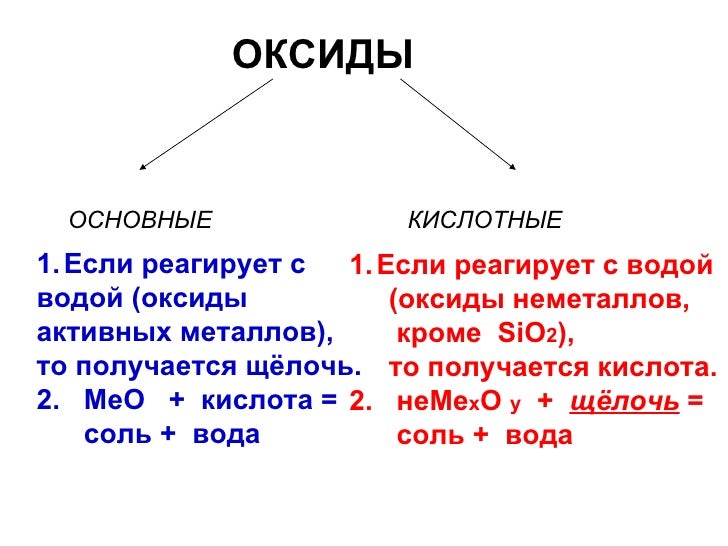
Возможно, вы произвели магний Оксид в лаборатории. Пара щипцов держит магний ленту в пламени горелки Бунзена. Происходит сильно экзотермическая реакция при этом выделяется много тепла и света, когда магний реагирует с кислородом в воздуха для получения оксида магния. Все оксиды можно разделить на одна из четырех групп: кислотные, основные, амфотерные или нейтральные оксиды. Давайте исследуем это и начнем с кислотными оксидами. Кислые оксиды – это те, которые при они реагируют с водой, образуя кислоты. Эти оксиды содержат неметаллы из группы с 14 по 17 таблицы Менделеева. Общее уравнение неметалла оксид плюс вода реагируют с образованием кислоты. Давайте посмотрим на некоторые примеры.
Когда газообразный диоксид серы реагирует с
вода, получается сернистая кислота, h3SO3. Когда оксид неметалла, углерод
двуокись, реагирует с водой, образуется углекислота или h3CO3. Эти две реакции могут протекать в
окружающей среде, когда в атмосфере много SO2 и CO2. Жидкая вода и капли дождя могут
взаимодействуют с двуокисью углерода и двуокисью серы в атмосфере и производят
две кислоты угольная и сернистая кислота. Эти две кислоты входят в состав
кислотный дождь. Последний пример того, когда неметалл
оксид взаимодействует с водой с образованием кислоты — это реакция диоксида азота
газ с водой для получения азотной кислоты. Если несколько капель универсального
к растворам этих кислот добавляли индикатор, он становился красно-оранжевым, что доказывало
что оксиды неметаллов SO2, CO2 и NO2 при взаимодействии с водой действительно
производят кислоты.
Эти две реакции могут протекать в
окружающей среде, когда в атмосфере много SO2 и CO2. Жидкая вода и капли дождя могут
взаимодействуют с двуокисью углерода и двуокисью серы в атмосфере и производят
две кислоты угольная и сернистая кислота. Эти две кислоты входят в состав
кислотный дождь. Последний пример того, когда неметалл
оксид взаимодействует с водой с образованием кислоты — это реакция диоксида азота
газ с водой для получения азотной кислоты. Если несколько капель универсального
к растворам этих кислот добавляли индикатор, он становился красно-оранжевым, что доказывало
что оксиды неметаллов SO2, CO2 и NO2 при взаимодействии с водой действительно
производят кислоты.
Теперь давайте посмотрим на основные
оксиды. Основной оксид – это оксид, который
при взаимодействии с водой образует основание или щелочь. Обычно основные оксиды содержат
металлы из первой или второй группы периодической таблицы. Общее уравнение — оксид металла
плюс вода реагируют с образованием основания или щелочи. Щелочь – это вещество, содержащее
гидроксид-ион ОН-. Вот два примера уравнений
где оксиды металлов образуют гидроксиды или растворы щелочей. В первом случае оксид натрия реагирует
с водой с образованием гидроксида натрия, а во втором оксид кальция реагирует с
воды для получения гидроксида кальция. Гидроксид натрия хорошо растворим
в воде, тогда как гидроксид кальция мало растворим. Тем не менее, если несколько капель
в эти растворы добавляли универсальный индикатор, он становился сине-фиолетовым,
подтверждая, что растворы являются основными или щелочными, и доказывая, что эти оксиды
действительно реагируют с водой с образованием оснований или щелочей.
Обычно основные оксиды содержат
металлы из первой или второй группы периодической таблицы. Общее уравнение — оксид металла
плюс вода реагируют с образованием основания или щелочи. Щелочь – это вещество, содержащее
гидроксид-ион ОН-. Вот два примера уравнений
где оксиды металлов образуют гидроксиды или растворы щелочей. В первом случае оксид натрия реагирует
с водой с образованием гидроксида натрия, а во втором оксид кальция реагирует с
воды для получения гидроксида кальция. Гидроксид натрия хорошо растворим
в воде, тогда как гидроксид кальция мало растворим. Тем не менее, если несколько капель
в эти растворы добавляли универсальный индикатор, он становился сине-фиолетовым,
подтверждая, что растворы являются основными или щелочными, и доказывая, что эти оксиды
действительно реагируют с водой с образованием оснований или щелочей.
До сих пор мы видели, что неметалл
оксиды или кислотные оксиды реагируют с водой с образованием кислот и оксидов металлов или
основные оксиды реагируют с водой с образованием основания. Кислотные оксиды также могут действовать как
кислоты и реагируют с основанием с образованием соли и воды. А основные оксиды могут действовать как
основания, реагируя с кислотой с образованием соли и воды. Применяется общее правило: кислота
реагирует с основанием с образованием соли и воды. Чуть позже в этом видео мы
посмотрите, как основные оксиды реагируют с кислотами с образованием соли и
вода. А пока переходим к третьему
тип оксида, амфотерные оксиды.
Кислотные оксиды также могут действовать как
кислоты и реагируют с основанием с образованием соли и воды. А основные оксиды могут действовать как
основания, реагируя с кислотой с образованием соли и воды. Применяется общее правило: кислота
реагирует с основанием с образованием соли и воды. Чуть позже в этом видео мы
посмотрите, как основные оксиды реагируют с кислотами с образованием соли и
вода. А пока переходим к третьему
тип оксида, амфотерные оксиды.
Оксиды амфотерные, в отличие от кислотных
и основные оксиды обычно не растворяются в воде и не реагируют с ней. Тем не менее, они показывают как кислую
и основные свойства. Они ведут себя как кислота, когда
реагируют с основанием и ведут себя как основание, когда реагируют с кислотой. Эти оксиды содержат такие металлы, как
медь, цинк, свинец, бериллий, алюминий и олово.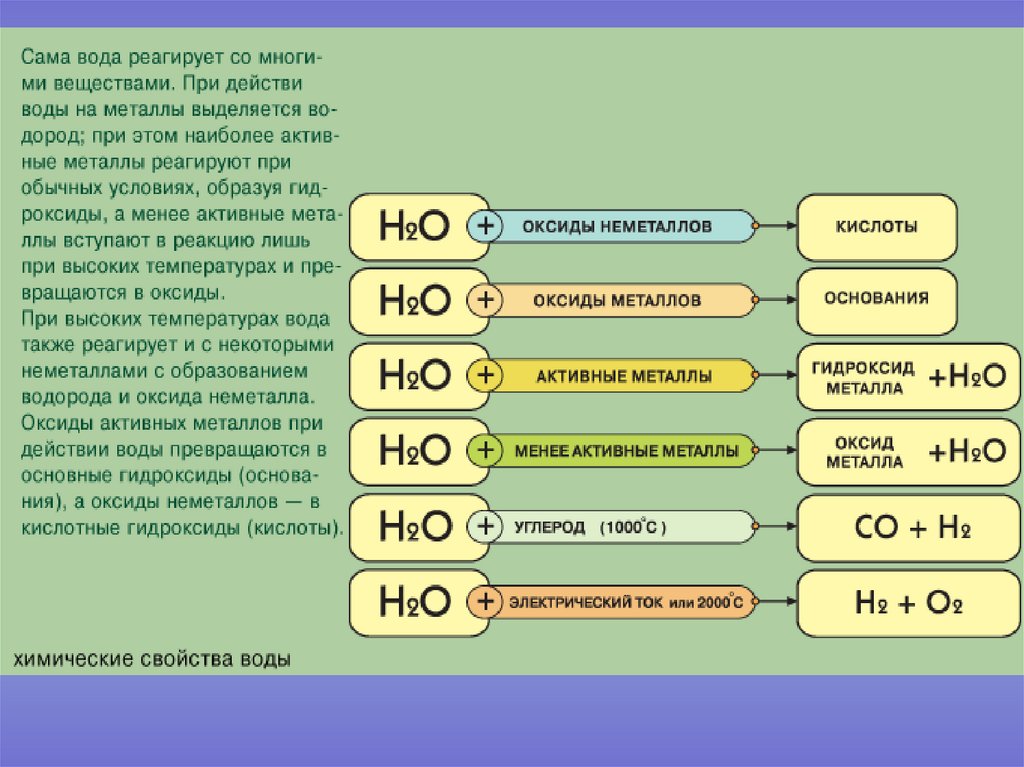 Мы видели минуту назад, что когда
кислота и основание реагируют, образуется соль и вода. Так как амфотерные оксиды могут
ведут себя как кислоты или основания, есть два общих уравнения, на которые следует обратить внимание. Когда эти оксиды ведут себя как
кислота, уравнение представляет собой амфотерный оксид плюс основание, что дает соль и воду. И когда они реагируют как база,
уравнение представляет собой амфотерный оксид плюс кислота, что дает соль и воду.
Мы видели минуту назад, что когда
кислота и основание реагируют, образуется соль и вода. Так как амфотерные оксиды могут
ведут себя как кислоты или основания, есть два общих уравнения, на которые следует обратить внимание. Когда эти оксиды ведут себя как
кислота, уравнение представляет собой амфотерный оксид плюс основание, что дает соль и воду. И когда они реагируют как база,
уравнение представляет собой амфотерный оксид плюс кислота, что дает соль и воду.
Давайте рассмотрим пример для
каждый. Оксид алюминия амфотерен. Не растворяется и не реагирует
с водой и может действовать как кислота или основание. Когда он реагирует с основанием, таким как
получают гидроксид натрия, алюминат натрия, соль и воду. Обратите внимание, что эта формула является
упрощение. Алюминий может образовывать довольно сложные
ионы в растворе. Формула здесь для натрия
алюминат на самом деле является формулой твердого безводного продукта. Но алюминат натрия в
присутствие воды хорошо растворяется, и поэтому будет реагировать с водой с образованием гидратированного
соединение со сложной формулой, которое мы здесь рассматривать не будем. Когда этот амфотерный оксид реагирует
с кислотой образуется соль хлорида алюминия. Эта двойственная природа амфотерных
оксидов указывается их название. Слово амфотерный происходит от
Греческое слово amphoteroi, означающее оба.
Но алюминат натрия в
присутствие воды хорошо растворяется, и поэтому будет реагировать с водой с образованием гидратированного
соединение со сложной формулой, которое мы здесь рассматривать не будем. Когда этот амфотерный оксид реагирует
с кислотой образуется соль хлорида алюминия. Эта двойственная природа амфотерных
оксидов указывается их название. Слово амфотерный происходит от
Греческое слово amphoteroi, означающее оба.
Перейдем к последнему типу
оксид, нейтральные оксиды. Нейтральные оксиды не проявляют кислотности
или основные свойства и не реагируют с кислотами или основаниями. Есть только несколько известных нейтральных
оксиды, и к ним относятся окись углерода, закись азота и окись азота. Опять же, нейтральные оксиды не
вступают в реакции с кислотами или основаниями. А теперь посмотрим конкретно
того, как основные оксиды реагируют с кислотами с образованием соли и воды, а также некоторые другие
примеры того, как амфотерные оксиды могут действовать как основания, реагировать с кислотами и давать
соль и вода. При взаимодействии оксида натрия с
соляная кислота, хлорид натрия и вода являются продуктами. Обратите внимание, что анион в кислоте
и катион в основном оксиде определяют, какая соль образуется.
При взаимодействии оксида натрия с
соляная кислота, хлорид натрия и вода являются продуктами. Обратите внимание, что анион в кислоте
и катион в основном оксиде определяют, какая соль образуется.
Можете ли вы угадать, в чем кислота?
это следующее уравнение? Оксид магния в основном
нерастворим в воде. Однако в разбавленных подогретых кислых
раствор, он может реагировать с образованием соли и воды, в данном случае нитрата магния
и вода. Катион магния в соли
продукт происходит из оксида, а NO3 или нитрат-ион должны были происходить из
кислота. Есть два нитрат-иона, которые
означает, что в кислоте должно быть два положительных заряда или два иона Н+. Объединяя эти ионы вместе, мы
получаем, мы получаем две HNO3, которая представляет собой кислую азотную кислоту. Ранее мы видели пример того, как
амфотерный оксид может действовать как основание и реагировать с кислотой. Давайте рассмотрим еще один пример.
Давайте рассмотрим еще один пример.
Реакция оксида цинка(II) с серная кислота дает соль сульфат цинка и воду. Опять катион в соли приходит из оксида, а анион в соли происходит из кислоты. До сих пор мы рассматривали типы оксидов, как они реагируют, и мы рассмотрели множество уравнений. Прежде чем мы сделаем практический пример, давайте сделаем что-то немного другое. Давайте проверим, насколько отличается элементы реагируют с кислородом с образованием оксидов и как это дает нам основное представление о ряды реактивности для элементов.
Некоторые элементы реагируют с кислородом
энергичнее других. Золото имеет низкую реакционную способность с
кислород. Мы говорим, что он инертен и не
реагировать. Серебро и ртуть очень медленные
и устойчивы к реакции с кислородом. К этому добавлено больше металлов.
перечислить в определенном порядке, и это основано на увеличении реакционной способности с кислородом, в
Другими словами, увеличение легкости, с которой эти элементы реагируют на увеличение
энергия. Элементы в крайнем правом углу
ряды легко и энергично реагируют с кислородом, требуя мало энергии для
вступают в эту реакцию, при этом металлический калий является наиболее энергичным, или, как мы говорим,
самый реактивный.
Элементы в крайнем правом углу
ряды легко и энергично реагируют с кислородом, требуя мало энергии для
вступают в эту реакцию, при этом металлический калий является наиболее энергичным, или, как мы говорим,
самый реактивный.
Важно знать, что все
эти металлы можно заставить реагировать с кислородом при правильных условиях, даже
золото. Но здесь речь идет об их
естественная реактивность. Чем активнее элемент,
тем более вероятно, что его можно найти в природе связанным с кислородом или другими элементами. Этот список здесь называется
ряд реактивности. Он показывает общую тенденцию или порядок
с которыми элементы реагируют с кислородом. Вы заметите только металлы, написанные
в этом ряду реактивности. Но неметаллы также могут реагировать с
кислород. Энергия, с которой водород
реагирует между железом и цинком. Рассмотрим более подробно
ряды удельной реакционной способности четырех неметаллов. Имейте в виду, однако, что эти
неметаллы могут быть помещены в высший ряд реактивности среди металлов,
по их относительной реакционной способности с кислородом.
Рассмотрим более подробно
ряды удельной реакционной способности четырех неметаллов. Имейте в виду, однако, что эти
неметаллы могут быть помещены в высший ряд реактивности среди металлов,
по их относительной реакционной способности с кислородом.
Известно много оксидов
хлор. Однако хлор не реагирует
кислородом воздуха и в нормальных условиях. Энергия необходима для того, чтобы вызвать
реакция. Из этих четырех неметаллов хлор
является наименее реактивным. Углерод тоже обычно не
самопроизвольно реагируют с кислородом. Подумайте о куске древесного угля на
барбекю. Предварительно его нужно нагреть до красна.
горячий. Тогда он будет реагировать и гореть с
кислорода в воздухе. Сера реагирует немного сильнее
энергично. Он загорится при нагревании
горелка Бунзена. Фосфор, однако, реагирует вполне
энергично и самовозгорается в кислороде воздуха. Фосфор является наиболее активным
в сторону кислорода от элементов этого ряда. Итак, из их реакции с кислородом
мы можем сделать вывод об увеличении реакционной способности от хлора к углероду, к сере, к
фосфор. Теперь пришло время взглянуть на
пример, прежде чем мы обобщим все, что мы узнали.
Фосфор является наиболее активным
в сторону кислорода от элементов этого ряда. Итак, из их реакции с кислородом
мы можем сделать вывод об увеличении реакционной способности от хлора к углероду, к сере, к
фосфор. Теперь пришло время взглянуть на
пример, прежде чем мы обобщим все, что мы узнали.
Для определения рН различных
оксидов был поставлен эксперимент. Три стакана были наполнены 0,5
литров деионизированной воды и несколько капель универсального индикатора. Шпатель следующего оксида
затем добавляли в каждый стакан. Какого цвета будет каждое решение
измениться после добавления оксида? (A) A: синий, B: зеленый и C:
красный. (B) A: зеленый, B: красный и C:
синий. (C) A: синий, B: красный и C:
зеленый. (D) A: красный, B: зеленый и C:
синий. Или (E) A: красный, B: синий и C:
зеленый.
Оксид представляет собой соединение, состоящее из кислорода, связанного с другим элементом. P2O10, который был добавлен в первую стакан, является оксидом неметалла, потому что он состоит из неметаллического фосфора, связанного к кислороду. MgO и Al2O3 являются примерами оксиды металлов, потому что Mg, магний, является металлом, а Al, алюминий, также является металл. И эти металлы связаны с кислород. В общем, когда оксид неметалла реагирует с водой, образуется кислота. Обычно это происходит, когда неметалл находится в группах с 14 по 17 таблицы Менделеева. Когда металл в оксиде металла из одной или двух групп периодической таблицы, например, магния и оксида реагирует с водой, обычно образуется раствор основания или щелочи.
Обратите внимание, однако, что есть
всегда исключения из правил. Например, оксид бериллия не
растворим в воде и не реагирует с водой при нормальных условиях. Другие оксиды металлов, содержащие
металлы, не входящие в первую или вторую группу периодической таблицы, например,
медь, цинк, свинец, алюминий и олово, если их поместить в воду, не
обычно реагируют и обычно нерастворимы. Теперь оксида магния тоже нет.
хорошо растворим в воде, но небольшие количества растворяются и реагируют с водой с образованием
производят основание или щелочной раствор.
Другие оксиды металлов, содержащие
металлы, не входящие в первую или вторую группу периодической таблицы, например,
медь, цинк, свинец, алюминий и олово, если их поместить в воду, не
обычно реагируют и обычно нерастворимы. Теперь оксида магния тоже нет.
хорошо растворим в воде, но небольшие количества растворяются и реагируют с водой с образованием
производят основание или щелочной раствор.
Нам сказали, что универсальный
В каждый химический стакан добавляли индикатор для определения рН. Универсальный индикатор красный в
сильнокислая область шкалы pH, затем оранжево-желтая, затем зеленая вокруг нейтральной
точка, затем синий, и на дальнем конце спектра в высокоосновной области он
фиолетовый. Мы видели, что когда неметалл
оксид реагирует с водой, в случае стакана А образуется кислота. Так индикатор
в стакане А станет красным. В стакане В в виде металла образуется основание или щелочь.
оксид вступает в реакцию с водой, поэтому индикатор окрасится в пурпурно-синий цвет. А в стакане С, когда металл
добавляется оксид, реакции не происходит.
В стакане В в виде металла образуется основание или щелочь.
оксид вступает в реакцию с водой, поэтому индикатор окрасится в пурпурно-синий цвет. А в стакане С, когда металл
добавляется оксид, реакции не происходит.
Оксид алюминия является примером амфотерный оксид. И опять же, это не обычно растворимы и обычно не реагируют с водой, хотя могут реагировать с кислотами и базы. Потому что нет реакции с воды, pH воды в этом стакане останется нейтральным, а индикатор появится зеленый. Таким образом, изменение цвета в каждом стакане из-за добавления оксида будет A: красный, B: синий и C: зеленый.
Подытожим, что имеем
научился. Оксид – это соединение, содержащее
кислород, связанный с другим элементом. При взаимодействии оксида неметалла с
воды образуется кислота. При взаимодействии оксида металла с
вода, получается основание. Когда помещают амфотерный оксид
в воде он не растворяется и не реагирует. А когда помещается нейтральный оксид
в воде тоже нет реакции. Это общие тенденции. При взаимодействии оксида неметалла с
основание, соль и вода производятся. Соль и вода также производятся
при взаимодействии оксида металла с кислотой. А для амфотерных оксидов, которые могут
реагируют с кислотой или основанием, потому что они действуют как кислоты или основания, снова соль и
вода — продукты.
Когда помещают амфотерный оксид
в воде он не растворяется и не реагирует. А когда помещается нейтральный оксид
в воде тоже нет реакции. Это общие тенденции. При взаимодействии оксида неметалла с
основание, соль и вода производятся. Соль и вода также производятся
при взаимодействии оксида металла с кислотой. А для амфотерных оксидов, которые могут
реагируют с кислотой или основанием, потому что они действуют как кислоты или основания, снова соль и
вода — продукты.
Что образуется при взаимодействии кислых оксидов с водой?A.ОснованиеB.КислотыC.СолиD.Ничего из перечисленного Какой класс веществ образуется при взаимодействии кислых оксидов с водой. Когда кислые оксиды реагируют с водой, рН раствора уменьшается.
Полный ответ:
Оксиды можно разделить на кислотные, основные и амфотерные.
Основные оксиды, также известные как основные ангидриды. Они в основном реагируют с водой с образованием основания и реагируют с кислотой с образованием солей.
Амфотерные оксиды представляют собой оксиды, которые могут действовать как кислотные, так и основные оксиды.
Кислотные оксиды — это другое название кислотного ангидрида. В основном это оксиды неметаллов или металлов в высоких степенях окисления. Кислые оксиды можно назвать кислотой Аррениуса, но не кислотой Бренстеда-Льюиса, поскольку они не могут отдавать протоны, но затем могут увеличивать концентрацию ионов водорода в воде.
Например,
Углекислый газ (${\text{C}}{{\text{O}}_{\text{2}}}$) реагирует с водой (${{\text{H}}_{ \text{2}}}{\text{O}}$) с образованием угольной кислоты (${{\text{H}}_{\text{2}}}{\text{C}}{{\text {O}}_{\text{3}}}$). Фермент под названием карбоангидраза, который используется в качестве катализатора, назван так из-за того, что в этой реакции только
${\text{C}}{{\text{O}}_{\text{2}}}{\text{ + }}{{\text{H}}_{\text{2}}} {\ text{O}} \to {\text{}}{{\text{H}}_{\text{2}}}{\text{C}}{{\text{O}}_{\ text{3}}}$
Точно так же триоксид хрома (${\text{Cr}}{{\text{O}}_3}$) реагирует с водой с образованием хромовой кислоты(${{\text{H}} _2}{\text{Cr}}{{\text{O}}_4}$).




 к. с кислотами не взаимодействует кислотный оксид CO2
к. с кислотами не взаимодействует кислотный оксид CO2
 к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)

Leave A Comment