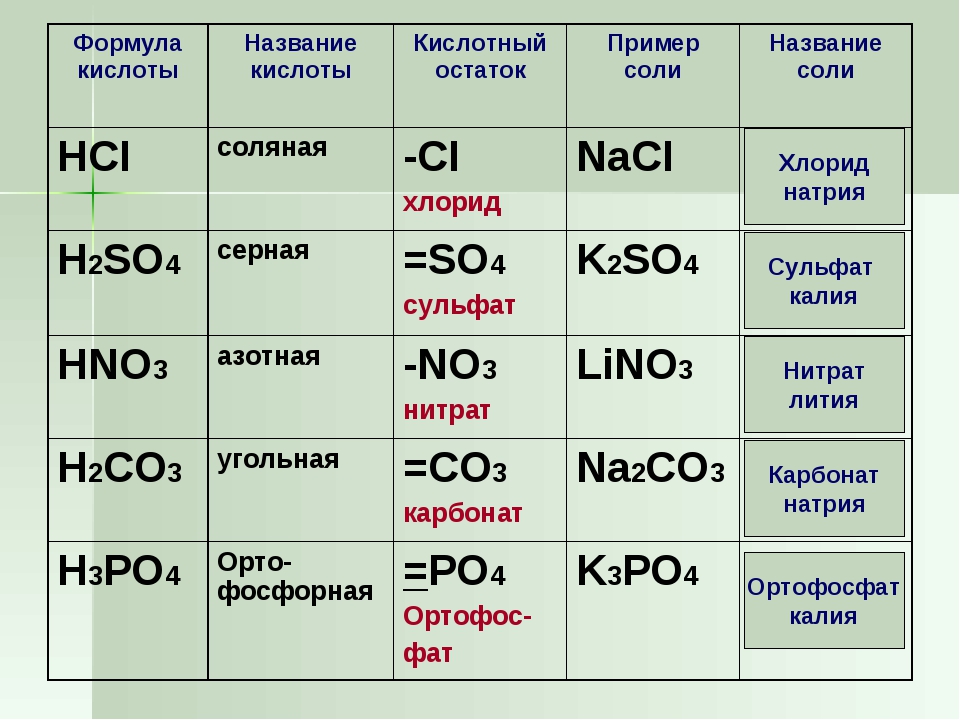
основанием и кислотой соответственно являются
Яка кількість речовини Гідрогену міститься в 2.8л амоніаку?(повний розв’язок)
Помогите 30 баллов срочно!!! Завершите схемы
ПОМОГИТЕ!!! 20 БАЛЛОВ!!!Перепишите схемы реакций в тетрадь и завершите их.
1)Какие электронные формулы соответствуют атомам галогенов?
1. …2s22p5 2. …2s22p6 3. …3d64s1 4. …3s23p5 5. …3s23p4
… A) 1,2,3 B) 1,2 C) только 1 D) 1,3,4,5 E) 1,4
2) Что верно для хлороводорода?
1. имеет резкий запах
3. хорошо растворяется в воде
5. при обычных условиях – жидкость 2. во влажном воздухе дымит
4. реагирует с аммиаком
3) Укажите верные высказывания. Среди галогеноводородов …
1. HСl – самый сильный восстановитель
2. HF – в растворе самая сильная кислота
3. HF – самая полярная молекула
4. HI – легче всех диссоциирует в растворе
5. HBr – очень устойчив и при нагревании не разлагается
4) Укажите верные высказывания. Среди ионов F–, Cl–, Br– и I– …
1. F –– самый слабый восстановитель
2.
Яка кількість речовини Гідрогену міститься в 2.8л амоніаку?(повний розв’язок)
у якій кількості молів кисню міститься скільки атомів Оксигену, скільки їх є в ортофосфатній кислоті h4PO4 кількістю речовини 4 моль?а)2 б)4 в)6 г)8 ( … з розв’язком, будь ласка)
Пж. Задачи по химии — Нужно на завтра 1. Дано: масса (р-ра) — 340 гр.; w (раствор. вещ) — 20%; w(2) (раствор. вещ.) — 40 % Найти: массу (h3O) и массу … (соли) 2. Дано: масса (р-ра) — 200гр.; w (раствор. вещ) — 10%; масса (раствор. вещ. *вода) — 10 гр.; масса (раствор. вещ. *соли) — 10 гр. Найти: w (раствор. вещ)
Записати хімічні властивості (хімічні реакції) та добування у промисловості та/або у лабораторії:
— алканів;
— алкенів та алкінів,
— спиртів та фенолі
… в;
— альдегідів та карбонових кислот;
— жирів;
— моно-та дисахаридів;
— амінів та амінокислот.
Записати хімічні властивості та добування у промисловості або у лабораторії: — алканів; — алкенів та алкінів, — спиртів та фенолів; — альдегідів та ка … рбонових кислот; — жирів; — моно-та дисахаридів; — амінів та амінокислот.
Ученикам были даны относительные молекулярные массы двух оксидовуглерода. Определи их формулы.Формулу вещества введи в формате: Н2О или H,SO4.Mr (X) = … 28, X-2 Mr (X) = 44, X-
Разработки тестов По теме «Простые и сложные вещества»
№5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
1. Вещества, формулы которых – Al(OH)3 и (NH4)3PO4, являются соответственно
1) основанием и кислотой
2) основанием и солью
3) амфотерным гидроксидом и солью
4) амфотерным гидроксидом и кислотой
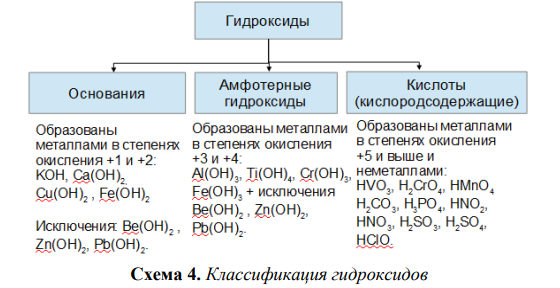
2.К нерастворимым в воде основаниям относится
1) NaOH
2) LiOH
3) Cu(OH)2
4) Ba(OH)2
3. Высшему оксиду неметалла и его высшему гидроксиду соответствуют:
Высшему оксиду неметалла и его высшему гидроксиду соответствуют:
1) оксид серы(IV) и сернистая кислота
2) оксид углерода(II) и угольная кислота
3) оксид азота(V) и азотная кислота
4) оксид хлора(VII) и хлороводородная кислота
4. Вещества, формулы которых – CO и Zn(OH)2, соответственно являются
1) кислотным оксидом и основанием
2) несолеобразующим оксидом и амфотерным гидроксидом
4) несолеобразующим оксидом и основанием
5. Кислотным оксидом является каждое из двух веществ
1) Mn2O7 и SO3
2) NO и Р2О5
3) СаО и SO2
4) ZnO и N2O5
6. К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
7. Одной и той же кислотой образована соль:
1) KCl и KClO3
2) Ba(NO2)2 и Ba(NO3)2
3) FeS и Fe2(SO4)3
4) Na2SO3 и NaHSO3
8. Кислотным является каждый из двух оксидов
Кислотным является каждый из двух оксидов
1) N2O и N2O5
2) CO2 и SO2
3) Al2O3 и SO3
4) CaO и BaO
9. Солью является каждое из двух веществ:
1) AgCl, Al(OH)3
2) NaCl, Al2(SO4)3
3) NaOH, MgCl2
4) Zn(NO3)2, HCl
10. Формулам NO2 и Cu(OH)2 соответствуют названия
1) оксид азота(II) и гидроксид меди(II)
2) оксид азота(II) и гидроксид меди(I)
3) оксид азота(IV) и гидроксид меди(II)
4) оксид азота(I) и гидроксид меди(I)
11. Оксиду серы(IV) и сернистой кислоте соответствуют формулы
1) SO3 и H2S
2) SO2 и H2SO3
3) SO3 и H2SO4
4) SO2 и H2SO4
12. Кислотному оксиду и кислоте соответствуют формулы
Кислотному оксиду и кислоте соответствуют формулы
1) SO2 и H2S
2) N2O и HNO3
3) CO2 и CH4
4) BeO и Be(OH)2
13. Формулой соли является
1) NaOH
2) Na2CO3
3) H2CO3
4) Na2O
14. К неметаллам относится каждое из двух веществ:
1) кальций и барий
2) азот и алюминий
3) фосфор и кремний
4) магний и сера
15. Об азоте как о простом веществе сказано в следующем предложении.
1) Растениям нужен азот для построения молекул белков.
2) Молекула аммиака состоит из атомов азота и водорода.
3) С минеральными удобрениями азот вносится в почву.
4) Азотом наполняют электролампы.
16. Кислотным оксидом является каждое из двух веществ:
1) SO3 и ZnO
3) P2O5 и MgO
4) Cl2O7 и SO2
17. Кислотным оксидом является
Кислотным оксидом является
1) оксид углерода(II)
2) оксид хлора(VII)
3) оксид алюминия
4) оксид калия
18. Кислотой является каждое из двух веществ:
1) HNO3; NaOH
2) H2CO3; H3PO4
3) Ba(OH)2; Al(OH)3
4) H2S; NaOH
19. Вещества, формулы которых Ba(OH)2 и Al2O3, являются соответственно
1) основанием и амфотерным оксидом
2) амфотерным гидроксидом и оснóвным оксидом
3) солью и основанием
4) солью и амфотерным оксидом
20. Оснόвному, амфотерному и кислотному оксидам соответствует ряд формул
1) Na2O – MgO – Al2O3
2) MgO – Al2O3 – SiO2
3) BeO – B2O3 – CO2
4) Li2O – Na2O – K2O
21. Кислотному оксиду и кислоте соответствуют формулы веществ
1) CO и NaНCO3
2) CO2 и H2CO3
3) CO и K2CO3
4) CO2
22. Гидроксиду алюминия соответствует химическая формула:
Гидроксиду алюминия соответствует химическая формула:
1) Al(NO3)3
2) Al2O3
3) AlCl3
4) Al(OН)3
23. Сульфидом натрия и оксидом хрома(III) соответственно являются
1) Na2S и Cr(OH)3
2) Na2SO4 и CrO3
3) Na2S и Cr2O3
4) Na2SO3 и Cr2O3
24. К оснóвным оксидам относится
1) оксид железа (II)
2) оксид серы (VI)
3) оксид углерода (IV)
4) оксид фосфора (V)
25. Только амфотерные оксиды представлены в ряду
1) ZnO, Al2O3
2) CaO, Fe2O3
3) Li2O, N2O
4) BeO, SO3
26. Кислотой является каждое из двух веществ:
1) NaОН и H2SO4
2) HCl и HNO3
3) H2S и H3N
4) NaCl и NaOH
27. Серной кислоте соответствует формула
Серной кислоте соответствует формула
1) H2S
2) H2SO3
3) H
4) SO3
28. Кислотному оксиду и кислоте соответствуют формулы веществ
1) Na2O и NaOH
2) N2O и NaNO3
3) NO и H3N
4) N2O5 и HNO3
29. Основному оксиду и кислоте соответствуют формулы
1) Al2O3 и NH3
2) MgO и H2S
3) Ca(OH)2 и HCl
4) NaOCl и H2SiO3
30. Только кислотные оксиды представлены в ряду
1) CaO, P2O5
2) Al2O3, N2O3
3) NO, NO2
4) SO2, SO3
31. Амфотерным оксиду и гидроксиду соответствуют формулы веществ
1) BeO и AlCl3
2) B2O3 и Zn(OH)2
3) Al2O3 и Fe(OH)3
4) ZnO и Ba(NO3)2
32. Фтор и бром являются соответственно
Фтор и бром являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
33. Кислотному и амфотерному оксидам соответствуют формулы
1) N2O и BaO
2) NO и B2O3
3) N2O5 и BeO
4) N2O3 и Br2O7
34. Вещества, формулы которых CuSO4 и HCl, являются соответственно
1) оснóвным оксидом и солью
2) солью и кислотой
3) основанием и кислотой
4) солью и основанием
35. Приведены формулы веществ: А – CuSO4; Б – CuO; В – Cu(OH)2. Среди них к солям относят
1) только А
2) А и В
3) только В
4) Б и В
36. Сернистой кислоте и оксиду азота(II) соответствуют формулы
1) H2SO4 и N2O4
2) H2SO3 и NO
3) H2S и NO2
4) (NH4)2S и N2O
37. Вещества, формулы которых СaCO3 и Na2SiO3, называются соответственно
Вещества, формулы которых СaCO3 и Na2SiO3, называются соответственно
1) карбонат кальция и силикат натрия
2) силикат кальция и карбонат натрия
3) карбонат калия и силикат натрия
4) силикат кальция и сульфат натрия
38. Только основные оксиды представлены в ряду
1) Na2O, MgO
2) Li2O, BeO
3) B2O3, Al2O3
4) CO, CuO
39. Основным является каждый из двух оксидов
1) MgO и Al2O3
2) CO2 и SO2
3) CO и NO
4) Na2O и CaO
40. К металлам относится каждое из двух веществ:
1) алюминий и бор
2) углерод и магний
3) фосфор и фтор
4) бериллий и кальций
41. К классу кислот относят каждое из двух веществ:
1) H2S и H2O
2) H2S и H2SiO3
3) NaOH и NH3
4) HCl и СH4
42. Сложным является каждое из двух веществ
Сложным является каждое из двух веществ
1) аммиак и серная кислота
2) медь и гидроксид натрия
3) сульфат бария и водород
4) вода и алмаз
43. Вещества, формулы которых Ca(NO3)2 и FeCl3, называются соответственно
1) нитрат кальция и хлорид железа(II)
2) нитрат кальция и хлорид железа(III)
3) нитрит кальция и хлорид железа(II)
4) нитрит кальция и хлорид железа(III)
44. Вещества, формулы которых – H3PO4 и SiO2, являются соответственно
1) солью и оснόвным оксидом
2) кислотой и кислотным оксидом
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным оксидом
45. К оснóвным оксидам относят каждое из двух веществ, формулы которых
1) FeO, BaO
2) K2O, Al2O3
3) MgO, NO
4) MnO2, CrO3
46. Вещества, формулы которых HCl и N2O5, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и амфотерным оксидом
3) кислотой и кислотным оксидом
4) солью и кислотой
47. Какая из формул соответствует оксиду азота (I)?
Какая из формул соответствует оксиду азота (I)?
1) NO2
2) NO
3) N2O3
4) N2O
48. К сложным веществам относится
1) медь
2) белый фосфор
3) аммиак
4) бром
49. Высшему оксиду и гидроксиду фосфора соответствуют формулы
1) P2O5 и H3P
2) P2O3 и H3PO3
3) P2O5 и H3PO4
4) P2O3 и H3PO4
50.Оксиду железа(III) соответствует формула
1) Fe3O4
2) Fe2O3
3) FeO
4) Fe(OH)3
51. Только основные оксиды расположены в ряду
1) СаO, ZnO, BaO
2) Na2O, CuO, SrO
3) CO2, K2O, NO
4) CrO3, K2O, CaO
52. Гидроксид бария и фосфат калия соответственно являются
1) основанием и средней солью
2) амфотерным гидроксидом и средней солью
3) оснόвным оксидом и кислотой
4) основанием и оснόвным оксидом
53. Вещества, формулы которыхCaO и NaHCO3, являются соответственно
Вещества, формулы которыхCaO и NaHCO3, являются соответственно
1) основным оксидом и кислотой
2) амфотерным оксидом и солью
3) основанием и кислотой
4) основным оксидом и солью
54. Амфотерному гидроксиду и cоли соответствуют формулы
1) Ca(OH)2 и NaHCO3
2) Mg(OH)2 и CuCl2
3) Al(OH)3 и Na3PO4
4) Zn(OH)2 и HNO3
55. О железе как о простом веществе говорится в следующем предложении.
1) В кожуре яблок содержится железо.
2) Для получения железа оксид железа(III) нагревают с углем.
3) Железо входит в состав хлорида железа(III).
4) При малокровии употребляют лекарства, содержащие железо.
56. Простым и сложным веществами соответственно являются
1) аммиак и гидроксид кальция
2) графит и ромбическая сера
3) красный фосфор и метан
4) сероводород и сода
57. К сложным веществам относится
К сложным веществам относится
1) иод
2) сода
3) воздух
4) графит
58. Формулы высшего оксида серы и соответствующей ему кислоты:
1) SO3, H2SO4
2) SO3, H2SO3
3) SO2, H2SO3
4) H2S, H2SO4
59. Оснόвному оксиду и основанию соответствуют формулы веществ
1) FeO и Fe(OH)2
2) Fe2O3 и Fe(OH)3
3) FeO и Fe(OH)3
4) Fe2O3 и Fe(OH)2
60. Кислотным оксидом является
1) SO2
2) CO
3) ZnO
4) Na2O
61. К кислотным оксидам относится
1) оксид натрия
2) оксид цинка
3) оксид углерода(II)
4) оксид серы(VI)
62. Даны вещества: вода, кислород и аммиак. Среди них к сложным веществам относится(-ятся):
1) только вода
2) только кислород
3) кислород и аммиак
4) вода и аммиак
63. Даны оксиды: А – оксид натрия, Б – оксид кальция, В – оксид цинка. Среди них к оснóвным оксидам относят
Даны оксиды: А – оксид натрия, Б – оксид кальция, В – оксид цинка. Среди них к оснóвным оксидам относят
1) только А
2) только Б
3) А и Б
4) А, Б и В
64. Простым и сложным веществами соответственно являются
1) угарный газ и медный купорос
2) озон и хлороводород
3) железо и кислород
4) вода и гипс
65. К кислотным оксидам относят каждое из двух веществ:
1) H2O и Al2O3
2) SO2 и P2O5
3) Na2O и Fe2O3
4) ZnO и N2O5
66. Какое из перечисленных веществ является простым?
1) аммиак
2) красный фосфор
3) азотная кислота
4) хлорид натрия
67. Кислотой и оснόвным оксидом соответственно являются
1) NH3 и CO2
2) H2SO4 и K2O
3) NH4Cl и N2O
4) HCl и Al2O3
68. Оснόвному и кислотному оксидам соответствуют формулы
Оснόвному и кислотному оксидам соответствуют формулы
1) CaO и CO
2) CaCl2 и H2SiO3
3) Ca(OH)2 и CO2
4) CaO и SiO2
69. Какое из перечисленных веществ является простым?
1) серная кислота
2) вода
3) водород
4) оксид бария
70. К оснoвным оксидам относится
1) ZnO
2) CrO3
3) BaO
4) SO3
71. Вещество, химическая формула которого Ca3(PO4)2, называется
1) фосфат кальция
2) гидроксид кальция
3) сульфат кальция
4) карбонат кальция
72. Кислоте и соли этой кислоты соответствуют формулы веществ
1) H2SiO3 и CaSiO3
2) HNO2 и Al(NO3)3
3) H2S и K2SO4
4) H3PO3 и Na3PO4
73. Кислоте и оснóвному оксиду соответствуют формулы
Кислоте и оснóвному оксиду соответствуют формулы
1) HClO и Nа2O
2) H2S и CO
3) H3Р и Al2O3
4) NH4Cl и BaO
74. Вещества, формулы которых – SiO2 и HNO3, являются соответственно
1) оснόвным оксидом и кислотой
2) амфотерным оксидом и кислотой
3) кислотным оксидом и кислотой
4) кислотным оксидом и солью
75. Какой из приведённых элементов образует оснóвный оксид?
1) натрий
2) углерод
3) алюминий
4) фосфор
76. Кислотному оксиду и кислоте соответствуют формулы
1) СО и СН4
2) P2O3 и H3P
3) SO2 и H2S
4) N2O и NH3
77. Амфотерным оксидом и кислотой соответственно являются
1) MgO и HCl
2) ZnO и HNO3
3) Al2O3 и KOH
4) SO2 и H2SO4
78. Оснóвным оксидом и основанием соответственно являются
Оснóвным оксидом и основанием соответственно являются
1) Al2O3 и HBr
2) CO и NaOH
3) MgO и Ca(OH)2
4) CaO и NaBr
79. Щёлочью является каждое из двух веществ
1) NaOH и Ba(OH)2
2) NH4OH и Cu(OH)2
3) LiOH и Al(OH)3
4) Be(OH)2 и Mg(OH)2
80. Простым и сложным веществами соответственно являются:
1) аммиак и метан
2) озон и вода
3) метан и сероводород
4) цинк и азот
81. Амфотерным гидроксидом является каждое из двух веществ.
1) Zn(OH)2 – Al(OH)3
2) Be(OH)2 – Ba(OH)2
3) LiOH – KOH
4) Cu(OH)2 – Fe(OH)3
82. Названия только сложных веществ записаны в ряду
1) аммиак, серная кислота
2) медь, гидроксид натрия
3) сульфат бария, водород
4) вода, алмаз
83. Формулы высшего оксида хлора и соответствующей ему кислоты:
Формулы высшего оксида хлора и соответствующей ему кислоты:
1) Cl2O, HClO
2) Cl2O7, HClO4
3) Cl2O7, HClO3
4) Cl2O3, HClO3
84. Вещества, формулы которых MgCl2 и CO2, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и кислотным оксидом
3) солью и кислотным оксидом
4) основанием и кислотой
85. Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
86. Амфотерным гидроксидом и кислотой соответственно являются
1) Mg(OH)2 и H2S
2) Ca(OH)2 и HCl
3) Fe(OH)2 и CO2
4) Al(OH)3 и H2SiO3
87. Вещества, формулы которых K2O и Fe2(SO4)3, называются соответственно
1) оксид кальция и сульфат железа(III)
2) оксид калия и сульфат железа(II)
3) оксид калия и сульфат железа(III)
4) гидроксид калия и сульфат железа(II)
88. Высшему кислотному оксиду и соли соответствуют формулы
Высшему кислотному оксиду и соли соответствуют формулы
1) Al2O3 и Ba(ОН)2
2) B2O3 и H3PO3
3) CO и MgS
4) Cl2O7 и NaCl
89. К классу солей относят каждое из двух веществ:
1) HNO3 и BaCl2
2) Na2SO4 и CuS
3) BaCl2 и CaO
4) NaOH и H2O
90. Одной и той же кислотой образована каждая из двух солей
1) NaNO2, NaNO3
2) K2CO3, KHCO3
3) BaSO3, BaSO4
4) CuS, CuSO4
91. Высшему оксиду и кислоте соответствуют формулы веществ
1) CO и H2CO3
2) CuO и Cu(OH)2
3) SO3 и H2SO4
4) N2O3 и HNO2
92. Высшему оксиду и гидроксиду неметалла соответствуют формулы
1) Cl2O5 и HClO3
2) SO3 и H2SO3
3) P2O5 и H3PO4
4) NO2 и HNO2
93. Вещества, формулы которых SO2 и Na2SO3, называются соответственно
Вещества, формулы которых SO2 и Na2SO3, называются соответственно
1) оксид серы(IV) и сульфит натрия
2) оксид серы(VI) и сульфат натрия
3) оксид серы(IV) и сульфид натрия
4) оксид серы(VI) и сульфит натрия
94. Кислотой и щелочью соответственно являются
1) HCl и Cu(OH)2
2) HNO3 и Ba(OH)2
3) NaCl и KOH
4) HBr и Zn(OH)2
95. Кислоте HClO4 соответствует оксид
1) Cl2O
2) Cl2O3
3) Cl2O7
4) ClO2
96. Гидроксиду бария соответствует формула
1) Ba(NO3)2
2) BaO
3) BaSO4
4) Ва(OН)2
97. Оксиду серы(VI) соответствует кислота
1) H2S
2) H2SO3
3) H2SO4
4) Na2SO4
98. Вещества, формулы которых – Al(OH)3 и SO3, являются соответственно
Вещества, формулы которых – Al(OH)3 и SO3, являются соответственно
1) основанием и оснόвным оксидом
2) солью и амфотерным оксидом
3) амфотерным гидроксидом и кислотным оксидом
4) основанием и кислотным оксидом
99. Вещество, химическая формула которого Fe2(SO4)3, имеет название
1) сульфат железа (III)
2) сульфит железа (III)
3) сульфат железа (II)
4) сульфит железа (II)
100. Кислотным оксидом является каждое из двух веществ:
1) SO2, P2O5
2) SO2, CO
3) BaO, CO2
4) P2O5, Al2O3
101. Оснoвным оксидом и кислотой, соответственно, являются
1) FeO, Ba(OН)2
2) K2O, (NH4)2S
3) MgO, H2SO4
4) SO2, HNO3
102. Вещества, формулы которых Al2S3 и Са(ОН)2, являются соответственно
Вещества, формулы которых Al2S3 и Са(ОН)2, являются соответственно
1) кислотой и основанием
2) солью и оснóвным оксидом
3) амфотерным гидроксидом и солью
4) солью и основанием
103. Какой кислоте соответствуют характеристики: трёхосновная, кислородсодержащая?
1) серной
2) соляной
3) кремниевой
4) ортофосфорной
104. Вещества, формулы которых СaO и KOH, являются соответственно
1) оснóвным оксидом и щёлочью
2) кислотным оксидом и щёлочью
3) амфотерным оксидом и кислотой
4) оснóвным оксидом и амфотерным гидроксидом
105. Кислотой является вещество, формула которого
1) H3РО4
2) NaOH
3) Na3РО4
4) H3N
106. Карбонат кальция и оксид калия являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
107. Кислотным оксидом является вещество, формула которого
Кислотным оксидом является вещество, формула которого
1) Na2O
2) Cl2O
3) Al2O3
4)CO
108. Только несолеобразующие оксиды представлены в ряду
1) FeO, Fe2O3
2) CO, CO2
3) N2O3, NO2
4) N2O, NO
109.Какой из приведённых элементов образует кислотный оксид?
1) литий
2) кремний
3) магний
4) кальций
110. Сложным является каждое из двух веществ:
1) нитрат калия и хлор
2) белый фосфор и озон
3) гидроксид калия и аргон
4) угарный газ и аммиак
111. Вещества, формулы которых – NH4NO3 и NaOH, являются соответственно
1) солью и основанием
2) кислотой и основанием
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным гидроксидом
112. К оснóвным оксидам относят каждое из двух веществ:
1) H2O и Al2O3
2) SO2 и P2O5
3) Na2O и CaO
4) ZnO и CuO
113. Кислотным оксидом и основанием соответственно являются
Кислотным оксидом и основанием соответственно являются
1) CO и Al(OH)3
2) SO2 и Mg(OH)2
3) CuO и NaOH
4) SiO2 и Fe(OH)3
114. Оснóвным оксидом является каждое из двух веществ:
1) Al2O3, K2O
2) CaO, Na2O
3) CO, BaO
4) NO2, Li2O
115. Щёлочью является каждое из двух веществ:
1) Al(OH)3 и Ca(OH)2
2) KOH и Ba(OH)2
3) Cu(OH)2 и K2SO4
4) NaOH и Na2O
116. Оксиду меди(I) и гидроксиду меди(I) соответствуют формулы
1) CuO и CuOH
2) CuO и Cu(OH)2
3) Cu2O и Cu(OH)2
4) Cu2O и CuOH
117. Фосфорной кислоте соответствует формула
1) PH3
2) Na3PO4
3) H3PO4
4) P2O5
118. Вещество, формула которого Cr2S3, имеет название
Вещество, формула которого Cr2S3, имеет название
1) сульфат хрома(II)
2) сульфит хрома(III)
3) сульфид хрома(II)
4) сульфид хрома(III)
119. Кислотным оксидом и основанием соответственно являются
1) SiO2 и Ва(OH)2
2) CaO и Cu(OH)2
3) CO2 и Аl(OH)3
4) NO2 и Fe(OH)3
120. К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
121. Амфотерным оксидом и кислотой соответственно являются
1) ZnO и H2S
2) BaO и H3N
3) P2O3 и HClO
4) BeO и NaOH
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических веществ.
Задание №5
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических веществ.
Основные классы неорганических веществ. Номенклатура неорганических веществ.
1. Кислотному оксиду и кислоте соответствуют формулы веществ
1) Na2O и NaOH
2) N2O и NaNO3
3) NO и h4N
4) N2O5 и HNO3
2. Кислотному оксиду и кислоте соответствуют формулы веществ
1) CO и NaНCO3
2) CO2 и h3CO3
3) CO и K2CO3
4) CO2 и h5C
3. Основному оксиду и основанию соответствуют формулы веществ
1) FeO и Fe(OH)2
2) Fe2O3 и Fe(OH)3
3) FeO и Fe(OH)3
4) Fe2O3 и Fe(OH)2
4. Кислотному и амфотерному оксидам соответствуют формулы
1) N2O и BaO
2) NO и B2O3
3) N2O5 и BeO
4) N2O3 и Br2O7
5. Основному и кислотному оксидам соответствуют формулы
1) CaO и CO
2) CaCl2 и h3SiO3
3) Ca(OH)2 и CO2
4) CaO и SiO2
6. Кислотному оксиду и кислоте соответствуют формулы
1) SO2 и h3S
2) N2O и HNO3
3) CO2 и Ch5
4) BeO и Be(OH)2
7. Вещества, формулы которых ZnO и Na2SO4, являются соответственно
Вещества, формулы которых ZnO и Na2SO4, являются соответственно
1) основным оксидом и кислотой
2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью
4) основным оксидом и основанием
8. Вещества, формулы которых CO и Zn(OH)2, соответственно являются
1) кислотным оксидом и основанием
2) несолеобразующим оксидом и амфотерным гидроксидом
3) кислотным оксидом и солью
4) несолеобразующим оксидом и основанием
9. Амфотерным оксидом и кислотой соответственно являются
1) ZnO и h3S
2) BaO и h4N
3) P2O3 и HClO
4) BeO и NaOH
10. Простым и сложным веществами соответственно являются
1) аммиак и гидроксид кальция
2) графит и ромбическая сера
3) красный фосфор и метан
4) сероводород и сода
11. Простым и сложным веществами соответственно являются
1) угарный газ и медный купорос
2) озон и хлороводород
3) железо и кислород
4) вода и гипс
12. Высшему оксиду и кислоте соответствуют формулы веществ
Высшему оксиду и кислоте соответствуют формулы веществ
1) CO и h3CO3
2) CuO и Cu(OH)2
3) SO3 и h3SO4
4) N2O3 и HNO2
13. Высшему оксиду и гидроксиду фосфора соответствуют формулы
1) P2O5 и h4P
2) P2O3 и h4PO3
3) P2O5 и h4PO4
4) P2O3 и h4PO4
14. Высшему кислотному оксиду и соли соответствуют формулы
1) Al2O3 и Ba(ОН)2
2) B2O3 и h4PO3
3) CO и MgS
4) Cl2O7 и NaCl
15. Амфотерным оксиду и гидроксиду соответствуют формулы веществ
1) BeO и AlCl3
2) B2O3 и Zn(OH)2
3) Al2O3 и Fe(OH)3
4) ZnO и Ba(NO3)2
16. Амфотерному гидроксиду и cоли соответствуют формулы
1) Ca(OH)2 и NaHCO3
2) Mg(OH)2 и CuCl2
3) Al(OH)3 и Na3PO4
4) Zn(OH)2 и HNO3
17. Вещества, формулы которых СaO и KOH, являются соответственно
1) оснóвным оксидом и щёлочью
2) кислотным оксидом и щёлочью
3) амфотерным оксидом и кислотой
4) оснóвным оксидом и амфотерным гидроксидом
18. Вещества, формулы которых Ca(NO3)2 и FeCl3, называются соответственно
Вещества, формулы которых Ca(NO3)2 и FeCl3, называются соответственно
1) нитрат кальция и хлорид железа(II)
2) нитрат кальция и хлорид железа(III)
3) нитрит кальция и хлорид железа(II)
4) нитрит кальция и хлорид железа(III)
19. Вещества, формулы которых MgCl2 и CO2, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и кислотным оксидом
3) солью и кислотным оксидом
4) основанием и кислотой
20. Фтор и бром являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
21. Вещества, формулы которых Ca3(PO4)2 и Na2O, являются соответственно
1) основанием и кислотным оксидом
2) солью и основанием
3) солью и оснóвным оксидом
4) кислотой и амфотерным оксидом
22. Вещества, формулы которых Ba(OH)2 и Al2O3, являются соответственно
1) основанием и амфотерным оксидом
2) амфотерным гидроксидом и оснóвным оксидом
3) солью и основанием
4) солью и амфотерным оксидом
23. Вещества, формулы которых K2O и Fe2(SO4)3, называются соответственно
Вещества, формулы которых K2O и Fe2(SO4)3, называются соответственно
1) оксид кальция и сульфат железа(III)
2) оксид калия и сульфат железа(II)
3) оксид калия и сульфат железа(III)
4) гидроксид калия и сульфат железа(II)
24. Какой из приведённых элементов образует кислотный оксид?
1) литий 2) кремний 3) магний 4) кальций
25. Вещества, формулы которых SO2 и Na2SO3, называются соответственно
1) оксид серы(IV) и сульфит натрия
2) оксид серы(VI) и сульфат натрия
3) оксид серы(IV) и сульфид натрия
4) оксид серы(VI) и сульфит натрия
26. Азот и аммиак являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
27. К кислотным оксидам относят каждое из двух веществ:
1) h3O и Al2O3
2) SO2 и P2O5
3) Na2O и Fe2O3
4) ZnO и N2O5
28. Вещества, формулы которых HCl и N2O5, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и амфотерным оксидом
3) кислотой и кислотным оксидом
4) солью и кислотой
29. Вещества, формулы которых СaCO3 и Na2SiO3, называются соответственно
Вещества, формулы которых СaCO3 и Na2SiO3, называются соответственно
1) карбонат кальция и силикат натрия
2) силикат кальция и карбонат натрия
3) карбонат калия и силикат натрия
4) силикат кальция и сульфат натрия
30. Вещества, формулы которых Al2S3 и Са(ОН)2, являются соответственно
1) амфотерным гидроксидом и солью
2) солью и оснóвным оксидом
3) кислотой и основанием
4) солью и основанием
31. Вещества, формулы которых Al(OH)3 и CO2, являются соответственно
1) основанием и амфотерным оксидом
2) амфотерным гидроксидом и оснóвным оксидом
3) основанием и кислотным оксидом
4) амфотерным гидроксидом и кислотным оксидом
32. Вещества, формулы которых CuSO4 и HCl, являются соответственно
1) оснóвным оксидом и солью
2) солью и кислотой
3) основанием и кислотой
4) солью и основанием
33. К оснóвным оксидам относят каждое из двух веществ :
1) h3O и Al2O3
2) SO2 и P2O5
3) Na2O и CaO
4) ZnO и CuO
34. Какой из приведённых элементов образует оснóвный оксид?
Какой из приведённых элементов образует оснóвный оксид?
- натрий 2) углерод 3) алюминий 4) фосфор
35. Карбонат кальция и оксид калия являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
36. Вещества, формулы которых BaO и HCl, являются соответственно
1) основным оксидом и солью
2) амфотерным оксидом и солью
3) кислотным оксидом и кислотой
4) основным оксидом и кислотой
37. Высшим является оксид, формула которого
1) CaO 2) NO2 3) P2O3 4) Cl2O
38. Даны вещества: вода, кислород и аммиак. Среди них к сложным веществам относится(-ятся):
1) только вода
2) только кислород
3) кислород и аммиак
4) вода и аммиак
39. Названия только простых веществ записаны в ряду:
1) алмаз, графит
2) углекислый газ, угарный газ
3) железо, аммиак
4) оксид магния, оксид серы(IV)
40. Солью кремниевой кислоты и щёлочью соответственно являются
Солью кремниевой кислоты и щёлочью соответственно являются
1) Na2SiO3 и Cа(OH)2
2) h3SiO3 и Cu(OH)2
3) SiO2 и Na2SO4
4) Na2SO3 и NaOH
41. Оксиду меди(I) и гидроксиду меди(I) соответствуют формулы
1) CuO и CuOH
2) CuO и Cu(OH)2
3) Cu2O и Cu(OH)2
4) Cu2O и CuOH
42. Гидроксид бария и фосфат калия соответственно являются
1) основанием и средней солью
2) амфотерным гидроксидом и средней солью
3) основным оксидом и кислотой
4) основанием и основным оксидом
43. Вещества, формулы которых Al(OH)3 и SO3, являются соответственно
1) основанием и основным оксидом
2) солью и амфотерным оксидом
3) амфотерным гидроксидом и кислотным оксидом
4) основанием и кислотным оксидом
44. Вещества, формулы которых SiO2 и HNO3, являются соответственно
1) основным оксидом и кислотой
2) амфотерным оксидом и кислотой
3) кислотным оксидом и кислотой
4) кислотным оксидом и солью
45. Вещества, формулы которых Nh5NO3 и NaOH, являются соответственно
Вещества, формулы которых Nh5NO3 и NaOH, являются соответственно
1) солью и основанием
2) кислотой и основанием
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным гидроксидом
46. Оснóвным оксидом является каждое из двух веществ:
1) Al2O3, K2O
2) CaO, Na2O
3) CO, BaO
4) NO2, Li2O
47 . Вещества, формулы которых Fe2O3 и FeCl2, являются соответственно
1) основным оксидом и основанием
2) амфотерным оксидом и солью
3) кислотой и амфотерным гидроксидом
4) амфотерным оксидом и кислотой
48. Кислотным оксидом и основанием соответственно являются
1) SiO2 и Ва(OH)2
2) CaO и Cu(OH)2
3) CO2 и Аl(OH)3
4) NO2 и Fe(OH)3
49. Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
1) только сера
2) только белый фосфор
3) белый фосфор и азотная кислота
4) сера и белый фосфор
50. Кислотой и основным оксидом соответственно являются
Кислотой и основным оксидом соответственно являются
1) Nh4 и CO2
2) h3SO4 и K2O
3) Nh5Cl и N2O
4) HCl и Al2O3
51. Вещества, формулы которых CaCO3 и Ca(OH)2, являются соответственно
1) солью и основным оксидом
2) амфотерным оксидом и основанием
3) кислотой и амфотерным гидроксидом
4) солью и основанием
52. Сульфидом натрия и оксидом хрома(III) соответственно являются
1) Na2S и Cr(OH)3
2) Na2SO4 и CrO3
3) Na2S и Cr2O3
4) Na2SO3 и Cr2O3
53. К сложным веществам относится
1) иод 2) сода 3) воздух 4) графит
54. Вещества, формулы которых h4PO4 и SiO2, являются соответственно
1) солью и оснвным оксидом
2) кислотой и кислотным оксидом
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным оксидом
55. Амфотерным гидроксидом и кислотой соответственно являются
1) Mg(OH)2 и h3S
2) Ca(OH)2 и HCl
3) Fe(OH)2 и CO2
4) Al(OH)3 и h3SiO3
56. Фосфорной кислоте соответствует формула
Фосфорной кислоте соответствует формула
1) Ph4
2) Na3PO4
3) h4PO4
4) P2O5
57. Оксиду железа(III) соответствует формула
1) Fe3O4
2) Fe2O3
3) FeO
4) Fe(OH)3
58. Вещество, формула которого Cr2S3, имеет название
1) сульфат хрома(II)
2) сульфит хрома(III)
3) сульфид хрома(II)
4) сульфид хрома(III)
59. Азотной кислоте и хлориду кальция соответствуют формулы
1) HNO3 и CaCO3
2) HNO3 и CaCl2
3) Nh4 и Ca(NO3)2
4) Nh4 и CaCl2
60. Формула сульфата натрия
2) Na2SO3
3) Na2SO4
4) Na2SiO3
61. Кислотным оксидом является
1) оксид углерода(II)
2) оксид хлора(VII)
3) оксид алюминия
4) оксид калия
62. К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
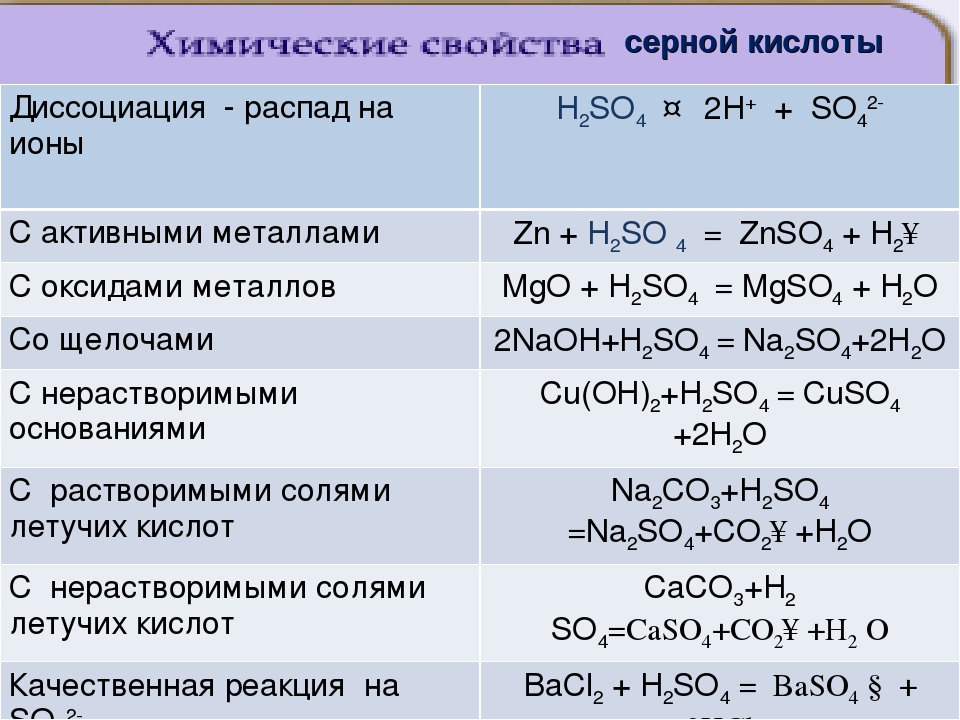
63. Серной кислоте соответствует формула
1) h3S 2) h3SO3 3) h3SO4 4) SO3
64. Кислотным оксидом является
Кислотным оксидом является
65. Какое из перечисленных веществ является простым?
1) хлорид натрия
2) вода
3) кислород
4) оксид кальция
66. Кислотным оксидом и кислотой соответственно являются
1) NO и h3SO4
2) ZnO и NaOH
3) CO2 и h4N
4) SO2 и HNO3
67. Какой кислоте соответствуют характеристики: трёхосновная, кислородсодержащая?
1) серной
2) соляной
3) кремниевой
4) Ортофосфорной
68. Названия только сложных веществ записаны в ряду
1) аммиак, серная кислота
2) медь, гидроксид натрия
3) сульфат бария, водород
4) вода, алмаз
69. К оснoвным оксидам относится
- ZnO 2) CrO3 3) BaO 4) SO3
70. Кислотным оксидом и основанием соответственно являются
1) CO и Al(OH)3
2) SO2 и Mg(OH)2
3) CuO и NaOH
4) SiO2 и Fe(OH)3
71. К сложным веществам относится
1) азот 2) вода 3) кислород 4) магний
72. Вещество, химическая формула которого Fe2(SO4)3, имеет название
Вещество, химическая формула которого Fe2(SO4)3, имеет название
1) сульфат железа (III)
2) сульфит железа (III)
3) сульфат железа (II)
4) сульфит железа (II)
73. Какое из перечисленных веществ является простым?
1) аммиак
2) красный фосфор
3) азотная кислота
4) хлорид натрия
74. Гидроксиду бария соответствует формула
1) Ba(NO3)2 2) BaO 3) BaSO4 4) Ва(OН)2
75. К оснóвным оксидам относится
1) оксид железа (II)
2) оксид серы (VI)
3) оксид углерода (IV)
4) оксид фосфора (V)
76. Амфотерным оксидом и солью являются соответственно
1) Al2O3 и MgCO3
2) ZnCl2 и Na2SO4
3) BaO и h3S
4) K2O и Zn(OH)2
77 . Формулой соли является
2) Na2CO3
3) h3CO3
4) Na2O
78. К кислотным оксидам относится
1) оксид натрия
2) оксид серебра
3) оксид меди (II)
4) оксид фосфора (V)
79. Сернистой кислоте и оксиду азота(II) соответствуют формулы
1) h3SO4 и N2O4
2) h3SO3 и NO
3) h3S и NO2
4) (Nh5)2S и N2O
80. Вещества, формулы которых CaO и NaHCO3, являются соответственно
Вещества, формулы которых CaO и NaHCO3, являются соответственно
1) основным оксидом и кислотой
2) амфотерным оксидом и солью
3) основанием и кислотой
4) основным оксидом и солью
81. Оснóвным оксидом и основанием соответственно являются
1) Al2O3 и HBr
2) CO и NaOH
3) MgO и Ca(OH)2
4) CaO и NaBr
82. Кислотным оксидом является каждое из двух веществ:
1) SO2 и P2O5
2) SO2 и CO
3) BaO и CO2
4) P2O5 и Al2O3
83. К кислотным оксидам относится
1) оксид натрия
2) оксид цинка
3) оксид углерода(II)
4) оксид серы(VI)
84. Приведены формулы веществ: А CuSO4 ; Б CuO ; В Cu(OH)2 . Среди них к солям
относят
- только А 2) А и В 3) только В 4) Б и В
85. Кислотой является каждое из двух веществ:
1) HNO3 и NaOH
2) h3CO3 и h4PO4
3) Ba(OH)2 и Al(OH)3
4) h3S и NaOH
86. К оснóвным оксидам относят каждое из двух веществ, формулы которых
1) FeO и BaO
2) K2O и Al2O3
3) MgO и NO
4) MnO2 и CrO3
87. Кислотному оксиду и кислоте соответствуют формулы
Кислотному оксиду и кислоте соответствуют формулы
1) СО и СН4
2) P2O3 и h4P
3) SO2 и h3S
4) N2O и Nh4
88. Кислотным оксидом является каждое из двух веществ:
1) SO3 и ZnO
2) CaO и CO
3) P2O5 и MgO
4) Cl2O7 и SO2
89. Основному оксиду и кислоте соответствуют формулы
1) Al2O3 и Nh4
2) MgO и h3S
3) Ca(OH)2 и HCl
4) NaOCl и h3SiO3
90. Вещество, химическая формула которого Ca3(PO4)2, называется
1) фосфат кальция
2) гидроксид кальция
3) сульфат кальция
4) карбонат кальция
91. Сложным является каждое из двух веществ
1) аммиак и серная кислота
2) медь и гидроксид натрия
3) сульфат бария и водород
4) вода и алмаз
92. Щёлочью является каждое из двух веществ:
1) Al(OH)3 и Ca(OH)2
2) KOH и Ba(OH)2
3) Cu(OH)2 и K2SO4
4) NaOH и Na2O
93. Кислотой является каждое из двух веществ:
1) NaОН и h3SO4
2) HCl и HNO3
3) h3S и h4N
4) NaCl и NaOH
94. Гидроксиду алюминия соответствует химическая формула:
Гидроксиду алюминия соответствует химическая формула:
1) Al(NO3)3
2) Al2O3
3) AlCl3
4) Al(OН)3
95. К сложным веществам относится
1) медь
2) белый фосфор
3) аммиак
4) бром
96. Сложным и простым веществами соответственно являются
1) метан и алмаз
2) озон и азот
3) серная кислота и аммиак
4) красный фосфор и цинк
97. Высшему оксиду неметалла и его высшему гидроксиду соответствуют формулы:
1) оксид серы(IV) и сернистая кислота
2) оксид углерода(II) и угольная кислота
3) оксид азота(V) и азотная кислота
4) оксид хлора(VII) и хлороводородная кислота
98. Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
99. Кислотой является вещество, формула которого
1) h4РО4 2) NaOH 3) Na3РО4 4) h4N
100. Оснoвным оксидом и кислотой, соответственно, являются
1) FeO, Ba(OН)2
2) K2O, (Nh5)2S
3) MgO, h3SO4
4) SO2, HNO3
101. Солью является каждое из двух веществ:
Солью является каждое из двух веществ:
1) AgCl и Al(OH)3
2) NaCl и Al2(SO4)3
3) NaOH и MgCl2
4) Zn(NO3)2 и HCl
102. Сложным является каждое из двух веществ:
1) нитрат калия и хлор
2) белый фосфор и озон
3) гидроксид калия и аргон
4) угарный газ и аммиак
103. К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
104. Простым и сложным веществами соответственно являются:
1) аммиак и метан
2) озон и вода
3) метан и сероводород
4) цинк и азот
105. Даны оксиды: А оксид натрия, Б оксид кальция, В оксид цинка. Среди них к оснóвным оксидам относят
- только А 2) только Б 3) А и Б 4) А, Б и В
106. Какое из перечисленных веществ является простым?
1) серная кислота
2) вода
3) водород
4) оксид бария
107. Оксиду серы(IV) и сернистой кислоте соответствуют формулы
1) SO3 и h3S
2) SO2 и h3SO3
3) SO3 и h3SO4
4) SO2 и h3SO4
108. К нерастворимым в воде основаниям относится
К нерастворимым в воде основаниям относится
1) NaOH 2) LiOH 3) Cu(OH)2 4) Ba(OH)2
109. Кислоте и оснóвному оксиду соответствуют формулы
1) HClO и Nа2O
2) h3S и CO
3) h4Р и Al2O3
4) Nh5Cl и BaO
110. Основным оксидом и кислотой соответственно являются
1) Na2O и h4N
2) ZnO и h3S
3) BaO и h3SiO3
4) Cl2O7 и NaHS
111. Только несолеобразующие оксиды представлены в ряду
1) FeO, Fe2O3
2) CO, CO2
3) N2O3, NO2
4) N2O, NO
112. Оксиду серы(VI) соответствует кислота
1) h3S
2) h3SO3
3) h3SO4
4) Na2SO4
113. Амфотерным гидроксидом является каждое из двух веществ.
1) Zn(OH)2 и Al(OH)3
2) Be(OH)2 и Ba(OH)2
3) LiOH и KOH
4) Cu(OH)2 и Fe(OH)3
114. Одной и той же кислотой образована каждая из двух солей
1) NaNO2, NaNO3
2) K2CO3, KHCO3
3) BaSO3, BaSO4
4) CuS, CuSO4
115. Амфотерным оксидом и кислотой соответственно являются
Амфотерным оксидом и кислотой соответственно являются
1) MgO и HCl
2) ZnO и HNO3
3) Al2O3 и KOH
4) SO2 и h3SO4
116. Кислоте HClO4 соответствует оксид
2) Cl2O3
3) Cl2O7
4) ClO2
117. Оксиду P2O3 соответствует кислота
1) Ph4
2) h4PO3
3) HPO3
4) h4PO4
118. Кислотным оксидом является каждое из двух веществ
1) Mn2O7 и SO3
2) NO и Р2О5
3) СаО и SO2
4) ZnO и N2O5
119. Формулы высшего оксида серы и соответствующей ему кислоты:
1) SO3, h3SO4
2) SO3, h3SO3
3) SO2, h3SO3
4) h3S, h3SO4
120. Формулы высшего оксида хлора и соответствующей ему кислоты:
1) Cl2O, HClO
2) Cl2O7, HClO4
3) Cl2O7, HClO3
4) Cl2O3, HClO3
121. Только амфотерные оксиды представлены в ряду
1) ZnO, Al2O3
2) CaO, Fe2O3
3) Li2O, N2O
4) BeO, SO3
122. Основным является каждый из двух оксидов
1) MgO и Al2O3
2) CO2 и SO2
3) CO и NO
4) Na2O и CaO
123. О железе как о простом веществе говорится в следующем предложении .
О железе как о простом веществе говорится в следующем предложении .
1) В кожуре яблок содержится железо.
2) Для получения железа оксид железа(III) нагревают с углем.
3) Железо входит в состав хлорида железа(III) .
4) При малокровии употребляют лекарства, содержащие железо.
124. Только основные оксиды расположены в ряду
1) СаO, ZnO, BaO
2) Na2O, CuO, SrO
3) CO2, K2O, NO
4) CrO3, K2O, CaO
125. Кислоте HClO4 соответствует оксид
2) Cl2O3
3) ClO2
4) Cl2O7
126. Кислотным является каждый из двух оксидов
1) N2O и N2O5
2) CO2 и SO2
3) Al2O3 и SO3
4) CaO и BaO
127. Кислотой и щелочью соответственно являются
1) HCl и Cu(OH)2
2) HNO3 и Ba(OH)2
3) NaCl и KOH
4) HBr и Zn(OH)2
128. Только основные оксиды представлены в ряду
1) Na2O, MgO
2) Li2O, BeO
3) B2O3, Al2O3
4) CO, CuO
129. Щёлочью является каждое из двух веществ
Щёлочью является каждое из двух веществ
1) NaOH и Ba(OH)2
2) Nh5OH и Cu(OH)2
3) LiOH и Al(OH)3
4) Be(OH)2 и Mg(OH)2
130. Только кислотные оксиды представлены в ряду
1) CaO, P2O5
2) Al2O3, N2O3
3) NO, NO2
4) SO2, SO3
131. Кислотному оксиду N2O5 соответствует кислота
1) HNO3
2) HNO2
3) Nh4
4) Nh5Cl
132. Одной и той же кислотой образована соль:
1) KCl и KClO3
2) Ba(NO2)2 и Ba(NO3)2
3) FeS и Fe2(SO4)3
4) Na2SO3 и NaHSO3
Тест по теме «Классы неорганических веществ» 1. Кислотным и основным оксидом являются соответственно: 1) SO2…
2) CO2 и Al2O3 , 3) Na2O и FeO , 4) ZnO и SO3 2. Кислотные свойства наиболее ярко выражены у вещества, формула которого: 1) Nh4 2) h3S 3) HCl 4) Sih5 3. Среди перечисленных веществ кислой солью является: 1) гидрид магния 2) гидрокарбонат натрия 3) гидроксид кальция 4) гидроксокарбонат меди(II) 4. Только кислотные оксиды расположены в ряду: 1) CO2, Mn2O7, SO3 2) Na2O, SiO2, Cr2O3 3) CrO, SO2, CaO 4) CuO, Al2O3, FeO 5. Кислотные свойства проявляет соединение: 1) Ph4, 2) Ch5, 3) h3S, 4) Nh4 6. Какие из приведенных утверждений верны: А) основным оксидам соответствуют основания; Б) основные оксиды образуют только металлы. 1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 7. Какое из соединений не является оксидом: 1) K2O, 2) Mn2O7, 3) h3O, 4) Na2O2 8. Исключите «лишнее» вещество: 1) K2CO3, 2) Al(OH)3, 3) MgOHCl, 4) Nh5HCO3 9. Формула высшего гидроксида хлора: 1) HCl, 2) HClO4, 3) HClO3, 4) HClO 10. Оксид железа (III): 1) не проявляет кислотно-основных свойств 2) проявляет кислотные свойства 3) проявляет основные свойства 4) проявляет амфотерные свойства 11. Формула гидроксида, соответствующего оксиду хрома (VI): 1) Cr(OH)3 2) Cr(OH)2 3) h3CrO4 4) h4[Cr(OH)6] 12. Основание и кислая соль представлены в группе: 1) Nh4, Nh5HCO3, 2) NaOH, (CuOH)2CO3, 3) h3S, NaHSO4 4) Al(OH)3, AlOHCl2 13.
Только кислотные оксиды расположены в ряду: 1) CO2, Mn2O7, SO3 2) Na2O, SiO2, Cr2O3 3) CrO, SO2, CaO 4) CuO, Al2O3, FeO 5. Кислотные свойства проявляет соединение: 1) Ph4, 2) Ch5, 3) h3S, 4) Nh4 6. Какие из приведенных утверждений верны: А) основным оксидам соответствуют основания; Б) основные оксиды образуют только металлы. 1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 7. Какое из соединений не является оксидом: 1) K2O, 2) Mn2O7, 3) h3O, 4) Na2O2 8. Исключите «лишнее» вещество: 1) K2CO3, 2) Al(OH)3, 3) MgOHCl, 4) Nh5HCO3 9. Формула высшего гидроксида хлора: 1) HCl, 2) HClO4, 3) HClO3, 4) HClO 10. Оксид железа (III): 1) не проявляет кислотно-основных свойств 2) проявляет кислотные свойства 3) проявляет основные свойства 4) проявляет амфотерные свойства 11. Формула гидроксида, соответствующего оксиду хрома (VI): 1) Cr(OH)3 2) Cr(OH)2 3) h3CrO4 4) h4[Cr(OH)6] 12. Основание и кислая соль представлены в группе: 1) Nh4, Nh5HCO3, 2) NaOH, (CuOH)2CO3, 3) h3S, NaHSO4 4) Al(OH)3, AlOHCl2 13. В каком из рядов расположены только солеобразующие оксиды: 1) CO2 , SO2 , N2O, SO3 2) CO, Cl2O7, P2O3, SO3 3) NO, As2O5 , Br2O5, SO3 4) CO2 , SO2 , P2O3, SeO3 14. Какое из перечисленных веществ относится к солям: 1) KCl, 2) h3 3) h3S 4) SO2 15. Кислотным и основным оксидом являются соответственно: 1) SO2 и MgO 2) CO2 и Al2O3 3) Na2O и FeO 4) ZnO и SO3 16. Верны ли суждения о щелочных металлах: А. Во всех соединениях они имеют степень окисления +1. Б.С галогенами они образуют соединения с ионной связью. 1) верно только А, 2) верно только Б 3) оба суждения верны 4) оба суждения не верны 17. Только окислительные свойства способен проявлять: 1) кислород 2) фтор 3) хлор 4) азот 18. Кислотным и основным оксидом являются соответственно: 1) SO3 и Al2O3 2) CO и Na2O 3) K2O и Fe2O3 4) CrO3 и BaO 19. Верны ли следующие суждения о меди: А. Для меди характерны степени окисления +1 и +2. Б. Медь вытесняет цинк из раствора сульфата цинка. 1) верно только А, 2) верно только Б 3) оба суждения верны 4) оба суждения не верны 20.
В каком из рядов расположены только солеобразующие оксиды: 1) CO2 , SO2 , N2O, SO3 2) CO, Cl2O7, P2O3, SO3 3) NO, As2O5 , Br2O5, SO3 4) CO2 , SO2 , P2O3, SeO3 14. Какое из перечисленных веществ относится к солям: 1) KCl, 2) h3 3) h3S 4) SO2 15. Кислотным и основным оксидом являются соответственно: 1) SO2 и MgO 2) CO2 и Al2O3 3) Na2O и FeO 4) ZnO и SO3 16. Верны ли суждения о щелочных металлах: А. Во всех соединениях они имеют степень окисления +1. Б.С галогенами они образуют соединения с ионной связью. 1) верно только А, 2) верно только Б 3) оба суждения верны 4) оба суждения не верны 17. Только окислительные свойства способен проявлять: 1) кислород 2) фтор 3) хлор 4) азот 18. Кислотным и основным оксидом являются соответственно: 1) SO3 и Al2O3 2) CO и Na2O 3) K2O и Fe2O3 4) CrO3 и BaO 19. Верны ли следующие суждения о меди: А. Для меди характерны степени окисления +1 и +2. Б. Медь вытесняет цинк из раствора сульфата цинка. 1) верно только А, 2) верно только Б 3) оба суждения верны 4) оба суждения не верны 20. Химические соединения: CaCO3, Ca(HCO3)2, Ch4COONa относятся к: 1) кислотам 2) основаниям 3) солям 3) оксидам 21. Амфотерным гидроксидом и кислотой соответственно являются: 1) h3SO4 и Zn(OH)Cl 2) Ca(OH)2 и Be(OH)2 3) KHSO4 и NaOH 4) Al(OH)3 и HNO3 22. В перечне веществ А) Al(OH)3 Б) HCl В) h3S Г) Ca(OCl)2∙ 4h3O Д) KOH Е) h3SO4 к гидроксидам относятся вещества, формулы которых обозначены буквами: 1) АГД 2) АГЕ 3) БВГ 4) АДЕ 23. В перечне веществ А) CO2 Б) Al2O3 В) Fe3O4 Г) CaO Д) Cl2O7 Е) CrO3 к кислотным оксидам относятся вещества, формулы которых обозначены буквами: 1) БВЕ 2) АДЕ 3) АГД 4) БВД 24. Верны ли следующие суждения о серной кислоте: А. Концентрированная серная кислота относится к водоотнимающим реагентам. Б. Разбавленная серная кислота растворяет медь, но не растворяет серебро. 1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 25. Верны ли следующие суждения о фосфоре: А. Фосфор горит на воздухе с образованием P2O5. Б. При взаимодействии фосфора с металлами образуются фосфиды.
Химические соединения: CaCO3, Ca(HCO3)2, Ch4COONa относятся к: 1) кислотам 2) основаниям 3) солям 3) оксидам 21. Амфотерным гидроксидом и кислотой соответственно являются: 1) h3SO4 и Zn(OH)Cl 2) Ca(OH)2 и Be(OH)2 3) KHSO4 и NaOH 4) Al(OH)3 и HNO3 22. В перечне веществ А) Al(OH)3 Б) HCl В) h3S Г) Ca(OCl)2∙ 4h3O Д) KOH Е) h3SO4 к гидроксидам относятся вещества, формулы которых обозначены буквами: 1) АГД 2) АГЕ 3) БВГ 4) АДЕ 23. В перечне веществ А) CO2 Б) Al2O3 В) Fe3O4 Г) CaO Д) Cl2O7 Е) CrO3 к кислотным оксидам относятся вещества, формулы которых обозначены буквами: 1) БВЕ 2) АДЕ 3) АГД 4) БВД 24. Верны ли следующие суждения о серной кислоте: А. Концентрированная серная кислота относится к водоотнимающим реагентам. Б. Разбавленная серная кислота растворяет медь, но не растворяет серебро. 1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 25. Верны ли следующие суждения о фосфоре: А. Фосфор горит на воздухе с образованием P2O5. Б. При взаимодействии фосфора с металлами образуются фосфиды. 1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны Часть В. Выберите несколько правильных ответов. 1. Продуктами разложения нитрата аммония являются: 1) N2 2) NO2 3) N2O 4) NO 5) h3O 2. Продуктами разложения HNO3 являются: 1) вода 2) водород 3) оксид азота(V) 4) оксид азота(IV) 5) кислород 3. Продуктами разложения нитрата свинца являются: 1) кислород 2) оксид свинца 3) нитрит свинца 4) оксид азота(II) 5) оксид азота(IV) 4. Укажите, какие из утверждений, касающихся аммиака, верные: 1) водный раствор аммиака является более сильным основанием, чем Ph4 2) аммиак при обычных условиях – жидкость 3) аммиак – сильный окислитель 4) аммиак образуется при действии щелочей на растворы солей аммония 5) аммиак является сильным восстановителем. 5. Укажите, какие из утверждений, касающихся воды, верные: 1) вода – полярный растворитель 2) молекула воды имеет линейную форму 3) вода – сильный электролит 4) вода реагирует со щелочными металлами 5) вода разлагается при пропускании через нее электрического тока.
1) верно только А; 2) верно только Б 3) верны оба суждения 4) оба суждения неверны Часть В. Выберите несколько правильных ответов. 1. Продуктами разложения нитрата аммония являются: 1) N2 2) NO2 3) N2O 4) NO 5) h3O 2. Продуктами разложения HNO3 являются: 1) вода 2) водород 3) оксид азота(V) 4) оксид азота(IV) 5) кислород 3. Продуктами разложения нитрата свинца являются: 1) кислород 2) оксид свинца 3) нитрит свинца 4) оксид азота(II) 5) оксид азота(IV) 4. Укажите, какие из утверждений, касающихся аммиака, верные: 1) водный раствор аммиака является более сильным основанием, чем Ph4 2) аммиак при обычных условиях – жидкость 3) аммиак – сильный окислитель 4) аммиак образуется при действии щелочей на растворы солей аммония 5) аммиак является сильным восстановителем. 5. Укажите, какие из утверждений, касающихся воды, верные: 1) вода – полярный растворитель 2) молекула воды имеет линейную форму 3) вода – сильный электролит 4) вода реагирует со щелочными металлами 5) вода разлагается при пропускании через нее электрического тока.
Основные классы неорганических веществ. Контрольная работа по химии 8 класс.
8 класс — Контрольная работа по теме «Основные классы неорганических соединений»
Вариант 1.
На вопросы 1-7 выберете один правильный ответ
На вопросы 8-9 выберете два правильных ответа
1. Вещества, формулы которых СaO и NaOH, являются соответственно
1) основным оксидом и щѐлочью
2) кислотным оксидом и щѐлочью
3) оксидом и кислотой
4) основным оксидом и нерастворимым основанием
2. Кислотным оксидом и кислотой соответственно являются
1) ZnO и H2S 3) P2O3 и HClO
2) BaO и H3N 4) BeO и NaOH
3. Вещества, формулы которых Ba(NO3)2 и FeCl3, называются соответственно:
Вещества, формулы которых Ba(NO3)2 и FeCl3, называются соответственно:
1) нитрат бария и хлорид железа(II)
2) нитрат бария и хлорид железа(III)
3) нитрит бария и хлорид железа(II)
4) нитрид бария и хлорид железа(III)
4. Оксид серы (VI) реагирует с:
1) кислородом 3) хлороводородом
2) оксидом кремния 4) гидроксидом кальция
5. В реакцию с раствором серной кислоты вступает:
6. В реакцию с гидроксидом меди (II) вступает
1) нитрат натрия 3) гидроксид алюминия
2) сульфат бария 4) соляная кислота
7. Раствор хлорида натрия реагирует с:
1) AgNO3 3) Ba(NO3)2
2) NaOH 4) MgSO4
8. Основными оксидами являются:
Основными оксидами являются:
1) Na2O2 2) Li2O 3) MgO 4) SO3 5) HCl
9. В реакцию с оксидом железа (II) вступают:
1) K2SO4 2) H2O 3) HNO3 4) HCl 5) Mg(OH)2
На вопросы 10-12 представьте развернутый ответ
10.Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
B + HClO3 + H2O → H3BO3 + HCl
11.Осуществите превращения, составьте уравнения химических реакций. Для второго превращения составить ионное уравнение.
Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → FeCl3
12.Гидроксид железа (II) массой 22,5 г растворили в азотной кислоте. Определите массу полученной соли.
Составитель: Маланина Е.
|
8 класс — Контрольная работа по теме «Основные классы неорганических соединений»
Вариант 2.
На вопросы 1-7 выберете один правильный ответ
На вопросы 8-9 выберете два правильных ответа
1. Вещества, формулы которых – Al2O3 и Na2SO4, являются соответственно
1) основным оксидом и кислотой
2) нерастворимым гидроксидом и солью
3) оксидом и солью
4) основным оксидом и основанием
2. Высшему кислотному оксиду и соли соответствуют формулы 1) Al2O3 и Ba(ОН)2 3) CO и MgS
2) B2O3 и H3PO3 4) Cl2O7 и NaCl
3. Формулам SO2 и Fe(OH)2 соответствуют названия
Формулам SO2 и Fe(OH)2 соответствуют названия
1) оксид серы (IV) и гидроксид железа (II)
2) оксид серы (VI) и гидроксид железа (II)
3) оксид серы (IV) и гидроксид железа (III)
4) оксид серы (VI) и гидроксид железа (III)
4. С водой реагирует каждый из двух оксидов:
1) K2O и SiO2 3) FeO и SiO2
2) Al2O3 и SO2 4) K2O и CO2
5. В реакцию с соляной кислотой вступает
|
1) хлорид калия |
3) нитрат серебра |
|
2) нитрат бария |
4) сульфат натрия |
6. Гидроксид калия взаимодействуют с:
Гидроксид калия взаимодействуют с:
|
1) CaO 2) Fe(NO3)2 3) Cu(OH)2
7. С раствором сульфата меди(II) реагирует |
4) NO |
|
1) серебро 2) оксид кальция 3) сера
8. Несолеобразующими оксидами являются |
4) магний |
|
1) N2O 2) CO 3) BaO 4) K2O |
5) N2O5 |
9. В реакцию с оксидом серы (IV) вступают
В реакцию с оксидом серы (IV) вступают
1) CO 2) HNO3 3) BaO 4) NaOH 5) P2O5
На вопросы 10-12 представьте свободный ответ
10.Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель. SO2 + Br2 + H2O → H2SO4 + HBr
11.Осуществите превращения, составьте уравнения химических реакций. Для последнего превращения составить ионное уравнение.
MgO ← Mg → MgCl2 → Mg(OH)2 → MgSO4
12.При взаимодействии серной кислоты с магнием выделилось 33,6 л водорода. Определите, какая масса магия прореагировала.
Определите, какая масса магия прореагировала.
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Неорганические вещества, их номенклатура, классификация.
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
Классификация неорганических веществ
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с. о. – 2
о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные – оксиды металлов в с.о. +1, +2
(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
Таблица 2
Характерные химические свойства солеобразующих оксидов
Гр. Свойства | Основные оксиды | Кислотные оксиды | Амфотерные оксиды |
Образуют соль и воду в реакции обмена при взаимодействии | с кислотами | с основаниями | и с кислотами, и с основаниями |
Образуют соль в реакции соединения при взаимодействии | с кислотными и амфотерными оксидами | с основными и амфотерными оксидами | с основными и кислотными оксидами |
Образуют растворимый гидроксид при взаимодействии с водой | щелочи | кислородсодержащие кислоты | не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
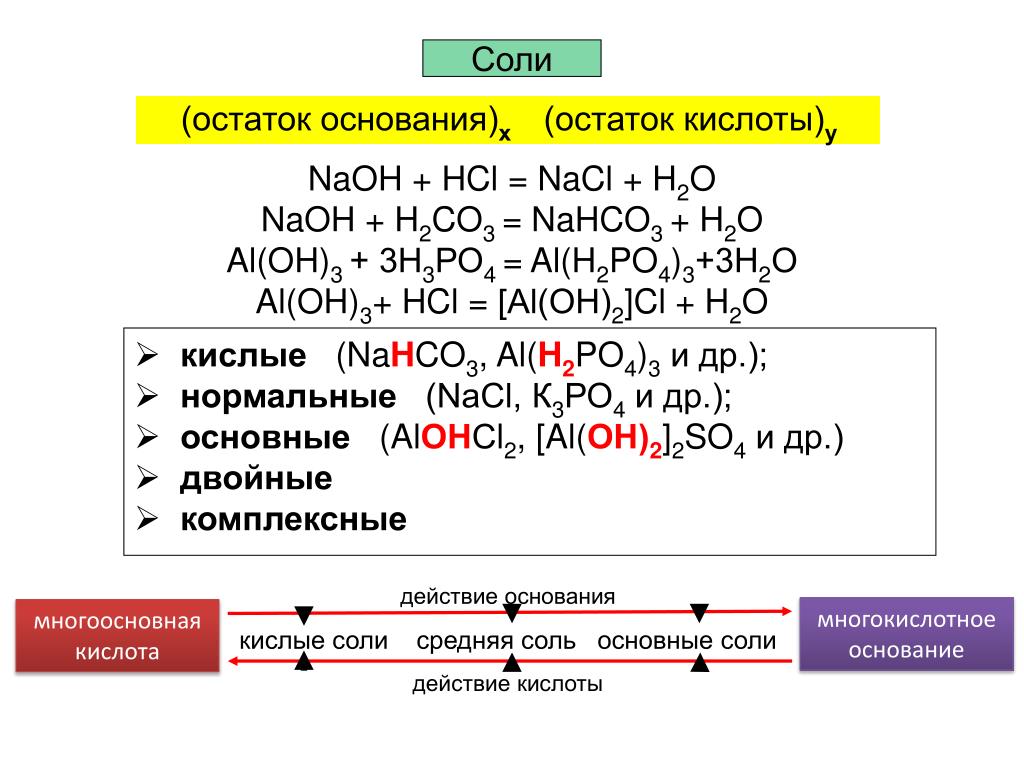
Соли
Соли (в свете атомно-молекулярного учения) – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с.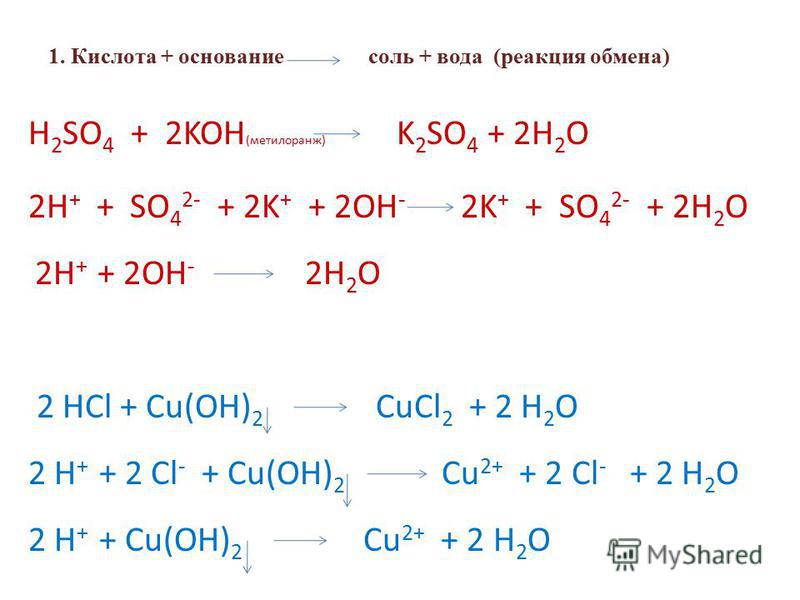 о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с.о. (как правило, оксид и гидроксид с низшей с.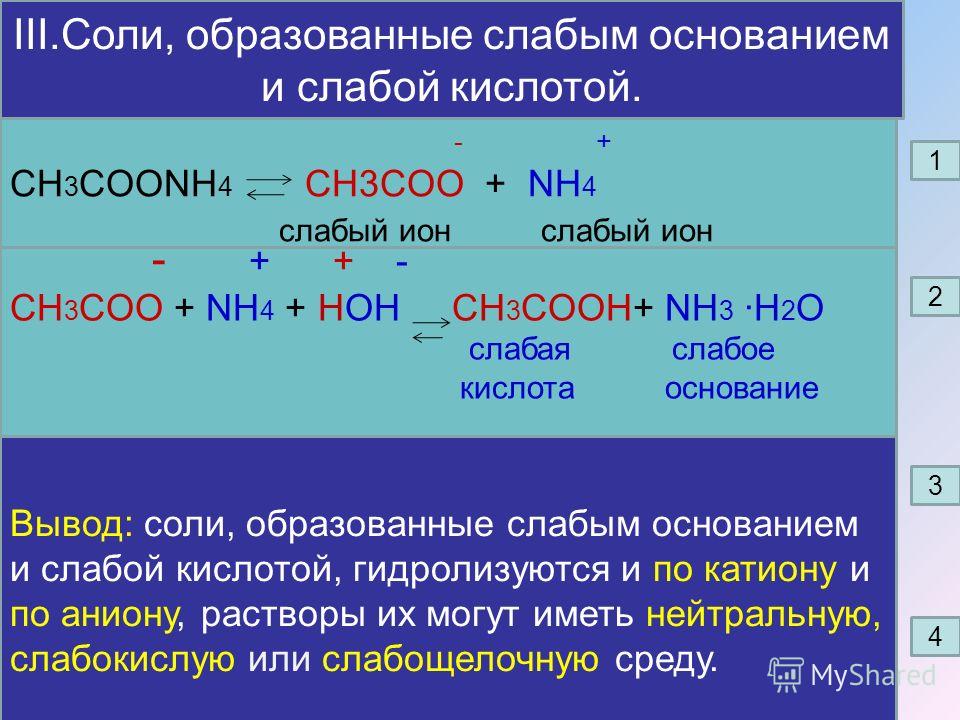 о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т.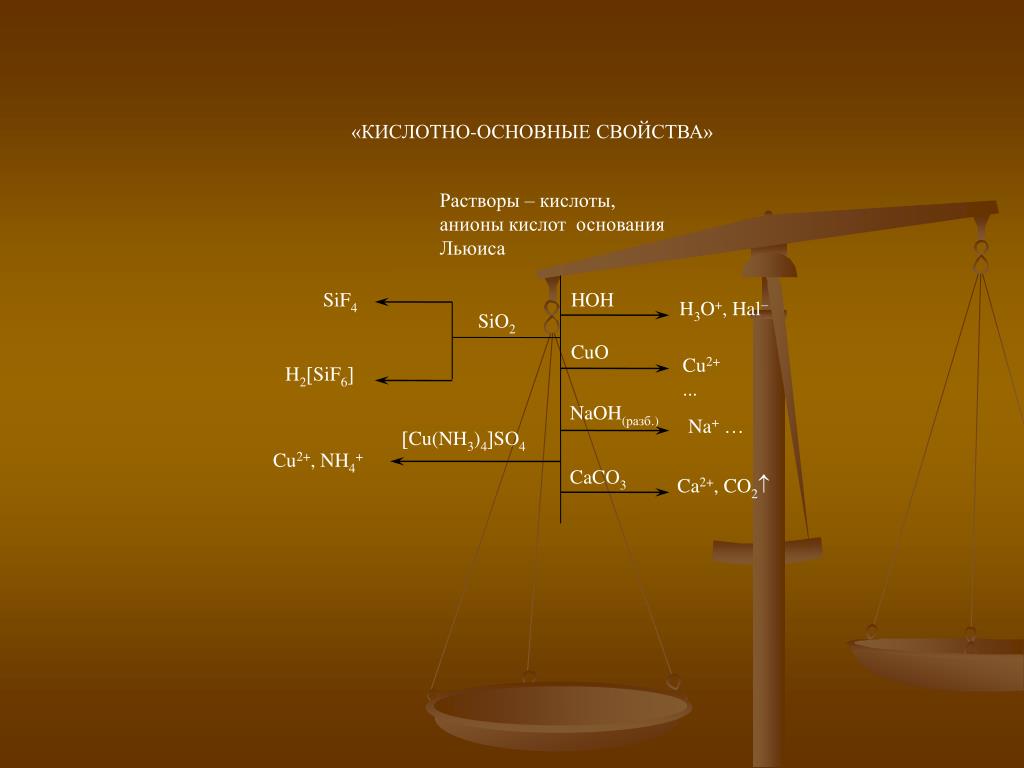 е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика.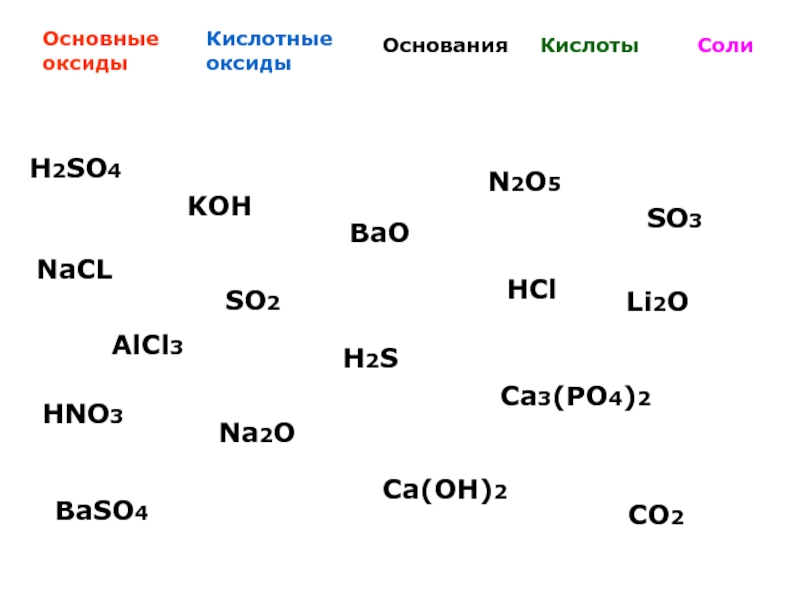 Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли. Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с. о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов.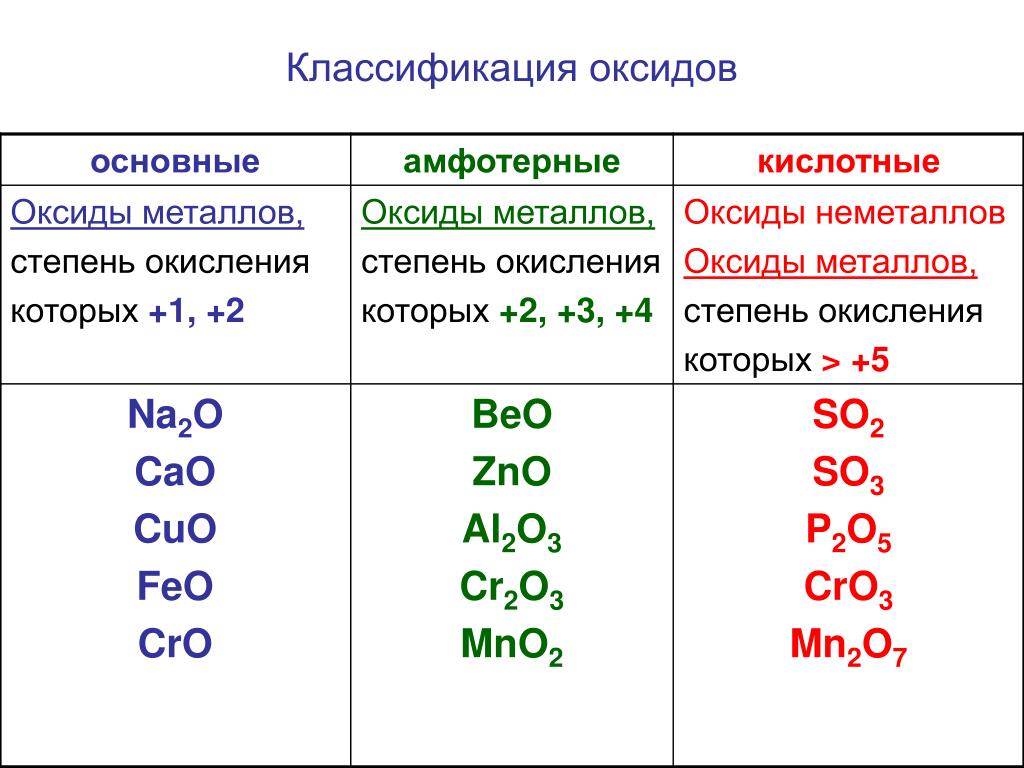 Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно. Ответ 1.
Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов. Ответ 3.
Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2. В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно. Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов. Для выпускников определение X2 представляет сложность, т. к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т. к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4.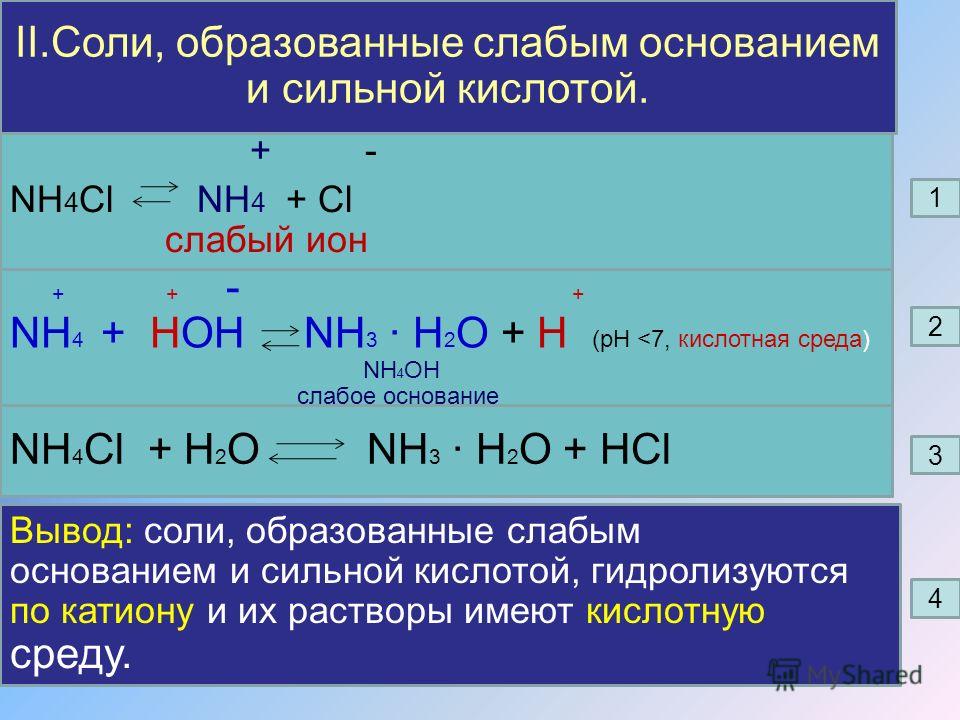 Содержит все три типа гидроксидов ряд веществ
Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10.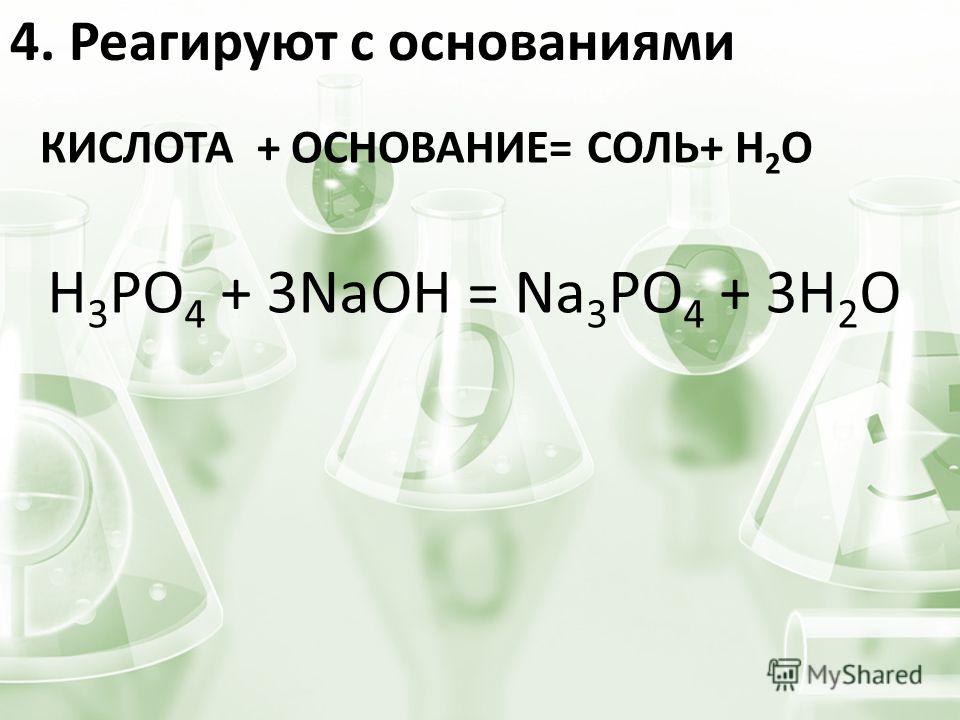 Оксиду марганца (VII) соответствует гидроксид, формула которого
Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24.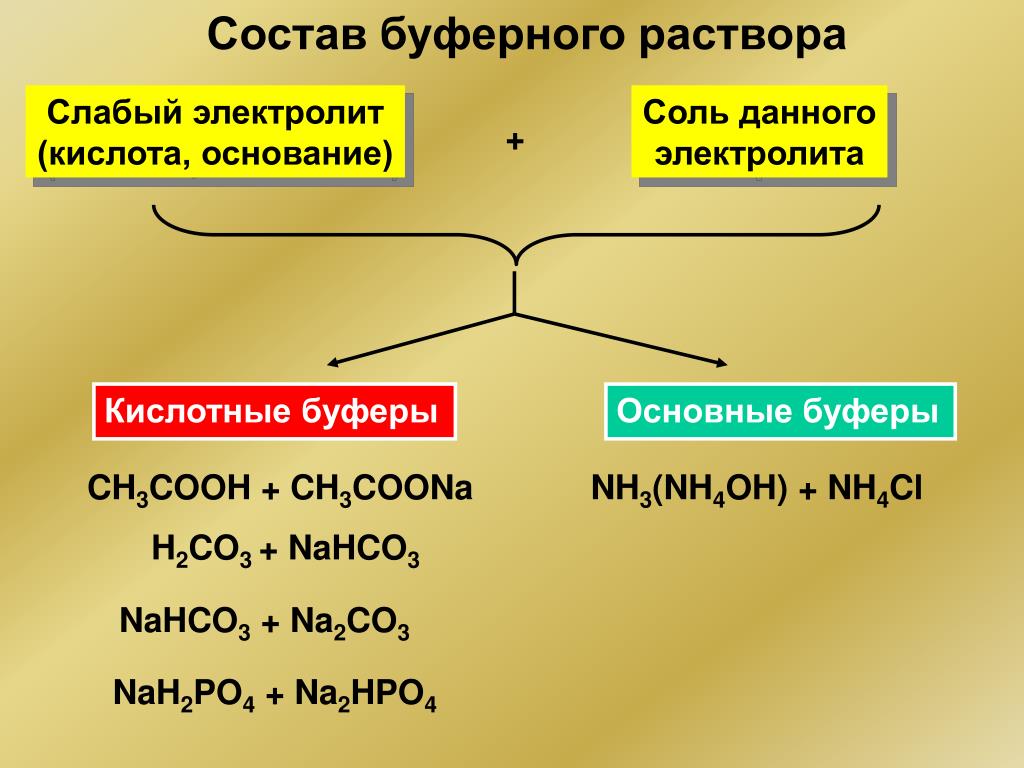 В цепочке превращений
В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15288 просмотров.
Комментарии
Тест на химические свойства оснований и амфотерных гидроксидов.
Задание №1
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)3
Задание №2
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4.
 Fe(OH)3
Fe(OH)3 - 5. Fe(OH)2
Задание №3
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Zn(OH)2
- 2. RbOH
- 3. CsOH
- 4. Sr(OH)2
- 5. KOH
Задание №4
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Mg(OH)2
- 2. Be(OH)2
- 3. Cu(OH)2
- 4. Pb(OH)2
- 5. Sr(OH)2
Задание №5
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. CrO2(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Ca(OH)2
Задание №6
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
Число верных ответов может быть любым.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №7
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
Задание №8
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. RbOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №9
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5.
 Zn(OH)2
Zn(OH)2
Задание №10
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Ba(OH)2
- 5. Al(OH)3
Задание №11
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Zn(OH)2
- 2. Ba(OH)2
- 3. Mn(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №12
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Fe(OH)2
- 3. Ba(OH)2
- 4. Mg(OH)2
- 5. Sr(OH)2
Задание №13
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1.
 KOH
KOH - 2. Cr(OH)2
- 3. Ba(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)3
Задание №14
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. Sr(OH)2
- 2. Ba(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №15
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1. RbOH
- 2. Ba(OH)2
- 3. CsOH
- 4. Sr(OH)2
- 5. Zn(OH)2
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn(OH)2 = ZnO + H2O
Задание №16
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1.
 CsOH
CsOH - 2. Ba(OH)2
- 3. KOH
- 4. Sr(OH)2
- 5. Al(OH)3
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al(OH)3 = Al2O3 + 3H2O
Задание №17
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид лития.
1) нитрат свинца
2) бромид калия
3) фосфат натрия
4) хлорид натрия
5) йодид рубидия
РешениеЗадание №18
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид натрия.
1) фторид калия
2) сульфат цинка
3) нитрат аммония
4) сульфат бария
5) хлорид серебра
РешениеЗадание №19
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид кальция.
1) карбонат цезия
2) нитрат бария
3) бромид натрия
4) сульфат аммония
5) йодид свинца
РешениеЗадание №20
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид бария.
1) хлорид аммония
2) карбонат калия
3) сульфат стронция
4) нитрат калия
5) бромид лития
РешениеЗадание №21
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид цезия.
1) нитрат железа(II)
2) хлорид рубидия
3) карбонат калия
4) карбонат аммония
5) нитрат натрия
РешениеЗадание №22
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид рубидия.
1) нитрат калия
2) нитрат бария
3) нитрат магния
4) нитрат аммония
5) нитрат свинца
РешениеЗадание №23
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид стронция.
1) сульфат натрия
2) фосфат калия
3) фторид натрия
4) хлорид натрия
5) йодид цезия
РешениеЗадание №24
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид натрия.
1) бромид аммония
2) фторид кальция
3) нитрат аммония
4) силикат цинка
5) хлорид магния
РешениеЗадание №25
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид бария.
1) сульфат меди
2) карбонат свинца
3) сульфат аммония
4) карбонат натрия
5) сульфат стронция
РешениеЗадание №26
Из приведенного списка солей выберите две такие, с которыми не будет взаимодействовать гидроксид калия.
1) силикат натрия
2) сульфид железа(II)
3) сульфид аммония
4) нитрат свинца
5) нитрат цинка
РешениеЗадание №27
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с углекислым газом.
1) едкий натр
2) гидроксид железа(III)
3) гидроксид алюминия(III)
4) гашеная известь
5) гидроксид хрома(III)
РешениеЗадание №28
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом натрия.
1) гидроксид лития
2) едкое кали
3) гидроксид алюминия
4) гидроксид стронция
5) гидроксид цинка
РешениеЗадание №29
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом алюминия.
1) гидроксид цезия
2) гидроксид бериллия
3) гидроксид свинца
4) гидроксид бария
5) гидроксид цинка
РешениеЗадание №30
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с оксидом кремния.
1) гидроксид железа (II)
2) гидроксид рубидия
3) едкий натр
4) гидроксид хрома(III)
5) гашеная известь
РешениеЗадание №31
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кальция.
1) гидроксид хрома(II)
2) гидроксид хрома(III)
3) гидроксид железа(II)
4) гидроксид железа(III)
5) гидроксид натрия
РешениеЗадание №32
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом цинка.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Mn(OH)2
- 5. Cu(OH)2
Задание №33
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом углерода (IV).
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Fe(OH)3
Задание №34
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом бария.
- 1. Ba(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Mn(OH)2
- 5. Cr(OH)3
Задание №35
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом хрома(III).
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №36
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кремния.
- 1. Ca(OH)2
- 2. Cr(OH)2
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Cu(OH)2
Задание №37
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с едким кали.
- 1. Pb(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №38
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с едким натром.
- 1. Cr(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Be(OH)2
Задание №39
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гашеной известью.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Cu(OH)2
- 5.
 Fe(OH)2
Fe(OH)2
Задание №40
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом стронция.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)2
Задание №41
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом рубидия.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)3
- 5. Sr(OH)2
Задание №42
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом алюминия.
- 1. Mn(OH)2
- 2. Be(OH)2
- 3. Ca(OH)2
- 4. Ba(OH)2
- 5. Sr(OH)2
Задание №43
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом цинка.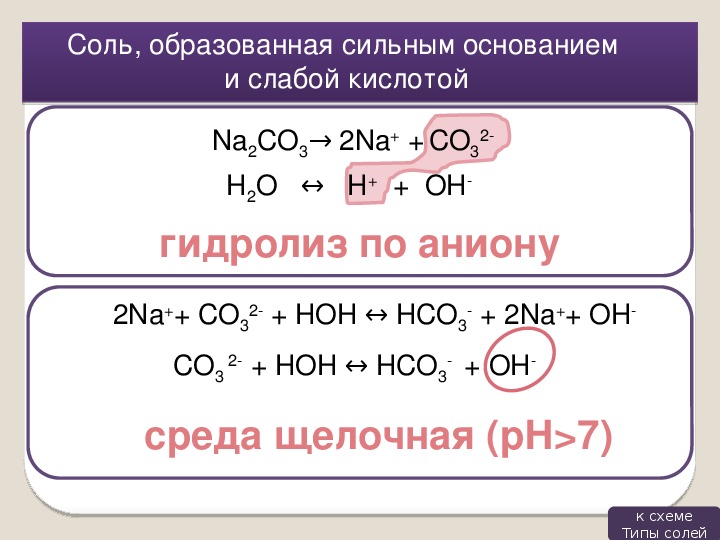
- 1. Zn(OH)2
- 2. Be(OH)2
- 3. CsOH
- 4. Pb(OH)2
- 5. KOH
Задание №44
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом хрома(III).
- 1. Fe(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №45
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом железа(III).
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №46
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом свинца.
- 1. Cr(OH)2
- 2. Ca(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5.
 LiOH
LiOH
Задание №47
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №48
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с сернистой кислотой.
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №49
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Al(OH)3
Задание №50
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с сероводородной кислотой.
- 1. NaOH
- 2. Al(OH)3
- 3. Ba(OH)2
- 4. Cr(OH)3
- 5. Sr(OH)2
Задание №51
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремнием.
- 1. Sr(OH)2
- 2. Be(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №52
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с серой.
- 1. NaOH
- 2. Mn(OH)2
- 3. RbOH
- 4. Cr(OH)3
- 5. Ca(OH)2
Задание №53
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремнием.
- 1. RbOH
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Zn(OH)2
Задание №54
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с фосфором.
- 1. Mg(OH)2
- 2. Ba(OH)2
- 3. Cu(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №55
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с фосфором.
- 1. Ca(OH)2
- 2. Cu(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Задание №56
Из приведенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1. Cr + NaOH
- 2. Si + CsOH
- 3. Fe + NaOH
- 4. I2 + Ba(OH)2
- 5. C + KOH
Задание №57
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с йодом.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Fe(OH)3
- 5. CsOH
Задание №58
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1.
 Al + Zn(OH)2
Al + Zn(OH)2 - 2. Cl2 + Al(OH)3
- 3. P + NaOH
- 4. S + Ba(OH)2
- 5. Br2 + Cu(OH)2
Задание №59
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида бария:
- 1. H2
- 2. Cl2
- 3. N2
- 4. O2
- 5. I2
Задание №60
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида калия:
- 1. Al
- 2. Cu
- 3. P
- 4. Cr
- 5. C
Задание №61
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида натрия:
- 1. Fe
- 2. Cu
- 3. S
- 4.
 C
C - 5. Zn
Задание №62
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Cu + NaOH
- 2. Cl2 + Cu(OH)2
- 3. C + KOH
- 4. Si + Ba(OH)2
- 5. Zn + Sr(OH)2
Задание №63
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Al + Fe(OH)2
- 2. I2 + RbOH
- 3. Cr + NaOH
- 4. N2 + KOH
- 5. P + CsOH
Задание №64
Из приведенного списка гидроксидов выберите такой, который взаимодействует с цинком.
- 1. NaOH
- 2. Fe(OH)2
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
В поле ответа введите уравнение реакции водного раствора данного гидроксида с цинком. В качестве разделителя левой и правой частей используйте знак равенства (=).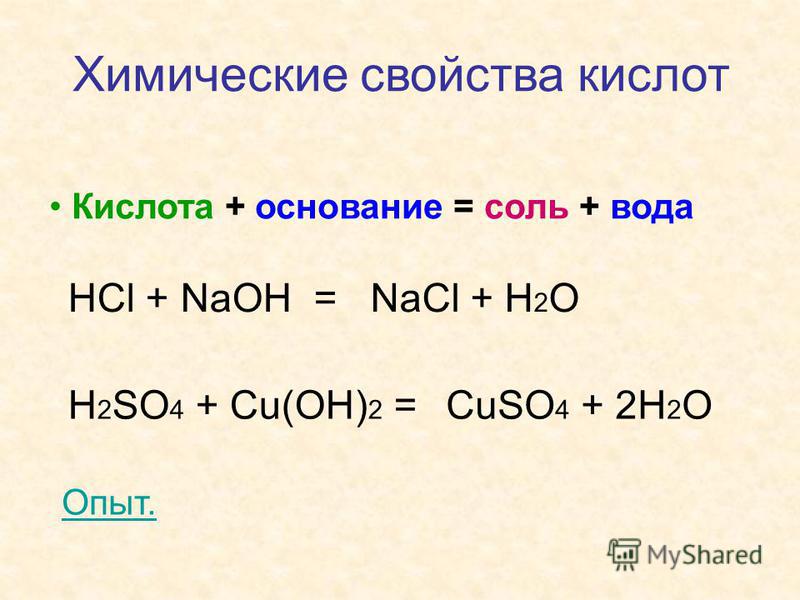
Ответ: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Задание №65
Установите соответствие между формулой/названием гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид цинка Б) едкий натр В) гидроксид хрома(III) | 1) алюминий, хлор, серная кислота 2) гидроксид цезия, соляная кислота, оксид натрия 3) вода, кислород, сера 4) азотная кислота, оксид серы(VI), вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №66
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) KOH Б) Al(OH)3 В) Ba(OH)2 | 1) Na2CO3, Br2, H2O 2) HNO3, P, HI 3) NaOH, HBr, K2O 4) HNO3, Fe(OH)2, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №67
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид меди Б) гашеная известь В) гидроксид цинка | 1) сульфат бария, нитрат аммония, карбонат свинца 2) серная кислота, сера, хлорид натрия 3) вода, кислород, кремний 4) азотная кислота, соляная кислота, оксид серы(VI) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №68
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) LiOH Б) Al(OH)3 В) Fe(OH)3 | 1) фторид натрия, бром, кремний 2) гидроксид натрия, гашеная известь, вода 3) оксид бария, гидроксид калия, серная кислота 4) цинк, фосфор, нитрат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №69
Цинк сплавили со гидроксидом натрия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn + 2NaOH = Na2ZnO2 + H2
Задание №70
Хлор пропустили через холодный раствор гидроксида калия. В случае если реакция протекает запишите ее уравнение. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: Cl2 + 2KOH = KClO + KCl + H2O
Задание №71
Серу подвергли совместному нагреванию с избытком концентрированного водного раствора гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №72
Кремний растворили в водном растворе гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
Ответ: Si + 2NaOH + H2O = 2H2 + Na2SiO3
Задание №73
Алюминий растворили при нагревании в растворе гидроксида рубидия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al + 2RbOH + 6H2O = 2Rb[Al(OH)4] + 3H2
Задание №74
Хлор пропустили через горячий раствор гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Задание №75
Через известковую воду пропустили углекислый газ в результате чего наблюдали ее помутнение. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: Ca(OH)2 + CO2 = CaCO3 + H2O
Задание №76
Через известковую воду пропустили некоторое количество углекислого газа, в результате чего был получен прозрачный раствор. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ca(OH)2 + 2CO2 = Ca(HCO3)2
Задание №77
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Сульфат калия + гидроксид бария
РешениеОтвет: K2SO4 + Ba(OH)2 = BaSO4 + 2KOH
Задание №78
Определите, протекает ли между данными веществами обменная реакция.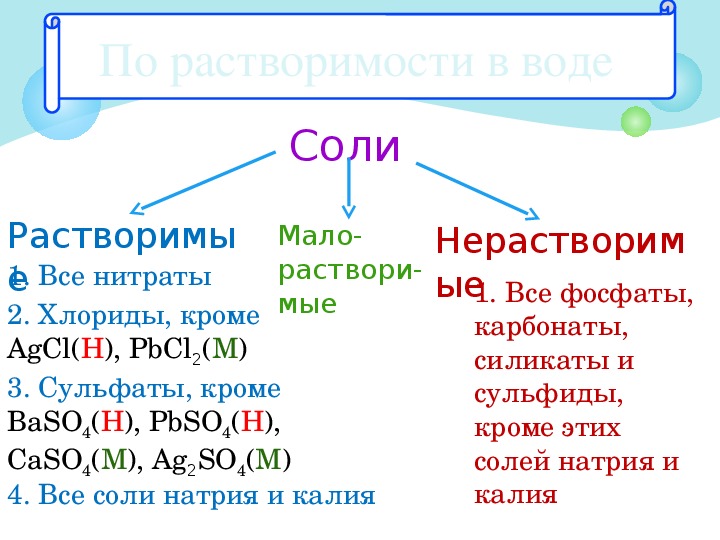 Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид свинца + кремниевая кислота
Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид свинца + кремниевая кислота
Задание №79
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид натрия + нитрат железа(III)
РешениеОтвет: 3NaOH + Fe(NO3)3 = Fe(OH)3 + 3NaNO3
Задание №80
К смеси порошкообразных гидроксида бария и хлорида аммония добавили каплю воды. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3 + 2H2O
Задание №81
Оксид алюминия прокалили совместно с твердым гидроксидом натрия. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства.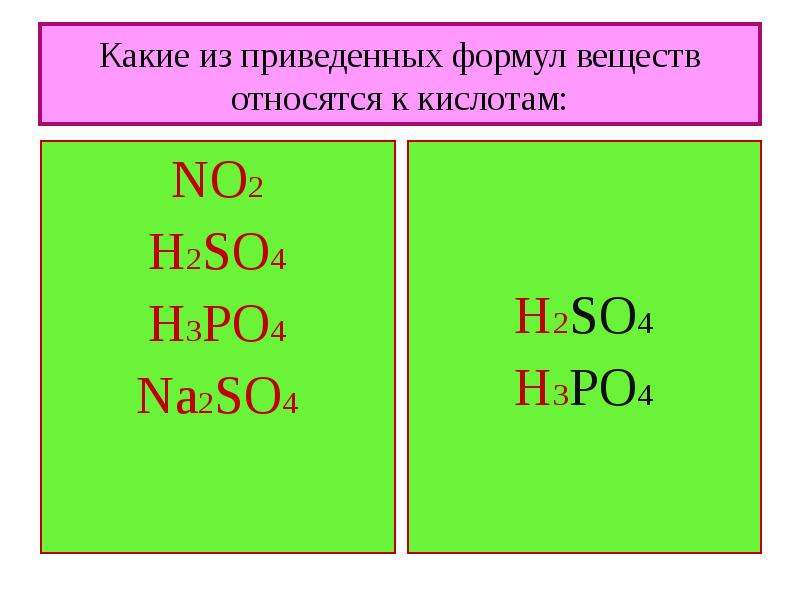 Если реакция не протекает введите в поле ответа знак минус (-)
Если реакция не протекает введите в поле ответа знак минус (-)
Ответ: 2NaOH + Al2O3 = 2NaAlO2 + H2O
Задание №82
Оксид алюминия поместили в концентрированный водный раствор гидроксида калия и подвергли нагреванию. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2KOH + Al2O3 + 3H2O = 2K[Al(OH)4]
Задание №83
Твердый гидроксид калия сплавили с гидроксидом цинка. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2KOH + Zn(OH)2 = K2ZnO2 + 2H2O
Задание №84
Сероводород пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №85
Углекислый газ пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №86
Вычислите массу осадка, полученную при взаимодействии избытка серной кислоты и 30 мл 10% раствора гидроксида бария (плотность 1,1 г/мл). Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №87
Рассчитайте объем 5% раствора соляной кислоты (плотность 1,05 г/см3), необходимый для полной нейтрализации 14 г едкого кали. Ответ укажите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №88
Определите массу воды, полученную при термическом разложении смеси 1,5 моль гидроксида алюминия и 49 г гидроксида меди. Ответ укажите в граммах округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №89
Вычислите массу твердого остатка, полученного при прокаливании 214 г гидроксида железа(III). Ответ укажите в граммах и округлите с точностью до целых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №90
Рассчитайте массовую долю бромата калия в растворе, полученном при полном растворении 8 г брома в 92 г горячего концентрированного раствора гидроксида калия. Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №91
Навеску порошка кремния массой 3,5 г растворили при нагревании в избытке гидроксида натрия. Определите массу осадка, который можно получить при подкислении данного раствора соляной кислотой. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №92
Смесь гидроксидов алюминия и магния имеет массу 100 г. Определите массовую долю гидроксида магния в исходной смеси, если для растворения гидроксида алюминия потребовалось 140 г 10% раствора гидроксида калия. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №93
Навеску гидроксида магния прокалили до постоянной массы. Определите массу азотной кислоты, необходимой для растворения твердого остатка, если при прокаливании выделилось 4,5 г паров воды. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №94
При растворении навески кремния в избытке гидроксида натрия выделился водород. Определите массу исходной навески, если выделившимся газом можно восстановить 20 г оксида меди(II). Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №95
Рассчитайте объем хлора, который может поглотить горячий раствор, содержащий 10 г гидроксида натрия и 7 г гидроксида калия. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №96
Вычислите массу хлорида аммония, необходимую для получения 112 л аммиака по реакции с гидроксидом бария. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №97
Определите массу осадка, оставшегося после реакции 39 г гидроксида алюминия и 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл). Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №98
Рассчитайте объем углекислого газа, необходимого для полного осаждения карбоната бария из 0,2 л 15% раствора его гидроксида (плотность 1,12 г/см3). Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №99
Какую массу воды можно получить при прокаливании образца гидроксида железа(III) массой 59,5 г, содержащего 10% песка. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №100
При полном растворении навески серы массой 9,6 г в избытке раствора гидроксида калия получено 100 г раствора. Рассчитайте массовую долю сульфида калия в получившемся растворе. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
РешениеКислоты и Основания
Вода
Обычно мы говорим о кислотно-основных реакциях в водной фазе, то есть в присутствии воды. Самая фундаментальная кислотно-основная реакция — диссоциация воды:| H 2 O H + + OH — |
В этой реакции вода распадается с образованием иона водорода (H + ) и иона гидроксида (OH —). В чистой воде мы можем определить специальную константу равновесия (K w ) следующим образом:
| K W = [H + ] [OH — ] = 1.00×10 -14 |
Где K w — константа равновесия для воды при 25 ° C (без единиц измерения)
[H + ] — молярная концентрация водорода
[OH — ] — молярная концентрация гидроксида
Константа равновесия меньше единицы (1) предполагает, что реакция предпочитает оставаться на стороне реагентов — в этом случае вода предпочитает оставаться в виде воды. Поскольку вода почти не ионизируется, она очень плохо проводит электричество.
pH
Однако что представляет интерес в этом чтении, так это кислотно-основная природа вещества. как вода. Вода на самом деле ведет себя как кислота и щелочь. Кислотность или Основность вещества чаще всего определяется значение pH, определяется следующим образом: pH = -log [H + ]В состоянии равновесия концентрация H + составляет 1,00 × 10 -7 , поэтому мы можем рассчитать pH воды в состоянии равновесия как:
pH = -log [H + ] = -log [1.00 × 10 -7 ] = 7,00Растворы с pH равным семи (7) считаются нейтральными, тогда как растворы со значениями pH ниже семи (7) определяются как кислые, а растворы с pH выше семи (7) как основные.
pOH дает нам еще один способ измерения кислотности раствора. Это полная противоположность pH. Высокий pOH означает, что раствор является кислым, а низкий pOH означает, что раствор является основным.
pOH = -log [OH — ]pH + pOH = 14,00 при 25 ° C
Определения кислот и оснований
- Аррениуса
кислота : образует [H + ] в растворе
основание : образует [OH — ] в растворе
нормальное уравнение Аррениуса: кислота + основная соль + вода
пример: HCl ( водн.) + NaOH (водн.) NaCl (водн.) + H 2 O (l) - Бренстед-Лоури:
кислота : все, что отдает [H + ] (донор протонов)
основание : все, что принимает [H + ] (акцептор протонов)
нормальное уравнение Бренстеда-Лоури: кислота + основание кислота + основание
пример: HNO 2 (водн.) + H 2 O (водн.) NO 2 — (водн.) + H 3 O + (водн.)
Каждая кислота имеет конъюгированное основание, а каждое основание — сопряженную кислоту.Эти сопряженные пары отличаются только протоном. В этом примере: NO 2 — — сопряженное основание кислоты HNO 2 и H 3 O + — сопряженная кислота основания H 2 O. - Льюис:
кислота : принимает пару электронов
основание : передает пару электронов
Преимущество этой теории состоит в том, что многие другие реакции могут считаться кислотно-основными реакциями, поскольку они не обязательно должны происходить в растворе.
Соли
Соль образуется, когда кислота и основание смешиваются, и кислота выделяет ионы H + , а основание выделяет ионы OH — . Этот процесс называется гидролизом. PH соли зависит от силы исходных кислот и оснований:| Acid | Base | Salt pH |
|---|---|---|
| strong | strong | pH = 7 |
| weak | strong | pH> 7 |
| сильное | слабое | pH <7 |
| слабое | слабое | зависит от того, что сильнее |
Эти соли бывают кислыми или основными из-за их кислотных или основных ионов.Когда слабые кислоты или слабые основания реагируют с водой, они образуют сильные сопряженные основания или сопряженные кислоты, соответственно, что определяет pH соли.
Чтобы молекула со связью H-X была кислотой, водород должен иметь положительную степень окисления, чтобы он мог ионизироваться с образованием положительного иона +1. Например, в гидриде натрия (NaH) водород имеет заряд -1, так что это не кислота, а основание. Такие молекулы, как CH 4 с неполярными связями, также не могут быть кислотами, потому что H не ионизируется.Молекулы с сильными связями (большая разница электроотрицательностей) с меньшей вероятностью будут сильными кислотами, потому что они не очень хорошо ионизируются. Для молекулы со связью X-O-H (также называемой оксокислота), чтобы быть кислотой, водород должен снова ионизироваться с образованием H + . Чтобы быть основанием, O-H должен отщепиться с образованием гидроксид-иона (OH — ). Оба эти явления случаются при работе с оксокислотами.Сильные кислоты: Эти кислоты полностью ионизируются в растворе, поэтому они всегда представлены в химических уравнениях в их ионизированной форме.Всего семь (7) сильных кислот:
HCl, HBr, HI, H 2 SO 4 , HNO 3 , HClO 3 , HClO 4Чтобы рассчитать значение pH, проще всего следовать стандартному процессу «Запуск, изменение, равновесие».
Пример задачи: Определите pH 0,25 М раствора HBr.
| Ответ: | |||||
| HBr (водн.) | → | H + (водн.) | + | Br — (водн.) | |
| Начало: | .25 Месяцев | 0 млн | 0 млн | ||
| Изменение: | -.25 | + 25 | + 25 | ||
| Равновесие: | 0 | ,25 | ,25 | ||
| pH = -log [H + ] = -log (0,25) = 0,60 | |||||
Слабые кислоты: Это наиболее распространенный тип кислот. Они следуют уравнению:
HA (водн.) H + (водн.) + A — (водн.)Константа равновесия диссоциации кислоты известна как K a .Чем больше значение K , тем сильнее кислота.
| К а = | [H + ] [A –] [HA] |
Пример задачи: Определите pH 0,30 М уксусной кислоты (HC 2 H 3 O 2 ) с помощью прибора K a 1,8×10 -5 .
Сильные основания: Как и сильные кислоты, эти основания полностью ионизируются в растворе и всегда представлены в их ионизированной форме в химических уравнениях.Всего восемь (8) сильных оснований:
LiOH, NaOH, KOH, RbOH, CsOH, Ca (OH) 2 , Sr (OH) 2 , Ba (OH) 2 Пример задачи: определить pH 0,010 М раствора Ba (OH) 2 .
| Ответ: | |||||
| Ba (OH) 2 (водн.) | → | Ba 2+ (водн.) | + | 2OH — (водн.) | |
| Начало: | .010 M | 0 млн | 0 млн | ||
| Изменение: | -.010 | +.010 | +.020 | ||
| Равновесие: | 0 | .010 | 0,020 | ||
| pOH = -log [OH — ] = -log (0,020) = 1,70 | |||||
| pH = 14,00 — 1,70 = 12,30 | |||||
Слабое основание: Следуют уравнению:
Слабое основание + H 2 O, сопряженная кислота + OH —Например: NH 3 + H 2 O NH 4 + + OH —
K b — константа диссоциации оснований:
| K b = | [сопряженная кислота] [OH —] [слабое основание] |
| пример: K b = | [NH 4 + ] [OH –] [NH 3 ] |
K a x K b = K w = 1.00×10 -14
Чтобы рассчитать pH слабого основания, мы должны следовать очень похожему процессу «Запуск, изменение, равновесие», как и для слабой кислоты, однако мы должны добавить несколько шагов.
Пример задачи: Определите pH 0,15 М аммиака (NH 3 ) с помощью прибора K b = 1,8×10 -5 .
Имея дело со слабыми кислотами и слабыми основаниями, вы также можете столкнуться с «эффектом общего иона». Это когда вы добавляете соль к слабой кислоте или основанию, которые содержат один из ионов, присутствующих в кислоте или основании.Чтобы иметь возможность использовать тот же процесс для определения pH, когда это происходит, все, что вам нужно изменить, — это ваши «начальные» числа. Сложите молярность иона, который образуется из соли, а затем решите уравнение K a или K b , как вы делали ранее.
Пример задачи: найти pH раствора, образованного растворением 0,100 моль
из HC 2 H 3 O 2 с K a из
1.8×10 -8 и 0.200 моль NaC 2 H 3 O 2 в общем объеме 1,00 л.
| Ответ: | ||||||||||
| HC 2 H 3 O 2 (водн.) | → | H + (водн.) | + | C 2 H 3 O 2 — (водн.) | ||||||
| Начало: | .10 М | 0 млн | .20 млн. | |||||||
| Изменение: | -х | + х | + х | |||||||
| Равновесие: | .10 — х | х | ,20 + х | |||||||
| ||||||||||
| x = [H + ] = -9.0×10 -9 | ||||||||||
| pH = -log (9,0×10 -9 ) = 8,05 | ||||||||||
Кислотно-основное титрование
Кислотно-основное титрование — это когда вы добавляете основание к кислоте до тех пор, пока не будет достигнута точка эквивалентности, когда число молей кислоты равно количеству молей основания. Для титрования сильного основания и сильной кислоты эта точка эквивалентности достигается, когда pH раствора равен семи (7), как видно на следующей кривой титрования:Для титрования сильного основания слабой кислотой точка эквивалентности достигается, когда pH больше семи (7).Половина эквивалентности точка — это когда половина от общего количества базы, необходимой для нейтрализации кислота была добавлена. Именно в этот момент pH = p K a слабая кислота.
При кислотно-основном титровании основание вступает в реакцию со слабой кислотой и образует раствор, содержащий слабую кислоту и сопряженное с ней основание, до тех пор, пока кислота полностью не уйдет. Чтобы решить эти типы проблем, мы будем использовать K значение слабой кислоты и молярности таким же образом, как и раньше.Перед демонстрируя этот способ, давайте сначала рассмотрим сокращенный путь, названный Уравнение Хендерсона-Хассельбаха . Это можно использовать, только если у вас есть немного кислоты и сопряженного основания в вашем растворе. Если у вас есть только кислота, вы должны выполнить задачу с чистым K a , а если у вас есть только основание (например, после завершения титрования), вы должны выполнить задачу K b .
| pH = pK a + log | [ основание ] [ кислота ] |
Где:
pH — логарифм молярной концентрации водорода
p K a — константа равновесной диссоциации кислоты
[основание] — молярная концентрация основного раствора
[кислота] — молярная концентрация кислого раствора
Пример проблемы: 25.0 мл 0,400 М КОН добавляют к 100 мл 0,150 М бензойной кислоты, HC 7 H 5 O 2 ( K a = 6,3×10 -5 ). Определите pH раствора.
Это уравнение часто используется при поиске pH буферных растворов. Буферный раствор — это раствор, который сопротивляется изменению pH при добавлении небольших количеств кислоты или основания. Они состоят из пары сопряженных кислот и оснований, таких как HC 2 H 3 O 2 / C 2 H 3 O 2 — или NH 4 + / NH 3 .Они работают, потому что кислотные частицы нейтрализуют ионы OH —, в то время как основные частицы нейтрализуют ионы H + . Буферная емкость — это количество кислоты или основания, которое буфер может нейтрализовать до того, как pH начнет значительно изменяться. Это зависит от количества кислоты или основания в буфере. Высокая буферная емкость обеспечивается решениями с высокими концентрациями кислоты и основания, и где эти концентрации близки по величине.Практика проблемы слабой кислоты :
C 6 H 5 COONa — это соль слабой кислоты C 6 H 5 COOH.0,10 М раствор C 6 H 5 COONa имеет pH 8,60.
- Вычислить [OH –] C 6 H 5 COONa
- Вычислить K b для: C 6 H 5 COO — + H 2 O C 6 H 5 COOH + OH —
- Вычислить K a для C 6 H 5 COOH
См. Слабый кислотный раствор.
Задача практического титрования :
20,00 мл 0,160 M HC 2 H 3 O 2 ( K a = 1,8×10 -5 ) титруют 0,200 M NaOH.
- Каков pH раствора перед началом титрования?
- Каков pH после добавления 8,00 мл NaOH?
- Каков pH в точке эквивалентности?
- Каков pH после добавления 20,00 мл NaOH?
См. Раствор для титрования.
[Базовый индекс]
[Химическая номенклатура]
[Атомная структура]
[Периодическая таблица]
[Структура Льюиса]
[Химические реакции]
[Стехиометрия]
[Кислотно-основная химия]
Кислоты и Основания
Определение Бронстеда-Лоури (1923) — Определение кислот и оснований с участием ионов водорода и гидроксида соответственно слишком ограничивает. Более широкое определение было предложено Бронстедом. и Лоури в 1923 году.Основной эффект определения — увеличение количество веществ, выступающих в роли оснований.
| Кислота | База | |
| Отдает ионы водорода | Принимает ионы водорода. | |
| HCl + | HOH —> | H 3 O + + Класс — |
| HOH + | NH 3 —> | NH 4 + + OH — |
Определение вещества как кислоты Бренстеда-Лоури или базу можно сделать только наблюдая за реакцией.В этом случае HOH это основание в первом случае и кислота в второй случай.
Ссылка на звонок анимация переноса иона аммония в воду — Джереми Харви, Бристольский университет, Англия,
См. Пример на рисунке слева:
Чтобы определить, является ли вещество кислотой или основанием, посчитайте водороды в каждом веществе до и после реакции.Если количество атомов водорода уменьшилось, это вещество является кислота (отдает ионы водорода). Если количество водородов увеличено, что вещество является основой (принимает ионы водорода). Эти определения обычно применяются к реагентам на осталось.
Если смотреть в обратном порядке, новая кислота и основание могут быть идентифицированным. Вещества в правой части уравнения называются конъюгированной кислотой и конъюгированным основанием по сравнению с теми слева.
Также обратите внимание, что исходная кислота превращается в сопряженное основание после того, как реакция закончилась.
Кислоты и основания (предыдущая версия) | Химия
Это более старая версия этого модуля. Доступна более новая версия модуля Acids and Bases I
На протяжении тысячелетий люди знали, что уксус, лимонный сок и многие другие продукты имеют кислый вкус. Однако только несколько сотен лет назад было обнаружено, почему эти вещества имеют кислый вкус — потому что все они являются кислотами.Термин «кислота» происходит от латинского термина acere , что означает «кислый». Хотя существует много разных определений кислот и оснований, в этом уроке мы познакомим вас с основами кислотно-щелочной химии.
В семнадцатом веке ирландский писатель и химик-любитель Роберт Бойль впервые назвал вещества кислотами или основаниями (он называл основания щелочами ) в соответствии со следующими характеристиками:
Кислоты имеют кислый вкус, вызывают коррозию. Металлы меняют лакмус (краситель, извлекаемый из лишайников) на красный и становятся менее кислыми при смешивании с основаниями.
Основы кажутся скользкими, меняют лакмусово-синий цвет и становятся менее щелочными при смешивании с кислотами.
В то время как Бойль и другие пытались объяснить, почему кислоты и основания ведут себя как они это делают, первое разумное определение кислот и оснований не будет предложено до 200 лет спустя.
В конце 1800-х годов шведский ученый Сванте Аррениус предположил, что вода может растворять многие соединения, разделяя их на отдельные ионы.Аррениус предположил, что кислоты — это соединения, которые содержат водород и могут раствориться в воде, чтобы высвободить ионы водорода в раствор. Например, соляная кислота (HCl) растворяется в воде следующим образом:
| HCl | H 2 O → | H + ( водн. ) | + | Класс — ( водн. ) |
Аррениус определил основания как вещества, которые растворяются в воде с выделением гидроксид-ионов (ОН-) в раствор.Например, типичным основанием согласно определению Аррениуса является гидроксид натрия (NaOH):
| NaOH | H 2 O → | Na + ( водн. ) | + | ОН — ( водн. ) |
Определение кислот и оснований Аррениуса объясняет ряд вещей.Теория Аррениуса объясняет, почему все кислоты имеют схожие свойства друг с другом (и, наоборот, почему все основания одинаковы): потому что все кислоты выделяют H + в раствор (а все основания выделяют OH — ). Определение Аррениуса также объясняет наблюдение Бойля о том, что кислоты и основания противодействуют друг другу. Идея о том, что основание может ослабить кислоту и наоборот, называется нейтрализацией.
Нейтрализация
Как видно из уравнений, кислоты выделяют H + в раствор и основы выпуск OH — .Если бы мы смешали кислота и основание вместе, ион H + будет соединяться с OH — ион для образования молекулы H 2 O, или обычная вода:
Реакция нейтрализации кислоты основанием всегда будет давать воду и соль, как показано ниже:
| Кислота | База | Вода | Соль | |||
|---|---|---|---|---|---|---|
| HCl | + | NaOH | → | H 2 O | + | NaCl |
| HBr | + | КОН | → | H 2 O | + | KBr |
Хотя Аррениус помог объяснить основы химии кислот и оснований, к сожалению, его теории имеют пределы.Например, определение Аррениуса не объясняет, почему некоторые вещества, такие как обычная пищевая сода (NaHCO 3 ), могут действовать как основание, даже если они не содержат гидроксид-ионы.
В 1923 году датский ученый Йоханнес Бренстед и англичанин Томас Лоури опубликовали независимые, но похожие статьи, уточняющие теорию Аррениуса. По словам Бренстеда, «… кислоты и основания — это вещества, способные соответственно отщеплять или поглощать ионы водорода.«Определение Брёнстеда-Лоури расширило аррениусовскую концепцию кислот и оснований.
Определение кислот Бренстеда-Лоури очень похоже на определение Аррениуса: любое вещество, которое может отдавать ион водорода, является кислотой (согласно определению Бренстеда, кислоты часто называют донорами протона , потому что ион H + , водород минус его электрон, является просто протоном.)
Определение Брёнстеда оснований , однако, сильно отличается от определения Аррениуса.Основание Бренстеда определяется как любое вещество, которое может принимать ион водорода. По сути, основание — это противоположность кислоты. NaOH и KOH, как мы видели выше, все равно будут считаться основаниями, потому что они могут принимать H + из кислоты с образованием воды. Однако определение Бренстеда-Лоури также объясняет, почему вещества, не содержащие OH — , могут действовать как основания. Пищевая сода (NaHCO 3 ), например, действует как основание, принимая ион водорода из кислоты, как показано ниже:
| Кислота | База | Соль | ||||
| HCl | + | NaHCO 3 | → | H 2 CO 3 | + | NaCl |
В этом примере образовавшаяся углекислота (H 2 CO 3 ) подвергается быстрому разложению до воды и газообразного диоксида углерода, в результате чего раствор пузырится в виде газа CO 2 .
pH
Согласно определению Бренстеда-Лоури, и кислоты, и основания связаны с концентрацией присутствующих ионов водорода. Кислоты увеличивают концентрацию ионов водорода, а основания уменьшают концентрацию ионов водорода (принимая их). Следовательно, кислотность или основность чего-либо может быть измерена по концентрации ионов водорода.
В 1909 году датский биохимик Сёрен Соренсен изобрел шкалу pH для измерения кислотности. Шкала pH описывается формулой:
| pH = -log [H + ] |
|---|
| Примечание. Обычно для сокращения концентрации используются квадратные скобки, таким образом [H + ] = концентрация ионов водорода.При измерении pH [H + ] выражается в молях H + на литр раствора. |
Например, раствор с [H + ] = 1 x 10 -7 моль / литр имеет pH, равный 7 (более простой способ думать о pH — это то, что он равен показателю H + концентрация, игнорируя знак минус). Шкала pH колеблется от 0 до 14. Вещества с pH от 0 до менее 7 являются кислотами (pH и [H + ] обратно пропорциональны — более низкий pH означает более высокий [H + ]).Вещества с pH от более 7 до 14 являются основаниями (более высокий pH означает более низкий [H + ]). Прямо посередине, при pH = 7, находятся нейтральные вещества, например, чистая вода. Взаимосвязь между [H + ] и pH показана в таблице ниже вместе с некоторыми типичными примерами кислот и оснований в повседневной жизни.
| [H + ] | pH | Пример | |
|---|---|---|---|
| Кислоты | 1 Х 10 0 | 0 | HCl |
| 1 х 10 -1 | 1 | Желудочная кислота | |
| 1 х 10 -2 | 2 | Лимонный сок | |
| 1 x 10 -3 | 3 | Уксус | |
| 1 x 10 -4 | 4 | Сода | |
| 1 x 10 -5 | 5 | Дождевая вода | |
| 1 x 10 -6 | 6 | Молоко | |
| Нейтраль | 1 х 10 -7 | 7 | Чистая вода |
| Базы | 1 х 10 -8 | 8 | Яичные белки |
| 1 x 10 -9 | 9 | Сода пищевая | |
| 1 x 10 -10 | 10 | Тумс ® антацидный | |
| 1 x 10 -11 | 11 | Аммиак | |
| 1 x 10 -12 | 12 | Минеральная известь — Ca (OH) 2 | |
| 1 x 10 -13 | 13 | Драно ® | |
| 1 x 10 -14 | 14 | NaOH |
Резюме
Поскольку кислоты и основания были впервые обозначены и описаны в 17 веке, их определение на протяжении веков уточнялось, чтобы отразить возросшее понимание их химических свойств.Этот модуль знакомит с основами кислотно-щелочной химии, включая реакции нейтрализации. Взаимосвязь между концентрацией ионов водорода [H + ] и pH показана вместе с обычными примерами кислот и оснований.
кислот и оснований | Grandinetti Group
С нашим пониманием сильных, слабых и неэлектролитов мы теперь можем изучить определение кислот и оснований Аррениуса:
- Кислоты:
- Вещество, которое образует ионы H + при растворении в H 2 O.
- Основания:
- Вещество, производящее ионы OH — при растворении в H 2 O.
Например, HCl — это кислота,
и NaOH — основание,
Кислотыи основания, являющиеся сильными электролитами, называются сильными кислотами и сильными основаниями соответственно. Кислоты и основания, являющиеся слабыми электролитами, называются слабыми кислотами и слабыми основаниями соответственно.
Сильные кислоты
HCl является примером сильной кислоты:
HCl (водн.) → H + (водн.) + Класс — (водн.)
Другие примеры включают HBr, HI, HClO 4 , HClO 3 , H 2 SO 4 и HNO 3 .
Слабые кислоты
HF является примером слабой кислоты:
Другие примеры включают HC 2 H 3 O 2 , H 2 CO 3 , H 2 SO 3 , H 3 PO 3 и H 3 PO 4 . Последние четыре являются примерами полипротонных кислот . Это кислоты, которые при растворении в воде могут производить более одного иона H + . H 2 CO 3 и H 2 SO 3 называются дипротонными кислотами , а H 3 PO 3 и H 3 PO 4 называются трипротонными кислотами .HF, HCl, HBr и HC 2 H 3 O 2 являются примерами монопротоновых кислот . Диссоциация полипротонных кислот обычно происходит ступенчато. Например, только после того, как H 3 PO 4 потеряет свой первый ион H + , он потеряет свой второй ион H + , а затем он потеряет свой третий ион.
В этом примере все три вида H 3 PO 4 , H 2 PO 4 — и HPO 4 2- являются слабыми электролитами, поэтому H 3 PO 4 считается слабой кислотой.H 2 SO 4 является другим примером дипротоновой кислоты. В случае H 2 SO 4 первый ион H + образуется легко, поэтому разновидность H 2 SO 4 считается сильным электролитом (, т.е. сильная кислота). Однако разновидность HSO 4 — является слабым электролитом.
Крепкие основания
NaOH — пример сильного основания:
NaOH (водн.) → Na + (водн.) + ОН — (водн.)
Другие примеры включают LiOH, KOH, RbOH, CsOH, Ca (OH) 2 , Sr (OH) 2 и Ba (OH) 2 .
Слабые основания
Аммиак, NH 3 , является хорошим примером слабого основания.
Другие примеры включают C 6 H 5 N (пиридин) и C 6 H 5 NH 2 (анилин).
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
4.1, 4.3, 4.5, 4.7, 4.9, 4.11, 4.13, 4.15, 4.17, 4.33, 4.35, 4.37,
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода H + между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичное поведение молекул и ионов, которые являются кислотными, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрияСульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin WalkerПопулярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый привкус, меняет цвет синей лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания вступают в реакцию с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2-).Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют друг друга)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более целесообразно рассматривать как включающую прямой перенос протона от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может привести к образованию соли (или ее раствора), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, реагирующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основы — это химические соединения, которые в растворе становятся мыльными на ощупь, а красные растительные красители становятся синими. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом и не имеющие характерных свойств кислот или оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как и химия, и термины кислота , основание и соль встречаются очень рано в трудах средневековых алхимиков. Кислоты, вероятно, были первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota образованы от слов, означающих кислый (латинское acidus , немецкий sauer , древнескандинавское sūur и Русский кислый ).К другим свойствам, которые в свое время связывали кислоты, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков газообразного диоксида углерода). Основания (или щелочи) характеризовались в основном своей способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для корреляции значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались первые химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), основания (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура).Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из самых ранних примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в каком-то химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать для регенерации исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, при которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПомимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии пронизывают повседневную жизнь, и термин соль особенно распространен.
Настройка площади поверхности и кислотно-основных свойств ZrO 2 для производства биодизеля из Nannochloropsis sp.
Влияние типа поверхностно-активных веществ и параметров реакции на площадь поверхности ZrO
2 и исследование оптимизацииМаксимальная площадь поверхности ZrO 2 была достигнута с использованием поли (этиленоксид) -блок-поли (пропилена) оксид) -блок-поли (этиленоксид) (Pluronic P123) и бромид цетримония (CTAB) в качестве поверхностно-активных веществ, с получением катализаторов ZrO 2 (P123) и ZrO 2 (CTAB) соответственно.Оптимизация параметров процесса проводилась с использованием RSMCCD, который поддерживал экспериментальные условия в желаемом диапазоне независимых параметров. Согласно литературным данным, наиболее важными параметрами, влияющими на площадь поверхности ZrO 2 , являются отношение ПАВ / Zr (A), pH (B), время старения (C) и температура (D) 39,40,41 . Конкретные значения независимых параметров, использованные в этом исследовании, наряду с площадью поверхности, полученной для ZrO 2 (P123) и ZrO 2 (CTAB) , указаны в дополнительных таблицах S1 и S2 соответственно.В частности, среди 30 экспериментальных прогонов RSMCCD, ZrO 2 (P123) показал максимальную площадь поверхности 79 м 2 / г (серия 21), тогда как ZrO 2 (CTAB) показал максимальную площадь поверхности 295 м 2. 2 / г (запуск 20).
Взаимосвязь между независимыми параметрами и площадью поверхности, полученная с помощью дисперсионного анализа (ANOVA) для ZrO 2 (P123) и ZrO 2 (CTAB) , суммирована в дополнительных таблицах S3 и S4, соответственно.Подгоняя данные к различным полиномиальным моделям, результат дисперсионного анализа показывает, что и ZrO 2 (P123) , и ZrO 2 (CTAB) были подходящим образом подогнаны к сокращенным кубическим моделям. Полученные P-значения (<0,05) показали, что предложенные условия модели оказывают существенное влияние на ответ 42 . В частности, для ZrO 2 (P123) (R1) значимыми членами были A, B, C, D, CD, B 2 , C 2 , D 2 , ACD и A 2. B, а для ZrO 2 (CTAB) (R2) значимыми членами были C, BC, CD, A 2 , B 2 , C 2 , D 2 , BCD, A 2 C и A 2 D.В данном случае комбинированный эффект времени старения и температуры (CD) был одним из наиболее значимых условий улучшения площади поверхности ZrO 2 . Таким образом, это наблюдение подчеркнуло важность достаточного времени старения для эффективного распределения Zr – OH и Zr – O – Zr с целью формирования стабильного сетчатого геля. Более того, было доказано, что подходящая гидротермальная температура приводит к развитию внутреннего давления, увеличивает скорость движения поверхностно-активных веществ и предотвращает агломерацию наночастиц Zr 38 .
Полученный высокий коэффициент детерминации (R 2 ) указывает на качество совпадения двух сгенерированных моделей. Кроме того, отсутствие значений соответствия для обеих моделей было незначительным, что является желаемым результатом. Значения R 2 и скорректированного R 2 были близки к единице, что указывает на точность моделей. Низкие значения коэффициента вариации (CV%) для обеих моделей указывают на хорошую точность и надежность экспериментов. Корреляция между прогнозируемыми и фактическими площадями поверхности ZrO 2 (P123) и ZrO 2 (CTAB) показана соответственно на дополнительном рисунке.S1 (а, б). Связь между прогнозируемыми и фактическими значениями для обеих моделей была приблизительно линейной, что указывает на надежность моделей, разработанных для установления корреляции между параметрами процесса и площадью поверхности. Соответственно, окончательные прогнозируемые площади поверхности ZrO 2 (P123) и ZrO 2 (CTAB) были определены на основе заданных значений каждого фактора, как показано в уравнениях (1) и (2), соответственно:
$$ \ begin {array} {rcl} R1 & = & 64.{2} D \ end {array} $$
(2)
где A — молярное отношение поверхностно-активного вещества / Zr, B — значение pH, C — время старения, D — температура.
Оптимальные параметры реакции, предложенные RSMCCD для максимальной площади поверхности ZrO 2 (P123) и ZrO 2 (CTAB) , приведены в дополнительной таблице S5. В частности, оптимальная площадь поверхности ZrO 2 (P123) составляла 79 м 2 / г при молярном соотношении поверхностно-активное вещество / Zr 0.03, pH 9,5 и время выдержки 22 ч при 110 ° C. С другой стороны, оптимальная площадь поверхности 295 м 2 / г была достигнута для ZrO 2 (CTAB) при молярном соотношении поверхностно-активное вещество / Zr 0,89, pH 9,8 и времени старения 39 ч при 110 °. С. Значения отклонения (%) были рассчитаны в соответствии с отклонением между прогнозируемыми и экспериментальными значениями 43 . Полученные результаты были удовлетворительными и надежными, с приемлемой точностью.
Характеристики катализатора
На рис. 1 (a – g) показаны спектры малоугловой и широкоугольной дифракции рентгеновских лучей (XRD) синтезированных катализаторов.Наличие пиков малоугловой дифракции в диапазоне 2θ от 0,06 ° до 0,80 ° указывает на то, что и ZrO 2 (P123) , и ZrO 2 (CTAB) показали хорошо организованные структуры мезопор после прокаливания при 500 ° C (рис. 1а, б) 44,45 . На рис. 1в представлена широкоугольная дифрактограмма дифрактограммы ZrO 2 без покрытия с пиками отражения при 2θ = 30,2 ° (011), 35 ° (110), 50,3 ° (112) и 60,1 ° (121), что соответствует тетрагональному ZrO2. 2 (t-ZrO 2 ; ICDD: 98-015-7619).Остальные пики при 2θ = 24,4 ° (110), 28,3 ° (11-1), 31,5 ° (111), 40,8 ° (102) и 45 ° (211) соответствуют моноклинному ZrO 2 (m-ZrO ). 2 ; ICDD: 98-006-8782). Было замечено, что добавление Pluronic P123 (фиг. 1d) немного увеличивало интенсивность пиков, но не сдвигало положение пиков. Добавление небольшого количества Bi 2 O 3 на поверхность ZrO 2 (P123) значительно улучшило кристаллическую структуру конечного катализатора за счет образования острых и очень интенсивных пиков при тех же значениях 2θ (рис. .1д). С другой стороны, добавление CTAB (рис. 1f) привело к появлению двух широких и неприметных пиков с центрами при 2θ = 30,7 ° и 50,6 °, что указывает на аморфную структуру. Аморфная структура ZrO 2 (CTAB) также была кристаллизована до почти тетрагональной фазы после пропитки Bi 2 O 3 (рис. 1g) из-за ее нестабильности, которая допускала фазовые переходы 46 . Хотя пики Bi 2 O 3 не удалось идентифицировать из-за перекрытия с пиками m-ZrO 2 , кубическая фаза Bi 2 O 3 (ICDD: 98-000-2375 ) присутствовал при 2θ = 27.2 ° (111), 31,5 ° (002) и 45,2 ° (022).
Рисунок 1Малоугловые дифрактограммы XRD ( a ) ZrO 2 (P123) и ( b ) ZrO 2 (CTAB) и широкоугольные дифрактограммы XRD (вставка) ( c ) ZrO без покрытия 2 , ( d ) ZrO 2 (P123) , ( e ) Bi 2 O 3 / ZrO 2 (P123) , ( f ) ZrO 2 (CTAB) и ( г ) Bi 2 O 3 / ZrO 2 (CTAB) катализаторов. t и m относятся к тетрагональному и моноклинному ZrO 2 соответственно.
В таблице 1 показаны средние размеры кристаллитов и составы форм m-ZrO 2 и t-ZrO 2 катализаторов. Чистый ZrO 2 обладал более крупными средними размерами кристаллитов как для моноклинной, так и для тетрагональной фаз по сравнению с наночастицами с добавлением Pluronic и CTAB. Во время синтеза ZrO 2 поверхностно-активное вещество служило мягким шаблоном для предотвращения агломерации наночастиц за счет различных сил отталкивания и притяжения, которые развивались между поверхностно-активным веществом и наночастицами 36 .Средние размеры кристаллитов ZrO 2 (P123) оказались равными 11,5 и 10,3 нм для моноклинной и тетрагональной фаз соответственно. Введение Bi 2 O 3 в каркас ZrO 2 (P123) увеличивало размер кристаллитов катализатора из-за участия Bi 2 O 3 в росте частиц. Поскольку ZrO 2 (CTAB) был аморфным, не было получено данных XRD, связанных с размером кристаллитов. Однако размеры кристаллитов m-ZrO 2 и t-ZrO 2 в Bi 2 O 3 / ZrO 2 (CTAB) были определены при 10.7 и 9,3 нм соответственно. Количественный анализ Ритвельда был применен как мощный инструмент для количественной оценки кристаллических компонентов в многофазных структурах 47 . Как показано в таблице 1, объемные доли моноклинной и тетрагональной фаз чистого ZrO 2 были одинаковыми. Первоначально ZrO 2 (P123) находился преимущественно в тетрагональной фазе. Однако нанесение Bi 2 O 3 на поверхность ZrO 2 (P123) преобразовало тетрагональную фазу в моноклинную.Напротив, Bi 2 O 3 / ZrO 2 (CTAB) имеет более высокое содержание t-ZrO 2 по сравнению с m-ZrO 2 . Сообщалось, что во многих реакционных системах t-ZrO 2 проявляет высокую каталитическую активность 48 из-за его низкой поверхностной энергии 49 и его оптимального геометрического расположения, которое стабилизирует комплекс переходного состояния между реагентами на t-ZrO 2 поверхность 50 .
Таблица 1 Средние размеры кристаллитов и фазовый состав форм m-ZrO 2 и t-ZrO 2 синтезированных катализаторов.На рис. 2 показаны изотермы адсорбции / десорбции азота катализаторами. Согласно классификации IUPAC, все катализаторы демонстрируют изотерму типа IV с петлей гистерезиса из-за капиллярной конденсации, приписываемой хорошо развитой мезопористой системе 51 . Форма петли гистерезиса способствовала характерной специфической структуре пор в катализаторах. Согласно полученным результатам, чистые ZrO 2 , ZrO 2 (CTAB) и Bi 2 O 3 / ZrO 2 (CTAB) напоминали тип h3, характерный для неорганических оксидов с чернилами. -образные мезопоры 52 .ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (P123) демонстрируют петлю гистерезиса h2-типа, что предполагает наличие цилиндрической геометрии пор, сферические частицы, спрессованные в однородное расположение, и высокая степень однородности пор 52,53 . Площадь поверхности Брунауэра – Эммета – Теллера (БЭТ), общий объем пор и средний размер пор приведены в таблице 2. Для чистого ZrO 2 были обнаружены самые низкие значения площади поверхности и общего объема пор.Что касается наночастиц с добавлением поверхностно-активного вещества, ZrO 2 (CTAB) показал значительно большую площадь поверхности по БЭТ и общий объем пор, чем ZrO 2 (P123) . Это связано с более высоким молярным соотношением ЦТАБ / Zr, используемым в синтезе ZrO 2 (ЦТАБ) , и влиянием катионной природы поверхностно-активного вещества. После смешивания воды с ЦТАБ катионные заряды ЦТАБ высвобождались и вызывали силы отталкивания между частицами Zr, что приводило к большому объему пор 54 .Больший объем пор наряду с меньшим средним размером пор способствовал формированию большей общей площади поверхности. Однако общая площадь поверхности ZrO 2 (P123) и ZrO 2 (CTAB) уменьшилась примерно на 20% и 47% соответственно после пропитки Bi 2 O 3 из-за эффекта заполнения пор. . Кроме того, все катализаторы имели мезопористую структуру со средним размером пор от 5,6 до 13,98 м 2 / г. На рис. 3 показаны графики распределения пор по размерам с использованием метода Барретта, Джойнера и Халенды.Все катализаторы демонстрировали одномодальные графики распределения пор по размерам, причем ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (P123) демонстрируют более узкое распределение пор по размеру по сравнению с другими катализаторами, что указывает на их высокая степень однородности пор. После пропитки Bi 2 O 3 наблюдается увеличение среднего размера пор Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) наблюдали из-за смещения графиков размеров пор вправо от области с большим размером пор 55 .
Рисунок 2Изотермы адсорбции / десорбции азота ( a ) чистого ZrO 2 , ( b ) ZrO 2 (P123) , ( c ) Bi 2 O 3 / Катализаторы ZrO 2 (P123) , ( d ) ZrO 2 (CTAB) и ( e ) Bi 2 O 3 / ZrO 2 (CTAB) .
Таблица 2 Площадь поверхности по БЭТ, общий объем пор и средний размер пор синтезированных катализаторов. Рисунок 3Графики распределения пор ( a ) чистого ZrO 2 , ( b ) ZrO 2 (P123) , ( c ) Bi 2 O 3 / ZrO 2 (P123) , ( d ) ZrO 2 (CTAB) и ( e ) Bi 2 O 3 / ZrO 2 (CTAB) катализаторы.
Кислотно-основные бифункциональные свойства катализаторов были подтверждены профилями NH 3 -TPD и CO 2 -TPD, как показано на рисунках 4 и 5, соответственно. Общее количество кислотных / основных центров катализаторов вместе с их плотностью сведено в Таблицу 3. Общее количество кислотных / основных центров было рассчитано на основе интенсивности пиков десорбции NH 3 / CO 2 и плотности каждого катализатора получали путем деления общего количества кислотных / основных центров на площадь поверхности.Между тем, силу кислотных / основных центров обозначали температурой десорбции. Для ZrO 2 пики десорбции ниже 250 ° C могут быть отнесены к слабым кислотным / основным центрам, пики адсорбции между 250 ° C и 500 ° C соответствуют кислотным / основным центрам средней силы, а пики адсорбции выше 500 ° C представляет сильные кислотные / основные центры 56 . В целом было доказано, что наночастицы с добавлением поверхностно-активного вещества увеличивают количество и плотность общих кислотных / основных центров по сравнению с чистым ZrO 2 .Согласно профилю NH 3 -TPD (рис. 4), чистый ZrO 2 показал небольшой пик десорбции при 489 ° C, что указывает на среднюю силу кислоты. Что касается наночастиц с добавлением поверхностно-активного вещества, ZrO 2 (P123) показал небольшой пик десорбции при 254 ° C, а ZrO 2 (CTAB) показал более широкий пик десорбции с центром при 266 ° C, что также указывает на среднюю кислотную силу. ZrO 2 (CTAB) показал более высокие общие кислотные центры по сравнению с ZrO 2 (P123) из-за большей площади поверхности катализатора 39 .Интересно отметить, что кривые Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) с более высокими общими кислотными центрами по сравнению с их родительскими ZrO 2 были смещены вправо. Эта тенденция в целом согласуется с другими выводами по Bi 2 O 3 -модифицированным La 2 O 3 катализаторам 7 . Низах и др. . обнаружили, что добавление Bi 2 O 3 на поверхность La 2 O 3 усиливает кислотные свойства конечных катализаторов 7 .На основании профиля CO 2 -TPD (рис. 5) все катализаторы, за исключением чистого ZrO 2 , проявляли основные центры слабой прочности при температуре десорбции от 112 ° C до 118 ° C. Вместо этого чистый ZrO 2 показал небольшой пик десорбции при 487 ° C, что указывает на среднюю основную прочность. Помимо слабых основных центров, ZrO 2 (CTAB) показал множественные пики десорбции при температурах десорбции от 468 ° C до 525 ° C, что указывает на среднюю или высокую прочность основных центров.
Рисунок 4NH 3 -TPD профили ( a ) чистого ZrO 2 , ( b ) ZrO 2 (P123) , ( c ) Bi 2 O 3 / ZrO 2 (P123) , ( d ) ZrO 2 (CTAB) и ( e ) Bi 2 O 3 / ZrO 2 (CTAB) катализаторы.
Рисунок 5CO 2 -TPD профили ( a ) чистого ZrO 2 , ( b ) ZrO 2 (P123) , ( c ) Bi 2 O 3 / ZrO 2 (P123) , ( d ) ZrO 2 (CTAB) и ( e ) Bi 2 O 3 / ZrO 2 (CTAB) катализаторы.
Таблица 3 Кислотные и основные свойства синтезированных катализаторов.Морфология синтезированных катализаторов представлена на рис. 6 (а – д). На рис. 6а показаны маленькие поры чистого ZrO 2 , а на рис. 6б показаны сферические наночастицы ZrO 2 (P123) (10–20 нм) с упорядоченным расположением. ZrO 2 (CTAB) имел шероховатую поверхность катализатора, и между частицами наблюдались частицы неправильной формы с большими внешними порами (рис.6г). В этом анализе было четко определено влияние длины гидрофобного хвоста поверхностно-активного вещества, поскольку длинная цепь Pluronic P123 обеспечивала лучший стерический эффект, чем CTAB, и позволяла самоорганизоваться, в то же время значительно предотвращая разрушение сети пор во время процесса сушки. 54 . Кроме того, однородный размер и расположение частиц ZrO 2 (P123) объясняют более узкий график распределения пор по размерам для ZrO 2 (P123) по сравнению с ZrO 2 (CTAB) .Как показано на рис. 6c, e, осаждение Bi 2 O 3 на внешней поверхности катализаторов привело к агломерации Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) морфологии соответственно. Это наблюдение согласуется с большими размерами наночастиц и кристаллитов, полученными ранее для Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) .Дополнительные рис. S2 (a, b) изображает энергодисперсионный рентгеновский (EDX) и картографический анализ, которые были применены для измерения элементного состава и распределения Bi 2 O 3 / ZrO 2 (P123) и Bi . 2 O 3 / ZrO 2 (CTAB) соответственно. На основе EDX-спектра четко наблюдались три отдельные фазы Zr, Bi и O, что подтвердило присутствие Bi 2 O 3 на поверхности катализатора ZrO 2 .Концентрации Bi в Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) также соответствовали количеству, загруженному во время приготовления катализаторы. Кроме того, результаты картографического анализа показали, что частицы Bi 2 O 3 были равномерно диспергированы на поверхности ZrO 2 благодаря однородной структуре Bi 2 O 3 / ZrO 2 (P123) и Bi 2 O 3 / ZrO 2 (CTAB) катализаторы.
Рисунок 6Изображения ( a ) без покрытия ZrO 2 , ( b ) ZrO 2 (P123) , ( c ) Bi 2 O, полученные с помощью электронного сканирующего электронного микроскопа (FESEM) 3 / ZrO 2 (P123) , ( d ) ZrO 2 (CTAB) и ( e ) Bi 2 O 3 / ZrO 2 (CTAB) катализаторов.
Каталитическая активность по отношению к производству биодизеля из микроводорослей
Одновременная этерификация-переэтерификация Nannochloropsis sp.липид в биодизель был выбран в качестве модельной реакции для проверки активности синтезированных катализаторов. Каталитическую активность оценивали по выходу метиловых эфиров жирных кислот (FAME), как показано на фиг.7. В частности, Bi 2 O 3 / ZrO 2 (CTAB) дает самый высокий выход FAME (73,21 %), затем следует ZrO 2 (CTAB) (71,65%), Bi 2 O 3 / ZrO 2 (P123) (67,01%), ZrO 2 (P123) (64,73%), и без покрытия ZrO 2 (25.48%). Хотя общее увеличение площади поверхности катализатора за счет наночастиц с добавлением поверхностно-активного вещества привело к лучшему выходу FAME по сравнению с чистым ZrO 2 , единичная большая площадь поверхности не привела к высокой каталитической активности. Было обнаружено, что каталитическая эффективность является результатом синергетической роли как общей плотности кислотных, так и основных участков. Помимо самой низкой площади поверхности и плотностей кислотных / основных центров, наименьший выход FAME, полученный с использованием чистого ZrO 2 , также коррелировал с небольшими отверстиями пор в структуре катализатора, которые препятствовали достижению объемными молекулами триглицерида активного центра катализатора.Подобные результаты наблюдались и в других исследованиях. Омар и др. . обнаружили, что сбалансированная кислотность и основность на поверхности катализаторов Sr / ZrO 2 способствует высокому выходу FAME из отработанного кулинарного масла 19 . В другом исследовании бифункциональный катализатор, модифицированный Bi 2 O 3 La 2 O 3 , был использован для одновременной этерификации-переэтерификации масла ятрофы в биодизельное топливо 7 . Результаты текущего исследования также показали, что характеристики катализатора связаны с большой площадью поверхности и сильными кислотными и основными центрами, а катализаторы на основе смешанных оксидов демонстрируют более высокие каталитические характеристики, чем их родительский ZrO 2 .Точно так же Умду и др. . исследовали использование одиночных оксидов металлов и смешанных оксидов для производства биодизеля из липидов микроводорослей 17 . Было продемонстрировано, что чистый CaO и MgO были неактивными, но смешанные оксиды CaO / Al 2 O 3 и MgO / Al 2 O 3 были каталитически активными для переэтерификации в тех же условиях реакции. Их высокие каталитические свойства объясняются высокой плотностью и умеренной прочностью их основных центров.
Рисунок 7Каталитическая активность синтезированных катализаторов для производства биодизеля из Nannochloropsis sp. липид.
Золь-гель-метод с добавлением поверхностно-активных веществ с последующей гидротермальной обработкой
В золь-гель-процессе участвуют три основные реакции, а именно гидролиз, конденсация и старение 43 . Во время гидролиза H 2 O замещается группой ОН из-за потери протонов. Реакция конденсации приводит к образованию мостиков M – OH – M (ol) или M – O – M (оксо) после отщепления молекул воды 57 .Процесс старения делает гель более устойчивым к капиллярным нагрузкам и увеличивает его механические свойства. 57 . Уорд и Ко сообщили о двух основных концепциях золь-гель процесса 58 . Согласно первой концепции, гель образуется из-за конденсации частично гидролизованных частиц в трехмерную полимерную сеть. А во второй концепции свойства геля существенно зависят от условий синтеза. Поверхностно-активные вещества, использованные в данном исследовании, сыграли решающую роль в разработке катализаторов, создав хорошую пористую структуру, которая способствовала высокой удельной поверхности 2 .На рисунке 8 показаны возможные пути шаблонов Pluronic P123 и CTAB для формирования наночастиц ZrO 2 . И CTAB, и Pluronic P123 хорошо диспергированы в полярных растворителях (особенно в воде) с образованием мицелл, которые состоят из гидрофильной головки (расположение наружу) и гидрофобного хвоста (рис. 8а). При добавлении в раствор шаблона цирконил-предшественник собирается и прикрепляется к гидрофильной головке, как показано на рис. 8b. Раствор предшественника цирконила имеет естественную кислотность (pH <1).В кислых условиях гидролиз происходит быстрее, чем конденсация, и в результате образуется слаборазветвленный гель 59 . Добавление аммиака увеличивает pH раствора. На этом этапе конденсация ускоряется по сравнению с гидролизом, образуя жесткий гель. При перемешивании предшественник цирконила равномерно растекается в матричном растворе. Внутреннее давление создается, когда гель переносится в автоклав, где применяемая термообработка вытесняет мицеллы и предотвращает агрегацию циркониловых частиц, что способствует увеличению площади поверхности 7 .Наконец, удаление темплата при 500 ° C дает большое количество пор с большим объемом пор ZrO 2 (рис. 8c).
Рис. 8Возможные пути шаблонов Pluronic P123 и CTAB для образования катализаторов ZrO 2 .
Реакционный механизм производства биодизеля с использованием бифункционального кислотно-основного катализатора
При гетерогенном катализе адсорбция реагентов и десорбция продуктов происходят на поверхности катализатора.Следовательно, как кислотные, так и основные свойства катализатора важны для достижения одновременной этерификации и переэтерификации сырья с высоким содержанием FFA. На рисунке 9 показан возможный механизм одновременных реакций с использованием бифункционального катализатора. Пять стадий бифункциональной каталитической реакции включают (1) диффузию реагентов, (2) физическую адсорбцию реагентов, (3) поверхностную реакцию, (4) десорбцию продуктов и (5) диффузию продуктов. На первом этапе карбонильная группа FFA (сложный эфир жирной кислоты) и метанол диффундируют из основной массы раствора к внутренней поверхности катализатора через поры катализатора.На втором этапе карбонильная группа FFA адсорбируется на кислотном участке (этерификация), а молекула метанола адсорбируется на основном участке (переэтерификация) на поверхности катализатора, тем самым образуя карбокатион и анион кислорода соответственно. На третьей стадии тетраэдрический промежуточный продукт образуется посредством нуклеофильной атаки спирта на сложные эфиры как по кислотным, так и по основным центрам. На четвертом этапе гидроксильная группа отвлекается от тетраэдрического промежуточного соединения с образованием одной молекулы воды и одной молекулы FAME на кислотном участке.В основном сайте связь C – O разрывается с образованием одной молекулы FAME и глицерина как побочных продуктов. По ходу реакции продукты десорбируются с поверхности катализатора. На заключительном этапе все продукты диффундируют с поверхности катализатора в основную массу раствора, и все этапы повторяются для расщепления каждого сложного эфира жирной кислоты 19,60 .
Рисунок 9Механизм реакции производства биодизеля с использованием бифункционального кислотно-основного катализатора.
Кислотно-основные реакции — определение и классификация
Изображение: «Мыла — это слабые основания, образующиеся в результате реакции жирных кислот с гидроксидом натрия или гидроксидом калия» от Phanton.Лицензия: Public Domain
Кислотность
Кислотность раствора — это концентрация H + (протонов) [или h4O +] в воде. Кислота — это вещество, которое теряет H +. База — это вещество, которое получает дополнительный H +.
AH + B → A — + BH +
Когда кислота (AH) реагирует с основанием (B), переносится H +. Вода — это амфотерная молекула, которая может действовать как кислота или основание.
HA + H 2 O → A — + H 3 O +
B + H 2 O → BH + + OH —
Вода также может самоионизироваться:
2H 2 O → HO — + H 3 O +
Поскольку большинство кислотно-основных реакций протекает в воде, вода, как правило, не включается в уравнения:
HA → A — + H +
B + H + → BH +
Кислотно-основные определения
Три рабочих определения кислот и оснований включают определения Аррениуса, Бренстеда-Лоури и Льюиса.
Определение АррениусаСогласно определению Аррениуса , кислоты — это соединения, которые диссоциируют в воде с образованием ионов H +, а основания — это соединения, которые диссоциируют в воде с образованием ионов OH–. Примеры соединений, удовлетворяющих определению Аррениуса, включают галогеноводородные кислоты и гидроксиды металлов. Когда эти 2 группы соединений диссоциируют в воде, галогеноводородные кислоты и гидроксиды металлов производят ионы H + или OH–, в зависимости от того, является ли соединение основанием или кислотой.
HCI (водн.) → H + (водн.) + CI — (водн.) (кислота)
NaOH (водн.) → Na + + OH — (водн.) (основание)
Аммиак (Nh4) — это основное соединение, которое не удовлетворяет определению Аррениуса. Nh4 не может диссоциировать в воде с образованием ионов OH–, поскольку Nh4 не содержит группу -OH. Nh4 может генерировать OH–, реагируя с водой. Одно из ограничений определения Аррениуса состоит в том, что определение Аррениуса не рассматривает растворитель как реагент.
HCI (водн.) + H 2 O (л) → H 3 O + (водн.) + CI — (водн.) (кислота)
NH 3 (водн.) + H 2 O (л) ⇔ NH 4 + (водн.) + OH — (водн.) (базовый)
Разрешение по Бронстеду-ЛоуриBronsted-Lowry определяет кислоту как донор протонов и основание как акцептор протонов.Молекулы воды отдают и принимают протон и участвуют не только в качестве растворителя, но и в качестве реагента.
Определение ЛьюисаОпределение Bronsted-Lowry не объясняет кислотность катионов металлов. Поэтому было разработано определение Льюиса , которое фокусируется на электронах атомов, участвующих в реакции.
Согласно определению Льюиса, кислота является акцептором электронной пары, а основание — донором электронной пары.Определение Льюиса правильно включает кислотность катионов. Поскольку катионы заряжены положительно, катионы проявляют более высокую тенденцию принимать электронную пару. Определение Льюиса считается наиболее обобщенным подходом, поскольку определение Льюиса является более всеобъемлющим.
Подходящим примером является Al (OH) 3, который считается амфотерным веществом. Амфотерные вещества — это соединения, которые действуют как кислоты или основания. Атом алюминия в структуре, несущий только 6 электронов, все еще может вместить электронную пару, поэтому атом алюминия может действовать как кислота.У атома кислорода есть электронные пары, которые он может отдать, и поэтому он действует как основание в реакции.
Al (OH) 3 + 3HCI → 3H 3 O + + AlCl 3 (основание)
Al (OH) 3 + OH — → Al (OH) 4 — (Кислота)
Равновесие
Многие реакции обратимы, например,
HA (кислота) → H + + A — (вперед)
H + + A — (сопряженное основание) → HA (назад)
Укороченная реакция:
HA ⇔ H + + A —
Со временем скорость прямой реакции такая же, как и обратной.Концентрации реагентов и продуктов остаются стабильными при равновесии .
Следовательно, реакция A + B → C + D может быть преобразована в состоянии равновесия в K = [C] [D] / [A] [B], где K — константа равновесия .
Если K велик, реакция дает продукты с небольшими количествами остаточных реагентов. Если K мало, генерируются только небольшие количества продуктов. В случае диссоциации кислоты в воде
HA → H + + A —
K a = [H + ] [A –] / [HA]
Константа диссоциации кислоты Ka.
Если K велик, HA будет почти полностью диссоциировать с образованием большого количества ионов [H +]. Такие кислоты описаны как сильные кислоты , например, H 2 SO 4 , HCl, и HNO 3.
Кислоты, которые диссоциируют лишь в небольшой степени, называются слабыми кислотами (малый Ka), например, карбоновые кислоты:
например этановая кислота имеет формулу CH 3 CO 2 H и K a = 1.8 х 10 -5
Базы
Основания могут принимать протоны.
B (основание) + H 2 O ⇔ BH + (конъюгированная кислота) + OH —
Как и в случае с кислотами, сила основания определяется константой равновесия (Kb) в указанной выше реакции, что также облегчает определение pKb. Как правило, сила основания представлена pKa в зависимости от реакции конъюгированной кислоты.
BH + → B + H +
pK a = -log [B] [H + ] / [BH + ]
- Слабые основания показывают низкие значения pKa.
- Прочные основания демонстрируют высокие значения pKa.
Для любой кислоты или основания pK a + pK b = 14,0
Сила кислот и оснований
Кислоты и основания могут быть классифицированы как сильные, или слабые, в зависимости от степени диссоциации в воде.Сильные кислоты и основания полностью диссоциируют в воде с образованием стехиометрических количеств ионов H + и OH– соответственно. Слабые кислоты и основания производят аналогичные ионы, но полностью не диссоциируют в воде. Следующий список представляет собой простую классификацию соединений на сильные и слабые кислоты и основания.
Сильные кислотыСильные кислоты включают галогеноводородные кислоты, такие как HCl, HBr и HI. Оксокислоты — это те кислоты, в которых количество атомов O превышает количество ионизируемых протонов на 2 или более, например h3SO4, HNO3 и HClO4.
Слабые кислоты- Галогеноводородная кислота, например HF
- Кислоты, в которых H не связывается с O или галогеном, такие как HCN и h3S.
- Оксокислоты, в которых количество атомов O равно или превышает количество ионизируемых протонов на один, например HClO. HNO2 и h4PO4.
- Карбоновые кислоты
Водорастворимые соединения, содержащие ионы O2- или OH–, являются сильными основаниями. Обычно к сильным основаниям относятся катионы наиболее активных металлов:
- M2O или MOH, где M = металл группы 1A (Li, K, Na, Rb или Cs)
- MO или M (OH) 2, где M = металл группы 2A (Ca, Sr или Ba)
Многие соединения с богатым электронами атомом азота являются слабыми основаниями (ни одно из них не является основанием Аррениуса).Структура обычно содержит атом азота с неподеленной электронной парой:
- Аммиак
- Амины (общая формула RNh3, R2NH или R3N)
Кислоты в воде
Добавление кислоты или основания к воде [H +] изменяет кислотность раствора, которая выражается значением pH: pH = -log [H + ].
Чистая вода имеет pH 7.
Примечание: Кислые растворы содержат более высокие уровни [H +] и pH <7.Основные растворы содержат более низкие концентрации [H +] и pH> 7.
Кислотно-щелочной расчетВажными количественными понятиями в кислотно-основных расчетах являются pH, pOH, Kw, Ka и Kb:
- pH: логорифмическая шкала, определяющая, насколько кислотным или основным является раствор. Низкий pH означает, что в нем больше свободных протонов, и он кислый, а более высокий pH означает, что имеется больше свободных гидроксид-ионов и больше основного.
- pOH: относится к шкале pH, но рассчитывается на основе концентрации гидроксид-иона, а не концентрации протонов.Это противоположно шкале pH, так что низкий pOH является основным, а высокий pOH — кислотным.
- Kw: это называется константой ионизации воды и определяется уравнением: Kw = [h4O +] [OH -] = 10-14
- Ka / Kb: Ka известна как константа кислотной диссоциации и может быть рассчитана несколькими различными способами. Kb — это базовый коррелят Ка, известный как константа диссоциации оснований.
Сильные кислоты и основания демонстрируют полную диссоциацию, поэтому ионы [H +] и [OH–] подставляются в уравнения для pH и pOH.Слабые кислоты и основания демонстрируют неполную диссоциацию из-за обратимого характера реакции. Например, диссоциация слабого основного аммиака описывается следующей реакцией:
NH 3 + H 2 O ⇔ NH 4 + + OH —
Таким образом, не все молекулы Nh4 превращаются в гидроксид-ион. Следовательно, концентрацию гидроксида нельзя считать равной концентрации основания.Чтобы получить концентрацию гидроксид-иона, можно рассчитать константу равновесия для реакции.
Полученное значение действительно, если процент диссоциации соединения ≤ 5%.
Примеры проблем
Проблема с сильной кислотой
Какие значения pH и pOH у 0,15 M HNO 3 при 25,0 ° C (77,0 ° F)?
HNO 3 (водн.) + H 2 O (л) → H 3 O + (водн.) + NO 3 — (водн.)
Примечание: HNO 3 — сильная кислота, поэтому происходит полная ионизация.Это означает, что на каждый моль HNO 3 образуется один моль H 3 O + .
[H 3 O + ] = [HNO 3 ] = 0,15 M
pH = –log [H 3 O + ] = –log [0,15] = 0,82
pOH = 14 — pH = 14 — 0,82 = 13,18
Проблема сильного основания
Каковы pH и pOH у 0,15 M Ca (OH) 2 при 25,0 ° C (77,0 ° F)?
Ca (OH) 2 (с) → 2OH — (водн.) + Ca 2+ (водн.)
Примечание: Ca (OH) 2 — сильное основание, поэтому происходит полная ионизация.Это означает, что на каждый моль Ca (OH) 2 образуется 2 моля OH — .
[OH — ] = 2 [Ca (OH) 2 ] = 2 [0,15 M] = 0,30 M
pOH = –log [OH — ] = –log [0,30] = 0,52
pH = 14 — pOH = 14 — 0,52 = 13,48
Проблема слабой кислоты
Каковы [H + ] и [OH — ] 0,15 M CH 3 COOH при 25 ° C? Каков процент диссоциации раствора (K a = 1.8 х 10 -5 )?
CH 3 COOH (водн.) + H 2 O (л) ⇔ H 3 O + (водн.) + CH 3 COO — (водн.)
Примечание: CH 3 COOH — слабая кислота, поэтому происходит неполная ионизация. Это означает, что не весь CH 3 COOH превращается в его сопряженное основание. Поскольку имеет место обратимая реакция, может быть установлено равновесие, и поэтому может быть использован метод ICE.
CH 3 COOH (водн.) + H 2 O (л) ⇔ H 3 O + (водн.) + CH 3 COO — (водн.)
I 0,15 M 0 0
C -x + x + x
E 0,15 — x x x
Примечание: Используйте квадратное уравнение, чтобы найти x.
x = [H 3 O +] = 1,64 x 10 -3 M
pH = –log [H 3 O + ] = –log [1,64 x 10 -3 ] = 2,78
pH = 14 — pOH = 14 — 2,78 = 11,22
Буферы — это растворы, устойчивые к изменениям pH, поскольку буферный раствор насыщен кислотными и основными ионами, которые могут легко реагировать с добавленным основанием или кислотой соответственно. Основным требованием для получения буферного раствора является то, что кислотные и основные компоненты буферной системы не должны нейтрализовать друг друга, что может быть достигнуто только при использовании слабой кислоты или основания с конъюгатом.Например, если рассматривается буфер уксусной кислоты и ацетата, два компонента не нейтрализуют друг друга.
CH 3 COOH + CH 3 COO — → CH 3 COOH + CH 3 COO —
Во время указанной выше реакции «нейтрализация » , продукты все еще представляют собой сопряженную кислотно-основную пару. Добавление небольших количеств кислоты к буферной системе уксусная кислота-ацетат запускает реакцию с ацетатным компонентом, который обладает основными свойствами, с образованием конъюгированной кислоты.Однако, если к системе добавляются небольшие количества основания, компонент уксусной кислоты реагирует с образованием основания конъюгата.
Уравнение Хендерсона-Хассельбаха
Уравнение Хендерсона-Хассельбаха используется для определения pH буферных растворов. Это уравнение получено из константы равновесия, выраженной для диссоциации кислоты в воде. Например, для буфера уксусная кислота-ацетат реакция диссоциации уксусной кислоты выражается как:
CH 3 COOH ⇔ H + + CH 3 COO —
Таким образом, если в 1 л буферного раствора содержится 0.10 М Ch4COOH и 0,01 М NaCh4COO, pH раствора равен 3,74.
Эффективность буфера по сопротивлению изменениям pH известна как буферная емкость. Буферная емкость формально определяется как количество сильной кислоты или основания в граммах-эквивалентах, которое необходимо добавить к 1 литру раствора, чтобы изменить pH на одну единицу.
Одним из распространенных примеров буферного раствора является кровь человека . Образцы крови человека поддерживают pH 7,4. Значительные изменения pH крови могут вызывать такие состояния, как ацидоз (pH <7.4) или алкалоз (pH> 7,4). Буферные растворы важны для людей, потому что определенные метаболические реакции происходят только при некоторых значениях pH раствора.
Вода в качестве буфераВода не имеет буферной емкости:
Примечание: Забуференный раствор поддерживает pH в пределах нескольких сотых единицы pH после добавления аналогичных количеств кислоты или основания.
.
 А. учитель химии, МБОУ Одинцовская гимназия № 13, Московская область
А. учитель химии, МБОУ Одинцовская гимназия № 13, Московская область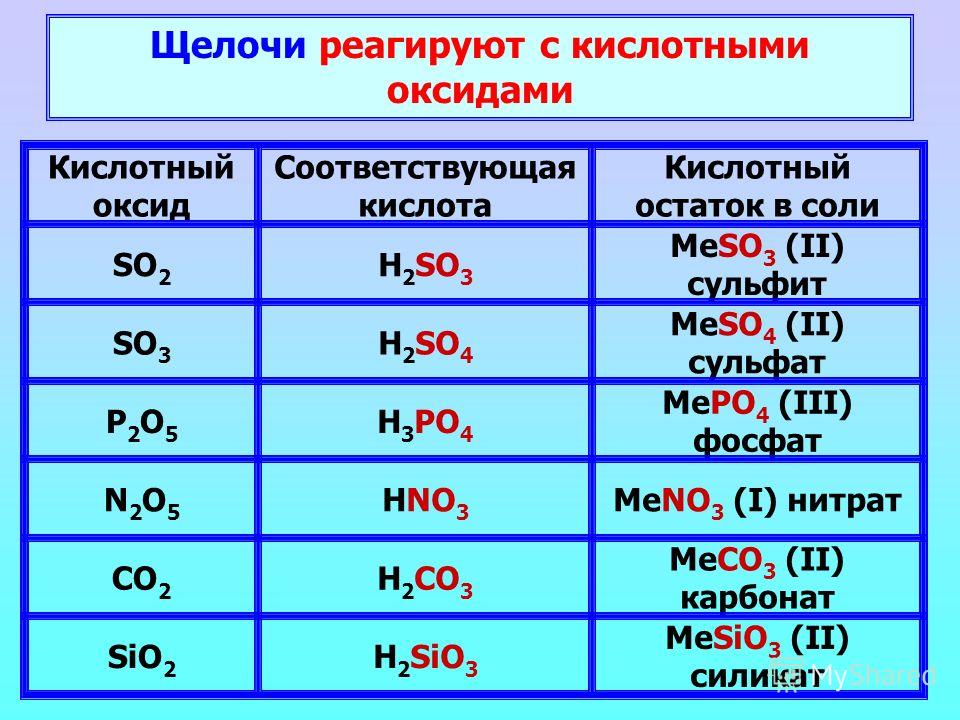 Оксидов
Оксидов Fe(OH)3
Fe(OH)3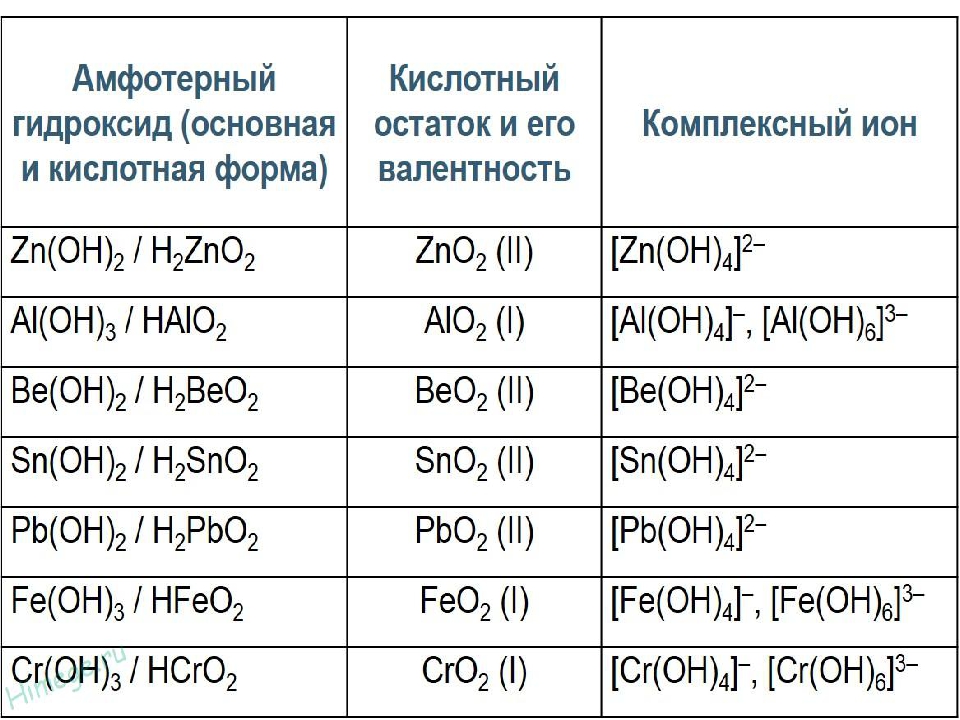 Zn(OH)2
Zn(OH)2 KOH
KOH CsOH
CsOH Fe(OH)2
Fe(OH)2 LiOH
LiOH Al + Zn(OH)2
Al + Zn(OH)2 C
C
Leave A Comment