Фосфорная кислота и её соли — урок. Химия, 8–9 класс.
Фосфорная кислота
Фосфорная (ортофосфорная) кислота h4PO4 представляет собой твёрдое прозрачное кристаллическое вещество.
Твёрдая фосфорная кислота
Она очень хорошо растворяется в воде (смешивается в любых соотношениях) и обычно применяется в виде растворов.
В водных растворах фосфорная кислота диссоциирует ступенчато:
h4PO4⇄H++h3PO4−,
h3PO4−⇄H++HPO42−,
HPO42−⇄H++PO43−.
Диссоциация на каждой следующей ступени протекает слабее, чем на предыдущей. Полностью на ионы фосфорная кислота не распадается и относится к кислотам средней силы. Она менее активна в химических реакциях по сравнению с серной, азотной, соляной кислотами.
Фосфорная кислота вступает в реакции:
- с металлами, расположенными в ряду активности до водорода:
2h4PO4+3Ca=Ca3(PO4)2+3h3↑;
- с основными оксидами:
2h4PO4+3K2O=2K3PO4+3h3O;
- с основаниями:
h4PO4+3NaOH=Na3PO4+3h3O;
- с солями, если выделяется газ или осадок:
2h4PO4+3CaCO3=Ca3(PO4)2+3h3O+3CO2↑;
h4PO4+3Nh4=(Nh5)3PO4.
В реакциях могут образовываться не только средние соли фосфаты с кислотным остатком PO43−, но и кислые: гидрофосфаты (HPO42−) и дигидрофосфаты (h3PO4−). В названиях кислых солей приставка гидро- обозначает атом водорода, а дигидро- — два атома водорода. Состав соли зависит от мольных соотношений кислоты и реагирующего с ней вещества:
h4PO4+2NaOH=Na2HPO4+2h3O,
h4PO4+NaOH=Nah3PO4+h3O,
h4PO4+2Nh4=(Nh5)2HPO4,
h4PO4+Nh4=Nh5h3PO4.
Соли фосфорной кислоты
Средние соли фосфорной кислоты фосфаты (например, Ca3(PO4)2) нерастворимы в воде, кроме фосфатов щелочных металлов. Характерную жёлтую окраску имеет фосфат серебра. Это свойство используется для качественного определения растворимых фосфатов. При добавлении к ним раствора нитрата серебра выпадает жёлтый осадок, растворимый в азотной кислоте:
3Ag++PO43−=Ag3PO4↓.

Большинство дигидрофосфатов (Cah3PO4 и др.) растворяется в воде хорошо. Гидрофосфаты (Ca(HPO4)2 и др.) растворяются лучше, чем фосфаты, но хуже по сравнению с дигидрофосфатами.
Фосфорная кислота используется:
- для производства минеральных удобрений,
- в качестве пищевой добавки в напитках,
- в производстве синтетических моющих средств,
- на производстве кормовых добавок для животных.
Соли фосфорной кислоты применяются в качестве минеральных удобрений.

Фосфорная кислота ⚗️ структурная формула, характеристика, химические и физические свойства, получение и применение, с какими веществами реагирует
Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой h4PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 0 | 1,633 |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации h4PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO43- и молекулами воды h3O.
Химические свойства
Растворы h4PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- h4PO4 = H+ + h3PO4-.
- h3PO4— = H+ + HPO42-.
- HPO42- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.
При комнатной температуре h4PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2h4PO4 = Al3 (PO4)2 + 3h3. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + h4PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2h4PO4 = Mg3 (PO4)2 + 3h3O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики.
- 2h4PO4 = h3O + h5P2O7;
- h5P2O7 = h3O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: h4PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2h3O = 3h4PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4h4PO3 = 3h4PO4 + Ph4.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6h3O = 4h4PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2h3O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5h3O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода h3SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует h4PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной h4PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Конспект «Ортофосфорная кислота. Фосфаты» — УчительPRO
Ортофосфорная кислота. Фосфаты
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:

Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
- а) с основаниями:

- б) с основными и амфотерными оксидами:

- в) с солями более слабых и летучих кислот:

В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2O
или
КОН + H3РO4 = КH2РO4 + H2O
Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4+) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4+, n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:

Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО43–.
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:

Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:

Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Следующая тема: «».
Фосфор. Химия фосфора и его соединений
1. Положение фосфора в периодической системе химических элементов
2. Строение атома фосфора
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения фосфора
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с кислородом
7.1.2. Взаимодействие с галогенами
7.1.3. Взаимодействие с серой
7.1.4. Взаимодействие с металлами
7.1.5. Взаимодействие с активными металлами
7.1.6. Взаимодействие с водородом
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с окислителями
7.2.2. Взаимодействие с щелочами
Фосфин
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Основные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
Фосфиды
Способы получения фосфидов
Химические свойства фосфидов
Оксиды фосфора
1. Оксид фосфора (III)
2. Оксид фосфора (V)
Фосфорная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация фосфорной кислоты
3.2. Кислотные свойства фосфорной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с металлами
3.6. Качественная реакция на фосфат-ионы
Фосфористая кислота
Соли фосфорной кислоты
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
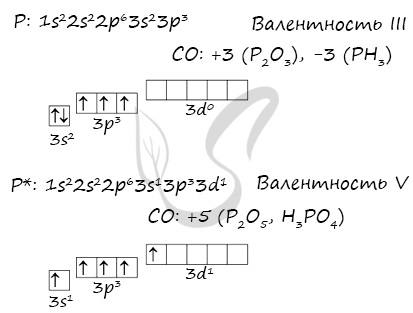
Электронная конфигурация фосфора в основном состоянии:

Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:

При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.


Белый фосфор:

Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):

Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.

Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.


Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.

Черный фосфор:

Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.

В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.

Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
Горение белого фосфора:

Горение красного фосфора:

1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
Фосфор реагирует с бромом:

1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 3H2SO4 → 2H3PO4 + 3SO2
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P2O5 + 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.

Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.

У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов.
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3.
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.

Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.

При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.

Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3

Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.

Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например, гидролизом хлорида фосфора (III):
PCl3 + 3H2O → H3PO3 + 3HCl
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Р2О3 + 3Н2О → 2Н3РО3
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например, при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
H3PO3 + 2NaOH → Na2HPO3 + 2H2O
2. При нагревании фосфористая кислота разлагается на фосфин (Р-3) и фосфорную кислоту (Р+5):
4H3PO3 → 3H3PO4 + PH3
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства.
Например, H3PO3 окисляется перманганатом калия в кислой среде:
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
Еще пример: фосфористая кислота окисляется соединениями ртути (II):
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Фосфат кальция растворяется под действием серной кислоты:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
Фосфат кальция также восстанавливается алюминием при сплавлении:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
K2HPO4 + H3PO4 → 2KH2PO4
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
K2HPO4 + KOH → K3PO4 + H2O
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой.
Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
Фосфор, подготовка к ЕГЭ по химии
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*SiO2 — фосфорит
- 3Ca3(PO4)2*Ca(F,Cl,OH)2 — апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (соли — фосфиты PO33-)
- Фосфорноватистая — H3PO2 (соли гипофосфиты — PO23- )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
I. Оксид фосфора (V) – фосфорный ангидрид
 Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
II. Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:

Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства:
|
Свойства, общие с другими кислотами |
Специфические свойства |
|
1. Водный раствор кислоты изменяет окраску индикаторов на красный: Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4— (дигидроортофосфат-ион) H2PO4— ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4= соль + Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4+ H2O или H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. Реагирует с солями слабых кислот: 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ |
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2H3PO4 (t˚C) → H2O + H4P2O7 H4P2O7 (t˚C)→ H2O + 2HPO3 2. Качественная реакция на PO43- — фосфат ион Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
|
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
III. Минеральные удобрения
|
Минеральные удобрения — неорганические соединения, содержащие необходимые для растений элементы питания. В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применениеминеральных удобрений – один из основных приемов интенсивного земледелия. С помощью минеральных удобренийможно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель. Для внесения минеральных удобрений используются туковые сеялки. Установлено, что в состав растений входит около 70 элементов. Некоторые из них – макроэлементы – необходимы растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах. 1. Макроэлементы – углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций. 2. Ммкроэлементы – железо, марганец, бор , медь, цинк, молибден, кобальт и др. Тир важнейших элемента – азот, фосфор и калий – необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах. При недостатке азота задерживается образование зелёной массы, растения плохо растут, их листья желтеют. Азотные удобрения необходимы растениям в весенний период. Фосфор необходим при росте и развитии репродуктивных органов растений (цветков, плодов). Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов (сахара – в сахарной свекле, крахмала в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание. Железо, марганец, бор и другие микроэлементы играют определённую роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор, и калий.Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла. Растения поглощают макро – и микроэлементы из почвенного раствора в виде ионов (NH4+, NO3—,K+ и других) Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, минеральные удобренияподразделяют на простые и комплексные. 1) Простые минеральные удобрения содержат один какой-либо элемент питания (P,K, N). К ним относятся фосфорные, азотные, калийные и микроудобрения. 2) Комплексные минеральные удобрения содержат одновременно два или более основных питательных элемента. |
IV. Тренажеры
Тренажёр №1. «Свойства фосфора и его соединений»
Тренажёр №2. Тестовые задания по теме: «Азот и фосфор, их соединения»
V. Закрепление
Задание №1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
Задание №2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
Задание №3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
Задание №4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
Фосфорная кислота и ее свойства

Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Учитель: Жасымбекова А.Р.
2 слайд Описание слайда:
Описание слайда:Тема урока: Фосфорная кислота и ее свойства.
3 слайд Описание слайда:
Описание слайда:Сегодня на уроке мы должны: Образовательные: Изучить физические и химические свойства фосфорной кислоты через проведение химического эксперимента; На основе Интернет-ресурсов, специальной литературы проиллюстрировать применение и получение фосфорной кислоты. развивающие: Пробудить интерес к самостоятельному поиску информации в Интернете, специальной литературе; Выразить свое отношение к проблемам экологии при промышленном получении фосфорной кислоты и ее применение. воспитательные: На основе материала данной темы, эксперимента умения обучающихся наблюдать, сравнивать, делать выводы.
4 слайд Описание слайда:
Описание слайда:Сегодня на уроке мы должны: План: 1. Молекулярная формула фосфорной кислоты. 2. Получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение.
5 слайд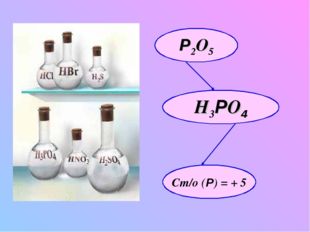 Описание слайда:
Описание слайда:Р2O5 h4РO4 Ст/о (Р) = + 5
6 слайд Описание слайда:
Описание слайда:Молекулярная формула фосфорной кислоты и физические свойства: твердое бесцветное, кристаллическое вещество, хорошо растворимое в воде в любых соотношениях; Сильная кислота – сильный окислитель (ст/о = +5) Mr(h4РO4) = 98 2h4 РO4 h3O +Н4Р2O7
7 слайд Описание слайда:
Описание слайда:Производство фосфорной кислоты. а) Горение фосфора в ложечке, которую вносят в колбу. 2Р+5О2 = Р2О5 После заполнения колбы дымом частичек оксида фосфора, приливают немного воды до полного растворения Р2O5. Р2O5 +3 Н2О = 2Н3РО4 Для доказательства образования кислоты в колбе, добавляем несколько капель индикатора – лакмуса или метилового оранжевого. Р2O5 является кислотным. б) Взаимодействием природной соли с серной кислоты при нагревании Са3(РO4)2 +3 Н2SО4 = 2Н3РО4 + 3 СаSО4
8 слайд Описание слайда:
Описание слайда:Химические свойства общие с другими кислотами: Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени: I) Н3РО4 = Н+ + Н2РО42- II) Н2РО4- = Н+ + НРО42- III) НРО42- = Н+ + РО4 3- 2. Взаимодействие с металлами, расположенными в вытеснительном ряду до водорода: 3 Nа + Н3РО4 = 3Н2 + Nа3РО4 3. Взаимодействие с оксидами металлов. Оксид фосфора растворяется. Напишите уравнение реакции. 3 CaO + 2 Н3РО4 = 3 Н2O + Ca 3(РО4 )2 4. Взаимодействие с основаниями и аммиаком. 3 NaOH + Н3РО4 = 3Н2O + Na3РО4 5. Реагирует с солями: 3 Na2CO3 + 2Н3РО4 = 3Н2O + 3 CO2 + 2Na 3РО4
9 слайд Описание слайда:
Описание слайда:Специфические свойства фосфорной кислоты: 6 а) При нагревании постепенно превращается в метафосфорную кислоту 2Н3РО4 = Н4Р2О7 + Н2O Н4Р2О7 =2НРО3 + Н2O б) Качественная реакция на фосфорную кислоту нитрат серебра – появляется желтый осадок 3 AgNO3 + Н3РО4 = 3НNO3 + Ag3РО4 в) Играет большую роль в жизнедеятельности животных и растений. Входит в состав АТФ при разложении которой выделяется большое количество энергии
10 слайд Описание слайда:
Описание слайда:h4РO4
11 слайд Описание слайда:
Описание слайда:Выберите вещества с которыми будет реагировать фосфорная кислота: КОН, Си, К2SО3, СО2, NО? 2. Какому молекулярному уравнению реакций соответствует ионное уравнение? 2Н+ + SО3 2- = Н2О + SО2 а) КОН + Н3РО4, = К3РО4 + Н2О б) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО2 в) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО3 Закрепление знаний учащихся
12 слайд Описание слайда:
Описание слайда:Сегодня на уроке мы: 1. Вспомнили молекулярная формула фосфорной кислоты. 2. Рассмотрели получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение. Задание на дом: 28, стр.159 – 163; з. 2,7. Урок закончен. Всем огромное спасибо!

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВнеурочная деятельностьВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДБ-016450
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
Ортофосфорная кислота (h4PO4) [Фосфорная кислота]
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел для класса 12
- Классы
- CBSE Контрольный документ за предыдущий год
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к версии
- CBSE
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
Ортофосфорная кислота, 131 — Большая химическая энциклопедия
Представлено Абтуром Г. Вебером Дж. И Г. Б. Кингом. Проверено Лоуренсом Л. Кттиллом и Уилфордом Х. Томасом [Стр.101]Ортофосфорная кислота высокой степени чистоты может быть получена путем кристаллизации кислоты из концентрированных растворов. Эти растворы получают путем удаления воды из обычной сиропообразной фосфорной кислоты при низкой температуре и давлении. Эту концентрацию необходимо выполнять с осторожностью, поскольку неполное удаление воды приводит к [Стр.101]
Поместите 5 фунтов 85-процентной коммерческой сиропообразной ортофосфорной кислоты в круглодонную колбу 5-1., Оборудованную конденсатором и всасывающей колбой и расположенную, как показано на рис. 17, таким образом, чтобы воздух сушат проведением [Стр.101]
Чтобы кристаллизовать концентрированный остаток, затравливают кристаллом кислоты, полученным путем переохлаждения части концентрированной кислоты на ледяной бане. Температура должна поддерживаться на уровне около 30 ° C. на протяжении всей кристаллизации. [Стр.102]
После того, как примерно одна треть материала кристаллизовалась, слейте маточный раствор с кристаллов в безводной атмосфере.Чтобы получить очень сухую кислоту, необходима перекристаллизация. Высушите твердую кислоту, пропустив через кристаллы очень сухой воздух при низком давлении в течение нескольких дней. [Стр.102]
Фосфорная кислота. Коммерческая сиропообразная ортофосфорная кислота имеет пр. гр. 1-75 и содержит около 88 процентов h4PO4. Также продается около 100% кислоты. [Стр.189]
В 500 мл. Трехгорлая колба, снабженная термометром, герметичной мешалкой Гершберга и обратным холодильником, вместимостью 32-5 г.оксида фосфора и добавить 115-5 г. (67-5 мл.) 85% ортофосфорной кислоты (1). Когда перемешиваемая смесь остынет до комнатной температуры, ввести 166 г. йодида калия и 22-5 г. бидистиллированного 14-бутандиола (т.кип. 228-230 ° или 133-135 ° / 18 мм.). Смесь нагревают при перемешивании при 100-120 ° в течение 4 часов. Охлаждают перемешиваемую смесь до комнатной температуры и добавляют 75 мл. воды и 125 мл. эфира. Отделить эфирный слой, обесцветить его встряхиванием с 25 мл. 10%, раствор тиосульфата натрия, промыть 100 мл.холодного насыщенного раствора хлорида натрия и сушат безводным сульфатом магния. Удалите эфир мгновенной перегонкой (разделы 11, 13, сравните рис. II, 13, 4) на паровой бане и перегоните остаток из колбы Клайзена с фракционирующим боковым рычагом при пониженном давлении. Собирают 14-дииодбутан при 110 ° / 6 мм. выход 65 г. [Pg.284]
Ацетилтиофен Получают ацетилированием тиофена уксусным ангидридом в присутствии ортофосфорной кислоты … [Pg.837]
Растворимость в сиропообразной фосфорной кислоте.Этот тест следует проводить только в том случае, если соединение растворимо в концентрированной серной кислоте. Налейте 3 0 мл. 85% ортофосфорной кислоты в сухую пробирку и добавить 0 10 г. твердого вещества или 0-20 мл. жидкости. Если состав не растворяется сразу, взболтать некоторое время, но не кипятить. [Стр.1056]
Ортофосфорная кислота h4PO4 (или селенистая кислота h3Se03 … [Стр.221]
Фильтровальная кислота дигидратного процесса содержит 28–32% P2 5, обычно концентрированная до 40–45% P2 s при использовании в участок по производству удобрений.Для транспортировки кислота концентрируется до 52—54% P2 5, при этих концентрациях продукт представляет собой ортофосфорную кислоту [7664-38-2] … [Pg.225]
| Рис. 25. Технология трубчатого реактора TVA для получения основных суспензий марок 9-32-0 и 12-36-0 непосредственно из ортофосфорной кислоты мокрым способом. |  |
Сгущенное молоко — это жидкий продукт, полученный путем частичного удаления воды только из молока.Он имеет минимальное содержание молочного жира 7,5% мол. И минимальное содержание сухих веществ молока 25,0% мол. Сгущенное обезжиренное молоко — это продукт Hquid, получаемый путем частичного удаления воды только из обезжиренного молока. Он имеет минимальное содержание сухих веществ молока 20,0 мол.%. Сгущенное молоко с сахаром — это продукт, полученный путем частичного удаления воды из молока только с добавлением сахаров. Он имеет минимальное содержание молочного жира 8,0 мол.% И минимальное содержание сухих веществ молока 28,0 мол.%. Сгущенное молоко обезжиренное с сахаром — это продукт, получаемый путем частичного удаления воды только из обезжиренного молока с добавлением сахаров.Он имеет минимальное содержание сухих веществ молока 24,0% мол. AH может содержать пищевые добавки (qv) в качестве стабилизаторов в максимальных количествах, включая натриевые, калиевые и кальциевые соли соляной кислоты в концентрации 2000 мг / кг, отдельно лимонной кислоты, угольной кислоты, ортофосфорной кислоты и полифосфорной кислоты в концентрации 3000 мг / кг в комбинация, выраженная в виде безводных веществ, и каррагенин сгущенного молока может быть добавлен в количестве 150 мг / кг. [Pg.365]
| Рис. 1. Кривая титрования ортофосфорной кислоты в присутствии гидроксида натрия. |  |
Ортофосфатные соли обычно получают путем частичной или полной нейтрализации ортофосфорной кислоты.Диаграммы фазового равновесия особенно полезны для определения условий получения конкретных фосфатных солей. Свойства растворов ортофосфатных солей одновалентных катионов резко отличаются от свойств раствора поливалентных катионов, последние в большинстве случаев проявляют растворимость в растворе. Коммерческие фосфаты включают соли щелочных металлов, щелочноземельных металлов, тяжелых металлов, смешанных металлов и аммониевые соли фосфорной кислоты. Фосфаты натрия являются наиболее важными, за ними следуют соли кальция, аммония и калия.[Pg.331]
Гидролиз сульфидов фосфонов изучен количественно. Формируется ряд продуктов (таблица 6). В то время как сульфид фосфома (V) медленно реагирует с холодной водой, реакция протекает быстрее при нагревании с образованием в основном сероводорода и ортофосфорной кислоты h3PO4. При высоком pH P4S Q гидролизуется до смеси продуктов, содержащих тиофосфаты и сульфиды. [Стр.363]
H PO поэтому является более сильной кислотой, чем ортофосфорная кислота. Вторая константа диссоциации, pR 2> Th, третий водород не ионизируется… [Pg.373]
Эти прекурсоры получают реакцией дымящей азотной кислоты в избытке уксусного ангидрида при низких температурах с 2-фуранкарбоксальдегидом [98-01-1] (фурфурол) или его диацетатом (16) с последующей обработкой промежуточное соединение 2-ацетокси-2,5-дигидрофуран [63848-92-0] с пиридином (17). Этот процесс был улучшен за счет использования концентрированной азотной кислоты (18,19), а также каталитических количеств пентоксида, трихлорида и оксихлорида фосфома (20) и серной кислоты (21). Ортофосфорная кислота, -толуолсульфоновая кислота, мышьяковая кислота, борная кислота и стибоновая кислота, среди прочих, являются полезными добавками для нитрования фурфурола ацетилнитратом.Гидролиз диацетата 5-нитро-2-фуранкарбоксиальдегида [92-55-7] водными минеральными кислотами дает альдегид, который подходит для использования без дополнительной очистки. [Pg.460]
Производство 2-ацетилтиофенов включает прямую реакцию тиофена или алкилтиофена с уксусным ангидридом или ацетилхлоридом. В предпочтительных системах используется уксусный ангидрид и в качестве катализаторов используются йод или ортофосфорная кислота. Первый катализатор приводит к более простой переработке, но имеет недостаток, заключающийся в повышении уровня 3-изомера в продукте.Процессы, требующие очень низких уровней 3-изомера, работают с катализаторами, которые являются запатентованными, хотя уровни менее 0,5% не легко достигаются. [Стр.21]
h2C фосфат ортофосфорная кислота (AP + и Zn «+) кальцинированный оксид 2инк, кальцинированный оксид магния оксиды фосфатный фиксатор, основание … [Стр.472]
Смесь 85% ортофосфорной кислоты (4 части ) и метафосфорная кислота (1 часть) … [Pg.35]
Фосфор существует в виде белого и красного фосфора.Первый аллотроп может храниться в темноте при низких температурах, но в остальном превращается в более устойчивую красную форму.Белая форма представляет собой воскообразное, полупрозрачное, кристаллическое, высокотоксичное твердое вещество, возгоняющееся при комнатной температуре и воспламеняющееся на воздухе при 35 ° C, поэтому с ним обращаются под водой. Красная форма представляет собой красновато-фиолетовое кристаллическое твердое вещество, которое испаряется при нагревании при атмосферном давлении и конденсируется с образованием белого фосфора. Красная форма воспламеняется на воздухе при температуре 260 ° C. Оба они нерастворимы в воде, а белый фосфор может накапливаться под ней. Фосфор образует множество соединений, таких как фосфин, три- и пентагалогениды, три-, тетра- и пентаоксиды, оксикислоты, включая гипофосфористую, ортофосфорную и ортофосфорную кислоты.[Стр.31]
Химические обозначения — синонимы Ортофосфорная кислота Химическая формула h4PO4. [Pg.314]
Раствор для распыления Для сахаров [3] растворите 3 г 2-аминодифенила в 100 мл ледяной уксусной кислоты и добавьте 1,5 мл 85% ортофосфорной кислоты. [Стр.157]
Вещества Бифенил-2-иламин Серная кислота (25%) Этанол Ледяная уксусная кислота Ортофосфорная кислота (85%) … [Стр.157]
См. Другие страницы, где упоминается Ортофосфорная кислота, 131 : [Стр.309] [Pg.244] [Pg.243] [Pg.284] [Pg.284] [Pg.284] [Pg.540] [Pg.837] [Pg.707] [Pg.226] [Pg.238] [Pg.238] [Pg.239] [Pg.241] [Стр.159] [Pg.225] [Pg.366] [Pg.323] [Pg.324] [Pg.327] [Pg.472] [Стр.130] [Pg.401] [Pg.450] [Стр.154] [Pg.179]
См. Также в источнике #XX — [ Стр. 314 ]
См. Также в источнике #XX — [ Стр.3 , Стр.145 ]
См. Также в источнике №XX — [ Стр.153 , Стр.180 , Стр.254 , Стр.317 , Стр.328 , Стр.335 , Стр.365 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.581 ]
См. Также в источнике №XX — [ Стр.947 , Стр.948 ]
См. Также в источнике №XX — [ Стр.386 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр. 331 ]
См. Также в источнике №XX — [ Стр.158 ]
См. Также в источнике №XX — [ Стр.410 , Стр.412 , Стр.413 ]
См. Также в источнике №XX — [ Стр.30 , Стр.43 ]
См. Также в источнике №XX — [ Стр.906 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.450 ]
См. Также в источнике №XX — [ Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.530 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.848 ]
См. Также в источнике №XX — [ Стр.396 ]
См. Также в источнике №XX — [ Стр. 314 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.931 ]
См. Также в источнике №XX — [ Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.45 , Стр.300 ]
См. Также в источнике №XX — [ Стр. 330 ]
См. Также в источнике №XX — [ Стр.254 ]
См. Также в источнике №XX — [ Стр.231 ]
См. Также в источнике №XX — [ Стр.62 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.19 ]
См. Также в источнике №XX — [ Стр.3 , Стр.145 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.19 , Стр.20 ]
См. Также в источнике №XX — [ Стр.951 ]
См. Также в источнике №XX — [ Стр.108 ]
См. Также в источнике №XX — [ Стр.3 , Стр.4 , Стр.127 ]
См. Также в источнике №XX — [ Стр.935 ]
См. Также в источнике №XX — [ Стр.145 ]
См. Также в источнике №XX — [ Стр.1076 ]
.
Фосфорная кислота — использование и свойства фосфорной кислоты и ее применение
Фосфорная кислота, также называемая ортофосфорной кислотой, представляет собой слабую кислоту с химическим составом H 3 PO 4 . Ортофосфорная кислота называется фосфорной кислотой, что является термином ИЮПАК для этого соединения. Приставка орто- используется для дифференциации кислоты от связанных фосфорных кислот, известных как полифосфорные кислоты. Ортофосфорная кислота по своей природе нетоксичная кислота, которая в чистом виде является твердым веществом при комнатной температуре и давлении.Основанием конъюгата фосфорной кислоты является ион дигидрофосфата, H 2 PO -4 , который, в свою очередь, содержит сопряженное основание гидрофосфата, HPO 2 -4 , которое также содержит сопряженное основание фосфата , А / я 3 −4 . Фосфаты жизненно необходимы.
Наиболее распространенная форма фосфорной кислоты — 85% жидкий раствор; эти растворы бесцветны, нелетучие и без запаха. 85% раствор — густая жидкость, но все же переносимая.Несмотря на то, что фосфорная кислота не соответствует строгому значению сильной кислоты, 85% раствор достаточно кислый, чтобы быть жестким.
Физические свойства: Чистая фосфорная кислота представляет собой белое кристаллическое твердое вещество с температурой плавления 42,35 ° C. В менее плотном состоянии это бесцветная вязкая жидкость без запаха с плотностью 1,885 г / мл. Он нетоксичен и нелетучим по своей природе. Наиболее часто используемая концентрация фосфорной кислоты составляет 85% в воде H 2 O.
Химические свойства: фосфорная кислота имеет три кислых замещаемых атома водорода.Следовательно, он реагирует иначе, чем другие минеральные кислоты. Он может реагировать с основаниями с образованием трех классов солей путем замещения одного, двух или трех атомов водорода, таких как Na 2 HPO 4 , NaH 2 PO 4 и Na 3 PO 4 , отдельно.
При высоких температурах молекулы фосфорной кислоты могут реагировать вместе и объединяться с образованием димеров, триммеров и даже длинных полимерных цепей или серий, таких как метафосфорные кислоты и полифосфорные кислоты
2 H 3 PO 4 → H 4 P 2 O 7 (ангидрид фосфорной кислоты)
Производство
Фосфорную кислоту производят промышленным способом двумя основными способами.
Фторапатит является замещающим сырьем, в этом случае фторид удаляется как нерастворимое соединение Na2SiF6. Раствор фосфорной кислоты обычно содержит 25–35% P 2 O 5 (32–46% h4PO4). Его можно сконцентрировать для получения фосфорной кислоты товарной чистоты, которая содержит около 55–63% P 2 O 5 (76–86% H 3 PO 4 ). Дальнейшее удаление воды дает суперфосфорную кислоту с концентрацией P 2 O 5 выше 80% (что эквивалентно почти 100% H 3 PO 4 ).Сульфат кальция (гипс) образуется как побочный продукт и удаляется в виде фосфогипса.
Фосфорная кислота, полученная в результате обеих процедур, может быть дополнительно очищена путем удаления соединений мышьяка и других, возможно, токсичных примесей.
Мокрый процесс
Фосфорная кислота производится из фторапатита, называемого фосфоритом, 3Ca 3 (PO 4 ) 2 . CaF 2 , путем добавления концентрированной (95%) серной кислоты в цепь реакторов с хорошим перемешиванием.В результате образуется сульфат кальция (гипс) и фосфорная кислота, а также другие нерастворимые примеси. добавляется вода, и гипс удаляется фильтрацией вместе с другими нерастворимыми веществами (например, кремнеземом). Фторид, как H 2 SiF 6 , удаляется на следующей стадии испарением.
Хотя реакция происходит поэтапно, включая дигидрофосфат кальция, общую реакцию можно записать как:
Ca 3 (PO 4 ) 2 (s) + 3H 2 SO 3 (I ) —> 2H 3 PO 4 (I) + 3CaSO 4 (s)
С другой стороны, есть побочные реакции; например, с карбонатом кальция и фторидом кальция, присутствующими в породе:
3CaF 2 (s) + SiO 2 (s) + 3H 2 SO 4 —> H 2 SiF 6 (I) + 3CaSO 4 (s) + 2H 2 O (I)
CaCO 3 (s) + H 2 SO 4 (I) —> CaSO 4 (s) + H 2 O (I) + CO 2 (g)
Кремнефтористоводородная кислота является жизненно важным побочным продуктом при этом и при производстве фтороводорода.Его можно нейтрализовать гидроксидом натрия с получением гексфторосиликата натрия. Кислота также используется для производства фторида алюминия, который, в свою очередь, используется в производстве алюминия.
Структура горного кристалла образования сульфата кальция зависит от условий реакции. При 345-355 K основным выходом является дигидрат CaSO 4 .2H 2 O. При 368-388 K образуется полугидрат CaSO 4 ,1 / 2H 2 O.
Кальций сульфат отфильтровывают, а затем кислоту концентрируют примерно до 56% P 2 O 5 с использованием вакуумной перегонки.
Кислота, полученная при «мокром процессе», загрязнена, но ее можно использовать без дополнительной очистки для производства удобрений. Вместо этого его можно испарить до 70% P 2 O 5 , раствора, известного как суперфосфорная кислота, который используется прямо как жидкое удобрение.
Для производства промышленных фосфатов кислоту фильтруют экстракцией растворителем, например, метилизобутилкетоном (MIBK), в котором кислота до некоторой степени растворима и концентрируется с получением 68% содержания P 2 O 5 .Эта кислота может быть дополнительно очищена с использованием растворителей для извлечения ее из тяжелых металлов и дефторирована (испарением) для создания продукта пищевого качества.
Термический процесс
Сырьем для этой процедуры являются воздух и фосфор:
P 4 (I) + 5O 2 (г) —> 2P 2 O 5 (г )
Первоначально фосфор распыляется в нагреватель и сжигается на воздухе в течение примерно 1850-3050 К.
В большинстве методов используется влажный воздух, а некоторые включают добавление пара к фосфорному пламени для получения и сохранения пленки сжатые полифосфорные кислоты, защищающие башню горелки из нержавеющей стали.Продукты из башни горелки направляются непосредственно в башню гидратации (используется вода), где газообразный оксид фосфора абсорбируется в виде фосфорной кислоты:
.Формула фосфорной кислоты — применение, свойства, структура и формула фосфорной кислоты
Формула и структура: Химическая формула фосфорной кислоты: H 3 PO 4 . Его молекулярная формула записывается как H 3 O 4 P, а его молярная масса составляет 97,99 г / моль.
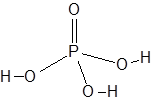
Центральный атом фосфора соединен с атомом кислорода двойной связью и с тремя гидроксильными (-ОН) группами одинарными связями. Таким образом, H 3 PO 4 может выделять до трех ионов H + .
Приготовление: Фосфорная кислота производится в промышленных масштабах мокрым способом, при котором серная кислота взаимодействует с апатитом (трикальцийфосфат).
Ca 5 (PO 4 ) 3 Cl + 5 H 2 SO 4 + 10 H 2 O → 3 H 3 PO 4 + 5 CaSO 4 · 2 H 2 O + HCl
Полученный раствор фосфорной кислоты содержит только около 32-46% H 3 PO 4 , поэтому он затем концентрируется (выпариванием воды) для получения фосфорной кислоты более высоких концентраций.
Физические свойства: Чистая фосфорная кислота представляет собой белое кристаллическое твердое вещество с температурой плавления 42,35 ° C. В меньшей концентрации это бесцветная вязкая жидкость без запаха с плотностью 1,885 г / мл. Он нетоксичен и нелетуч. Наиболее распространенная концентрация фосфорной кислоты в воде составляет 85%.
Химические свойства: Фосфорная кислота имеет три кислых замещаемых атома водорода. Таким образом, он реагирует иначе, чем другие минеральные кислоты. Он может реагировать с основаниями с образованием трех классов солей путем замены одного, двух или трех атомов H, таких как NaH 2 PO 4 , Na 2 HPO 4 и Na 3 PO 4 соответственно.
При высоких температурах молекулы фосфорной кислоты могут реагировать вместе и объединяться (с потерей молекулы воды) с образованием димеров, тримеров и даже длинных полимерных цепей, таких как полифосфорные кислоты и метафосфорные кислоты.
2 H 3 PO 4 → H 4 P 2 O 7 (- H 2 O)
Применение: Фосфорная кислота имеет множество применений. Из-за своей нетоксичной и умеренно кислой природы он используется в пищевых ароматизаторах, напитках, стоматологических продуктах, косметике и средствах по уходу за кожей.В промышленности он используется в основном при производстве фосфорных удобрений. Он также широко используется в качестве электролита, травителя, средства для удаления ржавчины, модификатора pH, бытового чистящего средства, диспергирующего средства и дезинфицирующего средства.
Опасность для здоровья / воздействие на здоровье: Фосфорная кислота не считается токсичной или опасной. В низких концентрациях он безопасен для кожи и даже для употребления в пищу (используется в продуктах питания, косметике и стоматологических продуктах). Однако в очень высоких концентрациях он вызывает коррозию и может вызвать ожоги кожи.
.
Leave A Comment