Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
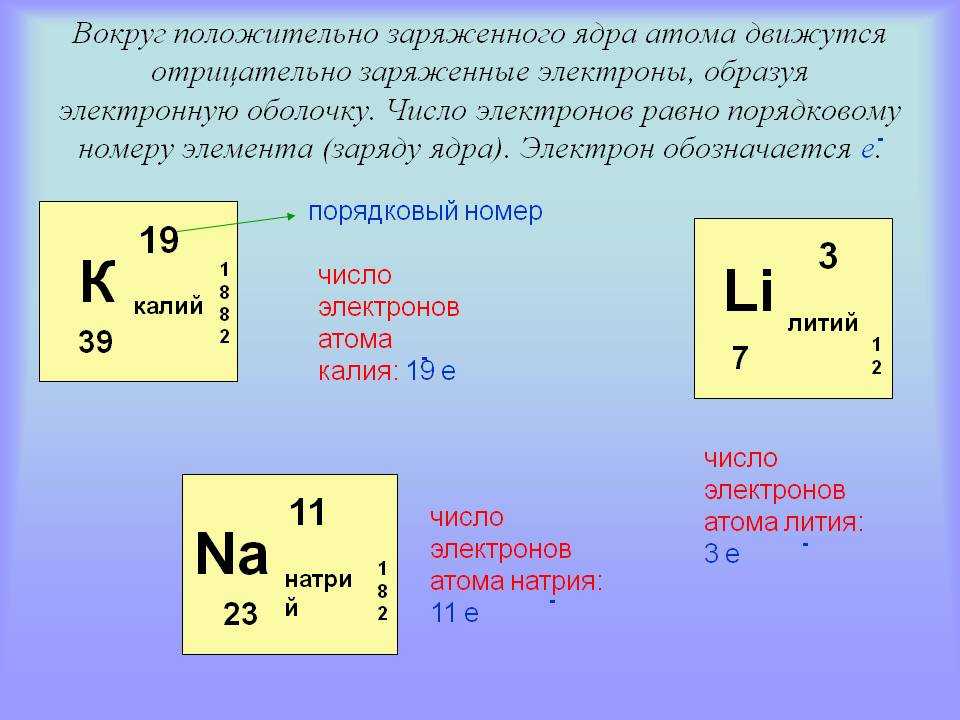
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 — 8 = 8 (в кислороде 8 нейтронов)
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 3 | 4 | 7,0160 |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | 28,9765 |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 15 | 16 | 30,9738 |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 22 | 39,9624 | |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46 |
20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 53,9396 | |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 34 | 62,9296 |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 33 | 42 | 74,9216 | |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 46 | 80,9163 |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 48 | 84,9118 | |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 53 | 94,9058 |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
8. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Контрольная работа.
Вариант №1.
1. Определите количество вещества сульфата натрия Na2SO4, если его масса равна 49,7 г.
2. Найти простейшую формулу вещества, в состав которого входят Н, C, О и N в соотношении 1 : 3 :4 : 7 по массе.
3. Определите число протонов и электронов в атомах железа и ртути.
4. Температуры кипения BF3, BC13, Вr3 и ВI3 соответственно равны 172, 286, 364, 483 К. Объяснить наблюдаемую закономерность.
5. Какой объем сероводорода, измеренный при нормальных условиях, прореагирует с раствором молекулярного иода массой 150 г, массовая доля I2 в котором составляет 2 %?
6. Сколько литров 2 н раствора гидроксида аммония можно приготовить из 1 л 24 %-ного раствора аммиака?
7.
При пропускании оксида углерода (IV)
через раствор гидроксида кальция
получили гидрокарбонат кальция массой
8,1 г.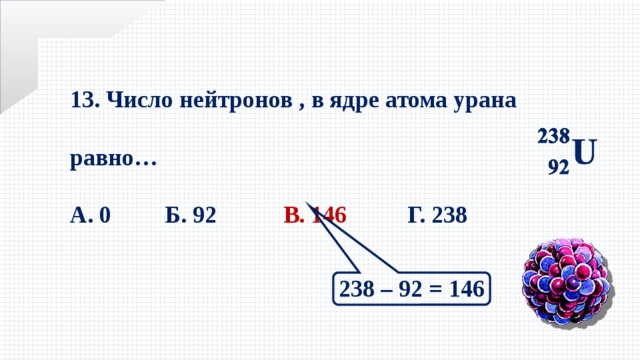 Определите объем оксида углерода
(IV),
измеренный при нормальных условиях,
который был пропущен через раствор.
Определите объем оксида углерода
(IV),
измеренный при нормальных условиях,
который был пропущен через раствор.
8. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al2(SO4)3 Al(OH)3 Al2O3 AlC13 Al(OH)3
Контрольная работа.
Вариант №2.
1. Масса образца сероводорода H2S равна 1,7 г. Вычислите число молекул сероводорода в данном образце.
2. Вычислите массовые доли каждого элемента в соединениях: 1) Fe(NO)3; 2) (NН4)2SO4; 3) Са3(РО4)2.
3. Определите число протонов и нейтронов в ядрах атомов следующих изотопов: а) 4Не; б) 24Mg; в) 37С1; г) 31Р; д) 209Bi.
4. Температуры кипения NF3,
PF3 и AsF3 соответственно равны 144, 178, 336 К. Объяснить
наблюдаемую
закономерность.
Температуры кипения NF3,
PF3 и AsF3 соответственно равны 144, 178, 336 К. Объяснить
наблюдаемую
закономерность.
5. При сгорании кальция массой 8 г количество выделившейся теплоты составило 127 кДж. Составьте термохимическое уравнение реакции.
6. Какой объём 1 М раствора карбоната натрия надо взять для приготовления 2 л 0,25 н раствора?
7. К раствору массой 200 г с массовой долей серной кислоты 8 % прилили раствор массой 50 г с массовой долей гидроксида натрия 12 %. Какова масса гидросульфата натрия, который выделили из полученного раствора?
8. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
NaOH NaHCO3 Na2CO3 Na2SO4 NaC1
Контрольная работа.
Вариант №3.
1.
Образец
вещества массой 6,6 г содержит 9,031022 молекул. Определите молярную массу
этого вещества.
Определите молярную массу
этого вещества.
2. Какой объем воздуха (содержащего 21% кислорода по объёму) потребуется для сжигания 1 м3 газа следующего объемного состава: 45% Н2, 40% СН4, 5% СО, 5% С2Н4 и 5% негорючих примесей?
3. Изотоп некоторого элемента имеет 10 нейтронов в составе ядра атома и атомную массу 19. Определите, что это за элемент.
4. К2СО3 плавится при 890 °С без разложения, Ag2СОз разлагается уже при 220°С. Объяснить указанное различие.
5. Железо, массой 7 г сожгли в хлоре, получив хлорид железа (III). При этом количество выделившейся теплоты составило 50 кДж. Напишите термохимическое уравнение данной реакции.
6. Сколько миллилитров 0,1 н раствора серной кислоты можно приготовить из 200 мл 20 %-ного раствора H2SO4 (плотность раствора 1,145 г/мл)?
7. Какая масса раствора с массовой долей
гидроксида натрия 4 % потребуется для
полной нейтрализации соляной кислоты
массой 30 г с массовой долей НС1 5 %?
Какая масса раствора с массовой долей
гидроксида натрия 4 % потребуется для
полной нейтрализации соляной кислоты
массой 30 г с массовой долей НС1 5 %?
8. Составьте уравнения реакций по следующей схеме:
FeC12 Fe(OH)2 FeSO4 Fe FeC12
Контрольная работа.
Вариант №4.
1. Определите число молекул оксида серы (IV), который занимает объем 2,8 л (нормальные условия).
2. К раствору, содержащему 68 г AgNOз, прилили раствор, содержащий такую же массу NаС1. Какова масса AgC1, полученного в результате реакции?
3. Рассчитайте относительную атомную массу элемента кобальта, если известно, что в природе существуют два его изотопа: 57Со (массовая доля 0,17%) и 59Со (99,83%).
4.
При переходе от CsF
к CsI
температура плавления
кристаллов уменьшается. Объяснить
наблюдаемый
ход изменения температур плавления.
5. На разложение оксида ртути (II) массой 8,68 г затрачена теплота количеством 3,64 кДж. Составьте термохимическое уравнение реакции.
6. К 700 кг 25 %-ного раствора серной кислоты прибавили 93 %-ный раствор серной кислоты, в результате чего образовался 40 %-ный раствор. Определить массу добавляемого 93 %-ного раствора.
7. Для реакции с раствором азотной кислоты массой 25 г, массовая доля растворенного вещества в котором составляет 6,3 %, потребовался раствор гидроксида калия массой 40 г. Определите массовую долю щелочи в растворе.
8. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al2(SO4)3 Al(OH)3 Al2O3 AlC13 Al(OH)3
Контрольная работа.
Вариант №5.
1.
Относительная
плотность газа по воздуху равна 1,517. Рассчитайте количество вещества этого
газа, которое
заключается в его образце массой 11 г.
Рассчитайте количество вещества этого
газа, которое
заключается в его образце массой 11 г.
2. При взаимодействии магния c серной кислотой получили 72 г MgSO4. Определите массы прореагировавших веществ.
3. Рассчитайте число протонов и нейтронов в ядре атома технеция (изотоп с атомной массой 99) и ядре атома радия (изотоп с атомной массой 226).
4. Какой вывод можно сделать об отношении значений энергий кристаллических решеток: 1) К2S с К2Sе?
5. Сколько теплоты выделится при сгорании теллура массой 1,92 г, если для ТеО2(к) = 322кДж/моль?
6. Какую массу тетрагидрата нитрата кальция нужно растворить в 75 г 2 %-ного раствора нитрата кальция для получения раствора с молярной концентрацией 0,948 моль/л (плотность 1,11 г/мл)?
7. Какая масса раствора гидроксида натрия с массовой долей 10 % необходима для нейтрализации 40 г раствора серной кислоты с массовой долей 10 %?
8. Составьте уравнения реакций по следующей
схеме:
Составьте уравнения реакций по следующей
схеме:
FeC12 Fe FeC13 Fe(OH)3 Fe2(SO4)3
Контрольная работа.
Вариант №6.
1. При давлении 105,4 кПа и температуре 25°С азот занимает сосуд вместимостью 5,5 л. Вычислите количество вещества азота, находящегося в данном сосуде.
2. Определите реакцию среды в растворе после взаимодействия 85 г NаОН и 73 г НС1.
3. Природный магний состоит из изотопов 24Mg, 25Mg и 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
4. Какой вывод можно сделать об отношении значений энергий кристаллических решеток: 1) СаС12 и CaI2?
5. Рассчитайте количество теплоты, которая поглотится при получении кислорода объемом 6,72 л по реакции
2KNO3 = 2KNO2 + О2, = 255 кДж
Объем
кислорода приведен к нормальным условиям.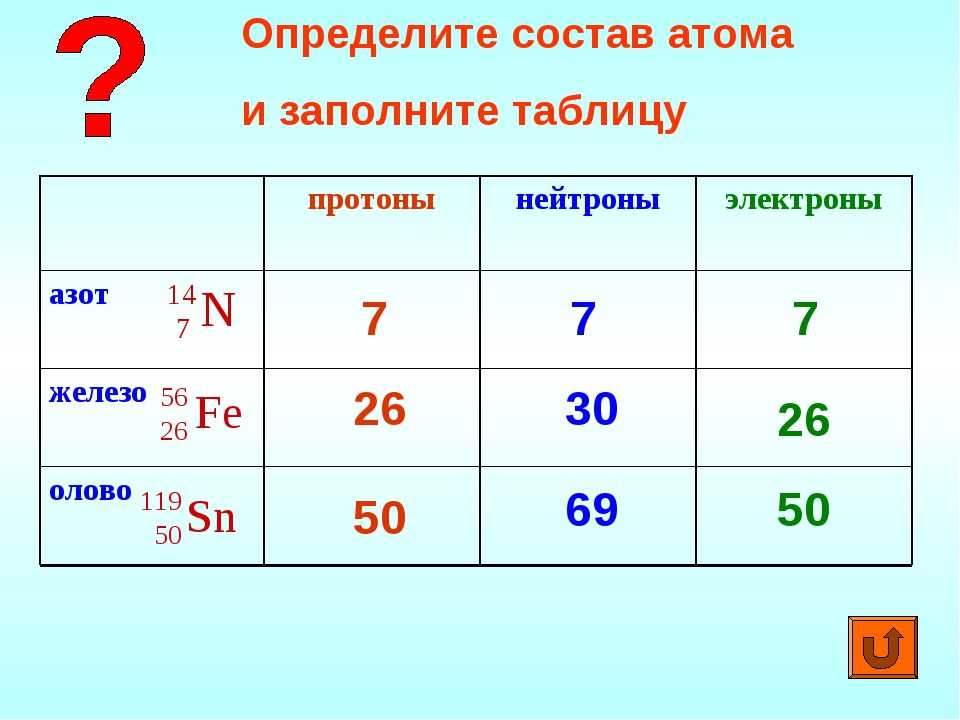
6. Из 500 г 40 %-ного раствора сульфата железа (II) при охлаждении выпало 100 г его кристаллогидрата (кристаллизуется с 7 молекулами воды). Какова массовая доля вещества в оставшемся растворе?
7. При пропускании избытка оксида серы (IV) через раствор гидроксида кальция образуется гидросульфит кальция. Рассчитайте объем оксида серы (IV), взятого при нормальных условиях, если гидросульфита образовалось 101 кг.
8. Составьте уравнения реакций по следующей схеме:
Р2О5 H3PO4 Са3(РО4)2 H3PO4 Са(Н2РО4)2
Контрольная работа.
Вариант №7.
1. Молекулярный кислород занимает при нормальных условиях объем 7,28 л. Вычислите массу газа.
2.
Найти
простейшую формулу оксида ванадия,
зная,
что 2,73 г оксида содержат 1,53 г металла.
3. Покажите распределение электронов по энергетическим уровням в атомах следующих элементов: а) азота; б) титана; в) галлия.
4. Сравните температуры плавления А1С13 и NaF. С чем это связано?
5. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент скорости реакции равен 3.
6. Кристаллогидрат сульфата меди (II) (кристаллизуется с пятью молекулами воды) массой 5 г растворили в воде количеством 5 моль. Рассчитайте массовую долю соли в полученном растворе.
7. При взаимодействии оксида кальция с водой образуется гидроксид кальция. Вычислить, сколько воды присоединяется к 5,6 г СаО, если при этом образуется 0,1 моль Са(ОН)2?
NaOH NaHCO3 Na2CO3 Na2SO4 NaC1
Контрольная работа.
Вариант
№8.
1. Рассчитайте объем, который при нормальных условиях займет хлор массой 42,6 г.
2. Вещество содержит (по массе) 26,53 % калия, 35,37%хрома и 38,10 % кислорода. Найти его простейшую формулу.
3. Покажите распределение электронов по энергетическим уровням в атомах следующих элементов: а) галлия; б) цезия; в) вольфрама.
4. Что можно сказать о температурах плавления следующих соединений: NaC1, MgC12, А1С13?
5. При температуре 20 °С реакция протекает за две минуты. За сколько времени будет протекать эта же реакция: а) при температуре 0 °С; б) при температуре 50 °С? Температурный коэффициент скорости реакции равен 2.
6. Через 250 г 5,75 %-ного раствора аммиака пропустили 10,5 л аммиака (20 °С, 101 кПа), при этом получился раствор с плотностью 0,963 г/мл. Вычислите молярную концентрацию полученного раствора.
7. При пропускании в известковую воду
оксида углерода (IV)
образовалось 20 г карбоната кальция.
Сколько граммов гидроксида кальция
вступило в реакцию?
При пропускании в известковую воду
оксида углерода (IV)
образовалось 20 г карбоната кальция.
Сколько граммов гидроксида кальция
вступило в реакцию?
8. Составьте уравнения реакций по следующей схеме:
FeC12 Fe(OH)2 FeSO4 Fe FeC12
Контрольная работа.
Вариант №9.
1. Вычислите количество вещества оксида углерода (IV), который занимает объем 120 л при температуре 27 °С и давлении 166,2 кПа.
2. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г.
3. Сколько энергетических уровней, занятых электронами, имеется в атомах элементов с порядковыми номерами 17, 29, 42?
4. B чем причина меньшей температуpы плавления кристаллов РbС14 по сравнению c РbС12?
5.
При
температуре 30 °С реакция протекает за
25
мин, при 50 °С – за 4 мин. Рассчитайте
температурный коэффициент скорости
реакции.
Рассчитайте
температурный коэффициент скорости
реакции.
6. Какой объём раствора уксусной кислоты с молярной концентрацией 1,98 моль/л (плотность 1,015 г/мл) был добавлен к 10 мл 40,2 %-ного раствора того же вещества (плотность 1,050 г/мл), если при этом получился 27,2 %-ный раствор (плотность 1,035 г/мл)?
7. Рассчитайте массу гидроксида кальция (II), который можно нейтрализовать при помощи 630 г раствора азотной кислоты, в которой массовая доля HNO3 равна 20 %.
Al2(SO4)3 Al(OH)3 Al2O3 AlC13 Al(OH)3
Контрольная работа.
Вариант №10.
1. Плотность галогеноводорода по воздуху равна 4,41. Определите плотность этого газа по водороду и назовите его.
2.
Найти
молекулярную формулу масляной кислоты,
содержащей (по массе) 54,5 % углерода, 36,4
% кислорода и 9,1 % водорода, зная, что
плотность ее паров по водороду равна
44.
3. Изобразите распределение электронов по энергетическим уровням и подуровням в атомах кремния и ванадия. К каким типам элементов с точки зрения строения атома они относятся?
4. Температуры плавления CaI2 и CdI2 575 °С и 388 °С соответственно, радиусы ионов Са2+ и Сd2+ близки по размерам. B чем причина различия в температурах плавления данных веществ?
5. Во сколько раз надо увеличить концентрацию водорода, чтобы скорость реакции H2(г)+ I2(г)= 2HI(г) возросла в три раза?
6. К насыщенному раствору карбоната натрия (растворимость 21,5 г в 100 г воды) добавили раствор того же вещества с молярной концентрацией 0,960 моль/л (плотность 1,095 г/мл). В каком диапазоне может находиться значение массовой доли карбоната натрия в получившемся растворе?
7.
К 60 мл раствора соляной кислоты с массовой
долей НС1 20 % и плотностью 1,1 г/мл добавили
избыток цинка. Рассчитайте, какую массу
хлорида цинка можно будет выделить из
полученного раствора.
Рассчитайте, какую массу
хлорида цинка можно будет выделить из
полученного раствора.
ядерных уравнений | Химия для специальностей
Результаты обучения
- Определение общих частиц и энергий, участвующих в ядерных реакциях
- Написать и сбалансировать ядерные уравнения
Изменения ядер, которые приводят к изменению их атомных номеров, массовых чисел или энергетических состояний, являются ядерными реакциями . Чтобы описать ядерную реакцию, мы используем уравнение, которое идентифицирует нуклиды, участвующие в реакции, их массовые числа и атомные номера, а также другие частицы, участвующие в реакции. 9{4}\text{Он}[/латекс]. Это работает, потому что, как правило, заряд иона не важен для балансировки ядерных уравнений.
Хотя многие виды встречаются в ядерных реакциях, в Таблице 1 обобщаются названия, символы, изображения и описания наиболее распространенных из них.
9{1}\text{n}[/латекс] Таблица 1. Ядерные частицы Ядерные частицы | |||
|---|---|---|---|
| Имя | Символ(ы) | Представительство | Описание |
| Частицы с массой примерно равной массе протона, но не имеющие заряда | |||
| Гамма-излучение | [латекс]\гамма[/латекс] | Очень мощное электромагнитное излучение | |
Обратите внимание, что позитроны точно такие же, как электроны, за исключением того, что они имеют противоположный заряд. Они являются наиболее распространенным примером антиматерии , частиц с той же массой, но противоположным состоянием другого свойства (например, заряда), чем обычная материя. Когда антиматерия сталкивается с обычной материей, обе они аннигилируют, а их масса превращается в энергию в виде 9{0}\text{e}\longrightarrow \gamma+\gamma[/latex]
Как видно из главы, посвященной свету и электромагнитному излучению, гамма-лучи представляют собой коротковолновое высокоэнергетическое электромагнитное излучение и обладают (намного) большей энергией, чем более известные рентгеновские лучи, которые могут вести себя как частицы в смысле корпускулярно-волнового дуализма.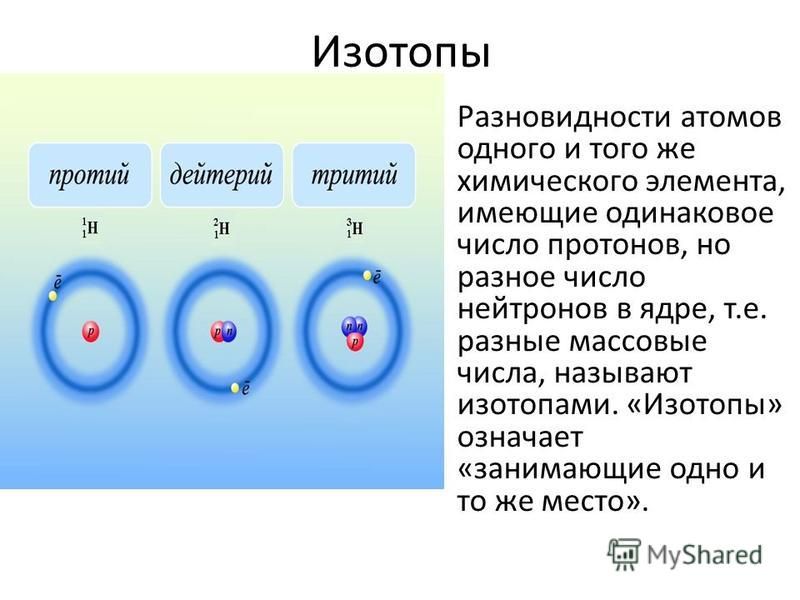 Гамма-лучи производятся, когда ядро претерпевает переход из более высокого в более низкое энергетическое состояние, аналогично тому, как фотон производится электронным переходом с более высокого на более низкий энергетический уровень. Из-за гораздо большей разницы энергий между ядерными энергетическими оболочками гамма-лучи, исходящие от ядра, имеют энергию, которая обычно в миллионы раз превышает энергию электромагнитного излучения, исходящего от электронных переходов.
Гамма-лучи производятся, когда ядро претерпевает переход из более высокого в более низкое энергетическое состояние, аналогично тому, как фотон производится электронным переходом с более высокого на более низкий энергетический уровень. Из-за гораздо большей разницы энергий между ядерными энергетическими оболочками гамма-лучи, исходящие от ядра, имеют энергию, которая обычно в миллионы раз превышает энергию электромагнитного излучения, исходящего от электронных переходов.
Балансировка ядерных реакций
Сбалансированное уравнение химической реакции отражает тот факт, что во время химической реакции связи разрываются и образуются, а атомы перестраиваются, но общее количество атомов каждого элемента сохраняется и не изменяется. Сбалансированное уравнение ядерной реакции указывает на то, что во время ядерной реакции происходит перегруппировка субатомных частиц, а не атомов. Ядерные реакции также подчиняются законам сохранения и уравновешиваются двумя способами: 9{125}\text{I}[/latex] соединяется с электроном и производит новое ядро, а не другие массивные частицы. Каково уравнение этой реакции?
Каково уравнение этой реакции?
Показать раствор
Ниже приведены уравнения нескольких ядерных реакций, сыгравших важную роль в истории ядерной химии:
- Первый выделенный в природе нестабильный элемент, полоний, был открыт польским ученым Мари Кюри и ее мужем Пьером. в 1898 году. Он распадается, испуская α-частицы: 9{1}\text{n}[/латекс].
Вы можете просмотреть стенограмму «Альфа-частицы, бета-частицы, гамма-лучи, позитроны, электроны, протоны и нейтроны» здесь (откроется в новом окне).
Ключевые понятия и резюме
Ядра могут подвергаться реакциям, которые изменяют их количество протонов, количество нейтронов или энергетическое состояние. В ядерных реакциях может участвовать множество различных частиц. Наиболее распространены протоны, нейтроны, позитроны (положительно заряженные электроны), альфа (α) частицы (которые представляют собой высокоэнергетические ядра гелия), бета (β) частицы (которые представляют собой высокоэнергетические электроны) и гамма (γ ) лучи (которые составляют высокоэнергетическое электромагнитное излучение). Как и химические реакции, ядерные реакции всегда сбалансированы. При протекании ядерной реакции общая масса (число) и общий заряд остаются неизменными.
Как и химические реакции, ядерные реакции всегда сбалансированы. При протекании ядерной реакции общая масса (число) и общий заряд остаются неизменными.
Попробуйте
Напишите краткое описание или определение каждого из следующих элементов:
- нуклон
- α-частица
- β-частица
- позитрон
- гамма-луч
- нуклид
- массовый номер
- атомный номер
Показать раствор
Попробуйте
- Какие из различных частиц (α-частицы, β-частицы и т. д.), которые могут образоваться в результате ядерной реакции, на самом деле являются ядрами. 9{1}\text{n}[/латекс]
- производство 17 O из 14 N путем бомбардировки α-частицами
- производство 14 C из 14 N нейтронной бомбардировкой
- производство 233 Th из 232 Th методом нейтронной бомбардировки
- производство 239 U из 238 U путем бомбардировки [латексом]{}_{1}^{2}\text{H}[/latex]
 Молибден-98 соединяется с нейтроном с образованием молибдена-99, нестабильного изотопа, который испускает β-частицы с образованием возбужденной формы технеция-99, представленной как 99 Tc * . Это возбужденное ядро релаксирует в основное состояние, представленное как 99 Tc, испуская γ-квант. Затем основное состояние 99 Tc испускает β-частицу. Напишите уравнения каждой из этих ядерных реакций. 9{0}\text{e}\text{)}[/latex] : античастица к электрону; обладает свойствами, идентичными электрону, за исключением противоположного (положительного) заряда
Молибден-98 соединяется с нейтроном с образованием молибдена-99, нестабильного изотопа, который испускает β-частицы с образованием возбужденной формы технеция-99, представленной как 99 Tc * . Это возбужденное ядро релаксирует в основное состояние, представленное как 99 Tc, испуская γ-квант. Затем основное состояние 99 Tc испускает β-частицу. Напишите уравнения каждой из этих ядерных реакций. 9{0}\text{e}\text{)}[/latex] : античастица к электрону; обладает свойствами, идентичными электрону, за исключением противоположного (положительного) зарядаКомпоненты ядра
Это «Компоненты ядра», раздел 20.1 из книги «Основы общей химии» (т. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Там вы можете просматривать или скачивать дополнительные книги. Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Помогла ли вам эта книга? Рассмотрите возможность передачи:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их школьные проекты, от художественных принадлежностей до книг и калькуляторов.
20.1 Компоненты ядра
Цель обучения
- Понять факторы, влияющие на ядерную стабильность.
Хотя большинство известных элементов имеют по крайней мере один изотоп, атомное ядро которого бесконечно стабильно, все элементы имеют изотопы, которые нестабильны и распадаются, или распадаются с измеримой скоростью, испуская излучение. Некоторые элементы не имеют стабильных изотопов и в конечном итоге распадаются на другие элементы. В отличие от химических реакций, которым уделялось основное внимание в предыдущих главах и которые происходят из-за изменений в расположении валентных электронов атомов, процесс ядерного распада приводит к изменениям внутри атомного ядра. Мы начнем обсуждение ядерных реакций с рассмотрения соглашений, используемых для описания компонентов ядра.
В отличие от химических реакций, которым уделялось основное внимание в предыдущих главах и которые происходят из-за изменений в расположении валентных электронов атомов, процесс ядерного распада приводит к изменениям внутри атомного ядра. Мы начнем обсуждение ядерных реакций с рассмотрения соглашений, используемых для описания компонентов ядра.
Атомное ядро
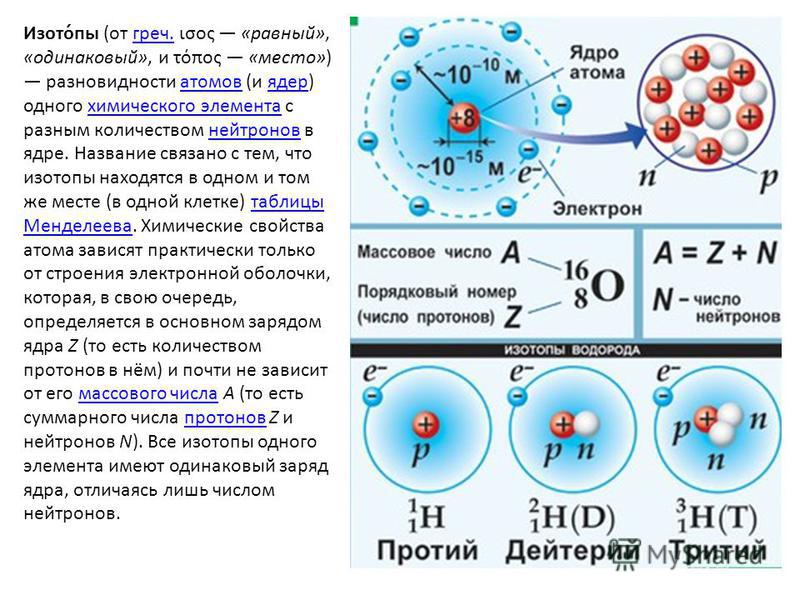
Как вы узнали из главы 1 «Введение в химию», каждый элемент может быть представлен обозначением XZA, где A , массовое число, представляет собой сумму числа протонов и числа нейтронов, а Z , атомный номер, это число протонов. Протоны и нейтроны, входящие в состав ядра атома, называются нуклонами Протоны и нейтроны, входящие в состав ядра атома, а атом с определенным числом протонов и нейтронов называется нуклидомАтом с определенным числом нуклонов .. Нуклиды с одинаковым числом протонов, но разным числом нейтронов называются изотопов . Изотопы также могут быть представлены альтернативным обозначением, в котором используется название элемента, за которым следует массовое число, например, углерод-12.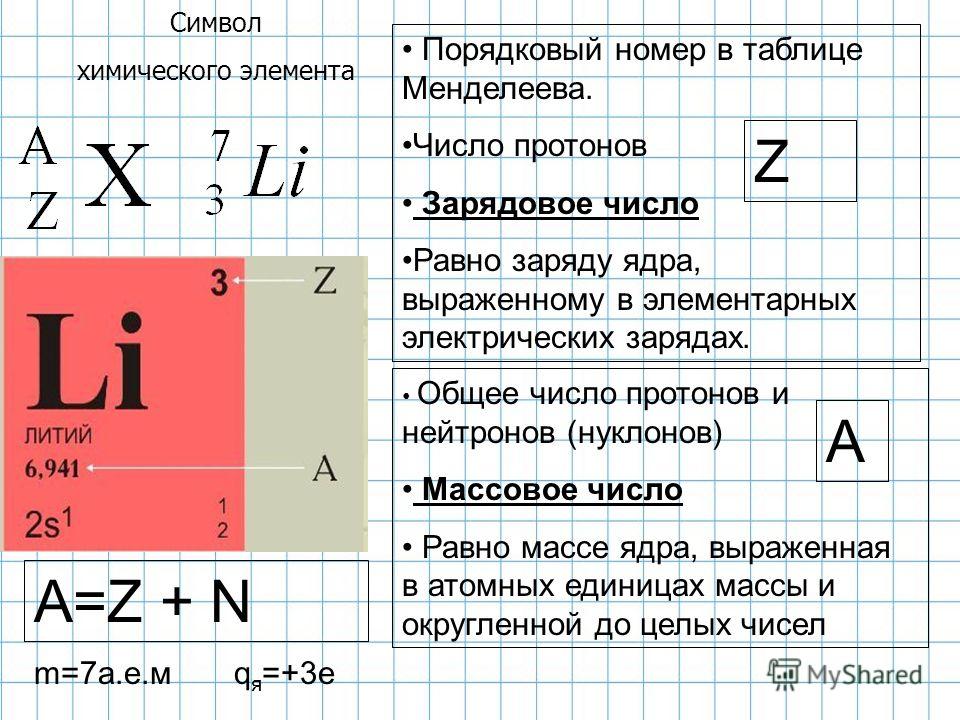 Стабильные изотопы кислорода, например, могут быть представлены любым из следующих способов:
Стабильные изотопы кислорода, например, могут быть представлены любым из следующих способов:
XZA:O816O817O818XA:O16O17O18элемент-A:кислород-16кислород-17кислород-18
Поскольку число нейтронов равно A − Z , мы видим, что первый изотоп кислорода имеет 8 нейтронов, второй изотоп 9нейтронов, а третий изотоп 10 нейтронов. Изотопы всех встречающихся в природе элементов на Земле присутствуют в почти фиксированных пропорциях, причем каждая пропорция составляет естественное содержание изотопа . Например, в типичном земном образце кислорода 99,76% атомов O составляют кислород-16, 0,20% — кислород-18 и 0,04% — кислород-17.
Любое ядро, которое нестабильно и самопроизвольно распадается, называется радиоактивным. Любое ядро, которое нестабильно и самопроизвольно распадается, испуская частицы и электромагнитное излучение, испуская субатомные частицы и электромагнитное излучение. Выбросы в совокупности называются радиоактивность и может быть измерена. Изотопы, испускающие излучение, называются радиоизотопами. Изотоп, излучающий излучение. Как вы узнали из главы 14 «Химическая кинетика», скорость, с которой происходит радиоактивный распад, является характеристикой изотопа и обычно указывается как период полураспада ( т 1/2 ), количество времени, необходимое для того, чтобы половина исходного числа присутствующих ядер распалась в реакции первого порядка. (Для получения дополнительной информации о периоде полураспада см. главу 14 «Химическая кинетика», раздел 14.5 «Период полураспада и кинетика радиоактивного распада».) Период полураспада изотопа может варьироваться от долей секунды до миллиардов лет и, среди прочего, приложения, могут быть использованы для измерения возраста древних объектов. В примере 1 и соответствующем упражнении рассматриваются расчеты скорости радиоактивного распада и периода полураспада.
Изотопы, испускающие излучение, называются радиоизотопами. Изотоп, излучающий излучение. Как вы узнали из главы 14 «Химическая кинетика», скорость, с которой происходит радиоактивный распад, является характеристикой изотопа и обычно указывается как период полураспада ( т 1/2 ), количество времени, необходимое для того, чтобы половина исходного числа присутствующих ядер распалась в реакции первого порядка. (Для получения дополнительной информации о периоде полураспада см. главу 14 «Химическая кинетика», раздел 14.5 «Период полураспада и кинетика радиоактивного распада».) Период полураспада изотопа может варьироваться от долей секунды до миллиардов лет и, среди прочего, приложения, могут быть использованы для измерения возраста древних объектов. В примере 1 и соответствующем упражнении рассматриваются расчеты скорости радиоактивного распада и периода полураспада.
Пример 1
Пещера Форт-Рок в Орегоне — это место, где археологи обнаружили несколько индейских сандалий, самых старых из когда-либо найденных в Орегоне.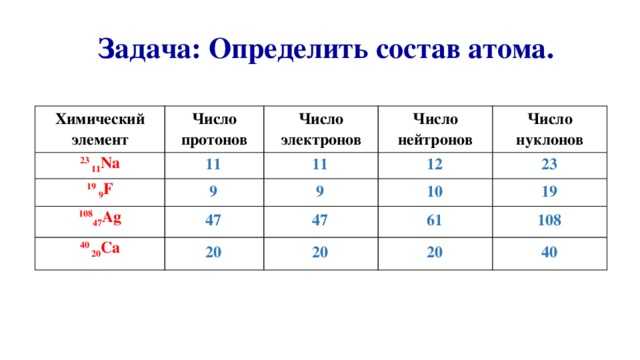 Анализ содержания 14 C в полыни, используемой для изготовления сандалий, дал среднюю скорость распада 5,1 распада в минуту (dpm) на грамм углерода. Текущее соотношение 14 C/ 12 C в живых организмах составляет 1,3 × 10 −12 , при скорости распада 15 dpm/г C. Как давно была срезана полынь в сандалиях? Период полураспада 14 C 5730 лет.
Анализ содержания 14 C в полыни, используемой для изготовления сандалий, дал среднюю скорость распада 5,1 распада в минуту (dpm) на грамм углерода. Текущее соотношение 14 C/ 12 C в живых организмах составляет 1,3 × 10 −12 , при скорости распада 15 dpm/г C. Как давно была срезана полынь в сандалиях? Период полураспада 14 C 5730 лет.
Дано: радиоизотоп, ток 14 C/ 12 Отношение C, начальная скорость распада, конечная скорость распада и период полураспада
Запрошено: возраст
Стратегия:
A Используйте уравнение 14.30 для расчета N 0 / N , отношения количества атомов 14 C, изначально присутствующих в образце, к количеству атомов, присутствующих сейчас.
B Подставьте значение периода полураспада 14 C в уравнение 14.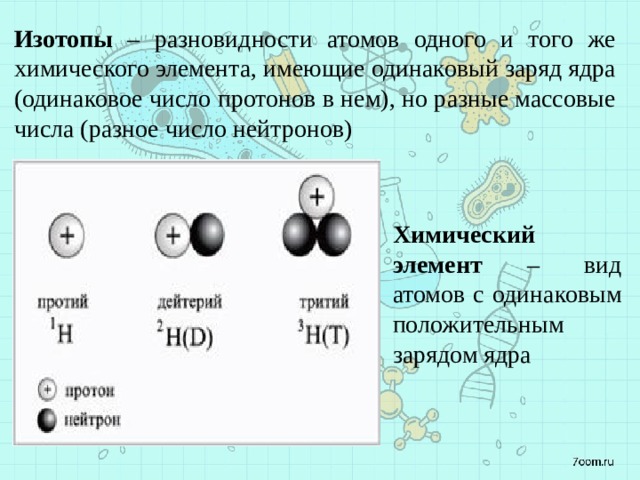 28, чтобы получить константу скорости реакции.
28, чтобы получить константу скорости реакции.
C Подставьте рассчитанные значения для N 0 / N и константу скорости в уравнение 14.32, чтобы получить прошедшее время t .
Решение:
Мы можем использовать интегральный закон скорости для ядерной реакции первого порядка (уравнение 14.32), чтобы вычислить количество времени, которое прошло с тех пор, как полынь была срезана для изготовления сандалий:
ln NN0=−kt
A Из уравнения 14.30 мы знаем, что A = кН . We can therefore use the initial and final activities ( A 0 = 15 and A = 5.1) to calculate N 0 / N :
A0A=kN0kN=N0N=155.1
B Теперь мы можем рассчитать константу скорости k из периода полураспада реакции (5730 лет) с помощью уравнения 14. 28:
28:
t1/2=0,693k
Преобразование этого уравнения для решения для k ,
k=0,693t1/2=0,6935730 год=1,21×10-4год-1
C
t=ln(N0/N)k=ln(15/5.1)1,21×10-4 лет-1=8900 лет
Таким образом, полыни в сандалиях около 8900 лет.
Упражнение
Пытаясь найти подходящий способ защитить свою собственную погребальную камеру, древнеегипетский фараон Сноферу разработал пирамиду, погребальное сооружение, которое защищало пустынные могилы от воров и ветра. Анализ 14 Содержание C в нескольких предметах в пирамидах, построенных во время его правления, дало среднюю скорость распада 8,6 dpm/g C. Когда были созданы предметы в камере?
Ответ: около 4600 лет назад или около 2600 г. до н.э.
Ядерная стабильность
число протонов и нейтронов, характерное для данного изотопа. Электростатическое отталкивание обычно заставляет положительно заряженные протоны отталкивать друг друга, но ядро не разлетается из-за сильного ядерного взаимодействия. Чрезвычайно мощной, но очень короткодействующей силы притяжения между нуклонами, которая удерживает ядро атома от разлета (из-за к электростатическому отталкиванию между протонами), чрезвычайно мощная, но очень короткодействующая сила притяжения между нуклонами (рис. 20.1 «Конкурирующие взаимодействия внутри атомного ядра»). Все стабильные ядра, кроме ядра водорода-1 ( 1 H) содержат по крайней мере один нейтрон для преодоления электростатического отталкивания между протонами. По мере увеличения числа протонов в ядре число нейтронов, необходимых для стабильного ядра, увеличивается еще быстрее. Слишком много протонов (или слишком мало нейтронов) в ядре приводит к дисбалансу сил, что приводит к ядерной нестабильности.
Чрезвычайно мощной, но очень короткодействующей силы притяжения между нуклонами, которая удерживает ядро атома от разлета (из-за к электростатическому отталкиванию между протонами), чрезвычайно мощная, но очень короткодействующая сила притяжения между нуклонами (рис. 20.1 «Конкурирующие взаимодействия внутри атомного ядра»). Все стабильные ядра, кроме ядра водорода-1 ( 1 H) содержат по крайней мере один нейтрон для преодоления электростатического отталкивания между протонами. По мере увеличения числа протонов в ядре число нейтронов, необходимых для стабильного ядра, увеличивается еще быстрее. Слишком много протонов (или слишком мало нейтронов) в ядре приводит к дисбалансу сил, что приводит к ядерной нестабильности.
Рис. 20.1 Конкурирующие взаимодействия внутри атомного ядра
Электростатическое отталкивание между положительно заряженными протонами обычно заставляет ядра атомов (кроме H) разлетаться на части. В стабильных атомных ядрах это отталкивание преодолевается сильным ядерным взаимодействием, короткодействующим, но мощным притягивающим взаимодействием между нуклонами. Если взаимодействия притяжения из-за сильного ядерного взаимодействия слабее, чем электростатическое отталкивание между протонами, ядро неустойчиво и в конце концов распадется.
Если взаимодействия притяжения из-за сильного ядерного взаимодействия слабее, чем электростатическое отталкивание между протонами, ядро неустойчиво и в конце концов распадется.
Взаимосвязь между числом протонов и числом нейтронов в стабильных ядрах, условно определенных как имеющие период полураспада, более чем в 10 раз превышающий возраст Земли, графически показана на рисунке 20.2 «Взаимосвязь между ядерной стабильностью и нейтронной отношение протонов». Стабильные изотопы образуют «полуостров стабильности» в «море нестабильности». Только два стабильных изотопа, 1 H и 3 He, имеют отношение нейтронов к протонам менее 1. Несколько стабильных изотопов легких атомов имеют отношение нейтронов к протонам, равное 1 (например, h34e, B510 , и C2040a). Все другие стабильные ядра имеют более высокое отношение нейтронов к протонам, которое неуклонно увеличивается примерно до 1,5 для самых тяжелых ядер. Однако независимо от числа нейтронов все элементы с Z > 83 нестабильны и радиоактивны.
Рис. 20.2 Зависимость между ядерной стабильностью и отношением нейтронов к протонам
На этом графике зависимости числа нейтронов от числа протонов каждая черная точка соответствует стабильному ядру. В этой классификации стабильное ядро условно определяется как ядро с периодом полураспада более 46 миллиардов лет (в 10 раз больше возраста Земли). По мере увеличения числа протонов (атомного номера) количество нейтронов, необходимых для стабильного ядра, увеличивается еще быстрее. Изотопы, показанные красным, желтым, зеленым и синим цветом, постепенно становятся менее стабильными и более радиоактивными; чем дальше изотоп от диагональной полосы стабильных изотопов, тем короче его период полураспада. Фиолетовые точки указывают на сверхтяжелые ядра, которые, по прогнозам, будут относительно стабильными, а это означает, что они должны быть радиоактивными, но иметь относительно длительный период полураспада. В большинстве случаев эти элементы еще не обнаружены и не синтезированы.
Источник данных: Национальный центр ядерных данных, Брукхейвенская национальная лаборатория, Файл оцененных данных о структуре ядра (ENSDF), Таблица нуклидов, http://www.nndc.bnl.gov/chart.
Как показано на рис. 20.3 «Связь между числом протонов и числом нейтронов и ядерной стабильностью», более половины стабильных ядер (166 из 279) имеют даже чисел как нейтронов, так и протонов; только 6 из 279 стабильных ядер не имеют нечетного числа обоих. Более того, определенное количество нейтронов или протонов приводит к особенно стабильным ядрам; это так называемые магические числа 2, 8, 20, 50, 82 и 126. Например, олово ( Z = 50) имеет 10 стабильных изотопов, но элементы по обе стороны от олова в периодической таблице, индий ( Z = 49) и сурьма ( Z = 51), имеют только по 2 стабильных изотопа. Ядра с магическими числами и протонов, и нейтронов называются «дважды магическими» и еще более стабильными. Примерами элементов с дважды магическими ядрами являются h34e с 2 протонами и 2 нейтронами и P82208b с 82 протонами и 126 нейтронами, который является самым тяжелым из известных стабильных изотопов среди всех элементов.
Рисунок 20.3 Зависимость между числом протонов и числом нейтронов и ядерной стабильностью
Большинство стабильных ядер содержат четное число как нейтронов, так и протонов.
Модель стабильности, предполагаемая магическими числами нуклонов, напоминает стабильность, связанную с закрытыми электронными конфигурациями инертных газов в группе 18, и привела к гипотезе, что ядро содержит оболочки нуклонов, которые находятся в некоторых способами, аналогичными оболочкам, занятым электронами в атоме. Как показано на рис. 20.2 «Взаимосвязь между ядерной стабильностью и нейтронно-протонным отношением», «полуостров» стабильных изотопов окружен «рифом» радиоактивных изотопов, которые достаточно стабильны, чтобы существовать в течение различных периодов времени. прежде чем они в конечном итоге распадутся, чтобы произвести другие ядра.
Пример 2
Классифицируйте каждый нуклид как стабильный или радиоактивный.
- P1530
- Т4398с
- олово-118
- P94239u
Дано: массовое число и атомный номер
Запрашиваемый: предсказанная ядерная стабильность
Стратегия:
Используйте количество протонов, отношение нейтронов к протонам и наличие четного или нечетного количества нейтронов и протонов, чтобы предсказать стабильность или радиоактивность каждого нуклида.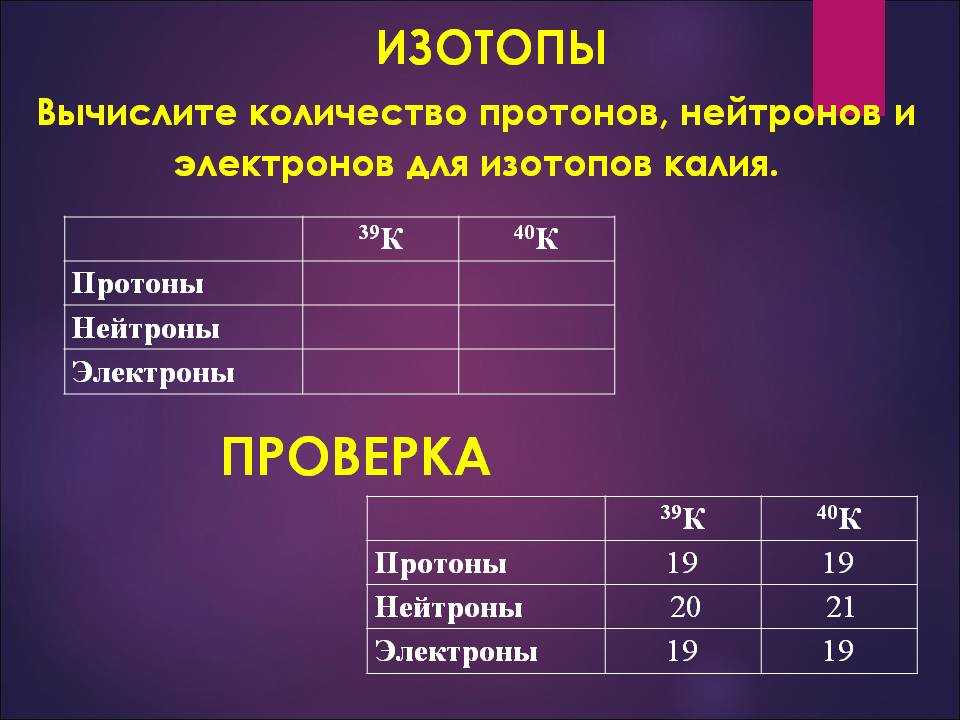
Решение:
- Этот изотоп фосфора имеет 15 нейтронов и 15 протонов, что дает отношение нейтронов к протонам, равное 1,0. Хотя атомный номер 15 намного меньше значения 83, выше которого все нуклиды нестабильны, отношение нейтронов к протонам меньше ожидаемого для стабильности элемента с такой массой. Как показано на рис. 20.2 «Взаимосвязь между ядерной стабильностью и отношением нейтронов к протонам», его отношение нейтронов к протонам должно быть больше 1. Кроме того, этот изотоп имеет нечетное число как нейтронов, так и протонов, что также делает нуклид нестабильным. Следовательно, предсказывается, что P1530 будет радиоактивным, и это так.
- Этот изотоп технеция имеет 55 нейтронов и 43 протона, что дает отношение нейтронов к протонам 1,28, что помещает T4398c на край полосы стабильности. Атомный номер 55 намного меньше значения 83, выше которого все изотопы нестабильны.
 Эти факты предполагают, что T4398c может быть стабильным. Однако T4398c имеет нечетное количество нейтронов и протонов, комбинация, которая редко дает стабильное ядро. Следовательно, предполагается, что T4398c будет радиоактивным, и так оно и есть.
Эти факты предполагают, что T4398c может быть стабильным. Однако T4398c имеет нечетное количество нейтронов и протонов, комбинация, которая редко дает стабильное ядро. Следовательно, предполагается, что T4398c будет радиоактивным, и так оно и есть. - Олово-118 имеет 68 нейтронов и 50 протонов при соотношении нейтронов к протонам 1,36. Как и в части b, это значение и атомный номер указывают на стабильность. Кроме того, этот изотоп имеет даже число как нейтронов, так и протонов, что увеличивает ядерную стабильность. Самое главное, в ядре 50 протонов, а 50 — одно из магических чисел, связанных с особо стабильными ядрами. Таким образом, S50118n должен быть особенно стабильным.
- Этот нуклид имеет атомный номер 94. Поскольку все ядра с Z > 83 нестабильны, P94239u должен быть радиоактивным.
Упражнение
Классифицируйте каждый нуклид как стабильный или радиоактивный.
- Т х
- C2040a
- О815
- L57139a
Ответ:
- радиоактивный
- стабильный
- радиоактивный
- стабильный
Сверхтяжелые элементы
В дополнение к «полуострову стабильности» на рис.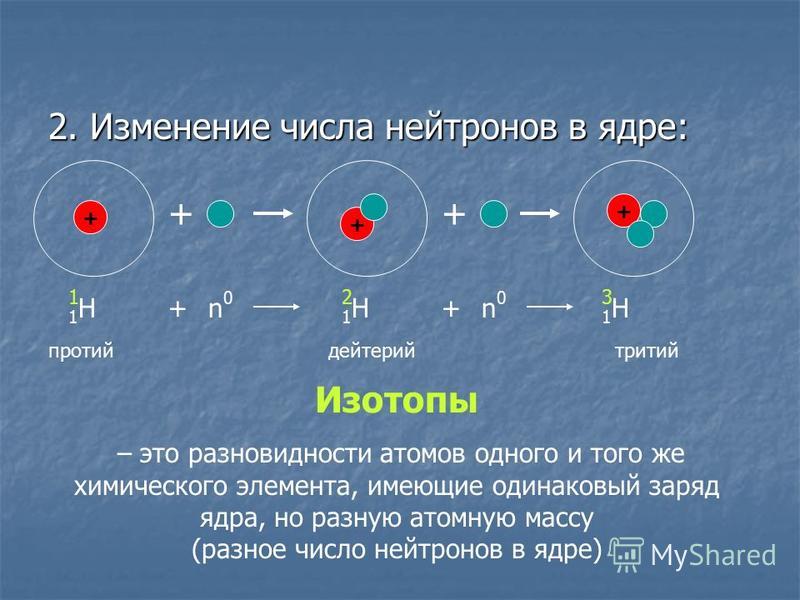 20.2 «Взаимосвязь между ядерной стабильностью и нейтронно-протонным отношением» показан небольшой «остров стабильности», который, по прогнозам, должен существовать в правом верхнем углу. угол. Этот остров соответствует сверхтяжелым элементам. Элемент с атомным номером, близким к магическому числу 126, с атомными номерами, близкими к магическому числу 126. Поскольку следующим магическим числом для нейтронов должно быть 184, было высказано предположение, что элемент со 114 протонами и 184 нейтрона могут быть достаточно стабильными, чтобы существовать в природе. Хотя эти утверждения многие годы встречались со скептицизмом, с 1999 было получено несколько атомов изотопов с Z = 114 и Z = 116, которые оказались на удивление стабильными. Один изотоп 114-го элемента распадается за 2,7 секунды, что химики-ядерщики называют «вечностью». Более того, недавно появились доказательства существования ядра с A = 292, обнаруженного в 232 Th. При расчетном периоде полураспада более 10 8 лет изотоп особенно стабилен.
20.2 «Взаимосвязь между ядерной стабильностью и нейтронно-протонным отношением» показан небольшой «остров стабильности», который, по прогнозам, должен существовать в правом верхнем углу. угол. Этот остров соответствует сверхтяжелым элементам. Элемент с атомным номером, близким к магическому числу 126, с атомными номерами, близкими к магическому числу 126. Поскольку следующим магическим числом для нейтронов должно быть 184, было высказано предположение, что элемент со 114 протонами и 184 нейтрона могут быть достаточно стабильными, чтобы существовать в природе. Хотя эти утверждения многие годы встречались со скептицизмом, с 1999 было получено несколько атомов изотопов с Z = 114 и Z = 116, которые оказались на удивление стабильными. Один изотоп 114-го элемента распадается за 2,7 секунды, что химики-ядерщики называют «вечностью». Более того, недавно появились доказательства существования ядра с A = 292, обнаруженного в 232 Th. При расчетном периоде полураспада более 10 8 лет изотоп особенно стабилен.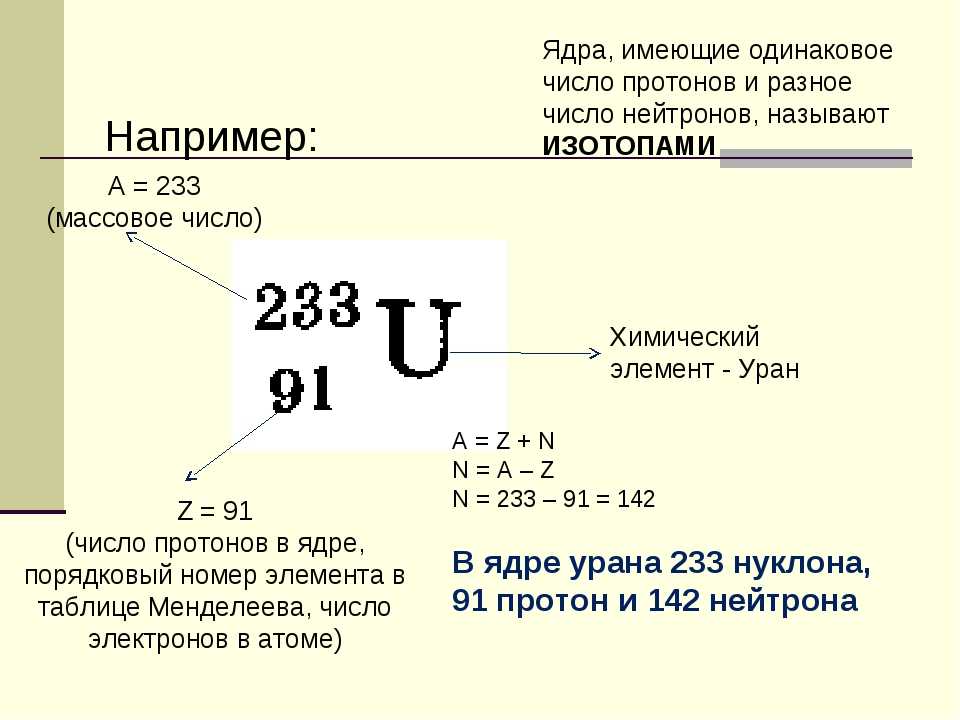 Его измеренная масса согласуется с предсказаниями массы изотопа с Z = 122. Таким образом, ряд относительно долгоживущих ядер вполне может быть доступен среди сверхтяжелых элементов.
Его измеренная масса согласуется с предсказаниями массы изотопа с Z = 122. Таким образом, ряд относительно долгоживущих ядер вполне может быть доступен среди сверхтяжелых элементов.
Резюме
Субатомные частицы ядра (протоны и нейтроны) называются нуклонами . Нуклид — это атом с определенным количеством протонов и нейтронов. Нестабильное ядро, которое спонтанно распадается, является радиоактивным , а его выбросы в совокупности называются радиоактивностью . Изотопы, испускающие излучение, называются радиоизотопы . Каждый нуклон притягивается к другим нуклонам силой сильных ядерных сил . Стабильные ядра обычно имеют четное число как протонов, так и нейтронов и отношение нейтронов к протонам не менее 1. Ядра, которые содержат магических чисел протонов и нейтронов, часто особенно стабильны. Сверхтяжелые элементы с атомными номерами около 126 могут быть даже достаточно стабильны, чтобы существовать в природе.
Key Takeaway
- Ядра с магическим числом нейтронов или протонов особенно стабильны, как и те ядра, которые являются дважды магическими.
Концептуальные проблемы
Чем ядерная реакция отличается от химической? Используйте пример каждого, чтобы проиллюстрировать различия.
Что имеют в виду химики, когда говорят, что вещество радиоактивно ?
Что характеризует изотоп? Как масса изотопа элемента связана с атомной массой элемента, указанного в периодической таблице?
Почему в типичном ядре электростатическое отталкивание между протонами не дестабилизирует ядро? Как отношение нейтронов к протонам влияет на стабильность изотопа? Почему все изотопы с Z > 83 нестабильны?
Каково значение магического числа протонов или нейтронов? Какая связь между числом стабильных изотопов элемента и наличием у элемента магического числа протонов?
Ожидаете ли вы, что Bi будет иметь большое количество стабильных изотопов? Ка? Объясните свои ответы.

Калий имеет три общих изотопа: 39 К, 40 К и 41 К, но только калий-40 является радиоактивным (бета-излучатель). Предложите причину нестабильности 40 К.
Самарий имеет 11 относительно стабильных изотопов, но только 4 нерадиоактивны. Одним из этих 4 изотопов является 144 Sm, который имеет более низкое отношение нейтронов к протонам, чем более легкие радиоактивные изотопы самария. Почему 144 См стабильнее?
Ответы
Изотопы с магическим числом протонов и/или нейтронов имеют тенденцию быть особенно стабильными.
 Элементы с магическим числом протонов, как правило, имеют более стабильные изотопы, чем элементы без них.
Элементы с магическим числом протонов, как правило, имеют более стабильные изотопы, чем элементы без них.Калий-40 имеет 19 протонов и 21 нейтрон. Ядра с нечетным числом как протонов, так и нейтронов, как правило, нестабильны. Кроме того, отношение нейтронов к протонам очень низкое для элемента с такой массой, что снижает ядерную стабильность.
Численные задачи
Напишите ядерный символ для каждого изотопа, используя обозначение XZA.
- хлор-39
- литий-8
- осмий-183
- цинк-71
Напишите ядерный символ для каждого изотопа, используя обозначение XZA.

- свинец-212
- гелий-5
- кислород-19
- плутоний-242
Укажите количество протонов, количество нейтронов и отношение нейтронов к протонам для каждого изотопа.
- железо-57
- 185 Вт
- калий-39
- 131 Хе
Укажите количество протонов, количество нейтронов и отношение нейтронов к протонам для каждого изотопа.
- технеций-99 м
- 140 Ла
- радий-227
- 208 Би
Какие из этих нуклидов вы считаете радиоактивными? Объясните свои рассуждения.

- 20 Не
- вольфрам-184
- 106 Ти
Какие из этих нуклидов вы считаете радиоактивными? Объясните свои рассуждения.
- 107 Ag
- 50 В
- лютеций-176
Ответы
- C1739l
- L38i
- О76183с
- Z3071n
- 26 протонов; 31 нейтрон; 1.

- 26 протонов; 31 нейтрон; 1.

 Эти факты предполагают, что T4398c может быть стабильным. Однако T4398c имеет нечетное количество нейтронов и протонов, комбинация, которая редко дает стабильное ядро. Следовательно, предполагается, что T4398c будет радиоактивным, и так оно и есть.
Эти факты предполагают, что T4398c может быть стабильным. Однако T4398c имеет нечетное количество нейтронов и протонов, комбинация, которая редко дает стабильное ядро. Следовательно, предполагается, что T4398c будет радиоактивным, и так оно и есть.
 Элементы с магическим числом протонов, как правило, имеют более стабильные изотопы, чем элементы без них.
Элементы с магическим числом протонов, как правило, имеют более стабильные изотопы, чем элементы без них.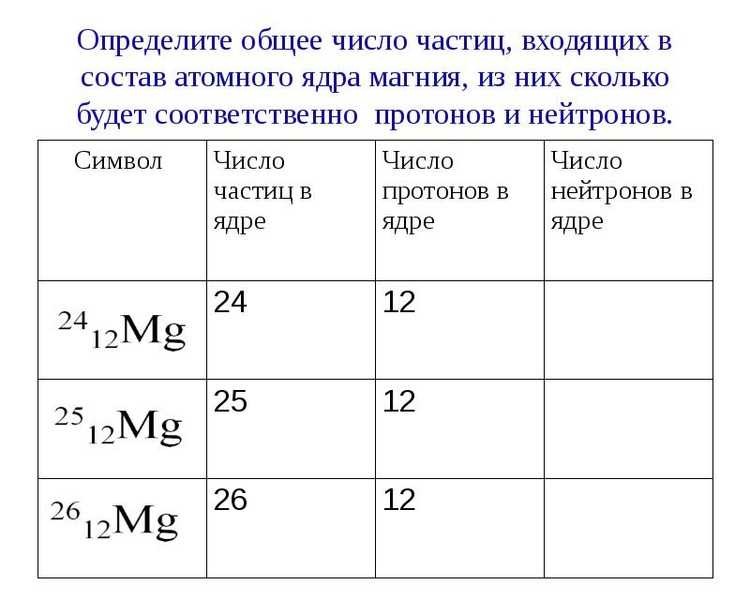

Leave A Comment