Задание 1 из ЕГЭ по химии
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание вы можете получить 1 балл на ЕГЭ в 2023 году
1) Cu 2) Ba 3) Ca 4) Ag 5) Be
Определите, атомы каких из указанных в ряду химических элементов имеют электронную конфигурацию внешнего энергетического уровня ns1(n–1)d10. Запишите в…
Запишите в…
1) Se 2) O 3) K 4) Te 5) Cs
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1. Запишите в поле ответа номера в…
Задача 31) F 2) Br 3) N 4) P 5) I
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня
1) S 2) Al 3) O 4) B 5) Te
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np1. Запишите в поле ответа номера…
Задача 51) Se 2) Ca 3) Br 4) Sr 5) Ba
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 4s24p6. Запишите в поле ответа но…
Задача 61) K 2) S 3) Ar 4) Na 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня
 Запишите в поле ответа номера в…Задача 7
Запишите в поле ответа номера в…Задача 71) Li 2) Ar 3) Na 4) Ne 5) Cs
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np6. Запишите в поле ответа ном…
Задача 81) O 2) S 3) Ne 4) Ar 5) Se
Определите, атомы каких из указанных в ряду элементов имеют в основном состоянии электронную конфигурацию ns2np6. Запишите в поле ответа номера выбранных…
Задача 91) N 2) As 3) Cu 4) P 5) Cr
Определите, атомы каких из указанных в ряду элементов имеют во внешнем электронном слое по одному неспаренному электрону. Запишите в поле ответа номера в…
Задача 101) O 2) N 3) S 4) C 5) As
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера …
Задача 111) Cl 2) Fe 3) I 4) Mn 5) Br
Определите, ионы каких из указанных в ряду элементов могут иметь электронную конфигурацию внешнего энергетического уровня 3d54s0. Запишите в поле ответа…
Запишите в поле ответа…
1) N 2) Be 3) B 4) Al 5) P
Определите, какие из указанных в ряду элементов в соединениях могут иметь электронную конфигурацию внешнего энергетического уровня ns2np1. Запишите в поле…
Задача 131) N 2) Sb 3) P 4) O 5) S
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера …
Задача 141) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номер…
Задача 151) Sn 2) Pb 3) Ca 4) Ba 5) Sr
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np2. Запишите в поле ответа ном…
Задача 161) As 2) B 3) P 4) Al 5) N
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np1. 10$.
10$.
Запишите номера выбранн…
Задача 201) O
2) S
3) N
4) Te
5) P
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s
Запишите номера выбранных элемент…
1 2 3 4 5
Задание 1 ЕГЭ по химии включает вопрос про электронную конфигурацию
атома. Несмотря на сложное звучание, это задание одно из самых простых в тесте. Все варианты почти одинаковы по строению. Школьнику предлагается ряд самых разных химических элементов, которые наполняют собой Периодическую систему великого Менделеева.
Экзаменуемому следует изучить этот набор и ответить на вопрос, который содержится в задании номер 1 единого государственного экзамена по химии. Он очень четкий и предполагает выбор атомов из доставшихся к рассмотрению элементов, с электронами в определенном количестве (пять, четыре, семь и т.д.) на внешнем энергетическом уровне. Затем в предназначенную для введения ответов ячейку потребуется внести номер подходящего элемента. Школьник должен быть очень внимательным, поскольку иногда правильных ответов может быть больше одного.
Данное задание рекомендуется выполнять первым, и не стоит уделять ему много времени. Достаточно 5 минут. Логичнее оставить побольше времени на следующие задания, так как ЕГЭ проводится в строгом соответствии с установленными регламентами.
Теория к заданию 1 по химии: Электронная конфигурация
Задание 2 >>
Популярные материалы
Составим твой персональный план подготовки к ЕГЭ
Электронная конфигурация атома.
 Часть 2
Часть 2Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн: после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию (для некоторых заданий есть видео-объяснения, тогда после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то у вас появится ссылка красного цвета, а если верный — то зелёного цвета. С помощью ссылки вы можете просмотреть подробное видео-объяснение этого задания, но помните, что ссылка неактивная, поэтому для просмотра видео-объяснения вам необходимо скопировать эту ссылку и вставить на новую страницу и нажать клавишу Enter, как результат у вас откроется видео на YouTube). В середине страницы вы увидите текстовые условия заданий, для некоторых из которых видео-объяснения даны сразу после задания, а текстовые ответы представлены в конце страницы.
Задание 1
Задание 2
Задание 3
Задание 4
Задание 5
Задание 6
Задание 7
Задание 8
Задание 9
Задание 10
Задание 11
Задание 12
Задание 13
Задание 14
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Na; 2) As; 3) Al; 4) Cr; 5) P.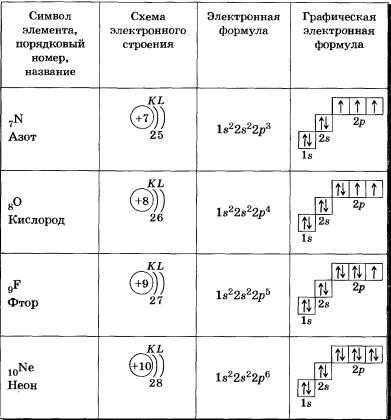
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную формулу внешнего энергетического уровня ns1.
Запишите в поле ответа номера выбранных элементов.
Задание 15
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Li; 2) Cs; 3) Ba; 4) O; 5) F.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, в атомах каких из указанных элементов связь валентных электронов с ядром наиболее слабая.
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Задание 16
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Cu; 2) P; 3) Zn; 4) K; 5) Cl.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня 4s1. Запишите в поле ответа номера выбранных элементов.
Задание 17
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Mg; 2) Se; 3) Al; 4) Те; 5) S.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют только 2 спаренных электрона на внешнем электронном слое.
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Задание 18
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Ar; 2) Be; 3) He; 4) Fe; 5) Xe.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют наименьшее отношение числа нейтронов к массовому числу. Запишите в поле ответа номера выбранных элементов.
Задание 19
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Cr; 2) Fe; 3) As; 4) N; 5) P.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют спаренные электроны на 3d-подуровне.
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Задание 20
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Fe; 2) Zn; 3) Cu; 4) Cr; 5) K.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют конфигурацию внешнего электронного слоя ns2. Запишите в поле ответа номера выбранных элементов.
Задание 21
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) C; 2) S; 3) Al; 4) P; 5) Zn.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, простые анионы каких из указанных элементов в основном состоянии имеют конфигурацию внешнего электронного слоя 3s23p6.
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Задание 22
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Cl; 2) Br; 3) S; 4) Se; 5) V.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомам каких из указанных в ряду элементов в основном состоянии не хватает двух электронов для завершения внешнего электронного слоя.
Запишите в поле ответа номера выбранных элементов.
Задание 23
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) H; 2) O; 3) B; 4) Zn; 5) F.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют вакантные орбитали.

Запишите в поле ответа номера выбранных элементов.
Задание 24
Задание 25
Задание 26
Среди перечисленных элементов выберите два элемента, у которых на внешнем энергетическом уровне имеется два электрона.
1) P 2) Cl 3) Zn 4) Be 5) Al
Запишите в поле ответа номера выбранных элементов.
Задание 27
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат 2 неспаренных электрона.
1) С 2) O 3) Cl 4) Cu 5) Ne
Запишите в поле ответа номера выбранных элементов.
Задание 28
Определите элементы из указанных, атомы которых в основном состоянии содержат не более двух неспаренных электрона.
1) Mn 2) B 3) Si 4) N 5) Sb
Запишите в поле ответа номера выбранных элементов.
Задание 29
Из предложенного перечня выберите два элемента, которые содержат одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии.
1) Ba 2) F 3) Ga 4) S 5) K
Запишите в поле ответа номера выбранных элементов.
Задание 30
Определите , атомы каких из указанных в ряду элементов в основном состоянии содержат валентные электроны на разных энергетических уровнях.
1) F 2) Cr 3) Mn 4) O 5) P
Запишите в поле ответа номера выбранных элементов.
Ответы:
- 35
- 23
- 35
- 45
- 14
- 13
- 14
- 15
- 25
- 25
- 13
- 34
- 45
- 14
- 23
- 14
- 13
- 34
- 23
- 12
- 24
- 34
- 34
- 14
- 13
- 34
- 12
- 23
- 13
- 23
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
1.
 3: Атомная структура — электронные конфигурации
3: Атомная структура — электронные конфигурации- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31370
Задача
После завершения этого раздела вы сможете записать электронную конфигурацию в основном состоянии для каждого из элементов до атомного номера 36 включительно.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- электронная конфигурация основного состояния
- Правило Хунда
- Принцип исключения Паули
- принцип ауфбау
Электронная конфигурация атома представляет собой расположение электронов, распределенных между орбитальными оболочками и подоболочками. Обычно электронная конфигурация используется для описания орбиталей атома в его основном состоянии, но ее также можно использовать для представления атома, который ионизируется в катион или анион, компенсируя потерю или приобретение электронов в их последующих состояниях. орбитали. Многие физические и химические свойства элементов могут быть связаны с их уникальными электронными конфигурациями. Валентные электроны, электроны на самой внешней оболочке, являются определяющим фактором уникального химического состава элемента.
Обычно электронная конфигурация используется для описания орбиталей атома в его основном состоянии, но ее также можно использовать для представления атома, который ионизируется в катион или анион, компенсируя потерю или приобретение электронов в их последующих состояниях. орбитали. Многие физические и химические свойства элементов могут быть связаны с их уникальными электронными конфигурациями. Валентные электроны, электроны на самой внешней оболочке, являются определяющим фактором уникального химического состава элемента.
Электронные конфигурации
Электронная конфигурация атома представляет собой расположение электронов, распределенных между орбитальными оболочками и подоболочками. Обычно электронная конфигурация используется для описания орбиталей атома в его основном состоянии, но ее также можно использовать для представления атома, который ионизируется в катион или анион, компенсируя потерю или приобретение электронов в их последующих состояниях. орбитали. Многие физические и химические свойства элементов могут быть связаны с их уникальными электронными конфигурациями. Валентные электроны, электроны на самой внешней оболочке, являются определяющим фактором уникального химического состава элемента.
Валентные электроны, электроны на самой внешней оболочке, являются определяющим фактором уникального химического состава элемента.
Перед распределением электронов атома по орбиталям необходимо ознакомиться с основными понятиями электронных конфигураций. Каждый элемент периодической таблицы состоит из атомов, которые состоят из протонов, нейтронов и электронов. Электроны обладают отрицательным зарядом и находятся вокруг ядра атома на электронных орбиталях, определяемых как объем пространства, в котором электрон может быть найден с вероятностью 95%. Четыре разных типа орбиталей (s, p, d и f) имеют разную форму, и одна орбиталь может содержать максимум два электрона. Орбитали p, d и f имеют разные подуровни, поэтому могут удерживать больше электронов.
Как уже говорилось, электронная конфигурация каждого элемента уникальна в зависимости от его положения в периодической таблице. Энергетический уровень определяется периодом, а количество электронов определяется атомным номером элемента. Орбитали на разных энергетических уровнях похожи друг на друга, но занимают разные области в пространстве. 1s-орбиталь и 2s-орбиталь имеют характеристики s-орбитали (радиальные узлы, вероятности сферического объема, могут содержать только два электрона и т. д.), но, поскольку они находятся на разных энергетических уровнях, они занимают разное пространство вокруг ядра. Каждая орбиталь может быть представлена определенными блоками периодической таблицы. S-блок — это область щелочных металлов, включая гелий (группы 1 и 2), d-блок — переходные металлы (группы с 3 по 12), p-блок — основные элементы группы от 13 до 18, а f-блок — ряды лантанидов и актинидов.
Орбитали на разных энергетических уровнях похожи друг на друга, но занимают разные области в пространстве. 1s-орбиталь и 2s-орбиталь имеют характеристики s-орбитали (радиальные узлы, вероятности сферического объема, могут содержать только два электрона и т. д.), но, поскольку они находятся на разных энергетических уровнях, они занимают разное пространство вокруг ядра. Каждая орбиталь может быть представлена определенными блоками периодической таблицы. S-блок — это область щелочных металлов, включая гелий (группы 1 и 2), d-блок — переходные металлы (группы с 3 по 12), p-блок — основные элементы группы от 13 до 18, а f-блок — ряды лантанидов и актинидов.
Использование периодической таблицы для определения электронных конфигураций атомов является ключевым, но также имейте в виду, что существуют определенные правила, которым необходимо следовать при назначении электронов на разные орбитали. Периодическая таблица — невероятно полезный инструмент для записи электронных конфигураций. Для получения дополнительной информации о том, как связаны электронные конфигурации и периодическая таблица, посетите модуль «Подключение электронов к периодической таблице».
Для получения дополнительной информации о том, как связаны электронные конфигурации и периодическая таблица, посетите модуль «Подключение электронов к периодической таблице».
Правила отнесения электронных орбиталей
Принцип исключения Паули
Принцип исключения Паули гласит, что никакие два электрона не могут иметь одинаковые четыре квантовых числа. Первые три (n, l и m l ) могут быть одинаковыми, но четвертое квантовое число должно быть другим. Одна орбиталь может содержать максимум два электрона, которые должны иметь противоположные спины; иначе у них были бы одни и те же четыре квантовых числа, что запрещено. Один электрон имеет спин вверх (m с = +1/2), а другой будет вращаться вниз (m с = -1/2). Это говорит нам о том, что каждая подоболочка имеет удвоенное количество электронов на орбиталь. Подоболочка s имеет 1 орбиталь, которая может содержать до 2 электронов, подоболочка p имеет 3 орбитали, которые могут содержать до 6 электронов, подоболочка d имеет 5 орбиталей, которые могут содержать до 10 электронов, а подоболочка f имеет 7 орбиталей с 14 электронами.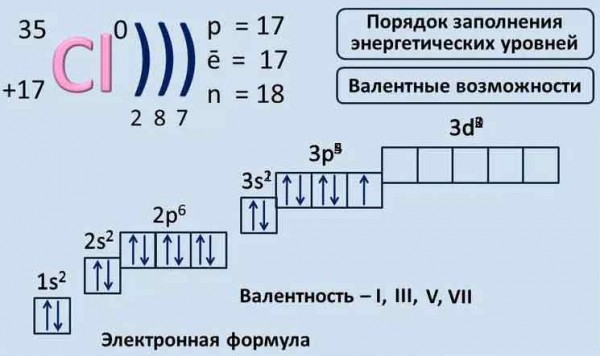 электроны.
электроны.
Пример 1: водород и гелий
Первые три квантовых числа электрона: n=1, l=0, m l =0. Им могут соответствовать только два электрона, т. е. либо m с = -1/2 или м с = +1/2. Как мы уже знаем из наших исследований квантовых чисел и электронных орбиталей, мы можем заключить, что эти четыре квантовых числа относятся к подоболочке 1s. Если задано только одно из значений m s , то мы получим 1s 1 (обозначая водород), если даны оба, мы получим 1s 2 (обозначая гелий). Визуально это можно представить как:
Как показано, подоболочка 1s может содержать только два электрона, и когда она заполнена, электроны имеют противоположные спины.
Правило Хунда
При размещении электронов на орбиталях каждый электрон сначала заполняет все орбитали с одинаковой энергией (также называемой вырожденной), прежде чем спариться с другим электроном на наполовину заполненной орбитали. Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя эти процессы, подумайте о том, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.
Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя эти процессы, подумайте о том, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.
Пример 2: кислород и азот
Если мы посмотрим на правильную электронную конфигурацию атома азота (Z = 7), очень важного элемента в биологии растений: 1s 2 2s 2 2p 3
Мы можем ясно видеть, что p-орбитали заполнены наполовину, так как есть три электрона и три p-орбитали. Это связано с тем, что правило Хунда гласит, что три электрона в подоболочке 2p сначала заполнят все пустые орбитали, а затем заполнят орбитали электронами. Если мы посмотрим на элемент после азота в том же периоде кислорода (Z = 8), его электронная конфигурация будет: 1s 2 2s 2 2p 4 (для атома).
У кислорода на один электрон больше, чем у азота, и поскольку все орбитали заполнены наполовину, электрон должен спариться.
Занятие орбиталей
Электроны заполняют орбитали таким образом, чтобы минимизировать энергию атома. Поэтому электроны в атоме заполняют главные энергетические уровни в порядке возрастания энергии (электроны удаляются от ядра). Относительная энергия орбиталей показана на рисунке \(\PageIndex{2}\)
Рисунок \(\PageIndex{2}\) Относительная потенциальная энергия атомных орбиталейПорядок заполнения уровней следующий:
4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d и 7p
Общий порядок заполнения орбиталей показан на рисунке \(\PageIndex{3}\). Подоболочки, соответствующие каждому значению n , записываются слева направо на последовательных горизонтальных линиях, где каждая строка представляет строку в периодической таблице. Порядок заполнения орбиталей обозначен диагональными линиями, идущими от верхнего правого угла к нижнему левому. Соответственно, 4 9Орбиталь 0124 s заполняется раньше, чем орбиталь 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которого начинается четвертый период, — [Ar]4 s 1 , а конфигурация кальция — [Ar]4 s 2 . Пять орбиталей 3 d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последним членом этого ряда является благородный газ криптон ( Z = 36), [Ar]4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 90 124 с , 3 д и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.
Соответственно, 4 9Орбиталь 0124 s заполняется раньше, чем орбиталь 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которого начинается четвертый период, — [Ar]4 s 1 , а конфигурация кальция — [Ar]4 s 2 . Пять орбиталей 3 d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последним членом этого ряда является благородный газ криптон ( Z = 36), [Ar]4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 90 124 с , 3 д и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.
 Если вы запишите подоболочки для каждого значения главного квантового числа в последовательных строках, наблюдаемый порядок их заполнения будет указан серией диагональных линий, идущих от верхнего правого угла к нижнему левому.
Если вы запишите подоболочки для каждого значения главного квантового числа в последовательных строках, наблюдаемый порядок их заполнения будет указан серией диагональных линий, идущих от верхнего правого угла к нижнему левому. Процесс Aufbau
Aufbau происходит от немецкого слова «aufbauen», означающего «строить». При записи электронных конфигураций орбитали строятся от атома к атому. При записи электронной конфигурации атома орбитали заполняются в порядке возрастания атомного номера. Однако есть некоторые исключения из этого правила.
Пример 3: 3
rd рядных элементовВ соответствии с закономерностью в периоде от B (Z=5) до Ne (Z=10) количество электронов увеличивается, и подоболочки заполняются. В этом примере основное внимание уделяется подоболочке p, которая заполняется от бора до неона.
- B (Z=5) конфигурация: 1s 2 2s 2 2p 1
- C (Z=6) конфигурация: 1s 2 2s 2 2p 2
- N (Z=7) конфигурация: 1s 2 2s 2 2p 3
- O (Z=8) конфигурация: 1s 2 2s 2 2p 4
- F (Z=9) конфигурация: 1s 2 2s 2 2p 5
- Ne (Z=10) конфигурация: 1с 2 2с 2 2п 6
Количество валентных электронов
Количество валентных электронов элемента можно определить по группе периодической таблицы (вертикальный столбец), к которой относится элемент. За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце. Например, в группе 16 цифра единиц равна 6, а элементы в этой группе имеют 6 валентных электронов.
За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце. Например, в группе 16 цифра единиц равна 6, а элементы в этой группе имеют 6 валентных электронов.
* Общий метод подсчета валентных электронов обычно непригоден для переходных металлов. Вместо этого используется модифицированный метод подсчета электронов d .
** За исключением гелия, имеющего только два валентных электрона.
Электронная конфигурация элемента — это расположение его электронов на атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химии.
Пример 1.3.1
Нарисуйте орбитальную диаграмму и используйте ее для получения электронной конфигурации фосфора, Z = 15. Какова его конфигурация валентных электронов?
Дано: атомный номер
Запрошено: орбитальная диаграмма и конфигурация валентных электронов для фосфора в периодической таблице. Затем вычтите количество его электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.
Затем вычтите количество его электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.
Решение:
A Поскольку фосфор находится в третьем ряду периодической таблицы, мы знаем, что он имеет закрытую оболочку [Ne] с 10 электронами. Мы начинаем с вычитания 10 электронов из 15 в фосфоре.
B . Дополнительные пять электронов помещаются на следующие доступные орбитали, которые на рисунке 1. 2.5 показано, что 3 S и 3 P Орбитали:
2.5 показано, что 3 S и 3 P Орбитали:
, потому что 3 S Орбитали ниже энергии в энергии ниже энергии. чем 3 p орбиталей, заполним сначала:
Правило Хунда говорит нам, что оставшиеся три электрона займут вырожденные 3 p орбитали по отдельности, но с выровненными спинами:
Электронная конфигурация [Ne]3 s 2 3 р 3 .
C Мы получаем конфигурацию валентного электрона, игнорируя внутренние орбитали, что для фосфора означает, что мы игнорируем замкнутую оболочку [Ne]. Это дает конфигурацию валентных электронов 3 с 2 3 р 3 .
Упражнение 1.3.1
Нарисуйте орбитальную диаграмму и используйте ее для получения электронной конфигурации хлора, Z = 17. Какова его конфигурация валентных электронов?
- Ответить
- [Ne]3 s 2 3 p 5 ; 3 с 2 3 р 5
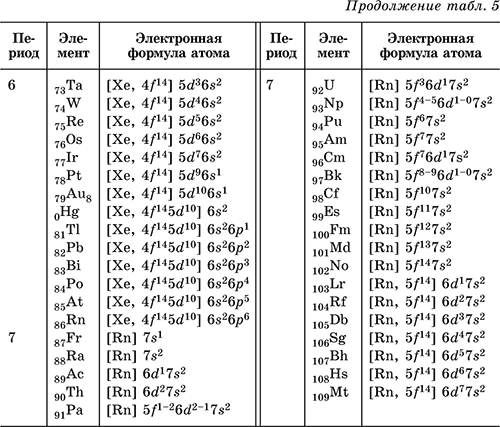
Шестая строка периодической таблицы будет отличаться от двух предыдущих, потому что 4 f орбиталей, которые могут содержать 14 электронов, заполнены между 6 s и 5 d орбиталями. Элементы, которые содержат 4 f орбиталей в своей валентной оболочке, являются лантаноидами. Когда 6 p орбиталей окончательно заполнены, мы достигли следующего (и последнего известного) благородного газа, радона ( Z = 86), [Xe]6 s 2 4 f 14 5 d 10 6 p 6 = [Rn]. В последнем ряду 5 f орбитали заполнены между 7 s и 6 d орбиталями, что дает 14 актинидных элементов. Поскольку большое количество протонов делает их ядра нестабильными, все актиноиды радиоактивны.
Элементы, которые содержат 4 f орбиталей в своей валентной оболочке, являются лантаноидами. Когда 6 p орбиталей окончательно заполнены, мы достигли следующего (и последнего известного) благородного газа, радона ( Z = 86), [Xe]6 s 2 4 f 14 5 d 10 6 p 6 = [Rn]. В последнем ряду 5 f орбитали заполнены между 7 s и 6 d орбиталями, что дает 14 актинидных элементов. Поскольку большое количество протонов делает их ядра нестабильными, все актиноиды радиоактивны.
Пример 1.3.2
Напишите электронную конфигурацию ртути ( Z = 80), указав все внутренние орбитали.
Дано: атомный номер
Запрошено: полная электронная конфигурация
Стратегия:
Используя орбитальную диаграмму на рис. 1.3.1 и периодическую таблицу в качестве руководства, заполните орбитали, пока не будут размещены все 80 электронов.
Решение:
Разместив электроны на орбитах в порядке, показанном на рис. 1.3.1, и используя периодическую таблицу в качестве руководства, мы получим
| 1 с 2 | ряд 1 | 2 электрона |
| 2 с 2 2 р 6 | ряд 2 | 8 электронов |
| 3 с 2 3 р 6 | ряд 3 | 8 электронов |
| 4 s 2 3 d 10 4 p 6 | ряд 4 | 18 электронов |
| 5 s 2 4 d 10 5 p 6 | ряд 5 | 18 электронов |
| ряд 1–5 | 54 электрона |
 Согласно рисунку 1.3.1 нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбитали. В результате получается электронная конфигурация ртути:
Согласно рисунку 1.3.1 нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбитали. В результате получается электронная конфигурация ртути:1 с 2 2 с 2 2 р 6 3 с 9007 8 2 3 р 6 4 с 2 3 д 10 4 р 6 5 с 2 4 д 10 5 р 6 6 с 2 4 f 14 5 d 10 = Hg = [Xe]6 с 90 078 2 4 е 14 5 d 10
с заполненной 5 d подоболочкой, a 6 s 2 4 f 14 5 d 10 val конфигурации оболочки, а всего 80 электронов. (Вы всегда должны проверять, чтобы общее количество электронов равнялось атомному номеру.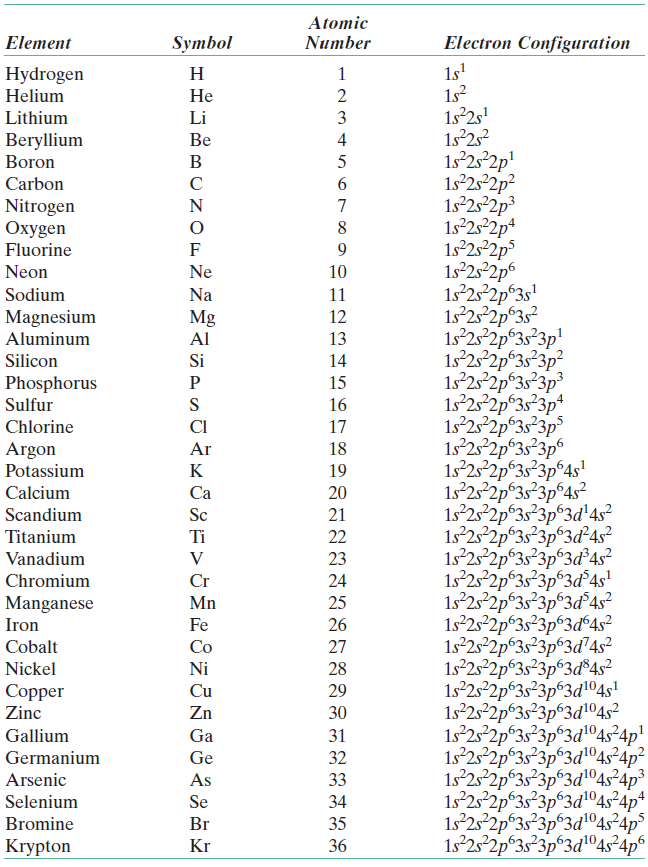 )
)
Резюме
Основываясь на принципе Паули и знании орбитальных энергий, полученных с использованием водородоподобных орбиталей, можно построить периодическую таблицу, заполнив доступные орбитали, начиная с орбиталей с самой низкой энергией (принцип aufbau ), что приводит к определенному расположению электронов для каждого элемента (его конфигурация электронов ). Правило Хунда гласит, что расположение электронов с наименьшей энергией — это то, которое размещает их на вырожденных орбиталях с параллельными спинами. Для химических целей наиболее важными электронами являются те, которые находятся на самой внешней главной оболочке, валентных электронов .
1.3: Atomic Structure — Electron Configurations распространяется под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Тим Содерберг и Тим Содерберг.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- принцип ауфбау
- автор@Дитмар Кеннеполь
- автор@Стивен Фармер
- автор @ Тим Содерберг
- Правило Хунда
- Принцип исключения Паули
9.7: Электронные конфигурации и периодическая таблица
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98053
Цели обучения
- Соотнести электронные конфигурации элементов с формой периодической таблицы.

- Определите ожидаемую электронную конфигурацию элемента по его месту в периодической таблице.
Ранее мы представили периодическую таблицу как инструмент для систематизации известных химических элементов. Периодическая таблица показана на рисунке \(\PageIndex{1}\). Элементы перечислены по атомному номеру (количеству протонов в ядре), а элементы со схожими химическими свойствами сгруппированы в столбцы.
Рисунок \(\PageIndex{1}\): Периодическая таблицаПочему периодическая таблица имеет такую структуру? Ответ довольно прост, если вы понимаете электронные конфигурации: форма периодической таблицы имитирует заполнение подоболочек электронами.
Форма периодической таблицы имитирует заполнение подоболочек электронами.
Начнем с H и He. Их электронные конфигурации: 1 с 1 и 1 с 2 соответственно; He заполняется оболочка n = 1. Эти два элемента составляют первую строку периодической таблицы (Рисунок \(\PageIndex{2}\))
Рисунок \(\PageIndex{2}\): подоболочка 1 s .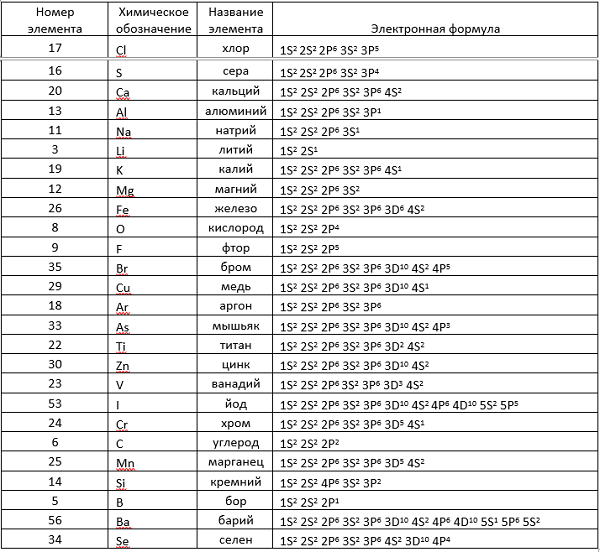 H и He представляют заполнение подоболочки 1 s .
H и He представляют заполнение подоболочки 1 s .Следующие два электрона для Li и Be перейдут в подоболочку 2 s . На рисунке \(\PageIndex{3}\) показано, что эти два элемента расположены рядом в периодической таблице.
Рисунок \(\PageIndex{3}\): 2 с Подоболочка. В Li и Be заполняется подоболочка 2 s .Для следующих шести элементов подоболочка 2 p занята электронами. В правой части периодической таблицы эти шесть элементов (от B до Ne) сгруппированы вместе (рис. \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Подоболочка 2 p . Для B-Ne занята подоболочка 2 p .Следующей подлежащей заполнению подоболочкой является подоболочка 3 s . Элементы, когда эта подоболочка заполняется, Na и Mg, возвращаются в левую часть периодической таблицы (рис. \(\PageIndex{5}\)).
Рисунок \(\PageIndex{5}\): подоболочка 3 s . Сейчас подоболочка 3 s занята. Затем подоболочка 3 p заполняется следующими шестью элементами (рис. \(\PageIndex{6}\)).
\(\PageIndex{6}\)).
Вместо заполнения следующей подоболочки 3 d электроны переходят в подоболочку 4 s (рис. \(\PageIndex{7}\)).
Рисунок \(\PageIndex{7}\): 4 с Подоболочка. Подоболочка 4 s заполняется перед подоболочкой 3 d . Это отражено в структуре периодической таблицы.После заполнения подоболочки 4 s подоболочка 3 d заполняется до 10 электронами. Это объясняет раздел из 10 элементов в середине таблицы Менделеева (рис. \(\PageIndex{8}\)).
Рисунок \(\PageIndex{8}\): подоболочка 3 d . Подоболочка 3 d заполнена в средней части периодической таблицы.…И так далее. Когда мы просматриваем строки периодической таблицы, общая форма таблицы показывает, как электроны занимают оболочки и подоболочки.
Первые два столбца в левой части периодической таблицы занимают подоболочки s .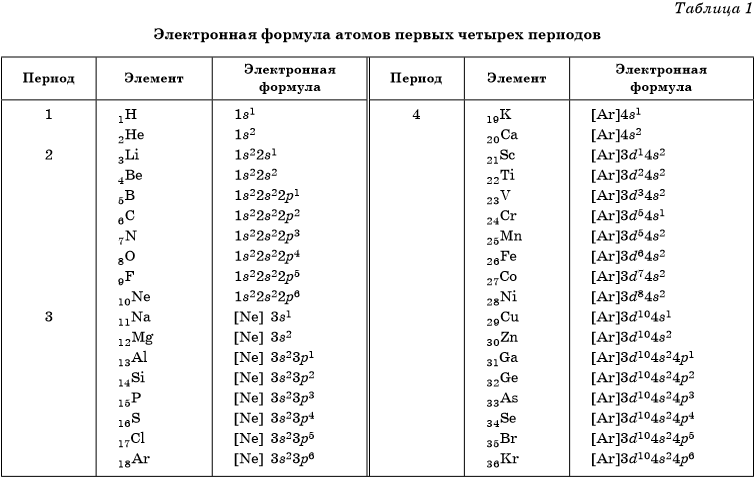 Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается отделенным от основной части периодической таблицы. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой. На рисунке \(\PageIndex{9}\) показаны блоки периодической таблицы.
Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается отделенным от основной части периодической таблицы. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой. На рисунке \(\PageIndex{9}\) показаны блоки периодической таблицы.
Электроны в оболочке с наибольшим номером плюс любые электроны в последней незаполненной подоболочке называются валентными электронами ; оболочка с наибольшим номером называется оболочкой валентности . (Внутренние электроны называются остовными электронами .) Валентные электроны в значительной степени контролируют химию атома. Если мы посмотрим только на электронную конфигурацию валентной оболочки, мы обнаружим, что в каждом столбце электронная конфигурация валентной оболочки одинакова. Например, возьмем элементы в первом столбце периодической таблицы: H, Li, Na, K, Rb и Cs. Их электронные конфигурации (сокращенно для более крупных атомов) следующие, с выделенной электронной конфигурацией валентной оболочки:
(Внутренние электроны называются остовными электронами .) Валентные электроны в значительной степени контролируют химию атома. Если мы посмотрим только на электронную конфигурацию валентной оболочки, мы обнаружим, что в каждом столбце электронная конфигурация валентной оболочки одинакова. Например, возьмем элементы в первом столбце периодической таблицы: H, Li, Na, K, Rb и Cs. Их электронные конфигурации (сокращенно для более крупных атомов) следующие, с выделенной электронной конфигурацией валентной оболочки:
| Г: | 1с 1 |
|---|---|
| Ли: | 1 с 2 2 с 1 |
| №: | [Не]3s 1 |
| К: | [Ar]4s 1 |
| Руб: | [Kr]5s 1 |
| Кс: | [Хе]6s 1 |
Все они имеют одинаковую электронную конфигурацию в своих валентных оболочках: один s электрон. Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь сходный химический состав — и они делают . Организация электронов в атомах объясняет не только форму таблицы Менделеева, но и тот факт, что элементы в одном и том же столбце таблицы Менделеева имеют схожий химический состав.
Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь сходный химический состав — и они делают . Организация электронов в атомах объясняет не только форму таблицы Менделеева, но и тот факт, что элементы в одном и том же столбце таблицы Менделеева имеют схожий химический состав.
То же самое относится и к другим столбцам таблицы Менделеева. Элементы в каждом столбце имеют одинаковую конфигурацию электронов валентной оболочки, а также некоторые химические свойства элементов. Это справедливо для всех элементов в s и p блоков. В блоках d и f из-за исключения порядка заполнения подоболочек электронами подобные валентные оболочки в этих блоках не являются абсолютными. Однако в этих блоках действительно существует много общего, поэтому ожидается сходство в химических свойствах.
Сходство электронной конфигурации валентной оболочки означает, что мы можем определить электронную конфигурацию атома исключительно по его положению в периодической таблице.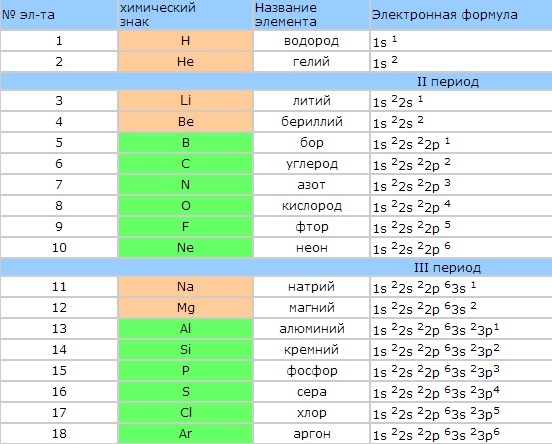 Рассмотрим Se, как показано на рисунке \(\PageIndex{10}\). Он находится в четвертом столбце р блок. Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация селена [Ar]4 s 2 3 d 10 4 p 4 , как и ожидалось.
Рассмотрим Se, как показано на рисунке \(\PageIndex{10}\). Он находится в четвертом столбце р блок. Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация селена [Ar]4 s 2 3 d 10 4 p 4 , как и ожидалось.
Пример \(\PageIndex{1}\): Прогнозирование электронных конфигураций
По положению элемента в периодической таблице предскажите электронную конфигурацию валентной оболочки для каждого атома (рис. \(\PageIndex{11}\)).
Рисунок \(\PageIndex{11}\): Различные элементы периодической таблицы- Ca
- Сн
Solution
- Ca находится во втором столбце блока s . Мы ожидаем, что его электронная конфигурация должна заканчиваться на s 2 .
 Электронная конфигурация кальция [Ar]4 s 2 .
Электронная конфигурация кальция [Ar]4 s 2 . - Sn расположен во втором столбце блока p , поэтому мы ожидаем, что его электронная конфигурация будет заканчиваться на стр 2 . Электронная конфигурация олова: [Kr]5 s 2 4 d 10 5 p 2 .
Упражнение \(\PageIndex{1}\)
По положению элемента в периодической таблице предскажите конфигурацию электрона валентной оболочки для каждого атома. Рисунок \(\PageIndex{11}\).
- Ти
- Кл
- Ответить на
[Ar]4 с 2 3 г 2
- Ответ б
[Ne]3 с 2 3 р 5
Расположение электронов в атомах определяет форму таблицы Менделеева.

 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.


 Электронная конфигурация кальция [Ar]4 s 2 .
Электронная конфигурация кальция [Ar]4 s 2 .
Leave A Comment