реакции, взаимодействие, примеры / Справочник :: Бингоскул
Оксид железа и гидроксид железа: реакции, взаимодействие, примерыдобавить в закладки удалить из закладок
Содержание:
Железо – элемент, расположенный в четвертом периоде в восьмой побочной подгруппе. В природе его нельзя обнаружить в чистом виде, поэтому железо добывают из горных пород. Оно входит в состав таких сплавов, как сталь и чугун. Железо, как правило, проявляет степени окисления +2 или +3.
Оксиды
Оксид железа (II) FeO
Оксид железа (II) – черное кристаллическое вещество, которое нерастворимо в воде и проявляет свойства основания. Оксид железа (II) взаимодействует с растворами, расплавами и другими соединениями.
- С кислотами
FeO + 2 HCl ⟶ FeCl2 + H2O
- С кислородом воздуха
4 FeO + O2 ⟶ 2 Fe2O3
- С водородом
Fe2O3 + H2 ⟶ 2 Fe + H2O
Оксид получают путем следующей реакции:
Fe2O3 + СО ⟶ 2 FeO + CO2
Оксид железа (III) Fe
2O3Оксид железа (III) – красно-коричневый нерастворимый в воде порошок. Он может существовать в трех формах – α, β, γ. Оксид железа (III) не взаимодействует с растворами щелочей. Он обладает амфотерными свойствами и реагирует с рядом веществ.
Он может существовать в трех формах – α, β, γ. Оксид железа (III) не взаимодействует с растворами щелочей. Он обладает амфотерными свойствами и реагирует с рядом веществ.
- С кислотами
Fe2O3 + 6 HCl ⟶ 2 FeCl3 + 3 H2O
- С твердыми щелочами при нагревании
Fe2O3 + NaOH ⟶ 2 NaFeO2 + H2O
- С карбонатами щелочных металлов при нагревании
Fe2O3 + Na2CO3 ⟶ 2 NaFeO2 + CO2
- С восстановителями
Fe2O3 + 2Al ⟶ 2Fe + Al2O3
Оксид железа (III) получают двумя путями:
- 2 Fe(OH)3 ⟶ Fe2O3 + 3 H2O
- 4 FeS2 + 11 O2 ⟶ 2 Fe2O3 + 8 SO2
Оксид железа (III) содержится в буром железняке, из которого изготавливают чугун.
Гидроксиды
Гидроксид железа (II) Fe(OH)
2Гидроксид железа (II) – белый порошок, который на воздухе приобретает зеленый оттенок. Он не растворим в воде и являются основаниями. Гидроксид железа (2) реагирует с растворами и рядом других соединений.
- С кислородом в присутствии влаги
4 Fe(OH)2 + O2 + 2 H2O ⟶ 4 Fe(OH)3
- С кислотами
Fe(OH)2 + 2 HCl ⟶ FeCl2 + 2 H2O
- С концентрированными щелочами при высоких температурах
Fe(OH)2 + 2 NaOH ⟶ Na2[Fe(OH)4]
- Разложение при нагревании
Fe(OH)2 ⟶ FeO + H2O
Гидроксид железа (II) получают путем следующего взаимодействия:
FeCl2 + 2 NaOH ⟶ Fe(OH)2 +2 NaCl
Гидроксид железа (III) Fe(OH)
3Гидроксид железа (III) – бурое рыхлое вещество. Он обладает амфотерными свойствами. Гидроксид железа (III) реагирует с различными соединениями.
Он обладает амфотерными свойствами. Гидроксид железа (III) реагирует с различными соединениями.
- С разбавленными кислотами
Fe(OH)3 + 3 HCl ⟶ FeCl3 + 3 H2O
- Разлагается при нагревании
2 Fe(OH)3 ⟶ Fe2O3 + 3 H2O
- С концентрированными растворами щелочей при нагревании
Fe(OH)3 + 3 NaOH ⟶ Na3[Fe(OH)6]
Гидроксид железа (III) получают при взаимодействии солей и щелочей.
FeCl3 + 3 NaOH = Fe(OH)3 + 3 NaCl
Общие характеристики оксидов и гидроксидов железа
Оксид и гидроксид железа (2) взаимодействуют с растворами кислот, но не реагируют со щелочами. Т. е. они обладают основными свойствами. Оксиду и гидроксиду железа (III) характерны слабые амфотерные свойства.
Соединения двухвалентного железа – восстановители, т. е. в реакциях они отдают электроны элементам. Они просто окисляются на воздухе. Соединения трехвалентного железа – окислители. Они длительное время могут находиться в растворе.
Они просто окисляются на воздухе. Соединения трехвалентного железа – окислители. Они длительное время могут находиться в растворе.
Поделитесь в социальных сетях:
23 сентября 2021, 22:08
Could not load xLike class!
Железо (III) оксид для ферритов ММ-2
Оптовые поставки оксида железа
Продаем оптом оксиды железа собственного производства в упаковках с разным весом, мелкодисперсные, с квалификацией «ч».
Предлагаем оксид железа III марки ММ-2.
Упаковка маркируется литерой «ч», указывающей на высокую химическую чистоту продукта – примеси других веществ составляют не более сотых и тысячных долей процента.
На свою продукцию мы предоставляем гарантию качества и пригодности до 2 лет при условии хранения в надлежащих условиях. Завод берет на себя организацию бережной доставки, исключающей порчу реактива.
Завод гарантирует полное соответствие заявленного качества реальным свойствам поставляемой продукции. Сырье производится на современном оборудовании с использованием передовых технологий. Проводится строгий контроль качества: полный спектр предпродажных проверок с забором проб и проверкой их в лабораторных условиях.
Проводится строгий контроль качества: полный спектр предпродажных проверок с забором проб и проверкой их в лабораторных условиях.
По желанию заказчика мы разрабатываем персональные ТУ, соответствующие конкретным условиям предприятия. Также есть каталог готовых нормативов.
Свойства оксида железа (III)
представляющий собой соединение железа с кислородом. Это мелкодисперсный порошок красноватого цвета, иногда с коричневым оттенком. Вещество отличается высокой однородностью, используется для производства ферритов.
Вещество проявляет амфотерность, но основные свойства более очевидны. Природный минерал красновато-коричневого цвета, устойчивый термически. На воду не реагирует, с кислотами и щелочами вступает в реакцию, но медленно.
При сплавлении с другими оксидами образует шпинели, двойные оксиды.
Для длительного сохранения заявленных производителем свойств, вещество необходимо хранить в закрытом сухом помещении.
Вещество токсично, при контакте или наличии взвеси в воздухе возникает раздражение кожи, слизистых оболочек и глаз. Поэтому, согласно требованиям безопасности, работа с оксидом железа мелкодисперсным проводится только с применением средств индивидуальной защиты. Используются резиновые перчатки, специальные очки, респираторы с противопылевым эффектом.
Поэтому, согласно требованиям безопасности, работа с оксидом железа мелкодисперсным проводится только с применением средств индивидуальной защиты. Используются резиновые перчатки, специальные очки, респираторы с противопылевым эффектом.
В помещении, где идет работа с соединением, необходимо поддерживать уровень допустимой концентрации в воздухе – не выше 1 мг на метр кубический. Обязательно устанавливается приточно-вытяжная вентиляция. В зонах наибольшей концентрации пыли оксида железа устанавливаются укрытия с отдельными вентиляционными системами.
Химическая активностьВступает в реакцию с раствором соляной кислоты.
Реагирует на натриевую соль угольной кислоты (карбонат натрия).
При сплавлении взаимодействует с едким натром (гидроксидом натрия).
При нагревании до определенных температур начинает проявлять слабые магнетические свойства.
Предлагаем сотрудничество крупным заказчикам на удобных условиях – со скидками и бесплатной доставкой. Завод без проблем обеспечит производство заказа с любым объемом продукции необходимого сырья. Заключаем долгосрочные договоры на регулярные поставки.
Завод без проблем обеспечит производство заказа с любым объемом продукции необходимого сырья. Заключаем долгосрочные договоры на регулярные поставки.
| Систематическое наименование | Оксид железа (III) |
|---|---|
| Традиционные названия | окись железа, колькотар, крокус, железный сурик |
| Хим. формула | Fe2O3 |
| Рац. формула | Fe2O3 |
| Состояние | твёрдое |
| Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Температура плавления | 1566 °C |
| Температура кипения | 1987 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Рег. номер CAS | 1309-37-1 |
| PubChem | 518696 |
| Рег. номер EINECS | 215-168-2 |
| SMILES | [Fe+3].[Fe+3].[O-2].[O-2]. |
1S/2Fe.3O | |
| Кодекс Алиментариус | E172(ii) |
| RTECS | NO7400000 |
| ChEBI | 50819 |
| ChemSpider | 14147 |
| В таблице указаны данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Показатели качества | |
| Наименование показателя | Требования ТУ |
| Чистый | |
| 1. Массовая доля оксида железа (Fe2O3), %, не менее | 99,5 |
| 2. Массовая доля потерь при прокаливании, %, не более | 0,5 |
| 3. Массовая доля растворимых в воде веществ, %, не более | 0,2 |
| 4. Массовая доля сульфатов (SO4), %, не более | 0,20 |
5. Массовая доля алюминия (Al), %, не более Массовая доля алюминия (Al), %, не более | 0,015 |
| 6. Массовая доля кремния (Si), % | 0,01 |
| 7. Массовая доля (Mg), %, не более | 0,01 |
| 8. Массовая доля марганца (Mn), % | 0,025 |
| 9. Массовая доля меди (Cu), %, не более | 0,01 |
| 10. Массовая доля хрома (Cr), %, не более | 0,015 |
| 11. Массовая доля кальция (Са), % | 0,01 |
| 12. Массовая доля суммы калия и натрия (К+Na), %, не более | 0,01 |
| 13. Массовая доля остатка на сите с сеткой №004К, %, не более | 1,0 |
| 14. Насыпная (утрясенная) масса, г/см3, , в пределах | 1,0-1,6 |
| 15. Коэффициент усадки при температуре 1000оС в пределах | 1,17-1,25 |
| 16. Время растворения в 6Н соляной кислоте, сек, не более | 1000 |
Доставляем продукцию точно в срок – по железной дороге или автотранспортом.
Так как железа (III) оксид требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Вообще, разработаны ГОСТы по его упаковке, и мы конечно, стараемся их соблюдать. Поэтому на нашем химическом заводе готовое вещество упаковываются в прочные полиэтиленовые мешки, завязываемые двойным узлом нитью или даже запаиваются по желанию заказчика. Далее мешки помещаются в фанерные коробы или в картонные навивные, или, на выбор покупателя, так же возможна упаковка в бумажные пяти-шести-слойные мешки.
Производство ферритов представляет собой соединение окисей железа и других металлов.
Распространен в естественной среде как минерал гематит. Наличие его в почве придает ей красноватый оттенок. Встречается его модификация в виде кристаллов маггемита, обладающего магнитными свойствами.
Образует природные залежи оксидных руд – гематита и лимонита.
Применение железа (III) оксида для ферритов ММ-2
ктивно используется в хозяйстве, во многих отраслях.
Вместе с другими видами оксидов железа используется в технологиях чугуноплавления, изготовлении стали и других металлургических производственных цепочках.
Железный сурик, производное оксидов. Применяется для полировки стали и стекла.
На основе оксидов, которые являются природными красителями, производится целая гамма красок: охры, сурика и других.
Термостойкие краски и эмали содержат оксиды железа.
Используется в производстве керамики.
Является основным компонентом в массах для очищения газов.
Используется в гальванопластике, электролизах и других технологиях с применением электричества.
Применяется в производстве цементов и различных строительных смесей.
Занимает важное место в технологии производства нашатырного спирта, используется в качестве катализатора.

Оксид железа лежит в основе разработки топлива, имеющего эффективность, не сравнимую ни с одним видом энергетических веществ, которые применяются сейчас.
Меры предосторожности при обращении с веществом
Среди негативных воздействий на человека — это общее токсическое воздействие при контакте с веществом без средств защиты, при попадании на кожу может вызвать сильное раздражение, тот же эффект ждет в случае попадания на слизистую оболочку. Предельно допустимая концентрация внутри рабочей зоны не должна превышать — 1 мг/м.
Во время работы с веществом нужно обязательно использовать индивидуальные средства защиты, например такие как: респираторами, резиновыми перчатками, защитными очками.
В помещениях где проводятся работы, необходимо обеспечить наличие общей приточно-вытяжной вентиляции. А места наибольшей концентрации вещества должны быть отдельны от общего пространства помещения и так же должны быть с локальной вытяжной вентиляцией. Проводить исследование вещества следует в вытяжном шкафу, в специально оборудованной для этого, лаборатории.
Проводить исследование вещества следует в вытяжном шкафу, в специально оборудованной для этого, лаборатории.
Приглашаем к сотрудничеству
Работаем по каталогу готовых ТУ, разрабатываем новые для конкретных задач клиентов.
Крупные партии продукции продаем со скидками. При заключении договоров на долговременные поставки предлагаем особые условия.
Видео-урок: свойства и реакции железа и оксидов железа
Стенограмма видео
В этом видео мы узнаем о свойства железа и его оксидов. И мы рассмотрим некоторые из них реакции. Начнем с железа.
Железо — очень важный металл для
экономики и используется во многих приложениях. Железо практически не используется в чистом виде.
металл, но обычно легирован другими элементами, например, углеродом в
сталь. Около пяти процентов земной
кора состоит из этого переходного элемента. Железо содержится в рудах
корка.
Теперь, когда мы немного знаем о железе, давайте посмотрим на некоторые из его свойств. Чистое железо относительно мягкое и низкая твердость. Мы склонны считать железо сильным и тяжело. Но помните, что почти всегда легированные другими элементами для улучшения его прочности и других свойств. Как и другие металлы, железо довольно ковкий и может быть забит в плоские листы. Железо можно вытянуть в тонкую проволоку, и поэтому мы говорим, что он пластичен.
Железо обладает магнитными свойствами. Он взаимодействует и привлекает
к магнитному полю. Железо является постоянным магнитом, то есть
у него есть магнитное поле само по себе. Плавится при 1538 градусах Цельсия,
что намного выше, чем температура плавления многих других чистых металлов и значительно
выше температуры плавления многих сплавов. Как соотносится его плотность? Плотность железа составляет 7,87 грамма на
кубический сантиметр и намного плотнее, чем, например, алюминий, плотность которого
2,7 грамма на кубический сантиметр, но менее плотный, чем медь.
Как соотносится его плотность? Плотность железа составляет 7,87 грамма на
кубический сантиметр и намного плотнее, чем, например, алюминий, плотность которого
2,7 грамма на кубический сантиметр, но менее плотный, чем медь.
Теперь давайте поговорим о химическом составе железа.
свойства и как на это реагировать. Реакция элемента зависит от
его электронной структуры или электронной конфигурации. Это электроника железа
конфигурация. Железо теряет электроны при реакции
с другими веществами. Обычное окисление утверждает, что это
формы, когда он реагирует, плюс два и плюс три. Вот электронный
конфигурации Fe2+. Два 4s-электрона были
потерянный. А вот и электронный
конфигурации Fe3+. Два 4s электрона и один 3d
электрон потерян. Часто ионы Fe2+ в растворе образуют
раствор бледно-зеленый, тогда как ионы Fe3+ в растворе часто имеют оранжево-коричневый или
красно-коричневый.
Теперь освободим место для осмотра в химических свойствах или реакциях железа несколько глубже. Когда железо раскаляется до красна, он реагирует с кислородом. Черный магнитный Fe3O4 – это продукт. Этот кислород может быть чистым кислородом или от сухого воздуха. С газообразной водой или водой в ее в виде пара, раскаленное железо также производит этот магнитный оксид железа, а также водород газ. С неметаллами, такими как хлор и серы, для этих реакций требуется затрата энергии. И соответствующий хлорид или образуется сульфид.
С хлором реакция две
Твердое Fe плюс три газообразных Cl2 нагревают, чтобы получить два твердых FeCl3. Железо здесь имеет степень окисления
плюс три. Общее название этого продукта
хлорид железа. В случае реакции с
серы, уравнение представляет собой твердое Fe плюс твердое S при нагревании с получением твердого FeS. Степень окисления железа в
продукт. плюс два. Общее название этого продукта
сульфид железа. Суффиксы -ic и -ous часто
используется с этими степенями окисления.
Степень окисления железа в
продукт. плюс два. Общее название этого продукта
сульфид железа. Суффиксы -ic и -ous часто
используется с этими степенями окисления.
Железо может реагировать с разбавленным минералом кислоты. Общее уравнение металл плюс разбавленная кислота дает соль и газообразный водород. С разбавленной соляной кислотой образуется соответствующая хлоридная соль с железом в состоянии плюс два, т.е. хлорид железа. С разбавленной серной кислотой, опять же, продукт железа находится в степени окисления плюс два, и это называется железным сульфат или сульфат железа (II) по названию ИЮПАК.
Однако, когда чистое железо реагирует с
горячей концентрированной серной кислоты образуются немного другие продукты. Две разные соли железа
получается, один со степенью окисления плюс два, а другой со степенью окисления плюс три
степень окисления. Уравнение реакции три Fe
твердое вещество плюс восемь жидкостей h3SO4 нагревают, чтобы получить водный раствор FeSO4 плюс Fe2(SO4)3
водный плюс четыре газа SO2 плюс восемь газов H3O. Теперь, почему есть два разных
изделия из железа с горячей концентрированной серной кислотой, но только одно изделие из железа с
разбавленная серная кислота из-за окислительного характера серной кислоты. Железо окисляется до Fe2+
серная кислота. Но с горячей концентрированной серной
кислоты, кислота настолько окислительна, что часть Fe2+ может быть дополнительно окислена до
Fe3+.
Уравнение реакции три Fe
твердое вещество плюс восемь жидкостей h3SO4 нагревают, чтобы получить водный раствор FeSO4 плюс Fe2(SO4)3
водный плюс четыре газа SO2 плюс восемь газов H3O. Теперь, почему есть два разных
изделия из железа с горячей концентрированной серной кислотой, но только одно изделие из железа с
разбавленная серная кислота из-за окислительного характера серной кислоты. Железо окисляется до Fe2+
серная кислота. Но с горячей концентрированной серной
кислоты, кислота настолько окислительна, что часть Fe2+ может быть дополнительно окислена до
Fe3+.
Посмотрим на последнюю реакцию
чистое железо. При взаимодействии чистого железа с
концентрированной азотной кислоты на поверхности железа образуется слой. Поверхностный слой неактивен или
нереактивный. В результате реакции образуется тонкий оксид
слой, покрывающий поверхность металла. Этот слой препятствует металлу
внизу от дальнейшей реакции. Этот процесс обработки металла
поверхность, обычно с кислотой, чтобы сделать ее неактивной или нереакционноспособной, называется
пассивация. Мы говорим, что металлическая поверхность была
переданы или сделаны пассивными. Мы не будем рассматривать конкретные
химическое уравнение этой реакции. Пассивация полезна
предотвратить или замедлить ржавление.
Этот слой препятствует металлу
внизу от дальнейшей реакции. Этот процесс обработки металла
поверхность, обычно с кислотой, чтобы сделать ее неактивной или нереакционноспособной, называется
пассивация. Мы говорим, что металлическая поверхность была
переданы или сделаны пассивными. Мы не будем рассматривать конкретные
химическое уравнение этой реакции. Пассивация полезна
предотвратить или замедлить ржавление.
Итак, мы узнали о железе
и его свойства и рассмотрели некоторые из его реакций. Теперь обратим внимание на
оксиды железа. Три оксида железа мы будем
обсуждаются FeO , название которого по ИЮПАК — оксид железа (II) и обычное название — оксид железа;
Fe2O3, название которого по ИЮПАК — оксид железа (III), а общепринятое название — оксид железа; и Fe3O4,
который известен как оксид железа (II, III) и иногда называется оксидом железа.
Мы знаем, что железо в оксиде железа имеет степень окисления плюс два. Это черное твердое вещество, которое часто встречается в виде порошка. Он нерастворим в воде, а минеральная руда, в которой он находится, называется вюститом. Вюстит не так экономичен важны, как и другие руды железа. И это потому, что большая часть находится в мантии Земли, а не в земной коре. Мантия Земли намного глубже и, следовательно, более труднодоступным.
Оксид железа красно-коричневый
твердый. Является основным компонентом
ржавчина. Он также нерастворим в воде. В природе широко распространен в
рудный гематит. Гематит — красновато-черный
цвет. Эта руда является основным источником железа.
для сталелитейной промышленности и поэтому является очень важной рудой. Из-за прекрасного красно-коричневого
цвет этого оксида железа, он часто используется в красках пигментов. И мы знаем, что окисление
состояние железа в этом соединении плюс три.
И мы знаем, что окисление
состояние железа в этом соединении плюс три.
Теперь последний оксид железа, который мы посмотрю интересно. В Fe3O4 ионы железа имеют разные степени окисления: плюс два и плюс три. Его часто считают Оксид Fe2+ и оксид Fe3+, смешанные вместе в виде комбинированного соединения. Иногда его формулу записывают как FeO.Fe2O3. Но мы просто упрощаем и говорим Fe3O4. Этот оксид представляет собой твердое вещество черного цвета. используется как черный пигмент. Он сильно магнитится и встречается в природе в рудном магнетите, который является наиболее распространенным железом руда.
Теперь мы немного знаем о железе
оксидов, а также некоторые их физические свойства. Теперь давайте посмотрим на их
химические реакции. Мы также обсудим, как они
готовый. Начнем с железа(II)
окись. Как он синтезируется? FeO получают термическим
разложение оксалата железа(II) в инертной атмосфере, т. е. в
отсутствие воздуха. Это структура железа (II)
оксалат, а побочными продуктами являются окись углерода и углекислый газ.
Как он синтезируется? FeO получают термическим
разложение оксалата железа(II) в инертной атмосфере, т. е. в
отсутствие воздуха. Это структура железа (II)
оксалат, а побочными продуктами являются окись углерода и углекислый газ.
FeO также может быть получен, когда другие оксиды железа восстанавливаются. Давайте посмотрим. В этой реакции газообразный водород используется в качестве восстановителя для превращения железа в его степени окисления плюс три в плюс две степени окисления. Иногда восстановитель, который используется угарный газ. Уравнение реакции для восстановление железа в его состоянии «три плюс» до состояния «два плюс» — это твердый Fe2O3 плюс h3 газ нагревается с образованием двух твердых веществ FeO плюс газообразного H3O.
Теперь давайте посмотрим на это
реакция. Опять же, используется газообразный водород. как восстановитель. Но в этом случае начало
оксид представляет собой оксид железа (II, III). И получаем тот же продукт:
оксид железа(II) или оксид железа. Уравнение реакции идентично
к предыдущему за исключением того, что у нас другой исходный оксид, и поэтому
балансировка разная. Итак, это три способа подготовки
оксид железа(II).
как восстановитель. Но в этом случае начало
оксид представляет собой оксид железа (II, III). И получаем тот же продукт:
оксид железа(II) или оксид железа. Уравнение реакции идентично
к предыдущему за исключением того, что у нас другой исходный оксид, и поэтому
балансировка разная. Итак, это три способа подготовки
оксид железа(II).
Теперь давайте взглянем на некоторые
реакции оксида железа(II). Когда оксид железа(II) находится в
присутствии газообразного кислорода и нагревании реакционной системы, Fe2O3 или оксида железа (III)
производится. Уравнение реакции четыре
оксиды железа реагируют с кислородом при нагревании с образованием двух оксидов железа. Кислород вызывает окисление железа
из степени окисления плюс два в степень окисления плюс три. Оксид железа(II) может реагировать с
разбавьте минеральные кислоты в соответствии со следующим общим уравнением: оксид металла плюс
разбавленная кислота дает соль и воду. Например, оксид железа(II) может
реагируют с разбавленной серной кислотой. Соответствующая сульфатная соль
добываемой, а также жидкой воды.
Например, оксид железа(II) может
реагируют с разбавленной серной кислотой. Соответствующая сульфатная соль
добываемой, а также жидкой воды.
Теперь переходим к следующему оксиду, Fe2O3. Для получения оксида железа(III) железо (III) плюс соль, такая как хлорид железа (III), в растворе реагирует с гидроксид, такой как гидроксид аммония, также известный как раствор аммиака. Гидроксид железа(III) выходит из раствор в виде осадка. Если этот осадок затем нагреть, разлагается с образованием целевого продукта и воды в газообразном виде или воды пар.
Другой способ получения железа(III)
оксида заключается в нагревании сульфата железа (II), который разлагается с образованием оксида железа, а также
два оксида серы, газообразный диоксид серы и газообразный триоксид серы. Мы быстро рассмотрим один
реакция оксида железа(III), а именно его реакция с горячим концентрированным минералом
кислота. В этом примере возьмем
серная кислота. Оксид железа(III) и серная
кислоты реагируют друг с другом в горячих условиях с образованием соли сульфата железа (III) в виде
ну как вода. Уравнение реакции Fe2O3
твердое вещество плюс три жидкости H3SO4 при нагревании с получением водного Fe2(SO4)3 плюс три воды H3O
газ.
В этом примере возьмем
серная кислота. Оксид железа(III) и серная
кислоты реагируют друг с другом в горячих условиях с образованием соли сульфата железа (III) в виде
ну как вода. Уравнение реакции Fe2O3
твердое вещество плюс три жидкости H3SO4 при нагревании с получением водного Fe2(SO4)3 плюс три воды H3O
газ.
Мы рассмотрели множество уравнений, поэтому далеко для получения и реакции первых двух оксидов железа, а именно, оксид железа(II) и оксид железа(III). Давайте посмотрим только на три больше уравнений, и они относятся к последнему оксиду, оксиду железа (II, III). Помимо извлечения его из руды, как мы можем получить оксид железа (II, III)?
Мы можем синтезировать этот оксид путем
взаимодействие Fe2O3 или оксида железа(III) с окисью углерода. Реакционная система должна быть
нагревается почти до 300 градусов по Цельсию. Образуется газообразный диоксид углерода
а также наш желаемый оксид железа. Вам может быть интересно, если это
оксид не может быть легче получен простой реакцией железа с кислородом из
воздух. И да можно, но мы не будем
посмотрите на это уравнение реакции здесь.
Образуется газообразный диоксид углерода
а также наш желаемый оксид железа. Вам может быть интересно, если это
оксид не может быть легче получен простой реакцией железа с кислородом из
воздух. И да можно, но мы не будем
посмотрите на это уравнение реакции здесь.
Последние два уравнения, которые мы будем посмотрите в этом видео реакции оксида железа(II,III). Первый – это его реакция с горячей концентрированной серной кислотой и последняя реакция с кислородом. Вот уравнение реакции с горячей концентрированной серной кислоты. Я не буду читать всю реакцию уравнение снова на этот раз. Но обратите внимание, что есть два различные продукты, содержащие железо. И ионы железа в этих двух соли имеют разные степени окисления и обе содержат сульфат-ионы, потому что серная кислота была одним из реагентов.
Посмотрим на последний
реакция. Когда оксид железа (II, III) реагирует
кислородом и система нагревается, образуется оксид железа. Обратите внимание, что ионы железа,
в состоянии «три плюса» остаются в состоянии «три плюс». Но газообразный кислород вызывает окисление
этих ионов железа в состоянии два плюс, два или три плюс состояние. Так что все железо заканчивается тройкой
плюс государство.
Когда оксид железа (II, III) реагирует
кислородом и система нагревается, образуется оксид железа. Обратите внимание, что ионы железа,
в состоянии «три плюса» остаются в состоянии «три плюс». Но газообразный кислород вызывает окисление
этих ионов железа в состоянии два плюс, два или три плюс состояние. Так что все железо заканчивается тройкой
плюс государство.
Теперь пришло время подвести итоги
мы научились. Мы узнали о некоторых
физические свойства чистого железа, например его относительная мягкость, магнитная
способности и его высокая температура плавления. Мы также узнали о трех оксидах
железа — оксид железа(II), оксид железа(III) и триоксид железа(II, III)
— и что последние два находятся в важных рудах. Мы также рассмотрели множество реакций
можно перечислить здесь много, но видел, что многие реакции железа и его оксидов требуют
тепловая энергия и что железо и его оксиды реагируют с кислотами с образованием железа
соли.
Объяснение урока: Свойства и реакции железа и оксидов железа
В этом толкователе мы научимся описывать свойства и реакции железа и его оксидов.
Железо — самый распространенный переходный элемент в земной коре и невероятно важный металл для общества. Хотя он кажется вездесущим, чистое железо очень редко используется вокруг нас, и огромное количество железа, извлеченного из его руды, используется для изготовления множества различных сплавов. Наиболее распространенные сплавы железа включают в себя различные формы стали, которые имеют множество свойств и множество применений. Однако чистое железо не имеет большого промышленного значения из-за его относительной мягкости и низкой твердости.
Чистое железо ковкое и пластичное, обладает магнитными свойствами. Он плавится при 1538°C и имеет плотность 7,87 г/см 3 в твердом состоянии. Точные физические свойства чистого железа зависят от конечной чистоты металла. Любые оставшиеся примеси, оставшиеся от руды, из которой она была извлечена, повлияют на ее физические свойства.
Пример 1: Определение физических свойств металлического железа
Какое из следующих свойств не верно для чистого железа?
- Чистое железо легко вытягивается или растягивается в тонкую проволоку.
- Чистое железо имеет сияющий блеск.
- Чистое железо очень мягкое с низкой твердостью.
- Чистое железо имеет низкую температуру плавления.
- Чистое железо обладает магнитными свойствами.
Ответ
В то время как некоторые свойства железа хорошо известны, такие как его магнетизм, менее известные свойства могут быть поняты из общих свойств металлов; кроме того, некоторые из них специфичны для железа и должны быть запомнены. Как и многие металлы, железо пластично и может быть вытянуто в проволоку, что исключает ответ А. Кроме того, как и многие металлы, железо можно полировать до блеска, что исключает ответ Б.
Физические свойства, характерные для железа, включают тот факт, что оно является магнитным, без учета ответа E, и что это мягкий металл с низкой твердостью, без учета ответа C.
Это оставляет нам ответ D, в котором говорится, что чистое железо имеет низкая температура плавления. Однако чистое железо плавится при 1538∘C, что не считается низкой температурой, а это означает, что ответ D является правильным ответом.
Железо имеет некоторые общие физические и химические свойства с другими металлами d-блока того же периода. Однако степени окисления железа различны. Атомы железа не образуют степень окисления +8, соответствующую потере всех электронов на 3d- и 4s-орбиталях. Это отличается от соседнего элемента марганца, который может потерять все свои 3d- и 4s-электроны, образуя степень окисления +7. Хотя железо может иметь степени окисления в диапазоне от -4 до +7, его наиболее распространенными степенями окисления являются +2 и +3.
При образовании ионов железо потеряет два электрона из подоболочки 4s, но также может потерять третий электрон со своей парной 3d-орбитали, что приведет к степени окисления +3.
Пример 2. Определение электронной конфигурации иона железа
Принимая во внимание электронную конфигурацию металлического железа, представленную на диаграмме, какова электронная конфигурация иона Fe2+?
Ответ
Подобно другим переходным металлам, атомы железа будут преимущественно терять электроны с 4s-подоболочки, прежде чем терять электроны с 3d-орбиталей. Таким образом, в этом вопросе мы ищем ответы, в которых оба электрона были потеряны из подоболочки 4s. Это оставляет нам ответ B и ответ C как возможные правильные ответы. Атом элемента железа имеет 26 протонов, и поэтому ион Fe2+ будет иметь 24 электрона. Аргон имеет 18 электронов, а это означает, что подоболочка 3d должна содержать 6 электронов, чтобы дать нам всего 24 электрона. Другим способом обесценивания C было бы сравнение исходной диаграммы в вопросе и замечание, что 3 электрона были потеряны в C. Без учета C правильным ответом будет B.
Таким образом, в этом вопросе мы ищем ответы, в которых оба электрона были потеряны из подоболочки 4s. Это оставляет нам ответ B и ответ C как возможные правильные ответы. Атом элемента железа имеет 26 протонов, и поэтому ион Fe2+ будет иметь 24 электрона. Аргон имеет 18 электронов, а это означает, что подоболочка 3d должна содержать 6 электронов, чтобы дать нам всего 24 электрона. Другим способом обесценивания C было бы сравнение исходной диаграммы в вопросе и замечание, что 3 электрона были потеряны в C. Без учета C правильным ответом будет B.
Железо реагирует аналогично большинству металлов, но необходимо соблюдать осторожность, чтобы полученные соединения железа имели желаемую степень окисления.
Одна из простейших реакций включает взаимодействие раскаленного докрасна железа с сухим воздухом или кислородом с образованием магнитного оксида железа (II, III): 3Fe()+2O()FeO()sgs234
Раскаленное докрасна железо при температуре около 500∘C также будет реагировать с водяным паром с образованием магнитного оксида железа(II, III) и газообразного водорода: 3Fe()+4HO()FeO()+4H()sgsg2342∘C
Железо также может реагировать с неметаллами с образованием соответствующего бинарного соединения; хотя опять же необходимо соблюдать осторожность, чтобы правильно определить степень окисления продукта железа: 2Fe()+3Cl()2FeCl()Fe()+S()FeS()sgssss23
Здесь следует отметить некоторые названия, которые можно использовать для описания соединений железа. Образовавшееся выше соединение хлорида, которое формально можно было бы назвать хлоридом железа (III), также можно назвать хлоридом железа. Термин трехвалентное железо относится к железу в степени окисления +3. Напротив, сульфид железа (II) (FeS) также может называться сульфидом железа. Здесь термин «железо» относится к соединению железа, в котором железо имеет степень окисления +2.
Образовавшееся выше соединение хлорида, которое формально можно было бы назвать хлоридом железа (III), также можно назвать хлоридом железа. Термин трехвалентное железо относится к железу в степени окисления +3. Напротив, сульфид железа (II) (FeS) также может называться сульфидом железа. Здесь термин «железо» относится к соединению железа, в котором железо имеет степень окисления +2.
При окислении металлического железа разбавленными минеральными кислотами образуются соли железа(II): Fe()+HSO()FeSO()+H()Fe()+2HCl()FeCl()+H()saqaqgsaqaqg244222
Однако при взаимодействии металлического железа с концентрированной серной кислотой часть ионов железа(II) далее окисляются до ионов железа (III), в результате чего образуется смесь продуктов, включающая сульфат железа, сульфат железа, газообразный диоксид серы и водяной пар: 3Fe()+8HSO()FeSO()+Fe(SO)()+4SO()+8HO()slaqaqgg24424322conc.HSO24
Пример 3. Вызов продуктов реакции между металлическим железом и разбавленными минеральными кислотами
Какое из следующих утверждений верно?
- Железо можно растворить в разбавленной соляной кислоте с образованием хлорида железа(III) и воды.

- Железо можно растворить в разбавленной соляной кислоте с образованием хлорида железа(II) и газообразного водорода.
- Железо можно растворить в разбавленной соляной кислоте с образованием хлорида железа(II) и воды.
- Железо можно растворить в разбавленной соляной кислоте с образованием хлорида железа(III) и газообразного водорода.
Ответ
Одним из химических свойств железа, общих с большинством металлов, является его реакция с разбавленной кислотой. Металлы, когда они реагируют с кислотами, образуют соли и газообразный водород, поэтому ответы А и С, где одним из продуктов является вода, оба неверны.
При взаимодействии металлического железа с разбавленными кислотами образуются соли железа(II). Соли железа(III) образуются только в реакциях с концентрированными минеральными кислотами. Это дает нам правильный ответ, B.
Одна особенно интересная реакция с участием железа и азотной кислоты является примером физико-химического и инженерного процесса, известного как пассивация. При взаимодействии концентрированной азотной кислоты с металлическим железом на поверхности металла образуется тонкий слой оксида железа. Этот слой оксида предотвращает попадание дальнейших молекул кислоты на поверхность железа и, следовательно, обеспечивает защиту от коррозии. Однако это оксидное покрытие можно удалить добавлением разбавленной соляной кислоты или шлифованием стеклянной бумагой.
При взаимодействии концентрированной азотной кислоты с металлическим железом на поверхности металла образуется тонкий слой оксида железа. Этот слой оксида предотвращает попадание дальнейших молекул кислоты на поверхность железа и, следовательно, обеспечивает защиту от коррозии. Однако это оксидное покрытие можно удалить добавлением разбавленной соляной кислоты или шлифованием стеклянной бумагой.
Одной из наиболее интересных групп соединений железа являются оксиды. Железо образует три различных оксида с различными физическими и химическими свойствами.
Оксид железа(II) содержится в минерале вюстите, но может образовываться химическим путем при разложении оксалата железа в отсутствие воздуха:
CCOOO—OFe2+FeCO()FeO()+CO()+CO() 242ssgg(отсутствие воздуха)
Оксид железа(II) также может образовываться путем восстановления оксидов железа в более высокой степени окисления, таких как оксид железа(III) и оксид железа(II, III): FeO()+H()2FeO()+HO()FeO()+H()3FeO()+HO()23223422sgsgsgsg––∘∘CC
Однако следует отметить, что хотя эти реакции FeO протекают теоретически, на практике полученный FeO нестабилен при температуре ниже 570°C и легко окисляется обратно до FeO34 или может окисляться из оксида железа(II) в железо(III).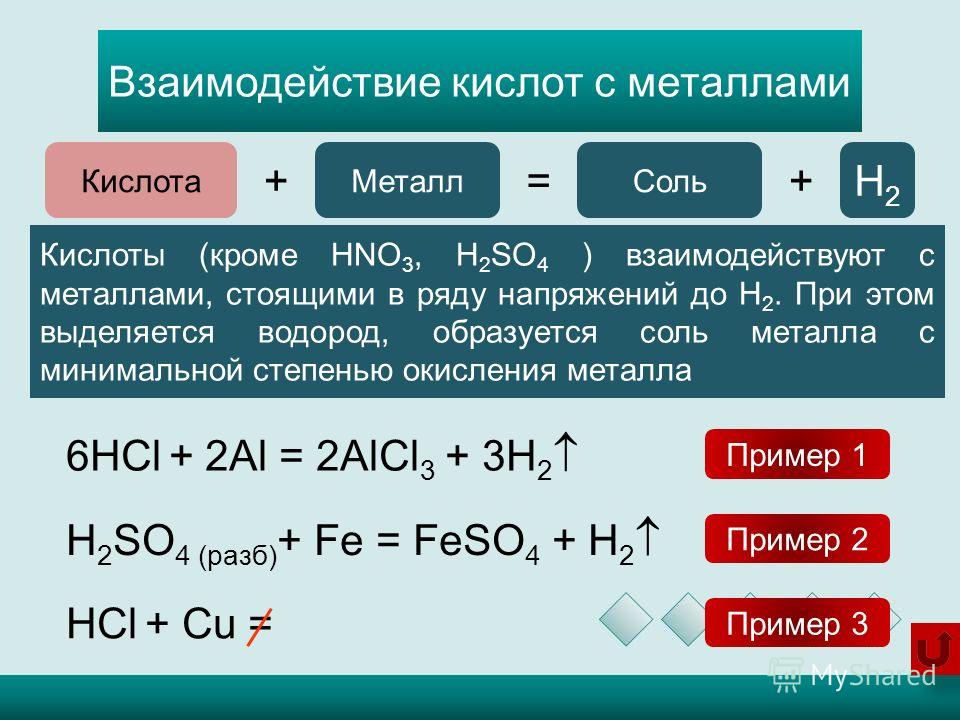 ) оксид согласно следующему уравнению:
4FeO()+O()2FeO()sgs223
) оксид согласно следующему уравнению:
4FeO()+O()2FeO()sgs223
Оксид железа(II) может реагировать с минеральной кислотой с образованием соответствующей соли и воды: FeO()+HSO()FeSO()+HO()saqaql2442
Рудный гематит, FeO23, представляет собой распространенный оксид железа, обнаруженный в земной коре. Часто красновато-коричневый цвет FeO23 можно использовать в качестве красного пигмента в красках. Оксид также можно химически выделить в результате реакции растворов хлорида железа и гидроксида с образованием нерастворимого гидроксида железа (III), который затем может термически разлагаться с образованием оксида железа (III). Например, хлорид железа может реагировать с гидроксидом аммония: FeCl()+3NHOH()Fe(OH)()+3NHCl()2Fe(OH)()FeO()+3HO()34343232aqaqsaqssgaboveC∘
Оксид железа(III) также может образовываться при нагревании сульфата железа(II); однако следует соблюдать осторожность при проведении этой реакции в лаборатории из-за образования вредных сернистых газов: 2FeSO()FeO()+SO()+SO()42323ssgg
Последний пример химических свойств оксида железа(III) включает реакцию с горячим концентрированные минеральные кислоты, такие как серная кислота, с образованием солей железа (III) и пара: FeO()+3HSO()Fe(SO)()+3HO()23242432slaqg
Пример 4.
 Идентификация оксида железа, полученного в результате реакции неизвестной соли с раствором щелочи
Идентификация оксида железа, полученного в результате реакции неизвестной соли с раствором щелочиКрасно-коричневый осадок, показанный на рисунке, образуется в результате реакции между солью железа и разбавленным раствором щелочи. Когда осадок выделяют и сушат, а затем нагревают в запальной трубке, было обнаружено, что водяной пар присутствует вместе с другим соединением железа, X. Какова возможная идентичность X?
Ответ
Соли железа реагируют с разбавленными растворами щелочей, особенно с ионами гидроксида, с образованием либо гидроксида железа(II), либо гидроксида железа(III) в зависимости от исходной соли железа. Нагревание гидроксида железа приводит к дегидратации гидроксида с образованием оксида железа, и в этом случае мы знаем, что полученный осадок представляет собой оксид железа (III), FeO23, из-за красно-коричневого цвета, показанного на рисунке.
Последний оксид, который мы обсудим в этом объяснении, — это черный магнитный оксид, также известный как двухвалентный оксид железа. Этот оксид встречается преимущественно в рудном магнетите и может рассматриваться как смесь оксида железа (II) и оксида железа (III). Его можно получить в лаборатории восстановлением оксида железа (III) монооксидом углерода, а также окислением металлического железа:
3FeO()+CO()2FeO()+CO()3Fe()+4HO()FeO()+4H()233422342sgsgsgsg–∘∘CC
Этот оксид встречается преимущественно в рудном магнетите и может рассматриваться как смесь оксида железа (II) и оксида железа (III). Его можно получить в лаборатории восстановлением оксида железа (III) монооксидом углерода, а также окислением металлического железа:
3FeO()+CO()2FeO()+CO()3Fe()+4HO()FeO()+4H()233422342sgsgsgsg–∘∘CC
Подобно железу металл, когда оксид железа (II, III) реагирует с концентрированной серной кислотой, образуется смесь железа (II) и солей железа (III), что подтверждает обоснованность рассмотрения этого оксида как смеси железа (II) и железа (III) оксиды: FeO()+4HSO()FeSO()+Fe(SO)()+4HO()342442432slaqaqgконц.HSO24
Это можно дополнительно проиллюстрировать с помощью ранее обсуждавшихся реакций восстановления и того факта, что оксид железа (II, III) также может быть окислен до оксида железа (III): FeO()+H()3FeO()+HO()2FeO()+O()3FeO()342234223sgsgsgs–∘C12
Таким образом, железо и его оксиды имеют широкий диапазон физических и химические свойства, которые важны для понимания химиками из-за важности этого элемента для нашего общества. Оксид железа (II) представляет собой твердое вещество черного цвета, нерастворимое в воде и легко окисляющееся горячим воздухом. Оксид железа(III) также нерастворим в воде и реагирует с горячими концентрированными минеральными кислотами с образованием солей железа(III) и воды. Последний оксид, который мы рассмотрели в этом объяснении, — это оксид железа (II, III), который также реагирует с горячими концентрированными кислотами и является сильным магнитом.
Оксид железа (II) представляет собой твердое вещество черного цвета, нерастворимое в воде и легко окисляющееся горячим воздухом. Оксид железа(III) также нерастворим в воде и реагирует с горячими концентрированными минеральными кислотами с образованием солей железа(III) и воды. Последний оксид, который мы рассмотрели в этом объяснении, — это оксид железа (II, III), который также реагирует с горячими концентрированными кислотами и является сильным магнитом.
Давайте подытожим, что мы узнали из этого объяснения.
Ключевые моменты
- Чистое железо не имеет большого промышленного значения; однако такие сплавы, как сталь, очень важны.
- Железо имеет общие свойства, аналогичные тем, которые можно приписать большинству металлов.
- Обычные химические реакции железа относятся к железу в степени окисления +2 или +3.
- Металлическое железо реагирует с воздухом, водяным паром, неметаллами и кислотой.
- Железо образует три разных оксида: оксид железа(II), оксид железа(III) и оксид железа(II, III).


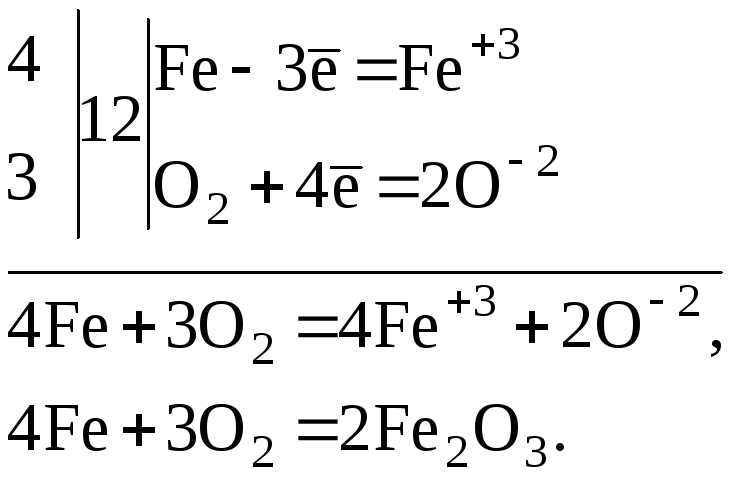 [O-2]
[O-2]


Leave A Comment