ядро калия теряет «магическое» число нейтронов
Научные специалисты провели исследование с помощью установки ISOLDE и усомнились в предполагаемой магической природе ядер с 32 нейтронами, пишет Rusargument.ru.
В ходе недавней работы исследователи измерили размеры ядер калия, богатых нейтронами, и не обнаружили признаков «магического» числа нейтронов в калии-51. Принято считать, что протоны и нейтроны занимают в атомном ядре серию оболочек разной энергии так же, как электроны в атоме заполняют оболочки вокруг ядра. Оболочки ядра, в которой протоны или нейтроны образуют полные оболочки, называются «магическими» благодаря более прочной и стабильной связи.
Ранее предполагалось, что ядра с 20 протонами и 32 нейтронами являются магическими. Однако калий-51 и кальций-52 ставят под сомнение теорию.
загрузка…
Коротко
Перевод«Светящиеся в темноте» белки могут помочь в диагностике вирусных заболеваний
В Южной Корее сфотографировали прототип нового кроссовера Hyundai Mufasa
В России выставили на продажу редкий спорткар Pagani Huayra 2022 года
ПереводМногие выжившие после инсульта имеют постоянные нерегулярные сердечные ритмы
Получение новых выигрышей в онлайн-казино
Российские ученые синтезировали новый препарат против болезни Альцгеймера
Медики выяснили, что средиземноморский образ жизни уменьшает риск летальности почти на 30%
BJSM: 75 минут физнагрузок в неделю снижают риск ранней смерти
Австралийские ученые раскрыли тайну морского чудовища Хафгуфа из Скандинавии
Эксперты признали — Китай опередил Америку в технологической гонке
Психиатры: взрослые курильщики с психическими заболеваниями потребляют больше всего кофеина
Как повысить размер выигрыша в казино
Кольца с россыпью бриллиантов
В Казахстане представили купе-кроссовер Geely Tugella, он стоит дешевле, чем в РФ
Показать все новостиПохожие новости
Российские ученые собрали 3D-принтер для скоростной печати
Названы полезные свойства меда
Интернет
Представлен новый смартфон Leitz Phone 1
Браузер Google Chrome научились взламывать через Wi-Fi
В PUBG могут появиться платные пользовательские матчи
Hi-tech
The Register: китайские смартфоны собирают излишнее количество информации о владельце
В России начались продажи ноутбуков завода «Горизонт»
Флагманы Samsung Galaxy S23 уже продаются в России
Наука
«Светящиеся в темноте» белки могут помочь в диагностике вирусных заболеваний
Российские ученые синтезировали новый препарат против болезни Альцгеймера
Медики выяснили, что средиземноморский образ жизни уменьшает риск летальности почти на 30%
Общество
Антиоксиданту из помидоров нашли применение
Ученые: в облачном слое атмосферы Венеры могут присутствовать микроорганизмы
Исследование: у людей уменьшается чувствительность к запаху человеческого тела
Описание элемента по положению в Периодической системе 8 класс онлайн-подготовка на Ростелеком Лицей
Строение атома элемента
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.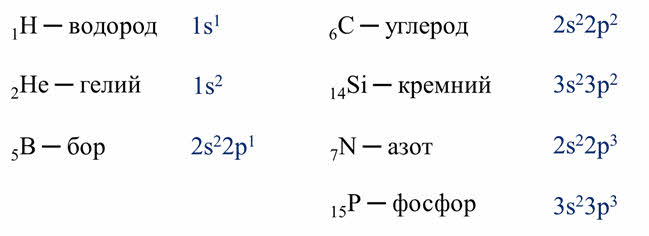
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (рис. 1).
Рис.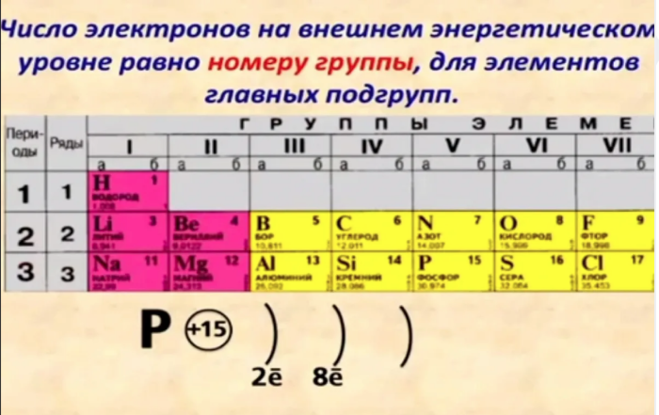 1. Схема строения атома калия
1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 — номер группы. Итак, высшая и единственная валентность калия равна I.
Свойства простого вещества, образованного элементом
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
Формула и свойства высшего оксида и гидроксида элемента
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными.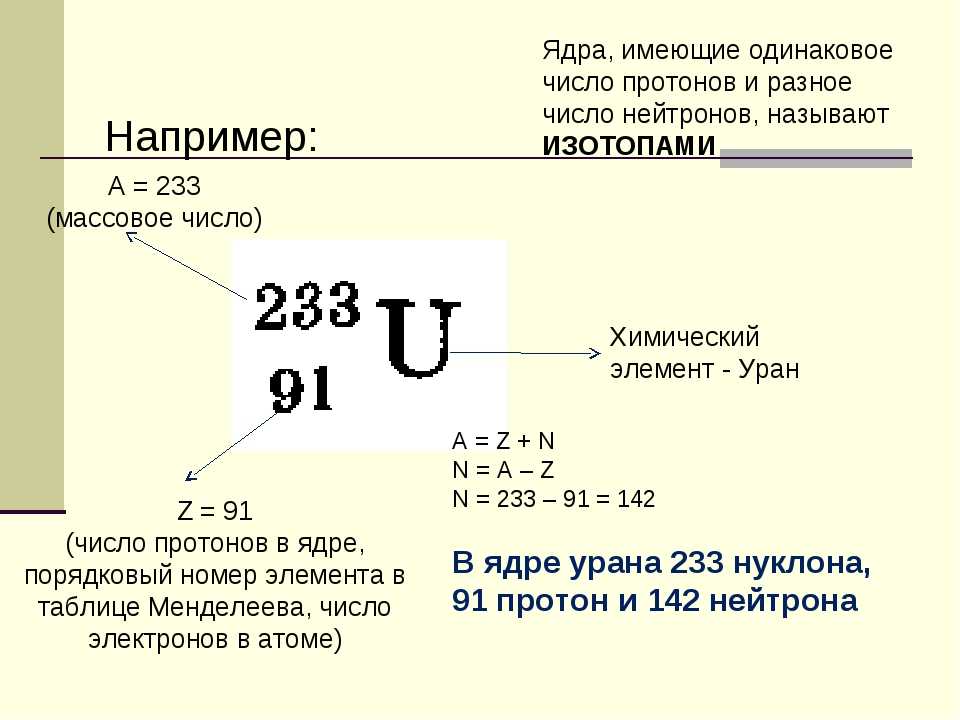 Если неметалл – то кислотными. Если переходный металл – то амфотерными (рис. 2).
Если неметалл – то кислотными. Если переходный металл – то амфотерными (рис. 2).
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида калия, записав уравнения реакций этих веществ с кислотой:
K2O + 2HCl = 2KCl + H2O
KOH + HCl = KCl + H2O
Элементы-неметаллы могут образовать летучие водородные соединения. Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.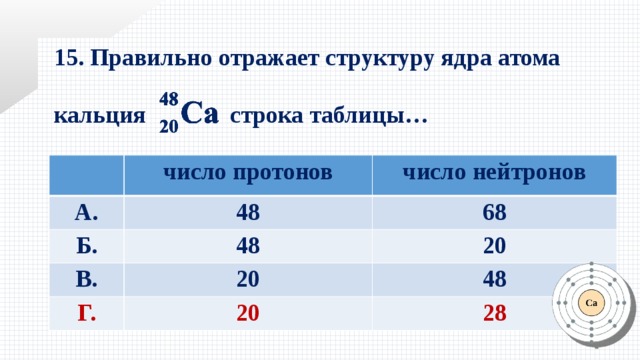
Если сравнивать калий с соседними по подгруппе и периоду элементами, то можно сказать, что основные свойства его оксида и гидроксида будут ярче выражены, чем у оксидов и гидроксидов натрия и кальция. Рубидий – более активный металл, чем калий. Значит, основные свойства его оксида и гидроксида будут выражены сильнее, чем у оксида и гидроксида калия.
Характеристика серы
Охарактеризуем по плану химический элемент серу, учитывая ее положение в Периодической системе элементов Д. И. Менделеева:
1. Химический знак – S («Эс»)
2. Порядковый номер – 16, VI группа, А подгруппа, 3 период
3. Строение атома:
4. Свойства простого вещества: S – неметалл
5. Высшая и низшая валентность: VI и II
6. Высший оксид: SO3 (кислотный)
Высший гидроксид: H2SO4 (кислота)
7. Формула летучего водородного соединения: H
Список литературы
- Оржековский П.
 А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45)
А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45) - Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§36)
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 35–36)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «InternetUrok.ru» (Источник)
- Дальневосточный Государственный Университет Путей Сообщения (Источник)
Домашнее задание
- с. 255 №№ 1–3 из учебника П. А. Оржековского «Химия: 8-ый класс» / П. А. Оржековский, Л.
 М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. - Охарактеризуйте по вышеприведенному плану химический элемент № 20.
2.1: Строительные блоки молекул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 6973
- OpenStax
- OpenStax
На самом фундаментальном уровне жизнь состоит из материи. Материя занимает пространство и имеет массу. Вся материя состоит из элементов, веществ, которые не могут быть расщеплены или химически преобразованы в другие вещества. Каждый элемент состоит из атомов, каждый из которых имеет постоянное количество протонов и уникальные свойства. Всего было определено 118 элементов; однако только 92 встречаются в природе, и менее 30 обнаруживаются в живых клетках.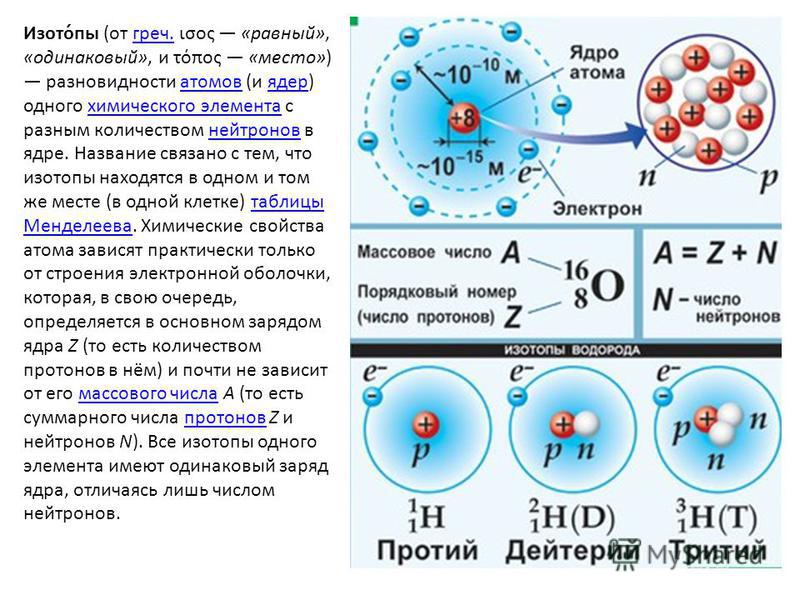
Каждый элемент обозначается своим химическим символом (например, H, N, O, C и Na) и обладает уникальными свойствами. Эти уникальные свойства позволяют элементам комбинироваться и связываться друг с другом особым образом.
Атомы
Атом — это наименьший компонент элемента, который сохраняет все химические свойства этого элемента. Например, один атом водорода обладает всеми свойствами элемента водорода, например, он существует в виде газа при комнатной температуре и связывается с кислородом, образуя молекулу воды. Атомы водорода не могут быть разбиты на что-то меньшее, сохраняя при этом свойства водорода. Если бы атом водорода был разбит на субатомные частицы, он бы больше не обладал свойствами водорода.
На самом базовом уровне все организмы состоят из комбинации элементов. Они содержат атомы, которые объединяются вместе, образуя молекулы. В многоклеточных организмах, таких как животные, молекулы могут взаимодействовать, образуя клетки, которые объединяются, образуя ткани, составляющие органы. Эти комбинации продолжаются до тех пор, пока не образуются целые многоклеточные организмы.
В многоклеточных организмах, таких как животные, молекулы могут взаимодействовать, образуя клетки, которые объединяются, образуя ткани, составляющие органы. Эти комбинации продолжаются до тех пор, пока не образуются целые многоклеточные организмы.
Все атомы содержат протоны, электроны и нейтроны (рис. \(\PageIndex{1}\)). Единственным исключением является водород (H), который состоит из одного протона и одного электрона. Протон — это положительно заряженная частица, которая находится в ядре (ядре атома) атома и имеет массу 1 и заряд +1. Электрон – это отрицательно заряженная частица, которая движется в пространстве вокруг ядра. Другими словами, он находится вне ядра. Он имеет пренебрежимо малую массу и имеет заряд -1.
Рисунок \(\PageIndex{1}\): Атомы состоят из протонов и нейтронов, находящихся внутри ядра, и электронов, окружающих ядро. Нейтроны, как и протоны, находятся в ядре атома. Они имеют массу 1 и не имеют заряда. Положительные (протоны) и отрицательные (электроны) заряды уравновешивают друг друга в нейтральном атоме, который имеет нулевой суммарный заряд.
Поскольку масса протонов и нейтронов равна 1, масса атома равна количеству протонов и нейтронов в этом атоме. Количество электронов не влияет на общую массу, потому что их масса очень мала.
Как было сказано ранее, каждый элемент имеет свои уникальные свойства. Каждый из них содержит разное количество протонов и нейтронов, что дает ему собственный атомный номер и массовое число. Атомный номер элемента равен количеству протонов, содержащихся в этом элементе. Массовое число или атомная масса – это количество протонов плюс количество нейтронов этого элемента. Следовательно, можно определить количество нейтронов, вычитая атомный номер из массового числа.
Эти номера предоставляют информацию об элементах и о том, как они будут реагировать при объединении. Различные элементы имеют разные температуры плавления и кипения и находятся в разных состояниях (жидком, твердом или газообразном) при комнатной температуре. Они также сочетаются по-разному. Некоторые образуют определенные типы связей, а другие нет.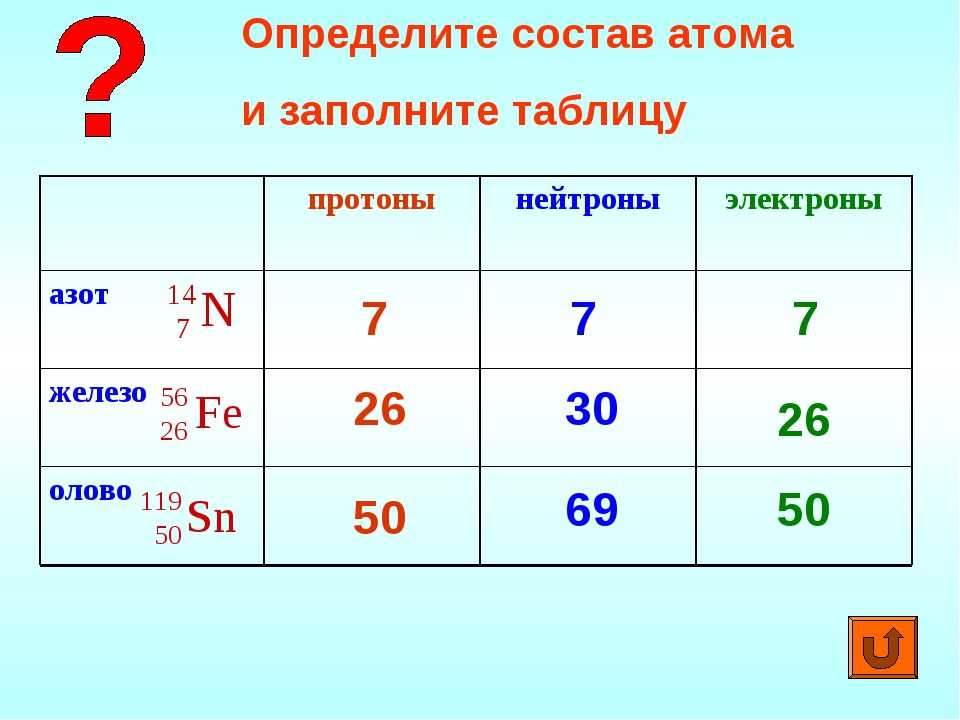 То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодической таблице элементов, диаграмме элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов (рис. \(\PageIndex{2}\)) — часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодической таблице элементов, диаграмме элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов (рис. \(\PageIndex{2}\)) — часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
Изотопы — это разные формы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов. Некоторые элементы, такие как углерод, калий и уран, имеют природные изотопы. Углерод-12, наиболее распространенный изотоп углерода, содержит шесть протонов и шесть нейтронов. Следовательно, он имеет массовое число 12 (шесть протонов и шесть нейтронов) и атомный номер 6 (что делает его углеродом).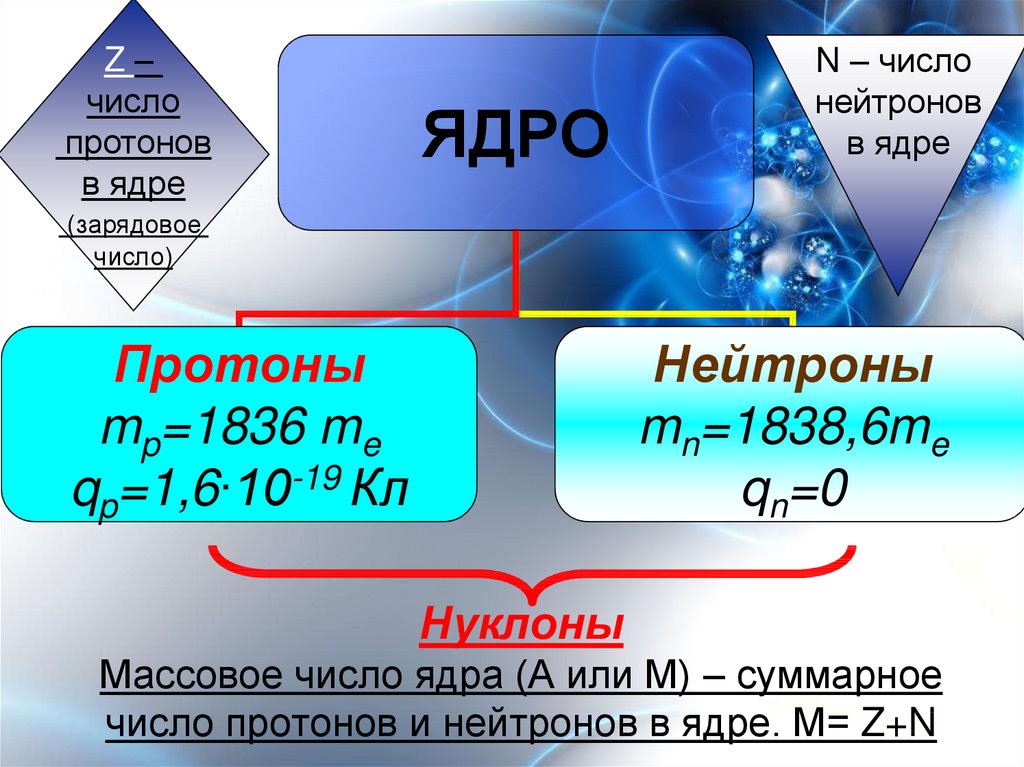 Углерод-14 содержит шесть протонов и восемь нейтронов. Следовательно, он имеет массовое число 14 (шесть протонов и восемь нейтронов) и атомный номер 6, что означает, что это все еще элемент углерода. Эти две альтернативные формы углерода являются изотопами. Некоторые изотопы нестабильны и теряют протоны, другие субатомные частицы или энергию, образуя более стабильные элементы. Их называют радиоактивными изотопами или радиоизотопами.
Углерод-14 содержит шесть протонов и восемь нейтронов. Следовательно, он имеет массовое число 14 (шесть протонов и восемь нейтронов) и атомный номер 6, что означает, что это все еще элемент углерода. Эти две альтернативные формы углерода являются изотопами. Некоторые изотопы нестабильны и теряют протоны, другие субатомные частицы или энергию, образуя более стабильные элементы. Их называют радиоактивными изотопами или радиоизотопами.
ART CONNECTION
Рисунок \(\PageIndex{2}\): Периодическая таблица, расположенная в столбцах и строках в зависимости от характеристик элементов, предоставляет ключевую информацию об элементах и о том, как они могут взаимодействовать друг с другом, образуя молекулы. Большинство периодических таблиц содержат ключ или легенду к содержащейся в них информации.Сколько нейтронов имеют (K) калий-39 и калий-40 соответственно?
ЭВОЛЮЦИЯ В ДЕЙСТВИИ: Датирование по углероду
Углерод-14 ( 14 C) представляет собой встречающийся в природе радиоизотоп, который создается в атмосфере космическими лучами. Это непрерывный процесс, поэтому всегда создается больше 14 C. По мере развития живого организма относительный уровень 14 С в его организме равен концентрации 14 С в атмосфере. Когда организм умирает, он больше не поглощает 14 C, поэтому соотношение будет снижаться. 14 C распадается до 14 N в процессе, называемом бета-распадом; он выделяет энергию в этом медленном процессе.
Это непрерывный процесс, поэтому всегда создается больше 14 C. По мере развития живого организма относительный уровень 14 С в его организме равен концентрации 14 С в атмосфере. Когда организм умирает, он больше не поглощает 14 C, поэтому соотношение будет снижаться. 14 C распадается до 14 N в процессе, называемом бета-распадом; он выделяет энергию в этом медленном процессе.
Приблизительно через 5730 лет только половина исходной концентрации 14 C превратится в 14 N. Время, за которое половина исходной концентрации изотопа распадется до более стабильной формы называется периодом его полураспада. Поскольку период полураспада 14 C велик, его используют для определения возраста ранее живших объектов, таких как окаменелости. Используя отношение концентрации 14 С, обнаруженной в объекте, к количеству 14 С, обнаруженному в атмосфере, можно определить количество еще не распавшегося изотопа.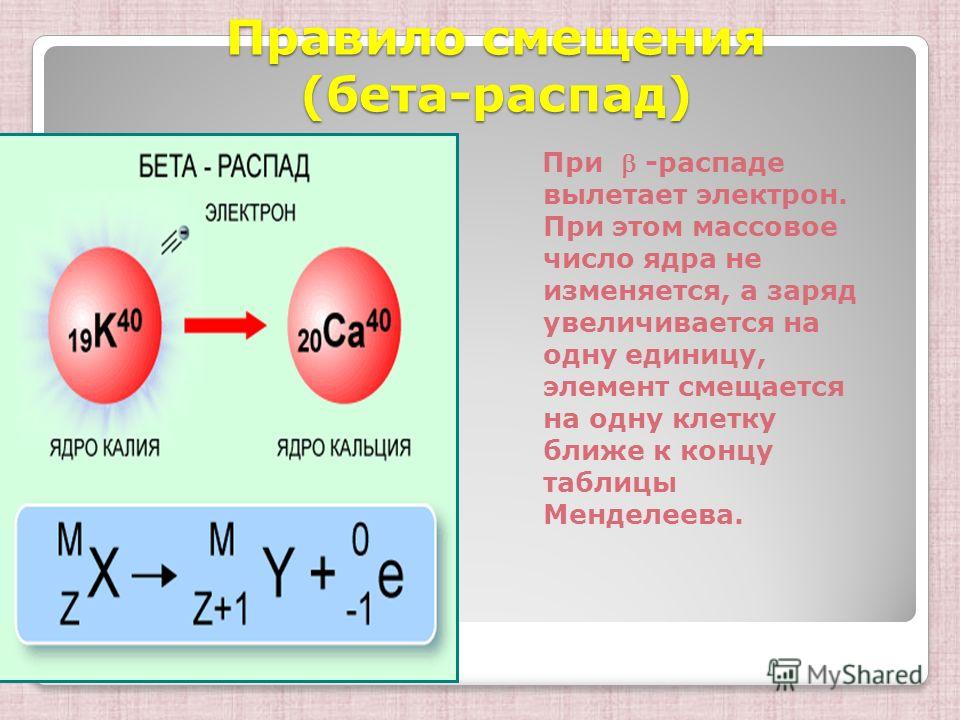 Основываясь на этом количестве, возраст окаменелости можно рассчитать примерно до 50 000 лет (рис. \(\PageIndex{3}\)). Изотопы с более длительным периодом полураспада, такие как калий-40, используются для расчета возраста более старых окаменелостей. С помощью углеродного датирования ученые могут реконструировать экологию и биогеографию организмов, живших в течение последних 50 000 лет.
Основываясь на этом количестве, возраст окаменелости можно рассчитать примерно до 50 000 лет (рис. \(\PageIndex{3}\)). Изотопы с более длительным периодом полураспада, такие как калий-40, используются для расчета возраста более старых окаменелостей. С помощью углеродного датирования ученые могут реконструировать экологию и биогеографию организмов, живших в течение последних 50 000 лет.
КОНЦЕПЦИЯ В ДЕЙСТВИИ
Чтобы узнать больше об атомах и изотопах и о том, как отличить один изотоп от другого, посетите этот сайт и запустите симуляцию.
Химические связи
То, как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует в самой внешней области, где электроны присутствуют в атоме.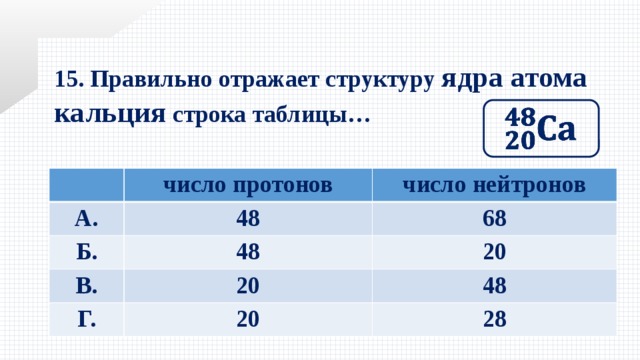 Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может содержать до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; поэтому у него занято только одно место в самой нижней оболочке. У гелия два электрона; поэтому он может полностью заполнить нижнюю оболочку своими двумя электронами. Если вы посмотрите на периодическую таблицу, то увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что у них есть только электроны в их первой оболочке. Водород и гелий — единственные два элемента, которые имеют самую нижнюю оболочку и не имеют других оболочек.
Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может содержать до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; поэтому у него занято только одно место в самой нижней оболочке. У гелия два электрона; поэтому он может полностью заполнить нижнюю оболочку своими двумя электронами. Если вы посмотрите на периодическую таблицу, то увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что у них есть только электроны в их первой оболочке. Водород и гелий — единственные два элемента, которые имеют самую нижнюю оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов. Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут заполнены.
Снова взглянув на периодическую таблицу (рис. \(\PageIndex{2}\)), вы заметите, что в ней семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере продвижения столбцов слева направо. Хотя каждый элемент имеет одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. У лития только один электрон на внешней оболочке, у бериллия — два электрона, у бора — три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
\(\PageIndex{2}\)), вы заметите, что в ней семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере продвижения столбцов слева направо. Хотя каждый элемент имеет одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. У лития только один электрон на внешней оболочке, у бериллия — два электрона, у бора — три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, но атом наиболее стабилен, когда все электронные позиции в самой внешней оболочке заполнены. Из-за этих вакансий в самых внешних оболочках мы наблюдаем образование химических связей или взаимодействий между двумя или более одинаковыми или разными элементами, которые приводят к образованию молекул. Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и для достижения этой цели будут связываться с другими элементами, делясь электронами, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку самые внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов. Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и для достижения этой цели будут связываться с другими элементами, делясь электронами, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку самые внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов. Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Когда атом не содержит одинакового количества протонов и электронов, он называется ионом. Поскольку количество электронов не равно количеству протонов, каждый ион имеет суммарный заряд. Положительные ионы образуются в результате потери электронов и называются катионами. Отрицательные ионы образуются путем присоединения электронов и называются анионами.
Например, натрий имеет только один электрон на внешней оболочке. Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий потеряет электрон, у него теперь будет 11 протонов и только 10 электронов, в результате чего его общий заряд составит +1. Теперь его называют ионом натрия.
Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий потеряет электрон, у него теперь будет 11 протонов и только 10 электронов, в результате чего его общий заряд составит +1. Теперь его называют ионом натрия.
Атом хлора имеет семь электронов на внешней оболочке. Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, что придает ему суммарный отрицательный (-1) заряд. Теперь его называют хлорид-ионом. Это перемещение электронов от одного элемента к другому называется переносом электрона. Как показано на рисунке \(\PageIndex{4}\), у атома натрия (Na) только один электрон на внешней оболочке, тогда как у атома хлора (Cl) на внешней оболочке семь электронов. Атом натрия пожертвует свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый из них теперь является ионом и имеет заряд +1 (натрий) или -1 (хлорид).
Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый из них теперь является ионом и имеет заряд +1 (натрий) или -1 (хлорид).
Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и взаимодействия Ван-дер-Ваальса. Ионные и ковалентные связи представляют собой сильные взаимодействия, которые требуют больших затрат энергии для разрыва. Когда элемент отдает электрон со своей внешней оболочки, как в приведенном выше примере с атомом натрия, образуется положительный ион. Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительные и отрицательные заряды притягиваются, эти ионы остаются вместе и образуют ионную связь или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда Na 9Ионы 0064 + и Cl – объединяются, образуя NaCl, электрон от атома натрия остается с другими семью от атома хлора, а ионы натрия и хлорида притягиваются друг к другу в решетке ионов с нулевым суммарным зарядом.
Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда Na 9Ионы 0064 + и Cl – объединяются, образуя NaCl, электрон от атома натрия остается с другими семью от атома хлора, а ионы натрия и хлорида притягиваются друг к другу в решетке ионов с нулевым суммарным зарядом.
Ковалентные связи
Другим типом прочной химической связи между двумя или более атомами является ковалентная связь. Эти связи образуются, когда электрон делится между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках. В отличие от ионных связей, ковалентные связи не диссоциируют в воде.
Атомы водорода и кислорода, которые объединяются, образуя молекулы воды, связаны друг с другом ковалентными связями. Электрон из атома водорода делит свое время между внешней оболочкой атома водорода и незавершенной внешней оболочкой атома кислорода.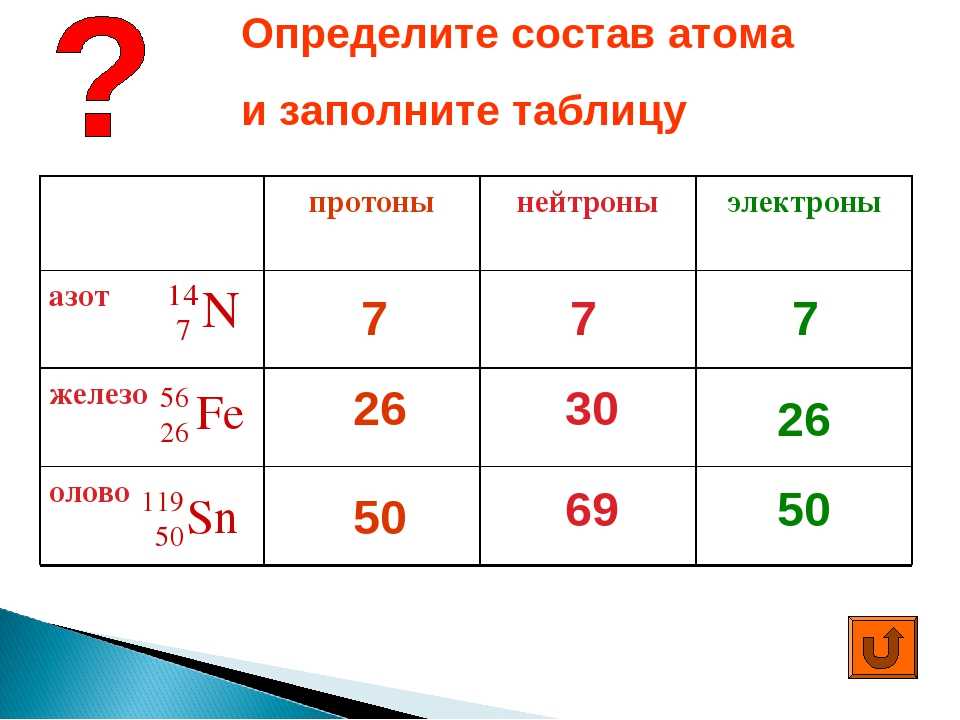 Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимо два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O. Электроны делятся между атомами, деля свое время между ними для «заполнения» внешняя оболочка каждого. Это совместное использование представляет собой более низкое энергетическое состояние для всех вовлеченных атомов, чем если бы они существовали без заполненных внешних оболочек.
Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимо два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O. Электроны делятся между атомами, деля свое время между ними для «заполнения» внешняя оболочка каждого. Это совместное использование представляет собой более низкое энергетическое состояние для всех вовлеченных атомов, чем если бы они существовали без заполненных внешних оболочек.
Ковалентные связи бывают двух типов: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые имеют одинаковые электроны. Например, атом кислорода может соединиться с другим атомом кислорода, чтобы заполнить их внешние оболочки. Эта ассоциация неполярна, потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислороду требуется два общих электрона, чтобы заполнить его внешнюю оболочку. Атомы азота будут образовывать три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, образуя четыре неполярные ковалентные связи (рис. \(\PageIndex{5}\)).
Атомы азота будут образовывать три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, образуя четыре неполярные ковалентные связи (рис. \(\PageIndex{5}\)).
В полярной ковалентной связи электроны, общие для атомов, проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ+) или слегка отрицательный (δ–) заряд. Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени возле ядра кислорода, придавая ему небольшой отрицательный заряд, чем возле ядер водорода, придавая этим молекулам небольшой положительный заряд.
Водородные связи
Ионные и ковалентные связи являются сильными связями, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Также могут образовываться более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрыва которых не требуется много энергии. Часто встречаются две слабые связи: водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи обуславливают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода.
Водородные связи могут образовываться между различными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами.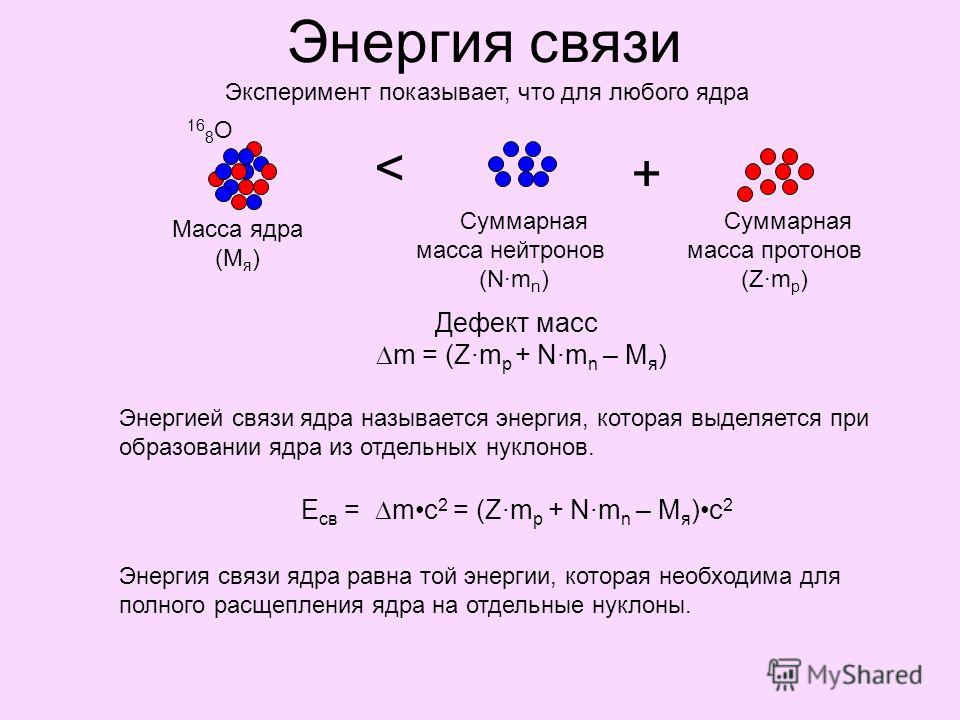 Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, взаимодействия Ван-дер-Ваальса представляют собой слабое притяжение или взаимодействие между молекулами. Они возникают между полярными, ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, образующимися при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
КАРЬЕРА В ДЕЙСТВИИ: Техник-рентгенолог
Делали ли вы или кто-либо из ваших знакомых магнитно-резонансную томографию (МРТ), маммографию или рентген? Эти тесты производят изображения ваших мягких тканей и органов (как при МРТ или маммографии) или ваших костей (как это происходит при рентгене) с использованием либо радиоволн, либо специальных изотопов (помеченных радиоактивным или флуоресцентным маркером), которые проглатываются или вводятся внутрь. тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
МРТ работает, подвергая ядра водорода, которых много в воде в мягких тканях, флуктуирующим магнитным полям, которые заставляют их излучать собственное магнитное поле. Затем этот сигнал считывается датчиками машины и интерпретируется компьютером для формирования подробного изображения.
Некоторые технологи и техники рентгенографии специализируются на компьютерной томографии, МРТ и маммографии. Они производят фильмы или изображения тела, которые помогают медицинским работникам исследовать и ставить диагноз. Рентгенологи работают непосредственно с пациентами, объясняя работу механизмов, готовя их к обследованиям и следя за тем, чтобы их тело или части тела располагались правильно для получения необходимых изображений. Затем врачи или рентгенологи анализируют результаты теста.
Специалисты по рентгенографии могут работать в больницах, кабинетах врачей или специализированных центрах визуализации. Обучение на рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Обучение на рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Резюме
Материя — это все, что занимает пространство и имеет массу. Он состоит из атомов различных элементов. Все 92 элемента, которые встречаются в природе, обладают уникальными свойствами, которые позволяют им комбинироваться различными способами для создания соединений или молекул. Атомы, состоящие из протонов, нейтронов и электронов, являются мельчайшими единицами элемента, сохраняющими все свойства этого элемента. Электроны могут быть пожертвованы или разделены между атомами для создания связей, включая ионные, ковалентные и водородные связи, а также взаимодействия Ван-дер-Ваальса.
Art Connections
Рисунок \(\PageIndex{2}\): Сколько нейтронов имеют (K) калий-39 и калий-40 соответственно?
- Ответить
Калий-39 имеет двадцать нейтронов.
 Калий-40 имеет двадцать один нейтрон.
Калий-40 имеет двадцать один нейтрон.
Глоссарий
- анион
- отрицательный ион, образованный присоединением электронов
- атомный номер
- количество протонов в атоме
- катион
- положительный ион, образованный потерей электронов
- химическая связь
- взаимодействие между двумя или более одинаковыми или разными элементами, приводящее к образованию молекул
- ковалентная связь
- Тип прочной связи между двумя или более одинаковыми или разными элементами; образуются, когда электроны делятся между элементами
- электрон
- отрицательно заряженная частица, находящаяся вне ядра на электронной орбитали; не имеет функциональной массы и имеет заряд –1
- электронный перенос
- движение электронов от одного элемента к другому
- элемент
- одно из 118 уникальных веществ, которые не могут быть разбиты на более мелкие вещества и сохраняют характеристики этого вещества; каждый элемент имеет определенное количество протонов и уникальные свойства
- водородная связь
- слабая связь между частично положительно заряженными атомами водорода и частично отрицательно заряженными элементами или молекулами
- ион
- атом или соединение, которое не содержит одинакового количества протонов и электронов и, следовательно, имеет суммарный заряд
- ионная связь
- химическая связь, которая образуется между ионами с противоположными зарядами
- изотоп
- одна или несколько форм элемента с разным числом нейтронов
- Массовый номер
- количество протонов плюс нейтронов в атоме
- материя
- все, что имеет массу и занимает пространство
- нейтрон
- частица без заряда, находящаяся в ядре атома; имеет массу 1
- неполярная ковалентная связь
- тип ковалентной связи, которая образуется между атомами, когда электроны распределяются поровну между атомами, что приводит к отсутствию областей с частичными зарядами, как в полярных ковалентных связях
- ядро
- (химия) плотный центр атома, состоящий из протонов и (за исключением атома водорода) нейтронов
- Правило октетов
- утверждает, что самая внешняя оболочка элемента с низким атомным номером может содержать восемь электронов .
- Периодическая таблица элементов
- организационная схема элементов с указанием атомного номера и массового числа каждого элемента; также предоставляет ключевую информацию о свойствах элементов
- полярная ковалентная связь
- тип ковалентной связи, при которой электроны притягиваются к одному атому и от другого, что приводит к образованию слегка положительно и слегка отрицательно заряженных участков молекулы
- протон
- положительно заряженная частица, находящаяся в ядре атома; имеет массу 1 и заряд +1
- радиоактивный изотоп
- изотоп, который спонтанно испускает частицы или энергию для образования более стабильного элемента
- Взаимодействие Ван-дер-Ваальса
- слабое притяжение или взаимодействие между молекулами, вызванное слегка положительно или слегка отрицательно заряженными атомами
Авторы и ссылки
Саманта Фаулер (Клейтонский государственный университет), Ребекка Руш (Общественный колледж Сэндхиллс), Джеймс Уайз (Хэмптонский университет).
 Оригинальный контент от OpenStax (CC BY 4.0; бесплатный доступ по адресу https://cnx.org/contents/b3c1e1d2-83…4-e119).а8аафбдд).
Оригинальный контент от OpenStax (CC BY 4.0; бесплатный доступ по адресу https://cnx.org/contents/b3c1e1d2-83…4-e119).а8аафбдд).
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- анион
- атомный номер
- катион
- химическая связь
- ковалентная связь
- электрон
- электронный перенос
- элемент
- водородная связь
- ион
- ионная связь
- изотоп
- массовый номер
- материя
- нейтрон
- неполярная ковалентная связь
- ядро Правило
- октетов
- периодическая таблица элементов
- полярная ковалентная связь
- протон
- радиоактивный изотоп
- Ван-дер-Ваальсово взаимодействие
Калий и кальций – атомная структура, химические свойства, применение
Атом – это наименьшая часть элемента или соединения, участвующая в химической реакции. Они состоят из крошечных частиц, известных как протоны, нейтроны и электроны. Греческий философ Демокрит был первым, кто употребил термин атом .
Они состоят из крошечных частиц, известных как протоны, нейтроны и электроны. Греческий философ Демокрит был первым, кто употребил термин атом .
Структура атома была открыта Джоном Дальтоном в 1808 году в опубликованной им книге. Он также известен как «отец атомной теории». Это крошечные частицы, состоящие из ядра и одного или нескольких электронов на их орбите. Ядро атома состоит из положительно заряженных протонов и отрицательно заряженных нейтронов. Протоны и нейтроны атома имеют примерно одинаковую массу. Орбиты атома вокруг ядра описывают местоположение и волнообразное поведение электрона. Теперь, здесь, в настоящей статье, мы собираемся обсудить случай калия и кальция.
Калий
Калий — первый элемент четвертого периода таблицы Менделеева. Название калия происходит от минерала Potash. Сотни лет этот элемент использовался. Он, наряду с литием, рубидием, натрием, цезием и францием, является щелочным металлом. Калий имеет атомную массу 39,098 атомных единиц массы.
Он обозначается буквой «К».
Калий считается 7-м наиболее распространенным элементом на поверхности земли. Он в основном встречается в хитроумных горных породах и отложениях полезных ископаемых. Калий в природе встречается в виде ионных солей. он растворен в морской воде, которая составляет 0,04% по весу. Калий является хорошим проводником тепла и электричества. Это чрезвычайно активный металл, который никогда не встречается в природе в свободном виде; вместо этого он всегда находится в соединениях с другими элементами.
Following is the summarized details of Potassium:
| Symbol | K |
| Atomic number | 19 |
| Atomic Mass | 39.098 a.m.u. |
| Группа | I |
| ПЕРИОД | 4 |
| 4 | |
| 4 | |
| 4 | |
| Solid (at 20 °C) | |
| Electronic configuration | [Ar] 4s 1 |
| Melting point | 63.5 °C or 336 K |
| Boiling point | 759 °C or 1032 K |
| Density | 0.89 g cm -3 |
| Key isotope | 39 K |
Изотопы калия: Калий имеет три изотопа, известных как калий-39, 40 и 41. Калий-40 — радиоактивный элемент, который можно найти в горных породах, растениях и животных. Используется для определения возраста объекта. Этот изотоп распадается на изотоп аргона.
Атомная структура калия
Ядро состоит из 19 протонов и 21 нейтрона. Ядро связано 19 электронами с одним очень нестабильным электроном во внешней оболочке (кольце).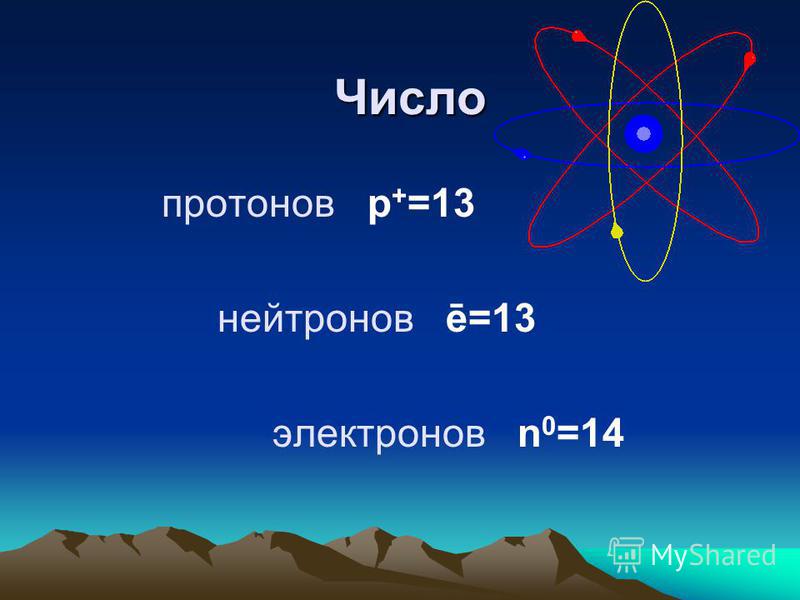 Химические и физические характеристики элемента определяются стабильностью его внешних электронов.
Химические и физические характеристики элемента определяются стабильностью его внешних электронов.
Fig: Atomic Structure of Potassium
The electronic configuration is given as,
| Shells | K | L | M | N |
| Число электронов | 2 | 8 | 8 | 1 |
Физические свойства калия:

Химические свойства калия:
- При взаимодействии с водой выделяется газообразный водород. Реакция летучая и может вызвать взрыв.
2K +2H 2 O ⇢ 2KOH + H 2 ⇡
- Обладает высокой реакционной способностью по отношению к азоту, фосфору, сере и фтору.
- Быстро растворяется при взаимодействии с разбавленной серной кислотой и выделяет ионы калия вместе с газообразным водородом.
2K + H 2 SO 4 ⇢ 2K + + SO 4 + H 2 ⇡
- Poltassium образуется HALEDIDEDIDEDIDEDIDES.
2K+ Cl 2 ⇢ 2KCl
Применение калия: , моющие средства, красители, порох и т. д. Интересные факты Кальций с атомным номером 20 обозначается символом Ca в периодической таблице. Кальций (Ca) является важным минералом, который помогает нашим костям оставаться сильными и способными выдерживать наш вес. Кальций также используется нашей нервной системой для передачи импульсов по всему телу. Кальций считается пятым по распространенности элементом на поверхности земли. Он дает катионы во время ионизации. Самая внешняя оболочка кальция состоит из двух валентных электронов. Наиболее распространенным соединением кальция, обнаруженным на Земле, является карбонат кальция. Гипс, безводный, флюорит и т. д. также являются одними из источников кальция. Following is the summarized details of Calcium: Изотопы кальция: Кальций имеет пять природных стабильных изотопов: кальций 40, кальций 42, кальций 43, кальций 44 и кальций 46. В ядре 20 протонов и 20 нейтронов. Доступные электронные оболочки (кольца) занимают 20 электронов. Химические и физические характеристики элемента определяются стабильностью его внешних (валентных) электронов. Fig: Atomic Structure of Calcium The electronic configuration of a Calcium atom is given by: Physical Properties of Calcium are: Химические свойства кальция: CACO 3 + CO 2 ⇢ CA (HCO 3 ) 2 + H 2 O 2Ca + O 2 ⇢ 2CaO 3Ca + N 2 ⇢ Ca 3 N 2 CaCO 3 + HCl ⇢ CaCl 2 + HO + CO 2 ⇡ Интересные факты 
Кальций

Symbol Ca Atomic number 20 Atomic mass 40.08 g/mol Group II Period 4 Block s State Solid (at 20 °C) Electronic configuration [Ar] 4s 2 Melting point 842 °C Boiling point 1482 °C 
Атомная структура кальция
Shells K L M N Number of electrons 2 8 8 2 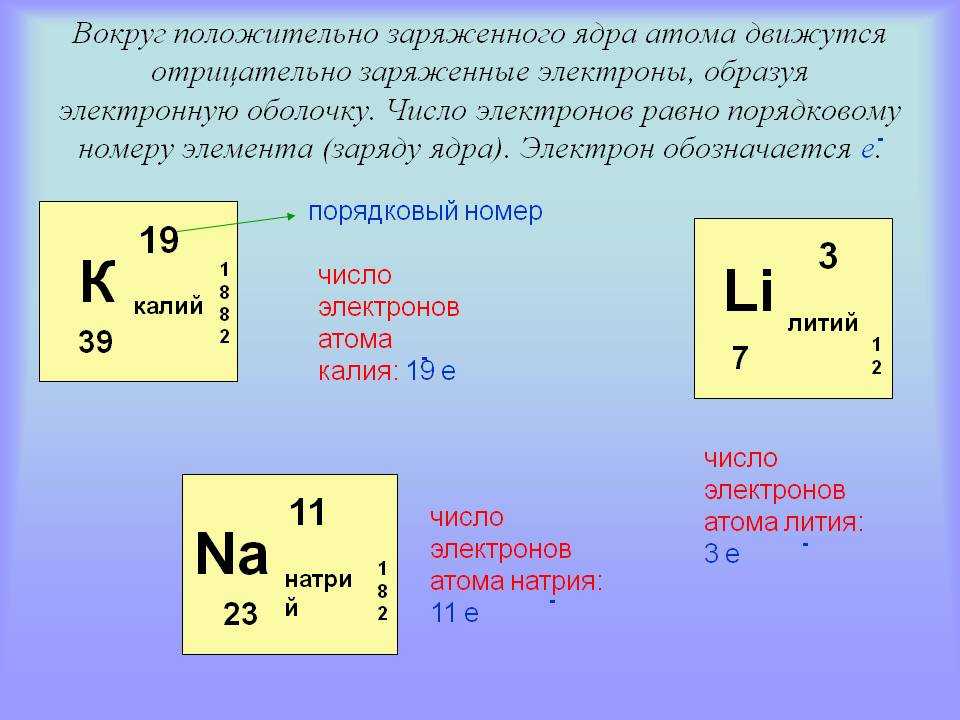
ПРИМЕНЕНИЕ КАЛЬЦИЯ
900 Некоторые из них упомянуты ниже;

Решение:
Люди принимают несколько форм калия, но наиболее распространенной является хлорид калия.
Минимальное потребление составляет в среднем около 4,7 мг.
Проблема 2: Почему используются калийные удобрения?
Решение:
Калийные удобрения также называются калийные удобрения. Его получают из сгоревшего леса, шахт и океана. Он широко используется в качестве удобрения, поскольку способствует росту растений, а также движению устьиц.
Проблема 3: Как естественным образом удалить кальций из воды?
Решение:
Кальций естественным образом содержится в воде, поскольку он может растворяться в известняке, мраморе, гипсе и т. д. Кальций в воде определяет ее жесткость. Мы можем обрабатывать воду, добавляя в нее немного карбоната натрия или стиральной соды, которые расщепляют присутствующий в ней кальций.
Задача 4. Каково биологическое применение кальция?
Решение:
Биологическое назначение кальция заключается в обеспечении прочности и структуры скелета.
Это очень важно для поддержания костей и зубов.
Проблема 5. Каковы последствия чрезмерного употребления калия?
Решение:
Некоторыми из распространенных побочных эффектов калия являются тошнота, боль в животе, дискомфорт, рвота и аномальный сердечный ритм.
Задача 6. Как используется калий в промышленном секторе?
Решение:
Калий используется в промышленности в качестве сырья для производства металлического калия, а также используется в мыловаренной промышленности в качестве средства для смягчения воды вместо хлорида натрия.
Проблема 7: Почему молочные продукты необходимы для нашего рациона?
Решение:
Молочные продукты очень богаты кальцием. Следовательно, это важно для нашей диеты, поскольку кальций помогает укрепить наши кости.

 А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45)
А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45)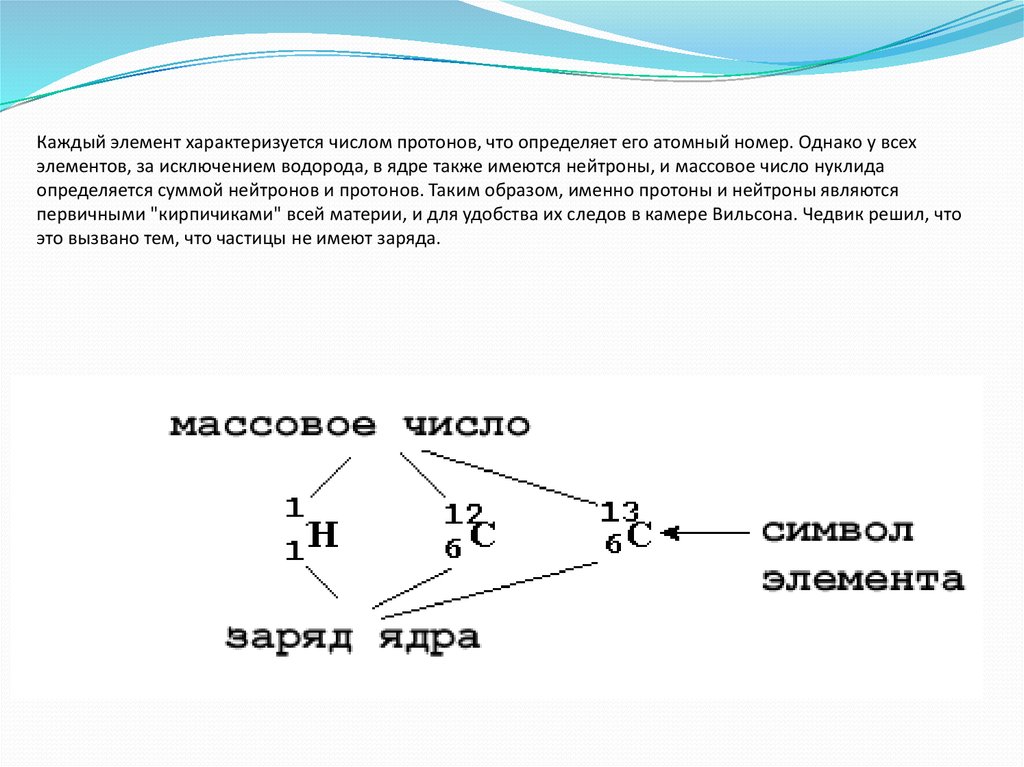 М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.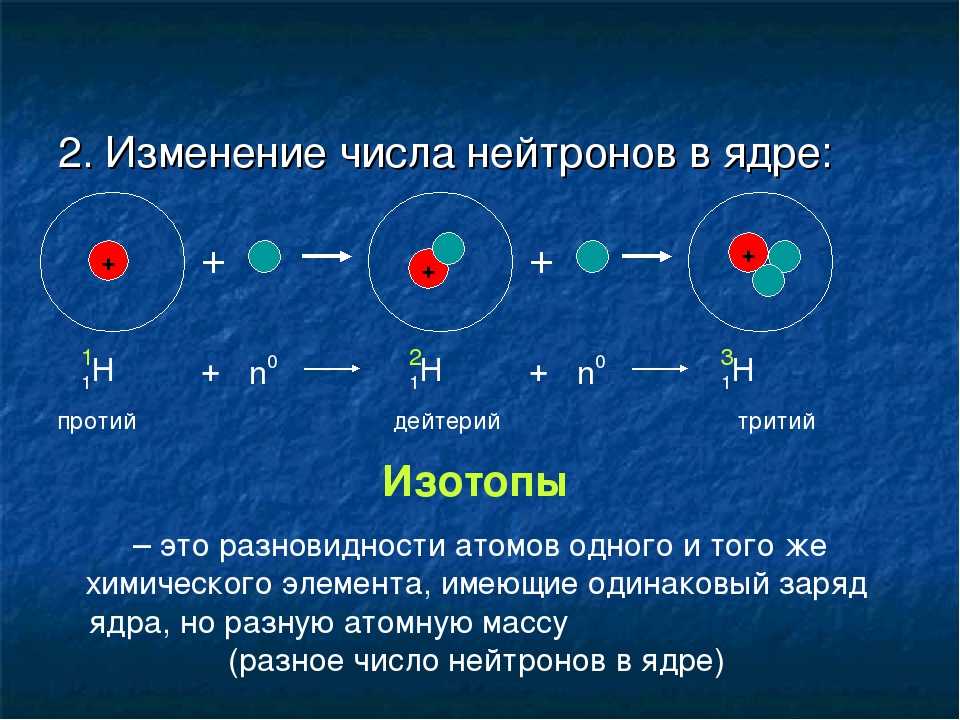 Калий-40 имеет двадцать один нейтрон.
Калий-40 имеет двадцать один нейтрон. Оригинальный контент от OpenStax (CC BY 4.0; бесплатный доступ по адресу https://cnx.org/contents/b3c1e1d2-83…4-e119).а8аафбдд).
Оригинальный контент от OpenStax (CC BY 4.0; бесплатный доступ по адресу https://cnx.org/contents/b3c1e1d2-83…4-e119).а8аафбдд). Он обозначается буквой «К».
Он обозначается буквой «К». 0043 State
0043 State 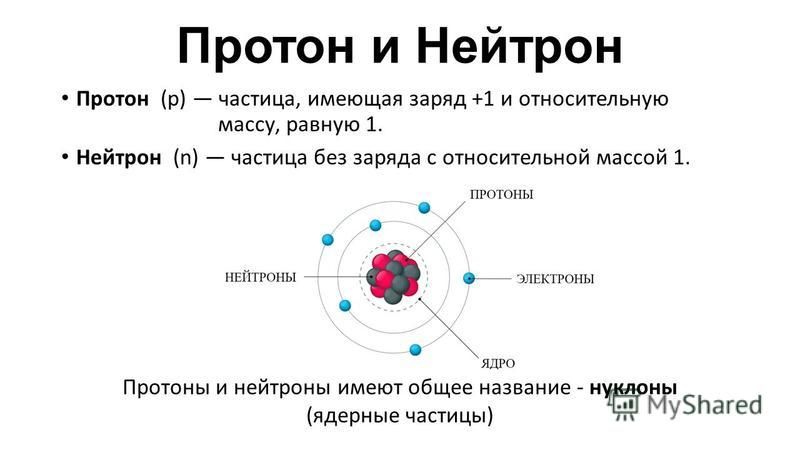 Минимальное потребление составляет в среднем около 4,7 мг.
Минимальное потребление составляет в среднем около 4,7 мг. Это очень важно для поддержания костей и зубов.
Это очень важно для поддержания костей и зубов.
Leave A Comment