Оксид цинка: получение и свойства
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами:
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
Zn(OН)2 → ZnO + H2O
3. Оксид цинка можно получить разложением нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Химические свойства
Оксид цинка — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например, оксид цинка взаимодействует с оксидом натрия:
ZnO + Na2O → Na2ZnO2
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом оксид цинка проявляет кислотные свойства.
Например, оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
ZnO + 2NaOH → Na2ZnO2 + H2O
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
3. Оксид цинка не взаимодействует с водой.
Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами. При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
ZnO + SO3 → ZnSO4
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства.
Например, оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната бария:
ZnO + BaCO3 → BaZnO2 + СО2
Понравилось это:
Нравится Загрузка…
Оксид цинка, характеристика, свойства и получение, химические реакции
Оксид цинка, характеристика, свойства и получение, химические реакции.
Поделиться в:
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка
Физические свойства оксида цинка
Получение оксида цинка
Химические свойства оксида цинка
Химические реакции оксида цинка
Применение и использование оксида цинка
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.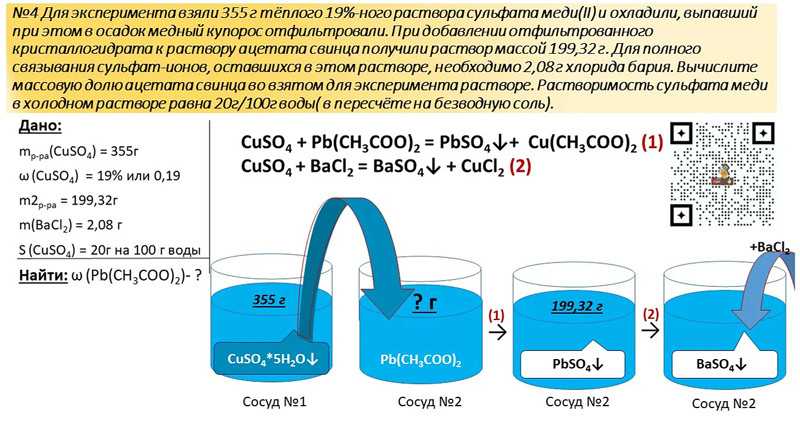
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 оС сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.) цинкит (рус.) цинковые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5610 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,61 |
| Температура сублимации, °C | 1800 |
| Температура плавления, °C | 1975 |
| Молярная масса, г/моль | 81,408 |
| Теплопроводность, Вт/(м·К) | 54 |
* Примечание:
— нет данных.
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
- 1. сжиганием цинка в кислороде:
2Zn + О2 → 2ZnО (t > 250 oC).
- 2. путем термического разложения гидроксида цинка:
Zn(OH)2 → ZnO + H2О (t = 100-250 oC).
- 3. путем термического разложения карбоната цинка:
ZnCO3 → ZnO + CO2 (t = 200-300 oC).
- 4. путем термического разложения нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2 (t = 300-500 oC).
- 5. путем окислительного обжига сульфида цинка:
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 oC).
- 6. путем термического разложения ацетата цинка.
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 oC).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 oC.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 oC),
2ZnО + SiО2 → Zn2SiО4 (t = 900-1000 oC).
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
ZnО + SО2 → ZnSО3.
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
ZnО + B2О3 → Zn(BО2)2.
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО → Zn + CO2 (t = 700 oC).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО → BaZnО2 (t = 1100 oC).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
ZnО + CrО3 → ZnCrО4.
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
ZnО + Fe2О3 → Fe2ZnО4 (t = 800-1000 oC),
ZnО + Fe2О3 → ZnFe2О4 (t = 800-1000 oC).
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
ZnО + MoО3 → ZnMoО4.
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
2ZnО + VО2 → Zn2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
3ZnО + MnО2 → MnZn3О5 (t = 700-800 oC),
ZnО + Mn2О3 → ZnMn2О4 (t = 900 oC).
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 → ZnWО4 (t = 600-800 oC).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 oC).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
ZnO + 2HF → ZnF2 + H2O.
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
ZnO + 2HNO3 → 2Zn(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
3ZnO + 2H3PO4 → Zn3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
реакция оксида цинка с бромистым водородом (бромоводородом):
ZnO + 2HBr → ZnBr2 + H2O.
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
ZnO + 2HI → ZnI2 + H2O.
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 oC).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 oC).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 oC),
ZnO + 2NaOH + H2O → Na2[Zn(OН)4] (t = 90 oC).
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 oC.
23. реакция оксида цинка с гидратом аммиака:
ZnО + 4(NH3•H2O) → [Zn(NH3)4](OH)2 + 3H2O.
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
ZnО + 2NH4Cl → ZnCl2 + 2NH3 + H2O (t°).
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид цинка реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида цинка
реакции с оксидом цинка
Коэффициент востребованности 9 127
Оксид цинка обрабатывают раствором едкого натра.
Question
Question
ICSE-ANALYTICAL CHEMISTRY- USE OF AMMONIUM HYDROXIDE AND SODIUM HYDROXIDE-Questions from Previous ICSE Board Papers
20 videosADVERTISEMENT
Ab Padhai karo bina ads ke
Khareedo DN Pro and dekho sari videos бина киси ад ки рукаават ке!
Ответить
Пошаговое решение, разработанное экспертами, чтобы помочь вам в решении вопросов и получении отличных оценок на экзаменах.
Расшифровка
Уравнение говорит: напишите уравнение для каждой из следующих реакций: оксид цинка обрабатывается раствором гидроксида натрия, формула оксида цинка – zn, а формула гидроксида натрия – любая, когда они реагируют друг с другом, форма продукта – продукт 2 Z и O2 + h3O известен как цинкат натрия, и это вода, эта реакция происходит в экстремальных условиях, то есть при температуре от 5
от 100 до 600 градусов Цельсия.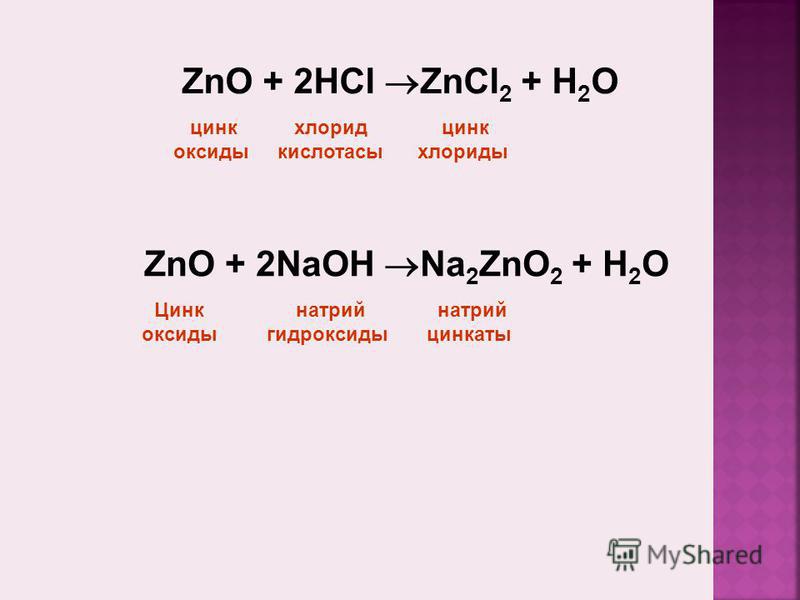 нерастворим в воде оксид цинка является амфотерным оксидом значение амфотерного оксида заключается в том, что он реагирует как с основанием, так и с кислотой реакция между оксидом цинка и гидроксидом натрия
нерастворим в воде оксид цинка является амфотерным оксидом значение амфотерного оксида заключается в том, что он реагирует как с основанием, так и с кислотой реакция между оксидом цинка и гидроксидом натрия
производители цинката натрия вместе с водой
Похожие видео
Напишите химическое уравнение реакции металлического цинка на гидроксид натрия.
34640171
जिंक ऑक्साइड की सोडियम हाइड्रॉक्साइड से क्रिया। इस अभिक्रिया के लिए संतुलित समीकरण दीजिए ।
188264398
Напишите химические уравнения для следующих реакций: Оксид алюминия реагирует с гидроксидом натрия.
565379883
Напишите уравнения следующих реакций: Бензальдегид обрабатывают концентрированным раствором едкого натра.
586005708
Напишите сбалансированное химическое уравнение для следующей реакции:
Цинк нагревают с раствором гидроксида натрия.
643525252
Напишите сбалансированное химическое уравнение для следующего:
Оксид цинка растворяется в гидроксиде натрия.
643525254
Напишите сбалансированное уравнение реакции между оксидом алюминия и раствором гидроксида натрия.
643734909
Напишите реакцию оксида цинка с раствором гидроксида калия.
643745840
Напишите сбалансированное химическое уравнение для каждой из следующих реакций:
Оксид цинка обрабатывают раствором гидроксида натрия.
643822307
Напишите сбалансированное химическое уравнение для каждого действия связанного гидроксида натрия с оксидом цинка.
643822454
Напишите сбалансированные химические уравнения для каждого из следующих:
Добавление цинка к раствору гидроксида натрия.
643924795
Напишите сбалансированное химическое уравнение реакции и назовите реакцию: Бензальдегид обрабатывают 50% раствором едкого натра.
644058793
जिंक की सोडियम ह हाइड्रोक्साइड के साथ क्रिया के लिए wy समीक समीक लिखें।।।।।। लिखें लिखें लिखें क क क र समीक समीक लिखें लिखें
644847600
Приведите сбалансированное химическое уравнение реакции цинка с раствором гидроксида натрия.
645000201
Текстовое решение
अभिक्रिया के संतुलित समीक समीक समीक दीजिए दीजिए —
645926112
[PDF] Изучение роли температуры и концентрации гидроксида натрия в синтезе наночастиц оксида цинка
- Идентификатор корпуса: 180
@inproceedings{Jyoti2013ToST,
title={Для изучения роли температуры и концентрации гидроксида натрия в синтезе наночастиц оксида цинка},
автор={М. Джиоти и Д. Мендхулкар Виджай и С. Радха},
год = {2013}
} - M. Jyoti, D. Vijay, S. Radha
- Опубликовано в 2013 г.
- Materials Science
температуры. Полученные наноструктуры ZnO охарактеризованы методами рентгеновской дифракции (РФА), сканирующей электронной микроскопии (СЭМ), энергодисперсионной рентгеновской спектроскопии (EDAX). Порошки ZnO имеют гексагональную структуру вюрцита и кристаллиты нанометрового размера. Размер частиц увеличивается с увеличением температуры реакции. Попытка была…
Размер частиц увеличивается с увеличением температуры реакции. Попытка была…
IJSRP.ORG
Влияние температур и концентраций поливинилового спирта в синтезе наночастиц оксида цинка
- Abebe Belay Gemta, B. Bekele, A. Reddy, Ommega Internations
Материало В этом исследовании влияние температуры отжига и концентрации поливинилового спирта (ПВС) на структурные и оптические свойства наночастиц оксида цинка было исследовано с помощью простого…
Синтез и характеристика наночастиц из оксида чистого цинка и наночастиц оксида цинка никеля
- J. Mayekar, V. Dhar, S. Radha
Материаловая наука, химия
- 2015
в этой статье
- 2015 9000 2
- .. J.S.Mayekar
Материаловедение, химия
- 2015
- A. Güngör, Rükan Genzde, T.0101
Материаловедение
- 2017
- Raymond Tichaona Taziwa , Э.

Материаловедение, химия
- 2017
- T. Hassanein, A. Mohammed, Wael Sabry Mohamed, R. Sobh, Magdy, Kandil Zahran
Материаловедение
- 2021
- A. Seidu
Материаловедение, химия
- 2016
- Мритунджая Парашар, В. Шукла, Ранбир Сингх
Материаловедение, химия
Journal of Materials Science: Materials in 10 9010 Electronics 9010
- 2020
- D. Bokov, Abduladheem Turki Jalil, E. Kianfar
Chemistry, Materials Science
Advances in Materials Science and Engineering
- 2021
- M. Moazzen, S.M. Borghei, F. Taleshi
- 2012
в этом наночастицы синтезируются простым методом влажного химического осаждения. В качестве исходных материалов используются нитрат цинка и гидроксид натрия. Наночастицы оксида цинка…0118
В качестве исходных материалов используются нитрат цинка и гидроксид натрия. Наночастицы оксида цинка…0118
В этой статье наночастицы оксида цинка синтезированы методом простого влажного химического осаждения. В качестве исходных материалов используются нитрат цинка и гидроксид натрия. Наночастицы оксида цинка…
ПРОСТОЙ СИНТЕЗ ПОЛУПРОВОДНИКОВЫХ НАНОРАЗМЕРНЫХ 0D И 2D ОКСИДОВ СВИНЦА С ИСПОЛЬЗОВАНИЕМ МОДИФИЦИРОВАННОГО МЕТОДА СООСАДКА
Наноразмерный свинец имеет множество универсальных применений, которые можно применять в повседневной жизни. В настоящем исследовании мы сообщаем о всестороннем исследовании получения наноразмерного оксида свинца с использованием…
Влияние модификации углерода на морфологические, структурные и оптические свойства наночастиц оксида цинка, синтезированных методом пиролиза с пневматическим распылением
В работе выявлено влияние легирования на морфологические, структурные и оптические свойства наночастиц (НЧ) оксида цинка (ZnO), синтезированных методом пневматического пиролиза (ПСП), …
Оптимизированный синтез наночастиц оксида цинка на основе биополимеров и оценка их антибактериальной активности
Благодаря своим уникальным свойствам наночастицы оксида цинка (ZnO NPs) имеют широкий спектр интересных применений. Однако проблема агрегации наночастиц остается сложной. Итак,…
Экспериментальное и расчетное исследование оксида цинка, легированного переходным металлом.
Чистые и переходные металлы (Fe, Mn, Co и Ni), легированные порошками ZnO, были синтезированы с использованием гидротермального порошка и охарактеризованы рентгеновским методом. дифракция, ультрафиолетовое-видимое поглощение…
дифракция, ультрафиолетовое-видимое поглощение…
Наночастицы оксидов металлов с помощью золь-гель метода: обзор синтеза, характеристики и применения
Наночастицы оксидов металлов (MONP) находят широкое применение, например, в оптических устройствах, системах очистки, биомедицинских системах, фотокатализе, фотогальванике и т. д. В этом обзоре мы рассмотрели…
Nanomaterial by Sol-Gel Method: Synthesis and Application
The sol -гель процесс является более химическим методом (мокрый химический метод) для синтеза различных наноструктур, особенно наночастиц оксидов металлов. В этом методе молекулярный предшественник (обычно…
В этом методе молекулярный предшественник (обычно…
Устройство для диагностики здоровья крупного рогатого скота
Исследовательская проблема, рассматриваемая в ходе исследования, заключалась в разработке недорогого портативного сенсорного устройства на основе ZnO для анализа сыворотки крови крупного рогатого скота (коровы) с целью диагностики их здоровья…
ПОКАЗАНЫ 1-10 ИЗ 19 ССЫЛОК
СОРТИРОВКА ПОРелевантностьНаиболее влиятельные статьиНедавность
Синтез и характеристика наноразмерных гексагональных и сферических наночастиц оксида цинка
ZnO играет важную роль во многих технологических аспектах производства полупроводников. Здесь метод прямого осаждения был использован для синтеза наноразмерных гексагональных частиц ZnO, который…
Электрохимический синтез наноцветков и нанолистов ZnO на пористом Si в качестве фотоэлектрических материалов , Shaoxiong Lin, Chunming Wang
Материаловедение
Гидротермальный синтез микросфер ZnO и гексагональных микростержней с пластинчатыми и пластинчатыми наноструктурами.

- Чиа-Лян Куо, Т. Куо, Майкл Х. Хуанг
Материаловедение, химия
Журнал физической химии. B
- 2005
Необычные микросферы ZnO, состоящие из взаимосвязанных пластинчатых наноструктур, которые могут существенно усиливать фоторазложение фенола под прямыми солнечными лучами и при этом сохранять структуру нанолистов с большой площадью поверхности.
Synthesis and optical properties of phosphorus-doped ZnO nanocombs
- D. Fan, Rong Zhang, Yang Li
Materials Science, Chemistry
- 2010
Study of the antibacterial activity of ZnO nanoparticles
- A Surti, S. Radha, Shivram S. Garje
Материаловедение
- 2013
Это исследование посвящено антибактериальной активности наночастиц ZnO против организмов, вызывающих кожные и раневые инфекции. Наночастицы были синтезированы мокрым химическим путем. Метод…
Наночастицы были синтезированы мокрым химическим путем. Метод…
Многослойные массивы нанопроволок ZnO с доминирующим излучением, связанным с поверхностью и акцептором
- Haiping He, Qiang Yang, Jingrui Wang, Z.Ye содержания Ag и ZnO на срок годности свежевыжатого апельсинового сока
- А. Эмамифар, М. Кадивар, М. Шахеди, С. Сулейманян-Зад
Химия
- 2010
Синтез наночастиц ZnO из Alpinia purpurata и их антимикробные свойства
- S. Suja
Материаловедение
- 2012
.Размер наночастиц ZnO составляет около 50 нм. Таким образом, исследование…
Безшаблонный золь-гель метод контролируемого роста массивов наностержней ZnO
- N. Huang, M. Zhu, Gao Lijun, Gong Jun, C. Sun, Xin Jiang
Материаловедение
- 2011
Повышенная биологическая активность наночастиц ZnO — антимикробное исследование.




Leave A Comment