Глинка Н. Л. Задачи и упражнения по общей химии. Задачи 1-27
Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 1-27
1. При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла. Решение
2. Одно и то же количество металла соединяется с 0,200 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена. Решение
3. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен ½ моля? Решение с ключом
4. Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. Решение с ключом
5. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (условия нормальные).
6. Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих случаях. Решение с ключом
7. 1,00 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль. Решение
8. Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди? Решение
9. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные). Решение с ключом
10. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла. Решение
11. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла. Решение
Определить массу металла. Решение
12. 1,60 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль. Решение
13. Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат? Решение с ключом
14. Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором? Решение с ключом
15. При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты. Решение
16. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия.
17. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,40 г соли. Вычислить эквивалентные массы вещества и образовавшейся соли. Решение с ключом
18. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль. Решение
19. От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной? Решение
20. Какая формула правильно выражает закон эквивалентов:
а) m1/m2= Э2/Э1
б) m1·Э2=m2·Э1
Решение
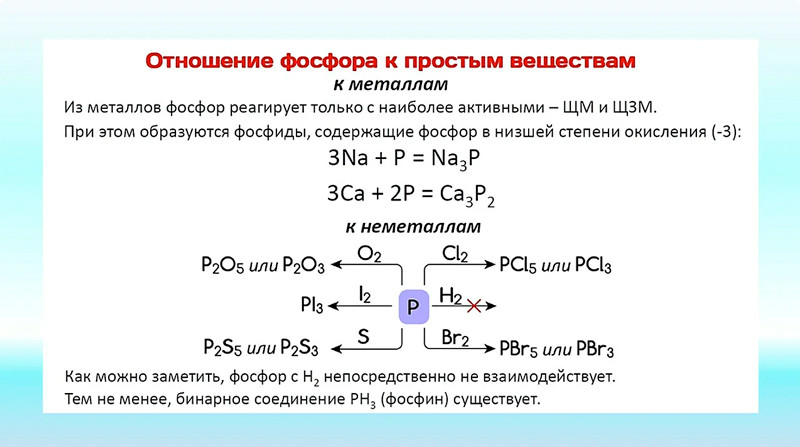
21. Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора? Решение
22. Выбрать правильные значения эквивалентных объемов кислорода и водорода при нормальных условиях: а) 11,2 л O2 и 22,4 л H2; б) 11,2 л O2 и 11,2 л H2; в) 5,6 л O2 и 11,2 л H2.
23. Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль? Решение
24. Эквивалентная масса металла в два раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза? Решение с ключом
25. Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16 г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль; б) 16 г/моль; в) 32 г/моль. Решение
26. Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)3: а) да; б) нет? Решение
27. Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет? Решение
Эквивалент. Закон эквивалентов
1.При разложении
0,7 г оксида металла выделилось 36,2 мл
кислорода, измеренного при нормальных
условиях. Найдите молярные эквивалентные
массы оксида и металла.
Найдите молярные эквивалентные
массы оксида и металла.
2. В состав соединения входит 24,8 % калия, 34,7 % марганца и 40,5 % (мас.) кислорода. Какова его эмпирическая формула и молярная эквивалентная масса?
3.Навеска металла массой 5 г вытесняет из кислоты 4,61 л водорода и 13,1 г меди из раствора ее соли. Вычислите молярные эквивалентные массы неизвестного металла и меди. Чему равна валентность последней?
4.Молярная масса эквивалента металла составляет 23,8 г/ моль. Рассчитайте массовую долю металла в оксиде.
5.Определите факторы эквивалентности и молярные эквивалентные массы катионов свинца в приведенных реакциях:
а) Pb4++ 2=Pb2+, б)Pb4++ 4OH—=Pb(OH)
6. Составьте
уравнения реакции полного (до)
и неполного (до)
окисления графита при его сгорании в
атмосфере кислорода. Определите
эквивалентные массы углерода в указанных
реакциях.
Определите
эквивалентные массы углерода в указанных
реакциях.
7.Молярная масса эквивалентов сульфида металла равна 36 г/ моль. Определите атомную массу металла и идентифицируйте его, учтя что валентность металла равна двум.
8.Вещество содержит 38,0 % серы и мышьяк. Молярная эквивалентная масса серы 16,0 г/моль. Вычислите молярную эквивалентную массу и стехиометрическую валентность мышьяка, составьте формулу данного сульфида.
9.При соединении серы с 5,6 г железа образовалось 8,8 г сульфида железа. Вычислите молярную эквивалентную массу металла и его эквивалент, если известно, что сера в образуемом сульфиде двухвалентна.
10. Молярная эквивалентная масса трехвалентного металла равна 68,1 г/моль. Вычислите атомную массу металла, молярную эквивалентную массу оксида и процентное содержание кислорода в оксиде.
11.На нейтрализацию
0,943 г фосфористой кислотыH3PO3израсходовано 1,291 гKOH.
12.Избытком гидроксида натрия подействовали на водные растворы: а) хлорида алюминия, б) гидроксохлорида алюминия. Составьте уравнения реакций и определите молярные эквивалентные массы указанных веществ.
13. Как определяются молярные эквивалентные массы многоосновных кислот и многооснований? Найдите молярную эквивалентную массу ортофосфорной кислоты в реакции
.
14.Вычислите молярную эквивалентную массу дихромат-аниона при его восстановлении в кислой среде по схеме:
15.Фосфор образует два различных по составу хлорида. Фактор эквивалентности какого элемента сохраняется постоянным? Назовите величины молярных эквивалентных масс
16.Одна и та же
масса металла соединяется с 2,51 г галогена
и с 180 см3О2. Вычислите
молярную эквивалентную массу галогена.
Вычислите
молярную эквивалентную массу галогена.
17.Один оксид марганца содержит 22,56 % кислорода, а другой – 50,50 %. Вычислите молярную эквивалентную массу и стехиометрическую валентность марганца в этих оксидах. Составьте формулы оксидов.
18.В какой массе гидроксида кальция находится столько же молярных грамм-эквивалентов, сколько их содержится в 147 г ортофосфорной кислоты?
19.В оксиде на два атома металла приходится три атома кислорода. Вычислите атомную массу металла, если известно, что содержание кислорода в его оксиде составляет 47 % (масс.).
20.На полную нейтрализацию 1,35 г серной кислоты израсходовано 1,1 г гидроксида щелочного металла. Какова формула этого гидроксида?
Хлориды элементов периода 3
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3666
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются структуры хлоридов элементов 3-го периода (от натрия до серы), их физические свойства и их реакции с водой. Хлор и аргон опущены — хлор, потому что бессмысленно говорить о «хлориде хлора», а аргон, потому что он инертен и не образует хлорида.
Хлор и аргон опущены — хлор, потому что бессмысленно говорить о «хлориде хлора», а аргон, потому что он инертен и не образует хлорида.
Краткий обзор тенденций
Интересующие хлориды приведены в таблице ниже:
| NaCl | MgCl 2 | AlCl 3 | SiCl 4 | ПКл 5 | S 2 Класс 2 |
| ПКл 3 |
Сера образует три хлорида, но наиболее распространен S 2 Cl 2 . Хлорид алюминия также существует при некоторых условиях в виде димера, Al 2 Cl 6 .
- Структуры : хлорид натрия и хлорид магния являются ионными и состоят из больших ионных решеток при комнатной температуре.
 Хлорид алюминия и хлорид фосфора (V) более сложны. Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы.
Хлорид алюминия и хлорид фосфора (V) более сложны. Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы. - Точки плавления и кипения: Хлориды натрия и магния представляют собой твердые вещества с высокими температурами плавления и кипения из-за большого количества тепла, необходимого для разрушения сильного ионного притяжения.
- Остальные представляют собой жидкости или твердые вещества с низкой температурой плавления. Оставляя в стороне случаи хлорида алюминия и хлорида фосфора (V), где ситуация довольно сложная, притяжение в других случаях будет гораздо более слабыми межмолекулярными силами, такими как дисперсионные силы Ван-дер-Ваальса. Они различаются в зависимости от размера и формы молекулы, но всегда будут намного слабее, чем ионные связи.
- Электропроводность: Хлориды натрия и магния являются ионными, поэтому в расплавленном состоянии подвергаются электролизу.
 Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.
Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов. - Реакции с водой : Приблизительно простые ионные хлориды (хлорид натрия и магния) просто растворяются в воде. Хотя все другие хлориды реагируют с водой различными способами, описанными ниже для каждого отдельного хлорида. Реакция с водой известна как гидролиз.
Хлорид натрия (NaCl)
Хлорид натрия представляет собой ионное соединение, состоящее из гигантского массива ионов натрия и хлора. Небольшая репрезентативная часть решетки хлорида натрия выглядит следующим образом:
Обычно это изображается в развернутом виде:
Сильное притяжение между положительными и отрицательными ионами требует большого количества тепловой энергии для разрыва, поэтому хлорид натрия имеет высокие температуры плавления и кипения. Соединение не проводит электричество в твердом состоянии, потому что в нем нет подвижных электронов, а ионы ограничены кристаллической решеткой. Однако, когда он плавится, он подвергается электролизу. Хлорид натрия растворяется в воде с образованием нейтрального раствора.
Соединение не проводит электричество в твердом состоянии, потому что в нем нет подвижных электронов, а ионы ограничены кристаллической решеткой. Однако, когда он плавится, он подвергается электролизу. Хлорид натрия растворяется в воде с образованием нейтрального раствора.
Хлорид магния (MgCl
2 )Как и хлорид натрия, хлорид магния также образует ионное твердое вещество, но с более сложной кристаллической структурой ионов, чтобы вмещать вдвое больше ионов хлорида, чем ионов магния. Как и в случае с хлоридом натрия, для преодоления притяжения между ионами требуется большое количество тепловой энергии (из-за высокой энтальпии решетки соединения), поэтому температуры плавления и кипения также высоки. Твердый хлорид магния не является проводником электричества, потому что ионы ограничены. Однако при плавлении соединение подвергается электролизу.
Хлорид магния растворяется в воде с образованием слегка кислого раствора (с pH приблизительно 6). Когда ионы магния сольватируются из твердой решетки, между ионами 2+ и молекулами воды возникает достаточное притяжение для образования координированных (дативных ковалентных) связей между ионами магния и неподеленными парами на окружающих молекулах воды. -_{(водн.)}\] 9+_{(aq)}\]
-_{(водн.)}\] 9+_{(aq)}\]
Если уравнение написано таким образом, необходимо включить символы состояния.
Хлорид алюминия (AlCl
3 )Электроотрицательность увеличивается в течение периода; алюминий и хлор недостаточно различаются по электроотрицательности, чтобы образовать простую ионную связь. Структура хлорида алюминия изменяется с температурой. При комнатной температуре алюминий имеет 6-координацию (т. е. каждый алюминий окружен 6 атомами хлора). Структура представляет собой ионную решетку, но имеет много ковалентного характера.
При атмосферном давлении хлорид алюминия возгоняется при температуре около 180°C. Если давление увеличить до чуть более 2 атмосфер, вместо этого он плавится при температуре 192°C.
Обе эти температуры намного ниже ожидаемого диапазона для ионного соединения. Они предполагают сравнительно слабое притяжение между молекулами вместо сильного притяжения между ионами. Это связано с тем, что координация алюминия изменяется при этих температурах. Он становится 4-координированным — каждый алюминий окружен 4 атомами хлора, а не 6. Исходная решетка превращается в Al 2 Cl 6 расположение молекул. Структура показана ниже:
Он становится 4-координированным — каждый алюминий окружен 4 атомами хлора, а не 6. Исходная решетка превращается в Al 2 Cl 6 расположение молекул. Структура показана ниже:
При конверсии весь ионный характер теряется, что приводит к испарению или плавлению хлорида алюминия (в зависимости от давления). Эти димеры и простые молекулы AlCl 3 существуют в равновесии. При дальнейшем повышении температуры положение равновесия все более и более смещается вправо следующей системы:
\[ Al_2Cl_6 \rightleftharpoons 2AlCl_3\]
Краткое содержание AlCl
3- При комнатной температуре твердый хлорид алюминия имеет ионную решетку со значительным ковалентным характером.
- При температуре около 180–190°C (в зависимости от давления) хлорид алюминия превращается в молекулярную форму Al 2 Cl 6 . Это заставляет его плавиться или испаряться из-за сравнительно слабого межмолекулярного притяжения.

- При дальнейшем повышении температуры образуется больше молекул AlCl 3 .
Твердый хлорид алюминия не проводит электричество при комнатной температуре, поскольку ионы не могут свободно двигаться. Расплавленный хлорид алюминия (возможен только при повышенных давлениях) также является непроводящим, так как потерял свой ионный характер.
Хлорид алюминия резко реагирует с водой. Капля воды, помещенная на твердый хлорид алюминия, образует паровые облака газообразного хлороводорода. Твердый хлорид алюминия в избытке воды еще брызгает, но вместо этого образуется кислый раствор. Раствор хлорида алюминия обычной концентрации (около 1 моль дм 9- (aq)\]
Это очень похоже на уравнение хлорида магния, приведенное выше, с той лишь разницей, что это заряд иона. Больший заряд довольно сильно притягивает электроны в молекулах воды к алюминию, делая атомы водорода более положительными и, следовательно, легче удаляемыми из иона. Следовательно, этот ион намного более кислый, чем в соответствующем случае магния.
Кислотно-щелочное равновесие для этой реакции лежит правее, чем для магния, поэтому образующийся раствор более кислый — образуется больше ионов гидроксония, как показано на рисунке: 9+ \]
Если воды мало, выделяется газообразный хлористый водород. Из-за тепла, выделяющегося в реакции, и концентрации образующегося раствора ионы водорода и ионы хлора в смеси объединяются в молекулы хлороводорода (\(HCl\)) и выделяются в виде газа. При большом избытке воды температура никогда не бывает достаточно высокой, чтобы это произошло; ионы остаются сольватированными.
Тетрахлорид кремния (SiCl
4 ) Тетрахлорид кремния представляет собой простой ковалентный хлорид, не требующий никаких манипуляций. Между кремнием и хлором недостаточно разницы в электроотрицательности для образования ионных связей. Тетрахлорид кремния представляет собой бесцветную жидкость при комнатной температуре, дымящую на влажном воздухе. Единственным притяжением между молекулами являются дисперсионные силы Ван-дер-Ваальса. Он не проводит электричество из-за отсутствия ионов или мобильных электронов.
Он не проводит электричество из-за отсутствия ионов или мобильных электронов.
Он дымится во влажном воздухе, потому что реагирует с водой в воздухе с образованием хлороводорода. Если к четыреххлористому кремнию добавить воду, произойдет бурная реакция с образованием двуокиси кремния и паров хлористого водорода. В большом избытке воды хлористый водород, конечно, растворяется с образованием сильнокислого раствора, содержащего соляную кислоту.
\[ SiCl_4 + 2H_2O \rightarrow SiO_2 + 4HCl\]
Хлориды фосфора
Есть два хлорида фосфора: хлорид фосфора(III), PCl 3 и хлорид фосфора(V), PCl 5 .
Хлорид фосфора(III) (PCl
3 ) Этот простой ковалентный хлорид существует в виде дымящейся жидкости при комнатной температуре, поскольку между молекулами действуют только ван-дер-ваальсовы дисперсионные силы и диполь-дипольное притяжение. Жидкость не проводит электричество из-за отсутствия ионов или подвижных электронов.
Хлорид фосфора(III) бурно реагирует с водой с образованием фосфористой кислоты, H 3 PO 3 и пары хлороводорода (или раствор, содержащий соляную кислоту в избытке воды):
\[ PCl_3 + 3H_2O \rightarrow H_3PO_3 + 3HCl\]
Фосфор(V) хлорид (PCl
5 )Хлорид фосфора(V) имеет более сложную структуру, чем хлорид фосфора(III). При комнатной температуре он образует белое твердое вещество, которое возгоняется при 163°С. Повышение температуры выше точки сублимации диссоциирует (обратимо разделяет) больше хлорида фосфора (V) на хлорид фосфора (III) и хлор:
\[ PCl_5 \rightleftharpoons PCl_3 + Cl_2\]
Хлорид фосфора(V) представляет собой ионное твердое вещество. В образовании ионов принимают участие две молекулы PCl 5 . Ион хлора переходит от одной исходной молекулы к другой, оставляя положительный ион [PCl 4 ] + и отрицательный ион [PCl 6 ] — .
При 163°C хлорид фосфора(V) превращается в молекулярную форму, содержащую молекулы PCl 5 . Поскольку между этими молекулами существуют только дисперсионные силы Ван-дер-Ваальса, частицы испаряются. Твердый хлорид фосфора(V) не проводит электричество.
Поскольку между этими молекулами существуют только дисперсионные силы Ван-дер-Ваальса, частицы испаряются. Твердый хлорид фосфора(V) не проводит электричество.
Хлорид фосфора(V) бурно реагирует с водой с образованием паров хлороводорода. Как и в случае с другими ковалентными хлоридами, при наличии достаточного количества воды они растворяются с образованием раствора соляной кислоты.
Реакция протекает в две стадии. Первый происходит в холодной воде; оксихлорид фосфора, POCl 3 , производится вместе с HCl:
\[ PCl_5 + 4H_2O \rightarrow POCl_3 + 2HCl\]
При кипении раствора хлорид фосфора(V) вступает в дальнейшую реакцию с образованием фосфорной (V) кислота и еще HCl. Фосфорная (V) кислота также известна как фосфорная кислота или ортофосфорная кислота:
\[ POCl_3 + 3H_2O \rightarrow H_3PO_4 + 3HCl\]
Объединение этих уравнений дает общую реакцию в кипящей воде: Cl 2 )
Дихлорид дисульфура является одним из трех хлоридов серы и представляет собой соединение, образующееся при реакции хлора с горячей серой. Дихлорид дисульфура представляет собой ковалентную жидкость оранжевого цвета с неприятным запахом. Его довольно необычная структура приведена ниже:
Дихлорид дисульфура представляет собой ковалентную жидкость оранжевого цвета с неприятным запахом. Его довольно необычная структура приведена ниже:
Конформация молекулы указывает на возможные межмолекулярные взаимодействия:
- В молекуле нет плоскости симметрии; следовательно, он имеет общий постоянный диполь.
- В жидком состоянии молекула испытывает дисперсионные силы Ван-дер-Ваальса и диполь-дипольное притяжение.
- В дихлориде серы нет ни ионов, ни подвижных электронов, что делает его непроводящим.
Дихлорид дисульфура медленно реагирует с водой с образованием сложной смеси соляной кислоты, серы, сероводорода и различных серосодержащих кислот и анионов.
Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Хлориды элементов периода 3» распространяется под лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Алюминий
- хлорид
- Дихлорид дихлорида
- энтальпия решетки
- Магний
- Период 3
- Фосфор
- Тетрахлорид кремния
- Натрий
- Хлорид натрия

 Хлорид алюминия и хлорид фосфора (V) более сложны. Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы.
Хлорид алюминия и хлорид фосфора (V) более сложны. Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы.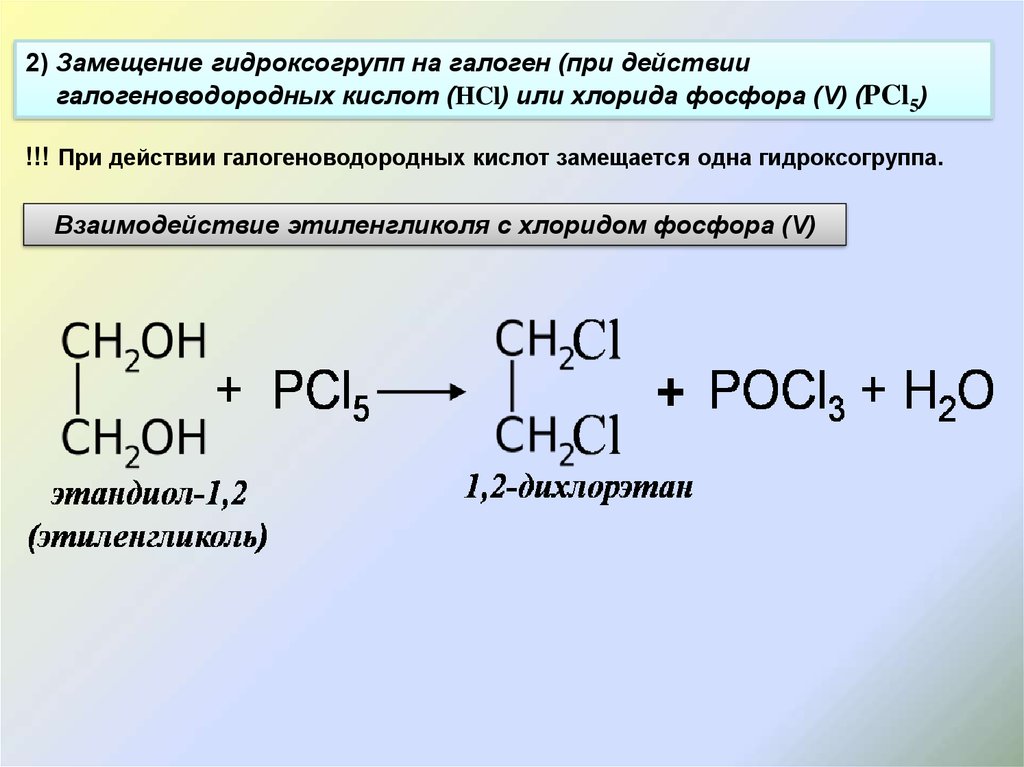 Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.
Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.


 Далее на этой странице об этом будет гораздо больше.
Далее на этой странице об этом будет гораздо больше.
 Реакция с водой известна как гидролиз .
Реакция с водой известна как гидролиз . Посмотрите на страницу предложений учебников, чтобы найти некоторые из доступных книг.
Посмотрите на страницу предложений учебников, чтобы найти некоторые из доступных книг. 
 Это означает, что вы не можете провести простое сравнение между точками плавления и кипения хлорида магния и более чисто ионного хлорида натрия.
Это означает, что вы не можете провести простое сравнение между точками плавления и кипения хлорида магния и более чисто ионного хлорида натрия.
 Магниевый корпус точно такой же.
Магниевый корпус точно такой же. Тот факт, что их образовалось немного (положение равновесия лежит далеко влево), означает, что раствор слабокислый.
Тот факт, что их образовалось немного (положение равновесия лежит далеко влево), означает, что раствор слабокислый.
 Если вы читали страницу о координационной связи, упомянутую выше, вы видели, что ее структура такова:
Если вы читали страницу о координационной связи, упомянутую выше, вы видели, что ее структура такова:
 Раствор хлорида алюминия обычной концентрации (например, около 1 моль дм -3 ) будет иметь рН около 2 — 3. Более концентрированные растворы будут ниже этого значения.
Раствор хлорида алюминия обычной концентрации (например, около 1 моль дм -3 ) будет иметь рН около 2 — 3. Более концентрированные растворы будут ниже этого значения.
 Между кремнием и хлором недостаточно разницы в электроотрицательности для образования ионных связей.
Между кремнием и хлором недостаточно разницы в электроотрицательности для образования ионных связей.


 В нескольких источниках упоминается необходимость кипячения воды для второй половины реакции, но в некоторых не указывается температура. Во всех паспортах безопасности, доступных в Интернете, говорится о сильной реакции оксихлорида фосфора с водой без каких-либо указаний на то, что его нужно нагревать.
В нескольких источниках упоминается необходимость кипячения воды для второй половины реакции, но в некоторых не указывается температура. Во всех паспортах безопасности, доступных в Интернете, говорится о сильной реакции оксихлорида фосфора с водой без каких-либо указаний на то, что его нужно нагревать. 
Leave A Comment