основных, амфотерных, кислотных – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.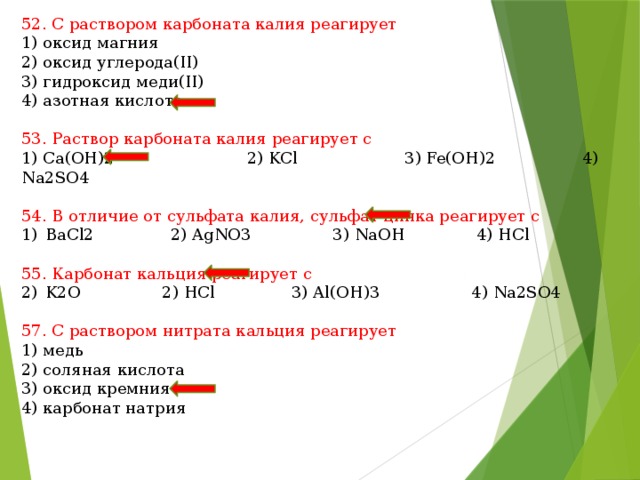
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + HCl →
Б) Na2O + CO2 →
В) Na2O + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) Na2CO3
2) NaCl + H2
3) NaCl + H2O
4) NaO3
5) Na2O2
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + H2SO4 (изб.) →
Б) Na2O + Al2O3 →
В) Na2O + P2O5 →
ПРОДУКТЫ РЕАКЦИИ
1) NaHSO4
2) NaHSO4 + H2O
3) NaAlO2
4) Na3PO4
5) Na2SO4 + H2O
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + H3PO4 (изб.) →
Б) CaO + H2O →
В) CaO + CO2 →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) CaCO3
3) Ca(OH)2
4) CaCO2
5) Ca3(PO4)2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) Ca3(PO4)2 + H2O
3) CaCl2 + H2O
4) CaSiO3 5) Ca(OCl)2
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯H2O→
В) ZnO + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnCl2 + H2O
2) ZnCl2
3) Na2[Zn(OH)4]
4) Na2ZnO2 + H2O
5) Na2ZnO2
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
ПРОДУКТЫ РЕАКЦИИ
1) Na2[Zn(OH)4] + H2
2) Na2ZnO2
3) Zn(H2PO4)2 + H2O
4) Zn + CO
5) Zn3(PO4)2 + H2O
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Ca(OH)2 ⎯⎯сплавление→
В) P2O5 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3(PO4)2 + H2O
2) CaHPO4
3) Na3PO4 + H2O
4) Na3PO4
5) H3PO4
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Na2O →
В) P2O5 + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) H3PO4 + HNO2
2) H3PO4
3) Na3PO4
4) H3PO3
5) HPO3 + N2O5
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + Ca(OH)2 (изб.) →
Б) SO2 + Na2O →
В) SO2 + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) CaSO3 + H2O
2) SO3
3) Ca(HSO3)2
4) Na2SO4
5) Na2SO3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб. ) + NaOH →
) + NaOH →
В) SO2 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Na2SO4 + H2O
2) Na2SO3 + H2O
3) NaHSO3
4) S + H2O
5) NaHSO4
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.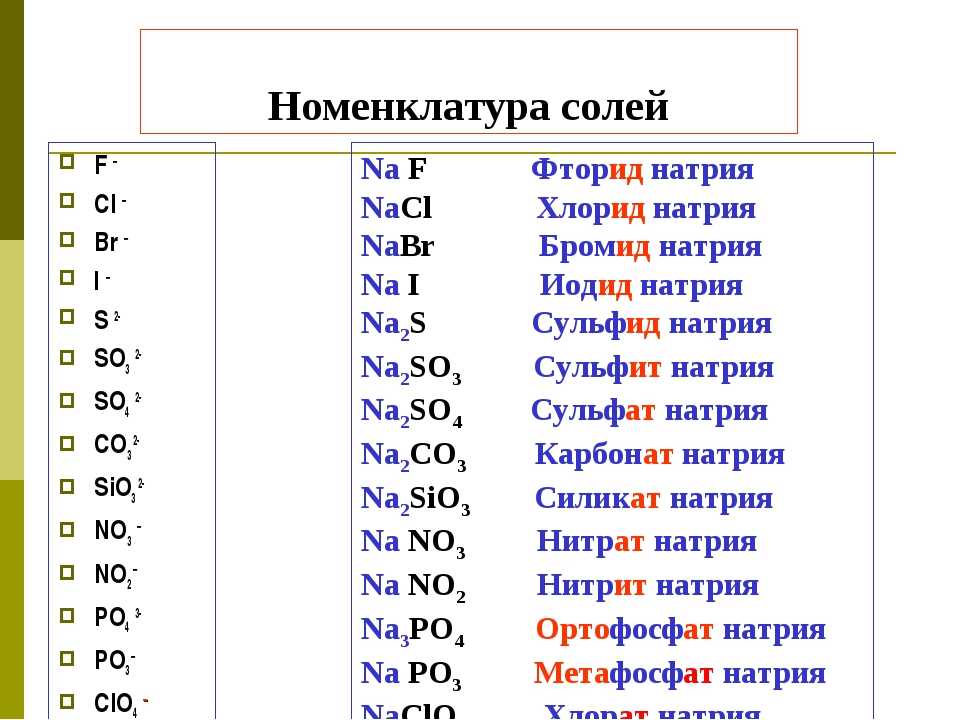 Для первого превращения составьте сокращённое ионное уравнение реакции.
Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Ответы
Химические свойства оснований →
← Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Оксид бария
Оксид бария известен в качестве соединения бария и кислорода. В письменном обозначении в составе химических формул оксид бария обозначается, как ВаО. В ряде химических реакций выступает оксидом основного вида. Допустим и элементарный визуальный анализ вещества в соответствии со стандартными условиями, где ВаО представлен в виде бесцветных кристаллов с кубической по форме решеткой.
В письменном обозначении в составе химических формул оксид бария обозначается, как ВаО. В ряде химических реакций выступает оксидом основного вида. Допустим и элементарный визуальный анализ вещества в соответствии со стандартными условиями, где ВаО представлен в виде бесцветных кристаллов с кубической по форме решеткой.
Оксид бария входит в число элементов, относящихся к подгруппе IV, то есть к неорганическим основаниям, представленным оксидами, гидроксидами и пероксидами металлов. Любое из оснований данного вида представляет собой соединение, где явно выражено наличие гидроксильного радикала (OH). Такие основания реагируют с кислотой, вследствие чего характерно образование солей.
Сырье, в основном используемое при получении бария, применяется в виде барита или, что реже, витерита. Реакция получения оксида бария – это реакция восстановления минералов при помощи каменного угля, кокса либо газа природного происхождения. Собственно именно в результате взаимодействия данных веществ и происходит стабильное получение сульфида и оксида бария.
Основные уравнения реакций оксида бария
• Реакция взаимодействия металлического бария и кислорода, в результате которой происходит образование оксида бария: 2Ва + О2 → 2ВаО. В подобном типе реакции обеспечивается получение не только оксида, но и пероксида бария: Ва + О2 → ВаО2;
• Реакция разложения карбоната бария при условии обязательного нагревания, где получение оксида бария сопровождается выделением углекислого газа: ВаСО3 → ВаО + СО2↑. Существует обратная реакция оксида бария и оксида углерода (IV) при условиях комнатной температуры;
• Реакция разложения нитрата бария при условиях нагревания, где полученными веществами являются оксид бария, оксид азота и кислород: 2Ba(NO3)2 → 2BaO + 4NO2 + O2;
• Реакция гидроксида бария и оксида серы (IV): Ва(НО)2 + 2SО2 → Ва(НSО3)2, где результатом взаимодействия веществ становится образование (Ва(НSО3)2).
Получение металлического бария возможно и с проведением реакции восстановления.
3ВаО + 2Аl → 3Ва + Аl2О3
Кроме этого, гарантированное получение бария обеспечивается посредством электролиза смеси хлорида бария и кальция в расплавленном состоянии.
Степень растворимости Ва
Растворимость оксида бария определяется по реакции данного вещества с водой. В этом случае, исходя из данных уравнения по взаимодействию:
ВаО + Н2О = Ва(ОН)2,
где оксид бария — это оксид основного типа.
Следовательно такому оксиду будет соответствовать основание — Ва(ОН)2. Сверяя полученные данные с таблицей растворимости веществ нетрудно определить, что данный вид оснований относится к растворимым и подтверждает тот факт, что реакция вполне осуществима.
Природные источники вещества
По содержанию в природных источниках различается несколько возможных:
- • Земная кора, где масса вещества составляет 0, 05 %;
- • Морская вода, где средняя величина содержания бария составляет 0,02 мг/литр.

Области применения оксидов основного типа
Любое их химических соединений данной группы широко применяется в различных отраслях современной промышленности. В соответствии с краткой классификацией веществ, можно определить следующее разграничение использования оксидов (калия, магния, бария, алюминия):
- • Оксид калия. Широко применяется в производстве удобрений минерального типа, используемых аграрном хозяйстве;
- • Оксид натрия. Незаменим в химической промышленности для получения гидроксида натрия;
- • Оксид бария. Применим в качестве катализатора в осуществлении химических реакций;
- • Оксид магния. Область применения – пищевая промышленность (в виде добавки Е530).
Определение химических свойств вещества на практике
• Ярко протекает реакция взаимодействия оксида бария и воды, вследствие чего отмечается образование щелочи с параллельным выделением тепла: ВаО + Н2О → Ва(ОН)2.
• Взаимодействует оксид бария и с кислотными оксидами, в результате чего характерно образование солей: ВаО + СО2 → ВаСО3, ВаО + SО3 → Ва SО4↓, где оксид бария вступает в реакцию с триоксидом серы;
• Реакция взаимодействия ВаО с кислотами, где обеспечивается итоговое образование солей и воды: ВаО + Н2Сl → ВаСl2 + Н2О, ВаО + Н2SО4 → Ва SО4↓ + Н2О. В течение подобной реакции между оксидом бария и серной кислотой (в разбавленном виде) результатом становится образование сульфата бария и воды.
Также стоит обратить внимание на реакцию оксида бария с соляной кислотой: ВаО + 2НСl (при обязательном условии разбавленного состояния) → ВаСl2 + Н2О, где результатом реакции обеспечено образование хлорида бария BaCl2 и воды h3O.
Описание физических свойств ВаО
Существует в твердом состоянии. Непосредственно сам барий отличается характерным серебристо – белым оттенком, достаточно пластичен, по причине чего относится к ковким металлам.
- • Величина молярной массы оксида бария, гр/моль: 153, 3394;
- • По плотности вещество характеризуется следующими показателями, при условии температурного режима в 20 °C: 5, 72;
- • Растворимость в воде, то есть показатель Кs, при условии температуры в 20° С = 1, 5 г/100 г;
Особенности гидроксида и пероксида бария
Гидроксид бария обозначается, как Ba(OH). Применяется в виде кристаллообразных пластин белого цвета, либо в состоянии раствора, более известного как баритовая вода. Популярен в стекольном производстве, например для создания и разработки непроницаемого стекла для рентгеновских установок. Также используется в производстве керамических изделий, в процессах по очистке воды и в производстве гидроксида калия.
Пероксид бария, обозначаемый, как BaO, получается путем нагревания оксида бария в воздушном пространстве с характерным отсутствием диоксида углерода.
Применение
Выход ВаО достаточно низок, соответственно, учитывая его невысокую стоимость, он пользуется повышенным спросом в работах по покрытию катодов, входящих в электронно-вакуумные приборы, на элементах телевизионных устройства и осциллографических трубок.
- • Производство антикоррозионных материалов;
- • Товары из категории сегнето- и пьезо- электрики;
- • Изготовление оптических приборов, таких, как призмы, линзы и прочие;
- • Пиротехнические изделия с целью окрашивания пламени заряда в зеленый цвет;
- • Отрасль атомно-водородной и ядерной энергетики;
- • В составе фторионных аккумуляторных батарей, как электролитный компонент;
- • При разработке и производстве медицинского оборудования.
Хранение
Условия соответствующего хранения ВаО подразумевают полное отсутствие любых легко возгораемых веществ. Также исключены в близком хранении и нахождении восстанавливающие агенты, металлы в порошкообразном состоянии. Категорически запрещается параллельное нахождение любых продуктов питания и сельскохозяйственных животных кормов.
Особые обозначения на упаковке
Полностью исключена одновременная транспортировка с пищевыми продуктами, косметической продукцией, животными кормами и любыми водными организмами. Весь транспортируемый материал должен быть помечен следующими символами:
Весь транспортируемый материал должен быть помечен следующими символами:
- • Хn, обозначающий раздражающее действие отмеченных веществ;
- • R, с числовым значением 20/22, что говорит об опасности при вдохе и в случае проглатывания;
- • S, с числовым значением 17, что предписывает ранение вещества в максимальной отдаленности от горюче – смазочных материалов;
- • S, с числовым значением 28, указывающем на незамедлительное промывание, в случае попадания ВаО на поверхность кожных покровов.
Варианты фасовки подразумевают распределение вещества по упаковкам в 1, 20 – 25, 100, 500 и 1000 килограммовые упаковки, которыми служат банки из стекла, мешки из полипропилена, пакеты из полиэтилена. На фасовке любого веса обязателен к указанию класс степени опасности: 5.1. Существует понятие вторичной опасности, означаемой 6.1.
Влияние ВаО на организм человека
Симптоматика отравлений барием как правило выражена в следующем: повышенное слюнотечение, жжение во рту, дискомфорт в пищеводе. Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
При использовании любых соединений бария стоит помнить о том, что изучение его недостаточно, а к жизненно важным микроэлементам он не относится. Вещество характеризуется как высокотоксичное, так что при любом виде контакта рекомендовано соблюдать все меры предосторожности и СИЗ.
Формула оксида бария – структура, свойства, применение, примеры вопросов
Оксид бария – замечательное (синтетическое) химическое соединение, подходящее для применения в оптике и керамике. Он втягивает атомы воды из общего климата при комнатной температуре. Это широко используется для покрытия горячих катодов в электронно-лучевых трубках, создания оптического коронного стекла и многого другого. Он также используется в качестве специального осушителя газа и растворителей. Это соединение проявляется от белого тона до желтого тона. При взаимодействии с водой образуется гидроксид бария. Он не проводит электричество, как другие оксидные соединения. Он имеет плотность 5,72 г/мл и является негорючим соединением.
Это соединение проявляется от белого тона до желтого тона. При взаимодействии с водой образуется гидроксид бария. Он не проводит электричество, как другие оксидные соединения. Он имеет плотность 5,72 г/мл и является негорючим соединением.
Барий
Барий — щелочной металл, химический элемент Ba и ядерный номер 56. Это пятый элемент в периодической таблице 2. Из-за высокой реакционной способности барий никогда не встречается в природе в свободном виде. Наиболее широко известными минералами бария являются барит и витерит.
- Символы: BA
- Атомная масса: 137,327 U
- Атомный номер: 56
- Van Der Waals Радиус: 268 вечера
- Точка плавления: 727 ° C
- Плотность: 3,5 г.см -3 при 20°C
- Стандартный потенциал: – 2,90 В
- Степень окисления: 2 +
9003 1 Кислород и оксид
Кислород составляет около 21% климатических газам и чрезвычайно восприимчив. Все компоненты на Земле реагируют с кислородом, образуя кислородсодержащие соединения. Соединения кислорода, парные смеси кислорода с меньшими электроотрицательными компонентами, называются оксидами. Примеры оксидов включают Na 2 O, CaO, Al 2 O 3 , CO 2 , N 2 O 3 , Cl 2 O и XeO 9 0035 2 . Оксид — это категория химического соединения, в состав которого входит один или несколько атомов кислорода, а также другой элемент, такой как Li 2 O, CO 2 , H 2 O и т. д.
Соединения кислорода, парные смеси кислорода с меньшими электроотрицательными компонентами, называются оксидами. Примеры оксидов включают Na 2 O, CaO, Al 2 O 3 , CO 2 , N 2 O 3 , Cl 2 O и XeO 9 0035 2 . Оксид — это категория химического соединения, в состав которого входит один или несколько атомов кислорода, а также другой элемент, такой как Li 2 O, CO 2 , H 2 O и т. д.
Формула оксида бария
Химическая формула оксида бария: BaO. Его молярная масса 153,33 г/моль, а плотность 5,72 г/см 9 .0020 3 . Это кубическая структура. BaO образуется при окислении солей бария и карбоната бария. Барий потребляет кислород для создания оксида бария. (Один ион бария нейтрализует один ион кислорода, эти два иона объединяются с образованием оксида бария, BaO.)
Физические свойства Оксид бария
- Когда соль бария окисляется с получением оксида бария, оксид бария, судя по всему, представляет собой белое нерастворимое тонкодисперсное вещество.

- При 20°С оксид бария распадается на 3,48 г/100 мл, а при 100°С распадается на 90,8 г/100 мл.
- В этаноле, разбавленных минеральных кислотах и щелочах оксид бария растворим.
- Температура плавления оксида бария составляет 1923 градуса по Цельсию, 3493° по Фаренгейту или 2196° по Кельвину.
- Оксид бария кипит при 2000 градусов по Цельсию, 3630 градусов по Фаренгейту или 2270 градусов по Кельвину.
- Оксид бария имеет толщину 5,72 грамма на кубический сантиметр.
Химические свойства оксида бария
- Всякий раз, когда соль бария окисляется, образуется оксид бария, иначе называемый барием. Это негорючее, гигроскопичное вещество белого цвета.
- Поскольку соли бария окисляются, субатомное уравнение для оксида бария — BaO. Соответствующее условие дает уравнение для оксида бария:0003
При нагревании карбоната бария образуется оксид бария или монооксид бария (BaCO 3 ). Для его получения можно использовать нагревание вещества нитрата бария (Ba(NO 3 ) 2 ).
 Кроме того, при разложении различных солей бария часто образуется оксид бария.
Кроме того, при разложении различных солей бария часто образуется оксид бария.2Ba + O 2 → 2BaO
BaCO 3 → BaO + CO 2
90 069Использование оксида бария
- Используется в качестве абсорбента во многих химических реакциях.
- Используется в производстве оптического кронового стекла.
- Оксид бария используется в процессе разделения изомеров.
- Действует как окислитель.
- Оксид бария является поставщиком кислорода из-за колебаний температуры.
- Используется для покрытия трубок с горячим катодом.
- Используется в производстве топлива.
- Используется в реакциях с этиленоксидом и спиртами в качестве катализатора этоксилирования, которое происходит при температуре от 150°C до 200°C.
Примеры вопросов
Вопрос 1: Каковы вопросы безопасности при использовании оксида бария?
Ответ :
В случае попадания на кожу или в глаза или при вдыхании вызывает боль и покраснение.
 это более опасно при попадании внутрь. Это может вызвать тошноту и послабление кишечника, потерю подвижности мышц, сердечно-сосудистую аритмию и может привести к смерти. При проглатывании следует немедленно обратиться за медицинской помощью.
это более опасно при попадании внутрь. Это может вызвать тошноту и послабление кишечника, потерю подвижности мышц, сердечно-сосудистую аритмию и может привести к смерти. При проглатывании следует немедленно обратиться за медицинской помощью.Вопрос 2: По какой причине мы обрабатываем вольфрамовые катоды оксидом бария в натриевых лампах?
Ответ:
Работоспособность вольфрама снижается при хранении оксида бария на проволочной нити. Иными словами, вольфрам тем эффективнее разряжает электроны и тем более эффективно работает.
Вопрос 3: Как приготовить BaO?
Ответ:
Мы можем получить оксид бария двумя способами:
Во-первых, барий реагирует с кислородом с образованием оксида бария:2Ba + O 2 → 2BaO
Далее оксид бария путем нагревания карбоната бария:
BaCO 90 035 3 → BaO + CO 2
Вопрос 4: Как при получении оксида бария термическим разложением карбоната бария добавляется углерод в реакционную смесь?
Ответ:
Карбонат бария из-за очень высокой энергии решетки разлагается примерно при 1400°C.

BaCO 3 → BaO + CO 2 .
При такой высокой температуре реакция становится обратимой. Добавленный углерод соединяется с CO 2 , образуя CO, и, таким образом, реакция становится необратимой,
CO 2 + C → 2CO.
Вопрос 5: Каково использование BaO?
Ответ :
Оксид бария используется в процессе разделения изомеров. Он используется в качестве абсорбента во многих химических реакциях.
Используется в производстве оптического кронового стекла. Используется в реакции этиленоксида и спиртов в качестве катализатора этоксилирования, которое происходит где-то в диапазоне 150˚C и 200˚C.Вопрос 6: Что такое глотательный тест с барием?
Ответ:
Барий используется во время глотательного теста, чтобы сделать определенные области тела более четкими на рентгеновском снимке.
 Рентгенолог на самом деле захочет увидеть размер и состояние глотки и горла. Человек также сможет воспринимать то, как вы глотаете. Эти тонкости, наверное, не будут видны на стандартном X-beam. Барий используется для визуализирующих тестов желудочно-кишечного тракта.
Рентгенолог на самом деле захочет увидеть размер и состояние глотки и горла. Человек также сможет воспринимать то, как вы глотаете. Эти тонкости, наверное, не будут видны на стандартном X-beam. Барий используется для визуализирующих тестов желудочно-кишечного тракта.Вопрос 7: Что такое клизма с барием?
Ответ:
Бариевая клизма — это рентгенологическое исследование, позволяющее выявить изменения или аномалии в пищеварительном органе (толстой кишке). Система дополнительно называется рентгеном толстой кишки.
Очищение — это введение жидкости в прямую кишку через небольшую трубку. В этой ситуации жидкость содержит металлическое вещество (барий), покрывающее оболочку толстой кишки. Обычно рентгеновский луч создает неблагоприятную картину нежных тканей, однако бариевое покрытие дает в целом четкие очертания толстой кишки.WebElements Periodic Table » Барий » оксид бария
- Формула: BaO
- Формула системы Хилла: Ba 1 O 1
- Регистрационный номер CAS:
- Вес формулы: 153,326
- Класс: оксид
- Цвет: от белого до очень бледно-желтого
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 1973°C; 1913°С
- Температура кипения: 2000°C
- Плотность: 5720 кг·м -3
Ниже приведены некоторые синонимы оксида бария :
- оксид бария
- бария(II) оксид
Степень окисления бария в оксиде бария 2 .

Синтез
Оксид бария получают путем термолиза солей, таких как карбонат бария
BaCO 3 (тепло) → BaO(s) + CO 2 (г)
Твердотельная структура
- Геометрия бария: 6 координата: октаэдрическая
- Прототип структуры: NaCl (каменная соль)
Элементный анализ
В таблице показано процентное содержание элементов для BaO (оксида бария).
Элемент % Ба 89,57 О 10,43 Изотопная схема BaO
На приведенной ниже диаграмме показана расчетная изотопная картина для формулы 9.0031 BaO с наиболее интенсивным ионом, установленным на 100%.
Ссылки
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.

- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Баттерворт, Великобритания, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.



Leave A Comment