Оксид магния — хим. свойства и получение CHEMEGE.RU
Оксид магния MgO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
MgCO3 = MgO + CO2
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
Mg(OH)2 = MgO + H2O
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
2MgSO4 = 2MgO + 2SO2 + O2
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
1. Оксид магния реагирует с простыми веществами:
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1. 2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами. При этом образуются соль и вода.
2.1.1. Оксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
MgO + H2O = Mg(OH)2
Понравилось это:
Нравится Загрузка..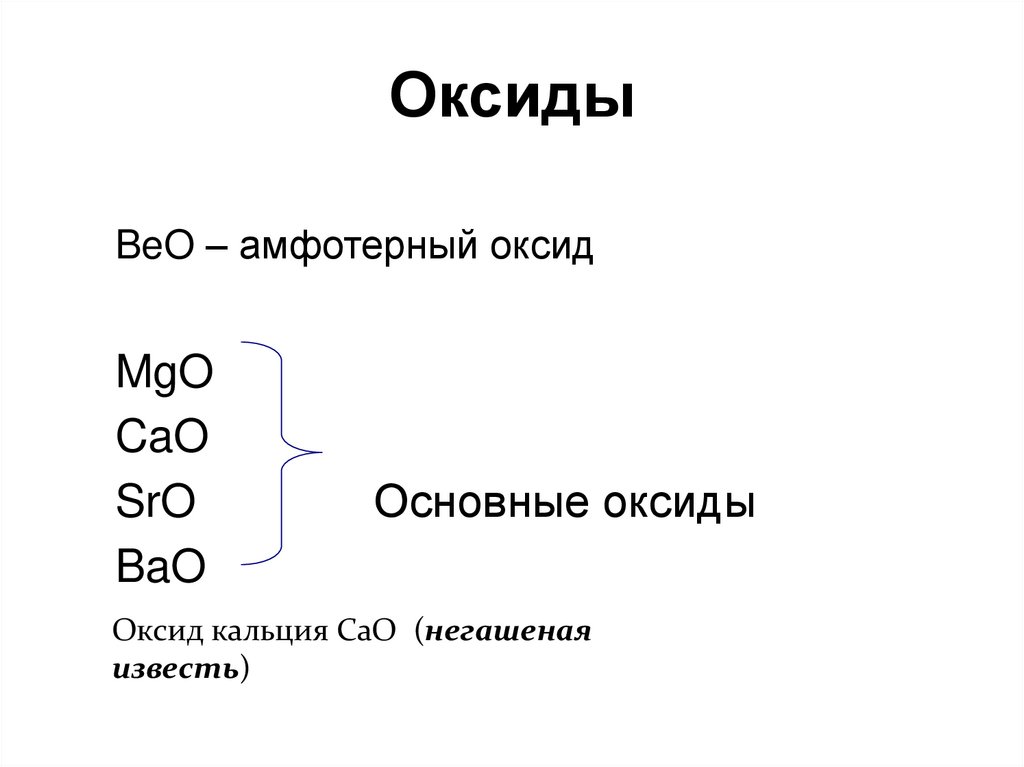 .
.
Оксид магния востребован в промышленности, пищепроме и медицине
Оксид магния — неорганическое соединение с формулой MgO. В литературе можно также встретить такие его названия как окись магния, магнезия, жженая магнезия.
Вещество встречается в естественном виде в качестве достаточно редкого минерала периклаза. В промышленном производстве MgO получают:
• обработкой природного сырья: доломита и магнезита;
• разложением сульфата магния MgSO4 при высоких температурах;
• разложением белой магнезии 3MgCO3×Mg (OH)2×3h3O или карбоната магния MgCO3.
Свойства
Внешне оксид магния — мягкое, легкое, рыхлое, мелкокристаллическое порошкообразное вещество белого или светло-серого цвета, без запаха, со слегка землистым вкусом. Очень хорошо поглощает воду, но само в воде почти не растворяется. Не растворяется в спиртах; поглощает жиры и жидкие вещества. Не слеживается, не комкуется, хорошо пересыпается, но пыли не образует. При нагревании свыше +2000 °С становится летучим.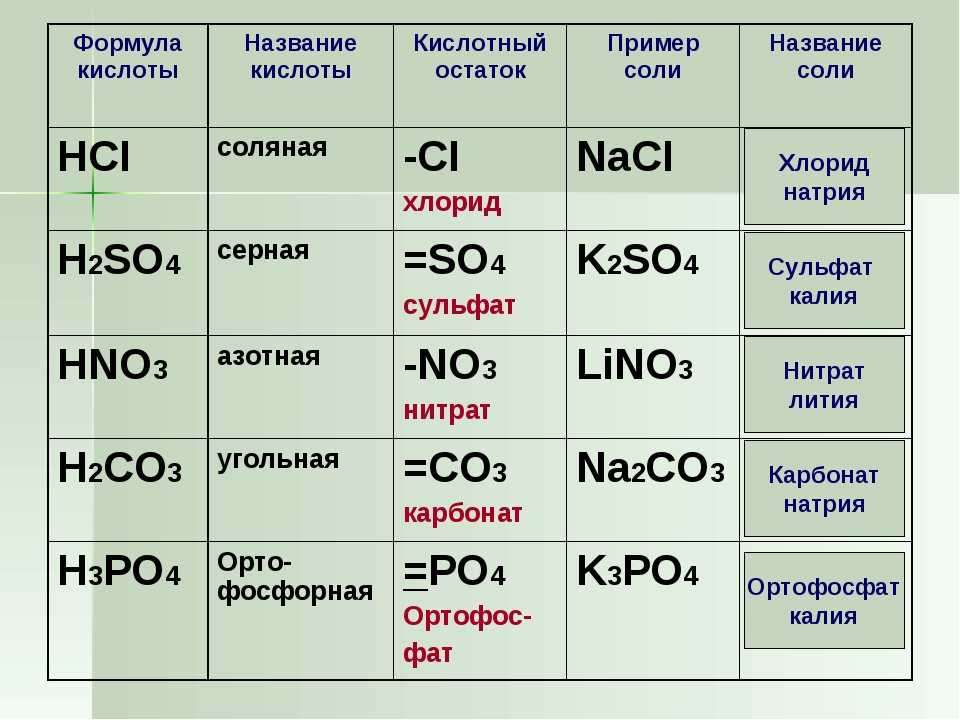 Плавится при температурах около +3000 °С. Способно гореть, не взрывается, не токсично.
Плавится при температурах около +3000 °С. Способно гореть, не взрывается, не токсично.
Тонкий рыхлый порошок хорошо поглощает влагу и углекислоту из воздуха. Активно реагирует с кислотами с образованием солей магния. В реакции с водой образует гидроксид магния Mg(OH)2. Разрушается в химических реакциях с трифторидом брома BrF3, пентахлоридом фосфора PCl5. Если магнезию прокалить, то она перестает поглощать воду и взаимодействовать с кислотами.
| Банка для реактивов 2000 мл, с делениями | Магний углекислый | Респиратор пылезащитный ЛЕПЕСТОК Л-200 до 4ПДК |
Меры предосторожности
Реактив малоксичен, но способен вызывать раздражение при прямом контакте с глазами, органами дыхания; проглатывание способно привести к расстройству работы кишечника. Возможны аллергические реакции в случае индивидуальной непереносимости.
Рабочее место для работы с оксидом магния должно располагаться в помещении с принудительной системой вентиляции. Сотрудники должны использовать маски или респираторы, очки для защиты органов дыхания и глаз, а также резиновые перчатки. На рабочем месте запрещается курить.
Сотрудники должны использовать маски или респираторы, очки для защиты органов дыхания и глаз, а также резиновые перчатки. На рабочем месте запрещается курить.
Фасуют и перевозят реагент в герметично запаянных пластиковых или многослойных бумажных мешках. Следует строго следить за целостностью упаковки, так как продукт активно поглощает влагу из окружающей среды.
Хранят магнезию на сухих, хорошо вентилируемых складах, защищающих от прямых солнечных лучей. Размещать вещество следует вдали от отопительных приборов, кислот, галогенов. В лабораториях ее хранят в герметичной стеклянной или пластиковой посуде с притертой или завинчивающейся пробкой.
Применение
Промышленность выпускает несколько видов жженой магнезии, которые отличаются своими потребительскими свойствами: весу, химической активности, способности к сорбции и т.п.
• Сорта магнезии, характеризующиеся высоким весом, используются для изготовления огнеупорных материалов.
• Среднетяжелые сорта востребованы в строительной индустрии для получения различных огнестойких стройматериалов (ксилит, бетон) и магнезиальных цементов.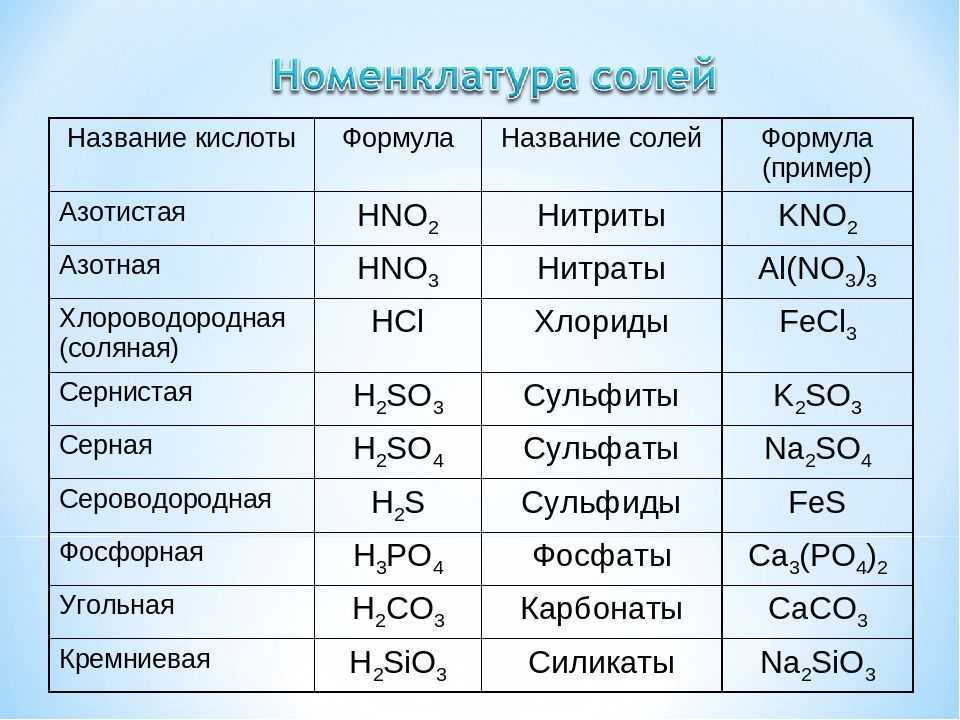
• Сорта с небольшим весом применяются в качестве сорбента для очистки производных нефти; как наполнитель в резинотехнической индустрии, наполнитель в ТЭНах.
• Легкая жженая магнезия используется в медицине для снижения кислотности желудочного сока, для стимуляции мускулатуры кишечника как слабительное средство, для профилактики образования камней в почках, при отравлениях кислотами, в качестве противовоспалительного средства при заболеваниях органов ЖКТ.
• В фармацевтике входит в состав минеральных и витаминных комплексов с магнием.
• Легкая магнезия в пищепроме — разрешенная в ЕС и РФ пищевая добавка Е530 (эмульгатор, стабилизатор). Применяется для производства сухого молока и сливок, масел и маргаринов, продуктов из шоколада и какао.
• В косметической индустрии — стабилизатор, абсорбент, буферное вещество при изготовлении пудр, румян, тальков и других сыпучих продуктов. Используется в декоративной косметике, в солнцезащитных кремах, масках для лица и волос, средствах от черных точек, шампунях, дезодорантах, детских присыпках и пр.
• Мелкодисперсионная легкая магнезия применяется на предприятиях радиоэлектроники в качестве абразива тонкой очистки.
• В спорте — противоскользящая присыпка для рук спортсменов и альпинистов.
• Используется как эталон белого цвета, обладает абсолютной отражаемостью в широком диапазоне спектра.
• Реактив входит в состав защитного слоя ЖК-экранов; используется в производстве бумаги; востребован на предприятиях переработки отходов для контроля за растворимостью радионуклидов.
• В сельском хозяйстве — антислеживающая добавка в удобрения; самостоятельное магниесодержащее удобрение и кормовая добавка для животных при недостатке магния на пастбищах.
Реакция бурения между оксидом магния и водой
оксид магния
(Источник: Wikimedia Commons)
Я часто спрашиваю об этом своих студентов, и обычно они отвечают, что они ожидают, что часть, если не весь, твердый MgO растворится с образованием прозрачного щелочного раствора.
Правда, они сделали правильно только часть щелочного раствора. Я должен отметить, что при добавлении воды к белому твердому образцу MgO нет видимых изменений не наблюдается. Реакция, без сомнения, ЕСТЬ, но ее нельзя «наблюдать» невооруженным глазом; вы узнаете, что реакция произошла, только если вы проверите рН смеси с помощью лакмусовой или рН-бумаги.
1 ——
Перед добавлением воды в пробирке находится белый твердый образец MgO.
2 ——
После добавления воды наблюдается суспензия белого твердого вещества.
Объяснение :
Твердый оксид магния реагирует с водой с образованием гидроксида магния, Mg(OH) 2 , который также представляет собой белое твердое вещество. Поскольку Mg(OH) 2 мало растворим в воде, видимых изменений не наблюдается.
MgO(s) + H 2 O( l ) → Mg(OH) 2 (s)
3 ——
При стоянии осаждается белое твердое вещество Mg(OH) 2 . Надосадочная жидкость над твердым веществом считается щелочной, когда красная лакмусовая бумажка становится синей.
Надосадочная жидкость над твердым веществом считается щелочной, когда красная лакмусовая бумажка становится синей.
(Обратите внимание, что также нет заметного изменения количества белого твердого вещества после «реакции».)
Объяснение :
Mg(OH) 2 мало растворим в воде. Таким образом, количество твердого вещества не уменьшается значительно, чтобы можно было наблюдать изменение.
Mg(OH) 2 (т) ⇌ Mg 2+
Раствор над белым твердым веществом оказался щелочным из-за присутствия очень низкой концентрации Ионы OH – , образующиеся при растворении небольшого количества Mg(OH) 2 .
Несмотря на то, что кальций находится чуть ниже магния в группе 2, интересно, что существует ОГРОМНЫЙ скачок в «наблюдаемой реакционной способности» от MgO до оксида кальция, CaO. В то время как нет видимых изменений, когда MgO реагирует с водой, CaO настолько энергично реагирует с водой, что количества выделяемого тепла достаточно, чтобы довести смесь до кипения, как демонстрирует следующее домашнее видео ниже!
Как и MgO, CaO реагирует с водой с образованием Ca(OH) 2 , который лучше растворим в воде, чем Mg(OH) 2 .
CaO(s) + H 2 O(l) → Ca(OH) 2 (s)
Ca(OH) 2 (s) → Ca 2+ (aq) + 2OH – (водный)
Таким образом, можно ожидать, что полученный раствор Ca(OH) 2 будет более щелочным, чем надосадочная жидкость над твердым Mg(OH)
Что происходит с магнием в воде с кислотой?
Задавать вопрос
спросил
Изменено 6 лет, 2 месяца назад
Просмотрено 4к раз
$\begingroup$
У меня есть кусок чистого металлического магния, погруженный в воду.
Вопрос 1: Что за покрытие?
Мне сказали, что это оксид магния. Для меня это имело бы смысл, если бы он находился на воздухе, но он погружен в воду. Это все еще MgO? Я предполагаю, что в воде достаточно свободного кислорода, чтобы реагировать медленно.
Если я добавлю в смесь кислоту, налет постепенно исчезнет. Я использую кристаллы яблочной кислоты. Куда уходит MgO?
Вопрос 2: Что находится в воде, когда налет исчезает?
По мере того, как покрытие исчезает, обнажая металл, магний реагирует все более и более энергично, выделяя водород, что, как я понимаю, оставит малат магния в воде. А как же MgO? Реагирует ли кислота с MgO? И в любом случае, куда он идет? MgO просто невидимо растворяется в воде или вступает в реакцию, образуя что-то еще? 9{2+}}$ растворяется и связывается с малатом (который в растворе депротонируется) и в конечном итоге выпадает в осадок, поскольку малат находится в высокой концентрации, а раствор насыщен.
Вы должны принять во внимание, что ионы металлов могут осаждаться в основных условиях и растворяться в кислых. Кроме того, вода обладает восстановительным потенциалом и должна учитываться в процессах коррозии металлов. Дополнительную информацию можно найти на диаграммах Пурбе, на которых можно увидеть изменения состава металлов в зависимости от pH и восстановительный потенциал некоторых металлов.
Вот диаграмма Пурбе Mg:
Надеюсь, это поможет!
$\endgroup$
$\begingroup$
- Какое покрытие?
Как указал Клаус Варцеха, оксида магния нет. Это гидроксид магния, $\ce{Mg(OH)2}$ и это покрытие.
$$\ce{Mg + h3O -> Mg(OH)2 + h3}$$
- Что находится в воде, когда исчезает налет?


Leave A Comment