Коагулирующее действие ионов
Коагулирующее действие электролита. Все электролиты вызывают коагуляцию. Вещество, коагулирующее дисперсную фазу коллоидной системы, называется коагулянтом, а ион, вызывающий этой процесс,— коагулятором.[ …]
Действие полимеров рассматривается по аналогии с действием низкбмолекулярных органических ионов, которые, как известно, не подчиняются правилу Шульце — Гарди (обратной пропорциональности дозы коагулирующего катиона его валентности в шестой степени), и их расход, необходимый для коагуляции лиофобных золей, меньше расхода неорганических ионов той же валентности.[ …]
Коагулирующее действие катионов кальция сильнее диспергирующего влияния ОН-ионов, поэтому в растворе, содержащем ионы кальция, коллоиды осаждаются даже при щелочной реакции. Магний в этом отношении занимает промежуточное место между одновалентными катионами и кальцием, но ближе стоит к последнему.[ …]
Ионное железо может существовать только при определенной кислотности. В щелочной среде железо коагулирует и выпадает в осадок, и в растворе остается ничтожное количество ионного железа. На рис. 137 приводятся данные А. Л. Минкиной по комбинированному действию ионов железа и pH на изменение веса шубункинов при обилии корма и легкой его доступности. Длительность опыта 30 дней •при 20—22°.[ …]
В щелочной среде железо коагулирует и выпадает в осадок, и в растворе остается ничтожное количество ионного железа. На рис. 137 приводятся данные А. Л. Минкиной по комбинированному действию ионов железа и pH на изменение веса шубункинов при обилии корма и легкой его доступности. Длительность опыта 30 дней •при 20—22°.[ …]
Коагулирующее действие иона коагулятора тем больше, чем больше его валентность (правило Шульце — Гарди).[ …]
Коагулирующее действие ионов при коагуляции смесью электролитов изменяется неоднозначно. Если ионы имеют одинаковый заряд и незначительно отличаются друг от друга по размеру и степени гидратации, их коагулирующее действие суммируется. Если ионы-коагуляторы отличаются по величине заряда, то коагулирующая способность иона с меньшим зарядом подавляется по-лизарядным (антагонизм ионов). Иногда суммарное воздействие превышает действие каждого из них, взятого в отдельности. Подобное явление взаимного усиления называется синергизмом. При специфической адсорбции ионов, химическом взаимодействии иона-жоагулятора с ионами двойного электрического слоя приведенные закономерности могут не всегда выполняться. [ …]
[ …]
Коагуляция под действием электролитов подчиняется правилу Шульце и Гарди, которое формулируется следующим образом: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы: коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора. Соотношение коагулирующей способности одно-, двух- и трехвалентных ионов приблизительно равно 1 : 30 :1000.[ …]
При введении в системы коагулирующих гидроокисей полиакриламида (рис. 55, а), который адсорбируется на выделяющихся из раствора частицах, экстремумы на кривых поглощения ультразвука в хлоридно-бикарбонатных растворах исчезают и сохраняются лишь ири измерениях в сульфатно-бикарбонатных растворах, подчеркивая этим сильное коагулирующее действие сульфатных ионов.[ …]
Предполагается также существование мицелл гидроокиси железа со строением, аналогичным строению мицелл гидроокиси алюминия. Электро-кинетический потенциал золей гидроокисей алюминия и железа положителен. Коагулирующими ионами, как уже отмечалось, являются анионы, причем для золей гидроокиси алюминия сильное коагулирующее действие сульфат-ионов объясняется [85] не явлением обмена ионов в двойном слое мицеллы, а выделением малорастворимых и хорошо сорбируемых основных сульфатов алюминия, область существования которых лежит в пределах pH 3—6,5. Пептизация коагелей гидроокисей происходит при понижении pH среды, что может быть достигнуто простым добавлением исходной гидролизующейся соли. Этот процесс протекает по механизму диссолюции частиц с последующим образованием истинного раствора основных солей.[ …]
Коагулирующими ионами, как уже отмечалось, являются анионы, причем для золей гидроокиси алюминия сильное коагулирующее действие сульфат-ионов объясняется [85] не явлением обмена ионов в двойном слое мицеллы, а выделением малорастворимых и хорошо сорбируемых основных сульфатов алюминия, область существования которых лежит в пределах pH 3—6,5. Пептизация коагелей гидроокисей происходит при понижении pH среды, что может быть достигнуто простым добавлением исходной гидролизующейся соли. Этот процесс протекает по механизму диссолюции частиц с последующим образованием истинного раствора основных солей.[ …]
Из строения мицелл ясно, что коагулирующим действием обладают только те ионы, заряд которых противоположен заряду частиц,— так называемые коагулирующие ионы. Для золей с отрицательно заряженными частицами коагулирующими являются катионы, для золей с положительно заряженными частицами — анионы.[ …]
С повышением кислотности среды коагулирующее действие катионов повышается, а при щелочной реакции значительно ослабевает. Коагулирующее действие одновалентных катионов оказывается слабее стабилизирующего влияния ОН-ионов, и поэтому при щелочной реакции эти катионы не могут вызвать коагуляцию почвенных коллоидов.[ …]
Коагулирующее действие одновалентных катионов оказывается слабее стабилизирующего влияния ОН-ионов, и поэтому при щелочной реакции эти катионы не могут вызвать коагуляцию почвенных коллоидов.[ …]
Реагенты, поставляющие в раствор ионы кальция и калия, — это хлористый калий, гидроокись кальция (гашеная известь), хлористый кальций и гипс. Растворы, содержащие кальций или калий в растворенном виде или в обменном комплексе глин, менее чувствительны к коагулирующему действию солей пластовых вод, способствуют уменьшению обвалов слабосвязанных глинистых пород приствольной области скважин.[ …]
По данным работ [32, 33], отклонения в действии электролитов от аддитивности в ту или иную сторону (антагонизм и синергизм) являются следствием либо взаимного электростатического влияния коагулирующих ионов в объеме раствора и в электрическом поле коллоидных частиц (для сильно заряженных золей), либо конкуренцией коагулирующих ионов за адсорбционные участки поверхности раздела. В некоторых случаях антагонизм электролитов может объясняться химическим взаимодействием ионов, в результате которого образуются комплексы с более слабым коагулирующим действием. В качестве примера такого случая приводят коагуляцию золей AgJ и AgBr солями алюминия [34].[ …]
В качестве примера такого случая приводят коагуляцию золей AgJ и AgBr солями алюминия [34].[ …]
При введении в золь электролита (коагулянта) коагулирующее действие оказывает ион, имеющий противоположный заряд: для отрицательно заряженных золей — катион, для золей с положительным зарядом частицы — анион. Наименьшая концентрация электролита, вызывающая коагуляцию, называется порогом коагуляции. Чем выше заряд коагулирующего иона, тем ниже его пороговая концентрация. Коагуляция золя происходит при достижении в растворе критической величины ¿¡-потенциала, т. е. еще до достижения системой изоэлектри-ческого состояния.[ …]
Коагуляция дисперсий может быть вызвана не только действием переменного и постоянного электрических полей, но и электрического разряда малой мощности. Снижение устойчивости частиц объясняется поляризацией ионных сфер или материала частиц.[ …]
Явление неправильных рядов может быть также объяснено действием не самих коагулирующих ионов, а продуктов их гидролиза — гидроокисей и основных солей. Действительно, в кислой среде, когда гидролиз А13+ и Fe3+ не происходит, даже весьма высокие концентрации катионов не способны вызвать перезарядку золей 131].[ …]
Действительно, в кислой среде, когда гидролиз А13+ и Fe3+ не происходит, даже весьма высокие концентрации катионов не способны вызвать перезарядку золей 131].[ …]
Высокой адсорбируемостью объясняется, например, сильное коагулирующее действие некоторых органических ионов.[ …]
Коагуляция в принципе может быть вызвана добавлением любых ионов, имеющих заряд, противоположный по знаку заряду поверхности коллоидной частицы, однако коагулирующее действие резко усиливается с увеличением валентности ионов (согласно правилу Шульце-Гарди, коагулирующая сила одно-, двух- и трехвалентных ионов находится в примерном соотношении 1:20:400). Для ионов- одной и той же валентности коагулирующее действие усиливается при увеличении радиуса ионов, например, для одновалентных ионов—от лития к цезию (Воюцкий, 1964).[ …]
Благодаря значительной окислительной способности озон оказывает действие в большей или меньшей степени на все металлы с относительно высоким значением окислительно-восстановительного потенциала (РЬ, Мп, Со и др. ), нежелательные в воде, используемой для питья. Необходимо отметить, что для каждого из металлов, присутствующих в обрабатываемой воде, характерно определенное значение pH, при котором наиболее полно осуществляется их удаление. Это обстоятельство создает определенные трудности при эксплуатации станций озонирования, требуя осуществления строгого контроля за величиной pH и дозой озона, так как при нарушении установленных режимов работы происходит накопление в воде ионов освобожденных металлов, которые могут быть токсичными (N1, Со и т. д.). Для задержания хлопьев гидроокиси металлов используются песчаные фильтры без добавления и с добавлением перед ними флокулянтов для усиления коагулирующего эффекта.[ …]
), нежелательные в воде, используемой для питья. Необходимо отметить, что для каждого из металлов, присутствующих в обрабатываемой воде, характерно определенное значение pH, при котором наиболее полно осуществляется их удаление. Это обстоятельство создает определенные трудности при эксплуатации станций озонирования, требуя осуществления строгого контроля за величиной pH и дозой озона, так как при нарушении установленных режимов работы происходит накопление в воде ионов освобожденных металлов, которые могут быть токсичными (N1, Со и т. д.). Для задержания хлопьев гидроокиси металлов используются песчаные фильтры без добавления и с добавлением перед ними флокулянтов для усиления коагулирующего эффекта.[ …]
. Таким образом, чем сильнее гидратирован ион, тем ниже его коагулирующая способность . Фрейндлихом (1926) было также показано, что коагулирующее действие органических ионов, в соответствии с ростом их адсорбируемости по правилу Траубе, растет с удалением углеводородной цепи[ .. .]
.]
Одно из объяснений явления неправильных рядов состоит в следующем. При малых количествах электролита многовалентных коагулирующих ионов недостаточно, чтобы снизить ДП и довести его значение до критического. С увеличением концентрации электролит начинает проявлять коагулирующее действие (зона /, рис. При дальнейшем росте концентрации многовалентных ионов ДП частиц сначала вновь становится выше критического (зона II), а затем уменьшается (зона III). Происходит концентрационная коагуляция золя.[ …]
Анионы алюмосиликата образуют основу отрицательно заряженной глинистой частицы, окруженной сферой положительных компенсирующих ионов водорода. При подкислении среды уменьшается степень диссоциации слабой алюмосиликатной кислоты и, следовательно, количество ионов, находящихся в диффузном слое. Глинистая взвесь коагулирует. Напротив, подщелачивание придает глинистой взвеси повышенную устойчивость. Вызвать коагуляцию можно в данном случае добавлением положительно заряженных ионов. Зависимость устойчивости дисперсной системы от величины -потенциала частиц характерна для гидрофобных коллоидов. Однако в практике очистки природных и сточных вод нередко приходится иметь дело, с коллоидами гидрофильными, которые не только менее чувствительны к добавлению электролитов, но и способны оказывать защитное действие по отношению к гидрофобным коллоидам.[ …]
Однако в практике очистки природных и сточных вод нередко приходится иметь дело, с коллоидами гидрофильными, которые не только менее чувствительны к добавлению электролитов, но и способны оказывать защитное действие по отношению к гидрофобным коллоидам.[ …]
Чтобы вызвать коагуляцию коллоидных частиц, необходимо снизить величину их дзета-потенциала до критического значения добавлением ионов, имеющих положительный заряд. Таким образом, при коагуляции происходит дестабилизация коллоидных частиц вследствие нейтрализации их электрического заряда. Эффект коагуляции зависит от валентности иона коагулянта, несущего заряд, противоположный знаку заряда частицы. Чем выше валентность, тем более эффективно коагулирующее действие.[ …]
Соли должны снижать скорость регенерации и способствовать тому, чтобы поперечное сечение нитей приобретало менее правильную форму. Действие солей обусловливается их влиянием на pH, гидратацией ионов и дегидрирующим и высаливающим воздействием, обычным для солей. При постоянной концентрации серной кислоты такие свойства нитей, как форма поперечного сечения, блеск, сродство к красителям и т. д. меняются в зависимости от концентрации сернокислого натрия. От концентрации сернокислого натрия зависит pH раствора в ванне, а от него [259] в значительной мере зависят физико-химические свойства нитей. Сернокислый цинк влияет на коагуляцию и свойства нитей больше, чем сернокислый натрий. Данилов и Гинце [260] установили, что четыре соли, обычно используемые в прядильных ваннах, можно расположить в следующем порядке, исходя из их возрастающего влияния на замедление скорости разложения и возрастающей способности коагулировать: сернокислый натрий, сернокислый магний, сернокислый аммоний, сернокислый цинк. Суммарная активность этих солей почти всегда превышает активность отдельно взятых солей.[ …]
При постоянной концентрации серной кислоты такие свойства нитей, как форма поперечного сечения, блеск, сродство к красителям и т. д. меняются в зависимости от концентрации сернокислого натрия. От концентрации сернокислого натрия зависит pH раствора в ванне, а от него [259] в значительной мере зависят физико-химические свойства нитей. Сернокислый цинк влияет на коагуляцию и свойства нитей больше, чем сернокислый натрий. Данилов и Гинце [260] установили, что четыре соли, обычно используемые в прядильных ваннах, можно расположить в следующем порядке, исходя из их возрастающего влияния на замедление скорости разложения и возрастающей способности коагулировать: сернокислый натрий, сернокислый магний, сернокислый аммоний, сернокислый цинк. Суммарная активность этих солей почти всегда превышает активность отдельно взятых солей.[ …]
Гумусовые вещества коллоидной степени дисперсности представляют собой переходные системы от гидрофобных к гидрофильным. О их гидрофобности свидетельствует относительная »легкость коагуляции и влияние валентности коагулирующих ионов на этот процесс. Тем не менее малая чувствительность этих коллоидов к содержанию в воде нейтральных электролитов, значительные количества воды в выпавших осадках гумусовых веществ, проявление защитного действия по отношению к высокодисперсным глинистым и почвенным суспензиям, коллоидной кремнекислоте, золям гидроокиси железа и алюминия свидетельствуют о наличии у гумусовых веществ свойств, присущих гидрофильным коллоидам.[ …]
Тем не менее малая чувствительность этих коллоидов к содержанию в воде нейтральных электролитов, значительные количества воды в выпавших осадках гумусовых веществ, проявление защитного действия по отношению к высокодисперсным глинистым и почвенным суспензиям, коллоидной кремнекислоте, золям гидроокиси железа и алюминия свидетельствуют о наличии у гумусовых веществ свойств, присущих гидрофильным коллоидам.[ …]
Фосфаты активно сорбируются поглощающим комплексом дисперсных грунтов и почв. Сорбция полифосфатов и метафосфатов на глинистых частицах приводит к росту заряда частиц и сопровождается пептизацией1 [4]. Пептизирующее действие фосфатов может быть объяснено связыванием ими катионов многовалентных металлов, выступающих в роли коагулирующих ионов для отрицательно заряженных глинистых частиц грунтов.[ …]
Наложение переменного тока на постоянный позволяет осуществить кратковременную катодную поляризацию анодов вместо более широко используемого отключения. При этом окисная пленка, образующаяся, во время анодной поляризации, разрушается под действием выделяющегося в ввде пузырьков водорода. Кроме того, при гидродинамическом режиме характеризуемом йе =2000 500, обеспечивается получение коагулянта в виде ионов с максимальным относительным зарядом (АС3 , А СОН2 ) г обладающих .наивысшей коагулирующей способностью.[ …]
Кроме того, при гидродинамическом режиме характеризуемом йе =2000 500, обеспечивается получение коагулянта в виде ионов с максимальным относительным зарядом (АС3 , А СОН2 ) г обладающих .наивысшей коагулирующей способностью.[ …]
В работах, посвященных изучению очистки природных вод от взвешенных и окрашенных веществ, основное внимание уделялось выяснению оптимальных областей pH, в которых происходит быстрое образование и осаждение хлопьев гидроокисей алюминия и железа. По очень важному вопросу влияния ионного состава природных вод на кинетику коагуляции этих гидроокисей в момент их образования при гидролизе, а также на структуру и свойства выделяющихся коагулятов в литературе имеется мало сведений. Миллер в нескольких работах [85] отмечает сильное коагулирующее действие сульфатных ионов. Специфическое рыхлое строение быстрооседающих хлопьев гидроокиси алюминия, образующихся из хлористого и азотнокислого алюминия, описано Лебедевой [91]. Кульский, Когановский и Шевченко [86], исследуя электролитную коагуляцию на разбавленных диализированных золях гидроокисей алюминия и железа, показали, что максимальная скорость коагуляции обусловливается следующими пороговыми концентрациями анионов в растворе: С1 — 0,07-н. , ОН-—1,0—0,3-н., НС103 — 0,005-н., 3042-—0,001—0,002-н; в природных водах концентрации этих ионов, за исключением НС03 , значительно ниже.[ …]
, ОН-—1,0—0,3-н., НС103 — 0,005-н., 3042-—0,001—0,002-н; в природных водах концентрации этих ионов, за исключением НС03 , значительно ниже.[ …]
Особо остановимся на флокуляции дисперсий неионными ВМС при введении реагента по методу двойной добавки. В этих условиях флокуляция — как это показано на примере золей Au и Agi, содержащих ПВС и ПЭО [129, 130],— наступает лишь при достижении определенной концентрации электролита в системе (рис. 5.7). Эта концентрация тем меньше, чем выше заряд коагулирующего иона. Влияние электролитов на флокуляцию можно объяснить тем, что при низком содержании соли в системе радиус действия электрических сил отталкивания (характеризуемый толщиной дебаевской атмосферы х”1) может превосходить толщину полимерной оболочки Д; этот барьер мешает подойти частицам на расстояния, где начинают проявляться силы притяжения, обусловленные мостико-образованием. С ростом концентрации электролита в результате сжатия двойного слоя (ДЭС) и снижения -потенциала высота этого барьера снижается и смещается на расстояние меньше А; при этом создаются условия для беспрепятственного сближения частиц и их взаимодействия через адсорбированный полимер, что и ведет к флокуляции золя. Дальнейшее прибавление электролита уже не влияет на этот процесс, поскольку число эффективных столкновений частиц будет определяться только их броуновским движением, а скорость флокуляции — скоростью образования адсорбционной связи. Иначе говоря, возможность флокуляции дисперсий ВМС определяется соотношением эффективных толщин полимерного.и двойного электрического слоев [10]. При х >А флокуляция невозможна, что и отражается на начальных участках кривых N (Сзл) (см. рис. 5.7). Приведенные качественные соображения были подтверждены теоретическими расчетами устойчивости золей Au и Agi по ДЛФО.[ …]
Дальнейшее прибавление электролита уже не влияет на этот процесс, поскольку число эффективных столкновений частиц будет определяться только их броуновским движением, а скорость флокуляции — скоростью образования адсорбционной связи. Иначе говоря, возможность флокуляции дисперсий ВМС определяется соотношением эффективных толщин полимерного.и двойного электрического слоев [10]. При х >А флокуляция невозможна, что и отражается на начальных участках кривых N (Сзл) (см. рис. 5.7). Приведенные качественные соображения были подтверждены теоретическими расчетами устойчивости золей Au и Agi по ДЛФО.[ …]
Применение метода коагулирования наиболее эффективно для удаления из воды коллоидно-дисперсных частиц, т. е. частиц с очень маленькими размерами. Для коллоидных растворов характерно присутствие на поверхности частиц электрического заряда, образующегося в результате адсорбции или диссоциации. Наличие заряда предохраняет частицы от слипания друг с другом под действием сил межмолекулярного притяжения и обусловливает относительную устойчивость коллоидных растворов. Нейтрализация поверхностного заряда (или, точнее, снижение так называемого электрокинетического потенциала) может быть достигнута добавлением электролитов, содержащих ионы с противоположным по знаку зарядом. Коагулирующее действие таких ионов тем сильнее выражено, чем выше их валентность.[ …]
Нейтрализация поверхностного заряда (или, точнее, снижение так называемого электрокинетического потенциала) может быть достигнута добавлением электролитов, содержащих ионы с противоположным по знаку зарядом. Коагулирующее действие таких ионов тем сильнее выражено, чем выше их валентность.[ …]
Основным условием для получения стабильной водной суспензии ультрамарина является отсутствие в воде растворенных электролитов. Степень коагуляции зависит от концентрации электролита в растворе. Поэтому при промывке полуфабриката нужно стремиться, как это было указано выше, к возможно более полному удалению солей. Чем больше в воде остается растворенных солей, тем сильнее коагулирует суспензия. При содержании в суспензии Ма2504 больше, чем 1,5—2 г/л, процесс фракционирования ультрамарина удовлетворительно провести уже не удается. Частицы ультрамарина в водной суспензии заряжены отрицательно, и поэтому доминирующим ионом, обусловливающим коагуляцию, является катион. Чем больше валентность катиона, тем сильнее его коагулирующее действие. [ …]
[ …]
При соответствующих количествах полисахарида и осадителя образующийся комплекс выпадает немедленно при смешении растворов. При добавлении избытка осадителя образуется гидрофобная коллоидная суспензия, которая в отсутствии других электролитов не отделяется центрифугированием от раствора. Частички комплекса имеют положительный заряд вследствие адсорбции небольшого количества положительных ионов аммониевого основания. Добавление одновалентных электролитов, как KCl, NaCl, приводит к коагуляции суспензии через час (процесс ускоряется нагреванием). Двухвалентные катионы (Mg++, Са++) в присутствии одновалентных анионов оказывают стабилизирующее действие и не коагулируют суспензию даже при нагреван ии. Двухвалентные анионы обладают сильным коагулирующим действи ем. При добавке небольшого количества NaaSOi происходит коагуляция солей при комнатной температуре через несколько мин[ …]
Магнитная обработка воды и щелочных пульп ускоряет фильтрацию не только потому, что понижает карбонизацию фильтроткани в связи со сдвигом углекислотного равновесия и повышает долю карбонатов, выделяющихся в неустойчивой форме (арагонит), благодаря чему последние не могут выполнять роль цементирующей связки [116], ной по причине изменения состояния поверхностей раздела твердая частица — раствор. В связи с этим определенное влияние на фильтрацию оказывают адсорбированные поверхностью твердых частиц коагулянты и другие вещества. Уменьшая электрокинетический потенциал и вытесняя ионы с поверхности твердых частиц, эти вещества, особенно органические коагулянты, уменьшают количество связанной с частицами воды, вследствие чего сечение капилляров (каналов) между частицами увеличивается. Подобное воздействие оказывает и магнитная обработка, уменьшая количество связанной воды, поэтому воздействие магнитных полей усиливает действие коагулирующих добавок и при совместном воздействии процессы фильтрации протекают значительно быстрее.[ …]
В связи с этим определенное влияние на фильтрацию оказывают адсорбированные поверхностью твердых частиц коагулянты и другие вещества. Уменьшая электрокинетический потенциал и вытесняя ионы с поверхности твердых частиц, эти вещества, особенно органические коагулянты, уменьшают количество связанной с частицами воды, вследствие чего сечение капилляров (каналов) между частицами увеличивается. Подобное воздействие оказывает и магнитная обработка, уменьшая количество связанной воды, поэтому воздействие магнитных полей усиливает действие коагулирующих добавок и при совместном воздействии процессы фильтрации протекают значительно быстрее.[ …]
Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
Регистрация на «Что? Где? Когда?»
Регистрация на конференцию «Транспорт в интеграционных процессах мировой экономики» (до 30 марта)
Регистрация на конференцию «Композиты в машиностроении и транспорте» (до 5 апреля)
Как поступить в БелГУТ
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 | 2 Дата : 2023-03-02 | 3 Дата : 2023-03-03 | 4 Дата : 2023-03-04 | 5 | ||
6 Дата : 2023-03-06 | 7 | 8 | 9 | 10 | 11 Дата : 2023-03-11 | 12 |
13 Дата : 2023-03-13 | 14 | 15 Дата : 2023-03-15 | 16 Дата : 2023-03-16 | 17 | 18 | 19 |
20 | 21 | 22 Дата : 2023-03-22 | 23 Дата : 2023-03-23 | 24 | 25 Дата : 2023-03-25 | 26 |
27 | 28 Дата : 2023-03-28 | 29 | 30 Дата : 2023-03-30 | 31 Дата : 2023-03-31 | ||
Все анонсы
- Послание Президента Беларуси Александра Лукашенко .
 ..
.. - Неделя русского языка
- Запись ДОНОРОВ на 26 апреля 2023 и 27 апреля 2023…
- Новое расписание звонков
- III Международная научно-методологическая конферен…
- Выставка-конкурс «Пасхальная фантазия»…
- IX Научная баталия «О науке с юмором»…
- 2 тур весенней серии игр «ЧТО? ГДЕ? КОГДА?» среди …
- Сбер Банк ответит на вопросы…
- Об изменении начала учебных занятий…
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
Послание Президента Беларуси Александра Лукашенко …
Неделя русского языка
Запись ДОНОРОВ на 26 апреля 2023 и 27 апреля 2023…
Новое расписание звонков
Новости
Университет
Международные связи
Спорт
ИВР
Жизнь студентов
Новости подразделений
- Университет
Визит начальника управления военного образования Вооруженных Сил. ..
..
30 марта 2023
- Спорт
Борьба греко-римская. 70-я спартакиада студентов…
29 марта 2023
- Университет
Открытие III международной научно-практической конференции «Водоснаб…
- Университет
Новый номер газеты «Вести БелГУТа»
29 марта 2023
- Воспитательная работа
Строил дома в двух государствах
28 марта 2023
- Университет
XXXII университетская олимпиада по сопротивлению материалов…
28 марта 2023
- Воспитательная работа
Неделя психологии в БелГУТе
28 марта 2023
- Спорт
70-я спартакиада студентов. Волейбол
Волейбол
27 марта 2023
- Университет
25 марта — День открытых дверей БелГУТа
26 марта 2023
Другие новости
- VIII Открытый межвузовский творческий фестиваль дружбы…
- Управление и диагностика – фундамент безопасности перевозочного процес…
- Встреча с Министром транспорта и коммуникаций…
- Где логика?
- Семинар-совещание «Техническое регулирование. Оценка соответствия. Кач…
- Никто не забыт и ничто не забыто…
- III Конгресс свободных экономических зон…
- Встреча с учащимися Мозырского государственного политехнического колле…
- Серебро в спартакиаде по быстрым шахматам г. Гомеля…
- Повышаем квалификацию
- Итоги олимпиады на знание экономики и управления в организациях трансп…
БелГУТ на Доске почета
Достижения университета
КУДА ПОСТУПАТЬ
Все факультеты
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
Ионы и ионные соединения | Введение в химию
Цели обучения
- Знать, как образуются ионы.

- Изучите характерные заряды ионов.
- Придумайте правильную формулу для ионного соединения.
- Придумайте собственное имя для ионного соединения.
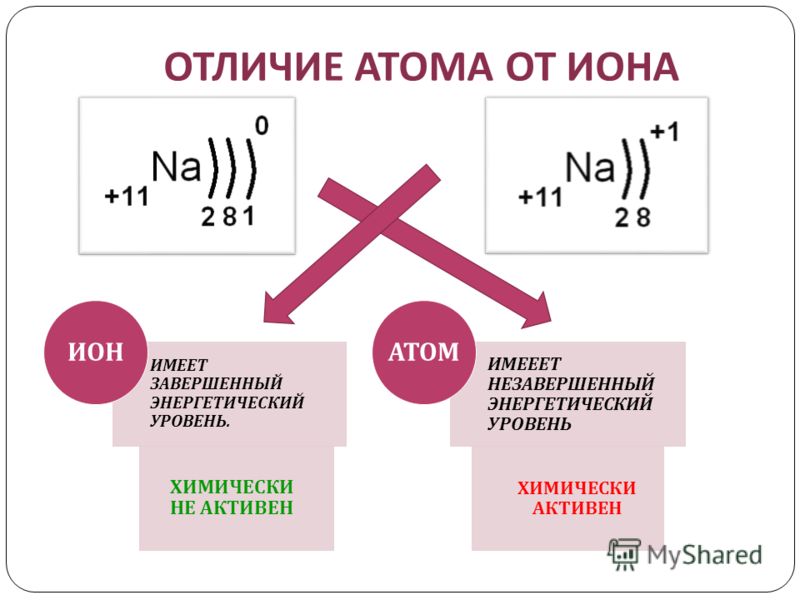
До сих пор мы обсуждали элементы и соединения, которые электрически нейтральны. У них такое же количество электронов, как и у протонов, поэтому отрицательные заряды электронов уравновешиваются положительными зарядами протонов. Тем не менее, это не всегда так. Электроны могут переходить от одного атома к другому; когда они это делают, образуются виды с общим электрическим зарядом. Такие частицы называются ионами. Вещества с общим положительным зарядом называются катионами, а соединения с общим отрицательным зарядом называются анионами. Помните, что ионы образуются только тогда, когда электронов переходят от одного атома к другому; протон никогда не переходит от одного атома к другому. Соединения, образованные положительными и отрицательными ионами, называются ионными соединениями.
Отдельные атомы могут приобретать или терять электроны. Когда они это сделают, они станут одноатомными ионами. Когда атомы приобретают или теряют электроны, они обычно приобретают или теряют характерное число электронов и, таким образом, приобретают характерный общий заряд. В таблице 3.6 «Одноатомные ионы с различными зарядами» перечислены некоторые распространенные ионы с точки зрения того, сколько электронов они теряют (образуя катионы) или приобретают (образуя анионы). В таблице 3.6 «Одноатомные ионы с различными зарядами» следует отметить несколько особенностей ионов. Во-первых, каждый элемент, образующий катионы, является металлом, за исключением одного (водорода), а каждый элемент, образующий анионы, является неметаллом. На самом деле это одно из химических свойств металлов и неметаллов: металлы склонны образовывать катионы, а неметаллы склонны образовывать анионы. Во-вторых, большинство атомов образуют ионы с одним характеристическим зарядом. Когда атомы натрия образуют ионы, они всегда образуют заряд 1+, а не заряд 2+, 3+ или даже 1–.
Когда они это сделают, они станут одноатомными ионами. Когда атомы приобретают или теряют электроны, они обычно приобретают или теряют характерное число электронов и, таким образом, приобретают характерный общий заряд. В таблице 3.6 «Одноатомные ионы с различными зарядами» перечислены некоторые распространенные ионы с точки зрения того, сколько электронов они теряют (образуя катионы) или приобретают (образуя анионы). В таблице 3.6 «Одноатомные ионы с различными зарядами» следует отметить несколько особенностей ионов. Во-первых, каждый элемент, образующий катионы, является металлом, за исключением одного (водорода), а каждый элемент, образующий анионы, является неметаллом. На самом деле это одно из химических свойств металлов и неметаллов: металлы склонны образовывать катионы, а неметаллы склонны образовывать анионы. Во-вторых, большинство атомов образуют ионы с одним характеристическим зарядом. Когда атомы натрия образуют ионы, они всегда образуют заряд 1+, а не заряд 2+, 3+ или даже 1–.
 ст. 2+
ст. 2+ В-третьих, есть некоторые исключения из предыдущего пункта.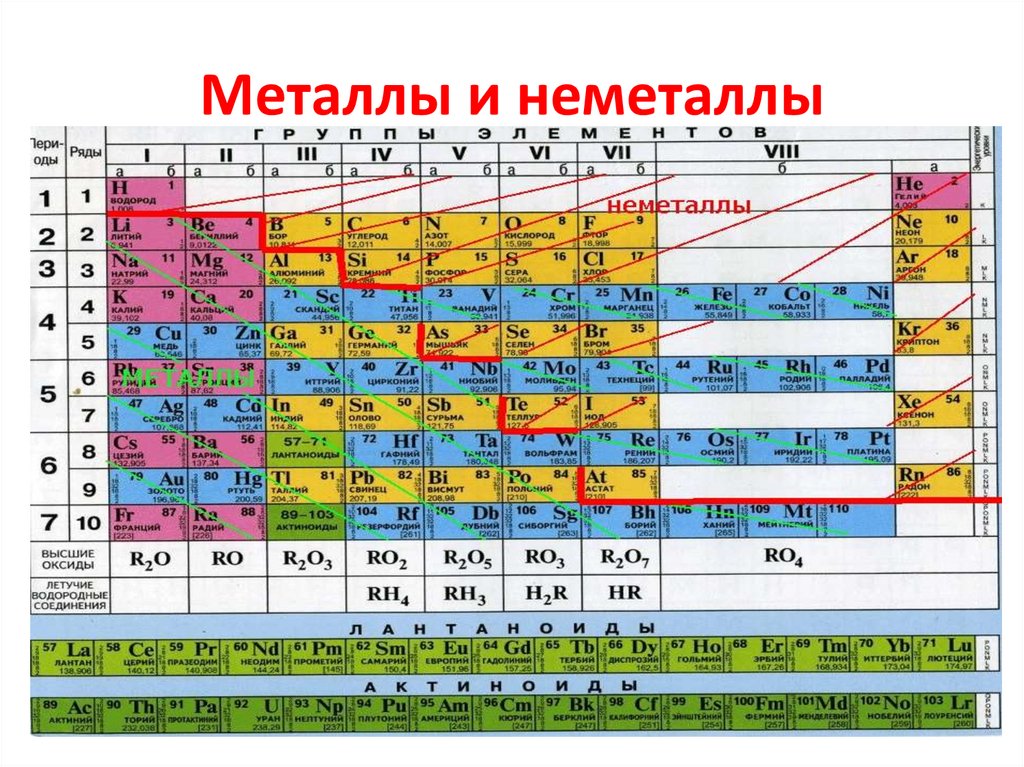 Несколько элементов, все металлы, могут образовывать более одного возможного заряда. Например, атомы железа могут образовывать 2+ катиона или 3+ катиона. Кобальт — еще один элемент, который может образовывать более одного возможного заряженного иона (2+ и 3+), а свинец может образовывать катионы 2+ или 4+. К сожалению, мало кто понимает, какие два заряда может иметь атом металла, поэтому лучше всего просто запомнить возможные заряды, которые может иметь тот или иной элемент.
Несколько элементов, все металлы, могут образовывать более одного возможного заряда. Например, атомы железа могут образовывать 2+ катиона или 3+ катиона. Кобальт — еще один элемент, который может образовывать более одного возможного заряженного иона (2+ и 3+), а свинец может образовывать катионы 2+ или 4+. К сожалению, мало кто понимает, какие два заряда может иметь атом металла, поэтому лучше всего просто запомнить возможные заряды, которые может иметь тот или иной элемент.
Обратите внимание на условное обозначение иона. Величина заряда указана в правом надстрочном индексе рядом с символом элемента. Если заряд единичный положительный или отрицательный, цифра 1 не пишется; если величина заряда больше 1, то число записывается как перед знаком + или -. Символ элемента без заряда, написанный рядом с ним, считается незаряженным атомом.
Назвать ион несложно. Для катиона просто используйте название элемента и добавьте слово ion (или, если вы хотите быть более конкретным, добавьте катион ) после имени элемента. Итак, Na + — это ион натрия; Ca 2+ представляет собой ион кальция. Если элемент имеет более одного возможного заряда, значение заряда указывается после имени элемента и перед словом ion . Таким образом, Fe 2+ представляет собой два иона железа, а Fe 3+ представляет собой три иона железа. В печати мы используем римские цифры в скобках для обозначения заряда иона, поэтому эти два иона железа будут представлены как катион железа (II) и катион железа (III) соответственно.
Итак, Na + — это ион натрия; Ca 2+ представляет собой ион кальция. Если элемент имеет более одного возможного заряда, значение заряда указывается после имени элемента и перед словом ion . Таким образом, Fe 2+ представляет собой два иона железа, а Fe 3+ представляет собой три иона железа. В печати мы используем римские цифры в скобках для обозначения заряда иона, поэтому эти два иона железа будут представлены как катион железа (II) и катион железа (III) соответственно.
Для одноатомного аниона используйте основу имени элемента и добавьте к нему суффикс -ide , а затем добавьте ion . Это похоже на то, как мы назвали молекулярные соединения. Так, Cl — является хлорид-ионом, а N 3- — нитрид-ионом.
Пример 6
Назовите каждый вид.
- О 2-
- Ко
- Со 2+
Решение
- Этот вид имеет заряд 2−, поэтому это анион.
 Анионы называются по основе названия элемента с суффиксом 9.0015 -ide добавлен. Это оксид-анион.
Анионы называются по основе названия элемента с суффиксом 9.0015 -ide добавлен. Это оксид-анион. - Поскольку этот вид не имеет заряда, в своей элементарной форме он представляет собой атом. Это кобальт.
- В этом случае атом имеет заряд 2+, поэтому это катион. Из таблицы 3.6 «Одноатомные ионы различных зарядов» мы отмечаем, что катионы кобальта могут иметь два возможных заряда, поэтому название иона должно указывать, какой заряд имеет ион. Это катион кобальта(II).
Проверь себя
Назови каждый вид.
- Р 3-
- Ср 2+
Ответы
- анион фосфида
- катион стронция
Химические формулы ионных соединений называются ионными формулами. В правильной ионной формуле есть катион и анион; ионное соединение никогда не образуется только между двумя катионами или только двумя анионами. Ключ к написанию правильных ионных формул прост: общий положительный заряд должен уравновешивать общий отрицательный заряд. Поскольку заряды ионов носят характерный характер, иногда нам приходится иметь более одного катиона или аниона, чтобы сбалансировать общие положительные и отрицательные заряды. Обычно используют наименьшее соотношение ионов, необходимое для балансировки зарядов.
Поскольку заряды ионов носят характерный характер, иногда нам приходится иметь более одного катиона или аниона, чтобы сбалансировать общие положительные и отрицательные заряды. Обычно используют наименьшее соотношение ионов, необходимое для балансировки зарядов.
Например, рассмотрим ионное соединение между Na + и Cl — . Каждый ион имеет один заряд, один положительный и один отрицательный, поэтому нам нужен только один ион каждого из них, чтобы сбалансировать общий заряд. При написании ионной формулы мы следуем двум дополнительным соглашениям: (1) сначала пишем формулу катиона, а затем формулу аниона, но (2) не пишем заряды ионов. Таким образом, для соединения между Na + и Cl − мы имеем ионную формулу NaCl (рис. 3.5 «NaCl = поваренная соль»). Формула Na 2 Cl 2 также имеет сбалансированные заряды, но принято использовать наименьшее соотношение ионов, которое должно быть по одному на каждый. (Помните из наших правил написания формул, что мы не пишем индекс 1, если присутствует только один атом определенного элемента. ) Для ионного соединения между катионами магния (Mg 2+ ) и анионами оксида (O 2−), опять же, нам нужен только один ион каждого типа, чтобы сбалансировать заряды. По соглашению формула MgO.
) Для ионного соединения между катионами магния (Mg 2+ ) и анионами оксида (O 2−), опять же, нам нужен только один ион каждого типа, чтобы сбалансировать заряды. По соглашению формула MgO.
Рисунок 3.5 NaCl = поваренная соль
Ионное соединение NaCl очень распространено.
Источник: «Кошерная соль» от stlbites.com находится под лицензией Creative Commons Attribution-NoDerivs 2.0 Generic.
Для ионного соединения между ионами Mg 2+ и ионами Cl − мы теперь учитываем тот факт, что заряды имеют разные величины: 2+ на ионе магния и 1– на ионе хлорида. Чтобы сбалансировать заряды с наименьшим возможным количеством ионов, нам нужно иметь два иона хлорида, чтобы сбалансировать заряд одного иона магния. Вместо того, чтобы писать формулу MgClCl, мы объединяем два иона хлорида и записываем ее с индексом 2: MgCl 2 .
О чем говорит нам формула MgCl 2 ? В формуле два иона хлора. Хотя хлор как элемент представляет собой двухатомную молекулу Cl 2 , элементарный хлор не является частью этого ионного соединения. Хлор находится в форме отрицательно заряженного иона , а не нейтрального элемента . Нижний индекс 2 стоит в ионной формуле, потому что нам нужны два иона Cl — , чтобы сбалансировать заряд одного иона Mg 2+ .
Хлор находится в форме отрицательно заряженного иона , а не нейтрального элемента . Нижний индекс 2 стоит в ионной формуле, потому что нам нужны два иона Cl — , чтобы сбалансировать заряд одного иона Mg 2+ .
Пример 7
Напишите соответствующую ионную формулу для каждого из двух данных ионов.
- Ca 2+ и Cl −
- Al 3+ и F −
- Al 3+ и O 2−
Раствор
- Нам нужны два иона Cl − , чтобы сбалансировать заряд одного иона Ca 2+ , поэтому правильная ионная формула CaCl 2 .
- Нам нужно три иона F − , чтобы сбалансировать заряд Al 3+ ион, поэтому правильная ионная формула AlF 3 .
- С Al 3+ и O 2− обратите внимание, что ни один заряд не является кратным другому. Это означает, что мы должны найти наименьшее общее кратное, которое в данном случае будет равно шести.
 Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 .
Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 .
Проверь себя
Напишите правильные ионные формулы для каждого из двух данных ионов.
- Fe 2+ и S 2−
- Fe 3+ и S 2−
Ответы
- FeS
- Fe 2 С 3
Назвать ионные соединения просто: соедините название катиона и название аниона, в обоих случаях опуская слово ион . Не используйте числовые префиксы, если для балансировки зарядов необходимо более одного иона. NaCl — хлорид натрия, сочетание названия катиона (натрий) и аниона (хлорид). MgO — оксид магния. MgCl 2 представляет собой хлорид магния — , а не дихлорид магния.
При наименовании ионных соединений, катионы которых могут иметь более одного возможного заряда, мы должны также включать заряд в скобках и римскими цифрами как часть названия. Следовательно, FeS представляет собой сульфид железа (II), а Fe 2 S 3 представляет собой сульфид железа (III). Опять же, в имени нет числовых префиксов. Количество ионов в формуле продиктовано необходимостью уравновешивания положительных и отрицательных зарядов.
Следовательно, FeS представляет собой сульфид железа (II), а Fe 2 S 3 представляет собой сульфид железа (III). Опять же, в имени нет числовых префиксов. Количество ионов в формуле продиктовано необходимостью уравновешивания положительных и отрицательных зарядов.
Пример 8
Назовите каждое ионное соединение.
- CaCl 2
- Альф 3
- Со 2 О 3
Раствор
- Используя названия ионов, это ионное соединение называется хлоридом кальция. Это не хлорид кальция (II) , потому что кальций образует только один катион, когда он образует ион, и имеет характерный заряд 2+.
- Название этого ионного соединения — фторид алюминия.
- Мы знаем, что кобальт может иметь более одного возможного заряда; нам просто нужно определить, что это такое. Оксид всегда имеет заряд 2-, поэтому с тремя ионами оксида у нас есть общий отрицательный заряд 6-.
 Это означает, что два иона кобальта должны вносить 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Поэтому правильное название этого ионного соединения — оксид кобальта (III).
Это означает, что два иона кобальта должны вносить 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Поэтому правильное название этого ионного соединения — оксид кобальта (III).
Проверьте себя
Назовите каждое ионное соединение.
- Ск 2 О 3
- AgCl
Ответы
- оксид скандия
- хлорид серебра
Как узнать, относится ли формула — и, соответственно, название — к молекулярному соединению или к ионному соединению? Молекулярные соединения образуются между неметаллами и неметаллами, а ионные соединения образуются между металлами и неметаллами. Периодическую таблицу (рис. 3.2 «Простая периодическая таблица») можно использовать для определения того, какие элементы являются металлами, а какие неметаллами.
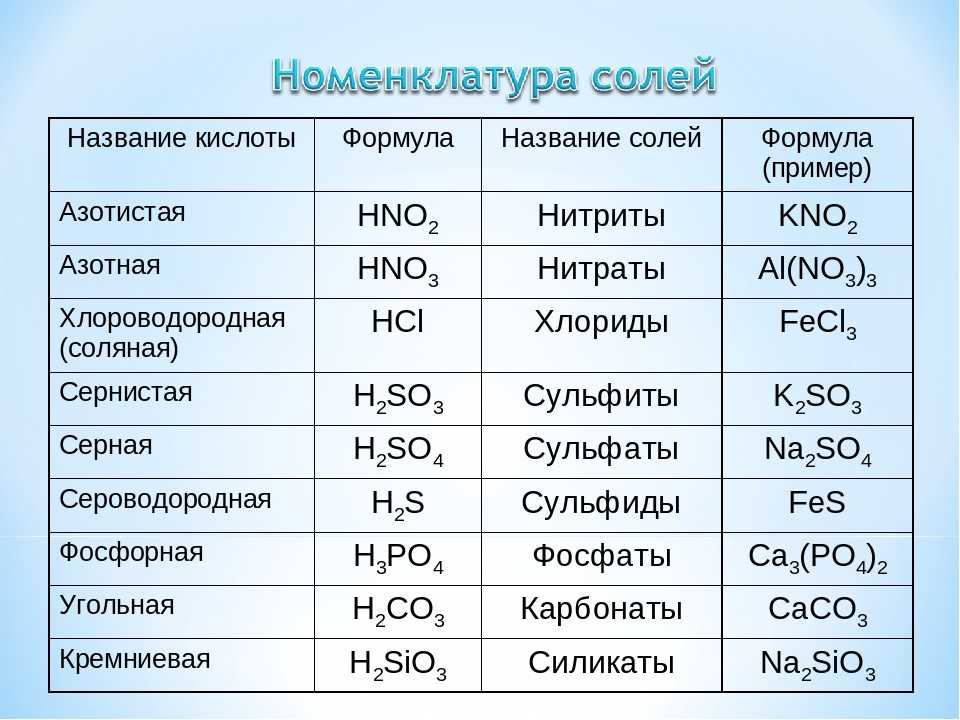
Также существует группа ионов, которые содержат более одного атома. Их называют многоатомными ионами. В Таблице 3.7 «Обычные многоатомные ионы» перечислены формулы, заряды и названия некоторых распространенных многоатомных ионов. Только один из них, ион аммония, является катионом; остальные — анионы. Большинство из них также содержат атомы кислорода, поэтому иногда их называют оксианионами . Некоторые из них, такие как нитраты и нитриты, а также сульфаты и сульфиты, имеют очень похожие формулы и названия, поэтому необходимо соблюдать осторожность, чтобы формулы и названия были правильными. Обратите внимание, что многоатомный ион -ite имеет в своей формуле на один атом кислорода меньше, чем -ate-ион, но с тем же ионным зарядом.
Только один из них, ион аммония, является катионом; остальные — анионы. Большинство из них также содержат атомы кислорода, поэтому иногда их называют оксианионами . Некоторые из них, такие как нитраты и нитриты, а также сульфаты и сульфиты, имеют очень похожие формулы и названия, поэтому необходимо соблюдать осторожность, чтобы формулы и названия были правильными. Обратите внимание, что многоатомный ион -ite имеет в своей формуле на один атом кислорода меньше, чем -ate-ион, но с тем же ионным зарядом.
Таблица 3.7 Общие многоатомные ионы
| Название | Формула и заправка | Имя | Формула и заправка | |
|---|---|---|---|---|
| аммоний | НХ 4 + | гидроксид | ОХ − | |
| ацетат | C 2 H 3 O 2 − или CH 3 COO − | нитрат | НЕТ 3 − | |
| бикарбонат (гидрокарбонат) | ОХС 3 − | нитрит | НЕТ 2 − | |
| бисульфат (сульфат водорода) | ХСО 4 − | пероксид | О 2 2− | |
| карбонат | СО 3 2− | перхлорат | ClO 4 − | |
| хлорат | ClO 3 − | фосфат | ЗП 4 3- | |
| хромат | CrO 4 2− | сульфат | СО 4 2− | |
| цианид | CN − | сульфит | СО 3 2- | |
| дихромат | Cr 2 O 7 2− | трийодид | I 3 − |
Наименования ионных соединений, содержащих многоатомные ионы, следуют тем же правилам, что и наименования других ионных соединений: просто объедините название катиона и название аниона. Не используйте числовые префиксы в названии, если имеется более одного многоатомного иона; единственным исключением является случай, когда название самого иона содержит числовой префикс, например дихромат или трийодид.
Не используйте числовые префиксы в названии, если имеется более одного многоатомного иона; единственным исключением является случай, когда название самого иона содержит числовой префикс, например дихромат или трийодид.
Написание формул ионных соединений имеет одно важное отличие. Если для уравновешивания общего заряда в формуле требуется более одного многоатомного иона, заключите формулу многоатомного иона в круглые скобки и напишите соответствующий числовой индекс справа и вне круглых скобок. Таким образом, формула между ионами кальция Ca 2+ и ионами нитрата NO 3 − правильно записывается Ca(NO 3 ) 2 , а не CaNO 32 или CaN 2 O 6 . Используйте скобки там, где это необходимо. Название этого ионного соединения просто нитрат кальция.
Пример 9
Напишите соответствующую формулу и дайте собственное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и S 2−
- Al 3+ и ПО 4 3−
- Fe 2+ и ПО 4 3−
Решение
- Поскольку ион аммония имеет заряд 1+, а ион сульфида — заряд 2–, нам нужны два иона аммония, чтобы сбалансировать заряд одного сульфид-иона. Заключив формулу иона аммония в скобки, мы получим (NH 4 ) 2 S. Название соединения — сульфид аммония.
- Поскольку ионы имеют одинаковую величину заряда, нам нужен только один из них, чтобы сбалансировать заряды. Формула — AlPO 4 , а название соединения — фосфат алюминия.
- Ни один из зарядов не является кратным другому, поэтому мы должны перейти к наименьшему общему кратному 6. Чтобы получить 6+, нам нужно три иона железа (II), а чтобы получить 6-, нам нужно два иона фосфата. Правильная формула – Fe 3 (PO 4 ) 2 , а название соединения – фосфат железа (II).

Проверьте себя
Напишите правильную формулу и дайте правильное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и PO 4 3−
- Co 3+ и NO 2 −
Ответы
- (NH 4 ) 3 PO 4 , фосфат аммония
- Co(NO 2 ) 3 , нитрит кобальта(III)
Приложение «Еда и напитки»: натрий в вашей пище
Элемент натрия, по крайней мере, в его ионной форме Na + , является необходимым питательным веществом для жизни человека. Фактически, человеческое тело содержит примерно 0,15% натрия, при этом в организме среднего человека в любой момент времени содержится от одной двадцатой до одной десятой килограмма, в основном в жидкостях вне клеток и в других жидкостях организма.
Натрий также присутствует в нашем рационе. Обычная поваренная соль, которую мы используем для приготовления пищи, представляет собой ионное соединение натрия. Многие обработанные пищевые продукты также содержат значительное количество натрия, добавленного к ним в виде различных ионных соединений. Почему соединения натрия так широко используются? Обычно соединения натрия недороги, но, что более важно, большинство ионных соединений натрия легко растворяются. Это позволяет производителям обработанных пищевых продуктов добавлять содержащие натрий вещества в пищевые смеси и знать, что это соединение будет растворяться и равномерно распределяться по пище. Простые ионные соединения, такие как нитрит натрия (NaNO 2 ) добавляют в вяленое мясо, такое как бекон и мясные деликатесы, а соединение, называемое бензоатом натрия, добавляют во многие упакованные продукты в качестве консерванта. Таблица 3.8 «Некоторые соединения натрия, добавляемые в пищу» представляет собой неполный список некоторых добавок натрия, используемых в пищевых продуктах.
Обычная поваренная соль, которую мы используем для приготовления пищи, представляет собой ионное соединение натрия. Многие обработанные пищевые продукты также содержат значительное количество натрия, добавленного к ним в виде различных ионных соединений. Почему соединения натрия так широко используются? Обычно соединения натрия недороги, но, что более важно, большинство ионных соединений натрия легко растворяются. Это позволяет производителям обработанных пищевых продуктов добавлять содержащие натрий вещества в пищевые смеси и знать, что это соединение будет растворяться и равномерно распределяться по пище. Простые ионные соединения, такие как нитрит натрия (NaNO 2 ) добавляют в вяленое мясо, такое как бекон и мясные деликатесы, а соединение, называемое бензоатом натрия, добавляют во многие упакованные продукты в качестве консерванта. Таблица 3.8 «Некоторые соединения натрия, добавляемые в пищу» представляет собой неполный список некоторых добавок натрия, используемых в пищевых продуктах. Некоторые из них вы узнаете, прочитав эту главу. Другие вы можете не узнать, но все они представляют собой ионные соединения натрия с некоторым присутствием отрицательно заряженных ионов.
Некоторые из них вы узнаете, прочитав эту главу. Другие вы можете не узнать, но все они представляют собой ионные соединения натрия с некоторым присутствием отрицательно заряженных ионов.
Таблица 3.8 Некоторые соединения натрия, добавляемые в продукты питания
| Соединение натрия | Использование в пищевых продуктах |
|---|---|
| Ацетат натрия | консервант, регулятор кислотности |
| Адипинат натрия | пищевая кислота |
| Альгинат натрия | загуститель, растительная камедь, стабилизатор, желирующий агент, эмульгатор |
| Фосфат алюминия натрия | регулятор кислотности, эмульгатор |
| Алюмосиликат натрия | средство против слеживания |
| Аскорбат натрия | антиоксидант |
| Бензоат натрия | консервант |
| Бикарбонат натрия | минеральная соль |
| Бисульфит натрия | консервант, антиоксидант |
| Карбонат натрия | минеральная соль |
| Карбоксиметилцеллюлоза натрия | эмульгатор |
| Цитраты натрия | пищевая кислота |
| Дегидроацетат натрия | консервант |
| Эриторбат натрия | антиоксидант |
| Эриторбин натрия | антиоксидант |
| Этилпарагидроксибензоат натрия | консервант |
| Ферроцианид натрия | средство против слеживания |
| Формиат натрия | консервант |
| Фумарат натрия | пищевая кислота |
| Глюконат натрия | стабилизатор |
| Гидроацетат натрия | консервант, регулятор кислотности |
| Гидроксид натрия | минеральная соль |
| Лактат натрия | пищевая кислота |
| Малат натрия | пищевая кислота |
| Метабисульфит натрия | консервант, антиоксидант, отбеливатель |
| Метилпарагидроксибензоат натрия | консервант |
| Нитрат натрия | консервант, закрепитель цвета |
| Нитрит натрия | консервант, закрепитель цвета |
| Ортофенилфенол натрия | консервант |
| Пропионат натрия | консервант |
| Натрия пропилпарагидроксибензоат | консервант |
| Сорбат натрия | консервант |
| Стеароиллактилат натрия | эмульгатор |
| Сукцинаты натрия | регулятор кислотности, усилитель вкуса |
| Натриевые соли жирных кислот | эмульгатор, стабилизатор, антислеживатель |
| Сульфит натрия | минеральная соль, консервант, антиоксидант |
| Сульфит натрия | консервант, антиоксидант |
| Тартрат натрия | пищевая кислота |
| Тетраборат натрия | консервант |
Использование большого количества соединений натрия в приготовленных и обработанных пищевых продуктах встревожило некоторых врачей и диетологов. Они утверждают, что среднестатистический человек потребляет слишком много натрия из своего рациона. Среднестатистическому человеку требуется всего около 500 мг натрия каждый день; большинство людей потребляют больше — до 10 раз больше. Некоторые исследования связывают повышенное потребление натрия с высоким кровяным давлением; новые исследования показывают, что эта ссылка сомнительна. Тем не менее, есть стремление уменьшить количество натрия, потребляемого большинством людей каждый день: избегайте обработанных и полуфабрикатов, читайте этикетки на упакованных продуктах (которые содержат указание на содержание натрия), не пересолите продукты и используйте другие продукты. травы и специи, кроме соли в кулинарии.
Они утверждают, что среднестатистический человек потребляет слишком много натрия из своего рациона. Среднестатистическому человеку требуется всего около 500 мг натрия каждый день; большинство людей потребляют больше — до 10 раз больше. Некоторые исследования связывают повышенное потребление натрия с высоким кровяным давлением; новые исследования показывают, что эта ссылка сомнительна. Тем не менее, есть стремление уменьшить количество натрия, потребляемого большинством людей каждый день: избегайте обработанных и полуфабрикатов, читайте этикетки на упакованных продуктах (которые содержат указание на содержание натрия), не пересолите продукты и используйте другие продукты. травы и специи, кроме соли в кулинарии.
На этикетках пищевых продуктов указано количество натрия на порцию. Эта конкретная этикетка показывает, что в одной порции этого конкретного продукта питания содержится 75 мг натрия.
Ключевые выводы
- Ионы образуются, когда атомы теряют или приобретают электроны.

- Ионные соединения имеют положительные и отрицательные ионы.
- Ионные формулы уравновешивают суммарные положительные и отрицательные заряды.
- Ионные соединения имеют простую систему наименования.
- Группы атомов могут иметь общий заряд и образовывать ионные соединения.
Упражнения
Объясните, как образуются катионы.
Объясните, как образуются анионы.
Укажите заряд, который получает каждый атом, образуя ион. Если возможно более одного заряда, укажите оба.
a) K
b) O
c) Co
4. Определите заряд, который получает каждый атом, когда он образует ион. Если возможно более одного заряда, укажите оба.
а) Ca
б) I
c) Fe
5. Укажите заряд, который получает каждый атом, образуя ион. Если возможно более одного заряда, укажите оба.
а) Ag
б) Au
в) Br
6. Укажите заряд, который получает каждый атом, образуя ион. Если возможно более одного заряда, укажите оба.
Если возможно более одного заряда, укажите оба.
a) S
b) Na
c) H
7. Назовите ионы из упражнения 3.
8. Назовите ионы из упражнения 4.0017
10. Назовите ионы из упражнения 6.
11. Назовите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
A) Mg 2+ и CL —
B) Fe 2+ и O 2-
C) Fe 3+ и O 2-
12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. 12. формула и название каждого ионного соединения, образованного между двумя перечисленными ионами.
а) K + и S 2−
б) Ag + и Br −
c) Sr 2+ и N 3−
13. Укажите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
a) Cu 2+ и F —
B) CA 2+ и O 2-
C) K + и P 3−
14. 14. 140014 14. 14. 140014 14. 14. 140014 14. 140014 14. 14. 140014 14. 14. 140014 14. 14. 140014 14. 14. 14. 14. 140014 14. 14. 140014 14. 14. 14. 14. 140014 14. 14. 14. 14. 14. 140014
14. 140014 14. 14. 140014 14. 14. 140014 14. 140014 14. 14. 140014 14. 14. 140014 14. 14. 140014 14. 14. 14. 14. 140014 14. 14. 140014 14. 14. 14. 14. 140014 14. 14. 14. 14. 14. 140014
14. 14. 14. 14. 140014
14. 14. 14. 14. 140014
14. 14. 14. 14. 14. 140014
14. 14. 14. 14. 14. 14. 14. 14. 140014 и название каждого ионного соединения, образованного между двумя перечисленными ионами.
а) Na + и N 3–
B) CO 2+ и I —
C) AU 3+ и S 2-
15. между двумя перечисленными ионами.
a) K + and SO 4 2−
b) NH 4 + and S 2−
c) NH 4 + and PO 4 3−
16. Укажите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
A) CA 2+ и № 3 —
B) CA 2+ и № 2 —
C) SC 3 3+ 2+ 3+ 3+ 3+ 3+ 3+ 3+ 3 2+ 3 2+ 3 2+ 3223333377777777777777777777777777777777777777777777 гг. 3 O 2 −
3 O 2 −
17. Укажите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
а) Pb 4+ и SO 4 2−
б) Na + и I 3 −
0014 c) Li + и Cr 2 O 7 2−
18. Укажите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
a) NH 4 + and N 3−
b) Mg 2+ and CO 3 2−
c) Al 3+ and OH −
19. Укажите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
A) AG + и SO 3 2–
B) NA + и HCO 3 —
C) Fe 31003333 и CLO 9035 7. 7. 7. 7. 7. 7. и CLA и CLA — 3 и CLO — — — 7. — 7. — 3 и CLA — 7. и Cl.
7. и CLA и CLA — 3 и CLO — — — 7. — 7. — 3 и CLA — 7. и Cl.
20. Укажите формулу и название каждого ионного соединения, образованного между двумя перечисленными ионами.
a) RB + и O 2 2-
B) AU 3+ и HSO 4 —
C) SR 2 2+ 2 2 2+ 2 2 2+ 2 2 2+ 2 2 2 2 2 2 2 2 2 2 2 2 2 —
C).0357 2 −
21. В чем разница между SO 3 и SO 3 2− ?
22. В чем разница между № 2 и № 2 − ?
Ответы
1.
Катионы образуются при потере электронов.
3.
а) 1+
б) 2−
в) 2+, 3+
5.
в) 1-
7.
а) ион калия
б) ион оксида
в) ион кобальта(III), ионы кобальта(II), ионы кобальта(II) и кобальта(II) соответственно
9.
а) ион серебра
б) ионы золота(I) и золота(III) соответственно
в) ион бромида
11. 9017 хлорид магния , MgCl 2
б) оксид железа(II), FeO
в) оксид железа(III), Fe 2 O 3 13.
A) Медь (II) фторид, CUF 2
B) оксид кальция, CAO
C) Polassium Phosshide, K 357 357 357 357 357 357 357 357 357 357 357 357 357 357 357 357 357.
A) Сульфат калия, K 2 SO 4
B) СУЛЬФИД АММММОН 4 17.
а) сульфат свинца(IV), Pb(SO 4 ) 2
b) sodium triiodide, NaI 3
c) lithium dichromate, Li 2 Cr 2 O 7 19.
a) silver sulfite, Ag 2 SO 3
b) sodium hydrogen carbonate, NaHCO 3
c) iron(III) chlorate, Fe(ClO 3 ) 3 21.
SO 3 is sulfur trioxide , тогда как SO 3 2− представляет собой сульфит-ион.
3.3: Формулы для ионных соединений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16137
- Анонимный
- LibreTexts
Цели обучения
- Напишите химическую формулу простого ионного соединения.
- Распознавать многоатомные ионы в химических формулах.

Мы уже встречались с некоторыми химическими формулами для простых ионных соединений. Химическая формула представляет собой краткий список элементов в соединении и соотношения этих элементов. Чтобы лучше понять, что означает химическая формула, мы должны рассмотреть, как ионное соединение построено из его ионов.
Ионные соединения существуют в виде чередующихся положительных и отрицательных ионов в правильных трехмерных массивах, называемых кристаллами (рис. \(\PageIndex{1}\)). Как видите, в массиве нет отдельных \(\ce{NaCl}\) «частиц»; вместо этого существует непрерывная решетка чередующихся ионов натрия и хлорида. Однако мы можем использовать отношение ионов натрия к ионам хлорида, выраженное в наименьших возможных целых числах, как способ описания соединения. В случае хлорида натрия отношение ионов натрия к ионам хлорида, выраженное в наименьших целых числах, составляет 1:1, поэтому мы используем \(\ce{NaCl}\) (один \(\ce{Na}\) символ и один символ \(\ce{Cl}\)) для представления соединения. Таким образом, \(\ce{NaCl}\) — это химическая формула хлорида натрия, которая представляет собой краткий способ описания относительного количества различных ионов в соединении. Макроскопический образец состоит из множества пар NaCl; каждая отдельная пара называется формульная единица . Хотя удобно думать, что кристаллы \(\ce{NaCl}\) состоят из отдельных единиц \(\ce{NaCl}\), рисунок \(\PageIndex{1}\) показывает, что ни один ион не связан исключительно с с любым другим одиночным ионом. Каждый ион окружен ионами противоположного заряда.
Таким образом, \(\ce{NaCl}\) — это химическая формула хлорида натрия, которая представляет собой краткий способ описания относительного количества различных ионов в соединении. Макроскопический образец состоит из множества пар NaCl; каждая отдельная пара называется формульная единица . Хотя удобно думать, что кристаллы \(\ce{NaCl}\) состоят из отдельных единиц \(\ce{NaCl}\), рисунок \(\PageIndex{1}\) показывает, что ни один ион не связан исключительно с с любым другим одиночным ионом. Каждый ион окружен ионами противоположного заряда.
Формула ионного соединения следует нескольким соглашениям. Во-первых, катион записывается как перед анионом . Поскольку большинство металлов образуют катионы, а большинство неметаллов образуют анионы, в формулах обычно сначала указывается металл, а затем неметалл. Во-вторых, 91 466 зарядов 91 467 — это 91 466, не записанные 91 467 в формуле. Помните, что в ионном соединении компонентами являются ионы, а не нейтральные атомы, хотя формула не содержит зарядов. Наконец, правильная формула ионного соединения всегда имеет чистый нулевой заряд, означает, что общий положительный заряд должен равняться общему отрицательному заряду. Чтобы определить правильную формулу любой комбинации ионов, определите, сколько каждого иона необходимо, чтобы сбалансировать общие положительные и отрицательные заряды в соединении.
Поскольку большинство металлов образуют катионы, а большинство неметаллов образуют анионы, в формулах обычно сначала указывается металл, а затем неметалл. Во-вторых, 91 466 зарядов 91 467 — это 91 466, не записанные 91 467 в формуле. Помните, что в ионном соединении компонентами являются ионы, а не нейтральные атомы, хотя формула не содержит зарядов. Наконец, правильная формула ионного соединения всегда имеет чистый нулевой заряд, означает, что общий положительный заряд должен равняться общему отрицательному заряду. Чтобы определить правильную формулу любой комбинации ионов, определите, сколько каждого иона необходимо, чтобы сбалансировать общие положительные и отрицательные заряды в соединении.
Это правило в конечном счете основано на том факте, что материя в целом электрически нейтральна.
По соглашению предполагается, что существует только один атом, если индекс отсутствует. Мы не используем 1 в качестве нижнего индекса.
Если мы посмотрим на ионное соединение, состоящее из ионов лития и ионов брома, мы увидим, что ион лития имеет заряд 1+, а ион брома имеет заряд 1–. Только один ион каждого необходим, чтобы уравновесить эти заряды. Формула бромида лития: \(\ce{LiBr}\).
Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2–. Хотя оба этих иона имеют более высокие заряды, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному. Следовательно, правильная формула для этого ионного соединения: \(\ce{MgO}\). 9{−}} \номер\]
Теперь положительные и отрицательные заряды уравновешены. Мы могли бы записать химическую формулу этого ионного соединения как \(\ce{MgClCl}\), но принято использовать числовой индекс, когда имеется более одного иона данного типа — \(\ce{MgCl2}\ ). Эта химическая формула говорит, что в этой формуле есть один ион магния и два иона хлорида. (Не читайте часть формулы «Cl 2 » как молекулу двухатомного элементарного хлора. В этом соединении хлор не существует как двухатомный элемент. Скорее, он существует в виде двух отдельных ионов хлорида.) По соглашению, 9{2+}}\).
В этом соединении хлор не существует как двухатомный элемент. Скорее, он существует в виде двух отдельных ионов хлорида.) По соглашению, 9{2+}}\).
Для соединений, в которых соотношение ионов не столь очевидно, нижние индексы в формуле могут быть получены с помощью перекрестных зарядов : используйте абсолютное значение заряда одного иона в качестве нижнего индекса для другого иона. Этот метод схематично показан на рис. 3.3.2.
На изображении показаны M с зарядом n+ и X с зарядом m-. Плата за M становится нижним индексом X, а заряд X становится нижним индексом M, что делает конечный продукт M индексом m X индексом n. На изображении предлагается написать формулу соединения, образованного алюминием и кислородом. Он показывает Al с зарядом 3+ и O с зарядом 2-. При скрещивании зарядов конечным результатом будет Al нижний индекс 2 O нижний индекс 3. Рисунок \(\PageIndex{2}\): Плата за проезд. Один из методов получения нижних индексов в эмпирической формуле — скрещивание зарядов.
При пересечении зарядов иногда необходимо привести индексы к их простейшему соотношению, чтобы записать эмпирическую формулу. Рассмотрим, например, соединение, образованное Pb 4 + и O 2− . Использование абсолютных значений зарядов ионов в качестве индексов дает формулу Pb 2 O 4 . Это упрощает его правильную эмпирическую формулу PbO 2 . Эмпирическая формула имеет один ион Pb 4 + и два O 2– ионов.
Пример \(\PageIndex{1}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион натрия и ион серы
- ион алюминия и ион фтора
- ион железа 3+ и ион кислорода
Решение
- Чтобы получить октет валентной оболочки, натрий образует ион с зарядом 1+, а ион серы имеет заряд 2−. Два иона натрия 1+ необходимы для уравновешивания заряда 2- иона серы.
 Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\).
Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\). - Ион алюминия имеет заряд 3+, а ион фтора, образованный фтором, имеет заряд 1–. Три иона фтора 1- необходимы, чтобы уравновесить заряд 3+ на ионе алюминия. Эта комбинация записывается как \(\ce{AlF3}\).
- Железо может образовывать два возможных иона, но здесь указан ион с зарядом 3+. Атом кислорода имеет заряд 2- как ион. Чтобы сбалансировать положительные и отрицательные заряды, мы обращаемся к наименьшему общему кратному — 6: два иона железа 3+ дадут 6+, а три иона кислорода 2- дадут 6-, тем самым уравновешивая общие положительные и отрицательные заряды. Таким образом, формула этого ионного соединения: \(\ce{Fe2O3}\). В качестве альтернативы используйте метод перекрестных сборов, показанный на рис. 3.3.2.
Упражнение \(\PageIndex{1}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион кальция и ион кислорода
- ион меди 2+ и ион серы
- ион меди 1+ и ион серы
- Ответ a:
СаО
- Ответ б:
CuS
- Ответ c:
Медь 2 С
Многоатомные ионы
Некоторые ионы состоят из групп атомов ковалентно связанных вместе и имеют общий электрический заряд . Поскольку эти ионы содержат более одного атома, их называют многоатомными ионами. Структуры Льюиса, названия и формулы некоторых многоатомных ионов приведены в таблице 3.3.1.
Поскольку эти ионы содержат более одного атома, их называют многоатомными ионами. Структуры Льюиса, названия и формулы некоторых многоатомных ионов приведены в таблице 3.3.1.
| Ион Имя | Ионная формула |
|---|---|
| ион аммония | NH 4 +1 |
| гидроксид-ион | ОХ −1 |
| цианид-ион | CN −1 |
| карбонат-ион | СО 3 −2 |
| бикарбонат или гидрокарбонат | ОХС 3 − |
| ацетат-ион | С 2 Н 3 O 2 −1 или CH 3 CO 2 −1 |
| нитрат-ион | НЕТ 3 −1 |
| нитрит-ион | НЕТ 2 −1 |
| сульфат-ион | СО 4 −2 |
| сульфит-ион | СО 3 −2 |
| ион фосфата | ЗП 4 −3 |
| фосфит-ион | ЗП 3 −3 |
Обратите внимание, что только один многоатомный ион в этой таблице, ион аммония (NH 4 +1) , является катионом. Этот многоатомный ион содержит один атом азота и четыре атома водорода, которые вместе несут заряд +1. Все остальные многоатомные ионы заряжены отрицательно и поэтому классифицируются как анионы. Однако только два из них, ион гидроксида и ион цианида, названы с использованием суффикса «-ид», который обычно указывает на отрицательно заряженные частицы. Остальные многоатомные анионы, которые все содержат кислород в сочетании с другим неметаллом, существуют как часть ряда, в котором количество атомов кислорода в многоатомной единице может варьироваться. Как неоднократно подчеркивалось в нескольких разделах этого текста, никакие две химические формулы не должны иметь общего химического названия. Одного суффикса «-ид» недостаточно для различения названий анионов в родственном многоатомном ряду. Поэтому используются суффиксы «-ate» и «-ite», чтобы обозначить, что соответствующие многоатомные ионы являются частью ряда. Кроме того, эти суффиксы также указывают относительное количество атомов кислорода, содержащихся в многоатомных ионах.
Этот многоатомный ион содержит один атом азота и четыре атома водорода, которые вместе несут заряд +1. Все остальные многоатомные ионы заряжены отрицательно и поэтому классифицируются как анионы. Однако только два из них, ион гидроксида и ион цианида, названы с использованием суффикса «-ид», который обычно указывает на отрицательно заряженные частицы. Остальные многоатомные анионы, которые все содержат кислород в сочетании с другим неметаллом, существуют как часть ряда, в котором количество атомов кислорода в многоатомной единице может варьироваться. Как неоднократно подчеркивалось в нескольких разделах этого текста, никакие две химические формулы не должны иметь общего химического названия. Одного суффикса «-ид» недостаточно для различения названий анионов в родственном многоатомном ряду. Поэтому используются суффиксы «-ate» и «-ite», чтобы обозначить, что соответствующие многоатомные ионы являются частью ряда. Кроме того, эти суффиксы также указывают относительное количество атомов кислорода, содержащихся в многоатомных ионах. Обратите внимание, что все многоатомные ионы, названия которых оканчиваются на «-ate», содержат на один кислород больше, чем те многоатомные анионы, названия которых заканчиваются на «-ite». К сожалению, как и в обычной системе обозначения переходных металлов, эти суффиксы обозначают только относительное число атомов кислорода, содержащихся в многоатомных ионах. Например, нитрат-ион, который обозначается как NO 3 -1 , содержит на один атом кислорода больше, чем нитрит-ион, который обозначается как NO 2 -1 . Однако ион сульфата обозначается как SO 4 -2 . Хотя и нитрат-ион, и сульфат-ион имеют суффикс «-ate», первый содержит три атома кислорода, а второй — четыре. Кроме того, и нитрат-ион, и сульфит-ион содержат три атома кислорода, но эти многоатомные ионы не имеют общего суффикса. К сожалению, относительный характер этих суффиксов требует, чтобы комбинации формул ионов и названий ионов многоатомных ионов просто запоминались.
Обратите внимание, что все многоатомные ионы, названия которых оканчиваются на «-ate», содержат на один кислород больше, чем те многоатомные анионы, названия которых заканчиваются на «-ite». К сожалению, как и в обычной системе обозначения переходных металлов, эти суффиксы обозначают только относительное число атомов кислорода, содержащихся в многоатомных ионах. Например, нитрат-ион, который обозначается как NO 3 -1 , содержит на один атом кислорода больше, чем нитрит-ион, который обозначается как NO 2 -1 . Однако ион сульфата обозначается как SO 4 -2 . Хотя и нитрат-ион, и сульфат-ион имеют суффикс «-ate», первый содержит три атома кислорода, а второй — четыре. Кроме того, и нитрат-ион, и сульфит-ион содержат три атома кислорода, но эти многоатомные ионы не имеют общего суффикса. К сожалению, относительный характер этих суффиксов требует, чтобы комбинации формул ионов и названий ионов многоатомных ионов просто запоминались.
Правило построения формул для ионных соединений, содержащих многоатомные ионы, такое же, как и для формул, содержащих одноатомные (одноатомные) ионы: положительный и отрицательный заряды должны уравновешиваться. Если для уравновешивания заряда требуется более одного конкретного многоатомного иона, вся формула для многоатомного иона должна быть заключена в круглые скобки, а числовой индекс помещается вне скобок . Это должно показать, что нижний индекс относится ко всему многоатомному иону. Два примера показаны ниже:
Изображение задает вопрос, состоящий из двух частей: напишите формулу соединения, образованного (а) барием и нитратом и (б) аммонием и фосфатом. Для (а) Ba имеет заряд 2+, а NO 3 имеет заряд -1. При скрещивании зарядов получается формула Ba(NO 3 ) 2 . Для (b) NH 4 имеет заряд +1, а PO 4 имеет заряд 3-, поэтому при пересечении зарядов получается формула (NH 4 ) 3 PO 4 .
Пример \(\PageIndex{2}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион калия и сульфат-ион
- ион кальция и нитрат-ион
Раствор
- Ионы калия имеют заряд 1+, тогда как ионы сульфата имеют заряд 2–. Нам понадобятся два иона калия, чтобы сбалансировать заряд сульфат-иона, поэтому правильная химическая формула будет \(\ce{K_2SO_4}\).
- Ионы кальция имеют заряд 2+, в то время как ионы нитрата имеют заряд 1-. Нам понадобится два иона нитрата, чтобы сбалансировать заряд каждого иона кальция. Формула для нитрата должна быть заключена в круглые скобки. Таким образом, мы пишем \(\ce{Ca(NO3)2}\) как формулу этого ионного соединения.
Упражнение \(\PageIndex{2}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион магния и карбонат-ион
- ион алюминия и ацетат-ион
- Ответ a:
Mg 2 + и CO 3 2 — = MgCO 3
- Ответ б:
AL 3 + и C 2 H 3 O 2 — = AL (C 2 H 3 = Al (C 2 H 3 8 9.
 7 7 9. 7 ) 7 9. ).
7 7 9. 7 ) 7 9. ).
Распознавание ионных соединений
Существует два способа распознавания ионных соединений. Во-первых, соединения между металлическими и неметаллическими элементами обычно ионные . Например, CaBr 2 содержит металлический элемент (кальций, металл группы 2А) и неметаллический элемент (бром, неметалл группы 7А). Следовательно, это, скорее всего, ионное соединение. (на самом деле это равно ионному.) Напротив, соединение NO 2 содержит два элемента, которые оба являются неметаллами (азот из группы 5А и кислород из группы 6А). Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте. Также обратите внимание, что эта комбинация азота и кислорода не имеет определенного электрического заряда, поэтому это , а не ион нитрита.
Во-вторых, если вы узнаете формулу многоатомного иона в соединении, соединение равно 9{2+}}\) ион, при этом заряд 2+ уравновешивает общий заряд 2- от двух нитрат-ионов. Таким образом, это соединение также является ионным.
Таким образом, это соединение также является ионным.
Пример \(\PageIndex{3}\)
Идентифицируйте каждое соединение как ионное или неионное.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{Nh5Cl}\)
- \(\ce{OF2}\)
Раствор
- Натрий — металл, а кислород — неметалл; поэтому ожидается, что \(\ce{Na2O}\) будет ионным. 9{+}}\), что указывает на то, что это соединение является ионным.
- И кислород, и фтор являются неметаллами. Следовательно, \(\ce{OF2}\) не является ионным.
Упражнение \(\PageIndex{3}\)
Определите каждое соединение как ионное или неионное.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(Nh5)3PO4}\)
- \(\ce{SOCl2}\)
- Ответ a:
неионогенный
- Ответ б:
ионный
- Ответ c:
ионный
- Ответ д:
неионогенный
Взгляд поближе: кровь и морская вода
Науке давно известно, что кровь и морская вода имеют схожий состав. Ведь в обеих жидкостях растворены ионные соединения. Сходство может быть больше, чем простое совпадение; многие ученые считают, что первые формы жизни на Земле возникли в океанах. Однако при ближайшем рассмотрении видно, что кровь и морская вода совершенно разные. А 0,9% раствора хлорида натрия приблизительно соответствует концентрации солей в крови. Напротив, морская вода в основном представляет собой 3% раствор хлорида натрия, что более чем в три раза превышает его концентрацию в крови. Вот сравнение количества ионов в крови и морской воде:
Ведь в обеих жидкостях растворены ионные соединения. Сходство может быть больше, чем простое совпадение; многие ученые считают, что первые формы жизни на Земле возникли в океанах. Однако при ближайшем рассмотрении видно, что кровь и морская вода совершенно разные. А 0,9% раствора хлорида натрия приблизительно соответствует концентрации солей в крови. Напротив, морская вода в основном представляет собой 3% раствор хлорида натрия, что более чем в три раза превышает его концентрацию в крови. Вот сравнение количества ионов в крови и морской воде:

 ..
..
 Анионы называются по основе названия элемента с суффиксом 9.0015 -ide добавлен. Это оксид-анион.
Анионы называются по основе названия элемента с суффиксом 9.0015 -ide добавлен. Это оксид-анион. Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 .
Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 . Это означает, что два иона кобальта должны вносить 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Поэтому правильное название этого ионного соединения — оксид кобальта (III).
Это означает, что два иона кобальта должны вносить 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Поэтому правильное название этого ионного соединения — оксид кобальта (III).

 Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\).
Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\). 7 7 9. 7 ) 7 9. ).
7 7 9. 7 ) 7 9. ).
 Напишите химическую формулу ионного соединения, образованного каждой парой ионов.
Напишите химическую формулу ионного соединения, образованного каждой парой ионов. Напишите химическую формулу ионного соединения, образованного каждой парой ионов.
Напишите химическую формулу ионного соединения, образованного каждой парой ионов. Для каждой пары элементов определите заряд их ионов и напишите правильную формулу образовавшегося ионного соединения между ними.
Для каждой пары элементов определите заряд их ионов и напишите правильную формулу образовавшегося ионного соединения между ними. Соотношение каждого вида ионов в соединении
Соотношение каждого вида ионов в соединении

Leave A Comment