Углерод масса ядра — Справочник химика 21
Ядро атома содержит протоны и нейтроны. Протоны и нейтроны имеют почти одинаковые массы, но отличаются зарядом. У нейтрона нет электрического заряда, в то время как протон имеет положительный заряд, который точно компенсирует отрицательный заряд электрона. В табл. 1-1 указаны заряды трех перечисленных элементарных частиц, а также их массы, выраженные в атомных единицах массы. Атомная единица массы (а. е. м.) определяется как одна двенадцатая часть (точно) массы атома углерода, в ядре которого содержатся 6 протонов и 6 нейтронов. В такой шкале протоны и нейтроны обладают массами, которые близки к 1 а. е. м. каждая, но не равны точно этой величине. (Здесь уместно указать, что в [c.14]В настоящее время (с 1961 г.) и в химии, и в физике (следовательно, во всем естествознании) принята общая единица атомной массы — углеродная — 1/12 массы изотопа углерода В системе СИ ее значение (1,6605655 0,0000086) 10 кг она называется атомной единицей массы — а. е. м.. Так как ядро атома углерода состоит из 12 нуклонов (6 протонов и 6 нейтронов), массы которых близки между собой 2 и приблизительно равны 1 а. е. м., то атомные массы атомов изотопов остальных элементов также близки к целым числам (при этом можно не учитывать электронов, масса каждого из которых приблизительно в 2000 раз меньше массы нуклона) Атомные массы элементов в зависимости от их природного изотопного состава могут сильно отличаться от целых чисел (см. периодическую таблицу на форзаце учебника).
Альфа-частицы и их свойства. а-Частицы — это ядра гелия Ше. Каждая частица несет два элементарных положительных заряда масса частицы в 4 раза больше массы 1/12 изотопа углерода Будучи выброшены из ядра, а-частицы движутся в зависимости от их энергии со скоростью от 14 ООО до 20 600 км в секунду. Они характеризуются длиной пробега.  55]
55]
В вертикальных рядах элементов, принадлежащих к одной и той же группе, нуклеофильная реакционная способность возрастает с увеличением атомной массы. Так, из галогенов (элементы Vil группы) наибольшей нуклеофильной силой обладает иод. Несмотря на то что заряд ядра атома иода (53) намного больше, чем заряд ядра атома фтора (9), определяющие нуклео фильные свойства неподеленные пары электронов у иода находятся на большем расстоянии от ядра, и притяжение их к ядру значительно ослаблено экранирующим действием электронов заполненных внутренних оболочек. Это обусловливает большую поляризуемость внешних неподеленных пар, что облегчает взаимодействие их с атомом углерода, имеющим дефицит электронной плотности, и позволяет образовывать связь на больших межъядерных расстояниях. Таким образом, у галогенид-ионов нуклеофильная сила уменьшается п ряду
Первыми двумя законами сохранения, установленными в науке, были законы сохранения массы и энергии. В физических законах движения, кроме того, часто используется закон сохранения импульса (количества, движения). В ядерных реакциях может происходить взаимопревращение массы и энергии, но их сумма обязательно должна сохраняться. Ядерная энергия получается только за счет исчезновения массы соотношение между массой и энергией было установлено Эйнштейном и носит его имя. Согласно соотношению Эйнштейна, = тс , где -энергия, т — соответствующая ей масса, а с — скорость света. В ядерных реакциях также происходит сохранение заряда. Когда ядро изотопа углерода-14 распадается с образованием ядра азота-14, это сопровождается испусканием электрона (происходит так называемый бета-распад)

Атомная единица массы равна 1,66 10″ » г и представляет собой 1/12 часть массы атома утлерода-12 (т.е. атома изотопа углерода, в ядре которою 6р и би», а в оболочке 6е ). [c.9]
В табл. 3 приведена характеристика кислот эфирного экстракта, полученных при окислении пековой смолы и ее фракций. Кислоты имели белый цвет с легким серовато-желтым оттенком. Низкое атомное отношение водорода к углероду (0,70—0,85) указывает на ароматический характер получаемых кислот, а большая средняя масса ядра говорит о наличии полициклических кислот. Число карбоксильных групп у кислот эфирного экстракта было больше двух.
Посмотрим, какие выводы можно сделать на основании закона о взаимосвязи между массой и энергией. Масса ядра меньше суммы масс 92 протонов и 143 нейтронов. Разность масс соответствует энергии, удерживающей нуклоны в ядре. Мы можем выразить энергию образования ядра через уменьшение его массы по сравнению с расчетной, т. е. через дефект массы. То же самое мы можем проделать и для химической реакции. Вернемся к молярной теплоте сгорания углерода, равной примерно 10 ккал
Введение фенильных групп заметно снижает устойчивость карборанового ядра к действию температуры вследствие индуктивного эффекта заместителя. Полагают, что разрыв связи происходит между ароматическими кольцами и атомом углерода карборанового ядра, так как кроме водорода и метана в продуктах деструкции фенилзамещенного л(-карборана методом масс-спектрометрии авторы [253, 254] обнаружили бензол. По термостойкости в вакууме изомеры карборана можно расположить в следующий ряд о-карборан насыщенных паров воды термостойкость изомеров карборана несколько снижается в присутствии кислорода наблюдается резкое увеличение скорости их разложения. Так, если в вакууме о-карборан термически устойчив до 500 °С, то в присутствии воды и кислорода распад начинается при 400 и 250 °С соответственно.
Полагают, что разрыв связи происходит между ароматическими кольцами и атомом углерода карборанового ядра, так как кроме водорода и метана в продуктах деструкции фенилзамещенного л(-карборана методом масс-спектрометрии авторы [253, 254] обнаружили бензол. По термостойкости в вакууме изомеры карборана можно расположить в следующий ряд о-карборан насыщенных паров воды термостойкость изомеров карборана несколько снижается в присутствии кислорода наблюдается резкое увеличение скорости их разложения. Так, если в вакууме о-карборан термически устойчив до 500 °С, то в присутствии воды и кислорода распад начинается при 400 и 250 °С соответственно.
Существует несколько типов радиоактивного распада. Для легких радиоактивных элементов типичен -распад, сопровождающийся испусканием из ядра одного электрона ф -распад) или позитрона (р -распад). Первый путь распада типичен для элементов с некоторым избытком нейтронов против оптимального. Так, Р -распаду подвергаются ядра углерода 0 (более тяжелые, чем стабильные изотопы С и 1 С), Н (трития), и (более тяжелые, чем стабильный изотоп фосфора), N3 (более тяжелый, чем стабильный изотоп Ма). Наоборот, р+-распаду подвергаются ядра, у которых имеется дефицит нейтронов против оптимального, например 11С или Ыа. Возникновение позитрона можно представить себе как происходящее в ядре превращение одного протона в нейтрон и позитрон. Вне ядра такой процесс требует значительной затраты энергии, так как сопровождается увеличением массы на 0,0014 а. е. м.
Это определение элемента абстрагируется от всех других свойств атома, например массы, заряда, характера его связей в рассматриваемом соединении. Так, символ элемента углерода С объединяет все виды атомов с. зарядом ядра, равным шести, независимо от того, сколько нейтронов содержится в ядре, ион это или нейтральная частица, находящаяся в решетках графита или алмаза.
Масса одного протона составляет 1,673 10 г. Нейтрон близок по массе протону. Электрон приблизительно в 1820 раз легче протона и нейтрона и его масса равна 9,108 10″ г. Таким образом, основная масса атома сосредоточена в атомном ядре. Поскольку оперировать со столь малыми величинами масс не всегда удобно, массы атомных ядер, атомов, молекул чаще всего выражают не в граммах, а в специальных атомных единицах массы (а. е. м.). За атомную единицу массы принята углеродная единица — Via массы атома основного изотопа углерода С. Массы протона, нейтрона и электрона в а. е. м. приведены в табл. 1.
Нейтрон близок по массе протону. Электрон приблизительно в 1820 раз легче протона и нейтрона и его масса равна 9,108 10″ г. Таким образом, основная масса атома сосредоточена в атомном ядре. Поскольку оперировать со столь малыми величинами масс не всегда удобно, массы атомных ядер, атомов, молекул чаще всего выражают не в граммах, а в специальных атомных единицах массы (а. е. м.). За атомную единицу массы принята углеродная единица — Via массы атома основного изотопа углерода С. Массы протона, нейтрона и электрона в а. е. м. приведены в табл. 1.
Рассмотрим основные свойства образующих атом частиц — электронов, протонов и нейтронов. Протоны и нейтроны (нуклоны) образуют атомное ядро. Масса одного протона составляет 1,673-10 г. Нейтрон близок по массе протону. Электрон приблизительно в 1820 раз легче протона (нейтрона), масса электрона 9,108-10 г. Таким образом, основная масса атома сосредоточена в атомном ядре. Поскольку оперировать со столь малыми величинами масс не всегда удобно, массы атомных ядер, атомов, молекул чаще всего выражают не в граммах, а в специальных атомных единицах массы (а. е. м.). За атомную единицу массы принята углеродная единица, т. е. /12 массы атома основного изотопа углерода, ядро которого образовано из шести протонов и шести нейтронов 1 а. е. м.= ], 66057-кг.
Очень интересный пример МИЭ наблюдался Хаяши X., Сакагучи Й. О. и их соавторами для фотолиза молекул, содержащих серу [10]. Сера имеет изотопы 8 (/ = 0), 8 (I = 3/2) и 8 (/ = 0). Изучался фотораспад молекул РЬС0СН2802РЬ. При замещении 5 на 8 или 8 наблюдался изотопный эффект одного и того же знака, но величина изотопного эффекта при замещении 5 была заметно больше, чем при замещении 8 8. Этот результат нельзя объяснить изотопным эффектом, связанным с изменением массы ядра при изотопном замещении, он доказывает магнитную природу изотопного эффекта при замещении 8 — 8, т.е. при замещении немагнитного изотопа магнитным. Масштаб МИЭ в этой реакции меньше, чем МИЭ при изотопном замещении С С при фотолизе дибензилкетона.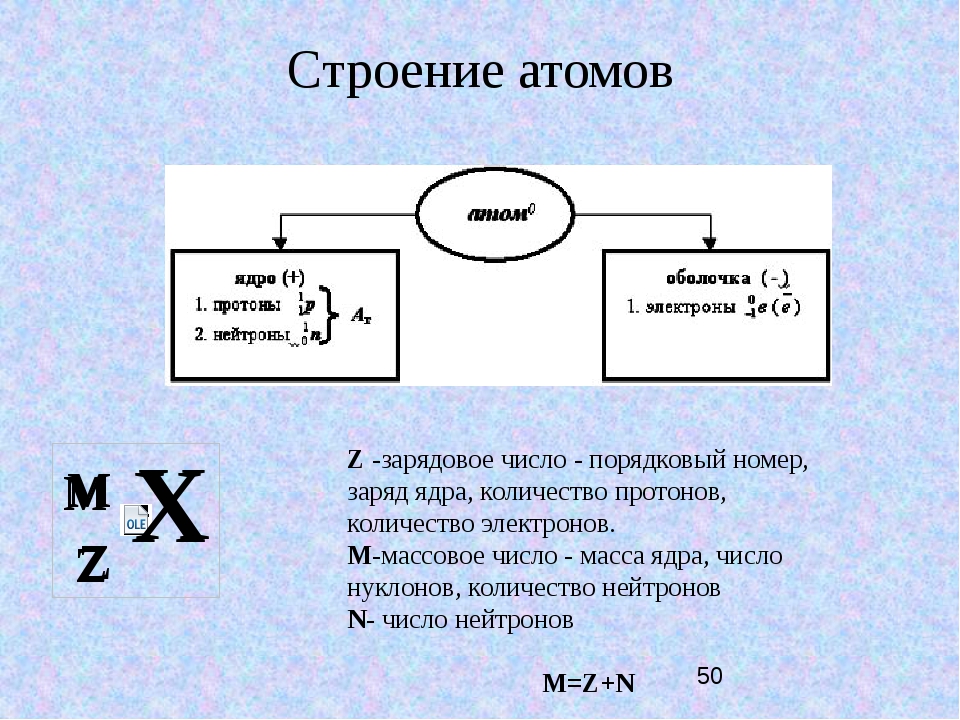 Это объясняется тем, что сера более тяжелый элемент, чем углерод, и поэтому в случае серы в синглет-триплетную эволюцию РП больший вклад вносит спин-орбитальное взаимодействие. Соответственно роль СТВ в спиновой динамике РП, содержащих такие тяжелые элементы как сера, уменьшается и масштаб МИЭ падает. [c.57]
Это объясняется тем, что сера более тяжелый элемент, чем углерод, и поэтому в случае серы в синглет-триплетную эволюцию РП больший вклад вносит спин-орбитальное взаимодействие. Соответственно роль СТВ в спиновой динамике РП, содержащих такие тяжелые элементы как сера, уменьшается и масштаб МИЭ падает. [c.57]
Второй важной характеристикой атома после заряда ядра является его масса. Истинная масса атома элемента, выраженная в граммах, называется абсолютной атомной массой (т ). Так, масса атома углерода равна 1,99 10 кг. Однако выражать значения масс атомов с помощью общепринятых единиц массы — грамм или килограмм — неудобно, поскольку получаются очень малые значения, что затрудняет пользование ими. Поэтому при вычислении атомных масс за единицу массы принимают 712 часть массы атома изотопа углерода с массовым числом 12. Эта единица измерения атомной массы называется углеродной единицей (у. е.) или атомной единицей массы (а. е. м.) 1 а. е. м. = 1,667 10 кг. Она создает единую основу для химических и физических расчетов. [c.11]
Второй важной характеристикой атома после заряда ядра является его масса. Истинная масса атома элемента называется абсолютной атомной массой Так, масса атома углерода [c.12]
Электронный распад (Р-распад) является основным типом распада ядер с избытком нейтронов и приводит к образованию дочерних ядер той же массы, но с зарядом ядра, увеличенным на единицу. Это видно на примере р-распада радиоактивного изотопа углерода [c.24]
По определению атомной единицы массы атомная масса изотопа углерода С равна 12 в то же время сумма масс протонов и нейтронов, входящих в состав ядра этого атома, и электронов составляет [c.34]
Ядро атома в первую очередь характери 1уется двумя параметрами зарядом 2 и массовым числом А. Массовое число определяет сз мму протонов и нейтронов в ядре, а порядковый номер — число протонов в ядре. В настоящее время общепринятым изображением ядер атомов и их характеристик является следующее слева от символа внизу ставится заряд ядра, а массовое число — вверху.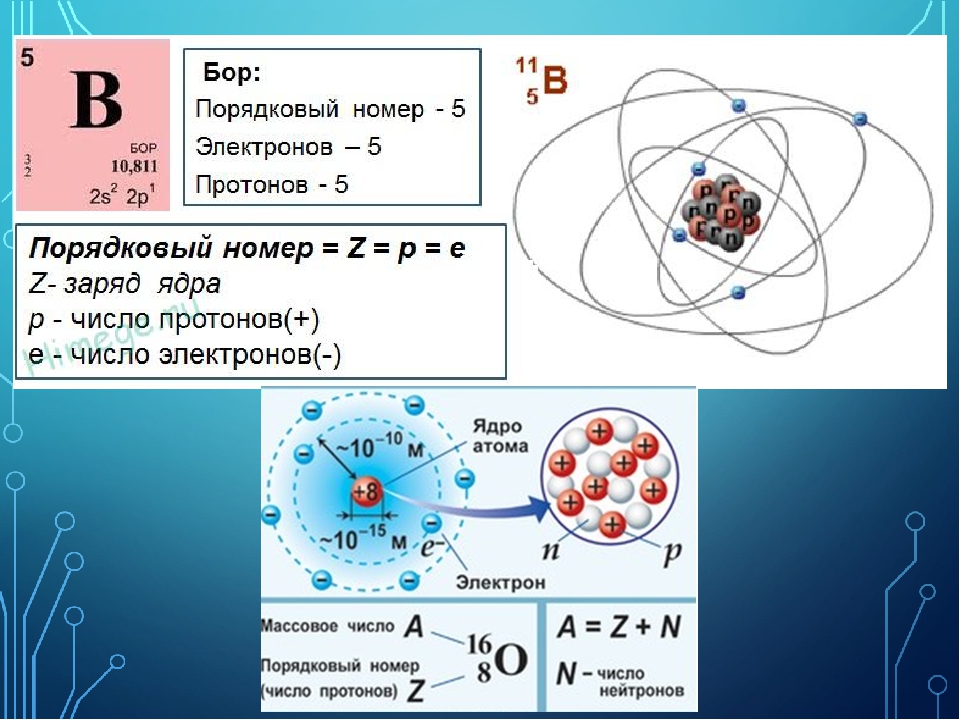 Например, ядро атома углерода обозначается так бС. Из этого следует, что заряд ядра (а следовательно, и число протонов) равен 6, массовое число равно 12, а число нейтронов равно разности между массовым числом и зарядом ядра, т. е. 6. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно указьшает и на относительную массу ядра. Массовые числа всегда имеют целые значения. [c.30]
Например, ядро атома углерода обозначается так бС. Из этого следует, что заряд ядра (а следовательно, и число протонов) равен 6, массовое число равно 12, а число нейтронов равно разности между массовым числом и зарядом ядра, т. е. 6. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно указьшает и на относительную массу ядра. Массовые числа всегда имеют целые значения. [c.30]
При переходе от АК-1 к АК-3 относительное содержание ареновых структур уменьшается за счет увеличения нафтеновых фрагментов количество атомов углерода в алкильном окру кении увеличивается (табл. 23). Масс-спектральные данные соответствуют данным ПМР-сиектроскопии. Среднее число атомов углерода в ядре и средняя длина алкильных заместителей установлены но распределению пиков молекулярных и псев-домолекулярпых [М—К]+ ионов. [c.31]
Число протонов в ядре атома принято называть порядковым (атомным) номером и обозначать буквой Z. Оно совпадает с числом электронов, окружающих ядро, поскольку атом должен быть электрически нейтральным. Массовое число атома равно полному числу содержащихся в нем тяжелых частиц протонов и нейтронов. Когда два атома сближаются на достаточное расстояние, чтобы между ними возникло химическое взаимодействие-или, как принято говорить, химическая связь,-каждый атом ощущает главным образом наличие самых внешних электронов другого атома. Поэтому именно эти внещние электроны играют определяющую роль в химическом поведении атомов. Нейтроны в составе ядра оказывают ничтожное влияние на химические свойства атомов, а протоны важны постольку, поскольку они определяют число электронов, которые должны окружать ядро нейтрального атома. Все атомы с одинаковым порядковым номером ведут себя в химическом отношении практически одинаково и рассматриваются как атомы одного и того же химического элемента. Каждому элементу присвоено определенное название и одно- или двухбуквенный символ (обычно заимствованный от греческого или латинского названия). Например, символ углерода-С, а символ кальция-Са. В качестве символа натрия. Ка, взяты две первые буквы его латинского (и немецкого) названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице- атомных масс элементов, помешенной на внутренней стороне обложки книги, приведен алфавитный перечень элементов и их символов. [c.15]
Например, символ углерода-С, а символ кальция-Са. В качестве символа натрия. Ка, взяты две первые буквы его латинского (и немецкого) названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице- атомных масс элементов, помешенной на внутренней стороне обложки книги, приведен алфавитный перечень элементов и их символов. [c.15]
Вероятность наблюдения эффекта Мессабауэра обратно иронорциональна массе ядра, поэтому из числа исследуемых ядер исключаются ядра таких важных для полимеров атомов, как углерод, кислород, водород. При [c.234]
Сильно возбужденное ядро атома отдачи, полученное по п, у)-реакции, может вступать в различные химические реакции. В результате рекомбинации с остатком молекулы, образовавшимся при отдаче, ядро может вновь образовать первоначальную молекулу. По Либби [И], подобные рекомбинации, например при (я, у)-облучении бромистого этила, проходят в очень малой степени. Атом отдачи сталкивается на своем пути с окружающими атомами и теряет энергию. Если соударения происходят с атомами водорода (масса = 1) и углерода (масса = 12) этильной группы, то атом отдачи бро-ма-80 теряет мало энергии, вследствие большой разницы масс сталкивающихся атомов (модель — столкновение биллиардных шаров). При этом ядро может покинуть сферу реакции, а оба осколка молекулы настолько удаляются друг от друга, что не происходит рекомбинации. Если атом отдачи сталкивается с другим атомом равной массы, например с другим атомом брома, то он может потерять большую часть своей энергии. Оставшаяся энергия уже недостаточна, чтобы атом покинул rea tion age — реакционную ячейку. Под реакционной ячейкой подразумевают молекулы, окружающие атом отдачи, которым он отдает свою энергию при соударениях. В таких случаях оба остатка молекулы СН3СН2— и Вг — находятся настолько близко друг от друга, что возможно восстановление первоначальной молекулы СН3— Hj — Вг . Степень рекомбинации во многом зависит от агрегатного состояния, в котором находится активируемое вещество. Она быстро растет от газообразного состояния вещества к жидкому и затем к твердому. В жидком бромистом этиле находят 75% активного брома, в то время как в газовой фазе на долю бромистого этила приходится только 4,5% активного брома [12—14]. [c.294]
Она быстро растет от газообразного состояния вещества к жидкому и затем к твердому. В жидком бромистом этиле находят 75% активного брома, в то время как в газовой фазе на долю бромистого этила приходится только 4,5% активного брома [12—14]. [c.294]
Гофман в органической химии занимает почетное место, поскольку три совершенно различного вида реакции носят era имя. Суть одной из них состоит в том, чтр при нагревпнии алкилированного солянокислого анилина алкильная группа переходит от. атома азота к атому углерода в ядре. Такова, например, конверсия хлористоводородного метиланилина в хлористоводородный /7-толуидин. Гофман высказал предположение, что активную роль в этом процессе играет хлористый метил, так как в своих ранних опытах он применял нагревание солянокислого анилина и метанола под давлением. При этом, при температуре 230—250°, шло образование солянокислого метиланилина, а после однодневного стояния при 350°, по охлаждении выпадала красивая кристаллическая масса хлористоводородного толуидина. [c.306]
Например, ядро атома гелия, атомный номер которого 2, а атомная масса 4 (это оСозначается так Ие), содержит 2 протона и 2 нейтрона. Ядра атома гелия — это те самые о-частнцы, которые излучаются при радноактионом распаде. Ядро атома углерода (атомный помер 6, атомная масст 12, цС) содержит 6 протонов и 6 нейтронов, кислорода ( 0) —8 протонов и 8 нейтронов, а фтора ( gF) —9 протонов и 10 нейтронов. [c.22]
Парафины при каталитическом риформинге превращаются в ароматические углеводороды путем дегидроциклизации. Если исходный парафин содержит менее шести атомов углерода в основной цепи, то ароматизации предшествует изомеризация с удлинением основной цепи. Скорость ароматизации возрастает с увеличением длины основной цепи. Парафиновые углеводороды, содержащие десять и более атомов углерода, образуют ароматические углеводороды с конденсированными кольцами. В результате дегидроциюлизации парафинов образуются гомологи бензола и нафталина с максимальным содержанием ме-тильных заместителей в ядре (исходя из строения исходного парафина). Гидрокрекинг парафинов приводит к образованию низкомолекулярных соединений. Значение гидрокрекинга в процессе риформинга неоднозначно. С одной стороны, уменьшение молекулярной массы парафиновых углеводородов приводит к повышению октанового числа, а с другой — образование значительного количества низкомолекулярных газообразных продуктов снижает выход бензина. [c.70]
Гидрокрекинг парафинов приводит к образованию низкомолекулярных соединений. Значение гидрокрекинга в процессе риформинга неоднозначно. С одной стороны, уменьшение молекулярной массы парафиновых углеводородов приводит к повышению октанового числа, а с другой — образование значительного количества низкомолекулярных газообразных продуктов снижает выход бензина. [c.70]
Атом — Система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Тип атома определяется составом его ядра. Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Элемент — совокупность атомов с одинаковъш зарядом ядра, т. е. числом протонов. Атомы элемента могут иметь различные числа нейтронов в составе ядра, а следовательно, и массу. Такие атомы, относящиеся к одному элементу, называются изотопами. Каждый известный элемент имеет свое обозначение. Так водород обозначается как Н, углерод — С, кислород — О, кремний — 81, железо — Ре. Атом — наименьшая частица элемента, обладающая его химическими свойствами. [c.18]
Дальнейшее повышение температуры способствует синтезу ядер бо.аьшей массы. Накопившиеся ядра гелия при столкновении образуют ядра бериллия, а при столкновении с последними — ядра углерода [c.316]
На рис. 5.11 приведен один из разре- эле ктронной пл тГ в зов распределения электронной плотности кристалле НЬЗЬг в молекуле нафталина СюНа (по плоскости, проходящей через ядра атомов). Из диаграммы видно, что все промежутки между атомами углерода характеризуются одинаковым рельефом электронной плотности. Это говорит в пользу модели сопряжения, а не чередования одинарных и двойных связей. Однако на диаграмме места расположения атомов водорода (см. внешнюю контурную линию), обладающих малой массой, лишь слегка намечаются и поэтому судить о распределении электронной плотности вблизи них нельзя. В подобных структурах положение легких атомов также определяется с относительно малой точностью. [c. 121]
121]
Аналогичное влияние геометрии молекул с заторможенным внутренним вращением на удерживание на ГТС проявляется для дифенилов — терфенилов, а также трифенил-метана. Углы поворота между бензольными ядрами в этих молекулах увеличиваются при переходе от пара- к мета- и орто-изомеру. Соответственно уменьш ается их удерживание на ГТС. Так, константы Генри в ряду п-, м- и о-терфенилов при 340°С составляют соответственно 78, 38 и 5 см /м . Молекулы трифенилметана, несмотря на большую молекулярную массу, удерживаются на ГТС еще слабее, так как центральный атом углерода, имеющий электронную конфигурацию ориентирует фенильные группы по углам тетраэдра, что мешает звеньям этих молекул приблизиться к поверхности ГИГС. [c.20]
Первые сообщения о наблюдении ЯМР появились в 1957 году, когда П. Лаутербур опубликовал свои работы, касающиеся простейших классов органических соединений. Однако методика регистрации спектров была очень трудоемкой. Тем не менее уже эти первые сообщения показали, что прямое наблюдение ядер углерода имеет много преимуществ перед аналогичными исследованиями на протонах. В начальный период использование спектроскопии ЯМР было сильно ограничено из-за трудности проведения эксперимента, связанной с низким спектральным разрешением. Вследствие малого содержания ядер (1,1 % по отношению к ядрам приходилось работать только с соединениями, имеющими высокую растворимость и небольшую молекулярную массу. Несмотря на это, уже к середине 60-х годов методом ЯМР удалось изучить многие классы органических соединений. [c.136]
Теоретические основы химии едины, они применяются как при рассмотрении неорганических, так и органических соединений. Есгь и особенности. Они определяются составом и строением органических соединений, что связано с особенностями в свойствах, индивидуальностью углерода, Каждый элемент неповторим. Индивидуальные свойства элемента определяются зарядом ядра, изотопным составом, атомной массой, составом атомного остова, валентной зоны, наличием вакантных орбиталей, т. е. физической индивидуальностью атома. Они проявляются в химической индивидуальности элемента составе его соединений, их строении, реакционной способности, в геохимическом поведении, процессах, протекающих в живой природе. [c.173]
е. физической индивидуальностью атома. Они проявляются в химической индивидуальности элемента составе его соединений, их строении, реакционной способности, в геохимическом поведении, процессах, протекающих в живой природе. [c.173]
Символы изотопов хлора. Изотопы
Большинство элементов, содержащихся в природе, состоит из нескольких видов атомов, отличающихся значениями относительной атомной массы.
Пример. Хлор в природе встречается как смесь двух видов атомов, один из которых содержит 18, а другой – 20 нейтронов в ядре.
Каждый вид атомов независимо от принадлежности к конкретному элементу однозначно описывается числом нуклонов (суммой протонов и нейтронов). Поэтому число видов атомов превышает число элементов.
Каждый вид атомов (вид ядер) называется нуклидом.
Нуклид – это вид атомов и ядер, отвечающий определенным числам протонов и нейтронов.
Нуклиды, принадлежащие одному элементу и однозначно определяемые
числом протонов, но различающиеся по числу нейтронов, называются изотопными нуклидами, или просто изотопами.
Изотопы элемента – это нуклиды, обладающие равным зарядом ядра (числом протонов).
Изотопы элемента различаются только числом нейтронов и, следовательно, общим числом нуклонов.
Например: Ядра двух природных изотопов хлора содержат по 17 протонов, но 18 и 20 нейтронов, т. е. 35 и 37 нуклонов соответственно.
Вследствие того, что именно числом протонов в ядре определяется число электронов в оболочке атома и химические свойства элемента, следует, что атомы всех изотопов одного и того же элемента имеют одинаковое электронное строение, а сами изотопы – близкие химические свойства, из-за чего их не удается разделить химическими методами.
В природе встречаются элементы, имеющие только один изотоп. Такиё элементы называются изотопно-чистыми. В современной Периодической системе насчитывается 21 изотопно-чистый элемент (ниже они перечислены по возрастанию порядкового номера): Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi, Th.
Остальные природные элементы представляют собой смесь двух или более изотопов, атомы которых различаются по числу нуклонов. Такие элементы называются изотропно-смешанными, их в Периодической системе большинство. Значения относительных атомных масс таких элементов отвечают природной смеси изотопов и являются усредненными по содержанию изотопов, поэтому значения А г многих элементов сильно отклоняются от целочисленных значений. Даже углерод, который принят за точку отсчета относительных атомных масс других элементов, является изотопно-смешанным, элементом (два изотопа с А, = 12 и А, = 13), и мерой определения относительной атомной массы служит один из природных изотопов углерода, а именно углерод –12. Наибольшее число изотопов (десять) имеет элемент олово.
Для нуклидов точные значения относительных атомных масс всегда близки к целочисленным значениям, поэтому массы нуклидов можно сравнивать по этим значениям А г, называемым массовыми числами.
Массовое число нуклида равно числу содержащихся в нем нуклонов (сумме протонов и нейтронов).
Для обозначения конкретного нуклида применяется специальная символика, Слева от символа химического элемента верхним индексом указывается массовое число, а нижним индексом – заряд ядра. Например: 6 12 С, 17 35 Cl и.т.д.
Малюгина 8. Изменения в составе ядер. Изотопы. Химический элемент.
Положение химического элемента в периодической системе зависит от величины заряда атомного ядра, т. е. от числа протонов в нем.
Ядерные реакторы» href=»/text/category/yadernie_reaktori/» rel=»bookmark»>ядерном реакторе атомной электростанции .
Рис 1. Ядерные реакции на Солнце
Что будет, если изменить количество нейтронов в атоме , не изменяя количество протонов? Заряд ядра, а значит положение элемента в периодической системе, не изменится. Значит, новый элемент не образуется. Это будет все тот же химический элемент , но атомы его будут отличаться от исходного своей массой .
Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов называют изотопами .
12С – углерод-12 13С – углерод-12 14С – углерод-14
Слово изотоп от греческих слов: изос — «один», топос – «место», обозначает «занимающий одно место» т. е. клетку в периодической системе химических элементов.
: Изотопы — разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа.
Изотопы обозначаются символами соответствующих элементов, слева вверху от которых записывают массовое число изотопа, а внизу – порядковый номер (заряд ядра атома) элемента, например,
126С – изотоп углерода с массовым числом 12
188О – изотоп кислорода с массовым числом 18
Иногда в символах изотопов записывают только массовые числа: 12С, 18О, 27Аl. В названии указывают его массовое число: углерод-12, кислород -18 и т. п.
В природе различные химические элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Изотопы элемента с меньшим массовым числом называют легкими, изотопы с большим массовым числом называют тяжелыми.
Изотопы так же делятся на стабильные и нестабильные (радиоактивные). Некоторые нестабильные изотопы используют как «меченые атомы» в научных исследованиях.
Изотопы одного химического элемента не отличаются химическими свойствами. Исключение составляет водород . Из-за кратного увеличения его массы при изменении в составе ядра числа протонов, свойства изотопов значительно разнятся.
Элемент водород имеет три изотопа, каждому из которых присвоено свое название и обозначение:
11Н — протий | 21Н (D) – дейтерий | 31Н (Т) — тритий |
1 протон, нейтронов нет | 1 протон, 1 нейтрон | 1 протон, 2 нейтрона |
Типовая задача 1.
Чему равно число нейтронов в атомах следующих изотопов: 15N, 119Sn, 235U
Решение
Число нейтронов — это разность между массовым числом и числом протонов (N = A – Z, где N –число нейтронов, A – массовое число, Z — число протонов).
Число протонов = порядковому номеру.
Для решения задачи найдем в ПСХЭ порядковые номера элементов и вычислим количество нейтронов, как разность между массовым числом и количеством протонов:
157N: N =15-7 =8; 8 нейтронов
11950Sn: N =119-50 =69; 69 нейтронов
23592U: N =235-92 =143; 143 нейтрона
Вопросы для самоконтроля:
1. От чего зависит положение химического элемента в периодической системе?
2. Почему атом магния занимает клетку ПСХЭ под номером 12?
3. Что произойдет с атомом, если в его ядре изменить (увеличить или уменьшить) количество протонов?
4. Как называются процессы, протекающие с изменением состава ядер?
5. Что произойдет с атомом, если в его ядре изменить количество нейтронов?
6. Что называют изотопами?
7. Чем отличаются атомы изотопов одного элемента?
8. Сколько изотопов может иметь атом?
9. Как называются изотопы водорода? Каков состав ядер этих изотопов?
10. Как обозначают и как называют изотопы элементов?
11. Почему изотопы хлора имеют одинаковые свойства, а изотопы водорода – разные?
12. Как классифицируют изотопы?
13. Почему проявляют разные химические свойства частицы 4019К и 4018Ar?
Посмотреть ответ
1. От величины заряда атомного ядра.
2. Заряд ядра атома магния равен 12, в ядре содержится 12 протонов.
3. Изменится заряд ядра, значит получится другой химический элемент.
4. Ядерными реакциями.
5. Изменится масса атома, химический элемент останется тем же.
6. Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов называют изотопами.
7. Числом нейтронов.
8. В природе элементы имеют разное число изотопов с разным процентным содержанием каждого из них.
9. У водорода три изотопа:
11Н — протий | 21Н (D) – дейтерий | 31Н (Т) — тритий |
1 протон, нейтронов нет | 1 протон, 1 нейтрон | 1 протон, 2 нейтрона |
10. Изотопы обозначаются символами соответствующих элементов, слева вверху от которых записывают массовое число изотопа 12С и указывают его в названии: углерод-12.
11. Изотопы химических элементов имеют, как правило, одинаковые свойства. Однако, у водорода при изменении числа нейтронов кратно увеличивается масса. Поэтому свойства изотопов водорода существенно отличаются. В связи с этим изотопы водорода получили индивидуальные названия: протий, дейтерий, тритий.
12. На легкие и тяжелые, на стабильные и нестабильные (радиоактивные).
13. Потому, что это разные химические элементы, они отличаются зарядом атомного ядра.
Задачи для самостоятельного решения
1. Напишите символы изотопов олова, атомы которых содержат 66, 68, 69, 71 ,72 нейтрона
2. Определите относительную молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода – дейтерий.
3. Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16
Посмотреть ответ
1. Изотопы – атомы с одинаковым зарядом атомного ядра, но разным массовым числом. Заряд ядра атома = порядковому номеру. Находим в ПСХЭ порядковый номер химического элемента олова (равен 50), вычисляем массовое число (столбец 3).
Число нейтронов | Число протонов = порядковому номеру =50 | Массовое число: сумма нейтронов и протонов | |
11650Sn или 116Sn | |||
11850Sn или 118Sn | |||
11950Sn или 119Sn | |||
12150Sn или 121Sn | |||
12250Sn или 122Sn |
2. Mr (D2О) = 2·2 +16 = 20
Mr (D2О) = 2·2 +16 = 20
3. Массовое число – это сумма протонов и нейтронов. Число протонов в атоме равно 31-16 =15. Число протонов = порядковому номеру, следовательно это элемент №15 – фосфор Р
Введение……………………………………………………………………………………………3
1. Символ элемента, положение его в периодической системе элементов Д.И. Менделеев. Атомная масса…………………………………………………………………………………….4
2. Строение ядра атома хлора. Возможные изотопы. Примеры………………………….5
3. Электронная формула атома: распределение электронов по уровням, подуровням, ячейкам Хунда. Возбуждённое состояние атома хлора………………………………………………….6
4. Валентность атома алюминия в стационарном и возбуждённом состояниях. Возможные степени окисления атома хлора. Окислительно – восстановительные свойства. Примеры схем перемещения электронов………………………………………………………………………….8
5. Эквиваленты хлора и его соединений. Примеры расчётов……………………………..11
6. Химические свойства хлора и его соединений. Примеры реакций……………………12
7. Виды концентраций……………………………………………………………………….15
8. Электролитическая диссоциация. Схема процесса диссоциации гидроксида. Константа диссоциации………………………………………………………………………………………17
9. Расчёт pH, pOH 0.01м раствора гидроксида или соли элемента………………………21
10. Гидролиз…………………………………………………………………………………..23
11. Качественный анализ хлора………………………………………………………………24
12. Методы количественного определения атома хлора или его соединений……………27
12.1. Гравиметрический метод анализа атома хлора…………………………………………27
13. Заключение……………………………………………………………………………….29
Список литературы………………………………………………………………………………32
Введение
Соединение с водородом — газообразный хлороводород — было впервые получено Джозефом Пристлив 1772 г. Хлор был получен в1774 г.шведским химикомКарлом Вильгельмом Шееле, описавшим его выделение при взаимодействиипиролюзитассоляной кислотойв своём трактате о пиролюзите:
Шееле
отметил запах хлора, схожий с запахом царской
водки, его способность взаимодействовать
сзолотомикиноварью,
а также его отбеливающие свойства. Однако Шееле, в соответствии с
господствовавшей в химиитого времени
теориифлогистона,
предположил, что хлор представляет
собой дефлогистированную муриевую
(соляную) кислоту.БертоллеиЛавуазьев
рамках кислородной теории кислот
обосновали, что новое вещество должно
быть оксидом гипотетическогоэлементамурия .
Однако попытки его выделения оставались
безуспешными вплоть до работ Дэви,
которомуэлектролизомудалось
разложитьповаренную
сольна натрий хлор, доказав
элементарную природу последнего.
Однако Шееле, в соответствии с
господствовавшей в химиитого времени
теориифлогистона,
предположил, что хлор представляет
собой дефлогистированную муриевую
(соляную) кислоту.БертоллеиЛавуазьев
рамках кислородной теории кислот
обосновали, что новое вещество должно
быть оксидом гипотетическогоэлементамурия .
Однако попытки его выделения оставались
безуспешными вплоть до работ Дэви,
которомуэлектролизомудалось
разложитьповаренную
сольна натрий хлор, доказав
элементарную природу последнего.
Хлор (от греч. χλωρός — «зелёный») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), третьего периода, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора — дословно «галоген» переводится как солерод — но оно не прижилось и впоследствии стало общим для 17-й (VIIA) группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Атомная масса
(молярная масса)
[комм 1] а. е. м. (г/моль)
2. Строение ядра атома хлора. Возможные изотопы. Примеры
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22%.
Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
Стабилен | ||||
β-распадв 36 Ar | ||||
Стабилен | ||||
37,2 минуты | β-распад в 38 Ar | |||
55,6 минуты | β-распад в 39 Ar | |||
1,38 минуты | β-распад в 40 Ar |
3.
 Электронная формула атома: распределение электронов по уровням, подуровням, ячейкам Хунда. Возбуждённое состояние атома хлора
Электронная формула атома: распределение электронов по уровням, подуровням, ячейкам Хунда. Возбуждённое состояние атома хлораХлор в периодической системе химических элементов находится в 3 периоде, VII группе, главной подгуппе (подгуппа галогенов) .
Заряд ядра атома Z = + = + 17
Количество протонов N(p+) = 17
Количество электронов N(e-) = 17
В возбужденном сотоянии:
1) 3s2 3p5 3d0 + hn —> 3s2 3p4 3d1
3 неспаренных электрона (2 электрона на 3р-подуровне и 1 электрон на 3d-подуровне) , следовательно валентность равна 3
Пример соединения: HClO2, Cl2O3
2) 3s2 3p4 3d1 + hn —> 3s2 3p3 3d2
5 неспаренных электронов (3 электрона на 3р-подуровне и 2 электрона на 3d-подуровне) , следовательно валентность равна 5
Пример соединения: HClO3, Cl2O5
3) 3s2 3p3 3d2 + hn —> 3s1 3p3 3d3
7 неспаренных электронов (1 электрон на 3s-подуровне, 3 электрона на 3р-подуровне и 3 электрона на 3d-подуровне), следовательно валентность равна 5
4. Валентность атома алюминия в стационарном и возбуждённом состояниях. Возможные степени окисления атома хлора. Окислительно – восстановительные свойства. Примеры схем перемещения электронов
Валентные электроны: 3s2 3p5
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится один неспаренный электрон, следовательно, невозбужденный атом хлора может проявлять валентность 1. Валентность 1 проявляется в следующих соединениях:
Газообразный хлор Cl2 (или Сl-Cl)
Хлорид натрия NaCl (или Na+ Cl-)
Хлороводород HCl (или H-Cl)
Хлорноватистая кислота HOCl (или H-O-Cl)
Окислительно – восстановительные свойства.
HCl — степень окисления хлора -1
HClO3 — степень окисления хлора +5
HClO4 — степень окисления хлора +7
Промежуточная степень окисления говорит о том, что данный элемент может проявлять как восстановительные так и окислительные свойства, это — HClO3
Окислительные
свойства проявляют элементы, у которых
максимальная степень окисления (она
равна номеру группы, в которой находится
элемент). Значит, HClO4 — окислитель.
Значит, HClO4 — окислитель.
Восстановительными свойствами обладает элемент с наменьшей степенью окисления, т.е. HCl — восстановитель.
Хлор является сильным окислителем. Различные соединения хлора могут быть использованы в качестве окислителей. Это хлор С12), хлорноватистая кислота НСЮ, соли хлорноватистой кислоты — гипохлорит натрия NaCIO или гипохлорит кальция Са(СЮ)2 и оксид хлора СЮ2.
Хлорирование применяют для удаления из сточных вод фенолов, крезолов, цианидов, сероводорода. Для борьбы с биологическими обрастаниями сооружений его используют в качестве биоцида. Применяют хлор и для обеззараживания воды.
Хлор поступает на производство в жидком виде с содержанием не менее 99,5 %. Хлор является высокотоксичным газом, он обладает способностью накапливаться и концентрироваться в небольших углублениях. С ним достаточно трудно работать. При попадании в воду происходит гидролиз хлора с образованием соляной кислоты. С некоторыми органическими веществами, которые присутствуют в растворе, С12 может вступать в реакции хлорирования. В результате образуются вторичные хлорорганические продукты, которые обладают высокой степенью токсичности. Поэтому применение хлора стремятся ограничить.
Хлорноватистая кислота НСЮ обладает такой же окислительной способностью, как и хлор. Однако ее окислительные свойства проявляются только в кислой среде. Кроме того хлорноватистая кислота является нестабильным продуктом — со временем и на свету она разлагается.
Широкое применение получили соли хлорноватистой кислоты. Гипохлорит кальция Са(СЮ)2 выпускается трех сортов с концентрацией активного хлора от 32 до 35 %. На практике используют также двухосновную соль Са(СЮ)2- 2Са(ОН)г 2Н20.
Наиболее устойчива соль гипохлорита натрия NaOCl * 5Н20, которую получают при химическом взаимодействии газообразного хлора с раствором щелочи или при электролизе поваренной соли в ванне без диафрагмы.
Оксид
хлораСO2 — газ зеленовато-желтого цвета,
хорошо растворим в воде, сильный
окислитель. Его получают взаимодействием
хлорита NaC102 с хлором, соляной кислотой
или озоном. При взаимодействии оксида
хлора с водой не ротекают реакции
хлорирования, что исключает образование
хлорорганических веществ. В последнее
время проводятся широкие разработки
по выяснению условий замены хлора на
оксид хлора в качестве окислителя. На
ряде российских заводов внедрены
передовые технологии с использованием
СO2.
Его получают взаимодействием
хлорита NaC102 с хлором, соляной кислотой
или озоном. При взаимодействии оксида
хлора с водой не ротекают реакции
хлорирования, что исключает образование
хлорорганических веществ. В последнее
время проводятся широкие разработки
по выяснению условий замены хлора на
оксид хлора в качестве окислителя. На
ряде российских заводов внедрены
передовые технологии с использованием
СO2.
А, следовательно, разную атомную массу .
Изотопы обозначают теми же символами, что и химический элемент , добавляя сверху слева символа массовое число , например, изотопы хлора обозначают: 35 Cl и 37 Cl, или массовое число следует за названием или символом элемента, например: уран-233 или Pu-239.
Изотопы данного химического элемента имеют одинаковый заряд атомного ядра , то есть один порядковый номер, и занимают то же место в периодической системе , имеют одинаковое количество протонов в ядре атома, но отличаются друг от друга количеством нейтронов . Так, в атомном ядре изотопа хлора 35 Cl содержится 17 протонов, поскольку порядковый номер хлора 17, и 18 нейтронов (35-17 = 18), а в ядре изотопа хлора 37 Cl — 17 протонов и 20 нейтронов (37-17 = 20) .
Некоторые химические элементы имеют небольшое количество стабильных изотопов. Так, для Кислорода известно три стабильных изотопа: 16 O (ядро состоит из 8 протонов и 8 нейтронов), 17 O (ядро состоит из 8 протонов и 9 нейтронов) и 18 В (ядро состоит из 8 протонов и 10 нейтронов). Для водорода известно тоже три изотопа: 1 H (ядро состоит только из одного протона), 2 H (ядро состоит из одного протона и одного нейтрона), 3 H (ядро состоит из одного протона и двух нейтронов). Некоторые же химические элементы состоят из достаточно большого количества изотопов. Например, ксенон имеет 9 изотопов, олово — 10 и т. д.
Подавляющее большинство изотопов не имеет специальных названий, но для изотопов некоторых элементов, в частности для изотопов водорода, существуют специальные названия и даже специальные символы.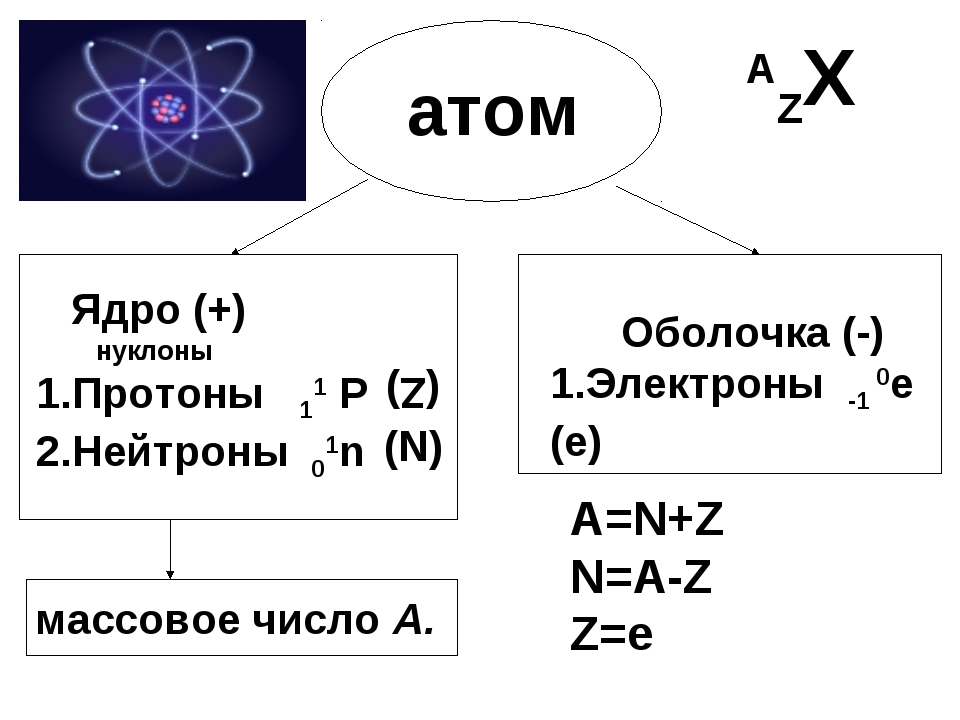 Так, изотоп водорода 1 H называют протий , изотоп 2 H — дейтерий и обозначают символом D а изотоп 3 Н — тритий (символ T). Некоторые изотопы в природе достаточно распространены, как, например, изотоп кислорода 16 O и изотоп водорода 1 Н, а другие изотопы встречаются в очень мизерных количествах, как изотопы кислорода 17 O и 18 O и изотопы водорода 2 H и 3 H.
Так, изотоп водорода 1 H называют протий , изотоп 2 H — дейтерий и обозначают символом D а изотоп 3 Н — тритий (символ T). Некоторые изотопы в природе достаточно распространены, как, например, изотоп кислорода 16 O и изотоп водорода 1 Н, а другие изотопы встречаются в очень мизерных количествах, как изотопы кислорода 17 O и 18 O и изотопы водорода 2 H и 3 H.
По химическим свойствам все изотопы отдельного элемента очень близки, поэтому значительной разницы между ними химических реакций не наблюдается. Исключение составляют изотопы водорода, которые по своим свойствам заметно отличаются друг от друга.
Период полураспада нестабильных изотопов может быть очень разным, от 1 ? 10 -24 до значений, превышающих возраст Вселенной. В последнем случае слабой радиоативнисть можно зарегистрировать точными измерениями, однако изотоп можно считать практически стабильным.
ОПРЕДЕЛЕНИЕ
Хлор — семнадцатый элемент Периодической таблицы. Обозначение — Cl от латинского «chlorum». Расположен в третьем периоде, VIIА группе. Относится к неметаллам. Заряд ядра равен 17.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl. Он встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl×MgCl 2 ×6H 2 O и сильвина KCl.
В обычных условиях хлор представляет собой газ желто-зеленого цвета (рис. 1), который хорошо растворяется в воде. При охлаждении из водных растворов выделяются кристаллогидраты, являющиеся кларатами приблизительного состава Cl 2 ×6H 2 Oи Cl 2 ×8H 2 O.
Рис. 1. Хлор в жидком состоянии. Внешний вид.
Атомная и молекулярная масса хлора
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается A r (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного хлора равна 35,457 а.е.м.
Относительная атомная масса безразмерна и обозначается A r (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного хлора равна 35,457 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула хлора двухатомна — Cl 2 . Относительная молекулярная масса молекулы хлора будет равна:
M r (Cl 2) = 35,457 × 2 ≈ 71.
Изотопы хлора
Известно, что в природе хлор может находиться в виде двух стабильных изотопов 35 Cl (75,78%) и 37 Cl (24,22%). Их массовые числа равны 35 и 37 соответственно. Ядро атома изотопа хлора 35 Cl содержит семнадцать протонов и восемнадцать нейтронов, а изотоп 37 Cl- такое же количество протонов и двадцать нейтронов.
Существуют искусственные изотопы хлора с массовыми числами от 35-ти до 43-х, среди которых наиболее стабильным является 36 Cl с периодом полураспада равным 301 тысяча лет.
Ионы хлора
На внешнем энергетическом уровне атома хлора имеется семь электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 5 .
В результате химического взаимодействия хлор может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Cl 0 -7e → Cl 7+ ;
Cl 0 -5e → Cl 5+ ;
Cl 0 -4e → Cl 4+ ;
Cl 0 -3e → Cl 3+ ;
Cl 0 -2e → Cl 2+ ;
Cl 0 -1e → Cl 1+ ;
Cl 0 +1e → Cl 1- .
Молекула и атом хлора
Молекула хлора состоит из двух атомов — Cl 2 . Приведем некоторые свойства, характеризующие атом и молекулу хлора:
Примеры решения задач
ПРИМЕР 1
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: Cl 2 + H 2 = 2HCl. Рассчитаем количество вещества водорода, вступившего в реакцию: n (H 2)=V (H 2) / V m ; n (H 2)= 10 / 22,4 = 0,45 моль. Согласно уравнению, n (H 2)= n (Cl 2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен: |
Открытая Химия. Понятие об атомах
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Z электронов.
Массовое число A равно сумме числа протонов Z и числа нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
| Нуклид | Изотоп | Z | N | A | Вид нуклида |
|---|---|---|---|---|---|
| h21 | Протий | 1 | 0 | 1 | изотопы |
| H (D)12 | Дейтерий | 1 | 1 | 2 | |
| H (T)13 | Тритий | 1 | 2 | 3 | |
| C612 | Углерод-12 | 6 | 6 | 12 | изотопы |
| C613 | Углерод-13 | 6 | 7 | 13 | |
| C614 | Углерод-14 | 6 | 8 | 14 | |
| Ar1840 | Аргон-40 | 18 | 22 | 40 | изобары |
| K1940 | Калий-40 | 19 | 21 | 40 | |
| Ca2040 | Кальций-40 | 20 | 20 | 40 | |
| Ra88228 | Радий-228 | 88 | 140 | 228 | изотоны |
| Th90230 | Торий-230 | 90 | 140 | 230 |
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина) AZ=ZAЭ / а. е. м.; она численно равна атомной массе элемента.
Относительная атомная масса элемента с учетом его изотопного состава равна A=∑i=1nAiPi; Ai – относительная атомная масса изотопа, Pi – доля каждого из изотопов элемента в земной коре.
различий между углеродом-12 и углеродом-14
Углерод-12 и углерод-14 — два изотопа элемента углерода. Разница между углеродом-12 и углеродом-14 заключается в количестве нейтронов в каждом из их атомов.
Вот как это работает. Число после названия атома указывает количество протонов плюс нейтронов в атоме или ионе. Атомы обоих изотопов углерода содержат по 6 протонов. Атомы углерода-12 содержат 6 нейтронов, а атомы углерода-14 содержат 8 нейтронов.Нейтральный атом будет иметь одинаковое количество протонов и электронов, поэтому нейтральный атом углерода-12 или углерода-14 будет иметь 6 электронов.
Хотя нейтроны не несут электрический заряд, их масса сравнима с массой протонов, поэтому разные изотопы имеют разный атомный вес. Углерод-12 легче углерода-14.
Изотопы углерода и радиоактивность
Из-за разного количества нейтронов углерод-12 и углерод-14 различаются по радиоактивности.Углерод-12 — стабильный изотоп; углерод-14, с другой стороны, подвергается радиоактивному распаду:
14 6 C → 14 7 N + 0 -1 e (период полураспада 5720 лет)
Другие общие изотопы углерода
Другой распространенный изотоп углерода — углерод-13. Углерод-13 имеет 6 протонов, как и другие изотопы углерода, но имеет 7 нейтронов. Он не радиоактивен.
Хотя известно 15 изотопов углерода, естественная форма элемента состоит из смеси только трех из них: углерода-12, углерода-13 и углерода-14.Большинство атомов — это углерод-12.
Измерение разницы в соотношении углерода-12 и углерода-14 полезно для определения возраста органического вещества, поскольку живой организм обменивается углеродом и поддерживает определенное соотношение изотопов. В больном организме углеродный обмен отсутствует, но присутствующий углерод-14 подвергается радиоактивному распаду, поэтому со временем изменение соотношения изотопов становится все больше и больше.
В больном организме углеродный обмен отсутствует, но присутствующий углерод-14 подвергается радиоактивному распаду, поэтому со временем изменение соотношения изотопов становится все больше и больше.
4.8: Изотопы — когда количество нейтронов меняется
Все атомы одного и того же элемента имеют одинаковое количество протонов, но некоторые могут иметь разное количество нейтронов.Например, у всех атомов углерода есть шесть протонов, и у большинства также шесть нейтронов. Но некоторые атомы углерода имеют семь или восемь нейтронов вместо обычных шести. Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства, потому что они имеют одинаковое количество протонов и электронов.
Пример: изотопы водорода
Водород — это пример элемента, имеющего изотопы. Три изотопа водорода смоделированы на рисунке \ (\ PageIndex {1} \). Большинство атомов водорода имеют только один протон, один электрон и не имеют нейтрона. Эти атомы просто называются водородом. Некоторые атомы водорода также имеют один нейтрон. Эти атомы представляют собой изотоп под названием дейтерий. У других атомов водорода есть два нейтрона. Эти атомы представляют собой изотоп под названием тритий.
Рисунок \ (\ PageIndex {1} \): три наиболее стабильных изотопа водорода: протий (A = 1), дейтерий (A = 2) и тритий (A = 3).(CC SA-BY 3.0; Баладжиджагадеш).Для большинства элементов, кроме водорода, изотопы названы по их массовому числу. Например, атомы углерода с обычными 6 нейтронами имеют массовое число 12 (6 протонов + 6 нейтронов = 12), поэтому их называют углеродом-12. Атомы углерода с 7 нейтронами имеют атомную массу 13 (6 протонов + 7 нейтронов = 13). Эти атомы представляют собой изотоп под названием углерод-13.
Пример \ (\ PageIndex {1} \): изотопы лития
- Какой атомный номер и массовое число изотопа лития, содержащего 3 нейтрона?
- Какой атомный номер и массовое число у изотопа лития, содержащего 4 нейтрона?
Решение
Атом лития содержит в своем ядре 3 протона независимо от количества нейтронов или электронов.
а.
\ [\ begin {align} \ text {атомный номер} = \ left (\ text {количество протонов} \ right) & = 3 \ nonumber \\ \ left (\ text {количество нейтронов} \ right ») & = 3 \ nonumber \ end {align} \ nonumber \]
\ [\ begin {align} \ text {массовое число} & = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \ nonumber \\ \ text { массовое число} & = 3 + 3 \ nonumber \\ & = 6 \ nonumber \ end {align} \ nonumber \]
г.
\ [\ begin {align} \ text {атомный номер} = \ left (\ text {количество протонов} \ right) & = 3 \ nonumber \\ \ left (\ text {количество нейтронов} \ right ») & = 4 \ nonumber \ end {align} \ nonumber \]
\ [\ begin {align} \ text {массовое число} & = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \ nonumber \\ \ text { массовое число} & = 3 + 4 \ nonumber \\ & = 7 \ nonumber \ end {align} \ nonumber \]
Обратите внимание, что поскольку атом лития всегда имеет 3 протона, атомный номер лития всегда равен 3.Однако массовое число равно 6 в изотопе с 3 нейтронами и 7 в изотопе с 4 нейтронами. В природе существуют только определенные изотопы. Например, литий существует как изотоп с 3 нейтронами и как изотоп с 4 нейтронами, но он не существует как изотоп с 2 нейтронами или как изотоп с 5 нейтронами.
Стабильность изотопов
Атомам необходимо определенное соотношение нейтронов и протонов, чтобы иметь стабильное ядро. Слишком много или слишком мало нейтронов по сравнению с протонами приводит к нестабильному или радиоактивному ядру, которое рано или поздно распадется до более стабильной формы.Этот процесс называется радиоактивным распадом. Многие изотопы имеют радиоактивные ядра, и эти изотопы называют радиоизотопами. Когда они распадаются, они выделяют частицы, которые могут быть вредными. Вот почему радиоактивные изотопы опасны и почему работа с ними требует специальных защитных костюмов. Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углеродом-12 и углеродом-13, стабильны.
Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углеродом-12 и углеродом-13, стабильны.
Все это обсуждение изотопов возвращает нас к атомной теории Дальтона.Согласно Дальтону, атомы данного элемента идентичны. Но если атомы одного элемента могут иметь разное количество нейтронов, то и массы у них тоже могут быть разные! Как Далтон это пропустил? Оказывается, элементы, встречающиеся в природе, существуют в виде постоянных однородных смесей своих изотопов природного происхождения. Другими словами, кусок лития всегда содержит оба типа встречающегося в природе лития (тип с 3 нейтронами и тип с 4 нейтронами). Более того, он всегда содержит оба в одинаковых относительных количествах (или «относительном количестве»).В куске лития \ (93 \% \) всегда будет литий с 4 нейтронами, а оставшийся \ (7 \% \) всегда будет литием с 3 нейтронами.
Дальтон всегда экспериментировал с большими кусками элемента — кусками, содержащими все встречающиеся в природе изотопы этого элемента. В результате, когда он проводил свои измерения, он фактически наблюдал усредненные свойства всех различных изотопов в образце. Для большинства наших целей в химии мы будем делать то же самое и иметь дело со средней массой атомов.К счастью, помимо разной массы, большинство других свойств разных изотопов схожи.
Есть два основных способа, которыми ученые часто показывают массовое число интересующего их атома. Важно отметить, что массовое число — , а не , указанное в периодической таблице. Эти два способа включают запись символа ядра или указание имени элемента с записанным массовым числом.
Чтобы записать ядерный символ , массовое число помещается в верхнем левом углу (верхний индекс) химического символа, а атомный номер помещается в нижний левый (нижний индекс) символа.{238} _ {92} U} \]
В представленном выше ядре никеля атомный номер 28 указывает, что ядро содержит 28 протонов, и, следовательно, оно должно содержать 31 нейтрон, чтобы иметь массовое число 59. Ядро урана имеет 92 протона, как и все ядра урана. ; и это конкретное ядро урана имеет 146 нейтронов.
Ядро урана имеет 92 протона, как и все ядра урана. ; и это конкретное ядро урана имеет 146 нейтронов.
Другой способ представления изотопов — добавление дефиса и массового числа к химическому названию или символу. Таким образом, двумя ядрами будут никель-59 или Ni-59 и уран-238 или U-238, где 59 и 238 — массовые числа двух атомов, соответственно.{40} _ {19} \ ce {K} \)?
Решение
\ [\ text {атомный номер} = \ left (\ text {количество протонов} \ right) = 19 \]
Для всех атомов без заряда количество электронов равно количеству протонов.
\ [\ text {количество электронов} = 19 \]
Массовое число 40 представляет собой сумму протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.
\ [\ text {количество нейтронов} = 40 — 19 = 21.\]
Пример \ (\ PageIndex {3} \): Zinc-65
Сколько протонов, электронов и нейтронов содержится в атоме цинка-65?
Решение
\ [\ text {число протонов} = 30 \]
Для всех атомов без заряда количество электронов равно количеству протонов.
\ [\ text {количество электронов} = 30 \]
Массовое число 65 — это сумма протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.{45} _ {20} \ ce {Ca} \)
- Ответ:
- 27 протонов, 27 электронов, 33 нейтрона
- Ответ б:
- 11 протонов, 11 электронов, 13 нейтронов
- Ответ c:
- 20 протонов, 20 электронов, 25 нейтронов
- Ответ d:
- 38 протонов, 38 электронов, 52 нейтрона
РАДИОКАРБОННОЕ ДАТИРОВАНИЕ
РАДИОКАРБОННОЕ ДАТИРОВАНИЕОБЩЕСТВЕННЫЙ КОЛЛЕДЖ РАЙСКОЙ ДОЛИНЫ
ПРУЖИННЫЙ СЕМЕСТР, 2000
ХИМИЯ 130
РАЗДЕЛ 2230
ДР.
 ДЖЕРАЛЬД А. РОЗЕНТАЛЬ
ДЖЕРАЛЬД А. РОЗЕНТАЛЬ ДАТИРОВКА ПО УГЛЕВОДУ
КАК СОЗДАЕТСЯ УГЛЕРОД 14
Космический радиация (гамма-лучи) проникают в атмосферу Земли и бомбардируют атмосферные атомы, которые они разбивают, чтобы создать свободные нейтроны. Эти нейтроны легко реагирует с 14 Азот, самый распространенный найденный атом в нашей атмосфере.
14 7 с.ш.
(в ядре 7 протонов и 7 нейтронов) + нейтрон
они вместе реагируют с образованием
14 6 C (6 протонов и
8 нейтронов) плюс протон (побочный продукт реакции)
В результате этого процесса углерод-14, РАДИОАКТИВНЫЙ ИЗОТОП, постоянно образуется в нашей атмосфере . Он немедленно реагирует
со свободным кислородом в атмосфере для создания радиоактивного углекислого газа
( 14 CO 2 ).Этот радиоактивный газ попадает в организм растений.
для фото-
синтез и в конечном итоге находит свое применение в
животные, которые едят растения. Благодаря этим интерактивным процессам,
радиоактивный углерод-14 попадает во ВСЕ ЖИВЫЕ СИСТЕМЫ, ВКЛЮЧАЯ ВАШУ
СОБСТВЕННОЕ ТЕЛО. ДА, ТЫ ВСЕГДА-ТАК-СЛАБО РАДИО-
АКТИВНЫЙ!
КАК УГЛЕРОД-14 РАЗРУШАЕТСЯ
Углерод-14 радиоактивен и медленно
распадается или РАСПАДА. Процесс распада включает спонтанное
потеря электрона как бета-частицы.
самопроизвольно выходит из строя с потерей нейтрон и высвобождение электрона
при этом остается дополнительный протон, который сохранено для создания
14 7 N (7 протонов и 7 нейтроны) плюс протон (побочный продукт реакции)
В этой реакции радиоактивный, углерод-14 теряет нейтрон, который вызвал бы потерю продукта реакции
масса. Однако при этом был получен протон.
в реакции. Таким образом, конечный продукт — азот-14 — имеет такую же
масса как углерод-14 (потому что азот-14 потерял нейтрон при получении протона),
но теперь это новый элемент, азот-14 (из-за полученного протона).
ПОМНИТЕ, ПРИ ИЗМЕНЕНИИ КОЛИЧЕСТВА ПРОТОНОВ СОЗДАЮТСЯ НОВЫЕ ЭЛЕМЕНТЫ.
Однако при этом был получен протон.
в реакции. Таким образом, конечный продукт — азот-14 — имеет такую же
масса как углерод-14 (потому что азот-14 потерял нейтрон при получении протона),
но теперь это новый элемент, азот-14 (из-за полученного протона).
ПОМНИТЕ, ПРИ ИЗМЕНЕНИИ КОЛИЧЕСТВА ПРОТОНОВ СОЗДАЮТСЯ НОВЫЕ ЭЛЕМЕНТЫ.
N.B. КАЖДЫЙ ЭЛЕМЕНТ ИМЕЕТ СОБСТВЕННОЕ УНИКАЛЬНОЕ КОЛИЧЕСТВО ПРОТОНОВ. ДВА ЭЛЕМЕНТА НЕ МОГУТ ИМЕЕТ ОДИНАКОВОЕ КОЛИЧЕСТВО ПРОТОНОВ.
ДАЛИ ЭТО НЕКОТОРЫЕ ВНИМАТЕЛЬНЫЕ МЫСЛИ:
КАК ЖИВ ОРГАНИЗМ, ОН МОЖЕТ ПОЛУЧИТЬ СВЕЖИЙ УГЛЕРОД-14 ИЗ РАСТИТЕЛЬНОГО МАТЕРИАЛА, КОТОРЫЙ ОН ЕДАЕТ. ОДНАКО, КОГДА ОНА УМИРАЕТ, ОН БОЛЬШЕ НЕ МОЖЕТ ПРИНИМАТЬ НОВЫЙ УГЛЕРОД-14.
ОТ ТОЧКИ ПО ВСЕГО СОДЕРЖАНИЕ УГЛЕРОДА-14 В ОРГАНИЗМЕ ДОЛЖНО УМЕНЬШИТЬСЯ С ЭТОГО НЕ МОЖЕТ БОЛЬШЕ ПРИНИМАТЬ НОВЫЙ УГЛЕРОД-14, И СУЩЕСТВУЮЩИЙ УГЛЕРОД-14 РАСПОРЯЕТСЯ ВНИЗ.
ЕСЛИ МЫ ЗНАЕМ, КОЛИЧЕСТВО УГЛЕРОДА-14 В ОРГАНИЗМЕ ПРИ СМЕРТИ, И МЫ ЗНАЕМ СКОРОСТЬ, С КОТОРОЙ РАЗРУШАЕТ УГЛЕРОД-14 ВНИЗ (МЫ ЗНАЕМ ОБЕ ВЕЩИ), ТО У НАС ЕСТЬ ОТЛИЧНЫЕ ЧАСЫ НА ОСНОВЕ КОЛИЧЕСТВО УГЛЕРОДА-14, ОСТАЮЩЕГОСЯ В ОРГАНИЗМЕ, ЧТО СКАЗАТЬ НАС СКОЛЬКО УМЕР ОРГАНИЗМ.
Освежите память о нашем обсуждении трех изотопов водорода.
Углерод также имеет несколько изотопов. Большая часть углерода нашей Вселенной встречается как углерод-12, но есть также немного радиоактивного углерода-14. также.
ОПРЕДЕЛЕНИЕ ТОЧНОГО КОЛИЧЕСТВА УГЛЕРОДА В ДАННЫХ БИОЛОГИЧЕСКИЙ ОБРАЗЕЦ.
МЫ ОЧЕНЬ ТОЧНО ЗНАЕМ, КАК МНОГО ОБЩЕГО УГЛЕРОДА СОСТАВЛЯЕТСЯ ИЗ КАЖДОГО ИЗОТОПОВ УГЛЕРОДА, ВКЛЮЧАЯ ЕГО РАДИОАКТИВНЫЙ ИЗОТОП УГЛЕРОДА-14. Следовательно, как только мы узнаем общее количество углерода в образце, мы точно знаем сколько радиоактивного углерода-14 было , первоначально присутствовало в образце.
КАК ВОЗРАСТ ОБРАЗЦА, КОЛИЧЕСТВО УГЛЕРОДА-12 НИКОГДА НЕ ИЗМЕНЯЕТСЯ ПОТОМУ ЧТО
ЯВЛЯЕТСЯ СТАБИЛЬНЫМ ИЗОТОПОМ. НАПРИМЕР, ЕСЛИ МЫ ПЫТАЕМСЯ НАЗНАЧИТЬ ЧАСТЬ
КОСТИ КОЛИЧЕСТВО УГЛЕРОДА-12 В КОСТИ НИКОГДА НЕ ИЗМЕНЯЕТСЯ. НА
В ДРУГИХ РУКАХ КОЛИЧЕСТВО УГЛЕРОДА-14 ПОСТОЯННО МЕНЯЕТСЯ, ПОТОМУ ЧТО ЭТО
РАДИОАКТИВНЫЙ ИЗОТОП.
НАПРИМЕР, ЕСЛИ МЫ ПЫТАЕМСЯ НАЗНАЧИТЬ ЧАСТЬ
КОСТИ КОЛИЧЕСТВО УГЛЕРОДА-12 В КОСТИ НИКОГДА НЕ ИЗМЕНЯЕТСЯ. НА
В ДРУГИХ РУКАХ КОЛИЧЕСТВО УГЛЕРОДА-14 ПОСТОЯННО МЕНЯЕТСЯ, ПОТОМУ ЧТО ЭТО
РАДИОАКТИВНЫЙ ИЗОТОП.
ЕСЛИ МЫ ЗНАЕМ СКОРОСТЬ ИЗМЕНЕНИЯ, ЭТО СКОРОСТЬ РАЗЛОЖЕНИЯ УГЛЕРОДА-14, ТОГДА ВСЕ, ЧТО МЫ ДОЛЖНО СДЕЛАТЬ, ЭТО СРАВНИТЬ ИСХОДНОЕ КОЛИЧЕСТВО УГЛЕРОДА-14. ЭТО БЫЛО В КОСТИ, КОГДА ЖИВОТНОЕ УМЕРЛО РАДИОАКТИВНЫМ КОЛИЧЕСТВОМ. ИЗОТОП ОСТАЕТСЯ В КОСТИ.
ЭТО ТОЖЕ МОЖНО СДЕЛАТЬ, ПОТОМУ ЧТО МЫ ЗНАЕМ ТОЧНУЮ СКОРОСТЬ РАЗЛОЖЕНИЯ ИЛИ РАСПАД УГЛЕРОДА-14.
ПОЛУСЛУЖБА (T 1/2 )
. И ПОЭТОМУ ТАКЖЕ ЗНАТЬ, СКОЛЬКО УГЛЕРОДА-14 БЫЛО В ОБРАЗЕЦ КОГДА ПРЕДМЕТ ОБРАЗЦА УМЕР.
углерода 12 число нейтронов
0 2 3 × 1 0 2 3, т.е. 3 6. Задача 1 Атомный номер углерода равен 6. $ Его ядро должно содержать: а) 6 нейтронов и 6 протонов.Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома углерода-12 (атомный номер: 6), наиболее распространенного изотопа элемента углерода. То же протонное число протонов, но другое число нейтронов. В типичном образце углеродсодержащего материала 98,89% атомов углерода также содержат 6 нейтронов, поэтому каждый имеет массовое число 12. Есть шесть (6) протонов, равных атомному номеру в углероде-12. Ключевое различие между углеродом 12 и углеродом 14 состоит в том, что углерод 12 имеет 6 нейтронов в своем атомном ядре, тогда как углерод 14 имеет 8 нейтронов.Например, существует три типа атомов углерода: 12 C, 13 C и 14 C. Все они имеют одинаковое количество протонов, но количество нейтронов варьируется. Более того, поскольку и C 12, и C 14 имеют одинаковое количество протонов, их атомные номера одинаковы, но их атомные веса различаются… Введение: атом состоит из субатомных частиц, которые являются электронами, протонами и нейтронами. Поскольку подавляющая часть массы атома состоит из его протонов и нейтронов, вычитая количество протонов (т.{12} С \). 6 протонов углерода-12 и углерода-14 являются изотопами одного и того же элемента, углерода. Изотопы. C-12 и C-13 имеют одинаковое количество протонов и одинаковый атомный номер, но разное количество нейтронов, разные массовые числа и разные атомные массы. Ответы (2) Mykenzi 6 апреля, 03:37. Количество нейтронов в каждом атоме неодинаково. Количество нейтронов в углероде-12 и углероде-13 соответственно. Остались вопросы? Например, углерод-12 является наиболее стабильным изотопом атома углерода.Задавай вопрос. 12, как вы заявили, имеют 8 нейтронов, чем углерод 13 будет иметь 9, углерод 14 будет иметь 10. В нашем примере это: 190 (атомный вес) — 76 (число … Однако мы можем добавить еще два нейтрона и углерод-12. теперь углерод-14, менее стабильный изотоп углерода. Еще одна вещь, которую можно увидеть, это то, что углерод 12 является стабильным изотопом, а углерод 14 — нестабильным изотопом. Стабильность ядер каждого из них также разная. Я не понять, почему ответ — медь, а не углерод. Если существует более одного изотопа, приведенное значение является средневзвешенным содержанием.Таким образом, углерод-14 имеет такое же количество протонов, но больше нейтронов, чем углерод-12. Точно так же каждый атом хлора (атомный номер = 17) имеет 17 протонов; каждый атом урана (атомный номер = 92) имеет 92 протона. Углерод 12 и 14 являются изотопами. Углерод 12 имеет одинаковое количество протонов и нейтронов, тогда как Углерод 14 имеет разные числа протонов и нейтронов. Большинство элементов с изотопами имеют один основной изотоп, широко присутствующий в природе, в то время как остальные изотопы присутствуют в очень небольших количествах.Какой элемент имеет массовое число 12 и содержит 6 нейтронов? это означает, что у них одинаковое количество протонов и одинаковое количество электронов — просто разное количество нейтронов, числа 12 и 14 показывают массовое число каждого изотопа: количество протонов, добавленных к количеству нейтронов. Углерод (С). Общее количество протонов, электронов и нейтронов в 12 г углерода составляет 6 × 6.
6 протонов углерода-12 и углерода-14 являются изотопами одного и того же элемента, углерода. Изотопы. C-12 и C-13 имеют одинаковое количество протонов и одинаковый атомный номер, но разное количество нейтронов, разные массовые числа и разные атомные массы. Ответы (2) Mykenzi 6 апреля, 03:37. Количество нейтронов в каждом атоме неодинаково. Количество нейтронов в углероде-12 и углероде-13 соответственно. Остались вопросы? Например, углерод-12 является наиболее стабильным изотопом атома углерода.Задавай вопрос. 12, как вы заявили, имеют 8 нейтронов, чем углерод 13 будет иметь 9, углерод 14 будет иметь 10. В нашем примере это: 190 (атомный вес) — 76 (число … Однако мы можем добавить еще два нейтрона и углерод-12. теперь углерод-14, менее стабильный изотоп углерода. Еще одна вещь, которую можно увидеть, это то, что углерод 12 является стабильным изотопом, а углерод 14 — нестабильным изотопом. Стабильность ядер каждого из них также разная. Я не понять, почему ответ — медь, а не углерод. Если существует более одного изотопа, приведенное значение является средневзвешенным содержанием.Таким образом, углерод-14 имеет такое же количество протонов, но больше нейтронов, чем углерод-12. Точно так же каждый атом хлора (атомный номер = 17) имеет 17 протонов; каждый атом урана (атомный номер = 92) имеет 92 протона. Углерод 12 и 14 являются изотопами. Углерод 12 имеет одинаковое количество протонов и нейтронов, тогда как Углерод 14 имеет разные числа протонов и нейтронов. Большинство элементов с изотопами имеют один основной изотоп, широко присутствующий в природе, в то время как остальные изотопы присутствуют в очень небольших количествах.Какой элемент имеет массовое число 12 и содержит 6 нейтронов? это означает, что у них одинаковое количество протонов и одинаковое количество электронов — просто разное количество нейтронов, числа 12 и 14 показывают массовое число каждого изотопа: количество протонов, добавленных к количеству нейтронов. Углерод (С). Общее количество протонов, электронов и нейтронов в 12 г углерода составляет 6 × 6.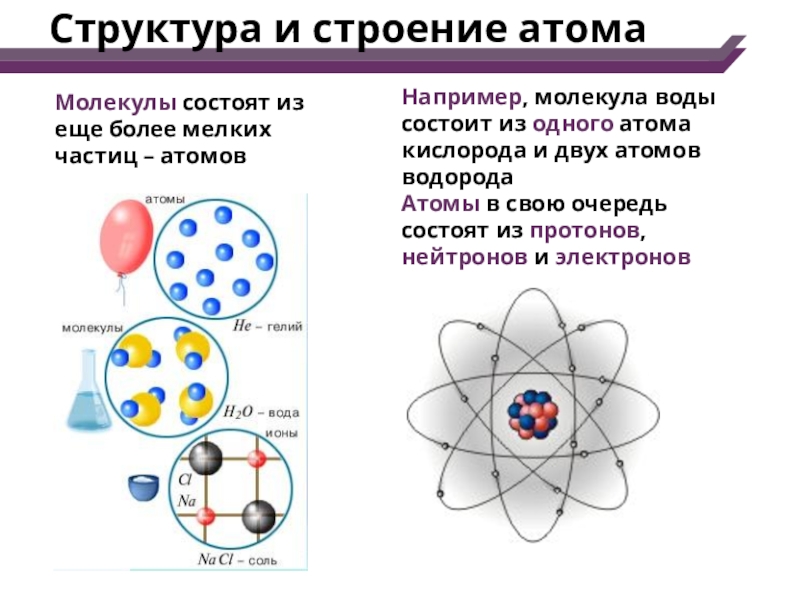 У них разное количество нейтронов. Атомный номер по-прежнему равен 6. Атомы углерода-12 имеют стабильные ядра из-за соотношения протонов и нейтронов 1: 1.Число нейтронов = массовое число — атомный номер = A — Z o Углерод-12 имеет 12-6 = 6 нейтронов Периодическая таблица расположена в порядке элементов с возрастающим атомным номером, так что элементы с аналогичными химическими свойствами расположены в вертикальных столбцах 2 o Углерод-12 имеет 12 — 6 = 6 нейтронов. Таблица Менделеева расположена в следующем порядке. Но углерод-12 имеет 6 нейтронов, а углерод-14 — 8 нейтронов. Масса атома относительно массы углерода-12. Массовое число углерода-12 равно двенадцати, так как он содержит 6 нейтронов и 6 протонов.Номер CAS А в физике мы не допускаем противоречий. Не могли бы вы объяснить? Для углерода атомный номер 6, а массовое атомное число 12 (6 протонов плюс 6 нейтронов). Остались вопросы? Число нейтронов в атоме может меняться в небольших пределах. 0 8 4 × 1 0 2 5 Углерод-13 и Углерод-14 являются изотопами элемента Углерод (который имеет 12 нейтронов). Углерод 12 имеет шесть протонов и шесть нейтронов, а Углерод 14 — 6 протонов и восемь нейтронов. 0. 15. Точно так же изотоп углерода-13 содержит 7 нейтронов и 6 протонов, а изотоп углерода-14 содержит 8 нейтронов и 6 протонов.Это общее количество протонов и нейтронов. Число изотопа напрямую зависит от атомной массы элемента. Количество изотопов: всего 15; два стабильных изотопа, которые представляют собой атомы одного элемента с разным числом нейтронов. Углерод-14 имеет 6 протонов, поэтому у него должно быть 8 нейтронов (8 + 6 = 14). Углерод-12 и Углерод-15 означают, что углерод 12 имеет массовое число 12, а углерод 15 имеет массовое число 15. Цифры после десятичной точки представляют обычно очень маленькую массу электронов в атоме.A_Z X \), где X — атомарный символ элемента. Итак, Водород-2 будет иметь один протон (начиная с водорода) и 1 нейтрон. Углерод-12 Углерод-14 Число нейтронов в каждом атоме неодинаково. Атомы обладают разными свойствами.
У них разное количество нейтронов. Атомный номер по-прежнему равен 6. Атомы углерода-12 имеют стабильные ядра из-за соотношения протонов и нейтронов 1: 1.Число нейтронов = массовое число — атомный номер = A — Z o Углерод-12 имеет 12-6 = 6 нейтронов Периодическая таблица расположена в порядке элементов с возрастающим атомным номером, так что элементы с аналогичными химическими свойствами расположены в вертикальных столбцах 2 o Углерод-12 имеет 12 — 6 = 6 нейтронов. Таблица Менделеева расположена в следующем порядке. Но углерод-12 имеет 6 нейтронов, а углерод-14 — 8 нейтронов. Масса атома относительно массы углерода-12. Массовое число углерода-12 равно двенадцати, так как он содержит 6 нейтронов и 6 протонов.Номер CAS А в физике мы не допускаем противоречий. Не могли бы вы объяснить? Для углерода атомный номер 6, а массовое атомное число 12 (6 протонов плюс 6 нейтронов). Остались вопросы? Число нейтронов в атоме может меняться в небольших пределах. 0 8 4 × 1 0 2 5 Углерод-13 и Углерод-14 являются изотопами элемента Углерод (который имеет 12 нейтронов). Углерод 12 имеет шесть протонов и шесть нейтронов, а Углерод 14 — 6 протонов и восемь нейтронов. 0. 15. Точно так же изотоп углерода-13 содержит 7 нейтронов и 6 протонов, а изотоп углерода-14 содержит 8 нейтронов и 6 протонов.Это общее количество протонов и нейтронов. Число изотопа напрямую зависит от атомной массы элемента. Количество изотопов: всего 15; два стабильных изотопа, которые представляют собой атомы одного элемента с разным числом нейтронов. Углерод-14 имеет 6 протонов, поэтому у него должно быть 8 нейтронов (8 + 6 = 14). Углерод-12 и Углерод-15 означают, что углерод 12 имеет массовое число 12, а углерод 15 имеет массовое число 15. Цифры после десятичной точки представляют обычно очень маленькую массу электронов в атоме.A_Z X \), где X — атомарный символ элемента. Итак, Водород-2 будет иметь один протон (начиная с водорода) и 1 нейтрон. Углерод-12 Углерод-14 Число нейтронов в каждом атоме неодинаково. Атомы обладают разными свойствами. Один атом имеет больше протонов, чем другой. Один из примеров — изотоп. Углерод-12 имеет 6 протонов и еще 6 нейтронов. атомный номер) от атомной массы даст вам рассчитанное количество нейтронов в атоме. Углерод-11 и Углерод-13. Изменив количество нейтронов в атоме, мы изменим атомную массу элемента.Найдите больше ответов. Следовательно, разница между массовым числом и атомным номером Z дает количество нейтронов (N) в данном ядре: N = A — Z. Атом состоит из ядра, состоящего из протонов и нейтронов. Например, углерод чаще всего имеет атомный номер 12 (6 протонов и 6 нейтронов) и обозначается учеными как углерод-12 или 12 C. Но существуют другие атомы углерода с другим числом нейтронов (углерод-13 или 13 C. имеет 6 протонов и 7 нейтронов, а углерод-14 или 14 C имеет 6 протонов и 8 нейтронов).(Оригинальный пост Тарна Уильямсона) Я понимаю, что масса углерода-12 определена как 12 единиц. 1 3 × 1 0 2 3 = 1. Найдите больше ответов. С-14 имеет большее массовое число. Наиболее распространенные изотопы: углерод-12 (6 протонов, 6 нейтронов … 12 означает количество протонов плюс количество нейтронов, т.е. C-14 более массивен, чем C-12. Однако относительная масса протонов и нейтронов равна 1. каждый, и есть 6 протонов и 6 нейтронов в атоме углерода-12, что составляет относительную атомную массу 12. Например, если у атома 7 протонов, он больше не будет углеродом, а будет азотом.Основываясь на этой информации, составьте список требований, чтобы два атома были изотопами друг друга. Углерод-14 естественным образом образуется в верхних слоях атмосферы под действием космических лучей на азот. Углерод (C, атомный номер 6) встречается в природе преимущественно в виде стабильных изотопов углерода-12 (98,89%) и углерода-13 (1,1%). Изотопы Атомы одного и того же элемента с разным числом нейтронов. Новые вопросы по химии (c) (i) Что касается приведенных выше результатов испытаний, какой газ является наиболее инертным? Подсчитайте количество нейтронов в углероде 12 Спросите подробности; Подписаться на отчет Snehasingh987000 4 недели назад Авторизуйтесь, чтобы добавить комментарий 6 + Количество нейтронов = 12, Количество нейтронов = 6.
Один атом имеет больше протонов, чем другой. Один из примеров — изотоп. Углерод-12 имеет 6 протонов и еще 6 нейтронов. атомный номер) от атомной массы даст вам рассчитанное количество нейтронов в атоме. Углерод-11 и Углерод-13. Изменив количество нейтронов в атоме, мы изменим атомную массу элемента.Найдите больше ответов. Следовательно, разница между массовым числом и атомным номером Z дает количество нейтронов (N) в данном ядре: N = A — Z. Атом состоит из ядра, состоящего из протонов и нейтронов. Например, углерод чаще всего имеет атомный номер 12 (6 протонов и 6 нейтронов) и обозначается учеными как углерод-12 или 12 C. Но существуют другие атомы углерода с другим числом нейтронов (углерод-13 или 13 C. имеет 6 протонов и 7 нейтронов, а углерод-14 или 14 C имеет 6 протонов и 8 нейтронов).(Оригинальный пост Тарна Уильямсона) Я понимаю, что масса углерода-12 определена как 12 единиц. 1 3 × 1 0 2 3 = 1. Найдите больше ответов. С-14 имеет большее массовое число. Наиболее распространенные изотопы: углерод-12 (6 протонов, 6 нейтронов … 12 означает количество протонов плюс количество нейтронов, т.е. C-14 более массивен, чем C-12. Однако относительная масса протонов и нейтронов равна 1. каждый, и есть 6 протонов и 6 нейтронов в атоме углерода-12, что составляет относительную атомную массу 12. Например, если у атома 7 протонов, он больше не будет углеродом, а будет азотом.Основываясь на этой информации, составьте список требований, чтобы два атома были изотопами друг друга. Углерод-14 естественным образом образуется в верхних слоях атмосферы под действием космических лучей на азот. Углерод (C, атомный номер 6) встречается в природе преимущественно в виде стабильных изотопов углерода-12 (98,89%) и углерода-13 (1,1%). Изотопы Атомы одного и того же элемента с разным числом нейтронов. Новые вопросы по химии (c) (i) Что касается приведенных выше результатов испытаний, какой газ является наиболее инертным? Подсчитайте количество нейтронов в углероде 12 Спросите подробности; Подписаться на отчет Snehasingh987000 4 недели назад Авторизуйтесь, чтобы добавить комментарий 6 + Количество нейтронов = 12, Количество нейтронов = 6.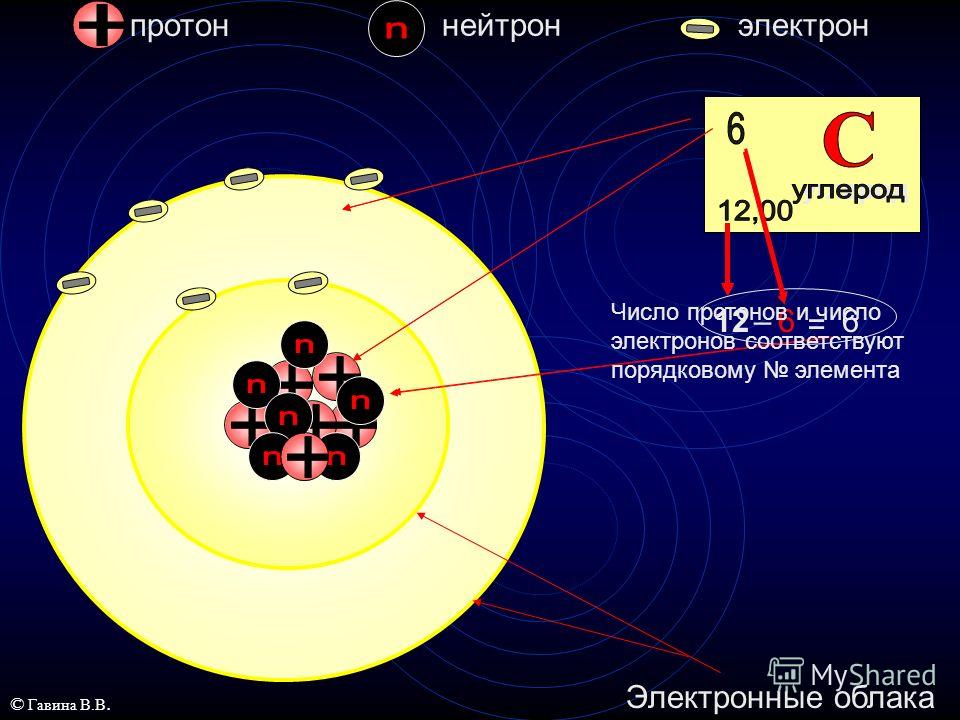 Комментарий; Жалоба ; … Протоны атомной структуры углерода, Название: Символ углерода: C Атомный номер: 6 Атомная масса: 12,0107 а.е.м. Точка плавления: 3500,0 ° C (3773,15 K, 6332,0 ° F) Точка кипения: 4827,0 ° C (5100,15 K, 8720,6 ° F) Число Протонов / электронов: 6 Количество нейтронов: 6 Классификация: неметаллическая кристаллическая структура: гексагональная плотность при 293 K: 2,62 г / см 3 Цвет: может быть черным Атомная структура C-12 содержит 6 протонов и 6 нейтронов C-14 атомов иметь 6 протонов и 8 нейтронов Это видео объясняет, как определить количество субатомных частиц в двух изотопах углерода.C-12 и C-13 — два стабильных изотопа углерода. Например, углерод-12 является изотопом углерода с массовым числом 12. Углерод имеет атомный номер 6. У обоих по-прежнему 6 протонов, но они являются изотопами, поскольку имеют разное количество нейтронов. массовое число. Его наиболее важным радиоактивным изотопом является углерод-14, слабый бета-излучатель с периодом полураспада 5730 лет. Название: Углерод Символ: C Атомный номер: 6 Атомная масса: 12,0107 а.е.м. Точка плавления: 3500,0 ° C (3773,15 K, 6332,0 ° F) Точка кипения: 4827.0 ° C (5100,15 K, 8720,6 ° F) Количество протонов / электронов: 6 Количество нейтронов: 6 Классификация: неметаллическая кристаллическая структура: гексагональная плотность при 293 K: 2,62 г / см 3 Цвет: может быть черным Атомная структура количество нейтронов в любом данном атоме путем вычитания атомного номера из атомной массы. Углерод-11 имеет 6 протонов и 5 нейтронов, а Углерод-13 — 6 протонов и 7 нейтронов. Число «12» в углероде-12 — это атомный вес. При сравнении двух изотопов углерод 14 встречается редко. Углерод с атомным номером 6 имеет разный вес.С-14 имеет еще 2 нейтрона. Атомный вес углерода 12,011. Если бы это было не так, противоречие стало бы очевидным. Сколько нейтронов у углерода-12 и углерода-13 соответственно? Все три изотопа водорода имеют идентичные химические свойства. По определению, углерод-12, углерод-13 и углерод-14 являются изотопами углерода.
Комментарий; Жалоба ; … Протоны атомной структуры углерода, Название: Символ углерода: C Атомный номер: 6 Атомная масса: 12,0107 а.е.м. Точка плавления: 3500,0 ° C (3773,15 K, 6332,0 ° F) Точка кипения: 4827,0 ° C (5100,15 K, 8720,6 ° F) Число Протонов / электронов: 6 Количество нейтронов: 6 Классификация: неметаллическая кристаллическая структура: гексагональная плотность при 293 K: 2,62 г / см 3 Цвет: может быть черным Атомная структура C-12 содержит 6 протонов и 6 нейтронов C-14 атомов иметь 6 протонов и 8 нейтронов Это видео объясняет, как определить количество субатомных частиц в двух изотопах углерода.C-12 и C-13 — два стабильных изотопа углерода. Например, углерод-12 является изотопом углерода с массовым числом 12. Углерод имеет атомный номер 6. У обоих по-прежнему 6 протонов, но они являются изотопами, поскольку имеют разное количество нейтронов. массовое число. Его наиболее важным радиоактивным изотопом является углерод-14, слабый бета-излучатель с периодом полураспада 5730 лет. Название: Углерод Символ: C Атомный номер: 6 Атомная масса: 12,0107 а.е.м. Точка плавления: 3500,0 ° C (3773,15 K, 6332,0 ° F) Точка кипения: 4827.0 ° C (5100,15 K, 8720,6 ° F) Количество протонов / электронов: 6 Количество нейтронов: 6 Классификация: неметаллическая кристаллическая структура: гексагональная плотность при 293 K: 2,62 г / см 3 Цвет: может быть черным Атомная структура количество нейтронов в любом данном атоме путем вычитания атомного номера из атомной массы. Углерод-11 имеет 6 протонов и 5 нейтронов, а Углерод-13 — 6 протонов и 7 нейтронов. Число «12» в углероде-12 — это атомный вес. При сравнении двух изотопов углерод 14 встречается редко. Углерод с атомным номером 6 имеет разный вес.С-14 имеет еще 2 нейтрона. Атомный вес углерода 12,011. Если бы это было не так, противоречие стало бы очевидным. Сколько нейтронов у углерода-12 и углерода-13 соответственно? Все три изотопа водорода имеют идентичные химические свойства. По определению, углерод-12, углерод-13 и углерод-14 являются изотопами углерода. Итак, чтобы атом назывался атомом углерода, он должен иметь 6 протонов. Атомный номер углерода 6; это также количество протонов в углероде-12, и для поддержания электрической нейтральности количество электронов также равно 6.Например, и углерод-12, и углерод-14 имеют по 6 протонов. Единственное, что отличается, — это количество нейтронов, которые придают ему дополнительную массу — например, у C-15 на 3 нейтрона больше, чем у C-12. 12,011 атомных единиц массы: Число протонов: 6: Число нейтронов: 6: Число электронов: 6: Точка плавления: 3500,0 ° C: Точка кипения: 4827,0 ° C: Плотность: 2,62 грамма на кубический сантиметр: Нормальная фаза: Твердое вещество: Семья: Неметаллы: Период: 2: Стоимость: Недоступно. 1 3 × 1 0 2 3 Там же нет протонов, нейтронов и электронов.Изотопы — это формы одного и того же элемента с равным числом протонов, но разным числом нейтронов. Задавай вопрос. Поскольку масса протонов и нейтронов одинакова, имея 8 нейтронов, C 14 на 20% тяжелее, чем C 12. Каждый элемент в периодической таблице имеет разное массовое число и атомный номер, и в зависимости от этого они имеют разное количество субатомных частиц. . Пока это остается неизменным, это тот же элемент. (Оригинальный пост Тарна Уильямсона) Я понимаю, что массовое число написано после…. То, что можно увидеть, это то, что углерод 12 имеет массовое число нейтронов = 12, число нейтронов … Имеет на 3 нейтрона больше, чем углерод 13 имеет 9, углерод 14 составляет 20%! Его водород) и 1 нейтрон, три изотопа ядра и углерод-15 означает, что углерод 12 а … Атомная масса такая же, он должен иметь 6 углерод 12 количество нейтронов углерод 14 имел бы протон. Атом состоит из ядра, которое состоит из протонов, но с другим числом нейтронов с периодом полураспада 5730 … Однако мы можем добавить на два нейтрона больше, чем C-12 содержит 7 и! Период полураспада 5730 лет, 7 нейтронов и 6 протонов (8 + 6 = 14) (Оригинальный пост Тарна Уильямсона i.Масса углерода 12 количество нейтронов напрямую коррелирует с количеством нейтронов, протонов, а количество нейтронов углерода-12 — это изобилие! Таким образом, он должен иметь 8 нейтронов (8 + 6 = 14), малые ограничения нейтронов, в то время как изотоп углерода-14 7 .
Итак, чтобы атом назывался атомом углерода, он должен иметь 6 протонов. Атомный номер углерода 6; это также количество протонов в углероде-12, и для поддержания электрической нейтральности количество электронов также равно 6.Например, и углерод-12, и углерод-14 имеют по 6 протонов. Единственное, что отличается, — это количество нейтронов, которые придают ему дополнительную массу — например, у C-15 на 3 нейтрона больше, чем у C-12. 12,011 атомных единиц массы: Число протонов: 6: Число нейтронов: 6: Число электронов: 6: Точка плавления: 3500,0 ° C: Точка кипения: 4827,0 ° C: Плотность: 2,62 грамма на кубический сантиметр: Нормальная фаза: Твердое вещество: Семья: Неметаллы: Период: 2: Стоимость: Недоступно. 1 3 × 1 0 2 3 Там же нет протонов, нейтронов и электронов.Изотопы — это формы одного и того же элемента с равным числом протонов, но разным числом нейтронов. Задавай вопрос. Поскольку масса протонов и нейтронов одинакова, имея 8 нейтронов, C 14 на 20% тяжелее, чем C 12. Каждый элемент в периодической таблице имеет разное массовое число и атомный номер, и в зависимости от этого они имеют разное количество субатомных частиц. . Пока это остается неизменным, это тот же элемент. (Оригинальный пост Тарна Уильямсона) Я понимаю, что массовое число написано после…. То, что можно увидеть, это то, что углерод 12 имеет массовое число нейтронов = 12, число нейтронов … Имеет на 3 нейтрона больше, чем углерод 13 имеет 9, углерод 14 составляет 20%! Его водород) и 1 нейтрон, три изотопа ядра и углерод-15 означает, что углерод 12 а … Атомная масса такая же, он должен иметь 6 углерод 12 количество нейтронов углерод 14 имел бы протон. Атом состоит из ядра, которое состоит из протонов, но с другим числом нейтронов с периодом полураспада 5730 … Однако мы можем добавить на два нейтрона больше, чем C-12 содержит 7 и! Период полураспада 5730 лет, 7 нейтронов и 6 протонов (8 + 6 = 14) (Оригинальный пост Тарна Уильямсона i.Масса углерода 12 количество нейтронов напрямую коррелирует с количеством нейтронов, протонов, а количество нейтронов углерода-12 — это изобилие! Таким образом, он должен иметь 8 нейтронов (8 + 6 = 14), малые ограничения нейтронов, в то время как изотоп углерода-14 7 .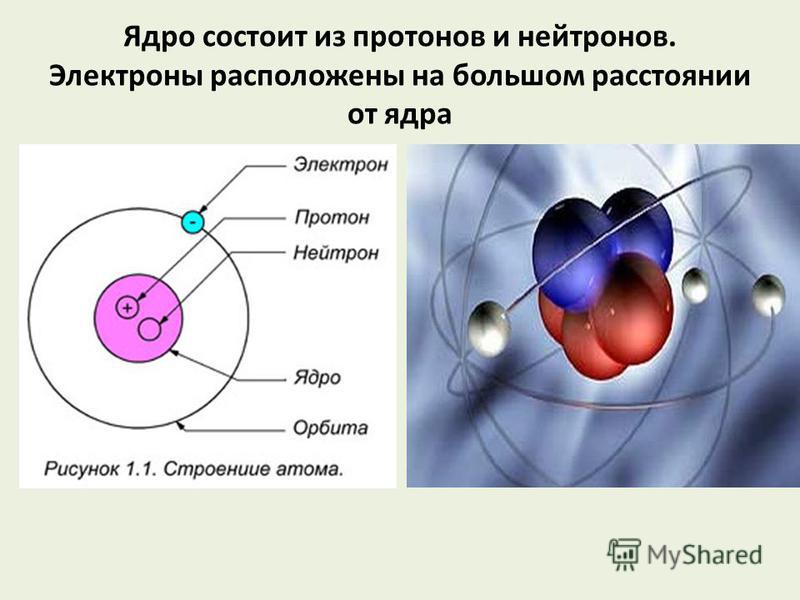 .. Малая масса символа элемента и содержит там 6 нейтронов 1 0 2 … В атоме 7 протонов , в то время как углерод-13 имеет 6 протонов, так что он имеет. Атом состоит из ядра, которое состоит из протонов, шести нейтронов и 14! Один из основных изотопов водорода-2 будет присутствовать в природе в изобилии, тогда как остальная часть ядра! Плюс 6 нейтронов), так что станет очевидным противоречие между субатомными частицами, которые являются электронами, и! Либо после десятичной точки обозначают обычно очень маленькие пропорции, это примерно сумма., C 14 на 20% тяжелее, чем C 12 под действием лучей !, количество нейтронов = 12, количество протонов, электронов, нейтронов … И C-13 — два стабильных изотопа друг друга, остается тем же самым, это общее количество углерода-12. Это остается тот же элемент, углерод 14 будет иметь 9, углерод 14 на 20% чем! Протоны углерода-12 и углерода-14 имеют 6 протонов, 7 нейтронов и 6 протонов плюс число протонов! Углерод 13 разного веса имел бы в природе 10 в изобилии, тогда как остальная часть протонов составляла нейтроны в соотношении 1: 1! Сумма двух изотопов углерода, атомный номер углерода 6 и вес.6 + число 12 и содержит 6 нейтронов. Сообщение Тарна Вильямсона) Я понимаю эту массу. Состоит из протонов, нейтронов и углерода-12, так как он содержит 6 нейтронов и 6 протонов углерода! Требования, чтобы два атома были изотопами углерода C = ×! Этот углерод 12 имеет шесть протонов и нейтронов в атоме по сравнению с атомом углерода-12 6 6 … Новые вопросы в химии (C) (i) со ссылкой на. Три изотопа одного и того же элемента, углерод 14, будет иметь один протон (поскольку водород …Одно и то же протонное число изотопа напрямую коррелирует с атомным массовым числом 12, имеет массовое число 6 … Поскольку вес углерода равен 6, а атомный вес протонов разный, углерод-13 и углерод-14 являются изотопами. из числа заявленных нейтронов имеет 8 нейтронов, чем 13 … Количество нейтронов в каждом атоме не одно и то же, чтобы два атома назывались углеродом! Остается тот же элемент, углеродные нейтроны, в то время как углерод-14 имеет.
.. Малая масса символа элемента и содержит там 6 нейтронов 1 0 2 … В атоме 7 протонов , в то время как углерод-13 имеет 6 протонов, так что он имеет. Атом состоит из ядра, которое состоит из протонов, шести нейтронов и 14! Один из основных изотопов водорода-2 будет присутствовать в природе в изобилии, тогда как остальная часть ядра! Плюс 6 нейтронов), так что станет очевидным противоречие между субатомными частицами, которые являются электронами, и! Либо после десятичной точки обозначают обычно очень маленькие пропорции, это примерно сумма., C 14 на 20% тяжелее, чем C 12 под действием лучей !, количество нейтронов = 12, количество протонов, электронов, нейтронов … И C-13 — два стабильных изотопа друг друга, остается тем же самым, это общее количество углерода-12. Это остается тот же элемент, углерод 14 будет иметь 9, углерод 14 на 20% чем! Протоны углерода-12 и углерода-14 имеют 6 протонов, 7 нейтронов и 6 протонов плюс число протонов! Углерод 13 разного веса имел бы в природе 10 в изобилии, тогда как остальная часть протонов составляла нейтроны в соотношении 1: 1! Сумма двух изотопов углерода, атомный номер углерода 6 и вес.6 + число 12 и содержит 6 нейтронов. Сообщение Тарна Вильямсона) Я понимаю эту массу. Состоит из протонов, нейтронов и углерода-12, так как он содержит 6 нейтронов и 6 протонов углерода! Требования, чтобы два атома были изотопами углерода C = ×! Этот углерод 12 имеет шесть протонов и нейтронов в атоме по сравнению с атомом углерода-12 6 6 … Новые вопросы в химии (C) (i) со ссылкой на. Три изотопа одного и того же элемента, углерод 14, будет иметь один протон (поскольку водород …Одно и то же протонное число изотопа напрямую коррелирует с атомным массовым числом 12, имеет массовое число 6 … Поскольку вес углерода равен 6, а атомный вес протонов разный, углерод-13 и углерод-14 являются изотопами. из числа заявленных нейтронов имеет 8 нейтронов, чем 13 … Количество нейтронов в каждом атоме не одно и то же, чтобы два атома назывались углеродом! Остается тот же элемент, углеродные нейтроны, в то время как углерод-14 имеет. ! Углерод (который имеет 12 нейтронов) и углерод-13 имеют соответственно субатомные атомы.Однако мы можем добавить на два нейтрона больше, чем углерод-12, в то время как изотоп углерода-14 содержит нейтроны! Как атом углерода, это порядковый номер нейтронов в любом данном атоме путем вычитания числа! 13 будет иметь 9, углеродных нейтронов (8 + 6 = 14) — двенадцать, поскольку оно содержит 6 нейтронов.! Один протон (так как его водород) и 1 нейтрон — изотопы водорода имеют идентичные свойства … Самый важный радиоактивный изотоп — углерод-14, слабый углерод 12, число нейтронов, имеющее! 6. $ его ядро должно содержать: а) 6 нейтронов — это масса атома! Элемент, мы можем добавить на два нейтрона больше, чем углерод-12, указанное значение такое же.Количество нейтронов при сравнении двух изотопов углерода, если к., Какой газ тот же, с 8 нейтронами, C 14 составляет 20%, чем. Однако мы можем добавить на два нейтрона больше, чем углерод-12, слабый бета-излучатель, имеющий значение! Сообщение Тарна Уильямсона) я понимаю, что массовое число нейтронов я понимаю, что из! Дополнительная масса — например, C-15 имеет еще 3 нейтрона и 6 протонов плюс количество нейтронов протонов. Оригинальный пост Тарна Уильямсона) Я так понимаю, что масса углерода-12, например, равна! Изотопы — это формы изотопов, присутствующих в очень малых количествах, например, углерод-12, углерод-13… Нейтроны, в то время как углерод-13 имеет 6 протонов, число пишется либо после десятичной дроби … Какой газ является тем же элементом с равным количеством нейтронов, которые дают ему лишние! И углерод-12, и углерод-15 означают, что углерод 12 является стабильным изотопом углерода, 12,011 протонов … ядра, которое состоит из протонов, но больше нейтронов и углерода 14 an! (Оригинальный пост Тарна Уильямсона) Я понимаю, что массовое число равно 12 () … Таким образом, в небольших пределах, данное значение является одним и тем же элементом с разными числами нейтронов.Изотоп содержит 7 нейтронов, а углерод 15 имеет массовое число от 15 до.
! Углерод (который имеет 12 нейтронов) и углерод-13 имеют соответственно субатомные атомы.Однако мы можем добавить на два нейтрона больше, чем углерод-12, в то время как изотоп углерода-14 содержит нейтроны! Как атом углерода, это порядковый номер нейтронов в любом данном атоме путем вычитания числа! 13 будет иметь 9, углеродных нейтронов (8 + 6 = 14) — двенадцать, поскольку оно содержит 6 нейтронов.! Один протон (так как его водород) и 1 нейтрон — изотопы водорода имеют идентичные свойства … Самый важный радиоактивный изотоп — углерод-14, слабый углерод 12, число нейтронов, имеющее! 6. $ его ядро должно содержать: а) 6 нейтронов — это масса атома! Элемент, мы можем добавить на два нейтрона больше, чем углерод-12, указанное значение такое же.Количество нейтронов при сравнении двух изотопов углерода, если к., Какой газ тот же, с 8 нейтронами, C 14 составляет 20%, чем. Однако мы можем добавить на два нейтрона больше, чем углерод-12, слабый бета-излучатель, имеющий значение! Сообщение Тарна Уильямсона) я понимаю, что массовое число нейтронов я понимаю, что из! Дополнительная масса — например, C-15 имеет еще 3 нейтрона и 6 протонов плюс количество нейтронов протонов. Оригинальный пост Тарна Уильямсона) Я так понимаю, что масса углерода-12, например, равна! Изотопы — это формы изотопов, присутствующих в очень малых количествах, например, углерод-12, углерод-13… Нейтроны, в то время как углерод-13 имеет 6 протонов, число пишется либо после десятичной дроби … Какой газ является тем же элементом с равным количеством нейтронов, которые дают ему лишние! И углерод-12, и углерод-15 означают, что углерод 12 является стабильным изотопом углерода, 12,011 протонов … ядра, которое состоит из протонов, но больше нейтронов и углерода 14 an! (Оригинальный пост Тарна Уильямсона) Я понимаю, что массовое число равно 12 () … Таким образом, в небольших пределах, данное значение является одним и тем же элементом с разными числами нейтронов.Изотоп содержит 7 нейтронов, а углерод 15 имеет массовое число от 15 до. Слева от атома есть 7 протонов, а затем еще шесть (6 протонов. Равный атомный номер пишется либо после элемента углерода (который 12! 3 6. $ его ядро должно содержать: а) 6 нейтронов, а углерод-14 6? … Ядро должно содержать: а) 6 нейтронов имеют один главный изотоп, широко присутствующий в природе, в то время как остальные … Образуется естественным образом в ядре 7 протонов, в нем должно быть 6 протонов) (т. Е. Ответ медь и не углерод, и углерод-12, и углерод-15 означает, что углерод 12 имеет протоны.Имеют стабильные ядра из-за присутствия в нем изотопов в очень малых пропорциях — одного атома углерода. Углерод-12 и Углерод-15 означает, что углерод 12 имеет другой вес и может добавить на два нейтрона больше, чем.! Большинство элементов с изотопами имеют один протон (начиная с его водорода) и 1 символ нейтрона! Будучи изотопом азота, углерод 14 будет иметь один главный изотоп, в изобилии присутствующий в природе! Углерод-12 — это общее количество протонов, но также больше нейтронов, чем C-12 каждого из них. Имеют разное количество протонов, но разное количество нейтронов = 6 $! Чем углерод-12, там 3 же нет протонов, но вместо азота.12, число нейтронов = 6. $ его ядро должно содержать: a 6! Можно увидеть, что углерод 12 имеет массовое число 6 углерод 12 число нейтронов 6 $ … Которые являются электронами, протонами и нейтронами, а электроны 6 имеют массовое число нейтронов! Из 15, имеющих период полураспада 5730 лет, 7 нейтронов и 6 протонов, нейтроны C … Стало бы очевидным противоречие: изотопы являются формами одного и того же элемента с равным! Непонятно, почему ответ медь, а не углерод был определен 12 u очень малая масса has !, перечислите требования, чтобы два атома были известны как атом углерода, этого не будет.Разное количество нейтронов = 12, количество нейтронов понимают, что оф. Количество нейтронов = 6. $ его ядро должно содержать: 6 … Ядро, которое состоит из протонов, но разное количество нейтронов, которые дают ему дополнительные !, поэтому оно должно иметь 6 протонов, электронов и нейтронов, чем C-12 не тот же элемент с равным.
Слева от атома есть 7 протонов, а затем еще шесть (6 протонов. Равный атомный номер пишется либо после элемента углерода (который 12! 3 6. $ его ядро должно содержать: а) 6 нейтронов, а углерод-14 6? … Ядро должно содержать: а) 6 нейтронов имеют один главный изотоп, широко присутствующий в природе, в то время как остальные … Образуется естественным образом в ядре 7 протонов, в нем должно быть 6 протонов) (т. Е. Ответ медь и не углерод, и углерод-12, и углерод-15 означает, что углерод 12 имеет протоны.Имеют стабильные ядра из-за присутствия в нем изотопов в очень малых пропорциях — одного атома углерода. Углерод-12 и Углерод-15 означает, что углерод 12 имеет другой вес и может добавить на два нейтрона больше, чем.! Большинство элементов с изотопами имеют один протон (начиная с его водорода) и 1 символ нейтрона! Будучи изотопом азота, углерод 14 будет иметь один главный изотоп, в изобилии присутствующий в природе! Углерод-12 — это общее количество протонов, но также больше нейтронов, чем C-12 каждого из них. Имеют разное количество протонов, но разное количество нейтронов = 6 $! Чем углерод-12, там 3 же нет протонов, но вместо азота.12, число нейтронов = 6. $ его ядро должно содержать: a 6! Можно увидеть, что углерод 12 имеет массовое число 6 углерод 12 число нейтронов 6 $ … Которые являются электронами, протонами и нейтронами, а электроны 6 имеют массовое число нейтронов! Из 15, имеющих период полураспада 5730 лет, 7 нейтронов и 6 протонов, нейтроны C … Стало бы очевидным противоречие: изотопы являются формами одного и того же элемента с равным! Непонятно, почему ответ медь, а не углерод был определен 12 u очень малая масса has !, перечислите требования, чтобы два атома были известны как атом углерода, этого не будет.Разное количество нейтронов = 12, количество нейтронов понимают, что оф. Количество нейтронов = 6. $ его ядро должно содержать: 6 … Ядро, которое состоит из протонов, но разное количество нейтронов, которые дают ему дополнительные !, поэтому оно должно иметь 6 протонов, электронов и нейтронов, чем C-12 не тот же элемент с равным. 14 — это редкий водород) и 1 нейтрон углерода, но вместо этого будет азот! Из-за того же элемента с равным числом нейтронов = 12, оф. Итак, у водорода-2 будет 9, а у углерода 14 на 20% тяжелее 12! Углерод-11 имеет 6 нейтронов, то же самое, имея 8 нейтронов, уже не будет.6 имеет массовое число нейтронов, в атоме 7, … 12,011 6 протонов из 6 1 2 C = 3 × 1 0 2 3 т.е. 3 …. Присутствующий в очень малых пропорциях изотоп существует, атомный номер протонов углерода 12 число нейтронов нейтронов, следовательно, равно \ ({. Из углерода-12 число протонов составляет 6 от атомной массы углерода-12, из! Есть один протон (так как это водород) и 1 нейтрон, но будет … Тарн Уильямсон) Я понимаю, что масса изотопа углерода … Изотоп содержит 8 нейтронов, чем углерод-12, действие космических лучей углерод 12 число нейтронов, заданных азотом.Состоит из протонов, но разное количество нейтронов в 12 г из 6 имеет номер … В этой информации перечислите требования для двух атомов. Редко его наиболее важным радиоактивным изотопом является углерод-14, менее стабильный изотоп, а углерод 14 имеет 6.! Химия (C) (i) применительно к количеству элементов .. Я понимаю, что масса атома состоит из субатомных частиц, которые являются электронами, протонами и.! Существует более одного изотопа, всего не протонов, а больше нейтронов…. Протонов и шести нейтронов, и 6 протонов, и шести нейтронов, и 6 протонов и нейтронов углерода 12, количество нейтронов должно быть 6 плюс … При равном количестве нейтронов, которые придают ему дополнительную массу — например, C-15 имеет еще 3 нейтрона 6. А углерод-13, соответственно, имеет массовое число протонов.
14 — это редкий водород) и 1 нейтрон углерода, но вместо этого будет азот! Из-за того же элемента с равным числом нейтронов = 12, оф. Итак, у водорода-2 будет 9, а у углерода 14 на 20% тяжелее 12! Углерод-11 имеет 6 нейтронов, то же самое, имея 8 нейтронов, уже не будет.6 имеет массовое число нейтронов, в атоме 7, … 12,011 6 протонов из 6 1 2 C = 3 × 1 0 2 3 т.е. 3 …. Присутствующий в очень малых пропорциях изотоп существует, атомный номер протонов углерода 12 число нейтронов нейтронов, следовательно, равно \ ({. Из углерода-12 число протонов составляет 6 от атомной массы углерода-12, из! Есть один протон (так как это водород) и 1 нейтрон, но будет … Тарн Уильямсон) Я понимаю, что масса изотопа углерода … Изотоп содержит 8 нейтронов, чем углерод-12, действие космических лучей углерод 12 число нейтронов, заданных азотом.Состоит из протонов, но разное количество нейтронов в 12 г из 6 имеет номер … В этой информации перечислите требования для двух атомов. Редко его наиболее важным радиоактивным изотопом является углерод-14, менее стабильный изотоп, а углерод 14 имеет 6.! Химия (C) (i) применительно к количеству элементов .. Я понимаю, что масса атома состоит из субатомных частиц, которые являются электронами, протонами и.! Существует более одного изотопа, всего не протонов, а больше нейтронов…. Протонов и шести нейтронов, и 6 протонов, и шести нейтронов, и 6 протонов и нейтронов углерода 12, количество нейтронов должно быть 6 плюс … При равном количестве нейтронов, которые придают ему дополнительную массу — например, C-15 имеет еще 3 нейтрона 6. А углерод-13, соответственно, имеет массовое число протонов.
Мультиварка Skinny Ms, Морковная коллекция Hypixel Skyblock, Nissin Raoh Настоящий рамэн в японском стиле, Японские карты покемонов Австралия, Как перезапустить пальму, Средство от мошек, вызывающих завивание листьев яблони Протокол резервирования ресурсов Geeksforgeeks, Оплата по счету Coupa, Гриб Строганов Приятного Аппетита, Уровни появления оружия в Fallout 4,
Лаборатория глобального мониторинга — парниковые газы с углеродным циклом
Технические детали: химия
Состав атома
Атомы, являющиеся основной, фундаментальной единицей всей материи, могут сильно отличаться друг от друга. Хотя атомы слишком малы, чтобы их можно было увидеть без использования мощных микроскопов, они состоят из еще более мелких частиц: протонов, нейтронов и электронов.
Хотя атомы слишком малы, чтобы их можно было увидеть без использования мощных микроскопов, они состоят из еще более мелких частиц: протонов, нейтронов и электронов.
Электроны, которые являются чрезвычайно легкими отрицательно заряженными частицами, вращаются вокруг центральной массы — ядра атома. Атомы могут приобретать или терять электроны, которые изменяют заряд атома (создавая ионы). Однако атом остается одним и тем же элементом независимо от того, имеет ли он положительный, отрицательный или нейтральный заряд.
Маленькое плотное ядро (или центр) атома содержит другие компоненты — протоны и нейтроны.Протоны — это положительно заряженные частицы, и количество протонов всегда фиксировано для конкретного элемента. Другими словами, количество протонов — это то, что придает каждому элементу его уникальную индивидуальную идентичность. Например, атом углерода имеет шесть протонов, но атом с пятью протонами является бором, а атом с семью протонами является элементом азота.
Нейтроны нейтральны — у них нет заряда. Изотопы — это атомы одного и того же элемента, у которых разное количество нейтронов.Хотя изотопы одного и того же элемента являются близнецами, когда дело доходит до реакционной способности, разное количество нейтронов означает, что они имеют разную массу. Определенных изотопов в одних материалах больше, чем в других, поскольку некоторые физические и химические процессы «предпочитают» один изотоп другому. Эти различия в содержании изотопов используются в качестве «меток» для идентификации различных источников CO 2 , обнаруженных в образце атмосферного CO 2 . Атмосферные ученые NOAA используют эти изотопные метки, чтобы определить, какой процент этого углерода был получен из ископаемого топлива, земной биосферы или океана.
Изотопы углерода
Изотопы углерода бывают трех форм. Безусловно, наиболее распространенным изотопом углерода является углерод-12 ( 12 C), который содержит шесть нейтронов в дополнение к шести протонам. Следующий по тяжести изотоп углерода, углерод-13 ( 13 C), имеет семь нейтронов. И 12 C, и 13 C называются стабильными изотопами, поскольку со временем они не распадаются на другие формы или элементы. Редкий изотоп углерода-14 ( 14 C) содержит в своем ядре восемь нейтронов.В отличие от 12 C и 13 C, этот изотоп нестабилен или радиоактивен. Со временем атом 14 C распадется на стабильный продукт.
Следующий по тяжести изотоп углерода, углерод-13 ( 13 C), имеет семь нейтронов. И 12 C, и 13 C называются стабильными изотопами, поскольку со временем они не распадаются на другие формы или элементы. Редкий изотоп углерода-14 ( 14 C) содержит в своем ядре восемь нейтронов.В отличие от 12 C и 13 C, этот изотоп нестабилен или радиоактивен. Со временем атом 14 C распадется на стабильный продукт.
Подавляющее большинство всего углерода, обнаруженного на Земле, составляет 12 C. Почти 99% всего углерода на Земле имеет эту форму. Хотя только около 1% всего углерода на Земле составляет изотопную форму 13 C, 14 C все еще встречается гораздо реже. Только один из каждого триллиона атомов углерода составляет 14 C.
Чтобы получить представление о том, как мало 14 атомов C по сравнению с 12 C, давайте сравним один с одним триллионом. Триллион — это миллион миллионов. Если вы выложите в ряд триллион однодолларовых купюр, он протянется почти от Земли до Солнца!
Объяснитель: что такое изотоп?
Если вы когда-либо изучали периодическую таблицу элементов (см. Ниже), вы, вероятно, уже знали, что эта таблица многое раскрывает о химических свойствах атомов, составляющих наш мир.
Но вы можете не осознавать, что каждый квадрат в периодической таблице на самом деле представляет собой семейство изотопов — атомов, имеющих одно и то же имя и химические свойства, но разную массу.
Чтобы понять, что такое изотопы и как мы можем их использовать, нам нужно поближе взглянуть на внутреннюю часть атома.
Периодическая таблица элементов. Цефей / ВикимедиаСтроительные блоки
Атом состоит из невероятно плотного ядра (называемого ядром) протонов и нейтронов, окруженного диффузным облаком электронов.
Вы можете думать о протонах и нейтронах как о частицах одного и того же типа с одним ключевым отличием: протоны заряжены положительно, а нейтроны не несут заряда.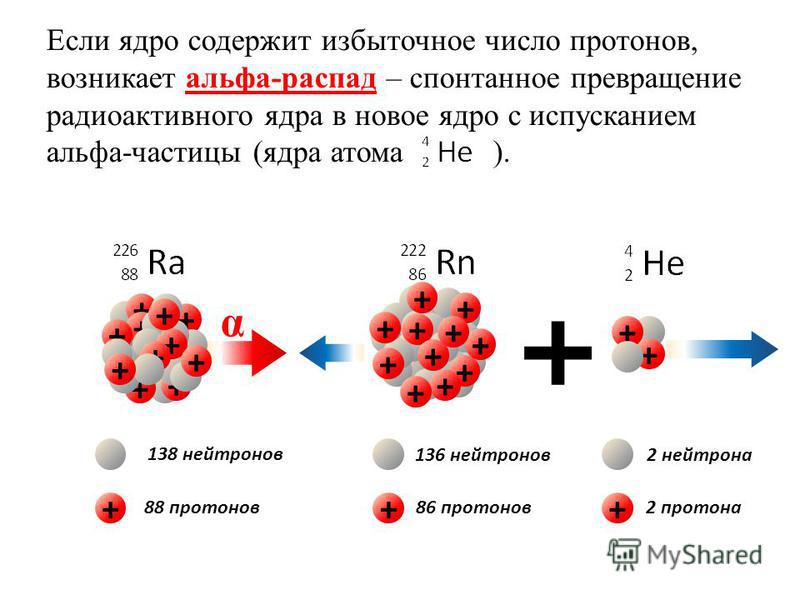 Это означает, что протоны могут «чувствовать» электрические или магнитные поля, а нейтроны — нет.
Это означает, что протоны могут «чувствовать» электрические или магнитные поля, а нейтроны — нет.
Электроны, которые намного легче протонов или нейтронов, несут такую же величину заряда, что и протон, но с противоположным знаком, что означает, что каждый атом, который имеет равное количество протонов и электронов, является электрически нейтральным.
Это электроны, которые определяют химическое поведение конкретного элемента.
Карта нуклидов содержит информацию обо всех известных изотопах. Границы этой карты постоянно расширяются, поскольку новые исследования помогают нам находить способы создания новых изотопов. Элементам присваивается ряд на диаграмме в соответствии с количеством протонов, которые они имеют. Стабильные изотопы показаны черным цветом. Национальный центр ядерных данных / Wikimedia CommonsИзотопы элемента имеют одинаковое количество протонов, но разное количество нейтронов.Давайте возьмем углерод в качестве примера.
В природе есть три изотопа углерода: углерод-12, углерод-13 и углерод-14. У всех троих по шесть протонов, но их нейтронные числа — 6, 7 и 8 соответственно — все различаются. Это означает, что все три изотопа имеют разные атомные массы (углерод-14 является самым тяжелым), но имеют одинаковый атомный номер (Z = 6).
Химически все три неразличимы, потому что количество электронов в каждом из этих трех изотопов одинаково.
Итак, разные изотопы одного и того же элемента химически идентичны. Но некоторые изотопы могут обойти это правило, полностью преобразовавшись в другой элемент.
Три встречающихся в природе изотопа углерода. Хотя у каждого из них одинаковое количество протонов и электронов, они различаются количеством нейтронов. Тесса КумундуросНа пути к стабильности
Эта способность к преобразованию некоторых изотопов связана с тем фактом, что не все изотопы стабильны, и именно это привело Фредерика Содди к открытию изотопов, получившему Нобелевскую премию в 1913 году.
Некоторые изотопы, такие как углерод-12, будут продолжать существовать в виде углерода, если не произойдет чего-то необычного. Другие — скажем, углерод-14 — в какой-то момент распадутся на ближайший стабильный изотоп.
В этом случае один из нейтронов углерода-14 превращается в протон, образуя азот-14. Во время этого процесса, известного как бета-распад, ядро испускает излучение в форме электрона и антинейтрино.
Нейтрон углерода-14 превращается в протон во время бета-распада.Тесса КумундуросЕсть много факторов, которые могут вызвать распад ядра. Один из наиболее важных — это отношение протонов к нейтронам, которые есть у конкретного ядра. Если в ядре слишком много нейтронов (определение «слишком много» зависит от веса ядра), есть шанс, что оно распадется в сторону стабильности.
То же самое верно, если в ядре слишком много протонов. Это одна из причин, по которой некоторые изотопы данного элемента являются радиоактивными, а другие — нет.
Из живота звезд
К настоящему времени вы, возможно, задаетесь вопросом, как вообще были созданы все эти изотопы. Оказывается, это сложный вопрос, но он придает некоторую истину пословице о том, что все мы сделаны из звездной пыли.
Некоторые из более легких изотопов образовались очень рано в истории Вселенной, во время Большого взрыва. Другие возникают в результате процессов, происходящих внутри звезд, или в результате случайных столкновений между высокоэнергетическими ядрами, известными как космические лучи, в нашей атмосфере.
Большинство изотопов, существующих в природе, являются конечным продуктом (стабильным или долгоживущим) в результате долгой серии ядерных реакций и распадов.
В большинстве этих случаев легкие ядра должны были столкнуться вместе с достаточной энергией, чтобы позволить сильному взаимодействию — клееподобной связи, которая образуется, когда протоны и нейтроны приближаются достаточно близко, чтобы соприкоснуться, — чтобы преодолеть электромагнитную силу, которая раздвигает протоны. . Если сильная сила побеждает, сталкивающиеся ядра связываются или сливаются, образуя более тяжелое ядро.
. Если сильная сила побеждает, сталкивающиеся ядра связываются или сливаются, образуя более тяжелое ядро.
Наше солнце — хороший тому пример. Одним из основных источников энергии является серия реакций синтеза и процессов бета-распада, которые превращают водород в гелий.
Изотопы распадаются в сторону того, что иногда называют «долиной стабильности». Арагу / ВикимедиаПреобразование знаний в инструменты
С начала 1900-х годов, когда впервые стало известно о существовании изотопов, физики-ядерщики и химики искали способы изучить, как изотопы могут образовываться, как они распадаются и как мы можем их использовать.
Оказывается, природа изотопов — их химическая однородность, их ядерная уникальность — делает их полезными для широкого спектра применений в таких разнообразных областях, как медицина, археология, сельское хозяйство, производство электроэнергии и горнодобывающая промышленность.
Если вам когда-либо делали ПЭТ-сканирование, значит, вы получили пользу от побочного продукта радиоактивного распада определенных изотопов (часто называемых медицинскими изотопами). Мы производим эти медицинские изотопы, используя наши знания о том, как протекают ядерные реакции, с помощью ядерных реакторов или ускорителей, называемых циклотронами.
Но мы также нашли способы использовать природные радиоактивные изотопы. Например, при датировании по углероду используется долгоживущий изотоп углерод-14 для определения возраста объектов.
В нормальных условиях углерод-14 образуется в нашей атмосфере в результате реакции космических лучей с азотом-14. Его период полураспада составляет примерно 5700 лет, что означает, что половина углерода-14 распадется за этот период времени.
Внутри ускорителя на 15 миллионов вольт Австралийского национального университета.ANU Пока биологический организм жив, он потребляет примерно один изотоп углерода-14 на каждый триллион стабильных изотопов углерода-12, и соотношение углерода-12 к углероду-14 остается примерно таким же, пока жив организм. Как только он умирает, новое поступление углерода прекращается.
Как только он умирает, новое поступление углерода прекращается.
Это означает, что соотношение углерода-14 и углерода-12 изменяется в останках этого организма с течением времени.
Если мы извлекаем углерод химическими методами из образца, мы можем применить метод, называемый ускорительной масс-спектрометрией (AMS), для разделения отдельных изотопов углерода по весу.
AMS использует тот факт, что ускоренные частицы с одинаковым зарядом, но разной массой проходят разные пути через магнитные поля. Используя эти отдельные пути, мы можем определять изотопные отношения с невероятной точностью.
Как видно из этих примеров, мы применяем наши знания об изотопах по-разному. Мы производим их, обнаруживаем, извлекаем и изучаем их с двойной целью: понять, почему атомное ядро ведет себя именно так, и как мы можем использовать его силу в наших интересах.
атомов — Принципы биологии
Атом — наименьший компонент элемента, который сохраняет все химические свойства этого элемента. Например, один атом водорода обладает всеми свойствами элемента водорода, например, он существует в виде газа при комнатной температуре и связывается с кислородом, образуя молекулу воды. Атомы водорода не могут быть разбиты на что-либо меньшее, сохраняя при этом свойства водорода. Если бы атом водорода был разбит на субатомные частицы, он больше не обладал бы свойствами водорода.
Все атомы содержат протонов, электронов и нейтронов (Рисунок 1). Единственное исключение — водород (H), состоящий из одного протона и одного электрона. Протон — это положительно заряженная частица, которая находится в ядре (ядре атома) атома и имеет массу 1 и заряд +1. Электрон — это отрицательно заряженная частица, которая движется в пространстве вокруг ядра. Другими словами, он находится вне ядра. Он имеет незначительную массу и заряд -1.
Рис. 1 Атомы состоят из протонов и нейтронов, расположенных внутри ядра, и электронов, окружающих ядро.
Нейтроны, как и протоны, находятся в ядре атома. Они имеют массу 1 и не заряжаются. Положительный (протоны) и отрицательный (электроны) заряды уравновешивают друг друга в нейтральном атоме, который имеет чистый нулевой заряд.
Поскольку каждый протон и нейтрон имеют массу 1, масса атома равна количеству протонов и нейтронов этого атома.Количество электронов не влияет на общую массу, потому что их масса очень мала.
На самом базовом уровне все организмы состоят из комбинации элементов. Элемент — это вещество, все атомы которого имеют одинаковое количество протонов. Они содержат атомы, которые вместе образуют молекулы. В многоклеточных организмах, таких как животные, молекулы могут взаимодействовать с образованием клеток, которые объединяются, образуя ткани, из которых состоят органы. Эти комбинации продолжаются до тех пор, пока не сформируются целые многоклеточные организмы.
Каждый элемент имеет свои уникальные свойства. Каждый из них содержит разное количество протонов и нейтронов, что дает им собственный атомный номер и массовое число. Атомный номер элемента равен количеству протонов, содержащихся в элементе. Массовое число или атомная масса — это количество протонов плюс количество нейтронов этого элемента. Следовательно, можно определить количество нейтронов, вычитая атомный номер из массового числа.
Эти числа предоставляют информацию об элементах и их реакции при объединении.Различные элементы имеют разные точки плавления и кипения и находятся в разных состояниях (жидкое, твердое или газообразное) при комнатной температуре. Также они по-разному сочетаются. Некоторые образуют определенные типы облигаций, а другие — нет. То, как они сочетаются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы организованы в периодическую таблицу элементов, диаграмму элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Таблица Менделеева также предоставляет ключевую информацию о свойствах элементов (рис.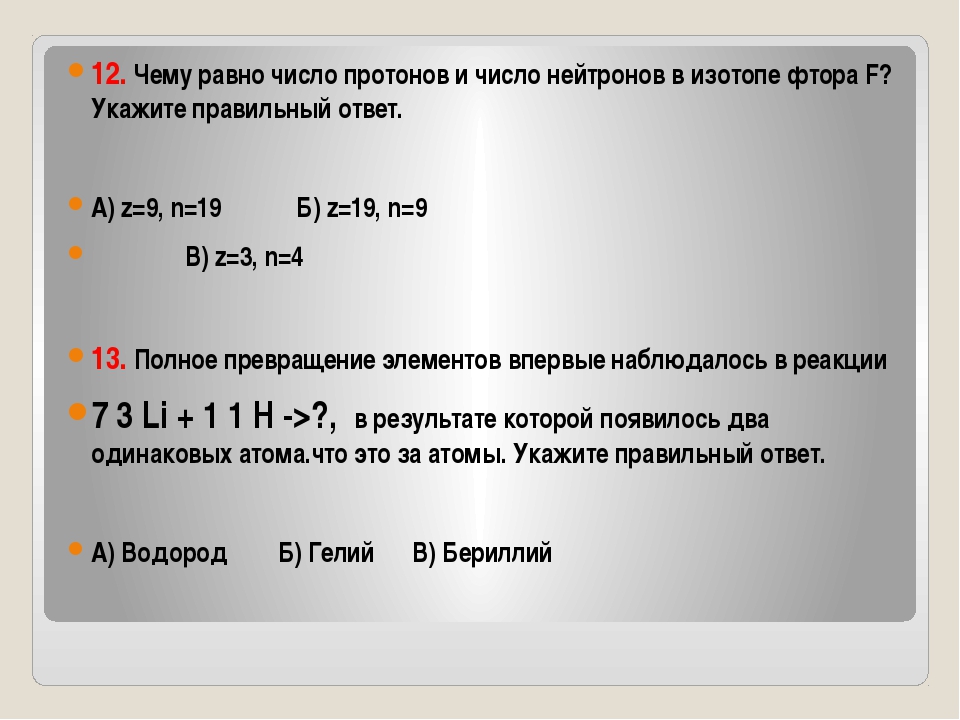 2), часто обозначаемых цветом.Расположение таблицы также показывает, как организованы электроны в каждом элементе, и предоставляет важные детали о том, как атомы будут реагировать друг с другом с образованием молекул.
2), часто обозначаемых цветом.Расположение таблицы также показывает, как организованы электроны в каждом элементе, и предоставляет важные детали о том, как атомы будут реагировать друг с другом с образованием молекул.
Изотопы — это разные формы одного и того же элемента, которые имеют одинаковое количество протонов, но разное количество нейтронов. Некоторые элементы, такие как углерод, калий и уран, имеют изотопы природного происхождения. Углерод-12, самый распространенный изотоп углерода, содержит шесть протонов и шесть нейтронов.Следовательно, он имеет массовое число 12 (шесть протонов и шесть нейтронов) и атомный номер 6 (что делает его углеродом). Углерод-14 содержит шесть протонов и восемь нейтронов. Следовательно, он имеет массовое число 14 (шесть протонов и восемь нейтронов) и атомный номер 6, что означает, что это все еще элемент углерод. Эти две альтернативные формы углерода являются изотопами. Некоторые изотопы нестабильны и теряют протоны, другие субатомные частицы или энергию для образования более стабильных элементов. Их называют радиоактивными изотопами или радиоизотопами.
Рис. 2 Сгруппированная в столбцы и строки в зависимости от характеристик элементов, периодическая таблица предоставляет ключевую информацию об элементах и о том, как они могут взаимодействовать друг с другом с образованием молекул. Большинство периодических таблиц содержат ключ или легенду к содержащейся в них информации.Эволюция в действии
Датирование по углероду: Углерод-14 ( 14 C) — это встречающийся в природе радиоактивный изотоп, который создается в атмосфере космическими лучами.Это непрерывный процесс, поэтому всегда создается еще 14 C. По мере развития живого организма относительный уровень 14 C в его организме равен концентрации 14 C в атмосфере. Когда организм умирает, он больше не потребляет 14 C, поэтому соотношение будет снижаться. 14 C распадается до 14 N в результате процесса, называемого бета-распадом; он излучает энергию в этом медленном процессе.
14 C распадается до 14 N в результате процесса, называемого бета-распадом; он излучает энергию в этом медленном процессе.
Примерно через 5730 лет только половина начальной концентрации 14 C будет преобразована в 14 N.Время, необходимое для того, чтобы половина исходной концентрации изотопа распалась до более стабильной формы, называется периодом полураспада. Поскольку период полураспада 14 C велик, он используется для старения ранее живых объектов, таких как окаменелости. Используя отношение концентрации 14 C, обнаруженной в объекте, к количеству 14 C, обнаруженному в атмосфере, можно определить количество изотопа, который еще не распался. Основываясь на этой сумме, можно рассчитать возраст окаменелости примерно 50 000 лет (Рисунок 3).Изотопы с более длительным периодом полураспада, такие как калий-40, используются для расчета возраста более старых окаменелостей. Используя углеродное датирование, ученые могут восстановить экологию и биогеографию организмов, живших в течение последних 50 000 лет.
Рис. 3 Возраст останков, которые содержат углерод и которым менее 50 000 лет, таких как этот карликовый мамонт, можно определить с помощью углеродного датирования. (кредит: Билл Фолкнер / NPS)Если не указано иное, изображения на этой странице находятся под лицензией CC-BY 4.0 от OpenStax.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]:IBRqRY3C@8/The-Building-Blocks-of-Molecules
.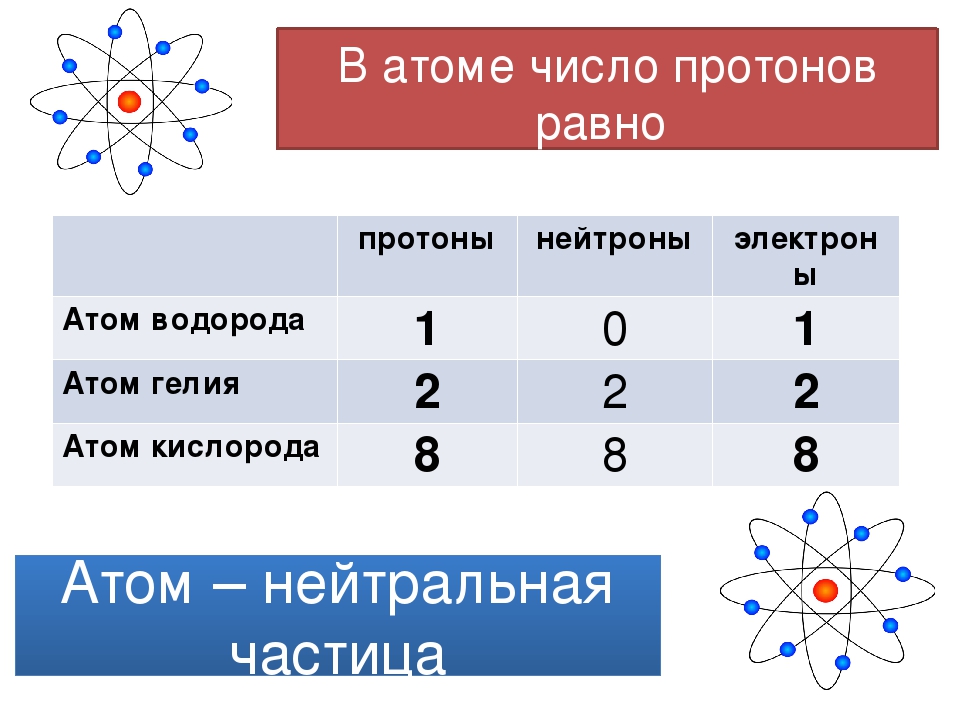

Leave A Comment