Тема: «Изопроцессы.Газовые законы»
Основные вопросы:изотермический, изобарный и изохорные процессы.
Задания:
1.Зависимость давления р от объёма V для фиксированного количества идеального газа при постоянной температуре представлена на графике
2.Зависимость давления р от температуры Т для фиксированного количества идеального газа при постоянном объёме представлена на графике
3. Зависимость объёма V от температуры Тдля фиксированного количества идеального газа при постоянной температуре представлена на графике
4.Баллон, содержащий 10 л водорода при давлении 1,2 МПа, соединили с пустым баллоном вместимостью 2 л. Какое давление установится в сосудах в процессе изотермического расширения.
5.Газ при 17 0С занимает объём V. До какой температуры газ следует изобарно охладить, чтобы его объём стал 0,65 V?
6.Газ находится при температуре Т и давлении 2р. Докакой температуре газ следует изохорно нагреть, чтобы давление газа стало 3р?
7.Идеальный газ изохорно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,8 раза. Масса газа постоянна. Найдите конечную температуру газа.
8.На рисунке изображён циклический процесс для идеального газа. Изохорическому охлаждению газа соответствует участок
9.На рисунке показан цикл, осуществляемый с идеальным газом. Изобарному нагреванию соответствует участок
10.На рисунке изображён циклический процесс для идеального газа. Изотермическому расширению газа соответствует участок
11.На диаграмме изображены изотермы трех газов — кислорода, гелия и углекислого газа. Массы газов одинаковы. Измерения проводились при одной и той же температуре. Какой график соответствует какому газу?
1) 1 — Не; 2 — О2; 3 — СО2
2) 1 — СО2; 2 — О2; 3 — Не
3) 1 — Не; 2 — СО2; 3 — О2
4) 1 — О2; 2 — Не; 3 — СО2
12.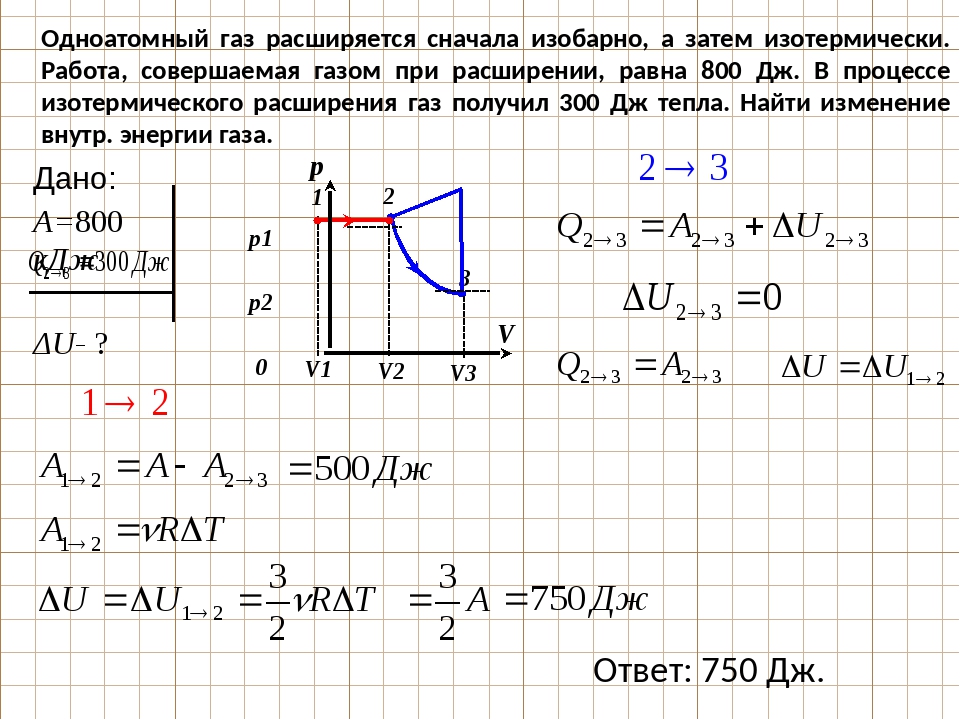 На pТ-диаграмме отображена последовательность трёх процессов (1 → 2 → 3) изменения состояния 2 моль идеального газа. Какова эта последовательность процессов в газе?
На pТ-диаграмме отображена последовательность трёх процессов (1 → 2 → 3) изменения состояния 2 моль идеального газа. Какова эта последовательность процессов в газе?
1) сжатие → нагревание → охлаждение
2)нагревание → расширение при постоянной температуре → сжатие
3)охлаждение → расширение при постоянной температуре → сжатие
4)расширение → нагревание → охлаждение
13.В сосуде находится идеальный газ. Процесс изобарного изменения состояния газа показан на диаграмме (см. рисунок). Масса газа в процессе изменялась. В какой из точек диаграммы масса газа имеет наименьшее значение?
14.На VT–диаграмме изображена зависимость V, объёма идеального газа от температуры (см. рисунок). Какому состоянию газа из четырёх (А, В, С, D
15.Наибольший объём газа в процессе Vмакс достигается
1)в точке 1 2)на всём отрезке 1–2 3)в точке 3 4)на всём отрезке 2–3
16.Один моль идеального газа сначала сжимается при постоянной температуре, затем нагревается при постоянном давлении и, наконец, охлаждается при постоянном объеме до первоначальной температуры. Какой из графиков в координатах p—T соответствует этим изменениям?
1) 1 2) 2 3)3 4)4
17.Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось при постоянном объёме, затем при постоянной температуре объём газа уменьшился до первоначального значения. Какой из графиков в координатных осях V–T соответствует этим изменениям состояния газа? Масса газа в ходе процесса не изменяется.
18.На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа.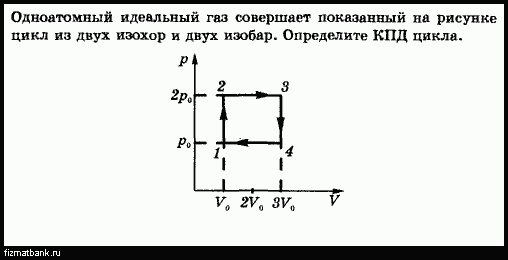 Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
19.На графике представлена зависимость давления неизменной массы идеального газа от его плотности. Опишите, как изменяются в зависимости от плотности температура и объём газа в процессах 1−2 и 2−3.
20.При исследовании изопроцессов использовался закрытый сосуд переменного объёма, заполненный воздухом и соединённый с манометром. Объём сосуда медленно увеличивают, сохраняя давление воздуха в нём постоянным. Как изменяются при этом температура воздуха в сосуде и его плотность?
Для каждой величины определите соответствующий характер её изменения: 1) увеличивается; 2) уменьшается; 3) не изменяется. Запишите в таблицу выбранные цифры для каждого ответа. Цифры в ответе могут повторяться.
| Температура воздуха в сосуде | Плотность воздуха в сосуде |
21.В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. На дне сосуда лежит стальной шарик (см. рисунок). Из сосуда выпускается половина газа при неизменной температуре. Выберите из предложенного перечня два верных утверждения, верно описывающие данный процесс, и укажите их номера.
1) Давление газа в сосуде остаётся неизменным.
2) Объём газа в этом процессе остаётся неизменным.
3) Плотность газа в этом процессе увеличивается.
4) Сила Архимеда, действующая на шарик, не изменяется.
5) Концентрация молекул газа в сосуде увеличивается.
22.В цилиндрическом сосуде под поршнем находится газ. Поршень не закреплён и может перемещаться в сосуде без трения (см. рисунок). В сосуд закачивается ещё такое же количество газа при неизменной температуре. Как изменится в результате этого давление газа и концентрация его молекул?Для каждой величины определите соответствующий характер изменения:1) увеличится; 2) уменьшится; 3)не изменится.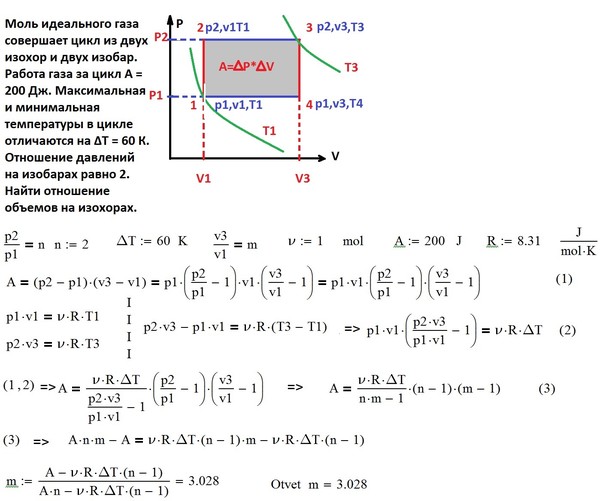 Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Давление газа | Концентрация молекул газа |
23.Сосуд с газом плотно закрыт пробкой, площадью сечения которой 2,5 см2. До какой температуры нагреть газ, чтобы пробка вылетела из сосуда, если сила трения, удерживающая пробку, 12 Н? Начальное давление в сосуде 105Па, а начальная температура (-3)0С.
24. Определите, во сколько раз изменится концентрация молекул газа, если изобарически уменьшить абсолютную температуру в 7 раз, а затем количество газа уменьшить в 14 раз при том же давлении.
26. Идеального газа совершает замкнутый процесс, состоящий из двух изохор и двух изобар. Температура в точке 1 равна T1 а в точке 3 T3. Точки 2,4 лежат на одной изотерме. Найти температуру в этих точках.
27. Идеальный газ участвует в процессах, представленных на pV- диаграмме. В состоянии 1 температура газа равна 100 К, а в состоянии 2 она составляет 400 К. Определите температуру газа в состоянии 3.
28.В вертикальном цилиндрическом сосуде с площадью поперечного сечения S=5 см
29.В запаянной с одного конца длинной горизонтальной стеклянной трубке постоянного сечения (см. рисунок) находится столбик воздуха длиной l1
Законы идеального газа. Работа газа
Закон Бойля – Мариотта – один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Закон является частным случаем уравнения состояния идеального газа.
Закон Бойля – Мариотта гласит: при постоянной температуре и массе идеального газа произведение его давления и объема постоянно. В математической форме это утверждение записывается следующим образом:
\(pV = const\),
где \(p\) – давление газа; \(V\) – объем газа.
Важно уточнить, что в данном законе газ рассматривается, как идеальный. На самом деле, все газы в той или иной мере отличаются от идеального. Чем выше молекулярная масса газа, тем больше это отличие.
Закон Бойля – Мариотта, закон Шарля и закон Гей-Люссака, дополненные законом Авогадро, образуют уравнение состояния идеального газа.
Закон Шарля – объем газа при постоянном давлении прямо пропорционален его абсолютной температуре. Эта зависимость была впервые выведена Жаком Шарлем в 1787 г. Его иногда называют законом Гей-Люссака, поскольку Жозеф Гей-Люссак заново вывел его и уточнил в 1802 г.
Закон Гей-Люссака – закон пропорциональной зависимости объема газа от абсолютной температуры при постоянном давлении, названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году (в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот). {3}$, а затем при постоянном объеме до давления $p_{3} = 0,5 МПа$. Найдите изменение $\Delta U$ внутренней энергии газа, совершенную им работу $A$ и теплоту $Q$, переданную газу. Постройте графики процесса. Подробнее
{3}$, а затем при постоянном объеме до давления $p_{3} = 0,5 МПа$. Найдите изменение $\Delta U$ внутренней энергии газа, совершенную им работу $A$ и теплоту $Q$, переданную газу. Постройте графики процесса. Подробнее
Задача по физике — 6219
В цилиндре под поршнем находится водород массой $m = 0,02 кг$ при температуре $T_{1} = 300 К$. Водород сначала расширился адиабатно, увеличив свой объем в $n_{1} = 5$ раз, а затем был сжат изотермически, причем объем газа уменьшился в $n_{1} = 5$ раз. Найдите температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах. Изобразите процесс графически. ПодробнееЗадача по физике — 6220
Два мыльных пузыря радиусами $R_{1}$ и $R_{2}$ сливаются в один пузырь радиуса $R$. Определите атмосферное давление. Коэффициент поверхностного натяжения мыльной пленки $\sigma$. ПодробнееЗадача по физике — 6221
В герметически закрытом сосуде смешат одинаковое количество кислорода и гелия (моль на моль). Потом в стенке сосуда сделали маленькое отверстие. Найти состав молекулярного пучка, который выходит из отверстия. ПодробнееЗадача по физике — 6222
Баллон с газом разделён на две части термоизолирующей перегородкой с малым отверстием (ото означает, что молекул проходят в отверстие только «поодиночке», т. е. макроскопическое движение газа вблизи отверстия не может возникнуть). По разным сторонам перегородки всё время поддерживается температуры $T_{1}$ и $T_{2}$. Определите отношение давления $p_{1}$ и $p_{2}$ в различных част баллона. Подробнее
Определите отношение давления $p_{1}$ и $p_{2}$ в различных част баллона. Подробнее Задача по физике — 6224
Внутри длинной трубы, наполненной воздухом, двигают с постоянной скоростью поршень, при этом по трубе распространяется упругая волна со скоростью $v = 320 м/с$. Считая перепад давлений на границе распространения волны равным 1000 Па, оцените перепад температур. Давление в невозмущенном воздухе 1 атм, температура 300 К. ПодробнееЗадача по физике — 6225
Идеальный газ постоянной массы расширяется по закону $p = \alpha V$. Определить работу, выполненную газом при увеличении объёма от $V_{1}$ до $V_{2}$. Нагревается или охлаждается газ при таком процессе? ПодробнееЗадача по физике — 6226
В цилиндре под поршнем находится $\nu$ молей ненасыщенного водяного пара при температуре $T_{0}$. При медленном изобарическом охлаждении цилиндра половина пара сконденсировалась, а внутренняя энергия содержимого цилиндра уменьшилась на $\Delta U$. Какое количество теплоты пришлось при этом отвести от содержимого цилиндра, если температура в нем уменьшилась на $\Delta T$? Объемом воды по сравнению с объемом пара можно пренебречь. ПодробнееЗадача по физике — 6227
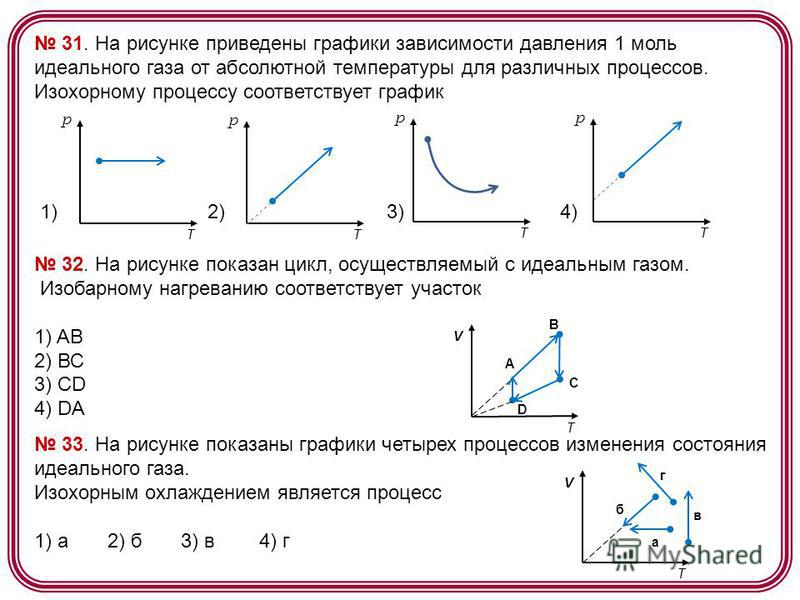
Моль идеального одноатомного газа расширяется сначала в изобарическом процессе, а затем в процессе с линейной зависимостью давления от объема (рис.). Известно, что $V_{2}/V_{1} = V_{3} / V_{2}$, а прямая 2 —3 походит через начало координат.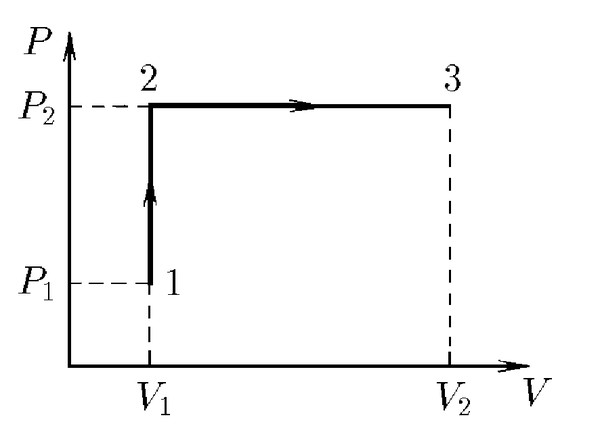 Найдите отношение объемов $V_{2}/V_{1}$, если количество теплоты, подведенное к газу на участке 1-2, в четыре раза меньше работы $A_{23}$, совершенной газом на участке 2—3.
Найдите отношение объемов $V_{2}/V_{1}$, если количество теплоты, подведенное к газу на участке 1-2, в четыре раза меньше работы $A_{23}$, совершенной газом на участке 2—3. Подробнее
Задача по физике — 6228
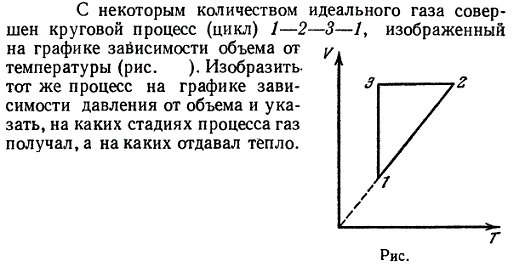
С одноатомным газом провели замкнутый процесс, состоящий из двух изохор и двух изобар (рис.). Определить $\eta$ (КПД) теплового двигателя, работающего по этому циклу.Подробнее
Задача по физике — 6229
Сообщающиеся цилиндры с поршнями площадью $S_{1}$ и $S_{2}$ (рис.) заполнены одноатомным газом с параметрами $p_{0}, V_{0}$ и $T_{0}$. Ни левый поршень действуют сила $F$, совершая работу $A$. Правый поршень сжимает упругую пружину жесткостью $k$. 1) Какое максимальное количество тепла $Q_{max}$ может при этом выделиться в окружающую среду? 2) До какой максимальной температуры может нагреться газ?Подробнее
Задача по физике — 6230
Два одинаковых металлических шарика радиусом $r$ и плотностью $\rho$ надеты на тонкий непроводящий стержень. Верхний шарик закреплен, нижний может свободно перемешаться вдоль стержня. Шарики опушены в жидкость, диэлектрическая проницаемость которой $\epsilon$, плотность $\rho_{1}$. У каждою миллиардного атома верх него шарика забрали по одному электрону и перенесли на подвижный шарик. На каком расстоянии будет находиться нижний шарик от верхнего в состоянии равновесия, если стержень расположен вертикально?Подробнее
Задача по физике — 6231
Шарик массой $m$, имеющий заряд $q$, свободно падает в однородном электрическом нате параллельном поверхности земли напряженностью $\vec{E}$.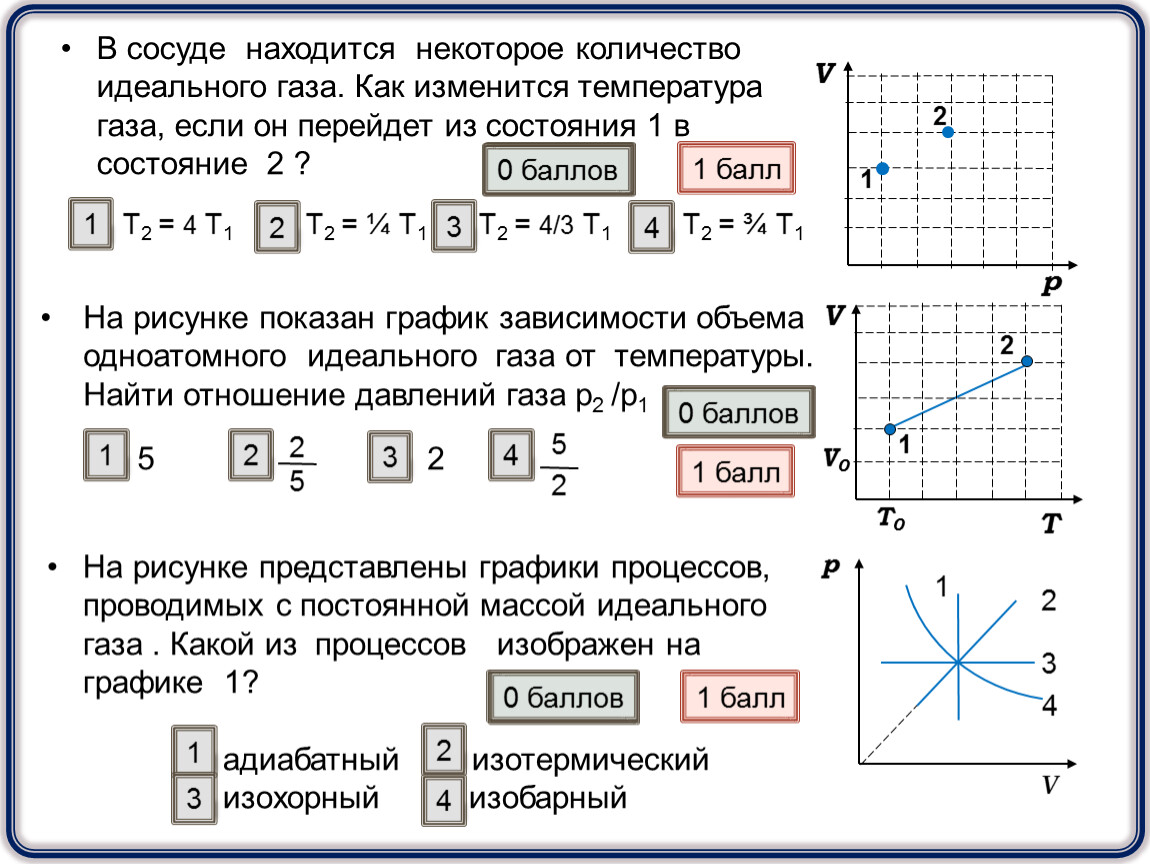 Опишите движение шарика и напишите уравнение траектории $y = y(x)$. Начальная скорость шарика равна нулю. Подробнее
Опишите движение шарика и напишите уравнение траектории $y = y(x)$. Начальная скорость шарика равна нулю. Подробнее Задача по физике — 6232
Тонкое проводящее кольцо радиусом $R$ несет электрический заряду $q$, распределенный по кольцу равномерно. В центре кольца расположен одноименный с $q$ заряд $Q$, причем $Q \gg q$. Определите силу, с которой растянуто кольцо. ПодробнееСтраница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Физика_111_МКТ-dop
Дисциплина: Физика
Индекс
темы «Молекулярно-кинетическая теория
идеального газа. Газовые законы»
Газовые законы»
Вариация v111
Контроль: П — промежуточный
П С111 Кластер (Графики, простые задания ) 15 заданий
1. [Уд] (ВО1) На графике стрелками указаны направления процессов, протекающих в идеальном газе. Давление газа убывает в ходе процесса, указанного под номером
1) 1
2) 2
3) 3
4) 4
:4
2. [Уд] (ВО1) В сосуде, закрытом поршнем, находится идеальный газ. Процесс изменения состояния газа приведен на рисунке. При переходе газа из состояния А в состояние В его объем
1) все время увеличивался
2) все время уменьшался
3) сначала увеличивался, затем уменьшался
4) сначала уменьшался, затем увеличивался
:1
3. [Уд] (ВО1) На рисунке приведены графики изобарических процессов, проведенных при одинаковом давлении для различных масс одного и того же идеального газа. Верным соотношением для масс является
1) m1 = m2
2) m1 > m2
3) m1 < m2
4) однозначногоответа дать нельзя
:2
4. [Уд] (ВО1) В сосуде, закрытом поршнем, находится идеальный газ. На рисунке представлена зависимость концентрации газа от температуры при изменении его состояния. Изохорическое нагревание газа соответствует участку
1) 1 – 2
2) 2 – 3
3) 3 – 4
4) такого участка на рисунке нет
:2
5.
[Уд] (ВО1) В сосуде, закрытом поршнем,
находится идеальный газ.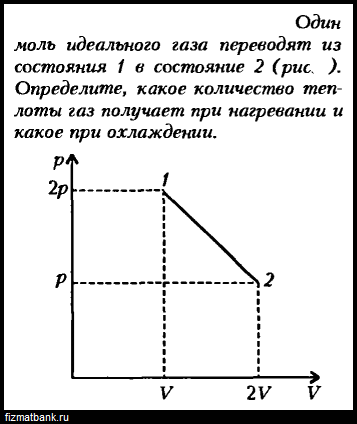 График
зависимости давления газа от температуры
при изменении его состояния представлен
на рисунке. Наименьшее значение объема
соответствует состоянию газа в точке
График
зависимости давления газа от температуры
при изменении его состояния представлен
на рисунке. Наименьшее значение объема
соответствует состоянию газа в точке
1) А
2) В
3) С
4) D
:1
6. [Уд] (ВО1) Идеальный газ переведен из состояния 1 в состояние 2. Между температурой газа Т1 в начальном состоянии и температурой T2 в конечном состоянии справедливо соотношение
1) Т1 > T2
2) T1 = T2
3) T1 < T2
4) однозначного ответа дать нельзя
:3
7. [Уд] (ВО1) На рисунке приведены графики зависимости давления одного моля некоторого идеального газа от объема. Наибольшая температура соответствует состоянию газа, отмеченному на рисунке точкой
1) 1
2) 2
3) 3
4) 4
:3
8. [Уд] (ВО1) Идеальный газ совершает круговой процесс, как показано на рисунке. Давление газа максимально в точке
1) 1
2) 2
3) 3
4) 4
:3
9. [Уд] (ВО1) Один моль идеального газа сначала сжимается при постоянной температуре, затем нагревается при постоянном давленнии, и, наконец, охлаждается при постоянном объеме до первоначальной температуры. Из приведенных ниже зависимостей этим изменениям в координатах Р –Т соответствует график
:1
10.
[Уд] (ВО1) На рисунке приведены графики
зависимости плотности ρ одного и того
же идеального газа от давления Р при разных температурах. Более высокая
температура соответствует графику,
приведенному под номером
Более высокая
температура соответствует графику,
приведенному под номером
1) 1
2) 2
3) 3
4) 4
:4
11. [Уд] (ВО1) На рисунке три точки a, b и c характеризуют три состояния одного и того же количества идеального газа. Меньшая плотность газа соответствует состоянию
1) a
2) b
3) c
4) плотность газов во всех состояниях одинакова
:3
12. [Уд] (ВОМ) На графике изображен изотермический процесс, при проведении которого изменилась масса газовой системы (участок b – c). Справедливы утверждения:
1) участок cd – изотерма для меньшей массы газа
2) участок ab – изотерма для меньшей массы газа
3) участок bc соответствует процессу возрастания массы газа
4) участок bc соответствует уменьшению массы газа
:1, 4
13. [Уд] (ВО1) На рисунке приведены графики зависимости давления одного моля газа от температуры при постоянном объеме. Наибольшее значение объема соответствует состоянию газа, отмеченному на рисунке точкой
1) 1
2) 2
3) 3
4) 4
:4
14. [Уд] (ВО1) Идеальный газ перешел из состояния 1 в состояние 2 по пути, изображенному на рисунке. Между объемом V1 газа в начальном состоянии и объемом V2 в конечном состоянии справедливо соотношение
1) V1 < V2
2) V1 = V2
3) V1 > V2
4) однозначного ответа дать нельзя
:1
15. [Уд] (ВО1) На (Р,V)
– диаграмме изображен циклический
процесс. На участках СD
и DА
температура
[Уд] (ВО1) На (Р,V)
– диаграмме изображен циклический
процесс. На участках СD
и DА
температура
1) на СD – понижается, на DА – повышается
2) на СD – повышается, на DА – понижается
3) повышается на СD и DА
4) понижается на СD и DА
: 1
Контроль: П — промежуточный
П S111 Сингл ( Температура, давление с т.зрения МКТ. Основное уравнение МКТ. Средняя энергия молекул ) 13 заданий
1. [Уд] (ВО1) При температуре 320 К и давлении 1,66·105 Па плотность газа равна 2 кг/м3. Молярная масса этого газа равна … кг/моль.
1) 0,032
2) 230
3) 0,028
4) 0,24·105
:1
2. [Уд] (ВО1) Часть стенки сосуда покрыли клеем, поглощающим все падающие молекулы газа. При этом давление газа на стенки сосуда
1) увеличится
2) уменьшится
3) не изменится
4) нет определенного ответа
:2
3. [Уд] (ВО1) Объем идеального газа изотермически увеличили вдвое. При это средний импульс , передаваемый молекулой стенке сосуда при каждом ударе, …
1) не изменился
2) увеличился в 2 раза
3) уменьшился в 2 раза
4) увеличился в 4 раза
:1
4. [Уд] (ВО1) .При одном ударе молекулы массы m0, движущейся со скоростью перпендикулярно к стенке сосуда, она передает ей импульс, равный по модулю
1)
2)
3) 2
4) 0
:3
5.
[Уд] (ВО1) Гелий находится при температуре
27ºС. Кинетическая энергия хаотического
движения всех молекул газа составляет
10 Дж. Постоянная Больцмана к =
1,38·10-23 Дж/К. Полное число молекул
газа равно
Полное число молекул
газа равно
1) 1,6·1021
2) 2,5·1022
3) 6·1023
4) 6,2·1024
:1
6. [Уд] (ВО1) Если объем идеального газа уменьшится в 2 раза, а средняя кинетическая энергия молекул увеличится в 2 раза, то его давление … раза.
1) увеличится в 4
2) уменьшится в 4
3) увеличится в 2
4) уменьшится в 2
:1
7. [Уд] (ВО1) При постоянной температуре концентрация молекул идеального газа увеличивается в 3 раза. При этом его давление …
1) увеличится в 9 раз
2) уменьшится в 3 раза
3) увеличится в 3 раза
4) не изменится
:3
8. [Уд] (ВО1) Из-за хаотичности движения N молекул идеального газа вдоль положительного направления оси Ох движется количество молекул, равное
1) (1/8) N
2) (1/6) N
3) (1/3) N
4) (1/2) N
:2
9. [Уд] (ВО1) Средняя кинетическая энергия молекул газа при температуре Т зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место поступательное и вращательное движение молекулы как целого, средняя кинетическая энергия молекулы водяного пара (Н2О) равна
1) 3kT
2) kT
3) kT
4) kT
:1
10. [Уд] (ВО1) Идеальный газ нагрет от температуры t1 = 27ºС до t2 = 39ºС. Если давление газа не изменилось, то объем газа увеличился на
1) 40%
2) 4%
3) 2%
4) 20%
:2
11. [Уд] (ВО1) Температуру идеального газа
увеличили в 16 раз. При этом средняя
квадратическая скорость молекул возрастает в … раз(а).
[Уд] (ВО1) Температуру идеального газа
увеличили в 16 раз. При этом средняя
квадратическая скорость молекул возрастает в … раз(а).
1) 2
2) 4
3) 8
4) 16
:2
12. [Уд] (ВО1) Если объем идеального газа постоянной массы возрастет в 2 раза, а температура уменьшится вдвое, то давление газа
1) увеличится в 4 раза
2) уменьшится в 4 раза
3) увеличится в 2 раза
4) не изменится
:2
13. [Уд] (ВО1) В двух сосудах одинакового объема находятся кислород О2 и углекислый газ СО2 при одинаковой температуре. Массы кислорода и углекислого газа одинаковы. Давления, которые оказывают газы на стенки сосудов, связаны между собой соотношениями
1)
2)
3)
4) для ответа недостаточно данных
:2
9
Задачи по молекулярной физике с подробными решениями
Задачи по молекулярной физике с решениями
Элементы молекулярной физики. Основное уравнение молекулярно-кинетической теории (МКТ)
4.1.1 В баллоне находится 20 моль газа. Сколько молекул газа находится
4.1.2 Определить массу молекулы кислорода
4.1.3 Сколько молекул содержится в 5 кг кислорода?
4.1.4 При температуре 320 К средняя квадратичная скорость молекулы кислорода 500 м/с
4.1.5 Определить давление водорода, если средняя квадратичная скорость его молекул
4.1.6 Какова средняя кинетическая энергия поступательного движения молекул газа
4.1.7 Определить давление, при котором 1 м3 газа, имеющий температуру 60 C, содержит
4.1.8 Сколько молекул содержится в 1 л воды?
4.1.9 Какое значение температуры по шкале Кельвина соответствует температуре 100 C?
4. 3, а средняя квадратичная
3, а средняя квадратичная
4.1.29 Сколько молекул кислорода находится в сосуде объемом 1 л, если температура
4.1.30 Определить плотность воздуха при 27 C и давлении 0,1 МПа
4.1.31 Какое давление на стенки сосуда производят молекулы газа, если масса газа 3 г, объем
4.1.32 Какое давление производит углекислый газ при температуре 330 К, если его плотность
4.1.33 Вычислить среднюю квадратичную скорость молекул углекислого газа
4.1.34 Определить среднеквадратичную скорость молекул газа при давлении 100 кПа и плотности
4.1.35 В баллоне емкостью 40 л находится 10 кг кислорода под давлением 20 МПа. Найти
4.1.36 Энергия поступательного движения, которой обладают все молекулы газа, находящегося
4.1.37 Найти концентрацию молекул газа, у которого средняя квадратичная скорость молекул
4.1.38 В первом сосуде находится азот, во втором – водород. Чему равно отношение давления
4.1.39 В сосуде вместимостью 2 м3 находится 2,4 кг газа. Под каким давлением находится газ
4.1.40 Плотность газа в баллоне электрической лампы 0,9 кг/м3, давление при горении 110 кПа
4.1.41 При какой температуре находится одноатомный газ, если средняя кинетическая энергия
4.1.42 Под каким давлением находится кислород в баллоне, если при температуре 27 C
4.1.43 Найдите отношение средних скоростей молекул O2 и h3 при одинаковой температуре
4.1.44 Найти среднюю квадратичную скорость молекул газа, имеющего плотность 1,8 кг/м3
4.1.45 В баллоне находится кислород при давлении 4 МПа и температуре 42 C. Определить
4.1.46 В баллоне объемом 0,01 м3 находится газ, кинетическая энергия поступательного движения
4.1.47 Во сколько раз плотность метана (Ch5) отличается от плотности кислорода (O2)
4.1.48 Определить давление азота в ампуле, если при 0 C в ней концентрация молекул
4.1.49 Во сколько раз средняя квадратичная скорость молекул воздуха при температуре 303 К
4.1.50 При некоторой температуре средняя скорость молекул азота равна 600 м/с.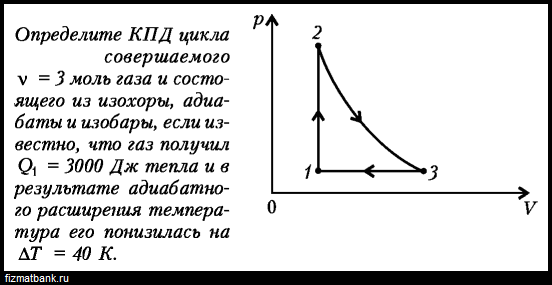 25 молекул, средняя квадратичная
25 молекул, средняя квадратичная
4.2.20 Найти массу водорода, находящегося в баллоне объемом 20 л под давлением 830 кПа
4.2.21 Газ массой 16 г при давлении 1 МПа и температуре 112 C занимает объем 1600 см3
4.2.22 Найти число молекул воздуха в комнате, имеющей объем 8x5x4 м3, при температуре 10 C
4.2.23 Вычислить молярную массу бутана, 2 л которого при температуре 15 C и давлении 87 кПа
4.2.24 Какая часть газа осталась в баллоне, давление в котором было 12,2 МПа, а температура
4.2.25 Идеальный газ при давлении 1,33 кПа и температуре 15 C занимает объем 2 л. Каким
4.2.26 Из баллона емкостью 5 л из-за неисправности вентиля произошла утечка газа, в результате
4.2.27 Газ, объем которого 0,8 м3 при температуре 300 К производит давление 280 кПа. На сколько
4.2.28 В баллоне объемом 200 л при температуре 20 C и давлении 10 МПа находится кислород
4.2.29 Некоторый газ массой 7 г, находящийся в баллоне при температуре 27 C, создает давление
4.2.30 Сколько молекул воздуха выходит из комнаты объемом 80 м3 при повышении температуры
4.2.31 В цилиндре дизеля воздух сжимается от 80 до 3000 кПа, а объем уменьшается от 7,5 до 0,5 л
4.2.32 В открытом сосуде газ нагрели так, что его температура увеличилась в 3 раза. Сколько
4.2.33 Температура воздуха в комнате была 10 C. После того как печь протопили, температура
4.2.34 Газ массой 1,2 г занимает объем 400 см3 при температуре 280 К. После нагревания газа
4.2.35 Из баллона со сжатым водородом объемом 0,01 м3 вытекает газ, при температуре 280 К
4.2.36 Откачанная лампа накаливания объемом 10 см3 имеет трещину, в которую проникает
4.2.37 Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%
4.2.38 При температуре 727 C газ занимает объем 8 л и производит давление 200 кПа на стенки
4.2.39 Воздух в открытом сосуде нагревают от 10 до 600 C и затем, герметически закрыв сосуд
4.2.40 До какой температуры нагрели колбу, содержащую воздух, если давление воздуха в ней
4. 2.41 Баллон, содержащий 1 кг азота, при испытании взорвался при температуре 630 К. Какое
2.41 Баллон, содержащий 1 кг азота, при испытании взорвался при температуре 630 К. Какое
4.2.42 При какой температуре давление 240 л водорода равно 126,6 кПа, если при нормальных
4.2.43 В баллоне находилось 5 кг газа при давлении 1 МПа. Какое количество газа взяли из баллона
4.2.44 Во сколько раз изменится объем кислорода массой 0,32 кг, если его давление увеличится
4.2.45 Баллон содержит газ при температуре 7 C и давлении 91,2 МПа. Каким будет давление
4.2.46 В баллоне находится газ при температуре 15 C. Во сколько раз изменится его давление
4.2.47 Сколько электронов заключается в 1 л кислорода при давлении 1 МПа и температуре
4.2.48 Плотность пара некоторого соединения углерода с водородом равна 3 г/л при 43 C
4.2.49 В комнате объемом в 30 м3 температура с 15 C поднялась до 25 C. На сколько при этом
4.2.50 Баллон содержит сжатый газ при 27 C и давлении 3 МПа. Каково будет давление, если
4.2.51 На сколько уменьшится масса воздуха в открытом сосуде, если его нагреть от 0 до 100 C?
4.2.52 Баллон содержит сжатый газ при 27 C и давлении 2000 кПа. Каково будет давление, если
4.2.53 Перед проведением газосварочных работ манометр баллона с кислородом показывал
4.2.54 Газ при давлении 126,6 кПа и температуре 300 К занимает объем 0,6 м3. Найти объем
4.2.55 Газ при давлении 0,2 МПа и температуре 15 C имеет объем 5 л. Чему равен объем
4.2.56 Сосуд вместимостью 0,6 м3, содержащий гелий массой 2 кг, разорвался при температуре
4.2.57 В сосуде объемом 10 литров находится 2 г водорода при температуре 2000 К. Определить
4.2.58 Какова минимальная разница в массе воздуха зимой и летом при нормальном атмосферном
4.2.59 Воздух в сосуде объемом 5 л находится при температуре 27 C под давлением 2 МПа
4.2.60 Некоторая масса водорода находится при температуре 200 К и давлении 0,4 кПа. Газ
4.2.61 Перед проведением газосварочных работ манометр баллона с кислородом показывал
4.2.62 В сосуде находится 1 литр воды при температуре 27 C. Чему стало бы равным давление
Чему стало бы равным давление
4.2.63 В двух сосудах находится одинаковое количество одного и того же газа. В первом сосуде
4.2.64 Резиновая камера содержит воздух при температуре 27 C и нормальном атмосферном
4.2.65 В баллоне объемом 10 л находится кислород, масса которого 12,8 г. Давление в баллоне
4.2.66 Баллон содержит 0,3 кг гелия. Абсолютная температура в баллоне уменьшилась на 10%
4.2.67 В откачанной ампуле объемом 3 см3 содержится радий массой 5 г в течение одного года
4.2.68 Два сосуда, содержащих одинаковую массу одного и того же газа, соединены трубкой
4.2.69 Сколько молей газа следует добавить к одному молю данного газа, чтобы его давление
4.2.70 В открытом цилиндре находится 90 г газа. Температуру газа увеличили от 300 до 450 К
4.2.71 Из баллона объемом 200 дм3, содержащего гелий при давлении 2 МПа и температуре 273 К
4.2.72 На рисунке показан график процесса, происходящего с идеальным газом. Укажите точки
4.2.73 На PT-диаграмме изображен замкнутый процесс, который совершает кислород некоторой
4.2.74 Если нагреть 1 моль идеального газа на 1 К при постоянном объеме, то давление возрастет
4.2.75 Имеется два сосуда с одним и тем же газом при одинаковой температуре. Плотность газа
4.2.76 При увеличении температуры газа на 60 К его объем возрос на 1 л. На сколько литров
4.2.77 Насос захватывает при каждом качании 1 л воздуха при нормальных условиях и нагнетает
4.2.78 Воздушный шар имеет легкорастяжимую теплоизолированную оболочку массой 130 кг
4.2.79 В некотором процессе давление и объем идеального газа связаны соотношением
4.2.80 Какой радиус должен иметь наполненный гелием воздушный шар, чтобы он мог подняться
4.2.81 Надувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити
4.2.82 Два баллона с объемами 20 и 10 л соединены длинной тонкой трубкой и содержат 6 моль
4.2.83 Воздушный шар объемом 20 м3, наполненный гелием, поднялся на высоту 180 м за 0,5 минуты
4. 3=const
3=const
4.2.99 Воздушный шар объемом 1000 м3 наполнен гелием при температуре окружающего воздуха
4.2.100 В цилиндре с площадью основания 100 см2 находится воздух. Поршень расположен на высоте
4.2.101 В сосуд, на дне которого лежит твердый шар, нагнетают воздух при температуре 27 C
4.2.102 В закрытом с обоих концов цилиндре длиной 2 м поршень соединён с днищами пружинами
4.2.103 Тонкостенный резиновый шар собственным весом 0,6 Н наполнен неоном и погружен в озеро
4.2.104 Давление воздуха в сосуде равно 102,4 кПа. Вместимость цилиндра разрежающего насоса
4.2.105 Компрессор всасывает в 1 мин 3 м3 сухого воздуха при температуре 290 К и давлении 100 кПа
4.2.106 Давление воздуха в сосуде 97 кПа. После трёх ходов откачивающего поршневого насоса
4.2.107 В цилиндре длиной 2L=2 м тонкий поршень соединён с днищами пружинами одинаковой
4.2.108 Газ, занимающий при температуре 127 C и давлении 100 кПа объем 2 л, изотермически
4.2.109 В цилиндре под поршнем находится газ при нормальных условиях. Сначала объем газа
4.2.110 При увеличении абсолютной температуры идеального газа в 2 раза его давление
4.2.111 Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%
Изопроцессы
4.3.1 Определить начальную температуру газа, если при изохорном нагревании
4.3.2 В закрытом баллоне находится газ при температуре 295 К
4.3.3 Давление в откачанной рентгеновской трубке при 15 градусах Цельсия
4.3.4 На сколько Кельвин надо нагреть воздух при постоянном давлении
4.3.5 Газ изотермически сжимают от объема 0,15 м3 до объема 0,1 м3
4.3.6 Газ нагрели на 1 К при постоянном объеме. Давление газа при этом
4.3.7 Газ нагрели на 100 К при постоянном объеме. Давление газа
4.3.8 В закрытом сосуде находится идеальный газ. Во сколько раз
4.3.9 Во сколько раз изменяется плотность идеального газа
4.3.10 В процессе изобарного нагревания газа его объем увеличился в 2 раза
4.3.11 Сосуд объемом 12 м3, содержащий газ под давлением 400 кПа
4. 3.12 Сосуд, содержащий 10 л воздуха при давлении 1 МПа, соединяют с пустым
3.12 Сосуд, содержащий 10 л воздуха при давлении 1 МПа, соединяют с пустым
4.3.13 Резиновая камера содержит воздух под давлением 104 кПа. Камеру
4.3.14 До какой температуры нужно нагреть воздух, взятый при 20 градусах
4.3.15 Объем некоторой массы газа при изобарном нагревании на 10 К
4.3.16 Даны две изохоры для одной и той же массы идеального газа
4.3.17 Газ сжат изотермически от 8 до 6 л. Давление при этом возросло
4.3.18 В сосуде объемом 1 л при температуре 183 градуса Цельсия находится
4.3.19 В цилиндре под поршнем изотермически сжимают 9 г водяного
4.3.20 Во сколько раз изменится плотность идеального газа при температуре
4.3.21 При 27 градусах Цельсия газ занимает объем 10 л. До какой
4.3.22 Продукты сгорания газа охлаждаются в газоходе с 1000 до 300 градусов
4.3.23 Газ занимает объем 8 л при температуре 300 К. Определите массу газа
4.3.24 Давление азота в электрической лампочке объемом 0,15 л равно 68 кПа
4.3.25 Бутылка с газом закрыта пробкой, площадь сечения которой 2,5 см2
4.3.26 В цилиндре под поршнем находится газ. Масса поршня 0,6 кг
4.3.27 Два сосуда объемом 2 и 4 л, заполненные одинаковым газом, соединены
4.3.28 В цилиндре под поршнем находится воздух. Вес поршня 60 Н
4.3.29 В цилиндре под поршнем находится вода массой 35 мг и пар массой 25 мг
4.3.30 Баллон, наполненный воздухом при температуре 273 К и атмосферном
4.3.31 В цилиндре под поршнем находится воздух при давлении 0,2 МПа
4.3.32 Один конец цилиндрической трубки, длина которой 25 см и радиус 1 см
4.3.33 Расположенная горизонтально, запаянная с обоих концов стеклянная трубка
4.3.34 В вертикальном закрытом цилиндре находится подвижный поршень
4.3.35 Открытую стеклянную трубку длиной 1 м наполовину погружают в ртуть
4.3.36 В стеклянной трубке находится столбик ртути длиной 10 см. Когда
4.3.37 Посередине откачанной и запаянной с обоих сторон горизонтально
4.3.38 Открытую с обеих сторон стеклянную трубку длиной 60 см
4. 3.39 В трубке длиной 1,73 м, заполненной газом, находится столбик ртути
3.39 В трубке длиной 1,73 м, заполненной газом, находится столбик ртути
4.3.40 В каком из изображенных на рисунке процессов, проведенных
4.3.41 Горизонтально расположенный закрытый цилиндрический сосуд
4.3.42 На рисунке изображены гиперболы для трех идеальных газов с одинаковыми массами
4.3.43 На рисунке изображены гиперболы для трех идеальных газов с разными массами
4.3.44 Постоянную массу идеального газа переводят из состояния 1
4.3.45 Горизонтально расположенный закрытый цилиндрический сосуд длины
4.3.46 Температура воздуха в комнате повысилась от 17 до 27 градусов Цельсия
4.3.47 Газ при 27 градусах Цельсия занимает объем V. До какой температуры
4.3.48 Баллон, содержащий 12 л кислорода при давлении 1 МПа, соединяют
Влажность
4.4.1 Определите относительную влажность воздуха при температуре 18 C, если точка росы
4.4.2 Определите давление водяных паров в воздухе при температуре 20 С и относительной
4.4.3 5 м3 воздуха при температуре 25 С содержат 86,5 г водяного пара. Определить абсолютную
4.4.4 Определить абсолютную влажность воздуха при температуре 37 C, если давление
4.4.5 В 6 м3 воздуха с температурой 19 С содержится 51,3 г водяного пара. Определите
4.4.6 В 10 м3 воздуха с температурой 19 С содержится 71,3 г водяного пара. Определите
4.4.7 В комнате объемом 120 м3 при температуре 15 C относительная влажность составляет 60%
4.4.8 Найти массу водяного пара, содержащегося в спортивном зале объемом 1100 м3
4.4.9 В комнате объемом 200 м3 относительная влажность воздуха при 20 С равна 70%
4.4.10 При температуре 22 C относительная влажность воздуха равна 60%. Найти относительную
4.4.11 В комнате размером 10x5x3 м3 поддерживается температура 293 К, а точка росы 283 К
4.4.12 В цистерне объемом 10 м3 находится воздух с относительной влажностью 70%
4.4.13 Воздух в помещении имеет температуру 24 C и относительную влажность 50%. Определите
4.4.14 Найти массу водяных паров в 1 м3 воздуха при нормальном атмосферном давлении
4. 4.15 Давление водяного пара в воздухе на 40% ниже давления насыщенных паров при этой же
4.15 Давление водяного пара в воздухе на 40% ниже давления насыщенных паров при этой же
4.4.16 В сосуде объемом 100 л при 27 C находится воздух с относительной влажностью 30%
4.4.17 Влажность в комнате объемом 520 м3 при температуре 25 C равна 90%. Какое количество
4.4.18 Сколько надо испарить воды в 1000 м3 воздуха, относительная влажность которого 40%
4.4.19 В комнате объемом 60 м3 при температуре 18 C относительная влажность воздуха 50%
Первое начало термодинамики 🐲 СПАДИЛО.РУ
Первое начало термодинамики (первый закон термодинамики) представляет собой закон сохранения энергии в тепловых процессах.
Первое начало термодинамикиВнутренняя энергия идеального газа изменяется двумя способами: за счет теплопередачи или при совершении работы.
±ΔU=±Q±A‘
Пояснение:
- +∆U — внутренняя энергия газа увеличивается.
- –∆U — внутренняя энергия газа уменьшается.
- +Q — газ нагревают (газу передают количество теплоты).
- –Q — газ охлаждается (газ отдает тепло окружающей среде).
- +A’ — газ сжимает внешняя сила.
- –A’ — газ расширяется, совершая работу.
Внимание! Знак перед работой показывает, как процесс совершения работы влияет на изменение внутренней энергии газа.
Пример №1. В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ совершил работу 500 Дж. Какое количество теплоты было сообщено газу?
Чтобы рассчитать количество теплоты, сообщенное газу, нужно найти разность между изменением внутренней энергии и работой, совершенным газом. Для этого нужно правильно определить их знаки. Так как внутренняя энергия уменьшилась, она отрицательна. Но работа положительна. Поэтому газу было сообщено следующее количество теплоты:
Q = A – U = 500 – 300 = 200 (Дж)
Зависимость физических величин
Выясним, от чего зависят величины, входящие в формулу первого начала термодинамики. Изменение внутренней энергии идеального газа зависит от изменения температуры:
Изменение внутренней энергии идеального газа зависит от изменения температуры:
ΔU=32..νRΔT
Работа идеального газа зависит от изменения его объема:
A‘=pΔV
Первое начало термодинамики для изопроцессов
| Изотермический процесс (T = const) | ΔU=0, Q=A‘ |
| Изохорный процесс (V = const) | A‘=0, ΔU=Q |
| Изобарное расширение газа (p = const) | ΔU=Q−pΔV ΔU=Q−νRΔT |
| Адиабатный (система не получает тепло извне и не отдает его окружающей среде, или Q = 0) | Q=0, ΔU=A‘ |
Пример №2. Идеальный одноатомный газ находится в сосуде с жесткими стенками объемом 0,6 куб. м. При нагревании его внутренняя энергия увеличилась на 18 кДж. На сколько возросло давление газа?
18 кДж = 18000 Дж
Внутреннюю энергию газа можно определить по формуле:
ΔU=32..νRΔT
Отсюда изменение температуры равно:
ΔT=2ΔU3νR..
Уравнение состояния идеального газа для 1 и 2 состояния:
p1V=νRT1
p2V=νRT2
Отсюда давления равны:
p1=νRT1V..
p2=νRT2V..
Разность давлений:
p2−p1=νRT2V..−νRT1V..=νRV..ΔT=νRV..·2ΔU3νR..=2ΔU3V..
p2−p1=2·180003·0,6..=20000 (Па)=20 (кПа)
Графические задачи на первое начало термодинамики
Рассмотрим графический способ решения задачи на первое начало термодинамики на конкретном примере.
Задача: Один моль идеального одноатомного газа сначала изотермически расширился (T1 = 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2–3?
Порядок решения:
1. Определить температуры для всех указанных точек, учитывая графики процессов, масштаб и условие задачи.T1 = T2 = 300 К; T3= 100 К
2. Определить, к какому изопроцессу относится тот участок графика, о котором спрашивают в задаче.
Участок 2–3 на графике — это изохорный процесс, так как давление остается постоянным.
3. Записать для него первое начало термодинамики.
В данном процессе:
ΔU=Q
4. Учитывая характер изменения величин, правильно расставить знаки: −ΔU=−Q.
5. Подставляя в первое начало термодинамики формулы для расчета изменения внутренней энергии и работы газа, решить задачу.
Формула изменения внутренней энергии газа:
ΔU=32..νRΔT
Формула работы газа:
A‘=pΔV
Так как процесс изохорный, работа газа равна нулю. Поэтому количество теплоты, отданное газом на участке 2–3, равно изменению внутренней энергии газа:
Изменение внутренней энергии равно:
Q23=32..νRΔT23=32..·1·8,31·200=2493 (Дж)
Задание EF17492 Четыре металлических бруска положили вплотную друг к другу, как показано на рисунке. Стрелки указывают направление теплопередачи от бруска к бруску. Температуры брусков в данный момент 100°С, 80°С, 60°С, 40°С. Температуру 40°С имеет брусокАлгоритм решения
- Определить тип теплопередачи.
- Вспомнить, как происходит этот тип теплопередачи.
- Сделав анализ рисунка, установить, какой брусок имеет указанную в задаче температуру.
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 оС.
Ответ: Apазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17758Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105Па.
• Конечное давление: p2 = 105Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32..νRT
Внутренняя энергия аргона до расширения и после него:
U1=32..νRT1
U2=32..νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV..
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2..
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1..=p2V2T2..
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2..=p2T1p1T2..
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2..=p2T12p1T2..
Отсюда:
T2=T1√p2p1..
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32..νRT1√p2p1..
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32..νRT1−32..νRT1√p2p1..=32..νRT1(1−√p2p1..)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32. .νRT1(1−√p2p1..)−A
.νRT1(1−√p2p1..)−A
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17562Газу передали изохорно количество теплоты 300 Дж. Как изменилась его внутренняя энергия в этом процессе?
Ответ:
а) увеличилась на 300 Дж
б) уменьшилась на 300 Дж
в) увеличилась на 600 Дж
г) уменьшилась на 600 Дж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 300 Дж.
Первое начало термодинамики:
ΔU=Q+A
Так как по условию задачи это изохорный процесс, то работа равна 0. Следовательно, изменение внутренней энергии газа равно количеству теплоты:
ΔU=Q=300 (Дж)
Ответ: аpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17597Находясь в цилиндре двигателя, газ получил от нагревателя количество теплоты, равное 10 кДж. Затем он расширился, совершив работу 15 кДж. В результате всех этих процессов внутренняя энергия газа уменьшилась на
Ответ:
а) 5 кДж
б) 10 кДж
в) 15 кДж
г) 25 кДж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 10 кДж.
• Работа, совершенная газом: A = 15 кДж.
Первое начало термодинамики:
ΔU=Q+A
В этой формуле за работу принимается та работа, что совершается над газом. Но в данном случае газ сам совершает работу. Поэтому первое начало термодинамики примет вид:
ΔU=Q−A=10−15=−5 (кДж)
Знак «–» указывает на то, что внутренняя энергия газа уменьшилась на 5 кДж.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17579При постоянном давлении гелий нагрели, в результате чего он совершил работу 5 кДж? Масса гелия 0,04 кг. Насколько увеличилась температура газа?
Ответ:
а) 60 К
б) 25 К
в) 15 К
г) 3 К
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать первое начало термодинамики.
3.Записать формулу для расчета работы газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и выполнить вычисления искомой величины.
Решение
Запишем исходные данные:
• Газ совершил работу: A = 5 кДж.
• Масса гелия: m = 0,04 кг.
5 кДж = 5000 Дж
Первое начало термодинамики:
ΔU=Q+A
Учтем, что не над газом совершают работу, а сам газ совершает ее:
Отсюда:
ΔU=Q−A
Так как газ нагревали изобарно, часть тепла ушла на изменение внутренней энергии газа, а часть — на совершение этим газом работы.
Работа, совершенная газом, равна:
A=pΔV=mM..RΔT
Молярная масса гелия равна 4∙10–3 кг/моль.
Отсюда:
Ответ: аpазбирался: Алиса Никитина | обсудить разбор | оценить
РЕШЕНИЕ: Медленно сжимается один моль идеального газа…
Стенограмма видеозаписи
так что в партии эта проблема была дана в отцовском процессе вечная проза. Это означает, что температура гостей во время сжатия лица будет постоянной, как мы видим в прошлом году по зарубежным данным. Это примерно верно для небольших изменений в владении. Это способность ударить по делу. Это не изменится по-крупному без каких-либо изменений в насилии в прошлом году, соответствующем кресту.Процесс траура. Мы видим, что если Delta G равна нулю, это означает, что доктор, вы будете нулем. Итак, начиная с первой партии храмовой геномики, бритье равняется изменению энергии плюс проделанной работе с этого нуля. Поэтому que lugar, равный семьям Andi, не было дано, что работа вниз составляет 600 рабочих мест. Итак, для первой части проблемы ответ состоит в том, что Q транспортных средств w равно минус 600. Джулс, это отрицательно, очевидно, потому что развод происходит по мере того, как объем уменьшается из-за сжатия профи.Итак, работа вкладывается в систему. Огромный пол был отрицательным и уменьшается по мере того, как работа ведется на подъезде. Таким образом, мы можем сказать, что тепло уходит от газа для бара ко мне, нам нужно найти работу, вечную энергию. Собственно, то есть в отношениях можно было деворе поставить на газ. Но для процесса моста ISO Zobrist растет. Это означает, что депрессия президента не меняется. Итак, здесь мы можем использовать, ну, это означает, что вы DeVol. Решение также можно считать приблизительно постоянным.Так что гениальный Дент делает новое ровно и ничего не водит раз в компакт-диски. Неужели вы, поскольку объем здесь не постоянный, на самом деле, но мы можем приблизить его для этого, но на самом деле, поскольку процессы изо нарушены, изменение температуры не будет нулевым. Следовательно, изменение внутренней энергии тоже не будет нулевым. Итак, мы можем перегруппировать это и сказать, что это равно двум, и найти изменение температуры, умноженное на теплоемкость, которая далее считается равной. И не будь грубым, если бы я был на нашем сайте. Это зарегистрированное резюме.В данном случае я не газовая постоянная. Итак, сначала нам нужно найти и вывести этот член из другого уравнения. Так использовали уравнение злого газа. Уравнение газа с заменой воды. Так что это трижды Дельта. Мы равны и являемся поясом T. Ясно, что мы показываем здесь эти два термина, и молодым людям нужно только переместить газовую постоянную er, чтобы она вызывалась, а Delta T на самом деле является дельтой, которую мы перестреляем и замечаем недостаток. \ circ C; [/ math], затем он изотермически сжимается, пока его давление не достигнет 10 бар.\ circ C. [/ math] Вычислить Q, W, [math] \ Delta U, [/ math] и [math] \ Delta H [/ math] в каждом случае. Возьмите [math] C_P = (7/2) R [/ math] и [math] C_V = (5/2) R. [/ Math] Или возьмите [math] C_P = (5/2) R [/ math ] и [math] C_V = (3/2) R. [/ math] :: Помощь и ответы по домашнему заданию :: Slader [математика] \ sinh [/ математика]
[math] \ sinh [/ math]
[math] \ ch [/ math]
[math] \ tanh [/ math]
[math] \ operatorname {sech} [/ math]
[math] \ operatorname {csch} [/ math]
[math] \ coth [/ math]
[математика] \ in [/ математика][математика] \ notin [/ математика]
[математика] \ подмножество [/ математика]
[математика] \ substeq [/ математика]
[математика] \ cap [/ математика]
[математика] \ чашка [/ математика]
[математика] \ существует [/ математика]
[math] \ forall [/ math]
[математика] \ грех [/ математика][математика] \ sin [/ математика]
[математика] \ cos [/ математика]
[math] \ tan [/ math]
[математика] \ сек [/ математика]
[математика] \ csc [/ математика]
[math] \ cot [/ math]
[математика] \ arcsin [/ математика][математика] \ arcsin [/ математика]
[математика] \ arccos [/ математика]
[математика] \ arctan [/ математика]
[math] \ operatorname {arcsec} [/ math]
[math] \ operatorname {arccsc} [/ math]
[math] \ operatorname {arccot} [/ math]
[math] \ theta [/ math]
[математика] \ phi [/ математика]
[математика] \ varphi [/ математика]
[математика] \ int_ {a} ^ {b} f (x) \, dx [/ math]
[математика] \ bigg | _ {a} ^ {b} [/ math]
[математика] \ left [\ right] _ {a} ^ {b} [/ math]
адиабатических процессов для идеального газа — Университетская физика, том 2
Цели обучения
К концу этого раздела вы сможете:
- Определите адиабатическое расширение идеального газа
- Продемонстрируйте качественное различие между адиабатическим и изотермическим расширениями
Когда идеальный газ сжимается адиабатически, над ним совершается работа, и его температура повышается; при адиабатическом расширении газ работает, и его температура падает.Фактически адиабатическое сжатие происходит в цилиндрах автомобиля, где сжатие газовоздушной смеси происходит так быстро, что у смеси нет времени на обмен тепла с окружающей средой. Тем не менее, поскольку во время сжатия со смесью выполняется работа, ее температура значительно повышается. Фактически, повышение температуры может быть настолько большим, что смесь может взорваться без добавления искры. Такие взрывы, поскольку они не рассчитаны по времени, приводят к тому, что машина плохо движется — обычно она «стучит».«Поскольку температура воспламенения повышается с октановым числом бензина, одним из способов решения этой проблемы является использование бензина с более высоким октановым числом.
Другой интересный адиабатический процесс — свободное расширение газа. (Рисунок) показывает газ, удерживаемый мембраной с одной стороны двухкамерного теплоизолированного контейнера. Когда мембрана прокалывается, газ устремляется в пустую сторону емкости, тем самым свободно расширяясь. Поскольку газ расширяется «против вакуума», он не работает, а поскольку сосуд имеет теплоизоляцию, расширение является адиабатическим.С и в первом законе, значит, для свободного расширения.
Газ из левой камеры свободно расширяется в правую камеру при проколе мембраны.
Если газ идеален, внутренняя энергия зависит только от температуры. Следовательно, когда идеальный газ свободно расширяется, его температура не меняется.
Квазистатическое адиабатическое расширение идеального газа представлено на (Рисунок), где показан изолированный цилиндр, содержащий 1 моль идеального газа.Газ заставляют расширяться квазистатически, удаляя по одной песчинке с верхней части поршня. Когда газ расширяется на dV , изменение его температуры составляет dT . Работа, совершаемая газом при расширении, происходит потому, что цилиндр изолирован; а изменение внутренней энергии газа составляет, из (Рисунок), Следовательно, из первого закона,
т.
Когда песок удаляется из поршня по одной крупице за раз, газ расширяется адиабатически и квазистатически в изолированном сосуде.
Также на 1 моль идеального газа
т.
и
Теперь у нас есть два уравнения для dT . Приравнивая их, получаем, что
Теперь разделим это уравнение на pV и используем. У нас остается
., что становится
, где мы определяем как отношение мольных теплоемкостей:
Таким образом,
и
Наконец, используя, мы можем записать это в форме
Это уравнение является условием, которому должен подчиняться идеальный газ в квазистатическом адиабатическом процессе.Например, если идеальный газ совершает квазистатический адиабатический переход из состояния с давлением и объемом в состояние с, тогда должно быть верно, что
Адиабатическое состояние (рисунок) может быть записано в терминах других пар термодинамических переменных, объединив его с законом идеального газа. При этом находим, что
и
Обратимое адиабатическое расширение идеального газа представлено на диаграмме pV (рисунок). Наклон кривой в любой точке
Квазистатические адиабатические и изотермические расширения идеального газа.
Пунктирная кривая, показанная на диаграмме pV , представляет изотермическое расширение, где T (и, следовательно, pV ) является постоянным. Наклон этой кривой полезен, когда мы рассмотрим второй закон термодинамики в следующей главе. Склон
Потому что изотермическая кривая не такая крутая, как кривая адиабатического расширения.
Сжатие идеального газа в автомобильном двигателе Пары бензина впрыскиваются в цилиндр автомобильного двигателя, когда поршень находится в расширенном положении.Температура, давление и объем образующейся газовоздушной смеси равны, и соответственно. Затем смесь адиабатически сжимают до объема 0,5 л. Обратите внимание, что при реальной работе автомобильного двигателя сжатие не является квазистатическим, хотя здесь мы делаем это предположение. а) Каковы давление и температура смеси после сжатия? б) Сколько работы совершает смесь во время сжатия?
Стратегия Поскольку мы моделируем процесс как квазистатическое адиабатическое сжатие идеального газа, у нас есть и.Затем необходимую работу можно оценить с помощью.
Решение
- Для адиабатического сжатия имеем
значит после сжатия давление смеси
Согласно закону идеального газа, температура смеси после сжатия составляет - Работа, совершаемая смесью при сжатии
При адиабатическом состоянии (рисунок) мы можем записать p как где Работа, следовательно,
Значение Отрицательный знак проделанной работы указывает на то, что поршень действительно работает на газовоздушной смеси.Двигатель не работал бы, если бы газо-воздушная смесь действовала на поршень.
Сводка
- Квазистатическое адиабатическое расширение идеального газа приводит к более крутой кривой pV, чем соответствующая изотерма.
- Реалистичное расширение может быть адиабатическим, но редко квазистатическим.
Концептуальные вопросы
Возможно ли быть меньше единицы?
Нет, всегда больше 1.
Ожидаете ли вы большего размера для газа или твердого вещества? Объяснять.
Внутренняя энергия идеального газа, подвергающегося изотермическому процессу, не изменяется, поскольку внутренняя энергия зависит только от температуры. Поэтому правильно ли говорить, что изотермический процесс — это то же самое, что адиабатический процесс для идеального газа? Поясните свой ответ.
Адиабатический процесс имеет изменение температуры, но отсутствует тепловой поток. Изотермический процесс не имеет изменения температуры, но имеет тепловой поток.
Работает ли газ при адиабатическом расширении? Если да, то каков источник энергии, необходимой для выполнения этой работы?
Проблемы
Одноатомный идеальный газ подвергается квазистатическому адиабатическому расширению, при котором его объем удваивается.Как меняется давление газа?
давление снизилось в 0,31 раза от исходного давления
Идеальный газ имеет давление 0,50 атм и объем 10 л. Он сжимается адиабатически и квазистатически до тех пор, пока его давление не станет 3,0 атм, а объем не станет 2,8 л. Является ли газ одноатомным, двухатомным или многоатомным?
Измерения давления и объема разреженного газа, испытывающего квазистатическое адиабатическое расширение, показаны ниже. Постройте график зависимости ln p от V и определите для этого газа свой график.
| P (атм) | В (л) |
|---|---|
| 20,0 | 1,0 |
| 17,0 | 1,1 |
| 14,0 | 1,3 |
| 11,0 | 1,5 |
| 8,0 | 2,0 |
| 5,0 | 2,6 |
| 2,0 | 5,2 |
| 1,0 | 8,4 |
;
Идеальный одноатомный газ при 300 К адиабатически и обратимо расширяется до удвоенного объема.Какова его конечная температура?
Идеальный двухатомный газ при 80 К медленно адиабатически и обратимо расширяется до удвоенного объема. Какова его конечная температура?
Идеальный двухатомный газ при 80 К медленно адиабатически сжимается до одной трети своего первоначального объема. Какова его конечная температура?
Сравните заряд внутренней энергии идеального газа для квазистатического адиабатического расширения с зарядом для квазистатического изотермического расширения. Что происходит с температурой идеального газа при адиабатическом расширении?
При адиабатическом расширении выполняется меньше работы и отсутствует тепловой поток, поэтому внутренняя энергия ниже по сравнению с изотермическим расширением, при котором выполняется как тепловой поток, так и работа.Температура снижается при адиабатическом расширении.
Температура n молей идеального газа изменяется с на при квазистатическом адиабатическом переходе. Покажите, что работа, проделанная газом, определяется числом
.Разбавленный газ квазистатически расширяется до трехкратного первоначального объема. Конечное давление газа больше при изотермическом или адиабатическом расширении? Ваш ответ зависит от того, является ли газ одноатомным, двухатомным или многоатомным?
Isothermal имеет большее конечное давление и не зависит от типа газа.
Два моля одноатомного идеального газа, такого как гелий, адиабатически и обратимо сжимаются из состояния (3 атм, 5 л) в состояние с давлением 4 атм. (а) Найдите объем и температуру конечного состояния. (б) Найдите температуру начального состояния газа. (c) Найдите работу, совершаемую газом в процессе. (d) Найдите изменение внутренней энергии газа в процессе.
Дополнительные проблемы
Автомобильная шина содержит воздух под давлением (около 32 фунтов на квадратный дюйм).Насколько больше внутренней энергии у этого газа, чем у того же объема при нулевом манометрическом давлении (что эквивалентно нормальному атмосферному давлению)?
Игрушечный воздушный шар, наполненный гелием, имеет манометрическое давление 0,200 атм и объем 10,0 л. Насколько больше внутренняя энергия гелия в воздушном шаре, чем она была бы при нулевом манометрическом давлении?
Пар для привода старомодного паровоза подается под постоянным манометрическим давлением (около 250 фунтов на кв. Дюйм) на поршень с 0.200-метровый радиус. (а) С помощью расчетов найдите работу, совершаемую паром, когда поршень перемещается на 0,800 м. Обратите внимание, что это чистый выходной сигнал работы, поскольку используется манометрическое давление. (b) Теперь найдите объем работы, вычислив прилагаемую силу, умноженную на пройденное расстояние. Ответ такой же, как в части (а)?
Шинный насос с ручным приводом имеет поршень диаметром 2,50 см и максимальным ходом 30,0 см. (а) Сколько работы вы делаете за один ход, если среднее манометрическое давление составляет (около 35 фунтов на квадратный дюйм)? б) Какую среднюю силу вы прикладываете к поршню, пренебрегая трением и силой тяжести?
Рассчитайте полезную мощность теплового двигателя по пути ABCDA , как показано ниже.
Каков чистый выход работы теплового двигателя, который следует по пути ABDA в предыдущей задаче с прямой линией от B до D ? Почему результат работы меньше, чем для пути ABCDA ?
Пять моль одноатомного идеального газа в цилиндре при изотермическом расширении с объема 5 л до 10 л. (А) Каково изменение внутренней энергии? б) Сколько работы было проделано с газом в процессе? (c) Сколько тепла было передано газу?
Четыре моля одноатомного идеального газа в цилиндре при at расширяются при постоянном давлении, равном 1 атм, до тех пор, пока его объем не удвоится.а) Как меняется внутренняя энергия? б) Сколько работы было проделано газом в процессе? (c) Сколько тепла было передано газу?
а. 15000 Дж; б. 10000 Дж; c. 25000 Дж
Газообразный гелий охлаждается от до за счет расширения с 40 до 1 атм. Если имеется 1,4 моль гелия, а) каков конечный объем гелия? б) Как меняется внутренняя энергия?
В адиабатическом процессе газообразный кислород в контейнере сжимается по пути, который может быть описан следующим давлением в атм как функция объема V, с:.Начальный и конечный объемы во время процесса составляли 2 л и 1,5 л соответственно. Найдите объем проделанной работы на газе.
Цилиндр, содержащий три моля одноатомного идеального газа, нагревается при постоянном давлении 2 атм. Температура газа изменяется от 300 K до 350 K в результате расширения. Найдите выполненную работу (а) по газу; и (б) газом.
Баллон, содержащий три моля газообразного азота, нагревается при постоянном давлении 2 атм. Температура газа изменяется от 300 К до 350 К в результате расширения.Найдите работу, проделанную (а) над газом и (б) газом, используя уравнение состояния Ван-дер-Ваальса вместо закона идеального газа.
Баллон, содержащий три моля газообразного азота, нагревается при постоянном давлении 2 атм. а. — 1220 Дж; б. +1220 Дж
Два моля одноатомного идеального газа, такого как кислород, адиабатически и обратимо сжимаются из состояния (3 атм, 5 л) в состояние с давлением 4 атм. (а) Найдите объем и температуру конечного состояния. б) Найдите температуру начального состояния.(c) Найдите работу, проделанную газом в процессе. (г) Найдите изменение внутренней энергии в процессе. Примем и для двухатомного идеального газа в данных условиях.
Изолированный сосуд содержит 1,5 моля аргона при 2 атм. Изначально газ занимает объем 5 л. В результате адиабатического расширения давление газа снижается до 1 атм. (а) Найдите объем и температуру конечного состояния. б) Найдите температуру газа в исходном состоянии. (c) Найдите работу, совершаемую газом в процессе.(d) Найдите изменение внутренней энергии газа в процессе.
а. 7,6 л, 61,6 К; б. 81,3 К; c. ; d. −367 Дж
задание 3
задание 3ФИЗ 340
Домашнее задание № 3 срок сдачи 17 февраля
A. Задание на чтение: текст, глава 2
Б. Задачи из учебника : 2.22; 2,25; 2,26; 2,29; 2.30
C. Дополнительные проблемы :
1. Один моль идеального газа подвергается изотермическому расширению. Найдите тепло добавлен к газу с точки зрения начального и конечного объемов и температуры.
Ответ : RT ln ( V f / V i )
2. Пусть к определенному идеальному газу добавлено 20,9 Дж тепла. В результате его громкость меняется от 50.0 см 3 до 100 см 3 при давлении остается постоянным на уровне 1,00 атм. а) Насколько изменилась внутренняя энергия газа изменять? Если количество присутствующего газа составляет 2,00 x 10 -3 моль, найдите молярная теплоемкость при (б) постоянном давлении и (в) постоянном объеме.
Ответ : а. 15,9 Дж; б. 34,4 Дж / моль К; c. 26,1 Дж / моль. K
3. Количество идеального одноатомного газа состоит из n моль первоначально при температура T 1 . Затем давление и объем медленно удвоен таким образом, чтобы очертить прямую линию на P- V диаграмма. В терминах n, R, и T 1 , что такое (а) Вт, (б) D U и (в) Q? (г) Если бы для этого процесса определить молярную удельную теплоемкость, какова была бы его молярная теплоемкость? ценить?
4. Контейнер содержит смесь трех газов, не вступающих в реакцию: n 1 моль первого газа с молярной теплоемкостью при постоянном объеме C 1 , и так далее.Найдите молярную удельную теплоемкость при постоянном объеме смеси в термины молярной удельной теплоты и количества отдельных газов.
Ответ : ( n 1 C 1 + n 2 C 2 + n 3 C 3 ) / ( n 1 + номер 2 + номер 3 )
5. Один моль идеального двухатомного газа претерпевает переход из в (5 кПа; 2 м 3 ) до c (2 кПа; 4 м 3 ) вдоль диагональный путь.Температура газа в точке a составляет 1200 К. В течение переход, (а) каково изменение внутренней энергии газа, и (б) сколько тепла добавляется к газу? (c) Сколько тепла нужно добавить к газу, если он идет от a к c по непрямому пути abc с b (5 кПа; 4 м 3 ) ?
Ответ: а. -5 кДж; б. 2,0 кДж; c. 5,0 кДж
6. Один моль кислорода (O 2 ) нагревают при постоянном давлении, начиная с 0C.Сколько тепла нужно добавить к газу, чтобы его объем удвоился? (Молекулы вращаются, но не колеблются.)
7. Предположим, что 12,0 г кислорода (O 2 ) нагревают при постоянном атмосферном давлении. давление от 25,0С до 125С. а) Сколько в нем молей кислорода? (В молярная масса для O 2 составляет 32 г / моль) (b) Сколько тепла передается кислород? (Молекулы вращаются, но не колеблются.) (C) Какая доля тепло используется для повышения внутренней энергии кислорода?
Ответ : а.0,375 моль; б. 1090 Дж; c. 0,714
8. Предположим, что 4,00 моль идеального двухатомного газа с вращением молекул, но не колебания, испытывает повышение температуры на 60,0 K под условия постоянного давления. а) Сколько тепла было добавлено к газу? (б) Как насколько увеличилась внутренняя энергия газа? (c) Сколько работы было выполнено газ? (d) Насколько увеличилась поступательная кинетическая энергия газа?
9. Масса газа занимает объем 4.3 л при давлении 1,2 атм и температура 310 К. Сжимается адиабатически до объема 0,76 л. Определите (а) конечное давление и (б) конечную температуру, предполагая, что газ быть идеальным газом, для которого g = 1,4.
Ответ : а. 14 атм; б. 620 К
10 . (a) Один литр газа с г = 1,3 при 273 К и давлении 1,0 атм. Внезапно сжимается (адиабатически) до половины первоначального объема. Найдите его окончательное давление и температура.(b) Теперь газ снова охлаждается до 273 К при постоянном давлении. Что его окончательный объем?
11. Пусть n моль идеального газа адиабатически расширяются от начальной температура T 1 до конечной температуры T 2 . Докажите, что работа, выполняемая газом, составляет нКл y (T 2 T 1 ), где C v — молярная теплоемкость при постоянный объем.
12. Идеальный газ испытывает адиабатическое сжатие от P = 1,0 атм, V = 1,0 x 10 6 L, T = 0,0C до P = 1,0 x 10 5 атм, В = 1.0 x 10 3 л. (a) Является ли газ одноатомным, двухатомным или многоатомный? б) Какова его конечная температура? (c) Сколько молей газа настоящее время? (d) Какова полная кинетическая энергия поступательного движения на моль до и после сжатия? (e) Каково отношение квадратов среднеквадратичных скоростей до и после сжатия?
Ответ : а.одноатомный; б. 2,7 x10 4 К; c. 4,5 х 10 4 моль; d. 3,4 кДж; е. 0,01
13. Образец идеального газа расширяется от начального давления и объема 32 атм. и 1,0 л до конечного объема 4,0 л. Начальная температура газа 300 К. Каковы конечные давление и температура газа и сколько работы выполняется газом во время расширения, если расширение (а) изотермическое, (б) адиабатический и газ одноатомный, и (c) адиабатический, а газ двухатомный?
14.Идеальный газ, при начальной температуре T 1 и начальном объеме 2 м 3 , адиабатически расширяется до объема 4 м 3 , затем изотермически расширился до объема 10 м 3 , а затем сжал адиабатически, пока его температура снова не станет T 1 . Что это окончательный том?
Ответ : 5 м 3
15. Один моль идеального одноатомного газа проходит цикл, показанный на рисунке.Процесс 1 → 2 происходит при постоянном объеме, процесс 2 → 3 является адиабатическим и процесс 3 → 1 происходит при постоянном давлении. (а) Вычислите теплоту Q, изменение внутренней энергии ДУ и выполненная работа Вт, для каждого из трех процессов и для цикла в целом. (b) Если начальное давление в точке 1 равно 1,00 атм, найдите давление и объем в точках 2 и 3. Используйте 1,00 атм = 1,013 x 10 5 Па и R = 8,314 Дж / моль К.
Ответ : а.в джоулях, по порядку Q. DU, W : 1 → 2: 3740, 3740, 0; 2 → 3: 0, -1810, -1810; 3 → 1: 3220, -1930, 1290; цикл: 520, 0, -520; б. V 2 = 0,0246 м 3 , P 2 = 2,00 атм, В 3 = 0,0373 м 3 , P 3 = 1,00 атм
Закон об идеальном газе
При изучении поведения газов в замкнутых пространствах полезно ограничиться изучением идеальных газов.Идеальные газы — это теоретические модели реальных газов, в которых используется ряд основных предположений, упрощающих их изучение. Эти предположения включают рассмотрение газа как состоящего из множества частиц, которые беспорядочно перемещаются в контейнере. Частицы, в среднем, находятся далеко друг от друга, и они не оказывают друг на друга силы, если они не вступают в контакт при упругом столкновении.
При нормальных условиях, таких как стандартная температура и давление, большинство газов ведут себя так же, как идеальный газ.Тяжелые газы, а также газы при очень низких температурах или очень высоких давлениях не так хорошо моделируются идеальным газом.
Закон об идеальном газе связывает давление, объем, количество частиц и температуру идеального газа в одном уравнении, и его можно записать разными способами.
В этом уравнении P — давление газа (в паскалях), V — объем газа (в кубических метрах), n — количество молей газа, N — количество молекул газа, R — универсальная газовая постоянная, равная 8.31 Дж / моль · К (что также составляет 0,08206 л · атм / моль · К), kB — постоянная Больцмана (1,38 × 10 -23 Дж / К), а T — температура в Кельвинах. Чтобы преобразовать молекулы в моль, вы можете использовать число Авогадро (N0 = 6,02 × 10 -23 молекулы / моль):
Обратите внимание, что Паскаль, умноженный на кубический метр, — это ньютон-метр или Джоуль. Кроме того, постоянная Больцмана — это постоянная закона идеального газа, деленная на число Авогадро.
Вопрос: Сколько молей идеального газа эквивалентно 3.01 × 10 24 молекул?
Ответ:
Вопрос: Найдите количество молекул в 0,4 моля идеального газа.
Ответ:
Вопрос: Сколько молей газа содержится в 0,3 м баллоне с углекислым газом 3 , выдерживаемом при температуре 320 К и давлении 1 × 10 6 Паскалей?
Ответ:
Вопрос: Кубический метр углекислого газа при комнатной температуре (300K) и атмосферном давлении (101,325 Па) сжимается до объема 0.1 м 3 и выдерживается при температуре 260К. Какое давление сжатого углекислого газа?
Ответ: Поскольку количество молей газа постоянно, вы можете упростить уравнение идеального газа до закона комбинированного газа, установив соотношение начального давления, объема и температуры, равное конечному давлению, объему и температуре.
Поскольку вам известны все величины в этом уравнении, кроме конечного давления, вы можете напрямую вычислить конечное давление.
Вопрос: Один моль газообразного гелия находится внутри воздушного шара. Каково давление внутри воздушного шара, когда воздушный шар поднимается до точки в атмосфере, где температура составляет -12 ° C, а объем воздушного шара составляет 0,25 кубических метра?
Ответ: Сначала вы должны перевести температуру из градусов Цельсия в Кельвины.
Затем вы можете использовать закон идеального газа для определения давления внутри воздушного шара.
Также довольно просто найти полную внутреннюю энергию идеального газа. Напомним, что средняя кинетическая энергия частиц идеального газа описывается формулой:
Полная внутренняя энергия идеального газа может быть найдена умножением средней кинетической энергии частиц газа на количество частиц (N) в газе. Следовательно, внутреннюю энергию газа можно рассчитать по формуле:
Вопрос: Найдите внутреннюю энергию 5 молей кислорода при температуре 300К.
Ответ:
Вопрос: Какова температура 20 молей аргона с полной внутренней энергией 100 кДж?
Ответ:
15-3. Работа, проделанная для сжатия одного моля одноатомного идеального газа, составляет 6200 Дж. температура газа изменяется от 350 до 550 К.(а) Сколько тепла течет между газ и его окружение? (b) Определите, течет ли тепло внутрь или из газ.
(a) Идеальный газ обладает тем особым свойством, что его внутренняя энергия зависит только от его температура. Внутренняя энергия одного моля одноатомного идеального газа при температура Т
U = (2/3) РТ
Изменение внутренней энергии газа при изменении его температуры от 350 до 550 К составляет
DU = (3/2) R (550 — 350) = (3/2) (8.314 Дж / моль-К) (200 К) = 2490 Дж
Это связано с теплотой, поглощаемой газом, и работой, выполняемой газом. через первый закон
DU = Q — W
В этом случае, если 6200 Дж — это работа на газ
2490 Дж = Q — (-6200 Дж)
Q = -3700 Дж
(b) Поскольку это значение отрицательное, направление теплового потока выходит за пределы допустимого диапазона. газ.
15-14.Давление и объем газа изменяются по пути ABCA (см. Стр. 452 Катнелла и Джонсона). Определите проделанную работу (включая алгебраические знак) на каждом участке пути: (a) от A до B, (b) от B до C и (c) от C до A.
В каждом сегменте проделанная работа — ПД V, равная площади под линией на PV график. Работа, совершаемая газом, положительна, если объем газа увеличивается.
(a) От A до B работа, совершаемая газом, равна (3.010 5 Па) (3,0 10 -3 м 2 ) = 900 Дж
(b) От B к C объем не меняется, поэтому проделанная работа равна нулю.
(c) От C до A проделанная работа — это площадь трапеции, то есть ее ширина. умноженное на его среднюю высоту (или сосчитайте квадраты на миллиметровой бумаге)
Вт = (1/2) (3,010 5 + 7,010 5 Па) (- 3,0 10 -3 м 2 ) = -1500 Дж
15-24.Одноатомный идеальный газ (g = 5/3) сжимается адиабатически, и его объем уменьшается в два раза. Определите коэффициент, по которому его давление увеличивается.
При адиабатическом сжатии идеального газа давление и объем связаны по
P i V i g = P f V f g
или
P f / P i = (V i g ) / (V f g ) = (V i / V f ) г
Соотношение V i / V f равно 2, поэтому
P F / P i = 2 г = 2 5/3 = 3.175.
15-47. Путешественник массой 58 кг поднимается на гору через вертикальное расстояние 950 м. Чтобы совершить подъем, ее тело генерирует дополнительные 4,5 10 6 Дж энергии. а) Сколько работы она делает, изменяя свою потенциальную гравитационную энергию? (б) Что ее эффективность (выраженная дробью от 0 до 1) при выполнении работы в часть (а)?
(a) Увеличение ее гравитационного потенциала такое же, как и за две недели. назад, а именно mgh = (58 кг) (9.8 м / с 2 ) (950 м) = 5,410 5 Дж.
(b) Ее эффективность — это доля общей дополнительной энергии, которую получает ее тело. генерирует, которая преобразуется в полезную потенциальную энергию. Это
(5,410 5 Дж) / (4,5 10 6 Дж) = 0,12
(Остальная энергия рассеивается в виде тепла.)
15-75. Четыре килограмма углекислого газа сублимируются из твердого «сухого льда» в газ при давление в одну атмосферу и температуру 194 ° С.7 К. Скрытое тепло сублимация составляет 5,77 10 5 Дж / кг. Найдите изменение энтропии углекислого газа.
Тепло, поглощаемое углекислым газом, равно
.Q = мл = (4 кг) (5,77 10 5 Дж / кг) = 2,31 10 6 Дж
Система поглощает это тепло при температуре 194,7 К, поэтому изменение ее энтропия
DS = Q / T = (+2,31 10 6 Дж) / (194,7 К) = +1,185 10 4 Дж / К.
3.E: Первый закон термодинамики (упражнения)
Q3.6
Рассчитать работу, проделанную по реакции
\ [\ ce {Zn (s) + h3SO4 (водн.) → ZnSO4 (водн.) + H3 (g)} \]
, когда 1 моль газообразного водорода собирается при 273 К и 1,0 атм. (Пренебрегайте изменениями объема, отличными от изменения объема газа, и предполагайте, что он ведет себя идеально.)
Q3.11a
Если внутренняя энергия 3 моль Cl 2 составляет 3,96 кДж, какова температура системы?
Q3.11b
Внутренняя энергия 3 моль газа неона (Ne) составляет 4,87 кДж. Если предположить, что условия идеальны, какова температура системы?
S3.11b
Поскольку мы можем предположить, что условия идеальны, мы знаем, что температура составляет 25 ° C или 298 K. Это предположение позволяет нам игнорировать небольшое изменение объема газа.
Q3.12a
Некоторые кубики льда помещают в запечатанный пластиковый пакет в жаркий день. Какой знак у \ (w \), \ (q \), \ (ΔH \), \ (ΔU \)? Что это значит о системе?
Q3.12b
Спортивная бутылка с Gatorade находится в руке мужчины во время бега на беговой дорожке. Предположим, что речь идет о Gatorade. Ответьте на последующие вопросы.
- Повысится ли температура из-за движения, вызванного бегом человека?
- Было ли действительно добавлено тепло в систему? Если да, то каков был источник?
- Были ли выполнены работы в системе?
- Каким образом внутренняя энергия системы была затронута, если вообще затронута?
3 кв.12c
Представьте таяние кубика льда.
- Является ли изменение энтальпии положительным или отрицательным для этого процесса?
- Является ли изменение энтропии положительным или отрицательным для этого процесса?
3,13 кв.
2,5 моля CO 2 расширяется при внешнем давлении 1,5 атм. Первоначально он был при 9,0 атм и 30 º C. Конечный объем 35,0 л.
- Какая конечная температура?
- Вычислить q, w и \ (\ Delta U \) для процесса.
S3.13
a) \ (T = \ dfrac {PV} {Rn} = \ dfrac {(1,5 атм) (35L)} {(. 08206 \ dfrac {L \ cdot atm} {mol \ cdot K}) (2,5 моль) } = 255 КБ \)
b) \ (w = — (nRT) ln \ dfrac {P_1} {P_2} = — (2,5 моль) (8,314 \ dfrac {J} {mol \ cdot K}) (255K) ln \ dfrac {9,0 атм} {1,5 атм} = — 9,5 \ dfrac {кДж} {моль} \)
\ (q_p = nCpT = n \ dfrac {3} {2} RT = (2,5 моль) \ dfrac {3} {2} (8,314 \ dfrac {J} {mol \ cdot K}) (255K) = 7,95 \ dfrac {кДж} {mol} \)
\ (\ Delta U = q + w = 7,95 \ dfrac {кДж} {моль} + -9,5 \ dfrac {кДж} {моль} = -1,55 \ dfrac {кДж} {моль} \)
— Для расчета работы вместо правильного -Pext * dV было использовано выражение для изотермического обратимого процесса, поскольку это необратимое расширение против внешнего давления.-Неверный метод расчета q. Вместо этого внутренняя энергия будет рассчитана с использованием nCv * dT.
3,18 кв.
, Верно ли \ ((q = -w \) для циклического процесса?
S3.18
Да, \ (q = -w \) истинное утверждение. Это правда, потому что \ (\ Delta U \) для любого циклического процесса равно нулю.
3,22 кв.
Лист золота весом 10,0 г и температурой 18,0 ° C кладут плашмя на лист железа весом 20,0 г и температурой 55,6 ° C. Учитывая, что удельная теплоемкость Au и Fe равна 0.129 Дж г -1 ° C -1 и 0,444 Дж г -1 ° C -1 соответственно, какова конечная температура объединенных металлов? (Подсказка: тепло, получаемое золотом, должно быть равно теплу, теряемому утюгом.)
3,23 кв.
Вы готовите 100 грамм куриного супа при 300К. Вы знаете, что для повышения температуры супа до желаемых 350К потребуется 500 Дж. Предполагая постоянное давление, рассчитайте молярную теплоемкость этого куриного супа.{-1}} \\ \ gamma & = 1.2 \ end {align} \]
3,29 кв.
Объясните (с точки зрения термохимии), почему императорские пингвины собираются вместе в Антарктике.
Q3.30a
Путем лабораторного эксперимента группа студентов выяснила, что молярная масса твердого элемента может быть рассчитана через удельную теплоемкость:
Молярная масса x удельная теплоемкость металлов = 25 (уравнение 1)
Они также получали значения трех металлов: алюминия (0.900 Дж / г o C), цинк (0,381 Дж / г o C) и мышьяк (0,329 Дж / г o C).
Определите, какой металл нарушает указанное выше уравнение (уравнение 1)
S3.30a
Алюминий (Al) не может применяться в этом уравнении, поскольку удельная теплоемкость Al приблизительно равна 1,0 Дж / г -1 ( o C -1 )
3 кв. 30б
Какова молярная теплоемкость свинца с учетом его удельной теплоемкости 0,128 Дж / (гºC) при 25ºC?
S3.30b
Первое, что мы делаем, это находим молярную массу свинца, которая составляет 207,2 г / моль.
Мы умножаем нашу молярную массу на удельную теплоемкость, чтобы получить молярную теплоемкость.
3,31 квартал
Какова общая работа, проделанная над 2,00 молями идеального одноатомного газа при 3,00 атм и 4,00 л, когда он адиабатически расширяется до 7,00 л?
S3.31
Уравнение для работы
\ [w = n \ bar {C_ {V}} (T_ {2} — T_ {1}) \]
Для одноатомного газа
\ [\ bar {C_ {V}} = \ dfrac {3} {2} R \ и \ \ bar {C_ {P}} = \ dfrac {5} {2} R \]
\ [\ gamma = \ dfrac {\ bar {C_ {P}}} {\ bar {C_ {V}}} = 1.{1,67}} = 1,178 атм \]
\ [T_ {2} = \ dfrac {PV} {nR} = \ dfrac {(1,178 атм) (7L)} {(2 моля) (0,08206 \ dfrac {L \ atm} {mol \ K})} \ ]
\ [T_ {2} = 50,24 КБ \]
Решить за работу:
\ [w = n \ bar {C_ {V}} (T_ {2} — T_ {1}) \]
\ [w = (2 моль) (\ dfrac {3} {2}) (8,314 \ dfrac {J} {mol \ K}) (50,24–73,12 K) \]
\ [w = -571 Дж \]
3,31 квартал
Вы заметили, что ваша система изменяет объем с 10 л до 30 л при постоянном давлении 770 торр. Затем происходит снижение давления до 740 торр при неизменном объеме 30 л.Подсчитайте общий объем проделанной работы.
S3.31
Мы разделили решение на две части.
Работа, выполняемая при изменении объема, и работа, выполняемая при изменении давления.
Часть первая:
Вторая часть:
Перевести давление в атм:
= 107,4 Дж
Затем сложите две работы
Вт до = -2046.3 + 107,4 = -1938,9 Дж
3,33 кв.
Рассчитайте значения q, w, ΔU и ΔH для обратимого адиабатического расширения 1 моля двухатомного идеального газа с 10,00 м 3 до 35,0 м 3 с начальной температурой 298 К.
3,33 кв.
Рассчитайте значения q, w, ΔU и ΔH для обратимого адиабатического расширения 1 моля двухатомного идеального газа с 10,00 м 3 до 40,0 м 3 с начальной температурой 298 К.
Q3.34
0,27 моля аргона удерживают в контейнере при 3,0 атм и 298 К, а затем дают возможность адиабатически расширяться в двух различных условиях: (а) обратимо до 0,80 атм и (б) при постоянном давлении 0,80 атм. Рассчитайте конечную температуру в каждом случае.
3,34 кв.
В адиабатическом процессе 0,5 моля He 2 в контейнере могут расшириться при постоянном давлении 1,00 атм и 298 К. Конечная температура после расширения газа составляет 205 К.Рассчитайте начальное давление внутри контейнера.
S3.34
В адиабатическом процессе
\ (C_ {V} = (T_ {2} -T_ {1}) = — P_ {ex} (V_ {2} -V_ {1}) \)
получаем
\ (\ dfrac {3} {2} (T_ {2} -T_ {1}) = — P_ {ex} \ left (\ dfrac {T_ {2}} {P_ {2}} — \ dfrac { T_ {1}} {P_ {1}} \ right) \)
переставляем и получаем
\ (\ dfrac {3} {2} (T_ {2} -T_ {1}) = \ dfrac {P_ {ex} T_ {1}} {P_ {1}} — T_2 \)
решаем на
\ (P_ {1} \) и получаем \ (P_ {1} = \ dfrac {P_ {2}} {\ dfrac {T_ {2}} {T_ {1}} (\ dfrac {5} {2 }) — \ dfrac {3} {2}} \)
\ (P_ {1} = \ dfrac {1.00atm} {\ dfrac {205K} {298K} (\ dfrac {5} {2}) — \ dfrac {3} {2}} \)
\ (P_ {1} = 4,5 атм \)
3,34 кв.
Количество 0,27 моля аргона удерживается в контейнере при 3,0 атм и 298 К, а затем позволяет адиабатически расширяться в двух различных условиях:
- обратимо на 0,80 атм и
- против постоянного давления 0,80 атм.
Рассчитайте конечную температуру в каждом случае.
Q3.35a
Два моля идеального двухатомного газа \ (H_2 \) расширяются с 2.От 00 до 1,30 атм при охлаждении от 550 K до 250 K. Вычислите изменение энтальпии (∆H) и изменение внутренней энергии (∆U) для 2 различных процессов: a. обратимый и b. необратимый. Объясните и посчитайте разницу a и b?
3 кв. 35б
0,5 моль гелия при 298 К могут обратимо расширяться от 5 до 1 атм. Найдите q, w и ΔU, если
- процесс адиабатический и
- , если процесс изотермический.
Q3.36a
808 кДж / моль тепла выделяется при сжигании x (грамма) количества железа в калориметре бомбы постоянного объема.Калориметр, содержащий 100 г воды, имеет теплоемкость 2100 JoC -1 . Оцените количество железа, необходимое для увеличения температуры воды на 5,20 ° C?
3 кв. 36б
В калориметре бомбы постоянного объема у вас есть образец калия 0,3677 г. Температура воды вокруг образца увеличивается с 18,08 ºC до 20,667 ºC. Калориметр имеет теплоемкость 1515 Дж / (г ° C). Какое изменение внутренней энергии?
S3.36b
Поскольку калориметр бомбы имеет постоянный объем \ (\ Delta V \), работы (PV) нет, поэтому первый закон термодинамики
\ [\ Delta U = q + w \]
можно упростить до
\ [\ Delta U = q \]
Тогда связь между теплом и изменением температуры
\ [q = c_v \ Delta T \]
можно поменять
\ [\ Delta U = m \, c_v \, \ Delta T \]
, что в данном случае равно
\ [\ Delta U = (0.-_ {(aq)} \ rightarrow H_2O _ {(l)} \]
Какова конечная температура смешанного раствора?
3,39 кв.
1,52 г толуола \ ((C_7H_8) \) сжигают в калориметре бомбы постоянного объема при 25 ° C. Рассчитайте \ (\ Delta _r \ bar {U} \) и \ (\ Delta _r \ bar {H} \) для этой реакции, учитывая, что было выделено 39,183 кДж тепла.
S3.39
Сначала нам нужно построить сбалансированную реакцию, которая происходит
\ [C_7H_8 (l) + 9O_2 (g) \ rightarrow7CO_2 (g) + 4H_2O (l) \]
\ (\ Delta _r \ bar {U} = q_r = -q_ {cal} = \ dfrac {-39.{-3} \; кДж / К * моль) (298,15 \; K) = — 2380 \; кДж / моль \ end {align *} \)
3,39 кв.
ΔU a горения нафталина (C 10 H 8 ) составляет -480 кДж моль -1 . Тепло, выделяемое при сгорании в калориметре постоянного объема, составляет 7,5 кДж. Рассчитайте массу нафталина в граммах в калориметре.
3,40 кв.
Для реакции
\ [C_2H_5OH _ {(l)} + O_ {2 (g)} \ rightarrow CO_ {2 (g)} + H_2O _ {(l)} \]
- Баланс реакции
- Рассчитайте \ (∆_rH \) реакции, используя данные \ (∆_fH \).
3 кв.\ circ \), если
- уравнение умножается на 4;
- направление реакции обратное;
- \ (C_2H_6 \) был жидкостью вместо газа?
Q3.41a
На каком основании значение 0 стандартной энтальпии образования присваивается веществу при определенной температуре? На основании этого определите, какие вещества имеют Δ f H ° = 0, а какие нет при 1 атм и 25 ° C (дайте объяснение тем, у которых нет).
H 2 (г), O 3 (г), Al (тв), Br 2 (г), NaCl (тв), Cl2 (г)
Подсказка: посмотрите на стандартную энтальпию образования
S3.41a
Значение0 стандартной энтальпии образования присваивается элементарным веществам, которые находятся в своем естественном / стандартном физическом состоянии при определенных условиях температуры и давления.
- H 2 (г), Al (s), Cl 2 (г) — вещества с Δ f H ° = 0 кДж / моль
- O 3 (г) является элементарным веществом, но не встречается в природе при 25 ° C, O 2 (г) является.
- Br 2 (г) также не является стандартным состоянием брома.На STP физическое состояние брома жидкое
- NaCl не имеет значения 0, потому что это не элементарное вещество
3 кв. 41б
Какое из следующих веществ имеет стандартную энтальпию образования 0 K при 298 K?
O 2 (г), Br 2 (г), Hg (s), CH 4 (г)
Q3. {\ circ} = — 84.\ circ = q_p = \ dfrac {178,3 кДж} {\ dfrac {2,3 г} {100,09 г / моль}} = 7759,15 кДж / моль \]
3 кв. 4б
В химическом эксперименте в средней школе 10 граммов метана были сожжены в присутствии избытка кислорода при стандартных условиях. Калориметр показал, что в результате реакции в окружающую среду было выделено 554,9 кДж тепла. Предполагая, что измерения калориметра учитывают все изменения тепла, связанные с реакцией, запишите реакцию горения метана и вычислите изменение энтальпии, связанное с ней.
3.46 квартал
Энтальпия реакции процесса изомеризации 1-бутена в 2-бутен составляет -7,1 кДж / моль.
=
1-бутен 2-бутен
Если гидрирование бутена-1 имеет энтальпию реакции -126,8 кДж / моль. Сколько энергии потребуется для гидрирования 2-бутена? Имейте в виду, что оба процесса дают один и тот же продукт.
Подсказка: посмотрите на пример задачи изменения стандартной энтальпии реакции
S3.46
1-бутен + 2H 2 → бутан Δ f H ° = -126.8 кДж / моль
1-бутен → 2-бутен Δ f H ° = -7,1 кДж / моль
Обратить вторую реакцию и объединить две реакции
1-бутен + 2H 2 → бутан Δ f H ° = -126,8 кДж / моль
2-бутен → 1-бутен Δ f H ° = +7,1 кДж / моль
Δ r H ° = -126,8 кДж / моль +7,1 кДж / моль
Δ r H ° = -119.{\ circ} \]
\ [= 3 \ left (-393.5 \ frac {KJ} {mol} \ right) +4 \ left (-285.8 \ frac {KJ} {mol} \ right) — \ left (-2005.8 \ frac {KJ} {mol} \ right) = — 317.9 \ frac {KJ} {mol} \]
3.48 квартал
Двухатомный газообразный фтор имеет Cp 31,3 Дж / К * моль. Какова его молярная энтальпия образования на поверхности планеты Венера (при стандартном давлении), где температура обычно составляет 465 ° C?
S3.48
При постоянном давлении изменение энтальпии в зависимости от температуры определяется выражением Cp.Определив изменение температуры и умножив его на Cp, мы можем найти изменение энтальпии.
ΔT = 465 ° C — 25 ° C = 440K
ΔH = 31,3 Дж / К * моль * 440K = 13,772 кДж / моль
3,50 кв.
Горючесть графита
C (г) + O 2 (г) → CO 2 (г)
Рассчитайте изменение энтальпии сгорания с 298 K до 398 K. Молярные значения C p следующие (в Дж K -1 моль -1 ): C (гр): 8.52, O 2 (г): 29,4 и CO 2 (г): 37,1
Q3.53
Какие значения необходимы для расчета изменения стандартной энтальпии реакции?
3 квартал 54
Рассмотрим следующие реакции:
C (графит) + O 2 (г) → CO (т) ∆ r H = -110,5 кДж / моль
CO 2 (г) → Co (s) + O 2 (г) ∆ r H = 283,0 кДж / моль
Найти энтальпию образования диоксида углерода (CO 2)
S3.54
\ (\ Delta H \) реакции представляет собой сумму \ (\ Delta H_1 \) и \ (\ Delta H_2 \)
\ [2C + O_2 \ rightarrow 2CO \, \ ,, \ Delta H_1 = -110,5 кДж / моль
\ [2CO + O2 \ вправо 2CO_2 \ Delta H_2 = -283 кДж / моль
, таким образом, \ (\ Delta H \) реакции составляет (-110,5) + (- 283,0) = -393,5 кДж / моль
Q3.55
Что такое Δ r H º следующей реакции? Δ f H º для O (г) составляет 249,4 кДж моль -1 и Δ f H º для O 3 (г) составляет 142.{\ circ} _ {rxn} = 392,1 \ dfrac {кДж} {mol} \]
3,60 кв.
Метан горит, какова энтальпия горения этой реакции?
| Вещество | Стандартные молярные энтальпии образования при 25ºC |
|---|---|
CH 4 (г) | -74,85 кДж / моль |
| CO 2 (г) | -393.5 кДж / моль |
| H 2 O (г) | -241,8 кДж / моль |
| H 2 O (л) | -285,8 кДж / моль |
S3.60
Напишите сбалансированную формулу этой реакции, чтобы определить коэффициенты
\ [CH_ {4 (g)} +2 O_ {2 (g)} \ rightarrow 2H_2O _ {(l)} + CO_ {2 (g)} \]
\ [\ Delta H = \ sum H_ {products} — сумма H_ {реагенты} \]
\ [= 2x H (H_2O) + H (CO_2) — H (CH_4) \]
Мы не включаем \ (O_2 \), потому что это стандартное состояние
\ [= [(2 х -285.8 + -393,5) — (-74,85)] кДж / моль \]
\ [= — 890,25 \; кДж / моль \]
3,62 кв.
Предскажите, будут ли значения q, w, ΔU и ΔH положительными, нулевыми или отрицательными для каждого из следующих процессов: (а) замерзание льда при 1 атм и 273 К, (б) плавление твердого бутанола при 1 атм и нормальной температурой плавления, (c) обратимое изотермическое сжатие идеального газа и (d) обратимое адиабатическое сжатие идеального газа.
3,62 кв.
Предскажите, будут ли значения q, w, ΔU и ΔH положительными, нулевыми или отрицательными для каждого из следующих процессов: (а) замерзание льда при 1 атм и 273 К, (б) плавление твердого бутанола при 1 атм и нормальной температурой плавления, (c) обратимое изотермическое сжатие идеального газа и (d) обратимое адиабатическое сжатие идеального газа.
3,63 кв.
Первый закон термодинамики гласит, что энергия сохраняется. Его нельзя ни разрушить, ни создать. Используя уравнение Эйнштейна E = mc 2 , объясните, как большое количество энергии необходимо для слияния атомов вместе. Если энергия сохраняется, куда девалась вся эта энергия?
S3.63
Когда большое количество энергии используется для слияния атомов вместе (например, слияние), мы можем наблюдать, что масса атомов очень мала по сравнению с количеством используемой энергии.Однако, используя уравнение Эйнштейна E = mc 2 , мы видим, что масса умножается на квадрат скорости света, что дает очень большое число. Энергия не разрушалась, а накапливалась в химических связях атомов.
3,64 кв.
Для ядерного процесса мы не можем применить предположение, что \ (∆_fH = 0 \) для наиболее стабильных элементов, потому что есть разные компоненты в сторонах реагента и продукта. Объясните эту разницу?
Q3.{-3} кДж / К * моль)} = 8613.6K \ end {align *} \)
3,70 кв.
Реакция ниже представляет собой окисление 2-пропанола с образованием ацетона
a) Рассчитайте изменение энтальпии реакции, используя энтальпии связи
б) Сравните результат с реакцией горения 2-пропанола, имеющей энтальпию -1825,5 кДж / моль. Что это говорит о двух реакциях. (Подсказка: посмотрите на энтальпию связи).
S3.70
а)
| Типы формируемых облигаций | Количество образованных облигаций | Энтальпия связи (кДж / моль) | Изменение энтальпии (кДж / моль) |
|---|---|---|---|
| C-H | 6 | 414 | 2484 |
| К-С | 2 | 347 | 694 |
| C = O | 1 | 724 | 724 |
| O-H | 1 | 460 | 460 |
\ [\ Delta _ {r} H ^ {\ circ} = \ sum BE (реагенты) — \ sum BE (продукты) = [(2898 + 694 + 351 + 460) — (2484 + 694 + 724 +460)] \ frac {kJ} {mol} = {\ color {red} +41 \ frac {kJ} {mol}} \]
b) Согласно значениям энтальпии, энтальпия окисления 2-пропанола в кетон положительна, а его сгорание в значительной степени отрицательно.Это говорит о том, что, хотя кислород участвует, эти две реакции различны. При сгорании выделяется тепло там, где другому процессу требуется поглощение энергии для протекания реакции. В этом случае обычно используется другой катализатор.
Q3.71a
Молярная энтальпия сублимации неизвестного органического вещества составляет 58,05 кДж / моль, а молярная энтальпия испарения составляет 37,12 кДж / моль. Используя эти значения, дайте оценку молярной энтальпии плавления этого вещества.{\ circ} = 58.05 \ frac {KJ} {mol} -37.12 \ frac {KJ} {mol} = 20.93 \ frac {KJ} {mol} \]
Q3.71b
Рассчитайте стандартную энтальпию сублимации этанола. Δ fus H º (этанол) = 4,9 кДж моль -1 и Δ пар H º (этанол) = 38,56 кДж моль -1 .
S3.71b
Вы можете оценить стандартную энтальпию сублимации, сложив стандартные энтальпии плавления и испарения, поскольку сублимация состоит из двух одновременных фазовых переходов.См. Здесь для получения дополнительной информации об этом.
Δ sub H º (этанол) = 4,9 + 38,56 = 43,46 кДж моль -1
3,72 кв.
Азотная кислота нейтрализуется гидроксидом по реакции HNO 3 (водн.) + OH — (водн.) → H 2 O (l) + NO 3 — (водн.). Энтальпия диссоциации воды составляет 55,8 кДж / моль. Каково изменение энтальпии диссоциации азотной кислоты?
Химическая промышленность | HNO 3 | ОН — | H 2 O | НЕТ 3 — |
|---|---|---|---|---|
Δ f H (кДж / моль) | -207. |

Leave A Comment