Задание 28 ЕГЭ по химии. Практика
Подборка реальных заданий прошлых лет.
№28 в спецификации ЕГЭ
Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси.
28_zadania.pdf
28_otvety.pdf
Вычислите объём аммиака (н.у.), полученного с выходом 90% при нагревании 13,2 г сульфата аммония с избытком гидроксида кальция. (Запишите число с точностью до целых.)
Ответ: 4 л.
Какой объём (н.у.) ацетилена может быть получен из 2,4 кг технического карбида кальция с массовой долей примесей 20%? (Запишите число с точностью до целых.)
Ответ: 672 л.
В результате взаимодействия водорода с угарным газом объёмом 19,94 л (н.у.) образовался метанол массой 12,8 г. Вычислите выход продукта реакции. (Запишите число с точностью до целых. )
)
Ответ: 45%.
При взаимодействии 200 г технического карбида кальция с избытком воды образовалось 56 л (н.у.) ацетилена. Определите массовую долю примесей в техническом образце карбида кальция. (Запишите число с точностью до целых.)
Ответ: 20%.
Из 220 г природного известняка при взаимодействии с соляной кислотой был получен хлорид кальция массой 222 г. Вычислите массовую долю примесей в образце карбоната кальция. (Запишите число с точностью до целых.)
Ответ: 9%.
Технический карбид алюминия массой 90 г, в котором массовая доля примеси углерода составляет 4%, растворили в избытке соляной кислоты. Определите массу образовавшейся при этом соли. (Запишите число с точностью до десятых.)
Ответ: 320,4 г.
Вычислите объём газа (н.у.), полученного при прокаливании 175 г технического карбоната магния, в котором массовая доля некарбонатных примесей составляет 4%. (Запишите число с точностью до десятых.)
Ответ: 44,8 л.
При сжигании в кислороде 17,6 г сульфида железа(II) было получено 4 л (н. у.) газа. Определите выход газа в указанной реакции. (Запишите число с точностью до целых.)
у.) газа. Определите выход газа в указанной реакции. (Запишите число с точностью до целых.)
Ответ: 89%.
Вычислите объём газа (н.у.), полученного при внесении в воду 40 г технического лития, в котором массовая доля примеси оксида лития составляет 30%. (Запишите число с точностью до десятых.)
Ответ: 44,8 л.
Вычислите массу меди, полученной при добавлении к избытку раствора сульфата меди(II) 3 г технического алюминия, в котором массовая доля примеси оксида алюминия составляет 10%. (Запишите число с точностью до десятых.)
Ответ: 9,6 г.
Вычислите объём (н.у.) газа, полученного с выходом 90% при внесении в воду 28 г лития. (Запишите число с точностью до целых.)
Ответ: 40 л.
Рассчитайте объём (н.у.) углекислого газа, образующегося при сплавлении карбоната натрия с 6,25 г оксида кремния(IV), содержащего 4% примеси кремния. (Запишите число с точностью до сотых.)
Ответ: 2,24 л.
Определите массу спирта, который может быть получен из 63 г глюкозы, если выход продукта реакции составляет 14%. (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)
Ответ: 4,5 г.
В результате реакции гидрогенизации бензола получили 840 г циклогексана, выход которого составил 80%. Вычислите массу бензола, израсходованного в этой реакции. (Запишите число с точностью до целых.)
Ответ: 975 г.
В результате реакции тримеризации ацетилена объёмом 26,88 л (н.у.) получили 23,4 г бензола. Вычислите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 75%.
Из 150 кг природного известняка при взаимодействии с азотной кислотой был получен нитрат кальция массой 196,8 кг. Вычислите массовую долю примесей в указанном известняке. (Запишите число с точностью до целых.)
Ответ: 20%.
В результате нитрования 468 г бензола было получено 676,5 г нитробензола. Определите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 92%.
При пропускании над нагретым оксидом меди(II) 5,6 л (н.у.) смеси аммиака с азотом было получено 19,2 г меди. Определите объёмную долю примеси азота в исходной газовой смеси. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
Ответ: 20%.
При взаимодействии 2,494 г технического карбоната натрия с избытком азотной кислоты выделилось 0,448 л (н.у.) углекислого газа. Какова массовая доля чистого вещества в этом образце соды? (Запишите число с точностью до целых.)
Ответ: 85%.
Вычислите объём углекислого газа (н.у.), полученного при прокаливании 50 г малахита, в котором массовая доля некарбонатных примесей составляет 20%. (Запишите число с точностью до целых.)
Ответ: 4 л.
Вычислите объём кислорода (н.у.), полученного с выходом 90% при термическом разложении 86,8 г оксида ртути(II). (Запишите число с точностью до целых.)
Ответ: 4 л.
При взаимодействии 1 кг технического карбида кальция с избытком воды образовалось 280 л (н.у.) ацетилена. Определите массовую долю примесей в техническом образце карбида кальция. (Запишите число с точностью до целых.)
Ответ: 20%.
Вычислите объём газа (н.у.), полученного действием избытка разбавленного раствора серной кислоты на 156,25 г технического сульфида алюминия, в котором массовая доля несульфидных примесей составляет 4%. (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)
Ответ: 67,2 л.
При растворении 6,21 г технического алюминия в кислоте образовалось 6,72 л (н.у.) водорода. Определите массовую долю примесей в техническом образце алюминия. (Запишите число с точностью до целых.)
Ответ: 13%.
При термическом разложении 26,88 л (н.у.) метана образовалось 11,2 л (н.у.) ацетилена. Определите выход продукта реакции. (Запишите число с точностью до десятых.)
Ответ: 83,3%.
Какая масса магнетита Fe3O4, содержащего 20% примесей, необходима для получения 16,8 кг железа? (Запишите число с точностью до целых.)
Ответ: 29 кг.
При взаимодействии 33,6 л (н.у.) водорода с избытком азота образовался аммиак массой 5,1 г. Определите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 30%.
При прокаливании 333 г калийной селитры получили 33,6 л (н.у.) кислорода. Вычислите массовую долю примесей в образце калийной селитры. (Запишите число с точностью до целых.)
Ответ: 9%.
При взаимодействии 11,2 г железа с избытком хлора образовалось 26 г соли. Определите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 80%.
При взаимодействии 840 г технического карбоната магния с избытком соляной кислоты образовалось 179,2 л (н.у.) углекислого газа. Определите массовую долю примесей в техническом образце карбоната магния. (Запишите число с точностью до целых.)
Ответ: 20%.
В результате каталитического окисления сернистого газа кислородом, взятым в объёме 31,36 л (н.у.), образовался оксид серы(VI) массой 84 г. Определите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 38%.
При обжиге технического сульфида меди(II) массой 5,21 г получили сернистый газ объёмом 896 мл (н.у.). Вычислите массовую долю примесей в техническом образце сульфида меди(II). (Запишите число с точностью до десятых.)
Ответ: 26,3%.
При взаимодействии хлорида аммония с гидроксидом бария массой 34,2 г образовался аммиак объёмом 6,9 л (н. у.). Определите выход продукта реакции. (Запишите число с точностью до целых.)
у.). Определите выход продукта реакции. (Запишите число с точностью до целых.)
Ответ: 77%.
При сплавлении гидроксида калия с техническим ацетатом калия массой 2,2 г образовался метан объёмом 448 мл (н.у.). Вычислите массовую долю примесей в техническом образце ацетата калия. (Запишите число с точностью до целых.)
Ответ: 11%.
При растворении в избытке соляной кислоты 5,4 г алюминия было получено 5,04 л (н.у.) газа. Определите выход газа в указанной реакции. (Запишите число с точностью до целых.)
Ответ: 75%.
Вычислите объём (н.у.) газа, полученного с выходом 85% при полном термическом разложении 158 г перманганата калия. (Запишите число с точностью до сотых.)
Ответ: 9,52 л.
Вычислите объём газа (н.у.), полученного действием избытка раствора соляной кислоты на 200 г технического сульфида цинка, в котором массовая доля несульфидных примесей составляет 3%. (Запишите число с точностью до десятых.)
Ответ: 44,8 л.
Какой объём (н.у.) оксида азота(II) образуется при каталитическом окислении 0,56 моль аммиака кислородом? Выход продукта считать равным 100%. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
Ответ: 13 л.
Какая масса альдегида образуется при окислении 0,5 моль этанола оксидом меди(II)? Выход продукта считать равным 50%. (Запишите число с точностью до целых.)
Ответ: 11 г.
Определите объём (н.у.) ацетилена, который необходим для получения 0,3 моль бензола. Выход продукта считать равным 20%. (Запишите число с точностью до десятых.)
Ответ: 100,8 л.
Какова масса продукта, образовавшегося в результате окисления 0,6 моль оксида серы(IV) кислородом? Выход продукта считать равным 75%. (Запишите число с точностью до целых.)
Ответ: 36 г.
Тесты входного контроля по химии (для профессий и специальностей технического профиля)
Входной контроль
Задания с выбором ответа
Вариант 1.
№ 1. К физическим явлениям относится:
1) | разложение воды электрическим током |
2) | испарение воды |
3) | горение свечи |
4) | скисание молока |
№ 2.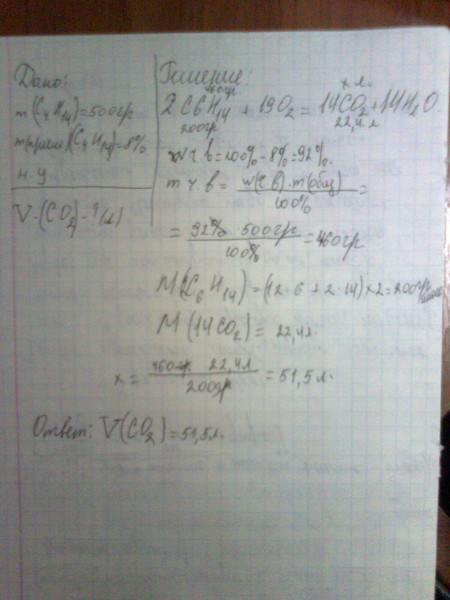 Сокращенное ионное уравнение реакции Mg2+ + 2OH– = Mg(OH) 2 соответствует взаимодействию:
Сокращенное ионное уравнение реакции Mg2+ + 2OH– = Mg(OH) 2 соответствует взаимодействию:
1) | магния с гидроксидом натрия |
2) | оксида магния с водой |
3) | хлорида магния с гидроксидом калия |
4) | нитрата магния с гидроксидом алюминия |
№ 3.Укажите название основного оксида.
1) | оксид углерода (IV) |
2) | оксид кремния |
3) | оксид магния |
4) | оксид серы (VI) |
№ 4. Водород образуется в результате взаимодействия:
Водород образуется в результате взаимодействия:
1) | H3PO4 и CaO |
2) | H2SO4 и Ca(OH)2 |
3) | HCl и Ca |
4) | HNO3 и CaCO3 |
№ 5.Формула вещества, обозначенного «X» в схеме превращений
P X H3PO4,
1) | PH3 | 2) | P2O3 | 3) | P4O6 | 4) | P2O5 |
Задания с кратким ответом
№ 6. При взаимодействии хлорида алюминия с гидроксидом калия образовалось 39 г осадка. Масса гидроксида калия равна _______г.
При взаимодействии хлорида алюминия с гидроксидом калия образовалось 39 г осадка. Масса гидроксида калия равна _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 22,4 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8.Массовая доля растворенного вещества в растворе, полученном при растворении
20 г сахара в 140 г воды, равна ________ %.
Входной контроль
Задания с выбором ответа
Вариант 2.
№ 1. При сжигании жёлтой серы образуется газ с резким запахом. Это явление:
1) | физическое, т. к. нового вещества не образуется |
2) | физическое, т. |
3) | химическое, т. к. наблюдаются признаки реакции изменение цвета и появление запаха |
4) | химическое, т. к. образуется ядовитый газ |
№ 2. В соответствии с сокращенным ионным уравнением Cu2+ + 2ОН— = Сu(ОН)2 взаимодействуют:
1) | CuS04 и Fe(OH)2 |
2) | CuCl2 и Са(ОН)2 |
3) | Cu2S03 и NaOH |
4) | КОН и Cu2S |
№ 3. Основный оксид, кислота, нерастворимое основание, соль расположены в ряду:
Основный оксид, кислота, нерастворимое основание, соль расположены в ряду:
1) | CaO, HCl, NaOH, NaCl |
2) | CaO, HCl, Cu(OH)2, NaCl |
3) | CaO, HCl, Cu(OH)2, CuO |
4) | CO2, NaH, Cu(OH)2, NaCl |
№ 4. Оксид серы (VI) SO3 вступает в реакцию со всеми веществами ряда
1) | Ca(OH)2, H2SO4, Zn |
2) | K2O, NaOH, SO2 |
3) | K2O, NaOH, H2O |
4) | H2O, Na2O, SO3 |
№ 5. Формула вещества, обозначенного «X» в схеме превращений Mg → Х → MgSO4
Формула вещества, обозначенного «X» в схеме превращений Mg → Х → MgSO4
1) | MgH2 | 2) | MgO | 3) | Mg3P2 | 4) | MgCl2 |
Задания с кратким ответом
№ 6. Вычислить массу углекислого газа, образовавшегося при сжигании 32г метана CH4, CH4 + 2O2 = CO2 +2H2O. Масса углекислого газа равна _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 44,8 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. В 180 г воды растворили 20 г хлорида калия KCl. Определите массовую долю хлорида калия в растворе ________ ( %)
Входной контроль
Задания с выбором ответа
Вариант 3.
№ 1. К химическому явлению относится процесс:
1) | замерзание воды |
2) | прокисание молока |
3) | ковка металла |
4) | размягчение стекла при нагревании |
№ 2. Сущность реакции обмена между растворами нитрата серебра и соляной кислотой можно выразить сокращенным ионным уравнением:
1) | Ag+ + Сl— = AgCl↓ |
2) | Н+ + CI— = НСl |
3) | Ag+ + NO3— = AgNO3 |
4) | Н++ NO3— = HNO3 |
№ 3. Формула кислотного оксида, основания, соли, соответственно:
Формула кислотного оксида, основания, соли, соответственно:
1) | SO3, Cu(OH)2, FeCl2 |
2) | SO2, BaO, H2S |
3) | CuO, Fe(OH)2, Na2CO3 |
4) | H2O, CuO, NaOH |
№ 4. Хлороводородная кислота HCl вступает в реакции со всеми веществами, записанными в ряду
1) | Na2O, SO3, CaCl2 |
2) | NaOH, K2O, CuO |
3) | P2O5, H2SO3, Ca(OH) 2 |
4) | ) CuO, HCl, NaOH |
№ 5. Формула вещества, обозначенного «X» в схеме превращений
Формула вещества, обозначенного «X» в схеме превращений
MgO → Х → Mg(OH)2
1) | MgH2 | 2) | Mg | 3) | MgSO4 | 4) | Mg3P2 |
Задания с кратким ответом
№ 6. Масса цинка, расходуемого для получения 12 г водорода, при взаимодействии с соляной кислотой (Zn + 2HCl = ZnCl2 +H2 ) составляет _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 11,2 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. Для приготовления 400 г 2%-го раствора соли, необходимо взять соль массой___ г.
Входной контроль
Задания с выбором ответа
Вариант 4.
№ 1. Плавление парафина и подгорание пищи на сковородке представляют соответственно явления:
1) | оба химические |
2) | оба физические |
3) | химическое и физическое |
4) | физическое и химическое |
№ 2. Сущность реакции обмена между растворами сульфата натрия и хлорида бария можно выразить сокращенным ионным уравнением:
1) | Na+ + CI— = NaСl |
2) | Ва 2+ + SO42- = BaSO4↓ |
3) | Na+ + SO42- = Na2 SO42- |
4) | Ва 2+ + CI— = BaСl2 |
№ 3. Соль, кислота, основание записаны соответственно в строке:
Соль, кислота, основание записаны соответственно в строке:
1) | Fe3O4, Ba(OH)2, BaCl2 |
2) | Li2O, H2S, Cu(OH)2 |
3) | KClO3, HNO3, RbOH |
4) | SO4, Na2SO3, H2SO4 |
№ 4. Оксид меди (II) CuO взаимодействует со всеми веществами ряда:
1) | SO3, HCl, HN O 3 |
2) | SO 2, СаO, H 2 SO4 |
3) | H2O, Ca O, H 2 SO 4 |
4) | H 2O, FeO, P 2O 5 |
№ 5. Формула вещества, обозначенного «X» в схеме превращений Fe → Х → FeSO4
Формула вещества, обозначенного «X» в схеме превращений Fe → Х → FeSO4
1) | Fe(OH)2 | 2) | FeO | 3) | Fe(OH)3 | 4) | Fe2O3 |
Задания с кратким ответом
№ 6. Масса серы, прореагировавшей с 5,4 г алюминия, равна _______ г. Уравнение химической реакции имеет вид 2Al + 3S= Al2S3
№ 7. Объём углекислого газа, образовавшегося при сжигании 67,2 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. Для приготовления 200 г 5%-го раствора соли, необходимо взять соль массой___ г.
CH(4)(g) + 2O(2)(g) в CO(2)(g) + 2H(2)O(l)
КОНЦЕПЦИЯ ICSE-MOLE И СТЕХИОМЕТРИЯ-ИЛЛЮСТРАТИВНЫЕ ЗАДАНИЯ
20 видеоРЕКЛАМА
Ab Padhai каро бина объявления ке
Khareedo DN Pro и дехо сари видео бина киси объявление ки rukaavat ке!
Обновлено: 27 июня 2022 г.
Текст Решение
Решение
Пусть x — объем CO2, образующийся при сжигании 8 г Ch5.
8гCh5(г)1моль16г+2O2(г)→x(объем)CO2(г)1моль44г=22,4л при СТП+2ч3О(л)
Соотношение пропорций: 8gCh516gCh5=xCO222.4LCO2
Или, x=8gCh516gCh5×22.4L=11.2L
Ответ
Пошаговое решение, разработанное экспертами, чтобы помочь вам в сомнениях и получить отличные оценки на экзаменах.
Расшифровка
У меня не должно быть здесь вопроса: вычислите объем двуокиси углерода, образовавшейся, когда 1 г газообразного метана был полностью представлен уравнением Сабхи, есть вопросы здесь ch5 Plus total дает CO2 + Tu h Tu соотношение это вопрос соотношение между диоксидом углерода и метаном и диоксид углерода и метан и диоксид углерода показывают один моль метан может дать один моль СО2 что означает один моль одного моля СО2 на самом деле означает СР 1 молярная
n h q 5 22,4 литра объема, так что также ch5 равен молекулярной массе ch5 равен 4 в одном 16 грамм на моль грамм молекулярная масса грамма на моль, что означает, если вы видите соотношение между ch5 и CO2, поэтому 16 граммов Метан при сгорании дает 22,4 литра СО2 вопрос о волосах 18 граммов метана сгорело когда мы сожгли всего 8 граммов метана
какой объем газировки производит нексус равный 22,4 в 85 действующем институте около 11,2 литров СО2 болячка и сжигая 8 граммов метана, мы можем получить только 11,2 литра СО2, спасибо 9(-1) CH_(4)(g)+2O_(2)(g)в CO_(2)(g)+2H_(2)O(g)
16597821
Рассмотрим следующие реакции: CH_(4) (г) + 2O_(2)(г) в CO_(2)(г) + 2H_(2)O(г) Сколько молей метана требуется для получения 22 г CO_(2) (г) после сгорания?
18255000
Сколько молей метана требуется для получения 22 г CO2(г)+ после сгорания:-
Ch5(г)+2O2(г)+2h3O(г)
23681705
CH_(4): При наличии тепла: C(s)+ O_(2)(g) rarr CO_(2) (g) » «DeltaH =-394 кДж 2H_(2)(г)+ O_(2)(г) ррр 2H_(2)O(ж) ррр 2H_(2)O(ж) «»DeltaH =-394 кДж CH_(4)(г) + 2O_(2)(g) rarr CO_(2)(g) + 2H_(2)O(l) » » DeltaH =- 394 KJ
34965685
Text Solution
Стандартная теплота образования Ch5(g), CO2(г) и h3O(ж) равны -75, -393,5, -286 кДж соответственно. Найдите изменение энтальпии реакции. CH5 (G)+2O2 (G) → CO2 (G)+2H3O (L)
Найдите изменение энтальпии реакции. CH5 (G)+2O2 (G) → CO2 (G)+2H3O (L)
41524753
CH5 (G)+2O2 (G) → CO2 (G)+2H3O (G) यह winसायनिक समीक समीक है:
121332810
Рассмотрим следующие реакции: CH_(4)(г) + 2O_(2)(г) в CO_(2)(г) + 2H_(2)O(г) Сколько молей метана требуется для получения 22 г CO_ (2) (ж) после сгорания?
571224678
Для данной реакции
Ch5(г)+2O2(г)→CO2(г)+2h3O(ж)
При использовании 64 г O2 образуется 44 г CO2.
8 г Ch5 реагирует с образованием 36 г продукта.
22 г CO2 образуется из 3,011×1023 молекул Ch5.
При STP, если используется 22,4 литра O2(г), образуется 11,2 литра CO2.
Какие из приведенных выше утверждений верны?
643041378
Text Solution
В эксперименте смесь 8 г Ch5 и 24 г O2 была сожжена с образованием CO2 и h3O в соответствии с уравнением: Ch5(г)+2O2(г)→CO2(г)+2h3O(г)+тепло
Какой реагент в лимитирующем реагенте (малая пропорция)?
644043933
В эксперименте смесь 8г Ch5 и 24gO2 была сожжена с образованием CO2 и h3O по уравнению: Ch5(г)+2O2(г)→CO2(г)+2h3O(г)+тепло
Сколько молей СО2 будет образовываться?
644043934
В эксперименте смесь 8 г Ch5 и 24 г O2 была сожжена с образованием CO2 и h3O по уравнению: Ch5(г)+2O2(г)→CO2(г)+2h3O(г)+тепло
Сколько граммов СО2 будет образовываться?
644043935
Рассчитайте массу газообразного кислорода, который соединится с 8 г метана, согласно химическому уравнению CH_(4) + 2O_(2) в CO_(2) + 2H_(2)O. (РАМ: H = 1, O = 16 , C = 12.)
(РАМ: H = 1, O = 16 , C = 12.)
644044065
Ch5(г)+2O2(г)→CO2(г)+2h3O(ж), ΔH=−890 кДж
какова теплотворная способность или топливная ценность 1 кг Ch5?
644119269
ChemTeam: Стехиометрия: Объем (газа) Примеры
ChemTeam: Стехиометрия: Объем (газа) ПримерыСтехиометрия
Объем-объем Примеры
(объем газа, а не раствора)
Датчики №1–10
Вернуться в меню стехиометрии
Краткое введение: Ключевым моментом, на который следует обратить внимание, являются условия температуры и давления. Если они остаются постоянными, вы можете обращаться с объемами так же, как с родинками. Это связано с тем, что в условиях постоянных Т и Р объемы прямо пропорциональны молям. Это обсуждается в нескольких решениях проблем ниже.
Хотя подавляющее большинство задач стехиометрии на основе объема сформулированы в терминах постоянных T и P, это не обязательно. Вы можете увидеть это в задачах 1b и 9 чуть ниже. Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
(1) Преобразовать объем в моли, используя PV = nRT и исходный набор T и P(2) Используйте отношение и пропорцию для определения молей другого вещества, связанного с проблемой.
(3) Используйте PV = nRT с новыми T и P, а также молями вещества из шага 2. Вы рассчитаете новый объем.
Будьте готовы! Ваш учитель может показать ситуацию, когда T и P не меняются, а затем проверить ситуацию, когда T и P меняются.
Пример №1: Уравнение сгорания метана:
CH 4 + 2O 2 —> 2H 2 O + CO 2
(a) Если на СТП сжечь 50,0 л метана, какой объем двуокиси углерода будет произведен на СТП?
(b) Если сжечь 50,0 л метана на НТП, какой объем газообразной воды образуется на НТП?
Решение (а):
Поскольку все происходит в STP, объемы прямо пропорциональны молям используемого реагента и произведенного продукта. Почему? Рассмотрим PV = nRT. Перепишите это как:
Почему? Рассмотрим PV = nRT. Перепишите это как:
н/В = П/РТВсе в правой части постоянно, поэтому отношение n:V также должно быть постоянным. Это означает, что объем прямо пропорционален количеству молей газа.
Поскольку существует молярное соотношение 1:1 между CH 4 и CO 2 , ответ 50,0 л
Решение (б):
1) Используйте PV = nRT для определения молей метана:
(1,00 атм) (50,0 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 2,044665 моль
Примечание: в этой задаче я принимаю комнатную температуру равной 25,0 °C, поскольку RTP означает комнатную температуру и давление.
2) Используйте молярное соотношение метан:вода:
1 к 2 как 2,044665 моль к хх = 4,08933 моль произведенной воды
3) Используйте PV = nRT для расчета объема водяного пара при нормальных условиях:
(1,00 атм) (V) = (4,08933 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 К)В = 91,6 л (до трех знаков фиг.
)
Пример #2: Учитывая следующее уравнение:
C(т) + 2H 2 (г) —> CH 4 (г)
Сколько литров водорода необходимо для производства 20,0 л метана?
Решение:
1) P и T не являются частью этой задачи:
Это потому, что в задаче вообще не упоминаются Т или Р. Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
2) Сформулируйте гипотезу Авогадро (используя моли, а не молекулы):
Равные объемы газа при одинаковых температуре и давлении содержат одинаковое число молей
3) Укажите молярное соотношение водорода и метана:
2:1
4) Используйте соотношение и пропорцию:
2 моля водорода соответствует 1 молю метана, поскольку x литров водорода соответствует 20,0 л метанах = 40,0 л водорода
Пример №3: 2,35 л газообразного кислорода реагирует с 3,72 л газообразного водорода с образованием воды. Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Решение:
1) Сбалансированное химическое уравнение:
2Н 2 + О 2 —> 2Н 2 О
2) Определите лимитирующий реагент:
кислород: 2,35 / 1 = 2,35
водорода: 3,72/2 = 1,86Водород является лимитирующим реагентом.
Обратите внимание, что в задаче не упоминается ни температура, ни давление. Это означает, что все происходит при неизменной температуре и давлении. Следовательно, эти два значения остаются постоянными и выпадают из рассмотрения. Нам не нужны моли, потому что в ситуации постоянной температуры и давления объемы прямо пропорциональны количеству молей.
Кроме того, мы не можем даже вычислить моли, так как не знаем ни температуры, ни давления.
3) Использовать H 2 :O 2 молярное соотношение:
2 равно 1, как 3,72 равно xИспользуется 1,86 л кислорода.
2,35 − 1,86 = 0,49 л непрореагировавшего кислорода остается
4) Выход в процентах:
Производится 3,72 л воды.2,50 / 3,72 = 67,2%
Пример #4: Сколько воздуха необходимо (в м 3
Решение:
1) Сжигание пропана:
C 3 H 8 + 5O 2 —> 3CO 2 + 4H 2 O
2) Определить количество молей чистого кислорода, необходимое для сжигания 10,0 моль пропана:
1 соответствует 5, как 10,0 соответствует хx = 50,0 моль необходимого кислорода
3) Используйте PV = nRT для перевода молей кислорода в литры кислорода при условиях, указанных в задаче:
(1,00 атм) (V) = (50,0 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (298 К)В = 1222,694 л
4) Преобразовать в требуемый объем воздуха:
1222,694 л / 0,21 = 5822,35 л
5) Перевести в кубические метры:
5822,35 L = 5822,35 дм 31 м 3 = 1000 дм 3
(5822,35 дм 3 ) (1 м 3 / 1000 дм 3 ) = 5,82 м 3 (до трех знаков фиг.
)
Пример #5: Пропан (C 3
Решение:
Поскольку T или P не указаны, мы предполагаем, что реакция происходит при постоянной температуре и нажатии.Это означает, что коэффициенты сбалансированного уравнения представляют объемное соотношение, в котором реагируют вещества.
5 объемов O 2 произведут 3 объема CO 2
Отсюда находим:
5/3 равно 2,8/xх = 1,68 л
Если бы мы предположили, что Т и Р изменились в ходе реакции, мы не смогли бы решить задачу. Однако не делайте этого предположения. Ваш учитель был бы недоволен.
Пример №6: Метан горит по следующему уравнению:
CH 4 + 2O 2 —> CO 2 + 2H 2 O
Рассчитайте объем воздуха, необходимый для сжигания 10,0 л метана при одинаковых температуре и давлении. Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Решение:
Коэффициенты дают молярное соотношение, при котором реагируют метан и кислород при одинаковых Т и Р.1 соответствует 2, как 10.0 соответствует х
x = требуется 20,0 л чистого кислорода.
20,0 л / 0,20 = требуется 100,0 л воздуха.
Пример № 7: Монооксид азота реагирует с кислородом в соответствии с приведенным ниже уравнением:
2NO(г) + O 2 (г) —> NO 2 (г)
Сколько литров NO (реагирующего с избытком кислорода) требуется для получения 3,0 литров NO 2 ?
Решение:
1) Указать соответствующее соотношение объемов:
2:1
2) Напишите соотношение и пропорцию:
2 соответствует 1, поскольку x соответствует 3,0 лx = 6,0 л NO требуется
К настоящему времени вы должны знать, что означает отсутствие упоминания о температуре или давлении для решения проблемы. (Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
(Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
Пример #8: Если стехиометрические количества X и Y поместить в герметичный гибкий контейнер с начальным объемом 30,0 л при STP, какой объем Z будет произведен? (X, Y и Z находятся в газообразном состоянии)
2X + Y —> Z
Решение:
Поскольку все они являются газами, молярное отношение равно объемному отношению:
2X + Y = 30,0 лX : Y = 2 : 1 = 20 л : 10 л
n(Y) = n(Z)
, следовательно, v(Y) = v(Z) = 10,0 л произведенного Z.
Пример #9: 200,0 литров H 2 , реагирующих при 25,0 °C и 751,0 торр, сколько потребуется литров O 2 при стандартной температуре?
Решение:
1) Уравнение:
2H 2 (ж) + O 2 (ж) —> 2H 2 O(л)
2) Используйте PV = nRT для расчета молей водорода:
(751,0 торр / 760,0 торр/атм) (200,0 л = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 8,0818 моль
3) Используйте H 2 : O 2 молярное соотношение:
2 к 1 как 8,0818 мл к хx = 4,0409 моль O 2 требуется
4) Используйте PV = nRT для расчета необходимого объема O 2 при SPT:
(1,00 атм) (V) = (4,0409 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 90,52 л
Пример #10: Готовят смесь, используя 12,0 л NH 3 и 12,0 л Cl 2 , оба измеряют при одинаковых условиях. Эти вещества реагируют по следующему уравнению:
Эти вещества реагируют по следующему уравнению:
2 NH 3 (г) + 3 Cl 2 (г) —> N 2 (г) + 6 HCl(г)
Каков объем каждого газа после завершения реакции (NH 3 , Cl 2 , N 2 и HCl соответственно)? Предположим, что конечные объемы измеряются в идентичных условиях.
Решение:
1) Нужен лимитирующий реагент:
аммиак: 12/2 = 6
хлор: 12 / 3 = 4У нас есть победитель! хлор.
Помните, я могу обращаться с томами так же, как с кротами. Это связано с тем, что при постоянных T и P объемы прямо пропорциональны количеству молей.
2) Конечный объем аммиака:
2 равно 3, а x равно 12x = 8,0 л использованного аммиака
Остаточный объем: 12,0 л − 8,0 л = 4,0 л
3) Конечный объем хлора:
Ноль!
4) Конечный объем азота:
3 соответствует 1, как 12 соответствует хх = 4,0 л
5) Конечный объем HCl:
3 соответствует 6, как 12 соответствует хх = 24,0 л
Бонус Пример: Сколько литров O 2 производятся (на СТП), когда достаточное количество KO 2 реагирует с 75,0 л диоксида углерода при −25,0 °C и 215 кПа?
4KO 2 (s) + 2CO 2 (g) —> 2K 2 CO 3 (s) + 3O 2 (g)
Решение №1:
1) Определить, сколько молей СО 2 присутствует:
PV = нРТ(215 кПа) (75,0 л) = (n) (8,31447 л кПа/моль К) (248 К)
n = 7,820121 моль
2) Определить количество молей полученного O 2 :
2 7,820121 моль ––– = –––––––––– 3 х х = 11,73018 моль
3) Определить объем на STP:
PV = нРТ(101,325 кПа) (В) = (11,73018 моль) (8,31447 л кПа/моль К) (273 К)
В = 263 л (до трех знаков фиг.
)
Решение №2:
1) Определить объем CO 2 при нормальных условиях (используя комбинированный газовый закон):
П 1 В 1 П 2 В 2 ––––– = ––––– Т 1 T 2
(215 кПа) (75,0 л) (101,325 кПа) (В 2 ) ––––––––––––––– = –––––––––––––––– 248 К 273 К В 2 = 175,1838 Д
2) Определить объем O 2 , произведенный на СТП:
2 175. 

 к. меняется агрегатное состояние
к. меняется агрегатное состояние

 )
) )
)
Leave A Comment