Отдел Мхи — что это, определение и ответ
Мхи – тупиковая ветвь в развитии растений на Земле. Они являются одними из самых примитивных растений, однако распространены достаточно широко в регионах с влажными почвами.
Влага очень необходима для мхов, так как:
У этих растений отсутствуют корни. Функцию прикрепления к субстрату и всасывания необходимых веществ выполняют ризоиды.
Тело мхов часто (однако не всегда) разделено на стебель и листья.
Ткани у мхов развиты гораздо меньше, чем у других высших растений, а ксилема и флоэма в принципе отсутствуют.
Один из самых знаменитых представителей моховидных – кукушкин лен.
Цифрой 1 обозначено мужское растение,
2 – женское,
3 – коробочка, которая несет в себе споры,
4 – коробочка в момент спороношения.
Кукушкин лён (листостебельный мох)
Гаметофит мхов = листостебельное растение.
Спорофит мхов = с коробочкой на ножке
Спорофит внедряется в ткань гаметофита (взрослого мха) и доставляет спорофиту воду и питательные вещества.
Таким образом, спорофит мха полностью зависим от гаметофита и не способен к самостоятельному существованию. На спорофите образуются споры, которые способны прорастать лишь в благоприятных условиях. Из них развивается протонема (зеленая нить), которая дает начало гаметофиту.
Жизненный цикл моховидных
Для размножения мхам необходима вода. Их сперматозоиды переносятся к яйцеклеткам только в капельно-жидкой среде. Именно этот факт ограничивает распространение мхов (и других споровых растений) по Земле.
Экология моховидных
Моховидные – одни из первых наземных растений, мало изменившиеся за время своего существования. Они обитают во влажных местах, часто под пологом леса, а также на болотах и на полях с кислыми почвами. В настоящее время в этом отделе выделяют около 15 тысяч видов.
Они обитают во влажных местах, часто под пологом леса, а также на болотах и на полях с кислыми почвами. В настоящее время в этом отделе выделяют около 15 тысяч видов.
Они способны впитывать и удерживать большое количество влаги, и поэтому способствуют поддержанию водного режима местности.
Также они часто обеспечивают условия для сохранения и прорастания спор голо- и покрытосеменных растений.
Значение для человека
Способность мхов всасывать и удерживать в себе жидкость ранее использовалась при наложении гемостатических повязок в случае отсутствия более надежных средств.
Также из мхов выделяют некоторые химические вещества, используемые как в домашнем хозяйстве, так и в промышленности.
Сфагнум – один из самых известных представителей отдела – не гниет в толще отложений, поэтому в течение многих лет участвует в формировании торфа, который широко используется в качестве топлива и источника органических удобрений.

Сфагнум
Урок 38. Отдел мохообразные.
Урок 38. Отдел мохообразные.
Зеленые и торфяные мхи
Цели: познакомить с наиболее характерными особенностями высших споровых растений на примере мхов; показать черты усложнения организации мхов по сравнению с водорослями в свя- зи с изменением условий обитания; дать представление о среде обитания и распространения мхов, о процессах жизнедеятельно- сти мхов, о роли мхов в природе и хозяйственной деятельности человека; закрепить знания о высших и низших растениях.
Оборудование и материалы: таблицы: «Растения болот», «Зеленый мох кукушкин лен», «Сфагновые мхи и их строение», гербарные ма- териалы сфагнума, кукушкина льна и других мхов, живые экземпля- ры аквариумных мхов фонтиналиса и риччии, коллекция «Торф».
Ключевые
слова и понятия: отдел мохообразные, печеночники, листостебельные (настоящие)
мхи; слоевище, ризоиды, спорогон, споры, гаметы, яйцеклетки, сперматозоиды,
зигота; риччия, мар- шанция, зеленый мох кукушкин лен; хлорофиллоносные клетки,
водоносные клетки, гигроскопичность.
Ход урока
I. Актуализация знаний
– Выберите верные утверждения.
1. Хламидомонада является одноклеточной зеленой водорослью.
2. На переднем, более узком, конце тела хлореллы находятся два жгутика, при помощи которых водоросль может двигаться.
3. Пульсирующие вакуоли хламидомонады служат для выделения избытков воды и ненужных веществ.
4. Хламидомонада обладает отрицательным фототаксисом.
5. При благоприятных условиях (при достатке воды, тепла, солнечного света) хламидомонада размножается бесполым путем – делением.
6. При неблагоприятных условиях (пересыхание водоема, похоло- дание) хламидомонада размножается вегетативным способом.
7. Ламинария и фукус являются нитчатыми водорослями.
8. Улотрикс ведет прикрепленный образ жизни.
9. Бурые и красные водоросли, помимо хлорофилла, содержат и другие пигменты.
10. Конъюгация
– это способ бесполого размножения водорослей.
11. В клетках кладофоры имеется большое количество ядер.
II. Изучение нового материала
1. Рассказ учителя с элементами беседы
– К каким организмам – высшим или низшим – относятся водоросли? (К низшим растительным организмам.)
– Какими признаками обладают высшие растения? (Тело высших растений разделено на органы, которые выполняют определенные функции.)
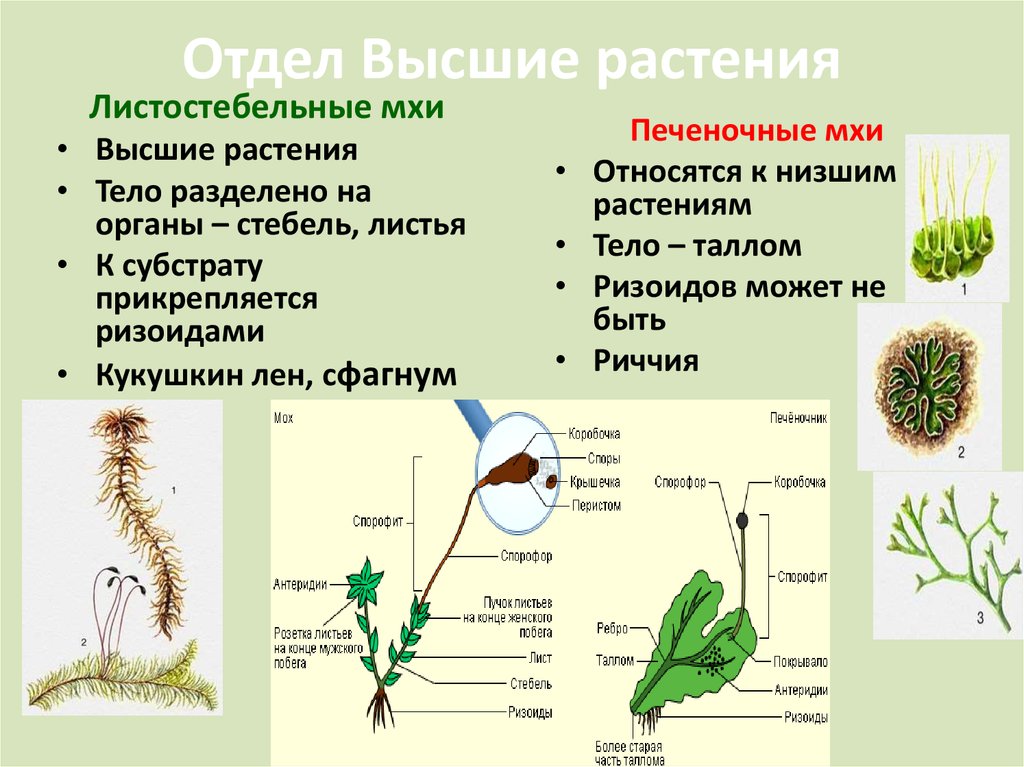
Сегодня мы с вами приступаем к изучению высших расте- ний. А начнем мы с отдела мохообразные. Отдел мохообразные насчитывает около 27 000 видов растений. У мохообразных, как и у всех остальных высших растений, имеются дифференциро- ванные органы и ткани. В отличие от водорослей мохообразные (за исключением некоторых примитивных форм) имеют стебли и листья, а органы размножения мохообразных многоклеточные. Корней у мохообразных нет, но есть ризоиды.
– Вспомните,
что такое ризоиды и в чем их отличие от кор- ней. (Ризоиды – выросты
поверхностных клеток тела, при помощи которых они прикрепляются к субстрату, но
не по- глощают вещества. )
)
Большинство мохообразных распространено в сильно увлаж- ненных, даже заболоченных местах. Это связано с высокой потреб- ностью в воде для нормальной жизнедеятельности этих растений. Все мохообразные низкорослы, их высота обычно не превы- шает 10–15 см. Практически они все многолетние растения. Сре-
ди них не встречается одревесневающих форм.
Мохообразные по своей организации очень близки к водорос- лям. Они представляют собой очень древнюю группу в царстве растений. Как и водоросли, они не имеют сосудов и корней. Не- которые примитивные представители отдела имеют тело в виде таллома, похожего на таллом водорослей. Оплодотворение мохо- образных также связано с водой и в ее отсутствие не может осу- ществляться. Размножаются мохообразные при помощи спор, поэтому их относят к высшим споровым растениям.
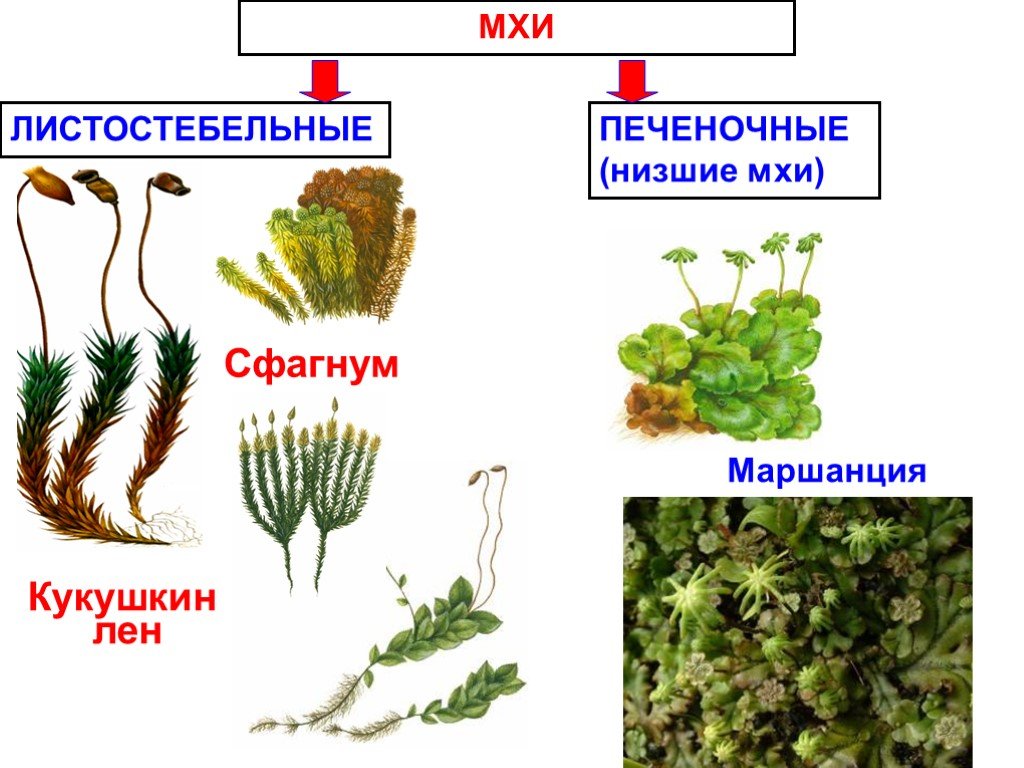
В отделе мохообразных выделяют класс печеночники и класс ли- стостебельные мхи (или настоящие мхи).
Печеночники
устроены наиболее примитивно, что вкупе с дру- гими признаками свидетельствует
об их древности.
Листостебельные мхи устроены более сложно, чем печеноч- ники, и встречаются в наших лесах гораздо чаще. Одним из самых распространенных является зеленый мох кукушкин лен, который относится к роду политрихум. (Учитель демонстрирует таблицы и гербарные материалы различных мхов.)
Кукушкин
лен часто встречается в заболоченных или просто влажных лесах. Этот мох
покрывает почву сплошным ковром, вытесняя другие зеленые мхи. Он способен
впитать воды в 4 раза больше собственной массы. За счет того, что плотные
покровы ку- кушкина льна задерживают большое количество влаги и создают особый
микроклимат, с появлением этого растения в экосистеме часто начинается
постепенное заболачивание леса.
В высоту кукушкин лен достигает 10–15 см. Стебли этого мха неветвящиеся, имеют буровато-зеленую окраску, густо покры- ты узкими зелеными листочками. Нижняя часть стебля темно- коричневая. Корней нет. К почве растение прикрепляется при помощи ризоидов.
– Как вы думаете, о чем говорит зеленая окраска листьев это- го растения? (О способности к фотосинтезу.)
Кукушкин лен, как и большинство других мхов, имеет слож- ное внутреннее строение. В теле его выделяют два типа тканей: покровную и проводящую.
– Как вы думаете, в чем заключаются функции этих тканей? (Ответы учащихся.)
Кукушкин лен – двудомное растение. (Учитель демонстрирует таблицы и гербарий мха.)
– Вспомните, что значит «двудомное». (Это значит, что ор- ганы, синтезирующие мужские и женские половые клетки, расположены на разных растениях.)
У
мужских растений верхушка стебелька имеет красно-желтую окраску. Здесь между
листочков расположены особые удлинен- ные мешочки, состоящие из большого числа
клеток.
– Вспомните, как называются половые клетки. (Половые клетки называются гаметами.)
Мужские гаметы мхов подвижны. Они называются сперма- тозоидами.
– Вспомните, как называются мужские гаметы покрытосемен- ных растений, подвижны они или нет. (Ответы учащихся.) На верхушках женских растений образуются женские поло-
вые органы. Они не окрашены и практически незаметны. Здесь созревают женские гаметы.
– Как они называются? (Женские гаметы называются яйце- клетками.)
После оплодотворения из зиготы образуется спорогон. Внешне он выглядит как коробочка на длинной ножке. Коробочки покры- ты волосистыми заостренными колпачками. Коробочка с колпач-
ком слегка напоминает сидящую кукушку. Отсюда и название – кукушкин лен. В коробочках развиваются споры.
Мхи
растут плотными скоплениями, а следовательно, мужские и женские растения
оказываются близко друг от друга. Как мы уже говорили, мхам для процесса
оплодотворения необходима вода.
Как мы уже говорили, мхам для процесса
оплодотворения необходима вода.
– О родстве с какими организмами это говорит? (Это дока- зывает их близость к водорослям.)
При наличии воды (обычно это случается после дождя) по- движные сперматозоиды подплывают к яйцеклеткам, происходит их слияние, или оплодотворение. Формируется зигота, из которой на следующий год образуется спорогон.
После созревания спор колпачок с коробочки опадает, и в сухую погоду споры высыпаются и разносятся ветром. Попав в благоприятные условия, спора прорастает, образует тонкую зе- леную нить. Нить ветвится, на ней образуются почки, из которых впоследствии вырастают новые побеги зеленого мха.
2. Выполнение опыта и практических работ
Практическая работа 22. СТРОЕНИЕ ЗЕЛЕНЫХ МХОВ НА ПРИМЕРЕ МХА КУКУШКИНА ЛЬНА
Цели:
познакомить с особенностями строения зеленого мха кукушкина льна; выявить
основные отличия высших споровых растений от низших; продолжить формирование
навыков ра- боты с натуральными объектами, выполнения биологического рисунка.
Оборудование и материалы: засушенные растения мха кукуш- кина льна с коробочками на листе бумаги, готовый микропрепарат
«Спорангий кукушкина льна», емкость с водой, лупа, препаро- вальная игла, пинцет, лист белой бумаги.
Общие рекомендации. Перед началом работы необходимо на- помнить учащимся о правилах техники безопасности.
Ход работы
1. Рассмотрите внешнее строение мха кукушкина льна нево- оруженным глазом и при помощи лупы. Найдите у него стебель, листья, на нижней части стебля найдите небольшие коричневатые выросты – ризоиды.
2. Определите форму, расположение, размер и окраску листьев растения. Рассмотрите один лист при помощи лупы и зарисуйте его.
3. Рассмотрите верхушки стеблей, найдите женские и мужские особи мха. Как вы их определили?
4. На женском растении найдите и рассмотрите коробочку со спорами. Обратите внимание на ее строение. Каково биологи- ческое значение расположения коробочки на высоте?
5. При
помощи пинцета или препаровальной иглы аккуратно снимите колпачок и рассмотрите
коробочку с крышечкой при помощи лупы.
При
помощи пинцета или препаровальной иглы аккуратно снимите колпачок и рассмотрите
коробочку с крышечкой при помощи лупы.
6. Потрясите коробочку над листом белой бумаги. Что вы уви- дели? Рассмотрите споры мха при помощи лупы. Подуйте на спо- ры. Что произошло? О чем свидетельствует легкость, с которой споры разлетелись от легкого дуновения?
7. Зарисуйте внешний вид мха кукушкина льна (мужского и женского растений) и подпишите его основные части. Отдельно зарисуйте внешний вид коробочки со спорами.
8. Рассмотрите готовый микропрепарат «Спорангий кукуш- кина льна» при помощи лупы. Рассмотрите продольный разрез коробочки, найдите крышечку, споры.
9. Зарисуйте продольный разрез спорангия кукушкина льна, каким вы увидели его при помощи лупы.
10. Сделайте вывод о строении и размножении зеленого мха кукушкина льна.
К
листостебельным мхам относится также и белый (или торфя- ной) мох сфагнум.
(Учитель демонстрирует таблицы и гербарные материалы различных торфяных мхов.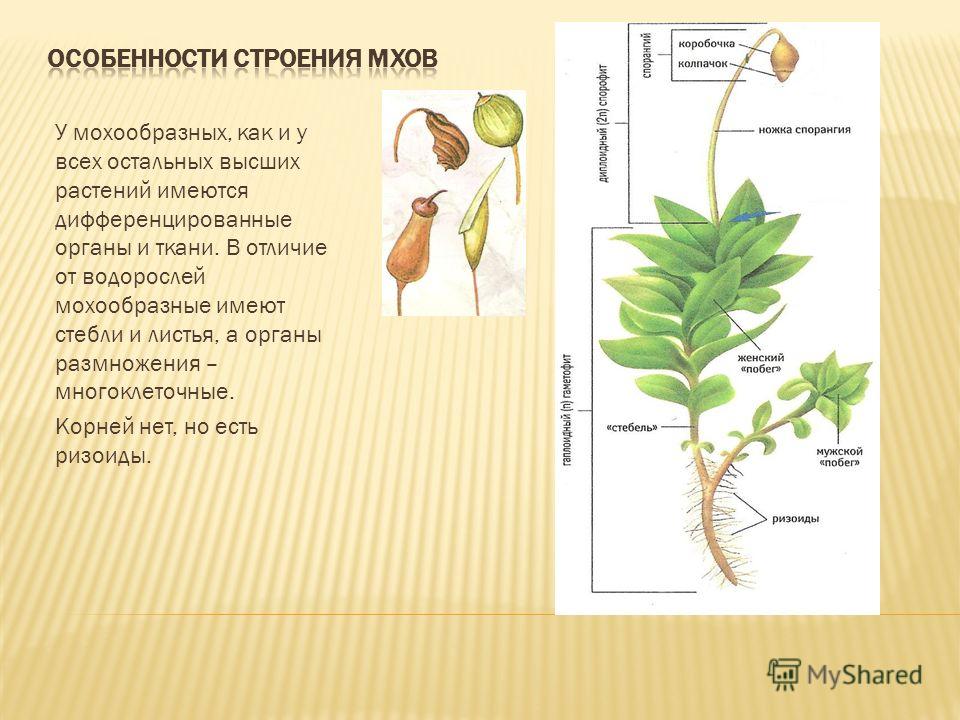 )
Сфагнум – многолетнее растение высотой до 20 см, обитающее в основном на
болотах. Внешне сфагнум сильно отличается от кукушкина льна. Стебель сфагнума
ветвится, образуя как бы веточки. Часть веточек на вер- хушке стебля образует
подобие головки, часть отходит в стороны, а некоторые (нижние) свисают вниз,
прилегая к стеблю. Стебель и ветви покрыты мелкими светло-зелеными листочками.
)
Сфагнум – многолетнее растение высотой до 20 см, обитающее в основном на
болотах. Внешне сфагнум сильно отличается от кукушкина льна. Стебель сфагнума
ветвится, образуя как бы веточки. Часть веточек на вер- хушке стебля образует
подобие головки, часть отходит в стороны, а некоторые (нижние) свисают вниз,
прилегая к стеблю. Стебель и ветви покрыты мелкими светло-зелеными листочками.
Каждый лист состоит из одного слоя клеток двух разных типов: живых узких зеленых клеток, содержащих хлоропласты, и круп- ных мертвых прозрачных клеток с разрушенной цитоплазмой. Живые клетки соединены друг с другом таким образом, что об- разуют сплошную сеть.
– Как вы думаете, что придает зеленый цвет этим клеткам? (Пигмент хлорофилл.)
– О чем свидетельствует наличие этого пигмента в листьях мха сфагнума? (О способности растения к фотосинтезу.) То есть процесс фотосинтеза, а значит и образование органи-
ческих
веществ, может происходить только в этих клетках. Между зелеными клетками
расположены мертвые клетки-резервуары, в оболочках которых имеются отверстия,
через которые они мо- гут заполняться водой или воздухом.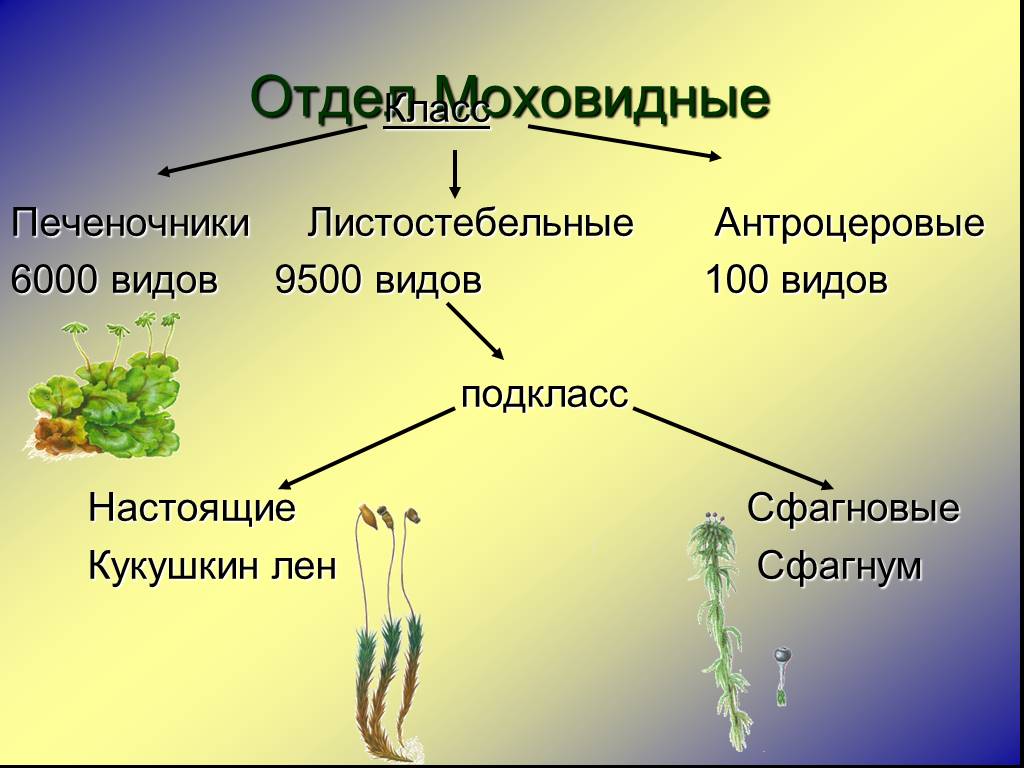 Благодаря такому
строению сфагнум способен быстро всасывать и проводить воду.
Благодаря такому
строению сфагнум способен быстро всасывать и проводить воду.
Стебли мха снаружи также покрыты прозрачными мертвыми клетками, что способствует проведению воды. Мертвые клетки
листьев и стеблей этого растения могут поглощать воды в 25 раз больше собственной массы.
ОПЫТ, ПОКАЗЫВАЮЩИЙ ГИГРОСКОПИЧЕСКИЕ ВОЗМОЖНОСТИ ТОРФЯНОГО МХА СФАГНУМА
Оборудование: сухой мох сфагнум, весы с разновесами, стакан с водой, пинцет, фильтровальная бумага.
Общие рекомендации. По желанию учителя данная работа мо- жет проводиться не в виде наглядного опыта, а как часть практи- ческой работы 23 или как самостоятельная практическая работа.
Ход опыта
1. Возьмем небольшое количество сухого мха сфагнума и взве- сим его на весах.
2. Опустим весь взвешенный мох в стакан с водой на 5–7 мин.
3. По истечении времени аккуратно вынем мох из стакана, положим на фильтровальную бумагу (пока вода не стечет).
4. Снова
взвесим мох.
Итог. Масса набухшего (напитавшегося водой) мха увеличи- лась более чем в 10 раз.
Вывод. Торфяной мох сфагнум способен впитывать и удержи- вать в себе количество воды, превышающее собственную массу более чем в 10 раз.
В отличие от кукушкина льна у сфагнума не имеется ризои- дов. Побеги сфагнума нарастают верхушкой, а нижние их части постепенно отмирают.
– Как вы думаете, что удерживает этот мох в вертикальном положении? (Ответы учащихся.)
Растения сфагнума тесно прижаты друг к другу, и это не по- зволяет им упасть. За счет этого они сохраняют вертикальное по- ложение.
– Сфагнум, как и кукушкин лен, размножается спорами, но в отличие от него он является однодомным растением. Что это значит? (У него мужские и женские половые органы расположены на одном растении.)
На
боковых веточках сфагнума развиваются мужские органы, а на верхушках – женские.
Оплодотворение у сфагнума происхо- дит так же, как и у кукушкина льна. После
оплодотворения из зи- готы образуется шаровидная коробочка с крышечкой, в
которой созревают споры.
Практическая работа 23. СТРОЕНИЕ ТОРФЯНЫХ МХОВ НА ПРИМЕРЕ МХА СФАГНУМА
Цели: познакомить с особенностями строения торфяного мха сфагнума; выявить основные отличия зеленых и торфяных мхов;
продолжить формирование навыков работы с натуральными объ- ектами, выполнения биологического рисунка, умения изготавли- вать временные препараты.
Оборудование: засушенные растения мха сфагнума с коробоч- ками на листе бумаги, микроскоп, предметное и покровное стек- ла, емкость с водой, лупа, препаровальная игла, пинцет.
Общие рекомендации. Перед началом работы необходимо на- помнить учащимся о правилах техники безопасности.
Ход работы
1. Рассмотрите внешнее строение мха сфагнума невооружен- ным глазом и при помощи лупы. Найдите у него стебель, листья, ветки. Обратите внимание на отсутствие у него ризоидов и корней.
2. При помощи лупы рассмотрите стебель мха. Чем он покрыт?
3. Найдите
ветви, прижатые к стеблю, торчащие в стороны и образующие плотную головку. На
верхушке стебля найдите ко- робочку со спорами.
На
верхушке стебля найдите ко- робочку со спорами.
4. Зарисуйте внешнее строение мха сфагнума и подпишите его основные части.
5. При помощи пинцета или препаровальной иглы аккуратно отделите один лист мха. Приготовьте временный микропрепарат, для этого положите лист в каплю воды на предметное стекло. На- кройте покровным стеклом.
6. Рассмотрите приготовленный вами микропрепарат при большом увеличении. Найдите хлорофиллоносные клетки и боль- шие мертвые водоносные клетки. В водоносных клетках найдите и рассмотрите поры.
7. Зарисуйте строение листа сфагнума, подпишите клетки, которые вы видели.
8. Сделайте вывод о строении мха сфагнума и об особенностях строения листа этого мха.
3. Самостоятельная работа учащихся с учебником
– Пользуясь текстом учебника (учебник И.Н. Пономаревой
§ 40; учебник В.В. Пасечника § 14), ответьте письменно на вопросы: что такое торф, как он образуется и каково его значение в жизни человека?
(На
выполнение задания отводится около 2–3 мин, после чего учащиеся меняются
тетрадями, самостоятельно выставляя оценку соседу.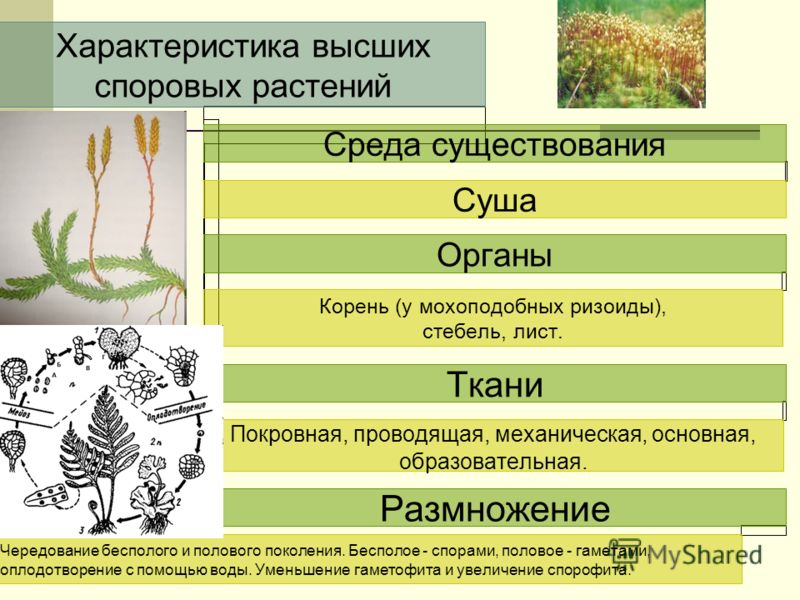 Данная оценка может быть
учтена учителем при дальней- шем контроле знаний.)
Данная оценка может быть
учтена учителем при дальней- шем контроле знаний.)
III. Закрепление знаний и умений
1. Самостоятельная работа учащихся с учебником
– Пользуясь текстом учебника (учебник И.Н. Пономаревой
§ 40; учебник В.В. Пасечника § 14), а также своими зна-
ниями, ответьте на вопрос: каково значение мхов в жизни и хозяйственной деятельности человека?
(На выполнение задания отводится около 2–3 мин, после чего 1–2 ученика отвечают устно с места. Учитель дополняет ответы учащихся.)
Помимо
того что мхи образуют торф, употребляемый в ка- честве топлива, удобрения,
сырья для промышленности, они при- меняются и в натуральном виде. Сфагновые мхи
издревле человек использовал при строительстве деревянных домов. Многие север-
ные народы, зная высокую гигроскопичность сфагновых мхов, до сих пор применяют
их в качестве подгузников для маленьких детей. В военные годы благодаря
гигроскопичности и бактерицид- ным свойствам сфагнум использовали как
перевязочный материал.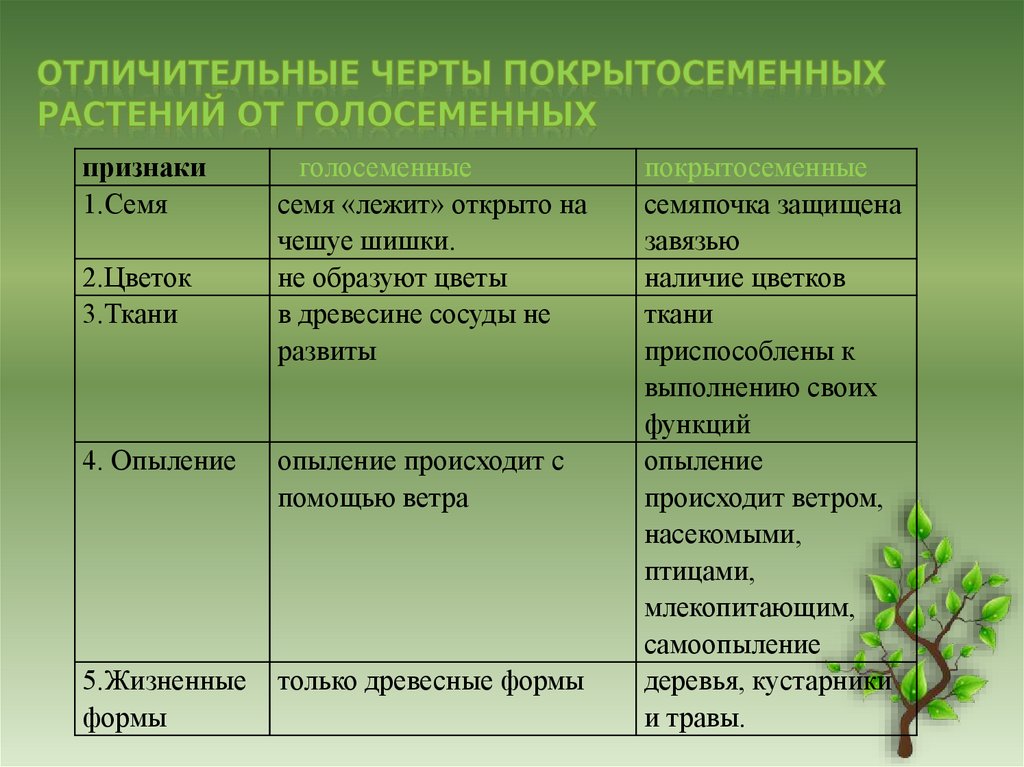 Кроме того, древние торфяные болота – настоящее сокрови-
Кроме того, древние торфяные болота – настоящее сокрови-
ще для палеобиологов, палеоэкологов и археологов. В слоях тор- фа благодаря минимальному проникновению кислорода, а также бактерицидным свойствам (сфагнумы выделяют вещества, пре- пятствующие развитию бактерий) хорошо сохраняются стволы деревьев, листва и пыльца растений, живших многие тысячи лет назад. Кроме того, при осушении болот нередко находят старин- ные изделия, в том числе и деревянные, а также мумифицирован- ные тела погибших животных и людей. Эти находки могут многое рассказать ученым.
В Красную книгу России занесены 22 вида мхов.
2. Самостоятельная работа учащихся
– Заполните таблицу. Отдельно выпишите черты сходства этих мхов.
Сравнение зеленых и сфагновых мхов на примере кукушкина льна и сфагнума
Признак сравнения Зеленый мох кукушкин лен Торфяной мох сфагнум
Наличие ризои- дов На нижней части стебля имеются ризоиды Ризоиды отсутствуют
Расположение мужских и жен- ских органов Двудомное растение Однодомное растение
Строение листа Лист многослойный, имеет относительно сложное строение Лист однослойный, со- стоящий из двух видов клеток
Строение стебля Стебель прямой, невет- вящийся Стебель ветвится
Строение споро- гона Коробочка на длинной ножке Круглая коробочка на короткой ножке
Черты сходства зеленых и сфагновых мхов на примере кукуш- кина льна и сфагнума
• Не
имеют корней.
• Имеют стебель и листья.
• Размножаются спорами, которые образуются в коробочках.
• Для оплодотворения необходима вода.
• Обитают в сырых местах, приводят к заболачиванию почвы.
IV. Подведение итогов урока Домашнее задание
1. Прочитать параграф, знать основные термины, ответить устно на вопросы в конце параграфа. (Учебник И.Н. Пономаревой
§ 40; учебник В.В. Пасечника § 14.)
2. Заполнить таблицу. Отдельно выписать черты сходства этих групп растений.
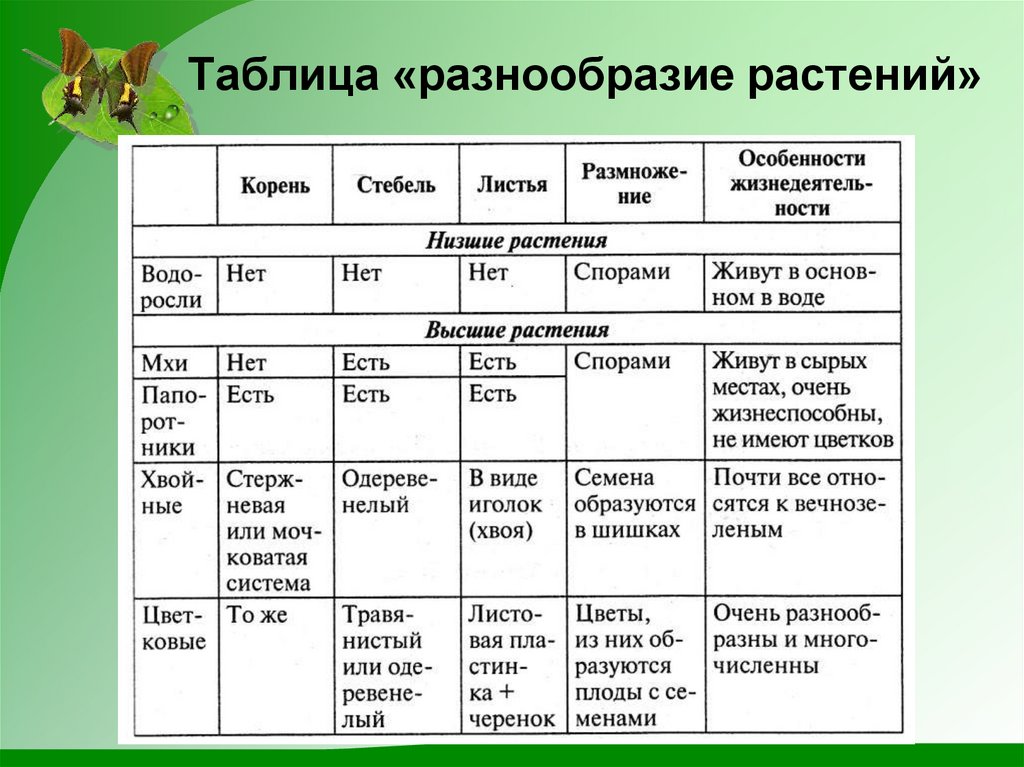
Сравнение мхов и водорослей
Признак сравнения Мхи Водоросли
Творческие задания.
1. Найти информацию об интересных находках в торфяных болотах. Подготовить доклад на эту тему.
2. Найти
на карте нашей страны места, занятые болотами. Примерно оценить площадь этих
территорий. К каким послед- ствиям может привести осушение этих болот? Написать
неболь- шую статью на эту тему.
Задание для учеников, интересующихся биологией. Найти ин- формацию о псилофитах. Каковы особенности их строения и жиз- недеятельности? В чем сходство и в чем различие мхов, псило- фитов и водорослей? О чем свидетельствуют эти черты? Почему псилофиты относятся к высшим растениям? Почему раньше псилофиты были широко распространены на Земле, а потом их численность резко сократилась? Как об этом узнали ученые? Что привело к массовому вымиранию псилофитов? Ответы на эти во- просы оформить в виде доклада.
Разница между мхом и водорослями
Автор: HAW
Мох против водорослей
Все организмы сгруппированы в пять царств. Это Monera, Protoctista, Fungi, Plantae и Animalia. Деление производится по 3 критериям. Это клеточная организация, расположение клеток и тип питания. Клеточная организация зависит от того, являются ли они эукариотическими или прокариотическими. Расположение клеток зависит от того, являются ли они одноклеточными, многоклеточными, с истинной тканевой дифференцировкой или без нее и т. д. Тип питания — автотрофные или гетеротрофные. Царство Protoctista включает водоросли, простейшие, оомикоты и слизевики. Царство plantae включает мохообразные, птерофиты, ликофиты, цикадофиты и антофиты. Другими словами, водоросли подпадают под царство Protoctista, а мхи подпадают под царство plantae.
Расположение клеток зависит от того, являются ли они одноклеточными, многоклеточными, с истинной тканевой дифференцировкой или без нее и т. д. Тип питания — автотрофные или гетеротрофные. Царство Protoctista включает водоросли, простейшие, оомикоты и слизевики. Царство plantae включает мохообразные, птерофиты, ликофиты, цикадофиты и антофиты. Другими словами, водоросли подпадают под царство Protoctista, а мхи подпадают под царство plantae.
Водоросли
В королевстве Protoctista есть четыре типа, которые включают различные виды водорослей. Это тип Chlorophyta, включающий зеленые водоросли, тип Phaeophyta, включающий бурые водоросли, тип Rhodophyta, включающий красные водоросли, и тип Bacillariophyta, включающий диатомовые водоросли. Водоросли представляют собой большую группу организмов (протоктистанов), имеющих большое биологическое значение. Часто это фотосинтезирующие эукариоты, живущие в воде. Водоросли можно найти как в морской, так и в пресной воде. Тело водорослей лишено стеблей, листьев или корней. Поэтому их тело называется слоевищем. Водоросли сгруппированы в разные типы в зависимости от типа их фотосинтетических пигментов. Все эти типы имеют некоторые общие характеристики. Почти все хорошо приспособлены к жизни в воде. Они демонстрируют большое разнообразие среди членов группы с точки зрения размера и формы. Они включают одноклеточные, нитчатые, колониальные и таллоидные формы.
Тело водорослей лишено стеблей, листьев или корней. Поэтому их тело называется слоевищем. Водоросли сгруппированы в разные типы в зависимости от типа их фотосинтетических пигментов. Все эти типы имеют некоторые общие характеристики. Почти все хорошо приспособлены к жизни в воде. Они демонстрируют большое разнообразие среди членов группы с точки зрения размера и формы. Они включают одноклеточные, нитчатые, колониальные и таллоидные формы.
Мхи
Тип мохообразных включает простейшие наземные растения. Предполагается, что они произошли от зеленых водорослей. В типе мохообразных выделяют два основных класса. Это класс Hepaticae, в который входят печеночники, и класс Musci, в который входят мхи. Эти группы плохо приспособлены к жизни на суше. Они приурочены к влажным, тенистым местам. Высота этих растений всего несколько сантиметров. Чередование поколений наблюдается там, где преобладает гаметофит. У класса Musci или мхов гаметофит дифференцируется на «стебель» и «листья». Листья расположены спирально вокруг стебля в три ряда. Гаметофит прикреплен к земле ризоидами. Эти ризоиды многоклеточные. Спорофит прикрепляется к женскому гаметофиту. Спорофит частично зависит от женского гаметофита. Распространение спор происходит по сложному механизму. Это зависит от сухих условий, а элатеров нет.
Листья расположены спирально вокруг стебля в три ряда. Гаметофит прикреплен к земле ризоидами. Эти ризоиды многоклеточные. Спорофит прикрепляется к женскому гаметофиту. Спорофит частично зависит от женского гаметофита. Распространение спор происходит по сложному механизму. Это зависит от сухих условий, а элатеров нет.
В чем разница между водорослями и мхами? • Водоросли относятся к типу Chlorophyta, Phaeophyta, Rhodophyta или Bacillariophyta царства Protoctista, тогда как мхи относятся к классу Musci типа Bryophyta царства Plantae. • Хотя у водорослей нет настоящей дифференциации тела на корни, стебли и листья, у мхов есть некоторая дифференциация стеблей и листьев. • Мхи прикрепляются к земле ризоидами, а водоросли прикрепляются к субстрату с помощью структуры, известной как фиксатор. • Чередование поколений присутствует у мхов, а у водорослей чередования поколений нет. • Большинство водорослей живут в морской или пресной воде, тогда как мхи живут во влажных, тенистых наземных местообитаниях. • Могут быть одноклеточные водоросли, но не одноклеточные мхи. |
Пространственные и временные закономерности эндополиплоидии у мхов
1. Бароу М., Мейстер А. Энпополиплоидия у семенных растений по-разному коррелирует с систематикой, органом, жизненной стратегией и размером генома. Окружающая среда растительной клетки. 2003; 26: 571–584. doi: 10.1046/j.1365-3040.2003.00988.х. [CrossRef] [Google Scholar]
2. Д’Амато Ф. Эндополиплоидия как фактор развития растительных тканей. Кариология. 1964; 17: 41–52. doi: 10.1080/00087114.1964.10796115. [CrossRef] [Google Scholar]
3. Малушинская Дж., Колано Б., Сас-Новосельска Х. Эндополиплоидия у растений. В: Leitch I.J., Greilhuber J., Doležel J., Wendel J., editors. Геномное разнообразие растений. Спрингер; Вена, Австрия: 2013. стр. 99–119. [Google Scholar]
4. Lee H.O., Davidson J.M., Duronio R.J. Эндорепликация: Целенаправленная полиплоидия. Гены Дев. 2009 г.;23:2461–2477. doi: 10.1101/gad.1829209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Lee H.O., Davidson J.M., Duronio R.J. Эндорепликация: Целенаправленная полиплоидия. Гены Дев. 2009 г.;23:2461–2477. doi: 10.1101/gad.1829209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Данте Р.А., Ларкинс Б.А., Сабелли П.А. Контроль клеточного цикла и развитие семян. Передний. Растениевод. 2014;5:14. doi: 10.3389/fpls.2014.00493. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Joubès J., Chevalier C. Endoreduplication в высших растениях. Завод Мол. биол. 2000;43:735–745. doi: 10.1023/A:1006446417196. [PubMed] [CrossRef] [Google Scholar]
7. Coelho C.M., Dante R.A., Sabelli P.A., Sun Y.J., Dilkes B.P., Gordon-Kamm W.J., Larkins B.A. Ингибиторы циклинзависимых киназ в эндосперме кукурузы и их потенциальная роль в эндоредупликации. Завод Физиол. 2005;138:2323–2336. doi: 10.1104/стр.105.063917. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Scholes D.R., Paige K.N. Пластичность плоидности: общий ответ на стресс. Тенденции Растениевод. 2015;20:165–175. doi: 10.1016/j.tplants.2014.11.007. [PubMed] [CrossRef] [Google Scholar]
Тенденции Растениевод. 2015;20:165–175. doi: 10.1016/j.tplants.2014.11.007. [PubMed] [CrossRef] [Google Scholar]
9. Бейтман Р.М., Гай Дж.Дж., Рудалл П.Дж., Лейтч И.Дж., Пеллисер Дж., Лейтч А.Р. Эволюционный и функциональный потенциал увеличения плоидности у отдельных растений: картирование соматической плоидности сложного лабелума пчелиных орхидей, вводящих в заблуждение половым путем. Анна. Бот. 2018; 122:133–150. дои: 10.1093/аоб/mcy048. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Bainard J.D., Newmaster S.G. Эндополиплоидия у мохообразных: широко распространена у мхов и отсутствует у печеночников. Дж. Бот. 2010;2010:7. doi: 10.1155/2010/316356. [CrossRef] [Google Scholar]
11. Bainard J.D., Henry T.A., Bainard L.D., Newmaster S.G. Изменение содержания ДНК у монолофитов и ликофитов: большие геномы, которые не являются эндополиплоидными. Хромосомный Рез. 2011; 19: 763–775. doi: 10.1007/s10577-011-9228-1. [PubMed] [CrossRef] [Академия Google]
12. Бхосале Р., Будольф В., Куэвас Ф., Лу Р., Экхут Т., Ху З.Б., Ван Истердал Г., Ламберт Г.М., Сюй Ф., Новак М.К. и др. Пространственно-временная карта эндоплоидии ДНК корня Arabidopsis показывает роль эндоцикла в развитии корня и адаптации к стрессу. Растительная клетка. 2018;30:2330–2351. doi: 10.1105/tpc.17.00983. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Бхосале Р., Будольф В., Куэвас Ф., Лу Р., Экхут Т., Ху З.Б., Ван Истердал Г., Ламберт Г.М., Сюй Ф., Новак М.К. и др. Пространственно-временная карта эндоплоидии ДНК корня Arabidopsis показывает роль эндоцикла в развитии корня и адаптации к стрессу. Растительная клетка. 2018;30:2330–2351. doi: 10.1105/tpc.17.00983. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Плоидность и размер в нескольких масштабах в Arabidopsis чашелистик. Растительная клетка. 2018;30:2308–2329. doi: 10.1105/tpc.18.00344. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Бароу М. Эндополиплоидия у семенных растений. Биоэссе. 2006; 28: 271–281. doi: 10.1002/bies.20371. [PubMed] [CrossRef] [Google Scholar]
15. Bauer M.J., Birchler J.A. Организация эндоредуплицированных хромосом в эндосперме Zea mays L. Chromosoma. 2006; 115: 383–394. doi: 10.1007/s00412-006-0068-2. [PubMed] [CrossRef] [Академия Google]
16. Чеккарелли М. , Сантантонио Э., Мармоттини Ф., Амзаллаг Г.Н., Чионини П.Г. Эндоредупликация хромосом как фактор солевой адаптации у Sorghum bicolor . Протоплазма. 2006; 227:113–118. doi: 10.1007/s00709-005-0144-0. [PubMed] [CrossRef] [Google Scholar]
, Сантантонио Э., Мармоттини Ф., Амзаллаг Г.Н., Чионини П.Г. Эндоредупликация хромосом как фактор солевой адаптации у Sorghum bicolor . Протоплазма. 2006; 227:113–118. doi: 10.1007/s00709-005-0144-0. [PubMed] [CrossRef] [Google Scholar]
17. Сливинская Е., Лукашевская Е. Полисоматы при выращивании in vitro сахарной свеклы ( Beta vulgaris L.) сеянцев разного уровня плоидности. Растениевод. 2005; 168:1067–1074. doi: 10.1016/j.plantsci.2004.12.003. [Перекрестная ссылка] [Академия Google]
18. Бурдон М., Пиррелло Дж., Шеникле С., Коритон О., Бурж М., Браун С., Моис А., Пейпелут М., Руйер В., Реноден Ж.П. и др. Доказательства кариоплазматического гомеостаза во время эндоредупликации и плоидно-зависимого увеличения транскрипции генов во время роста плодов томатов. Разработка. 2012; 139:3817–3826. doi: 10.1242/dev.084053. [PubMed] [CrossRef] [Google Scholar]
19. Cookson S.J., Van Lijsebettens M., Granier C. Корреляция между переменными роста листьев указывает на внутренний и ранний контроль размера листьев у Arabidopsis thaliana . Окружающая среда растительной клетки. 2005; 28:1355–1366. doi: 10.1111/j.1365-3040.2005.01368.x. [CrossRef] [Google Scholar]
Окружающая среда растительной клетки. 2005; 28:1355–1366. doi: 10.1111/j.1365-3040.2005.01368.x. [CrossRef] [Google Scholar]
20. De Veylder L., Larkin J.C., Schnittger A. Молекулярный контроль и функция эндорепликации в развитии и физиологии. Тенденции Растениевод. 2011; 16: 624–634. doi: 10.1016/j.tplants.2011.07.001. [PubMed] [CrossRef] [Google Scholar]
21. Кондороси Э., Рудье Ф., Жендро Э. Контроль размера клеток растений: выращивание с помощью плоидности? Курс. мнение биол. растений 2000; 3: 488–49.2. doi: 10.1016/S1369-5266(00)00118-7. [PubMed] [CrossRef] [Google Scholar]
22. Брейер К., Брейдвуд Л., Сугимото К. Эндоциклирование на пути развития растений. Курс. мнение биол. растений 2014; 17:78–85. doi: 10.1016/j.pbi.2013.11.007. [PubMed] [CrossRef] [Google Scholar]
23. Каваллини А., Барончелли С., Леркари Б., Чионини Г., Рокка М., Д’Амато Ф. Влияние света и гибберелловой кислоты на эндоредупликацию хромосом у эпидермис листьев Triticum durum Desf. Протоплазма. 1995;186:57–62. doi: 10.1007/BF01276936. [CrossRef] [Google Scholar]
Протоплазма. 1995;186:57–62. doi: 10.1007/BF01276936. [CrossRef] [Google Scholar]
24. Киношита И., Санбэ А., Ёкомура Э.И. Разница в индуцированном светом увеличении уровня плоидности и размера клеток между адаксиальными и абаксиальными клетками эпидермального покрытия первичных листьев Phaseolus vulgaris . Дж. Эксп. Бот. 2008;59:1419–1430. doi: 10.1093/jxb/ern055. [PubMed] [CrossRef] [Google Scholar]
25. Yamasaki S., Shimada E., Kuwano T., Kawano T., Noguchi N. Непрерывное УФ-В облучение вызывает эндоредупликацию и активность пероксидазы в эпидермальных клетках, окружающих трихомы огурца. семядоли. Дж. Радиат. Рез. 2010; 51: 187–19.6. doi: 10.1269/jrr.09101. [PubMed] [CrossRef] [Google Scholar]
26. Гегас В.К., Варджент Дж.Дж., Песке Э., Гранквист Э., Пол Н.Д., Дунан Дж.Х. Эндополиплоидия как потенциальная альтернативная адаптивная стратегия для изменения размера листьев Arabidopsis в ответ на УФ-В. Дж. Эксп. Бот. 2014;65:2757–2766. doi: 10. 1093/jxb/ert473. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1093/jxb/ert473. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Энгелен-Эйглс Г., Джонс Р.Дж., Филлипс Р.Л. Эндоредупликация ДНК в клетках эндосперма кукурузы: влияние кратковременного воздействия высокой температуры. Окружающая среда растительной клетки. 2000; 23: 657–663. doi: 10.1046/j.1365-3040.2000.00564.x. [Перекрестная ссылка] [Академия Google]
28. Йовчев Г., Бароу М., Мейстер А., Шуберт И. Влияние экологических и эндогенных факторов на эндополиплоидизацию покрытосеменных растений. Окружающая среда. Эксп. Бот. 2007; 60: 404–411. doi: 10.1016/j.envexpbot.2006.12.007. [CrossRef] [Google Scholar]
29. Артлип Т.С., Мэдисон Дж.Т., Сеттер Т.Л. Дефицит воды в развивающемся эндосперме кукурузы — деление клеток и эндоредупликация ядерной ДНК. Окружающая среда растительной клетки. 1995;18:1034–1040. doi: 10.1111/j.1365-3040.1995.tb00614.x. [Перекрестная ссылка] [Академия Google]
30. Granier C., Inzé D., Tardieu F. Пространственное распределение скорости клеточного деления можно вывести на основе активности киназы p34(cdc2) в листьях кукурузы, выращенных при контрастных температурах и условиях почвенной влаги. Завод Физиол. 2000; 124:1393–1402. doi: 10.1104/стр.124.3.1393. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Завод Физиол. 2000; 124:1393–1402. doi: 10.1104/стр.124.3.1393. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Эльмаграби А.М., Очатт С., Роджерс Х.Дж., Фрэнсис Д. Повышенная толерантность к солености после адаптации клеток к повышению уровня NaCl в Медикаго укороченный . Культ органов растительных клеток. 2013; 114:61–70. doi: 10.1007/s11240-013-0306-2. [CrossRef] [Google Scholar]
32. Андреа Б., Касерес М.Е., Чионини Г., Чионини П.Г. Цитофотометрическое исследование ДНК солевой адаптации у Allium cepa и Nicotiana bigelovii . Кариология. 2008; 61: 176–181. doi: 10.1080/00087114.2008.10589627. [CrossRef] [Google Scholar]
33. Barkla BJ, Rhodes T., Tran KNT, Wijesinghege C., Larkin JC, Dassanayake M. Увеличение клеток эпидермального мочевого пузыря: эндополиплоидия, вызванная развитием и соленостью, у модельного галофита. Завод Физиол. 2018; 177: 615–632. doi: 10.1104/стр.18.00033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Коцова В., Бубанова Д., Ракай А., Коларчик В., Мартонфи П. Засоление не влияет на полисоматический характер проростков Trifolium pratense и T. repens . Акта Биол. Крак. сер. Бот. 2017;59:55–65. doi: 10.1515/abcsb-2017-0005. [CrossRef] [Google Scholar]
Коцова В., Бубанова Д., Ракай А., Коларчик В., Мартонфи П. Засоление не влияет на полисоматический характер проростков Trifolium pratense и T. repens . Акта Биол. Крак. сер. Бот. 2017;59:55–65. doi: 10.1515/abcsb-2017-0005. [CrossRef] [Google Scholar]
35. Ding J., Sun Y., Xiao C.L., Shi K., Zhou Y.H., Yu J.Q. Физиологические основы различных аллелопатических реакций растений огурца и фиголистной тыквы на коричную кислоту. Дж. Эксп. Бот. 2007; 58: 3765–3773. дои: 10.1093/jxb/erm227. [PubMed] [CrossRef] [Google Scholar]
36. Гога М., Ручова Д., Коларчик В., Сабовлевич М., Бачкор М., Ланг И. Усниновая кислота как биотический фактор изменяет уровень плоидности в мхи. Экол. Эвол. 2018; 8: 2781–2787. doi: 10.1002/ece3.3908. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Maróti G., Kondorosi E. Азотофиксация Rhizobium — симбиоз бобовых: являются ли полиплоидия и дифференциация симбионтов, управляемая пептидами-хозяевами, общими принципами эндосимбиоза? Передний. микробиол. 2014;5:6. дои: 10.3389/fmicb.2014.00326. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
микробиол. 2014;5:6. дои: 10.3389/fmicb.2014.00326. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Bainard L.D., Bainard J.D., Newmaster S.G., Klironomos J.N. Микоризный симбиоз стимулирует эндоредупликацию у покрытосеменных растений. Окружающая среда растительной клетки. 2011; 34:1577–1585. doi: 10.1111/j.1365-3040.2011.02354.x. [PubMed] [CrossRef] [Google Scholar]
39. Исида Т., Адачи С., Йошимура М., Симидзу К., Умеда М., Сугимото К. Ауксин модулирует переход от митотического цикла к эндоциклу в Арабидопсис . Разработка. 2010; 137:63–71. doi: 10.1242/dev.035840. [PubMed] [CrossRef] [Google Scholar]
40. Scholes D.R., Paige K.N. Пластичность плоидности лежит в основе компенсации приспособленности растений к повреждению травоядными. Мол. Экол. 2014; 23:4862–4870. doi: 10.1111/mec.12894. [PubMed] [CrossRef] [Google Scholar]
41. Скоулз Д.Р. Плоидность устойчивости растений к повреждению апикальной меристемы: проверка относительных затрат и выгод. Междунар. Дж. Растениевод. 2020; 181: 509–517. дои: 10.1086/707728. [Перекрестная ссылка] [Академия Google]
Междунар. Дж. Растениевод. 2020; 181: 509–517. дои: 10.1086/707728. [Перекрестная ссылка] [Академия Google]
42. Пейдж К.Н. Гиперкомпенсация, экологический стресс и роль эндоредупликации. Являюсь. Дж. Бот. 2018;105:1105–1108. doi: 10.1002/ajb2.1135. [PubMed] [CrossRef] [Google Scholar]
43. Vieira P., De Clercq A., Stals H., Van Leene J., Van de Slijke E., Van Isterdael G., Eeckhout D., Persiau G. , Ван Дамм Д., Веркест А. и др. Ингибитор циклинзависимой киназы KRP6 индуцирует митоз и нарушает цитокинез в гигантских клетках, индуцированных нематодами, паразитирующими на растениях, у Arabidopsis 9.0077 . Растительная клетка. 2014;26:2633–2647. doi: 10.1105/tpc.114.126425. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
44. Виейра П., Энглер Дж. Д. Ингибиторы циклин-зависимых киназ растений семейства KRP: мощные ингибиторы мест питания галловых нематод в корнях растений. Передний. Растениевод. 2017;8:9. doi: 10.3389/fpls.2017.01514. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Сиддик С., Радакович З.С., Де Ла Торре К.М., Хронис Д., Новак О., Рамиредди Э., Гольбейн Дж., Матера С. , Хюттен М., Гутброд П. и др. Паразитическая нематода высвобождает цитокинин, который контролирует деление клеток и организует формирование мест питания в растениях-хозяевах. проц. Натл. акад. науч. США. 2015;112:12669–12674. doi: 10.1073/pnas.1503657112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Сиддик С., Радакович З.С., Де Ла Торре К.М., Хронис Д., Новак О., Рамиредди Э., Гольбейн Дж., Матера С. , Хюттен М., Гутброд П. и др. Паразитическая нематода высвобождает цитокинин, который контролирует деление клеток и организует формирование мест питания в растениях-хозяевах. проц. Натл. акад. науч. США. 2015;112:12669–12674. doi: 10.1073/pnas.1503657112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Bainard JD, Newmaster SG, Budke JM Размер генома и эволюция эндополиплоидии в филогении мхов. Анна. Бот. 2020; 125: 543–555. doi: 10.1093/aob/mcz194. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Buck W., Goffinet B. Biology Bryophyte. 2-е изд. Издательство Кембриджского университета; Кембридж, Великобритания: 2009. Морфология и классификация мохообразных; стр. 55–138. [Академия Google]
48. Crandall-Stotler B.J., Bartholomew-Began S.E. Морфология мхов ( тип Bryophyta ) Флора N. Am. Н. Мекс. 2007; 27:3–13. [Google Scholar]
49. Slack N.G. Экологическая ценность мохообразных как индикаторов изменения климата. В: Туба З., Слэк Н.Г., Старк Л.Р., редакторы. Экология мохообразных и изменение климата. 1-е изд. Издательство Кембриджского университета; Кембридж, Великобритания: 2011. с. 528. [Google Scholar]
Slack N.G. Экологическая ценность мохообразных как индикаторов изменения климата. В: Туба З., Слэк Н.Г., Старк Л.Р., редакторы. Экология мохообразных и изменение климата. 1-е изд. Издательство Кембриджского университета; Кембридж, Великобритания: 2011. с. 528. [Google Scholar]
50. Мэджилл Р.Е. Разнообразие мхов: Новый взгляд на старые числа. Фитотаксоны. 2010;9: 167–174. doi: 10.11646/phytotaxa.9.1.9. [CrossRef] [Google Scholar]
51. Эннос Р., Шеффилд Л. Жизнь растений. Джон Уайли и сыновья, ООО; Хобокен, Нью-Джерси, США: Blackwell Science Inc.; Оксфорд, Великобритания: 2000. Жизнь на земле; п. 232. [Google Scholar]
52. Нехира К. Прорастание спор, развитие протонемы и развитие язвочек. В: Шустер Р.М., редактор. Новое руководство по бриологии. Ботаническая лаборатория Хаттори; Ничинан, Япония: 1983. стр. 343–379. [Google Scholar]
53. Bainard J.D., Forrest L.L., Goffinet B., Newmaster S.G. Изменение содержания ядерной ДНК и эволюция печеночников. Мол. Филогенет. Эвол. 2013;68:619–627. doi: 10.1016/j.ympev.2013.04.008. [PubMed] [CrossRef] [Google Scholar]
Эвол. 2013;68:619–627. doi: 10.1016/j.ympev.2013.04.008. [PubMed] [CrossRef] [Google Scholar]
54. Bainard J.D., Villarreal J.C. Размер генома увеличивается в недавно расходящихся кладах роголистников. Геном. 2013; 56: 431–435. doi: 10.1139/gen-2013-0041. [PubMed] [CrossRef] [Google Scholar]
55. Gang Y.Y., Du G.S., Shi D.J., Wang M.Z., Li X.D., Hua Z.L. Создание системы регенерации in vitro мхов Atrichum . Акта Бот. Грех. 2003;45:1475–1480. [Google Scholar]
56. Loureiro J., Rodriguez E., Doležel J., Santos C. Два новых буфера для изоляции ядер для проточной цитометрии ДНК растений: тест с 37 видами. Анна. Бот. 2007; 100: 875–888. дои: 10.1093/аоб/mcm152. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
57. Doležel J., Greilhuber J., Suda J. Оценка содержания ядерной ДНК в растениях с помощью проточной цитометрии. Нац. протокол 2007; 2: 2233–2244. doi: 10.1038/nprot.2007.310. [PubMed] [CrossRef] [Google Scholar]
58. Гиван А.Л. Принципы проточной цитометрии: Обзор. Методы клеточной биологии. 2001; 63:19–50. doi: 10.1016/s0091-679x(01)63006-1. [PubMed] [CrossRef] [Google Scholar]
Методы клеточной биологии. 2001; 63:19–50. doi: 10.1016/s0091-679x(01)63006-1. [PubMed] [CrossRef] [Google Scholar]
59. Коларчик В., Фракова В., Коцова В., Копривы Л., Мартонфи П. Паттерн эндополиплоидии в Corydalis ранневесенние геофиты. Флора. 2020; 270 doi: 10.1016/j.flora.2020.151651. [CrossRef] [Google Scholar]
60. Bainard J.D., Bainard L.D., Henry T.A., Fazekas A.J., Newmaster S.G. Многомерный анализ изменчивости размера генома и эндоредупликации у покрытосеменных показывает сильный филогенетический сигнал и связь с фенотипическими признаками. Новый Фитол. 2012;196:1240–1250. doi: 10.1111/j.1469-8137.2012.04370.x. [PubMed] [CrossRef] [Google Scholar]
61. R Core Team . R: язык и среда для статистических вычислений. Основная команда R; Вена, Австрия: 2019 г.. [Google Scholar]
62. Уикхем Х. ggplot2: Элегантная графика для анализа данных. Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2009. [CrossRef] [Google Scholar]
63. Schween G., Gorr G. , Hohe A., Reski R. Уникальный тканеспецифический клеточный цикл в Physcomitrella . Растение. биол. 2003; 5: 50–58. doi: 10.1055/s-2003-37984. [CrossRef] [Google Scholar]
, Hohe A., Reski R. Уникальный тканеспецифический клеточный цикл в Physcomitrella . Растение. биол. 2003; 5: 50–58. doi: 10.1055/s-2003-37984. [CrossRef] [Google Scholar]
64. Рески Р. Развитие, генетика и молекулярная биология мхов. Бот. Акта. 1998; 111:1–15. doi: 10.1111/j.1438-8677.1998.tb00670.x. [Перекрестная ссылка] [Академия Google]
65. Lim WL, Loh CS Endopolyploidy in Vanda Miss Joaquim ( Orchidaceae ) New Phytol. 2003; 159: 279–287. doi: 10.1046/j.1469-8137.2003.00797.x. [CrossRef] [Google Scholar]
66. Qiu Y.L., Taylor A.B., McManus H.A. Эволюция жизненного цикла наземных растений. Дж. Сист. Эвол. 2012;50:171–194. doi: 10.1111/j.1759-6831.2012.00188.x. [CrossRef] [Google Scholar]
67. Пейси Э.К., Махерали Х., Муж Б.К. Влияние экспериментально индуцированной полиплоидии на отношения между эндополиплоидией и функцией растений в Arabidopsis thaliana . Экол. Эвол. 2020;10:198–216. doi: 10.1002/ece3.5886. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
68.


Leave A Comment