полное ионное уравнение нитрата кальция карбоната натрия
que problema se puede identificar en los ecosistemas
При охлаждении 140 грамм 20% раствора MgCl выпало 1,5 грамм соли; найти массовую долю MgCl после охлаждения в растворе
Для выполнения задания используйте следующий перечень веществ: хлорид алюминия(III), фторид калия, нитрат натрия, карбонат цезия, сульфат бария. Допу … стимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа и выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
В раствор сульфата меди (II) массой 320 г с массовой долей растворённого вещества 30% поместили пластинку неизвестного металла массой 25 г. Через неко … торое время масса пластинки стала равной 26,35 г, а массовая доля сульфата меди (II) в растворе — 22,59%. Определите неизвестный металл, если известно, что в образовавшемся сульфате он имеет степень окисления +2
В раствор сульфата меди (II) массой 400 г с массовой долей соли 20% поместили пластинку из магния массой 20 г. Пластинку вынули из раствора, когда её
… масса стала равной 32 г. К оставшемуся раствору прилили избыток раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
Пластинку вынули из раствора, когда её
… масса стала равной 32 г. К оставшемуся раствору прилили избыток раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
Пластинку из магния массой 25 г поместили в раствор хлорида меди (II). Через некоторое время масса пластинки стала равной 41 г и образовался раствор м … ассой 180 г с массовой долей хлорида меди (II) 15%. Вычислите массовую долю хлорида меди (II) в исходном растворе.
Помогитеее пожалуйстааа КР
С какими из перечисленных веществ будет реагировать h4PO4. 1)Ag 2)Rb2O 3)KON 4)Na2SO3 5)P2O5 6)HNO3 Напишите молекулярные и ионные уравнения возможны … х реакций.
300 г 4%-ного раствора соли упарили до массы 200 г. Определите массовую долю полученного раствор 2. К 250 г 6%-ного раствора сахара добавили ещё 10 г … сахара. Определите массовую долю полученного раствора.
Определите у атомов каких из указанных в ряду элементов валентные электроны находятся как на S так и на D подуровнях
Нитрат кальция, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.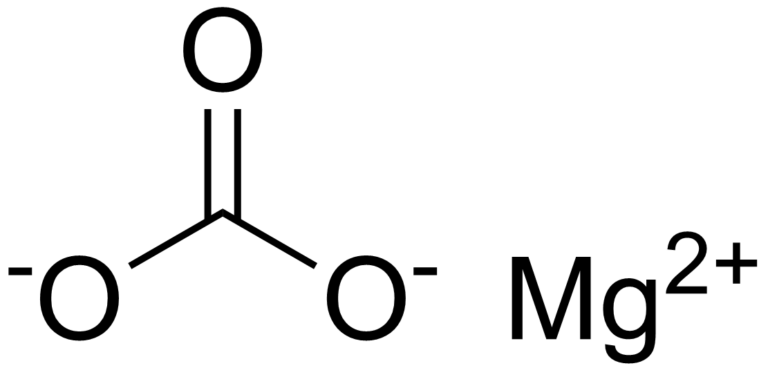
Чтобы получить подробное описание элемента, кликните по его названию.
| Код | Наименование | |||
| 28331900 | Сульфаты натрия прочие | |||
| Код | Наименование | Класс | Охрана | МВН |
| 483007 | СОЛИ КИСЛОРОДНЫХ КИСЛОТ | 3 | нет | 52 |
| 483011 | Алюминат натрия | 3 | нет | 52 |
| 483026 | Алюминия нитрат (алюминий азотнокислый) | 3 | нет | 52 |
| 483030 | Алюминия сульфат (алюминий сернокислый) | 3 | нет | 52 |
| 483045 | Аммония бисульфит | 3 | нет | 52 |
| 483056 | Аммоний нитрат (аммоний азотнокислый) | 3 | нет | 52 |
| 483064 | Аммония карбонат (аммоний углекислый) | 3 | нет | 52 |
| 483079 | Аммония молибдат фтористый | 3 | нет | 52 |
| 483083 | Аммония пероксодисульфат (аммоний надсернокислый) | 3 | нет | 52 |
| 483098 | Аммония перхлорат (аммоний хлорнокислый) | 3 | нет | 52 |
| 483115 | Аммония фосфат (аммоний фосфорнокислый трехзамещенный) | 3 | нет | 52 |
| 483122 | Аммония хромат (аммоний хромовокислый) | 3 | нет | 52 |
| 483134 | Аммония дихромат (аммоний двухромовокислый) | 3 | нет | 52 |
| 483149 | Бария бромата моногидрат (барий бромноватокислый) | 3 | нет | 52 |
| 483153 | Бария дихромат (барий двухромовокислый) | 3 | нет | 52 |
| 483168 | Бария карбонат (барий углекислый) | 3 | нет | 52 |
| 483172 | Бария нитрат (барий азотнокислый) | 3 | нет | 52 |
| 483187 | Бария перманганат (барий марганцевокислый) | 3 | нет | 52 |
| 483191 | Бария сульфат (барий сернокислый) | 3 | нет | 52 |
| 483204 | Бария хромат (барий хромовокислый) | 3 | нет | 52 |
| 483219 | Висмута (III) нитрат (висмут азотнокислый) | 3 | нет | 52 |
| 483223 | Гидразин-сульфат | 3 | нет | 52 |
| 483257 | Железа (III) нитрат (железо азотнокислое) | 3 | нет | 52 |
| 483261 | Железа сульфат (железо сернокислое, купорос железный) | 3 | нет | 52 |
| 483276 | Кадмия карбонат (кадмий углекислый) | 3 | нет | 52 |
| 483280 | Кадмия сульфат (кадмий сернокислый) | 3 | нет | 52 |
| 483308 | Калия бромат (калий бромноватокислый) | 3 | нет | 52 |
| 483312 | Калия дихромат (калий двухромовокислый) | 3 | нет | 52 |
| 483327 | Калия нитрат (калий азотнокислый) | 3 | нет | 52 |
| 483331 | Калия нитрит (калий азотистокислый) | 3 | нет | 52 |
| 483346 | Калия перманганат (калий марганцевокислый) | 3 | нет | 52 |
| 483350 | Калия пероксидисульфат (калий надсернокислый) | 3 | нет | 52 |
| 483365 | Калия перхлорат (калий хлорнокислый) | 3 | нет | 52 |
| 483375 | Калия пирофосфат | 3 | нет | 52 |
| 483399 | Калия хлорат (калий хлорноватокислый, соль бертолетова) | 3 | нет | 52 |
| 483401 | Кальция арсенат (кальций мышьяковистый) | 3 | нет | 52 |
| 483416 | Кальция арсенит (кальций мышьяковистокислый) | 3 | нет | 52 |
| 483420 | Кобальт сернокислый | 3 | нет | 52 |
| 483435 | Кальция гипохлорит (известь хлорная) | 3 | нет | 52 |
| 483441 | Кальция гипохлорит сухой или смеси более 39% акт. хлора хлора | 3 | нет | 52 |
| 483454 | Кальция нитрат (кальций азотнокислый) | 3 | нет | 52 |
| 483469 | Кальция нитрат, водный раствор | 3 | нет | 52 |
| 483473 | Кальция перманганат (кальций марганцевокислый) | 3 | нет | 52 |
| 483488 | Кальция сульфат (кальций сернокислый) | 3 | нет | 52 |
| 483492 | Кальция фосфат (кальций фосфорнокислый) | 3 | нет | 52 |
| 483505 | Квасцы алюмокалиевые | 3 | нет | 52 |
| 483518 | Квасцы, н. п. п. | 3 | нет | 52 |
| 483524 | Купоросы, н.п. | 3 | нет | 52 |
| 483539 | Лития нитрат (литий азотнокислый) | 3 | нет | 52 |
| 483543 | Магния карбонат (магний углекислый, магнезия белая) | 3 | нет | 52 |
| 483558 | Магния нитрат (магний азотнокислый) | 3 | нет | 52 |
| 483562 | Магния хлорат | 3 | нет | 52 |
| 483577 | Марганца борат (марганец борнокислый) | 3 | нет | 52 |
| 483581 | Марганца сульфат (марганец сернокислый), раствор | 3 | нет | 52 |
| 483596 | Марганца фосфат (марганец фосфорнокислый) | 3 | нет | 52 |
| 483609 | Меди дихромат (медь двухромовокислая) | 3 | нет | 52 |
| 483613 | Меди нитрат (медь азотнокислая), водный раствор | 3 | нет | 52 |
| 483628 | Меди сульфат (медь сернокислая, купорос медный) | 3 | нет | 52 |
| 483632 | Натрия арсенат (натрий мышьяковокислый) | 3 | нет | 52 |
| 483647 | Натрия арсенит (натрий мышьяковистокислый) | 3 | нет | 52 |
| 483666 | Натрия бисульфат (гидросульфат натрия) | 3 | нет | 52 |
| 483685 | Натрия борат ( натрий борнокислый) | 3 | нет | 52 |
| 483694 | Натрия бромат (натрий бромноватокислый) | 3 | нет | 52 |
| 483702 | Натрия гексаметафосфат | 3 | нет | 52 |
| 483721 | Натрия гидросульфит (дитионит натрия) | 3 | нет | 52 |
| 483736 | Натрия гипосульфит (тиосульфат натрия) | 3 | нет | 52 |
| 483740 | Натрия гипохлорит (натрий хлорноватистокислый) | 3 | нет | 52 |
| 483755 | Натрия дихромат (натрий двухромовокислый) | 3 | нет | 52 |
| 483760 | Натрия нитрат (натрий азотнокислый) | 3 | нет | 52 |
| 483774 | Натрия нитрит (натрий азотистокислый) | 3 | нет | 52 |
| 483789 | Натрия перманганат (натрий марганцевокислый) | 3 | нет | 52 |
| 483793 | Натрия пероксодисульфат (натрий надсернокислый) | 3 | нет | 52 |
| 483806 | Натрия сульфат (натрий сернокислый) | 3 | нет | 52 |
| 483810 | Натрия сульфит (натрий сернистокислый) | 3 | нет | 52 |
| 483825 | Натрия тетраборат (бура) | 3 | нет | 52 |
| 483844 | Натрия триполифофат | 3 | нет | 52 |
| 483859 | Натрия хлорат (натрий хлорноватокислый) | 3 | нет | 52 |
| 483863 | Натрия хлорит (натрий хлористокислый) | 3 | нет | 52 |
| 483878 | Натрия хромат (натрий хромовокислый) | 3 | нет | 52 |
| 483882 | Никеля нитрат (никель азотнокислый) | 3 | нет | 52 |
| 483897 | Никеля (II) нитрит (никель азотистокислый) | 3 | нет | 52 |
| 483903 | Никеля сульфат (никель сернокислый, купорос никелевый) | 3 | нет | 52 |
| 483914 | Олова арсенат (олово мышьяковокислое) | 3 | нет | 52 |
| 483929 | Олова арсенит (олово мышьяковистокислое) | 3 | нет | 52 |
| 483933 | Олова (II) сульфат (олово сернокислое) | 3 | нет | 52 |
| 483948 | Полифосфаты | 3 | нет | 52 |
| 483952 | Раствор смеси хлоридов и сульфатов натрия,калия,магния | 3 | нет | 52 |
| 483967 | Селитра аммиачно-кальциевая для ППВ | 3 | нет | 52 |
| 483971 | Свинца нитрат (свинец азотнокислый) | 3 | нет | 52 |
| 483986 | Серебра нитрат (серебро азотнокислое) | 3 | нет | 52 |
| 483990 | Соли азотистокислые (нитриты), н. п. п. | 3 | нет | 52 |
Способ получения карбоната кальция (варианты)
Изобретение относится к химической технологии комплексной азотнокислотной переработки фосфатной руды, в частности апатитового концентрата в сложные минеральные удобрения, и может найти применение в производстве химически осажденного карбоната кальция для стекольной, строительной и других отраслей промышленности.
При азотнокислотной переработке фосфатной руды нитрат кальция является одним из промежуточных продуктов. Апатитовый концентрат разлагают азотной кислотой, полученную азотнокислотную вытяжку охлаждают, при этом нитрат кальция кристаллизуется в виде тетрагидрата Ca(NO3)2·4H2O, выпавшие кристаллы отделяют от маточного нитрофосфатного раствора, промывают и расплавляют.
Расплав нитрата кальция содержит 14,5-15,5% кальция, до 4% азотной кислоты, 0,1-0,5% фосфатов в пересчете на P2O5, минералы из апатита, нерастворимые в азотной кислоте, водорастворимые соли щелочно-земельных (Mg, Sr, Ва), переходных (Fe, Mn, Ni, Co, Cr, Cu) и других металлов (К, Na, Al, Ti), а также соединения кремния и фтора. Полученный таким образом нитрат кальция не находит непосредственного применения, поэтому его перерабатывают в карбонат кальция и известково-аммиачную или аммиачную селитру (Технология минеральных удобрений. М.Е.Позин. Л.: Химия, 1989, с.340).
Полученный таким образом нитрат кальция не находит непосредственного применения, поэтому его перерабатывают в карбонат кальция и известково-аммиачную или аммиачную селитру (Технология минеральных удобрений. М.Е.Позин. Л.: Химия, 1989, с.340).
Известен ряд способов получения карбоната кальция, включающих обработку раствора нитрата кальция аммиаком и диоксидом углерода и/или карбонатом аммония, отделение осадка целевого продукта фильтрованием, его промывку водой и сушку. Степень чистоты карбоната кальция зависит от исходных реагентов, способа разделения суспензии, а также от веществ, присутствующих в маточном растворе и вспомогательных операций по промывке осадка.
Процесс конверсии нитрата кальция в карбонат кальция и нитрат аммония описывается следующими уравнениями:
Реакция 1 (газовая конверсия) протекает при обработке водного раствора нитрата кальция газообразными аммиаком и диоксидом углерода, реакция 2 (жидкостная конверсия) протекает при взаимодействии растворов нитрата кальция и карбоната аммония. Карбонат кальция, полученный конверсией нитрата кальция, представляет собой мелкодисперсный порошок с размером частиц 15-45 мкм. (Комплексная азотно-кислотная переработка фосфатного сырья. Под редакцией А.Л.Гольдинова и Б.А.Копылева. Л.: Химия, 1982, 207 с.; Двухстадийный способ конверсии нитрата кальция в карбонат кальция и нитрат аммония. Гольдинов О.В. и др. — Химическая промышленность, 1981. №2, с.96-97; авторское свидетельство №1527162 А1, С 01 F 11/18, 1987; авторское свидетельство №1530571 А1, С 01 С 1/18, С 01 F 11/18, 1987).
Карбонат кальция, полученный конверсией нитрата кальция, представляет собой мелкодисперсный порошок с размером частиц 15-45 мкм. (Комплексная азотно-кислотная переработка фосфатного сырья. Под редакцией А.Л.Гольдинова и Б.А.Копылева. Л.: Химия, 1982, 207 с.; Двухстадийный способ конверсии нитрата кальция в карбонат кальция и нитрат аммония. Гольдинов О.В. и др. — Химическая промышленность, 1981. №2, с.96-97; авторское свидетельство №1527162 А1, С 01 F 11/18, 1987; авторское свидетельство №1530571 А1, С 01 С 1/18, С 01 F 11/18, 1987).
Недостатки указанных способов конверсии:
— сложность аппаратурного оформления и регулирования процесса конверсии при параллельной и дифференцированной подаче реагентов в реакторы;
— необходимость использования каскада реакторов.
Общий недостаток всех способов получения карбоната кальция конверсией нитрата кальция с аммиаком и диоксидом углерода и/или с карбонатом аммония — это неизбежное загрязнение карбоната кальция водорастворимыми аммонийными соединениями: аммиаком, нитратом и карбонатом аммония, которые захватываются растущими кристаллами карбоната кальция из маточного раствора.
Во всех существующих в настоящее время технологиях при непрерывном режиме работы агрегатов большой мощности полная отмывка осадка от нитрата аммония и других аммонийных соединений практически невозможна, поэтому массовая доля водорастворимых аммонийных соединений в карбонате кальция может достигать 1,5% в пересчете на нитрат аммония.
Присутствие аммонийных соединений в карбонате кальция существенно ограничивает области его применения, т.к. щелочные реагенты (например, сода стекольной шихты) разлагают эти аммонийные соединения с выделением аммиака в газовую фазу, что приводит к загрязнению воздуха рабочей зоны, ухудшению условий труда персонала и снижению экологических показателей производства у потребителей. Поэтому значительная часть карбоната кальция не находит применения и складируется на предприятиях по производству минеральных удобрений как отход производства.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату является способ получения карбоната кальция (патент RU №2036147, кл. С 01 F 11/18, 28.07.1992), который включает обработку раствора нитрата кальция аммиаком и диоксидом углерода и/или карбонатом аммония, отделение осадка целевого продукта фильтрованием, его промывку водой и сушку. Промытый осадок перед сушкой обрабатывают гидроксидом или карбонатом натрия, обработку осадка осуществляют при расходе реагентов 1,5-3 моль на 1 моль водорастворимого аммонийного азота в карбонате кальция, при этом гидроксид натрия используют в виде 10-20%-ного водного раствора, а карбонат натрия — в виде 15-20%-ного водного раствора.
С 01 F 11/18, 28.07.1992), который включает обработку раствора нитрата кальция аммиаком и диоксидом углерода и/или карбонатом аммония, отделение осадка целевого продукта фильтрованием, его промывку водой и сушку. Промытый осадок перед сушкой обрабатывают гидроксидом или карбонатом натрия, обработку осадка осуществляют при расходе реагентов 1,5-3 моль на 1 моль водорастворимого аммонийного азота в карбонате кальция, при этом гидроксид натрия используют в виде 10-20%-ного водного раствора, а карбонат натрия — в виде 15-20%-ного водного раствора.
Недостатки известного способа:
— загрязнение целевого продукта водорастворимыми соединениями щелочного характера;
— увеличение затрат на производство карбоната кальция за счет использования щелочных реагентов — гидроксида натрия или карбоната натрия;
— необходимость дополнительного оборудования для хранения, приготовления водных растворов гидроксида или карбоната натрия и обработки этими растворами осадка карбоната кальция перед сушкой.
Технический результат, на достижение которого направлено изобретение, заключается в повышении качества и улучшении потребительских свойств карбоната кальция за счет снижения массовой доли водорастворимых аммонийных соединений без использования дополнительных реагентов.
Для достижения названного технического результата в предлагаемом способе, включающем обработку раствора нитрата кальция карбонатом аммония, отделение осадка целевого продукта фильтрованием, его промывку и сушку, массовую долю кальция в растворе нитрата кальция регулируют в пределах 10-13% подачей раствора аммиачной селитры в кислый расплав тетрагидрата нитрата кальция, осаждение кальция из приготовленного раствора нитрата кальция проводят при перемешивании и температуре 50-80°С в непрерывном режиме путем одновременного введения растворов нитрата кальция и карбоната аммония в реактор конверсии при избытке карбоната аммония в суспензии в пределах 0,05-0,50% в пересчете на свободный диоксид углерода, осадок карбоната кальция промывают в одну стадию по варианту 1 или в две стадии по варианту 2.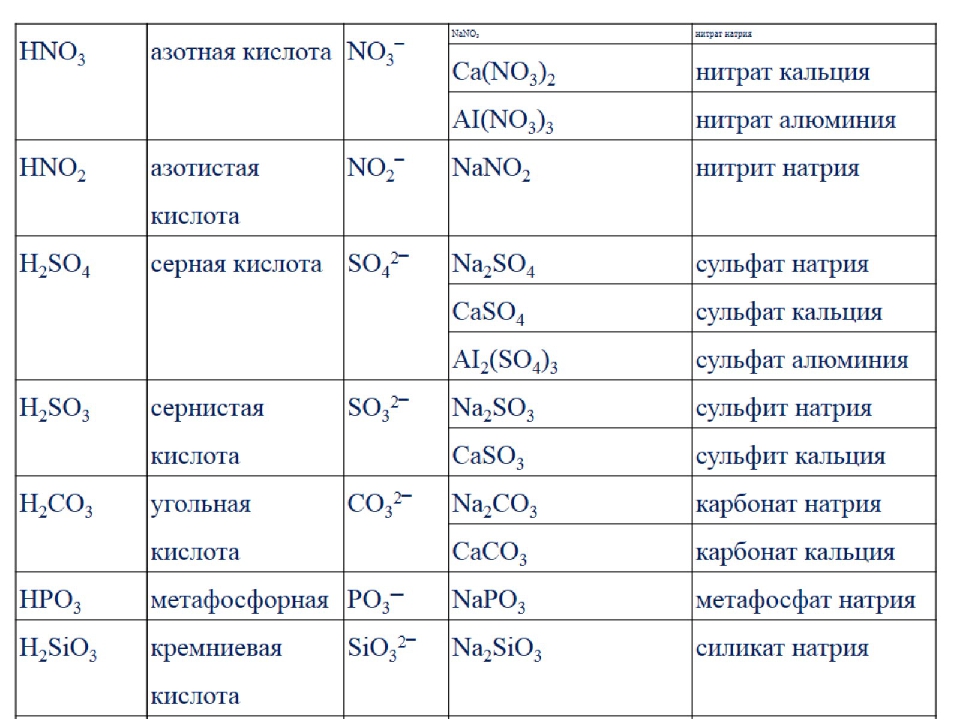
По первому варианту осадок карбоната кальция промывают на фильтре при массовом соотношении твердой и жидкой фазы (далее по тексту «при соотношении Т:Ж»)-(1-3):1.
По второму варианту осадок карбоната кальция промывают в две стадии: на первой стадии промывку осуществляют на фильтре раствором аммиачной селитры при соотношении Т:Ж-(1-3):1, затем проводят экстракцию примесей из осадка карбоната кальция путем смешивания его с раствором аммиачной селитры в соотношении Т:Ж-1:(3-5) при температуре 60-100°С, в качестве раствора аммиачной селитры используют фильтрат со второй стадии и на второй стадии осадок промывают на фильтре таким образом, чтобы массовая доля аммиачной селитры в получаемом фильтрате составляла 0,1-4,0%.
Промывку осадка могут осуществлять технологическим конденсатом, в качестве которого используют водный конденсат парогазовой фазы со стадии выпарки раствора аммиачной селитры и/или со стадии выпарки раствора нитроаммофоса из производства сложных удобрений.
В предложенном способе одним из отличительных признаков является то, что в растворе нитрата кальция массовую долю кальция регулируют в пределах 10-13% подачей раствора аммиачной селитры в кислый расплав тетрагидрата нитрата кальция.
Карбонат кальция является трудно растворимым веществом, легко образует пересыщенные растворы, пересыщение приводит к образованию мелкокристаллических осадков, которые трудно фильтруются и значительно труднее, чем крупнокристаллические осадки, отмываются от маточного раствора.
При получении карбоната кальция в результате химического взаимодействия нитрата кальция с карбонатом аммония регулирование массовой доли кальция в растворе нитрата кальция за счет подачи раствора аммиачной селитры в кислый расплав тетрагидрата нитрата кальция позволяет снизить степень пересыщения раствора и улучшить условия кристаллизации карбоната кальция. В качестве растворов аммиачной селитры используют технологические среды производства минеральных удобрений, содержащие нитрат аммония.
При указанных пределах массовой доли кальция в растворе нитрата кальция скорость роста кристаллов превышает скорость возникновения зародышей, кристаллизующийся карбонат кальция отлагается на поверхности первоначально возникших зародышей, что делает возможным получение крупнокристаллических осадков. Средний размер частиц карбоната кальция, получаемого по предлагаемому способу, составляет 67-83 мкм, доля наиболее мелких частиц (<24 мкм) снижается до 2,5-3,5%, поэтому суспензия карбоната кальция хорошо фильтруется, а осадок легко отмывается от аммонийных соединений, адсорбированных кристаллами из маточного раствора.
При массовой доле кальция в растворе нитрата кальция более 13% промывка осадка карбоната кальция ухудшается в результате уменьшения размера кристаллов за счет пересыщения раствора, при массовой доле кальция менее 10% — за счет уменьшения времени конверсии и скорости роста кристаллов.
Осаждение кальция из раствора нитрата кальция проводят в непрерывном режиме при перемешивании и температуре 50-80°С путем одновременного введения в реактор конверсии растворов нитрата кальция и карбоната аммония при избытке последнего.
Выбор температуры процесса обусловлен тем, что при температуре ниже 50°С осаждается мелкодисперсный трудно отмываемый осадок карбоната кальция, при температуре выше 80°С ухудшается качество продукционного раствора аммиачной селитры за счет увеличения растворимости примесей, в частности фтористых соединений.
Избыток карбоната аммония в суспензии карбоната кальция в реакторе конверсии регулируют в пределах 0,05-0,50% в пересчете на свободный диоксид углерода путем изменения расхода реагентов с учетом концентрации растворов нитрата кальция и карбоната аммония.
Избыток карбоната аммония в суспензии карбоната кальция в пределах 0,05-0,50% в пересчете на свободный диоксид углерода обеспечивает требуемую полноту осаждения ионов кальция из раствора нитрата кальция. При избытке меньше 0,05% возможно неполное осаждение кальция, при избытке более 0,5% происходит увеличение расхода реагентов: аммиака и диоксида углерода — и ухудшение качественных показателей аммиачной селитры как товарного продукта.
Для осаждения кальция используют раствор карбоната аммония, приготовленный абсорбцией аммиака и диоксида углерода 50-65% раствором аммиачной селитры.
После разделения осадка карбоната кальция и маточного раствора аммиачной селитры фильтрованием производят промывку осадка карбоната кальция в одну стадию по варианту 1 или в две стадии по варианту 2.
Способ получения карбоната кальция по предлагаемому изобретению позволяет без использования дополнительных реагентов обеспечить массовую долю водорастворимых аммонийных соединений в целевом продукте 0,005-0,03% в пересчете на аммонийный азот или 0,03-0,2% в пересчете на нитрат аммония (аммиачную селитру).
Достигаемый технический результат:
— повышение качества и улучшение потребительских свойств карбоната кальция без использования дополнительных реагентов, которые приводят к загрязнению карбоната кальция и продукционных растворов аммиачной селитры;
— использование оборудования действующего производства сложных минеральных удобрений без увеличения реакционных объемов на стадиях конверсии, фильтрации, промывки и сушки карбоната кальция;
— улучшение условий эксплуатации оборудования стадии конверсии и фильтрации карбоната кальция;
— уменьшение расхода технологического конденсата на промывку карбоната кальция и снижение расхода пара на выпарку раствора аммиачной селитры за счет подачи фильтрата со второй стадии на первую стадию промывки карбоната кальция;
— возможность утилизации слабых растворов аммиачной селитры из технологических потоков производства минеральных удобрений.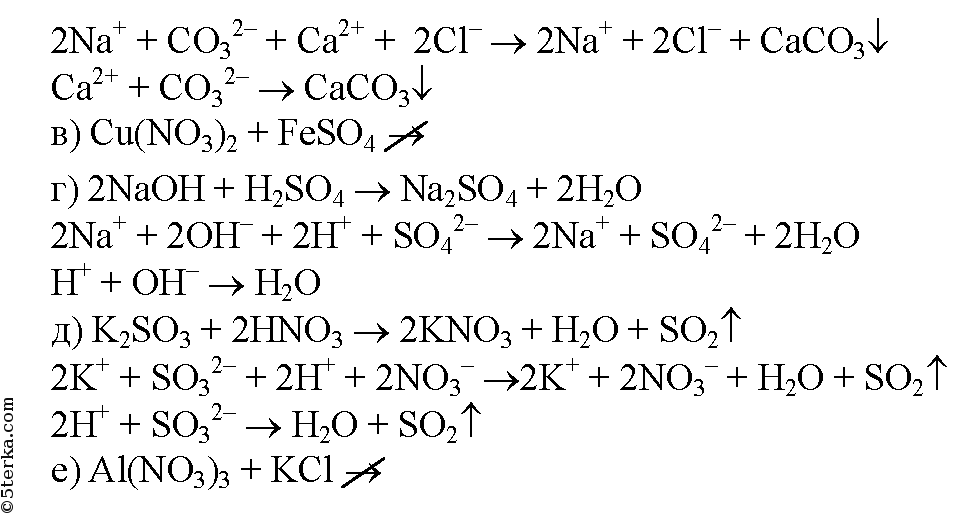
Карбонат кальция, полученный по данному способу, пригоден для производства стекла, сухих строительных смесей и других производств, что позволяет значительно расширить рынок сбыта.
Испытания предлагаемого способа проведены на действующем производстве сложных минеральных удобрений при проектной нагрузке агрегата по апатитовому концентрату.
Осуществления способа получения карбоната кальция конверсией нитрата кальция с карбонатом аммония в соответствии с предлагаемым изобретением по варианту 1 иллюстрирует описание следующего примера.
Пример.
В емкость, снабженную нагревательным и перемешивающим устройствами, непрерывно поступает 67 т/ч кислого тетрагидрата нитрата кальция, одновременно в ту же емкость подают раствор аммиачной селитры с расходом 16,9 м3/ч, смесь перемешивают при нагревании.
Полученный раствор нитрата кальция содержит 11,6% кальция, 3% азотной кислоты, 0,25% фосфатов в пересчете на пентаоксид фосфора, массовая доля аммиачной селитры и других соединений в растворе не регламентируется.
Процесс конверсии осуществляют при температуре 65°С в непрерывном режиме путем одновременного введения реагентов в реактор конверсии при перемешивании суспензии.
Расход раствора карбоната аммония составляет 63,9 м3/ч. Раствор нитрата кальция поступает в реактор конверсии в определенном соотношении с раствором карбоната аммония, соотношение реагентов регулируется автоматически, при этом массовая доля свободного диоксида углерода в суспензии карбоната кальция составляет 0,15%.
Из реактора конверсии суспензия карбоната кальция поступает на стадию фильтрации и промывки. Осадок карбоната кальция отделяют, промывают на фильтре технологическим конденсатом при отношении Т:Ж, равном 2, и направляют на сушку.
Массовая доля водорастворимого аммонийного азота в карбонате кальция составляет 0,018% или 0,1% в пересчете на нитрат аммония (аммиачную селитру).
Аналогично данному примеру проводят несколько опытов, конкретные условия и результаты которых приведены в таблице 1.
Осуществления способа получения карбоната кальция конверсией нитрата кальция с карбонатом аммония в соответствии с предлагаемым изобретением по варианту 2 иллюстрирует описание следующего примера.
Пример.
В емкость, снабженную нагревательным и перемешивающим устройствами, непрерывно поступает 65 т/ч кислого тетрагидрата нитрата кальция, одновременно в ту же емкость подают раствор аммиачной селитры с расходом 12 м3/ч, смесь перемешивают при нагревании.
Полученный раствор нитрата кальция содержит 12,5% кальция, 3,3% азотной кислоты, 0,23% фосфатов в пересчете на пентаоксид фосфора, массовая доля аммиачной селитры и других соединений в растворе не регламентируется.
Процесс конверсии осуществляют при температуре 68°С в непрерывном режиме путем одновременной подачи реагентов в реактор конверсии при перемешивании суспензии.
Расход раствора карбоната аммония составляет 67 м3/ч. Раствор нитрата кальция поступает в реактор конверсии в определенном соотношении с раствором карбоната аммония, соотношение реагентов регулируется автоматически, при этом массовая доля свободного диоксида углерода в суспензии карбоната кальция составляет 0,17%.
Из реактора конверсии суспензия карбоната кальция поступает на фильтрацию и промывку.
Осадок карбоната кальция отделяют фильтрованием и промывают в две стадии. На первой стадии промывку осадка производят на фильтре раствором аммиачной селитры в соотношении Т:Ж, равном 2,5, затем проводят экстракцию примесей из осадка карбоната кальция, для чего осадок карбоната кальция смешивают в отношении Т:Ж-1:3,5 с раствором аммиачной селитры при температуре 80±5°С, в качестве раствора аммиачной селитры используют фильтрат со второй стадии промывки карбоната кальция, в котором массовая доля аммиачной селитры составляет 2,6%. Осадок карбоната кальция отделяют фильтрованием, на второй стадии промывку осадка карбоната кальция осуществляют на фильтре таким образом, чтобы массовая доля аммиачной селитры в фильтрате составила 2,6%.
Карбонат кальция после промывки направляют на сушку.
Массовая доля водорастворимого аммонийного азота в карбонате кальция составляет 0,005% или 0,03% в пересчете на нитрат аммония (аммиачную селитру).
Аналогично данному примеру проводят несколько опытов, конкретные условия и результаты которых приведены в таблице 2.
|
|
 Способполучениякарбонатакальция,включающийобработкурастворанитратакальциякарбонатомаммония,отделениеосадкацелевогопродуктафильтрованием,егопромывкуисушку,отличающийсятем,чтомассовуюдолюкальцияврастворенитратакальциярегулируютвпределах10-13%подачейрастворааммиачнойселитрывкислыйрасплавтетрагидратанитратакальция,осаждениекальцияизприготовленногорастворанитратакальцияпроводятприперемешиванииитемпературе50-80°Свнепрерывномрежимепутемодновременноговведениярастворовнитратакальцияикарбонатааммониявреакторконверсииприизбыткекарбонатааммониявсуспензиивпределах0,05-0,50%впересчетенасвободныйдиоксидуглерода,осадоккарбонатакальцияпромываютнафильтреводнустадиюпримассовомсоотношенииТ:Ж-(1-3):1.12.Способполучениякарбонатакальция,включающийобработкурастворанитратакальциякарбонатомаммония,отделениеосадкацелевогопродуктафильтрованием,егопромывкуисушку,отличающийсятем,чтомассовуюдолюкальцияврастворенитратакальциярегулируютвпределах10-13%подачейрастворааммиачнойселитрывкислыйрасплавтетрагидратанитратакальция,осаждениекальцияизприготовленногорастворанитратакальцияпроводятприперемешиванииитемпературе50-80°Свнепрерывномрежимепутемодновременноговведениярастворовнитратакальцияикарбонатааммониявреакторконверсииприизбыткекарбонатааммониявсуспензиивпределах0,05-0,50%впересчетенасвободныйдиоксидуглерода,осадоккарбонатакальцияпромываютвдвестадии:напервойстадиипромывкуосуществляютнафильтрерастворомаммиачнойселитрыпримассовомсоотношенииТ:Ж-(1-3):1,затемпроводятэкстракциюпримесейизосадкакарбонатакальциярастворомаммиачнойселитрыпритемпературе60-100°СимассовомсоотношенииТ:Ж-1:(3-5),вкачестверастворааммиачнойселитрыиспользуютфильтратсовторойстадииинавторойстадииосадокпромываютнафильтреприподдержаниимассовойдолиаммиачнойселитрывполучаемомфильтратевпределах0,1-4,0%.
Способполучениякарбонатакальция,включающийобработкурастворанитратакальциякарбонатомаммония,отделениеосадкацелевогопродуктафильтрованием,егопромывкуисушку,отличающийсятем,чтомассовуюдолюкальцияврастворенитратакальциярегулируютвпределах10-13%подачейрастворааммиачнойселитрывкислыйрасплавтетрагидратанитратакальция,осаждениекальцияизприготовленногорастворанитратакальцияпроводятприперемешиванииитемпературе50-80°Свнепрерывномрежимепутемодновременноговведениярастворовнитратакальцияикарбонатааммониявреакторконверсииприизбыткекарбонатааммониявсуспензиивпределах0,05-0,50%впересчетенасвободныйдиоксидуглерода,осадоккарбонатакальцияпромываютнафильтреводнустадиюпримассовомсоотношенииТ:Ж-(1-3):1.12.Способполучениякарбонатакальция,включающийобработкурастворанитратакальциякарбонатомаммония,отделениеосадкацелевогопродуктафильтрованием,егопромывкуисушку,отличающийсятем,чтомассовуюдолюкальцияврастворенитратакальциярегулируютвпределах10-13%подачейрастворааммиачнойселитрывкислыйрасплавтетрагидратанитратакальция,осаждениекальцияизприготовленногорастворанитратакальцияпроводятприперемешиванииитемпературе50-80°Свнепрерывномрежимепутемодновременноговведениярастворовнитратакальцияикарбонатааммониявреакторконверсииприизбыткекарбонатааммониявсуспензиивпределах0,05-0,50%впересчетенасвободныйдиоксидуглерода,осадоккарбонатакальцияпромываютвдвестадии:напервойстадиипромывкуосуществляютнафильтрерастворомаммиачнойселитрыпримассовомсоотношенииТ:Ж-(1-3):1,затемпроводятэкстракциюпримесейизосадкакарбонатакальциярастворомаммиачнойселитрыпритемпературе60-100°СимассовомсоотношенииТ:Ж-1:(3-5),вкачестверастворааммиачнойселитрыиспользуютфильтратсовторойстадииинавторойстадииосадокпромываютнафильтреприподдержаниимассовойдолиаммиачнойселитрывполучаемомфильтратевпределах0,1-4,0%. 2
2| Температура | гр/100,00 гр воды | гр/100,00 гр этанола | гр/100,00 гр метанола | гр/100,00 гр ацетона | гр/100,00 гр ДМСО | гр/100,00 гр пиридина | гр/100,00 гр метилацетата | гр/100,00 гр азотной кислоты | гр/100,00 гр уксусной кислоты | гр/100,00 гр пропанола | гр/100,00 гр изопропанола | гр/100,00 гр изобутанола | гр/100,00 гр аммиака | гр/100,00 гр диметилформамида | гр/100,00 гр амилового спирта | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (безводный) | (тетрагидрат) | (безводный) | (безводный) | (безводный) | (тетрагидрат) | (безводный) | (безводный) | (безводный) | (безводный) | (безводный) | (безводный) | (безводный) | (безводный) | (тетрагидрат) | (безводный) | |
| 0°C 273,15 K | 102,0 | 82,8 | ||||||||||||||
| 10°C 283,15 K | ~115 | 134 | ||||||||||||||
| 15°C 288,15 K | ~121 | ~136 | 89,2 | |||||||||||||
| 20°C 293,15 K | 121,2 | 127,3 | 51,4 | ~138 | 1,68 | 69,5 | ||||||||||
| 25°C 298,15 K | ~159 | 138,1 | ~140 | 27 | 5,75 | 0,01 | 57,5 | 2,67 | 33,3 | 20 | 6,9 | |||||
| 30°C 303,15 K | ~196 | 154,5 | ~141 | 23,33 | ||||||||||||
| 40°C 313,15 K | 271 | 230,0 | 62,9 | 144 | ||||||||||||
| 50°C 323,15 K | ~313 | ~151 | ||||||||||||||
| 60°C 333,15 K | 354 | 158 | ||||||||||||||
| 70°C 343,15 K | 356 | |||||||||||||||
| 80°C 353,15 K | 358 | |||||||||||||||
| 90°C 363,15 K | 361 | |||||||||||||||
| 100°C 373,15 K | 363 | |||||||||||||||
9 класс.
 Химия. Реакции ионного обмена — Реакция ионного обменаКомментарии преподавателя
Химия. Реакции ионного обмена — Реакция ионного обменаКомментарии преподавателяРеакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na2CO3 +CaCl2 = CaCO3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Na2CO3 = 2Na+ + CO32-
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.
CaCl2 = Ca2+ + 2Cl-
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na+ + CO32- + Ca2+ + 2Cl- = CaCO3 ↓ + 2Na+ + 2Cl- — полное ионное уравнение.
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
Второй пример образования осадка карбоната кальция
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na2CO3 +Ca(NO3)2 = CaCO3 ↓ + 2NaNO3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na+ + CO32- + Ca2+ + 2NO3- = CaCO3 ↓ + 2Na+ + 2 NO3-– полное ионное уравнение
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Образование осадка сульфата бария
Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K2SO4 +BaCl2 = BaSO4 ↓ + 2KCl –молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓ + 2K+ + 2Cl- – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba2+ + SO42- = BaSO4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
Источники
http://www.youtube.com/watch?v=LaIeGmfgLzI
http://www.youtube.com/watch?t=2&v=-sm3RCNAjG8
http://www.youtube.com/watch?t=2&v=HToh5SytenA
заставка http://www.youtube.com/watch?t=6&v=TdlMOBnKGPw
источник презентации — http://ppt4web.ru/khimija/reakcii-ionnogo-obmena.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
Пояснения к ТН ВЭД 310240 —
3102 — Удобрения минеральные или химические, азотные:
| 3102 | Удобрения минеральные или химические, азотные: |
| 3102 10 | — мочевина, в том числе в водном растворе: |
| 3102 10 100 0 | — — мочевина, содержащая более 45 мас. % азота в пересчете на сухой безводный продукт % азота в пересчете на сухой безводный продукт |
| 3102 10 900 0 | — — прочая |
| — сульфат аммония; двойные соли и смеси сульфата аммония и нитрата аммония: | |
| 3102 21 000 0 | — — сульфат аммония |
| 3102 29 000 0 | — — прочие |
| 3102 30 | — нитрат аммония, в том числе в водном растворе: |
| 3102 30 100 0 | — — в водном растворе |
| 3102 30 900 0 | — — прочий |
| 3102 40 | — смеси нитрата аммония с карбонатом кальция или прочими неорганическими веществами, не являющимися удобрениями: |
| 3102 40 100 0 | — — с содержанием азота не более 28 мас.% |
| 3102 40 900 0 | — — с содержанием азота более 28 мас.% |
| 3102 50 | — нитрат натрия: |
| 3102 50 100 0 | — — природный нитрат натрия |
| 3102 50 900 0 | — — прочий |
| 3102 60 000 0 | — двойные соли и смеси нитрата кальция и нитрата аммония |
| 3102 80 000 0 | — смеси мочевины и нитрата аммония в водном или аммиачном растворе |
| 3102 90 000 0 | — пpочие, включая смеси, не поименованные в предыдущих субпозициях |
Данная товарная позиция применяется только к следующим товарам, при условии, что они не поставляются в виде и упаковках, предусмотренных в товарной позиции 3105:
(А) Товары, которые отвечают одному из следующих описаний:
(1) Нитрат натрия с примесями или без них.
(2) Нитрат аммония с примесями или без них.
(3) Двойные соли (с примесями или без них) сульфата аммония и нитрата аммония.
(4) Сульфат аммония с примесями или без них.
(5) Двойные соли (с примесями или без) или смеси нитрата кальция и нитрата аммония. Некоторые смеси нитрата кальция и нитрата аммония могут продаваться как «кальций-нитратное» удобрение.
(6) Двойные соли (с примесями или без) или смеси нитрата кальция и нитрата магния. Этот продукт получают обработкой доломита азотной кислотой.
(7) Цианамид кальция с примесями или без, или обработанный маслом.
(8) Мочевина (диамид угольной кислоты), чистая или с примесями. Используется как удобрение, а также в качестве кормовых добавок для животных, в производстве мочевинно-формальдегидных смол, в органическом синтезе и т.д.
Следует отметить, что минеральные или химические продукты, описанные выше в ограниченном списке, классифицируются в этой товарной позиции, даже если они явно не предназначены для использования в качестве удобрений.
С другой стороны, в эту товарную позицию не входят азотосодержащие продукты (такие как хлорид аммония, товарная позиция 2827), не описанные выше, даже если они используются как удобрения.
(Б) Удобрения, состоящие из любых продуктов, упомянутых в вышеприведенном пункте (А), смешанные вместе (например, удобрения, состоящие из смеси сульфата аммония и нитрата аммония).
(В) Удобрения, состоящие из хлорида аммония или любого продукта, упомянутого выше в пунктах (А) или (Б), смешанных с мелом, гипсом или другим неорганическим продуктом, не являющимся удобрением (например, удобрения, полученные добавлением к нитрату аммония, смешиванием с ним или на основе из него, вышеупомянутых неорганических веществ, не являющихся удобрениями).
(Г) Жидкие удобрения, состоящие из нитрата аммония (с примесями или без), или мочевины (с примесями или без), или смеси этих продуктов в водном или аммиачном растворах.
Следует отметить, что, в противоположность вышеуказанному пункту (А), смеси, соответствующие пунктам (Б), (В) или (Г), классифицируются в этой товарной позиции только в случае, когда их используют как удобрения.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.
 ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Как сделать нитрат натрия
Нитрат натрия (NaNO3) представляет собой белое твердое вещество при комнатной температуре и хорошо растворяется в воде. Чистый нитрат натрия обычно используется в качестве пищевого консерванта и ракетного топлива. Он также входит в состав многих продуктов, таких как удобрения и пиротехника. Нитрат натрия в основном получают путем его добычи в форме нитрата, но он также может быть синтезирован в промышленных масштабах. Кроме того, существует несколько способов экспериментального получения нитрата натрия.
Производство нитрата натрия в промышленных масштабах путем нейтрализации азотной кислоты (HNO3) кальцинированной содой (Na2CO3). Эта реакция дает нитрат натрия и угольную кислоту, которая немедленно разлагается на диоксид углерода (CO2) и воду (h30). Следующее уравнение показывает эту реакцию: Na2CO3 + 2 HNO3? 2 NaNO3 + h3CO3? 2NaNO3 + CO2 + h3O.
Следующее уравнение показывает эту реакцию: Na2CO3 + 2 HNO3? 2 NaNO3 + h3CO3? 2NaNO3 + CO2 + h3O.
Объедините водные растворы нитрата алюминия Al (NO3) 3 и гидроксида натрия (NaOH), чтобы получить нитрат натрия и гидроксид алюминия Al (OH) 3. Гидроксид алюминия выпадает в осадок в виде желатинового белого твердого вещества, оставляя нитрат натрия в растворе.Следующее уравнение показывает эту реакцию: Al (NO3) 3 + 3 NaOH? Al (OH) 3 + 3 NaNO3.
Смешайте нитрат свинца Pb (NO3) 2 и гидроксид натрия в растворе, чтобы получить нитрат натрия и гидроксид свинца Pb (OH) 2. Гидроксид свинца выпадет в осадок в виде белого твердого вещества, а гидроксид натрия останется в растворе. Следующее уравнение показывает эту реакцию: Pb (NO3) 2 + 2 NaOH = Pb (OH) 2 + 2 NaNO3.
Смешайте раствор нитрата железа Fe (NO3) и гидроксида натрия, чтобы получить нитрат натрия и гидроксид железа Pb (OH) 2.Нитрат натрия останется в растворе, а гидроксид железа выпадет в виде белого твердого вещества.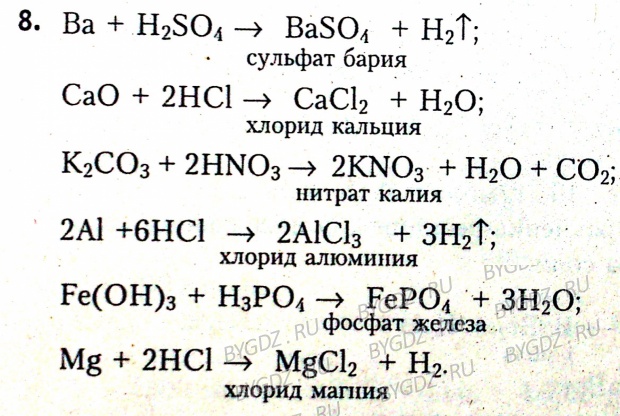 Это уравнение показывает реакцию: Fe (NO3) 3 + 3 NaOH? 3 NaNO3 + Fe (OH) 3.
Это уравнение показывает реакцию: Fe (NO3) 3 + 3 NaOH? 3 NaNO3 + Fe (OH) 3.
Объедините растворы нитрата кальция Ca (NO3) и карбоната натрия (Na2CO3), чтобы получить нитрат натрия и карбонат кальция NaNO3. Нитрат натрия останется в растворе, а карбонат кальция выпадет в осадок в виде белого твердого вещества. Следующее уравнение показывает эту реакцию: Ca (NO3) 2 + Na2CO3 = 2 NaNO3 + CaCO3.
Нитрат кальция — обзор
НИТРАТЫ МЕТАЛЛОВ
M (NO 3 ) n
Составы с индивидуальной индексацией:
* Гексанитроцерат аммония, 3958
*
- 4517
Нитрат бария, 0212
Нитрат цезия, 4255
Нитрат кальция, 3929
* Хромилнитрат, 4232
Нитрат кобальта (II)
900 Нитрат глицината меди (II), 0901Нитрат меди (II), 4273
* Диметилоловодинитрат, 0910
* Нитрат гептасильвера октаоксид, 0047
II* 2-нитрат гидрохлорид , 0853
Нитрат железа (III), 4391
Нитрат свинца (II), 4744
Нитрат лития ate, 4679
Нитрат магния, 4688
Нитрат марганца (II), 4696
Нитрат ртути (I), 4604
Нитрат ртути (II), 4598
* 2 -Метил-1-нитратодимеркурио-2-нитратомеркуриопропан, 1587
Нитрат никеля (II), 3583
Нитрат плутония (IV), 4763
Нитрат калия
- Нитрат серебра, 4645
Гексаоксодинитрат натрия, 4735
Нитрат натрия, 4716
Пентаоксодинитрат натрия, 4734
Тетраоксодинитрат натрия, 4733
Тетраоксодинитрат натрия
натрия
натрия нитрат, 4520
Нитрат таллия (III), 4757
Нитрат олова (II), 4745
* Триэтил Нитрат фосфинзолота, 2553
Нитрат уранила, 4747
* Оксид тринитрата ванадия, 4758
Нитрат цинка, 4746
См. См. MOLTEN SALT 9 BATHS
См. MOLTEN SALT 9 BATHS
Алюминий
См. Алюминий: нитраты металлов и т. Д.
Лимонная кислота
Шеннон И. Р., Chem. & Ind., 1970, 149
Во время вакуумного испарения водной смеси неопределенных смешанных нитратов металлов и лимонной кислоты аморфное твердое вещество взорвалось почти в сухом состоянии. Это было связано с окислением органического остатка присутствующими нитратами, возможно, катализированным одним из оксидов, которые, как ожидается, будут образовываться.
Сложные эфиры или хлорид фосфора или олова (II)
Pieters, 1957, 30
Смеси нитратов металлов с алкиловыми эфирами могут взорваться из-за образования алкилнитратов.Смеси нитрата с фосфором, хлоридом олова (II) или другими восстановителями (например, окислительно-восстановительные комбинации) могут вступать в реакцию со взрывом.
См. Другие РЕАКЦИИ РЕДОКС
Этанол
Pitwell, L. R. , Chem. Англ. News, 1978, 56 (37), 56
, Chem. Англ. News, 1978, 56 (37), 56
При анализе воды использование этанола для удаления более чем следов нитрата или нитрит-иона может привести к образованию фульминовой кислоты, а если ртуть (II) при использовании в качестве катализатора может образоваться взрывоопасный фульминат ртути.
Нитрат серебра: этанол, 0022
См. Нитрат ртути (II): этанол
Фосфинаты металлов
- 1.
Mellor, 1940, Vol. 8, 881
- 2.
Costa, R. L., Chem. Англ. News, 1947, 25, 3177
Смеси нитратов и фосфинатов металлов, ранее предложенные в качестве взрывчатых веществ [1], взрываются при нагревании.
Органические вещества
- 1.
Bowen, H. J. M., Anal. Chem., 1968, 40, 969; частная коммуникация, 1968
- 2.
Grewelling, T., Anal., Chem., 1969, 41, 540-541
- 3.

Crutchfield, CA et al. , J. Chem. Ed., 1991, 68 (7), 620
- 4.
Комментарии редактора
- 5.
Scheepers, P. et al., South African Pat. 98 03, 403
Когда органическое вещество разрушается для анализа остатка путем нагревания с эквимолярной смесью нитрата калия и нитрата натрия до 390 ° C, необходимо использовать 20-кратный избыток нитрата. Если присутствует более 10% органического вещества, происходят пиротехнические реакции, которые могут быть взрывоопасными [1]. После взрыва при нагревании смеси лимонной кислоты и нитрата натрия до температуры ниже 500 ° C эксперименты по эффекту нагревания различных органических материалов нитратами металлов показали тенденцию к увеличению взрыва от магния через кальций до нитрата натрия.Это в порядке m.p. нитратов, и взрыв может произойти, когда нитраты плавятся и вступают в тесный контакт с органическими веществами. Предварительная обработка азотной кислотой может снизить риск взрыва [2]. Суспензия нитрата никеля, крахмала, амина и некоторых предположительно инертных компонентов оказалась горючим взрывчатым веществом при сушке циклона, воспламеняющейся при температуре выше 135 ° C. Следует соблюдать осторожность при смешивании нитратов с окисляемыми материалами [3]. Нанотехнологи описали различные методы получения микрочастиц (обычно) оксидов переходных металлов путем пиролиза органических солей этих металлов, иногда, правда, смешанных с нитратами, в других случаях, полученных из них путем ионного обмена, без фактического удаления обмененного нитрата до на пиролиз; обычно это насилие и, кажется, суждено остаться нанотехнологией.
Суспензия нитрата никеля, крахмала, амина и некоторых предположительно инертных компонентов оказалась горючим взрывчатым веществом при сушке циклона, воспламеняющейся при температуре выше 135 ° C. Следует соблюдать осторожность при смешивании нитратов с окисляемыми материалами [3]. Нанотехнологи описали различные методы получения микрочастиц (обычно) оксидов переходных металлов путем пиролиза органических солей этих металлов, иногда, правда, смешанных с нитратами, в других случаях, полученных из них путем ионного обмена, без фактического удаления обмененного нитрата до на пиролиз; обычно это насилие и, кажется, суждено остаться нанотехнологией.
Недавние аварии предполагают, что научному миру нужно напомнить, что в течение первых 500 лет огнестрельного оружия и первых 300 гражданских взрывных работ единственное доступное взрывчатое вещество представляло собой смесь одного из более стабильных и менее окисляющих нитратов металлов с не очень горючими веществами. углеродистый материал плюс катализатор. Порох был в значительной степени заменен более безопасными и более надежными взрывчатыми веществами, но подобные смеси остаются небезопасными, поскольку потенциально взрывоопасны, особенно если смешивание происходит на молекулярном уровне в комплексе.Заменители пороха иногда патентуются, часто они состоят из углевода и нитрата металла [5]. Не всегда можно предположить, что безопасность нитратов металлов выше, когда они гидратированы [4].
Порох был в значительной степени заменен более безопасными и более надежными взрывчатыми веществами, но подобные смеси остаются небезопасными, поскольку потенциально взрывоопасны, особенно если смешивание происходит на молекулярном уровне в комплексе.Заменители пороха иногда патентуются, часто они состоят из углевода и нитрата металла [5]. Не всегда можно предположить, что безопасность нитратов металлов выше, когда они гидратированы [4].
См. Лимонная кислота, выше
См. Также Нитрат меди (II)
Гексанитрокобальтат калия
См. Гексанитрокобальтат калия (3–)
Sulphur
Винилсульфоны
соли — Соли — Edexcel — GCSE Chemistry (Single Science) Revision — Edexcel
Нерастворимая соль может быть получена путем взаимодействия двух подходящих растворов вместе с образованием осадка.
Определение подходящих растворов
1jp4eqt9zoe.0.0.0.1:0.1.0.$0.$2.$1″> Все нитраты и все соли натрия растворимы. Это означает, что данный осадок XY может быть получен путем смешивания вместе растворов:Например, для приготовления осадка карбоната кальция:
- X = кальций и Y = карбонат
- смешать раствор нитрата кальция и раствор карбоната натрия вместе
нитрат кальция + карбонат натрия → нитрат натрия + карбонат кальция
Ca (NO 3 ) 2 (водн.) + Na 2 CO 1jp4eqt9zoe.0.0.0.1:0.1.0.$0.$2.$6.$7″> 3 (водн.) → 2NaNO 3 (водн.) + CaCO 3 (s)
Это также работает, если раствор карбоната калия или раствор карбоната аммония используется вместо раствора карбоната натрия.Помните, что все обычные соли калия и аммония растворимы.
- Вопрос
Назовите два подходящих раствора, которые при смешивании образуют осадок хлорида серебра.
- Показать ответ
- $2.$8.3.$0″> Раствор нитрата серебра и раствор хлорида натрия (или раствор хлорида калия, или раствор хлорида аммония).
Контурный метод
Это контурный метод приготовления чистого сухого образца нерастворимой соли.
- Смешайте два подходящих раствора (см. Выше).
- Используйте фильтрацию, чтобы отделить осадок от раствора.
- Промойте осадок дистиллированной водой, пока он находится в фильтровальной воронке.
- Оставьте промытый осадок в стороне или в теплой духовке для просушки.
Причины для каждого шага
1. Один стакан содержит смесь твердого вещества и жидкости, другой содержит воронку с фильтровальной бумагой
2. Смесь твердого вещества и жидкости наливается в фильтровальную воронку.
3. Жидкость капает через фильтровальную бумагу, но твердые частицы задерживаются фильтровальной бумагой.
Нитрат кальция — Sciencemadness Wiki
Нитрат кальция , также называемый Норвежская селитра ( Norgessalpeter ), является неорганическим соединение кальция с формулой Ca (NO 3 ) 2 , обычно используется в качестве удобрения.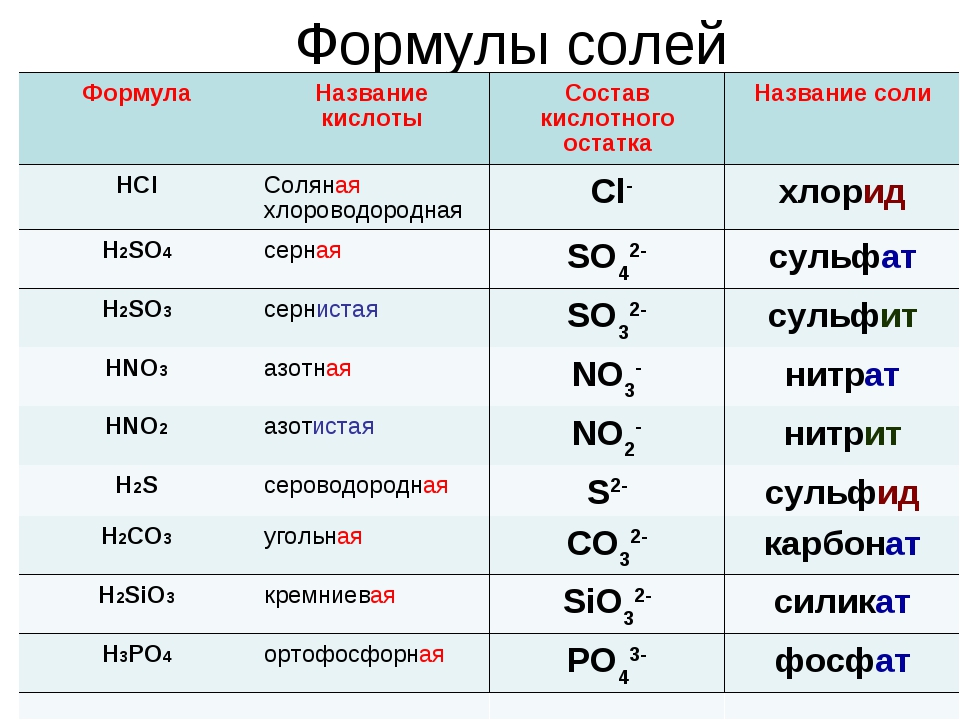
Недвижимость
Химическая промышленность
Нитрат кальция является источником ионов кальция и нитрата в реакциях. Из-за гигроскопичности он непригоден для использования в качестве окислителя в энергетических смесях; однако из-за нерастворимости многих солей кальция ион нитрата в нитрате кальция можно легко использовать для получения других более полезных нитратов, а также других соединений кальция. Примеры этого включают добавление карбоната натрия для осаждения карбоната кальция и оставления нитрата натрия в растворе или добавление сульфата калия для образования нитрата калия в растворе с осаждением сульфата кальция.
- Ca (NO 3 ) 2 + Na 2 CO 3 → 2 NaNO 3 + CaCO 3
- Ca (NO 3 ) 2 + K 2 SO 4 → 2 KNO 3 + CaSO 4
Практически любое нитратное соединение может быть получено путем добавления раствора сульфата или карбоната в таким образом, за исключением нитрата бария и нитрата свинца (II).
Нитрат кальция разлагается при нагревании с выделением диоксида азота и кислорода.
- Ca (NO 3 ) 2 → CaO + 2 NO 2 + ½ O 2
Физические
Нитрат кальция — белое гигроскопичное твердое вещество. Он представляет собой тетрагидрат. Нитрат кальция очень хорошо растворяется в воде. Растворение тетрагидрата нитрата кальция в воде сильно эндотермично, поэтому его можно использовать в охлаждающих ваннах. Он также растворим в спирте и ацетоне, но не растворим в концентрированной азотной кислоте.
Наличие
Нитрат кальция можно купить в качестве удобрения, часто для гидропоники.Он довольно чистый, в отличие от нитрата аммония, который обычно содержит сульфат кальция, чтобы снизить его взрывоопасность. Однако его также можно найти вместе с нитратом аммония, и это удобрение известно как нитрат аммония кальция.
Препарат
Нитрат кальция может быть получен реакцией карбоната кальция и азотной кислоты.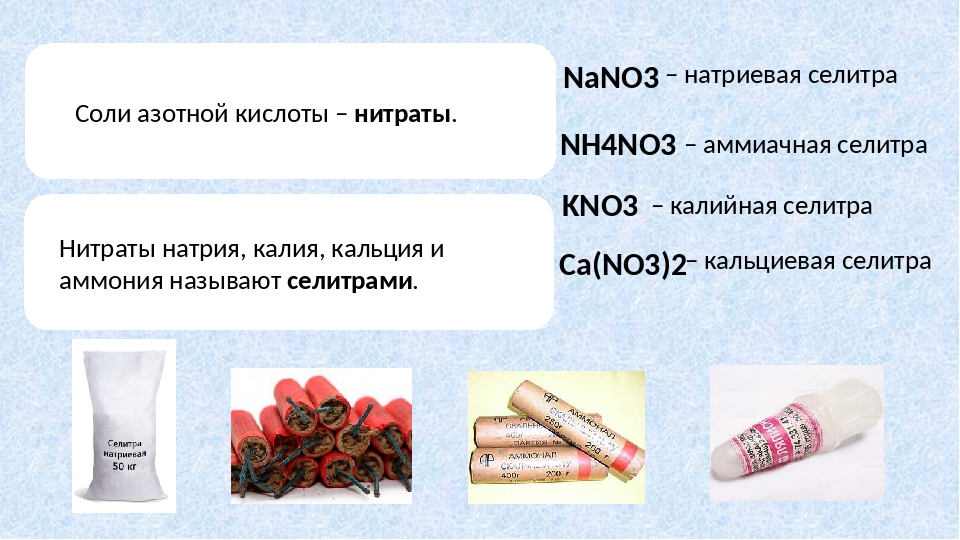
- 2 HNO 3 + CaCO 3 → Ca (NO 3 ) 2 + H 2 O + CO 2
Его также можно получить реакцией гидроксида кальция с нитратом аммония.
- 2 NH 4 NO 3 + Ca (OH) 2 → Ca (NO 3 ) 2 + 2 NH 3 + 2 H 2 O
Проекты
Обработка
Безопасность
Из-за своей гигроскопичности он не может выдерживать энергетическую смесь, как другие нитраты, такие как нитрат калия, что делает его полезным в качестве безопасного источника нитрат-ионов. Следует избегать контакта с кожей безводного соединения, так как оно может вызывать раздражение.
Хранилище
Нитрат кальция гидрат следует хранить в закрытых бутылях, в месте с низкой влажностью. Безводную форму следует хранить в закрытых флаконах, так как она гигроскопична.
Выбытие
Нитрат кальция без токсичных примесей можно безопасно сбрасывать в окружающую среду, так как он малотоксичен и является источником азота для растений. Однако избегайте сброса больших объемов.
Однако избегайте сброса больших объемов.
Список литературы
- ↑ http://chemister.ru/Database/properties-en.php? dbid = 1 & id = 558
Соответствующие темы Sciencemadness
Химическое равновесие смесей расплавленных тройных нитратных солей (Технический отчет)
Брэдшоу, Роберт В., Микер, Дональд Э. Химическое равновесие смесей расплавленных тройных нитратных солей . США: Н. П., 1989.
Интернет. DOI: 10,2172 / 1545834.
Брэдшоу, Роберт В., & Микер, Дональд Э. Химическое равновесие смесей расплавленных тройных нитратных солей . Соединенные Штаты. https://doi.org/10.2172/1545834
Брэдшоу, Роберт В., и Микер, Дональд Э. Мон.
«Химическое равновесие смесей расплавленных тройных нитратных солей». Соединенные Штаты. https://doi.org/10.2172/1545834. https://www.osti.gov/servlets/purl/1545834.
Соединенные Штаты. https://doi.org/10.2172/1545834. https://www.osti.gov/servlets/purl/1545834.
@article {osti_1545834,
title = {Химическое равновесие смесей расплавленных тройных нитратных солей},
author = {Брэдшоу, Роберт В.и Микер, Дональд Э.},
abstractNote = {Мы оценили химическое равновесие реакций разложения тройных смесей расплавов нитратных солей, состоящих из нитратов натрия и калия с добавками нитрата кальция, бария или лития. Мы обнаружили, что константа равновесия исходной реакции нитрат нитрит + кислород относительно нечувствительна к составу смесей. Степень протекания последующих реакций разложения зависит от типа и количества добавок к смеси бинарных нитратов щелочного металла и зависит от заряда и размера добавленных катионных частиц.Взаимодействие атмосферного углекислого газа с расплавами было оценено для щелочноземельных смесей.},
doi = {10. 2172 / 1545834},
2172 / 1545834},
url = {https://www.osti.gov/biblio/1545834},
journal = {},
number =,
объем =,
place = {United States},
год = {1989},
месяц = {5}
}
Визуализация молекулярного изменения границы раздела кальцит (104) — вода нитратом натрия
Goldschmidt, V.М. Принципы распределения химических элементов в минералах и горных породах. Седьмая лекция Хьюго Мюллера, прочитанная в Химическом обществе 17 марта 1937 года. J Chem Soc 1 , 655–673 (1937).
Артикул Google ученый
Heberling, F. et al. Реакционная способность границы раздела кальцит-вода, от процессов молекулярного масштаба до геохимической инженерии. Appl Geochem 45 , 158–190 (2014).
Appl Geochem 45 , 158–190 (2014).
CAS Статья Google ученый
Estroff, L.A. Введение: Биоминерализация. Chem Rev 108 , 4329–4331 (2008).
CAS Статья Google ученый
Смитс, П. Дж. М., Чо, К. Р., Кемпен, Р. Г. Э., Соммердейк, Н. А. Дж. М. и Де Йорео, Дж. Дж. Зарождение карбоната кальция, вызванное связыванием ионов в биомиметической матрице, выявленное с помощью электронной микроскопии in situ . Nat Mater 14 , 394–399 (2015).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Куффнер, И. Б., Андерссон, А. Дж., Джокель, П. Л., Роджерс, К. С. и Маккензи, Ф. Т. Уменьшение численности корковых кораллиновых водорослей из-за подкисления океана. Nat Geosci 1 , 114–117 (2008).
Б., Андерссон, А. Дж., Джокель, П. Л., Роджерс, К. С. и Маккензи, Ф. Т. Уменьшение численности корковых кораллиновых водорослей из-за подкисления океана. Nat Geosci 1 , 114–117 (2008).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Тейлор, Х.F. W. Cement Chemistry 2-е изд. (Thomas Telford Ltd, 1997).
Левита, Г., Маркетти, А. и Лазцери, А. Разрушение ультратонких композитов из полипропилена с карбонатом кальция. Polym Composite , 10 , 39–43 (1989).
CAS Статья Google ученый
Хашим, М.А., Мухопадхьяй, С., Саху, Дж. Н. и Сенгупта, Б. Технологии восстановления грунтовых вод, загрязненных тяжелыми металлами. J Environ Manage , 92 2355–2388 (2011).
Технологии восстановления грунтовых вод, загрязненных тяжелыми металлами. J Environ Manage , 92 2355–2388 (2011).
CAS Статья Google ученый
Геккейс, Х., Лютценкирхен, Дж., Полли, Р., Рабунг, Т. и Шмидт, М. Реакции на границе раздела минеральной воды и актинидов. Chem Rev 113 , 1016–1062 (2013).
CAS Статья Google ученый
Legens, C., Palermo, T., Toulhoat, H., Fafet, A. & Koutsoukos, P. Изменения смачиваемости карбонатных пород, вызванные адсорбцией органических соединений. J Petrol Sci Eng 20 , 277–282 (1998).
CAS Статья Google ученый
Teng, H. H., Dove, P. M. & DeYoreo, J. J. Обратные морфологии кальцита, вызванные микроскопической кинетикой роста: понимание биоминерализации. Geochim Cosmochim Acta 63 , 2507–2512 (1999).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Чада, В. Г. Р., Хауснер, Д. Б., Стронгин, Д. Р., Рафф, А. А. и Ридер, Р. Дж. Поглощение двухвалентного Cd и Pb на поверхности расщепления кальцита [10 (1) над стержнем4}: исследование XPS и AFM. J Colloid Interf Sci , 288 , 350–360 (2005).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Исикава, М.& Итикуни, М. Поглощение натрия и калия кальцитом. Chem Geol 42 , 137–146 (1984).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Stipp, SL, Hochella, MF, Parks, GA & Leckie, JO Cd 2+ Поглощение кальцитом, диффузия твердого тела и образование твердого раствора — межфазные процессы, наблюдаемые с помощью чувствительных к поверхности Техники (Xps, Leed и Aes). Geochim Cosmochim Acta 56 , 1941–1954 (1992).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Риччи, М., Спайкер, П., Стеллаччи, Ф., Молинари, Дж. Ф. и Войчовский, К. Прямая визуализация одиночных ионов в кормовом слое кальцита. Langmuir 29 , 2207–2216 (2013).
CAS Статья Google ученый
Бовет, Н., Янг, М., Джавади, М. С. и Стипп, С. Л.С. Взаимодействие спиртов с поверхностью кальцита. Phys Chem Chem Phys 17 , 3490–3496 (2015).
CAS Статья Google ученый
Фентер, П. и Стурчио, Н. С. Структура и рост монослоев стеарата на кальците: первые результаты исследования in situ рентгеновской отражательной способности. Geochim Cosmochim Acta 63 , 3145–3152 (1999).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Hofmann, S., Войчовский К., Шмидт М. и Штумпф Т. Концентрация следов — огромное влияние: нитраты в системе кальцит / Eu (III). Geochim Cosmochim Acta 125 , 528–538 (2014).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Келлер, К. С., Олссон, М. Х. М., Янг, М. и Стипп, С. Л. Адсорбция этанола и воды на кальците: зависимость от геометрии поверхности и влияние на поведение поверхности. Langmuir 31 , 3847–3853 (2015).
CAS Статья Google ученый
Ricci, M. et al. Рост и растворение кальцита в присутствии адсорбированной стеариновой кислоты. Langmuir 31 , 7563–7571 (2015).
CAS Статья Google ученый
Чой, У. Х., Шин, Дж. У., Ким, Дж. Дж. И Парк, Дж. Й. Колонны, заполненные кальцитом, для удаления фторида из промышленных сточных вод. Очистка опресненной воды 30 , 247–253 (2011).
Колонны, заполненные кальцитом, для удаления фторида из промышленных сточных вод. Очистка опресненной воды 30 , 247–253 (2011).
CAS Статья Google ученый
Меррихпур, Х. и Джалали, М. Отходы кальцитового шлама в качестве адсорбента для удаления кадмия, меди, свинца и цинка из водных растворов. Clean Technol Envir 14 , 845–855 (2012).
CAS Статья Google ученый
Мяо, Ю.Y. et al. Удаление сурьмы (V) из воды гидратированными оксидами железа на основе кальцитового песка и полимерного анионита. J Environ Sci-China 26 , 307–314 (2014).
CAS Статья Google ученый
Шмидт М., Штумпф Т., Фернандес М. М., Вальтер К. и Фангхенель Т. Компенсация заряда в твердых растворах. Angew. Chem. Intl. 47 , 5846–5850 (2008).
CAS Статья Google ученый
Сонг, С.и другие. Удаление мышьяка из воды с высоким содержанием мышьяка путем усиленной коагуляции ионами трехвалентного железа и грубым кальцитом. Water Res 40 , 364–372 (2006).
CAS Статья Google ученый
Бернер У. Р. Эволюция химического состава поровой воды при разложении цемента в среде хранилища радиоактивных отходов. Управление отходами 12 , 201–219 (1992).
CAS Статья Google ученый
Бронсон, К.F. et al. Остаточный почвенный нитрат на орошаемых хлопковых полях Southern High Plains и нитрат подземных вод Огаллала. J Почвенный водный заповедник 64 , 98–104 (2009).
Артикул Google ученый
Даримонт Т., Шульце Г. и Соннеборн М. Определение нитратов в питьевой воде с помощью ионной хроматографии. Fresen Z Anal Chem 314 , 383–385 (1983).
CAS Статья Google ученый
Фентер, П., Керисит, С., Райтери, П. и Гейл, Дж. Д. Понятна ли граница раздела кальцит-вода? Прямые сравнения моделирования молекулярной динамики с данными зеркальной отражательной способности рентгеновских лучей. J. Phys. Chem. С 117 , 5028-5042 (2013).
С 117 , 5028-5042 (2013).
CAS Статья Google ученый
Маркус Ю. Термодинамика сольватации ионов 5. Свободная энергия гидратации Гиббса при 298,15 К. J Chem Soc Faraday T 87 , 2995–2999 (1991).
CAS Статья Google ученый
Уолтерс М., Шарле Л. и ван Каппаллен П. Химия поверхности минералов карбоната двухвалентных металлов; критическая оценка поверхностного заряда и потенциальных данных с использованием многоузловой модели ионного комплекса с распределением заряда. Am J Sci , 308 , 905–941 (2008).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Спаньоли, Д., Kerisit, S. & Parker, S.C. Атомистическое моделирование свободных энергий растворения ионов с плоских и ступенчатых поверхностей кальцита. J Cryst Growth 294 , 103–110 (2006).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Риччи М., Спайкер П. и Войчовски К. Индуцированная водой корреляция между отдельными ионами, отображаемыми на границе твердое тело-жидкость. Нац Коммуна 5 , 5400 (2014).
Артикул Google ученый
Войчовский, К. Ангармонизм, силы сольватации и разрешение в атомно-силовой микроскопии на границе твердое тело-жидкость. Phys Rev E 88 , 022407 (2013).
ADS Статья Google ученый
Fukuma, T. et al. Механизм построения изображений трехмерных гидратных структур на границе твердое тело-жидкость с помощью атомно-силовой микроскопии. Phys. Ред. B 92 , 155412 (2015).
ADS Статья Google ученый
Войчовский К. & АСМ высокого разрешения в жидкости: что насчет наконечника? Нанотехнологии 26 , 100501 (2015).
ADS Статья Google ученый
Heberling, F. et al. Структура и реакционная способность границы раздела кальцит-вода. J Colloid Interf Sci 354 , 843–857 (2011).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Heberling, F., Eng, P., Denecke, MA, Luetzenkirchen, J. & Geckeis, H. Расслоение электролита на границе раздела кальцит (104)-вода, обозначенное Rb + — и Se (VI ) Резонансная дифракция на границе раздела K-края. Phys Chem Chem Phys 16 , 12782–12792 (2014).
CAS Статья Google ученый
Пириу, Б., Fedoroff, M., Jeanjean, J. & Bercis, L. Характеристика сорбции европия (III) на кальците с помощью сайт-селективной люминесцентной спектроскопии с временным разрешением. J Colloid Interf Sci 194 , 440–447 (1997).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Штумпф Т. и Фангхенел Т. Исследование взаимодействия трехвалентных актинидов (Cm (III)) с кальцитом с помощью лазерной флуоресцентной спектроскопии с временным разрешением (TRLFS). J Colloid Interf Sci 249 , 119–122 (2002).
J Colloid Interf Sci 249 , 119–122 (2002).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Politi, Y. et al. Структурная характеристика переходной фазы аморфного предшественника карбоната кальция в эмбрионах морского ежа. Adv Funct Mater 16 , 1289–1298 (2006).
CAS Статья Google ученый
Уоллес, А.F. et al. Микроскопические доказательства разделения жидкость-жидкость в перенасыщенных растворах CaCO3. Наука 341 , 885–889 (2013).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Siretanu, I. et al. Прямое наблюдение ионной структуры на границах раздела твердое тело-жидкость: глубокий взгляд на слой Стерна. Научный журнал , 4 , 4956 (2014).
et al. Прямое наблюдение ионной структуры на границах раздела твердое тело-жидкость: глубокий взгляд на слой Стерна. Научный журнал , 4 , 4956 (2014).
CAS Статья Google ученый
Li, X., Ли, Х. и Ян, Дж. Содействие адсорбции ионов металлов на каолините дефектными участками: исследование молекулярной динамики. Научный сотрудник , 5 , 14377 (2015).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Phillips, J. C. et al. Масштабируемая молекулярная динамика с NAMD. J Comput Chem 26 , 1781–1802 (2005).
CAS Статья Google ученый
Брукс, Б.R. et al. CHARMM: Программа биомолекулярного моделирования. J. Comput Chem. 30 , 1545–1614 (2009).
CAS Статья Google ученый
Бааден, М., Бургард и М., Випфф, Г. ТБФ на границе раздела вода-нефть: влияние концентрации ТБФ и кислотности воды исследовано с помощью моделирования молекулярной динамики. J. Phys Chem B 105 , 11131–11141 (2001).
CAS Статья Google ученый
Дель Пополо, М.Г. и Вот, Г. А. О структуре и динамике ионных жидкостей. J Phys Chem B , 108 , 1744–1752 (2004).
CAS Статья Google ученый
Хамфри, В., Далке, А. и Шультен, К. VMD: визуальная молекулярная динамика. Модель J Mol Graph Model 14 , 33–38 (1996).
CAS Статья Google ученый
Michaud-Agrawal, N., Деннинг, Э. Дж., Вульф, Т. Б. и Бекштейн, О. Новости и обновления программного обеспечения MDAnalysis: инструментарий для анализа моделирования молекулярной динамики. J. Comput Chem 32 , 2319–2327 (2011).
CAS Статья Google ученый
Fenter, P. et al. Поверхностное строение кальцита наблюдалось in situ по отражательной способности рентгеновских лучей с высоким разрешением. Geochim Cosmochim Acta 64 , 1221–1228 (2000).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Geissbuhler, P. et al. Трехмерная структура границы раздела кальцит-вода по поверхностному рассеянию рентгеновских лучей. Surf Sci 573 , 191–203 (2004).
ADS Статья Google ученый
Fenter, P. & Sturchio, N.C. Межфазные структуры минеральной воды, обнаруженные методом синхротронного рассеяния рентгеновских лучей. Prog Surf Sci 77 , 171–258 (2004).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Хаттер, Дж. Л. и Беххофер, Дж. Калибровка наконечников атомно-силового микроскопа.

 изм.
изм. изм
изм ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
Leave A Comment