Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
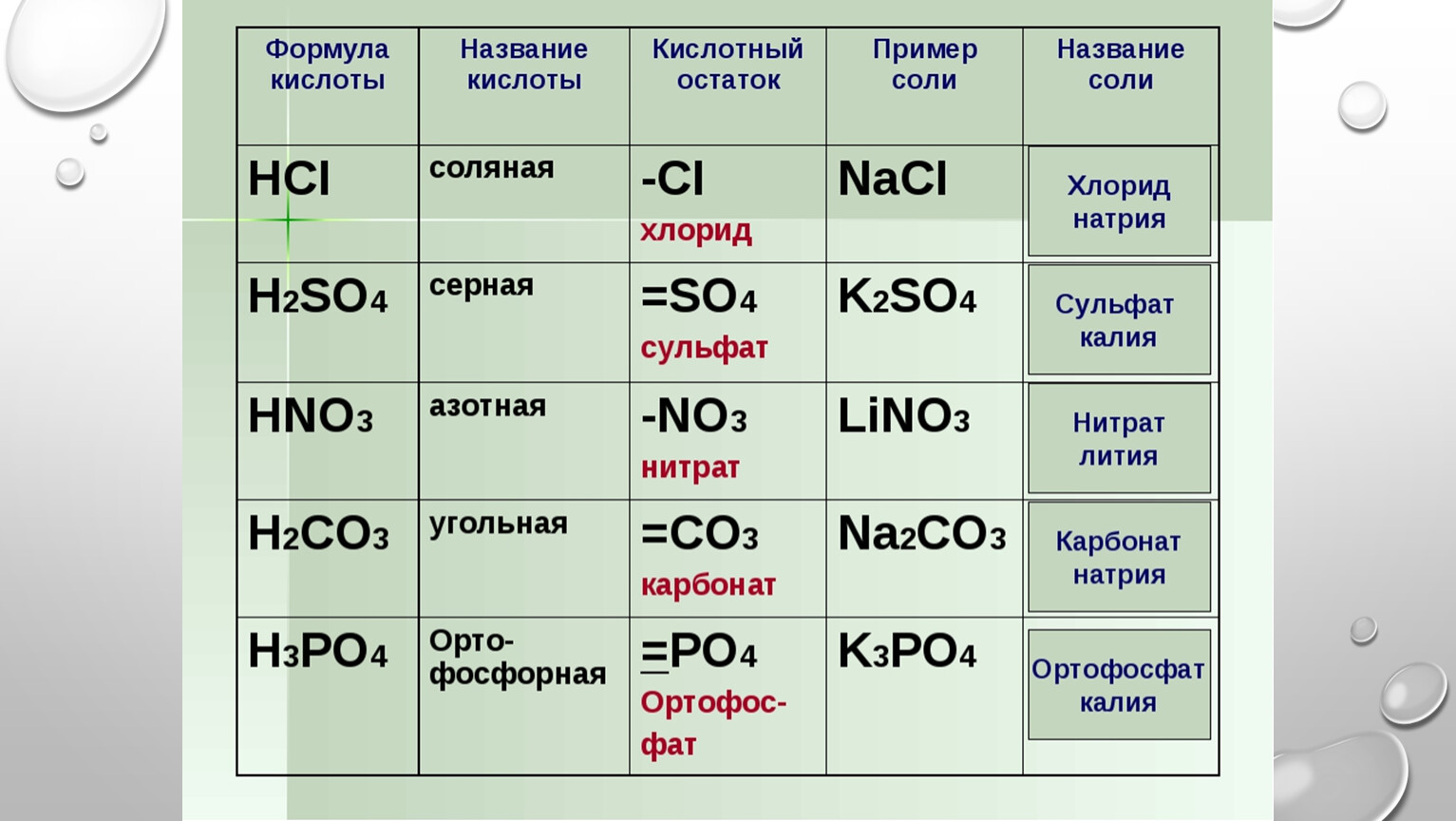
Составьте уравнения реакций с помощью которых можно осуществить следующие превращения: S—>SO2—>Na2SO3—>NaHSO3—>Na2SO4—>NaHSO4.
При нагревании насыщенного одноатомного спирта массой 12г с концентрированной серной кислотой образовался алкен массой 6,3 граммов.Выход продукта становил 75%.Определите формулу исходного спирта
Решено
Хлороводород объемом 100 л (н.у) растворили в 1 л воды. полученный раствор занимает объем 1,09 л. вычислите массовую долю хлороводорода в растворе, его молярную и нормальную концентрации
Какой объем оксида азота (IV) образуется при взаимодействии азотной кислоты со 140г меди, содержащей 15% примесей?
Решено
Определите число молекул кристаллизационной воды…
Пользуйтесь нашим приложением
1 задание ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 2 балла. {2+} = Zn(OH)_2$
{2+} = Zn(OH)_2$
Ответ:
Показать решение
Бесплатный интенсив
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк — это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить уведомления.
Включить уведомления
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.
Курс стартует 27 марта. Бесплатный интенсив
9 Важные примеры ионов-наблюдателей, которые необходимо знать —
Манси Шарма
Примерами ионов-наблюдателей являются те ионы, которые присутствуют в реакции, но не участвуют в ней. Они присутствуют как на стороне реагента, так и на стороне продукта, но обычно нейтрализуются в чистой химической реакции. Чистое химическое уравнение показывает только те химические вещества, которые претерпели химическое превращение.
Они присутствуют как на стороне реагента, так и на стороне продукта, но обычно нейтрализуются в чистой химической реакции. Чистое химическое уравнение показывает только те химические вещества, которые претерпели химическое превращение.
- Спектатор-ионы примеры чистой реакции между хлоридом меди(II) и фосфатом калия
- Спектатор-ионы примеры реакции между нитратом серебра и хлоридом натрия
- Спектатор-ионы примеры ионных реакций между хроматом натрия и нитратом свинца(II) сульфат
- Спектатор-ионы примеры ионной реакции между гидроксидом калия и нитратом магния
- Спектатор-ионы примеры реакции между йодидом натрия и нитратом серебра
- Примеры взаимодействия хлорида магния и нитрата серебра
- Спектатор-ионы примеры реакции нейтрализации между гидроксидом калия и азотной кислотой
Чтобы найти ионы-спектаторы в химической реакции, важно написать сбалансированную химическую реакцию между CuCl 2 и K 3 PO 4 . Диссоциированные ионные реакции исключают примеры ионов-спектаторов как со стороны реагентов, так и со стороны продуктов. Это обеспечивает чистую ионную реакцию. Здесь примерами ионов-спектаторов являются 6K + и 6Cl – . Итоговое ионное уравнение:
Диссоциированные ионные реакции исключают примеры ионов-спектаторов как со стороны реагентов, так и со стороны продуктов. Это обеспечивает чистую ионную реакцию. Здесь примерами ионов-спектаторов являются 6K + и 6Cl – . Итоговое ионное уравнение:
Нитрат серебра и хлорид натрия реагируют в водной среде с образованием осадка хлорида серебра и ионного соединения NaNO 3 .
Как показано в приведенной выше реакции, NaCl диссоциирует на Na + и Cl – , а AgNO 3 диссоциирует на Ag + и NO 3 – . Таким образом, это дает нам чистое химическое уравнение, как показано ниже, и два примера ионов-спектаторов Na + и № 3 – .
Спектатор-ионы примеры Na+ и NO3- Спектатор-ионы примеры ионных реакций между хроматом натрия и нитратом свинца(II) Ионная реакция между водными растворами Na 2 CrO 4 3 ) 2 дает желтый осадок PbCrO 4 и ионный раствор NaNO 3 . В их ионном уравнении исключены примеры ионов-спектаторов и записано результирующее ионное уравнение. Примерами ионов-спектаторов в химической реакции являются 2Na + и 2NO 3 – , как показано в уравнении.
В их ионном уравнении исключены примеры ионов-спектаторов и записано результирующее ионное уравнение. Примерами ионов-спектаторов в химической реакции являются 2Na + и 2NO 3 – , как показано в уравнении.
Гидроксид натрия реагирует с сульфатом меди по реакции двойного замещения с образованием гидроксида меди и сульфата натрия. Их суммарная ионная реакция показывает, что ионы сульфата и натрия остаются растворенными в водной среде. Следовательно, ионы натрия и сульфата являются примерами ионов-спектаторов.
Примерами ионов-спектаторов являются ионы Na+ и сульфат-ионы Примеры ионов-спектаторов ионной реакции между гидроксидом калия и нитратом магния KOH и Mg(NO 3 ) 2 существуют в виде водных растворов. Здесь магний реагирует с ионами гидроксида с образованием твердого соединения гидроксида магния. Ионы калия и нитрата здесь являются примерами ионов-спектаторов, растворенных в водной среде.
Здесь магний реагирует с ионами гидроксида с образованием твердого соединения гидроксида магния. Ионы калия и нитрата здесь являются примерами ионов-спектаторов, растворенных в водной среде.
Иодид натрия и нитрат серебра реагируют с образованием осадка йодида серебра и ионного раствора нитрата натрия. Согласно сбалансированным и ионным химическим уравнениям ионы натрия, железа и нитрата являются примерами ионов-спектаторов, поскольку они не участвуют непосредственно в образовании продукта.
Примеры спектаторных ионов Na+ и NO3- Примеры спектаторных ионов реакции между хлоридом магния и нитратом серебра Водные растворы хлорида магния и нитрата серебра реагируют с образованием твердого хлорида серебра и водного нитрата магния. Чистое ионное уравнение показывает, что ионы магния и нитрат-ионы являются примерами ионов-спектаторов.
Реакция между гидроксидом натрия и соляной кислотой является одной из наиболее соединение хлорида натрия и воды. Здесь примерами ионов-спектаторов являются H + и ОН – .
Зрительские ионы примеры реакции между нитратом свинца(II) и иодидом калияНитрат свинца(II) и иодидом калия вступают в реакцию двойного замещения. Это приводит к образованию йодида свинца (II) и нитрата калия. Здесь, согласно чистой ионной реакции, примерами ионов-спектаторов являются ион калия и нитрат-ион. Также нитрат калия растворим в водной среде.
Спектатор ионы примеры реакции нейтрализации между гидроксидом калия и азотной кислотой Это реакция нейтрализации, при которой кислота реагирует с основанием с образованием соли с выделением тепла и воды. В этой реакции KOH реагирует с HNO 3 с образованием KNO 3 и H 2 O. Примерами ионов-спектаторов являются ион калия и нитрат-ион.
Примерами ионов-спектаторов являются ион калия и нитрат-ион.
ChemTeam: Complete Molecular, Complete Ionic и Net Ionic: пятнадцать задач
ChemTeam: Complete Molecular, Complete Ionic и Net Ionic: пятнадцать задач Complete Molecular, Complete Ionic и Net Ionic: пятнадцать задач
| Десять проблем | Двадцать пять задач | Руководство по чистому ионному уравнению |
| Все NR | Меню уравнений и типов реакций | |
Задача №11: Напишите полное ионное уравнение и суммарное ионное уравнение для этой реакции в водном растворе:
AgNO 3 + CH 3 COOH —> AgCH 3 COO + HNO 3
Пожалуйста, включите символы состояния в обе реакции.
Решение:
1) Полная ионизация:
Ag + (водн.) + NO 3 — (водн.) + CH 3 COOH (водн.) —> AgCH 3 COO(s) + H + (водн.) + NO 3 — (водн.)Уксусная кислота является слабой кислотой, поэтому записывается в молекулярной форме. В водном растворе он ионизирован всего на несколько процентов. Ацетат серебра нерастворим, и вы узнаете это из таблицы растворимости.
2) Чистая ионная:
Ag + (водн.) + CH 3 COOH (водн.) —> AgCH 3 COO(s) + H + (водн.)Нитрат — единственный зрительный ион.
Задача №12: Напишите сбалансированное молекулярное уравнение и суммарные ионные уравнения для следующих реакций.
(a) Раствор гидроксида калия взаимодействует с раствором гидрофосфата натрия.
(б) Реакция раствора нитрата магния с раствором карбоната аммония.
Решение (а):
6KOH (AQ) + 3NAH 2 PO 4 (AQ) —> NA 3 PO 4 (AQ) + 2K 3 PO 4 (AQ) + 6H 2 PO 4 (AQ) + 6H 2 4 (AQ) + 6H 2 . О (ℓ)6OH — (водн.) + 3H 2 PO 4 — —> 3PO 4 3- (водн.) + 6H 2 90ℓ
Это кислотно-щелочная нейтрализация.
Решение (б):
Mg(NO 3 ) 2 (водн.) + (NH 4 ) 2 CO 3 (водн.) —-> MgCO 3 NH 4 NO 90 + 2 5 5 NH 90 + 2 3 (водный)Mg 2+ (водн.) + CO 3 2- (водн.) —> MgCO 3 (тв.)
Это двойная замена.
Задача № 13: Напишите сбалансированное молекулярное, полное ионное и суммарное ионное уравнения для этой реакции:
нитрат алюминия реагирует с хлоридом калия с образованием хлорида алюминия и нитрата калия
Решение:
Молекулярный:
Al(NO 3 ) 3 (водн.) + 3KCl(водн.) —> AlCl 3 (водн.) + 3KNO 3 (водный)
Полная ионизация:
Al 3+ (водн.) + 3NO 3 — (водн.) + 3K + (водн.) + 3Cl — (водн.) —> Al 3+ 9006 3Cl — (водн.) + 3K + (водн.) + 3NO 3 — (водн.)
Чистая ионная:
NRNR означает «нет реакции». Все с обеих сторон растворимо и остается в растворе. Все с обеих сторон ионизируется. Осадок не образуется. Газ не образуется. Жидкая вода (признак кислотно-щелочной нейтрализации) не образуется. Суть в том, что все является ионом зрителя, поэтому все, с каждой стороны, устраняется в ионной сети.
Вывод? Химической реакции не произошло.
Причина, по которой я включил эту реакцию, заключается в том, что вы можете увидеть ряд примеров реакций, в которых что-то происходит, а затем в тесте появляется NR, возможность которого никогда не упоминается.
Вы предупреждены!
Задача № 14: Напишите сбалансированные чистые ионные уравнения для следующих реакций в водном растворе:
(а) карбонат натрия и хлорид ванадия(V)
(b) фосфат лития и фторид хрома (III)
Решение (а):
Поскольку в двух реагентах первой реакции нет ни кислот, ни оснований, мы предполагаем, что это будет реакция двойной замены. На основании этого пишем следующее:0930.5Na 2 CO 3 (водн.) + 2VCl 5 (водн.) —> VВсе три растворимых вещества являются ионными, поэтому в растворе они становятся ионами. Ион натрия и ион хлорида являются ионами-спектаторами. Чистая ионизация:
2V 5+ + 5CO 3 2- —> V 2 (CO 3 ) 5 (s)Откуда вы знаете, что V 2 (CO 3 ) 5 выпадает в осадок? Ответ заключается в том, что вы обычно не можете понять это по таблице растворимости, потому что ванадий обычно не включается.
Однако большинство карбонатов тяжелых металлов выпадают в осадок, поэтому вполне разумно предположить, что V 2 (CO 3 ) 5 не растворяется.
И да, это необычная проблема.
Решение (б):
Мы также предсказываем, что это будет реакция двойной замены:Li 3 PO 4 (водн.) + CrF 3 (водн.) —> CrPO 4 (тв.) + 3LiF (водн.)Фосфаты тяжелых металлов почти всегда нерастворимы. Чистая ионизация такова:
Cr 3+ (водн.) + PO 4 3- (водн.) —> CrPO 4 (s)Теперь проблема! Оказывается, фосфат лития тоже нерастворим. Проблема в том, что многие учителя химии в старших классах могут этого не знать. Итак, это более химически правильный чистый ион:
Cr 3+ (водн.) + Li 3 PO 4 (тв.) —> CrPO 4 (тв.) + 3Li + (водн.)
Проблема в том, что ваш учитель (или ответ на онлайн-уроке химии) может ожидать, что первая ионная сеть, которую я написал выше. Моя рекомендация — дать ожидаемый ответ и двигаться дальше. Не пытайтесь спорить.
Задача № 15: Какое суммарное ионное уравнение для гидроксида меди(II) реагирует с разбавленной серной кислотой? (Предупреждение: это сложный ответ!)
Решение:
Молекулярное уравнение:
Cu(OH) 2 (s) + H 2 SO 4 (водн.) —> CuSO 4 (водн.) + 2H 2 O(ℓ)Это кислотно-щелочная нейтрализация. Его также можно рассматривать как двойную замену, но наиболее распространенным ответом является кислотно-основное.
Я хочу, чтобы вы обратили внимание на знак(и) после гидроксида меди(II). Это связано с тем, что гидроксид меди (II) нерастворим, поэтому (водный) не используется.
Два момента: (1) обычно нерастворимые вещества появляются на стороне продукта, реже на стороне реагента и (2) ваш учитель может потребовать, чтобы вместо (s) использовалась (aq).
Обоснование для (водного) состоит в том, что Cu(OH) 2 , который вступает в реакцию, сначала растворяется (и ионизируется, как мы увидим) и поэтому реагирует как водный, а не как твердый.
Полная ионизация на твердой основе для Cu(OH) 2 :
Cu(OH) 2 (т) + H + (водн.) + HSO 4 — (водн.) —> Cu 2+ (водн.) + SO 4 2 -90 (водн.) + 2H 2 O(ℓ)Важно отметить, что серная кислота является сильной кислотой, но только до степени диссоциации первого H + . Полученный ион HSO 4 — является слабой кислотой и не диссоциирует.
Поскольку ионов-спектаторов нет, ничего не удаляется, и результирующее ионное уравнение совпадает с полным ионным уравнением.
Опять же, может быть проблема (или две). Одна проблема заключается в том, что ваш инструктор будет настаивать на том, что серная кислота полностью диссоциирует на ОБА водорода. Другая возможная проблема заключается в том, что гидроксид меди (II) будет рассматриваться как растворимый и записываться как ионы, а не как твердое вещество. В этом случае это чистый ионный результат:
H + (водн.) + OH — (водн.) —> H 2 O(ℓ)Задача № 16: Определите ион-спектор в этой реакции:
Ba(OH) 2 (водн.) + H 2 SO 4 (водн.) —> BaSO 4 (тв.) + H 2 OРешение:
1) Быстрый ответ:
нет2) Более длинный ответ:
напишите полное ионное уравнение:Ба 2+ (водн.) + 2OH¯(водн.) + 2H + (водн.) + SO 4 2 ¯(водн.
) —> BaSO 4 (тв) + H 2 O
3) Определите ионы-спектаторы в полном ионном уравнении:
Их нет. Нет ничего одинакового по обе стороны от стрелки реакции.Заключение: результирующее ионное уравнение точно такое же, как и полное ионное уравнение
Задача №17: Напишите молекулярное уравнение, полное ионное уравнение и результирующее ионное уравнение для бикарбоната натрия и синильной кислоты, реагирующих в водном растворе.
Решение:
1) Реагенты:
NaHCO 3 (водн.) + HCN (водн.) —>2) Предсказать продукты:
—> NaCN(водн.) + H 2 CO 3 (водн.)3) Однако есть проблема. При прогнозировании продуктов H 2 CO 3 (водн.) никогда не бывает возможным. Вот что следует сделать:
H 2 CO 3 (водн.) —> H 2 O(л) + CO 2 (г)
Обратите внимание, что это жидкая вода и газообразный углекислый газ. Нет смысла использовать (aq).
4) Приходим к полному молекулярному уравнению:
NaHCO 3 (водн.) + HCN (водн.) —> NaCN (водн.) + H 2 O(л) + CO 2 (г)5) Ну и полный ионник:
Na + (водн.) + HCO 3 ¯(водн.) + HCN(водн.) —> Na + (водн.) + CN¯(водн.) + H 2 O(л) + СО 2 (г)Бикарбонат натрия является сильным электролитом (как и NaCN), поэтому их пишут полностью ионизированными. Однако HCN является слабой кислотой и всегда записывается в молекулярной форме.
6) Чистая ионная:
HCO 3 ¯(водн.) + HCN(водн.) —> CN¯(водн.) + H 2 O(л) + CO 2 (г)Удаляется только ион натрия.
Задача №18: При добавлении раствора гидроксида натрия к раствору карбоната аммония образуется H 2 O, а при нагревании раствора выделяется газообразный аммиак NH 3 .
Напишите полное молекулярное, полное ионное и суммарное ионное уравнения этой реакции.
Решение:
Реагенты для молекулярного уравнения:
(NH 4 ) 2 CO 3 (водн.) + NaOH (водн.) —>Эти продукты:
(NH 4 ) 2 CO 3 (водн.) + 2NaOH (водн.) —> Na 2 CO 3 (водн.) + 2NH 3 900 О (л)Выше приведено сбалансированное молекулярное уравнение. Обратите внимание, что карбонат натрия — тоже продукт, не упомянутый в тексте задачи.
Между прочим, это (более или менее) двойная замена, с добавлением небольшого количества разложения. Аммиак и вода происходят из NH 4 OH, «соединения», которое является нестабильным, немедленно разлагаясь до аммиак и вода.
Полная ионизация:
2NH 4 + (водн.) + CO 3 2- (водн.) + 2Na + (водн.) + 2OH — (водн.) ) + CO 3 2- (водн.) + 2NH 3 (г) + 2Н 2 О(л)
Чистая ионная:
2NH 4 + (водн.) + 2OH — (водн.) —> 2NH 3 (г) + 2H 2 O(л), который сводится к:
NH 4 + (водн.) + OH — (водн.) —> NH 3 (г) + H 2 O(ℓ)
Задача №19: Напишите полное молекулярное, полное ионное и суммарное ионное уравнения для реакции карбоната аммония с гидроксидом бария.
Решение:
молекулярный:
(NH 4 ) 2 CO 3 (водн.) + Ba(OH) 2 (водн.) —> BaCO 3 (тв.) + 2H 2 ℄ ℄ O 2NH 3 (г)полный ионный:
2NH 4 + (водн.) + CO 3 2- (водн.результирующее ионное уравнение:) + Ba 2+ (водн.) + 2OH — (водн.) 5 (60 5 3 CO 3 9005) —> Ba с) + 2H 2 O(л) + 2NH 3 (г)
2NH 4 + (водн.) + CO 3 2- (водн.) + Ba 2+ (водн.) + 2OH — (водн.) —> BaCO 3 ) + 2H 2 O(л) + 2NH 3 (г)Обратите внимание, что последние два уравнения совпадают. Все изменилось между реагентами и продуктами, ионов-спектаторов нет. Этот пример немного напоминает (по крайней мере, для ChemTeam!) двойное осаждение в задаче №10.
Другое:
Ва(ОН) 2 (водн.) + H 2 SO 4 (водн.) —> BaSO 4 (тв.) + 2H 2 O(ℓ)становится:
Ba 2+ + 2OH¯(водн.) + 2H + + SO 4 2 ¯(водн.) —> BaSO 4 (т) + 2H ℄ 2 6 O() 2
Ионы-зрители не должны быть устранены.
Серная кислота иногда вызывает проблемы. Большинство людей считают его сильно ионизированным (то есть на 100%) обоими ионами водорода. Вот как я сделал это выше. Однако на самом деле серная кислота сильно ионизирована по первому водороду, а затем не сильно ионизирована по второму водороду.
В результате ваш учитель может настаивать на правильности следующего ответа:
Ba 2+ + 2OH¯(водн.) + H + + HSO 4 ¯(водн.) —> BaSO 4 (т) + 2H 2 O(ℓ) 902Другой пример, когда ионы-спектаторы не удаляются:
2H 3 PO 4 (водн.) + 3Sr(OH) 2 (водн.) —> Sr 3 (PO 4 ) 6 9006H 5 9006H (ℓ)становится
2H 3 PO 4 (водн.) + 3Sr 2+ (водн.) + 6OH¯(водн.) —> Sr 3 (PO 4 ) 2 H 2
О(ℓ)Фосфорная кислота и вода являются молекулярными соединениями, поэтому не пишите в ионной форме.
Фосфат стронция выпадает в осадок, поэтому не образуются ионы. Гидроксид стронция ионизируется, но на другой стороне нет ионов, которые можно было бы компенсировать.
Задача №20: Раствор хлорида цинка заливают раствором карбоната аммония.
Решение:
Примечание: аммоний не всегда распадается на газообразный аммиак.
молекулярный:
ZnCl 2 (водн.) + (NH 4 ) 2 CO 3 (водн.) —> ZnCO 3 (тв.) + 2NH 4 (2aq)3 90 Clполное ионное уравнение:
Zn 2+ (водн.) + 2Cl — (водн.) + 2NH 4 + (водн.) + CO 3 2- (водн.) —0 у) + 2NH 4 + (водн.) + 2Cl — (водн.)чистая ионная:
Zn 2+ (водн.) + CO 3 2- (водн.) —> ZnCO 3 (тв.)При взаимодействии аммония с основанием образуется аммиак.
В приведенной выше задаче базы нет.
Задача №21: Pb(NO 3 ) 2 (водн.) + Na 2 S(водн.) —>
Решение:
молекулярный:
Pb(NO 3 ) 2 (водн.) + Na 2 S(водн.) —> PbS(s) + 2NaNO 3 (водн.)полный ионный:
Pb 2+ (водн.) + 2NO 3 — (водн.) + 2Na + (водн.) + S 2- (водн.) —> PbS(s) + 21Na + 90Na (водн.) + 2NO 3 — (водн.)чистая ионная:
Pb 2+ (водн.) + S 2- (водн.) —> PbS(s)Ионы натрия и нитрат-иона были удалены ионами-спектаторами.
Задача №22: фосфат аммония + хлорид кальция —>
Решение:
молекулярный:
2(NH 4 ) 3 PO 4 (водн.) + 3CaCl 2 (водн.) —> 6NH 4 Cl(водн.) + Ca 5 9 0 9 0 9 0 055 6 0 9 0 55 3 PO 90 055 3 2 (с)
Вы знаете, что фосфат кальция выпадает в осадок, зная таблицу растворимости.
чистая ионная:
3Ca 2+ (водн.) + 2PO 4 3- (водный) —> Ca 3 (PO 4 ) 2 (s)Переставлено так, чтобы катион располагался первым на стороне реагента.
Задача №23: Нитрат кобальта(II) реагирует с хлоридом натрия. Напишите полное молекулярное, полное ионное и суммарное ионное уравнения.
Решение:
молекулярные (только реагенты):
Co(NO 3 ) 2 (водн.) + NaCl(водн.) —>Это реакция двойной замены, поэтому мы пишем это для полной молекулярной:
Co(NO 3 ) 2 (водн.) + 2NaCl (водн.) —> 2NaNO 3 (водн.) + CoCl 2 (водн.)
полный ионный:
Co 2+ (водн.) + 2NO 3 — (водн.) + 2Na + (водн.) + 2Cl — (водн.) —> 2Na + + + (водн.) 3 — (водн.) + Co 2+ (водн.) + 2Cl — (водн.)Обратите внимание, что оба продукта растворимы и оба ионизируются.
чистая ионная:
После устранения всех ионов-спектаторов мы остались ни с чем.Н.Р. (нет реакции)
Вот NR: NaNO 3 (водн.) + CoI 2 (водн.) —> NaI (водн.) + Co(NO 3 )2 (водн.)
Все четыре вещества растворимы и все 4 ионизируются на 100%. Это отличительные черты NR.
Вот NR, заданный в хорошем смысле: Если смешать растворы Co(NO 3 ) 3 и Mg(ClO 3 ) 2 , сколько реакций осаждения произойдет? Возможные ответы: 0, 1, 2
Решение:
молекулярные (только реагенты):
Co(NO 3 ) 3 (водн.) + Mg(ClO 3 ) 2 (водн.) —>
Это реакция двойной замены, поэтому мы пишем это для полной молекулярной:
2Co(NO 3 ) 3 (водн.) + 3Mg(ClO 3 ) 2 (водн.) —> 2Co(ClO 3 ) 3 3 (gNO 3 ) 3 3 3 ) 2 (водный)полный ионный:
2Co 3+ (водн.) + 6NO 3 ¯(водн.) + 3Mg 2+ (водн.) + 6ClO 3 ¯(водн.) —> 2Co 3+ 9006 + 6ClO 3 ¯(водн.) + 3Mg 2+ (водн.) + 6NO 3 ¯(водн.)Обратите внимание, что оба продукта растворимы (помните: все нитраты и все хлораты растворимы) и оба ионизируются.
чистая ионная:
После устранения всех ионов-зрителей мы остались ни с чем.Н.Р. (нет реакции)
Это означает, что правильный ответ на вопрос равен нулю.
Вот еще два NR:
2CH 3 COOK(водн.) + BaSO 4 (водн.) —> Ba(CH 3 COO) 2 (водн.) + K 2 SO 4 900
3KI(водн.) + (NH 4 ) 3 PO 4 (водн.) —> K 3 PO 4 (водн.) + 3NH 4 02 9056 I(003)
Задача № 24: Напишите молекулярное и суммарное ионное уравнения для: TlNO 3 (водн.) + KI (водн.) —>
Комментарий: соединения таллия обычно не задают в таких вопросах, и соединения таллия обычно не включаются в таблицы растворимости. При этом таллий — тяжелый металл (это намек на растворимость).
Решение:
молекулярный:
TlNO 3 (водн.) + KI (водн.) —> TlI(s) + KNO 3 (водн.)чистая ионная:
Tl + (водн.) + I — (водн.) —> TlI(s)Комментарий: откуда вы знаете, что TlI выпадает в осадок, если его обычно не включают в таблицы растворимости? Ответ заключается в том, что йодиды тяжелых металлов обычно нерастворимы (AgI, PbI 2 и HgI 2 являются примерами).
Это одна из вещей, которую узнаешь, изучая вопросы того, что разрешимо, а что нет и какие существуют исключения из правил.
Задача № 25: Хлорид аммония и дигидрофосфат натрия, NaH 2 PO 4 смешивают в воде. Напишите сбалансированное суммарное ионное уравнение для кислотно-щелочной реакции, которая в принципе могла бы произойти.
Решение:
Сначала напишем частичное молекулярное:
NH 4 Cl(водн.) + NaH 2 PO 4 (водн.) —>Если рассматривать приведенное выше как реакцию двойного замещения, то можно увидеть, что ион натрия и хлорид-ион являются ионами-наблюдателями. Напишите чистое ионное уравнение в частных производных:
NH 4 + (водн.) + H 2 PO 4 — (водн.) —>Ключевым моментом здесь является признание того, что ион аммония может быть только кислотой, он не способен принимать протон (что сделало бы основание).
Это вынуждает дигидрофосфат играть основную роль, то есть принимать протон. Кстати, помогает то, что текст вопроса намекает, что эту реакцию следует рассматривать как кислотно-щелочную реакцию.
чистая ионная:
NH 4 + (AQ) + H 2 PO 4 — (AQ) —> NH 3 (G) + H 3 PO 4 (G) + H 3 PO 4 (AQ) + H 3 PO 4 .Другой вариант:
NH 4 + (AQ) + H 2 PO 4 — (AQ) —> NH 4 H 2 PO 4 (S)309 2 PO 4 (S)
Оказывается, дигидрофосфат аммония вполне растворим, но, видимо, выпадает в осадок, когда раствор очень кислый. Однако используется другая реакция, а не та, что описана непосредственно выше. Глянь сюда:
дигидрофосфат аммония
Бонусное задание: Напишите молекулярное, полное ионное и суммарное ионное уравнения реакции между гидросульфитом натрия и бромистоводородной кислотой.

 04.22
04.22
 ) + 3KCl(водн.) —> AlCl 3 (водн.) + 3KNO 3 (водный)
) + 3KCl(водн.) —> AlCl 3 (водн.) + 3KNO 3 (водный)
 Однако большинство карбонатов тяжелых металлов выпадают в осадок, поэтому вполне разумно предположить, что V 2 (CO 3 ) 5 не растворяется.
Однако большинство карбонатов тяжелых металлов выпадают в осадок, поэтому вполне разумно предположить, что V 2 (CO 3 ) 5 не растворяется.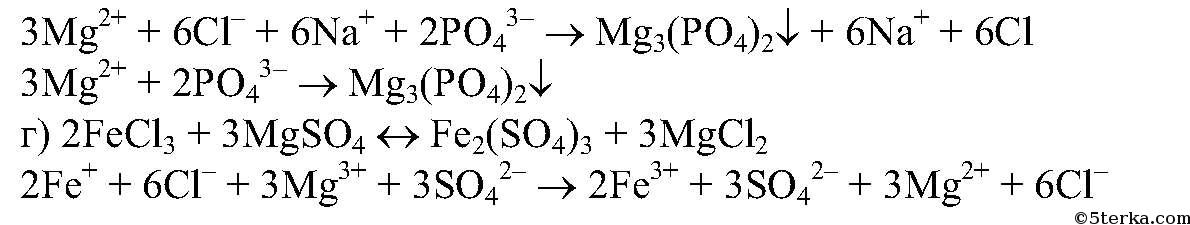 ) + 3Li + (водн.)
) + 3Li + (водн.) Два момента: (1) обычно нерастворимые вещества появляются на стороне продукта, реже на стороне реагента и (2) ваш учитель может потребовать, чтобы вместо (s) использовалась (aq).
Два момента: (1) обычно нерастворимые вещества появляются на стороне продукта, реже на стороне реагента и (2) ваш учитель может потребовать, чтобы вместо (s) использовалась (aq).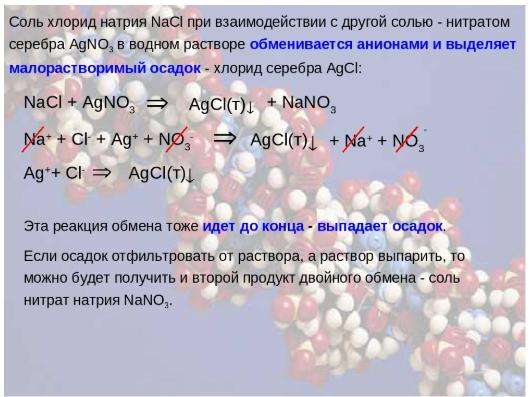
 ) —> BaSO 4 (тв) + H 2 O
) —> BaSO 4 (тв) + H 2 O ) —> H 2 O(л) + CO 2 (г)
) —> H 2 O(л) + CO 2 (г) Напишите полное молекулярное, полное ионное и суммарное ионное уравнения этой реакции.
Напишите полное молекулярное, полное ионное и суммарное ионное уравнения этой реакции. ) + 2Na + (водн.) + 2OH — (водн.) ) + CO 3 2- (водн.) + 2NH 3 (г) + 2Н 2 О(л)
) + 2Na + (водн.) + 2OH — (водн.) ) + CO 3 2- (водн.) + 2NH 3 (г) + 2Н 2 О(л)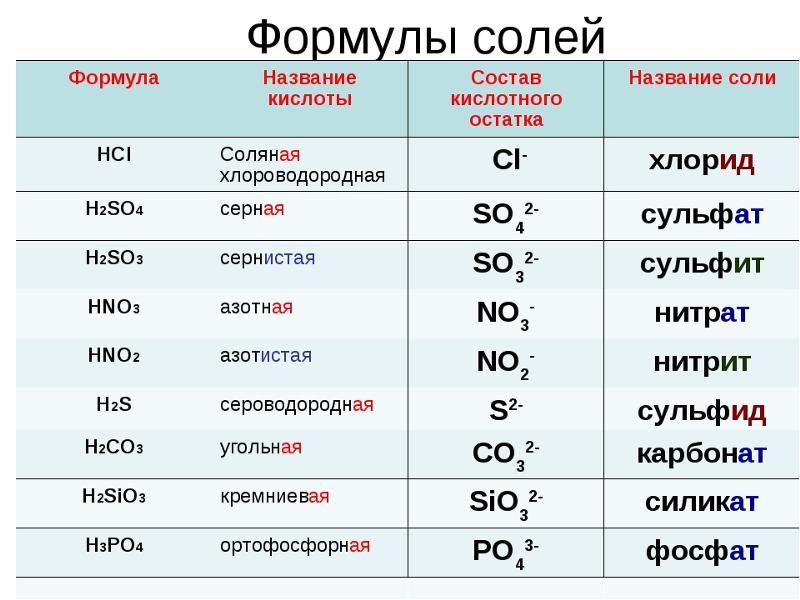 ) + Ba 2+ (водн.) + 2OH — (водн.) 5 (60 5 3 CO 3 9005) —> Ba с) + 2H 2 O(л) + 2NH 3 (г)
) + Ba 2+ (водн.) + 2OH — (водн.) 5 (60 5 3 CO 3 9005) —> Ba с) + 2H 2 O(л) + 2NH 3 (г)
 Фосфат стронция выпадает в осадок, поэтому не образуются ионы. Гидроксид стронция ионизируется, но на другой стороне нет ионов, которые можно было бы компенсировать.
Фосфат стронция выпадает в осадок, поэтому не образуются ионы. Гидроксид стронция ионизируется, но на другой стороне нет ионов, которые можно было бы компенсировать. В приведенной выше задаче базы нет.
В приведенной выше задаче базы нет. ) + 3CaCl 2 (водн.) —> 6NH 4 Cl(водн.) + Ca 5 9 0 9 0 9 0 055 6 0 9 0 55 3 PO 90 055 3 2 (с)
) + 3CaCl 2 (водн.) —> 6NH 4 Cl(водн.) + Ca 5 9 0 9 0 9 0 055 6 0 9 0 55 3 PO 90 055 3 2 (с) ) + CoCl 2 (водн.)
) + CoCl 2 (водн.)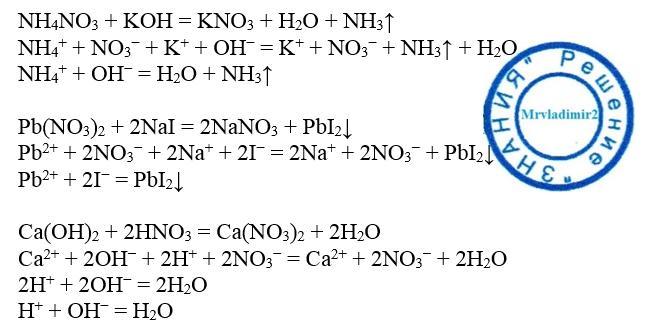 ) + Mg(ClO 3 ) 2 (водн.) —>
) + Mg(ClO 3 ) 2 (водн.) —> ) + BaSO 4 (водн.) —> Ba(CH 3 COO) 2 (водн.) + K 2 SO 4 900
) + BaSO 4 (водн.) —> Ba(CH 3 COO) 2 (водн.) + K 2 SO 4 900 Это одна из вещей, которую узнаешь, изучая вопросы того, что разрешимо, а что нет и какие существуют исключения из правил.
Это одна из вещей, которую узнаешь, изучая вопросы того, что разрешимо, а что нет и какие существуют исключения из правил. Это вынуждает дигидрофосфат играть основную роль, то есть принимать протон. Кстати, помогает то, что текст вопроса намекает, что эту реакцию следует рассматривать как кислотно-щелочную реакцию.
Это вынуждает дигидрофосфат играть основную роль, то есть принимать протон. Кстати, помогает то, что текст вопроса намекает, что эту реакцию следует рассматривать как кислотно-щелочную реакцию.
Leave A Comment