Строение атома — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице.
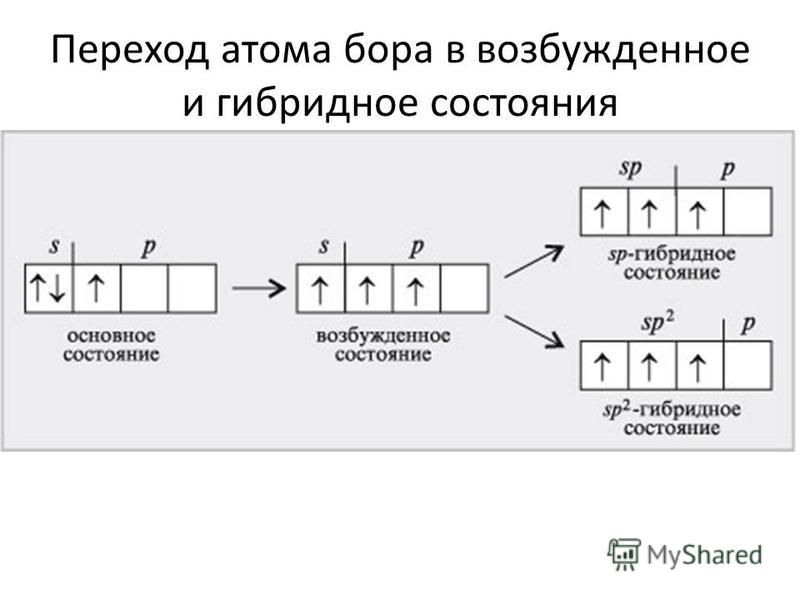
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона.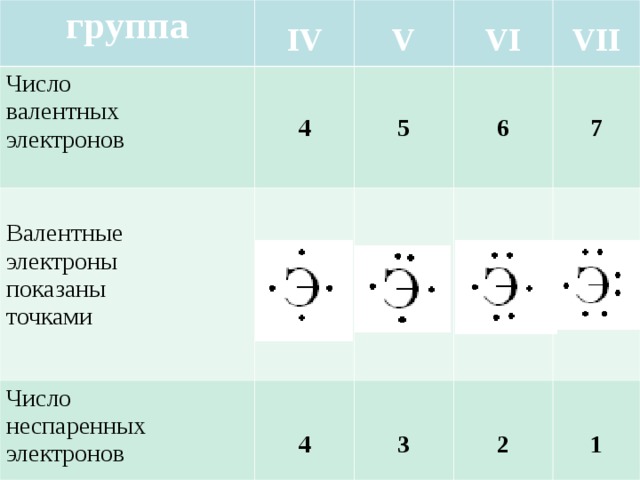 Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий.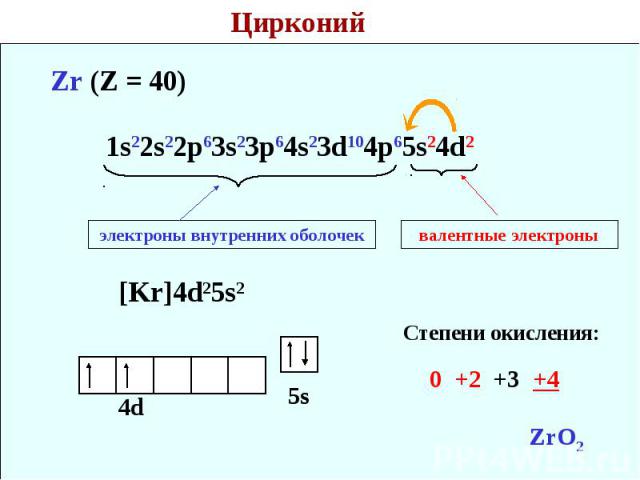
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
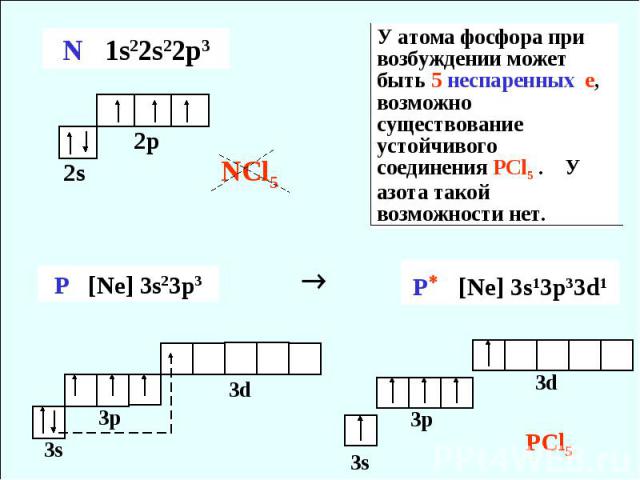
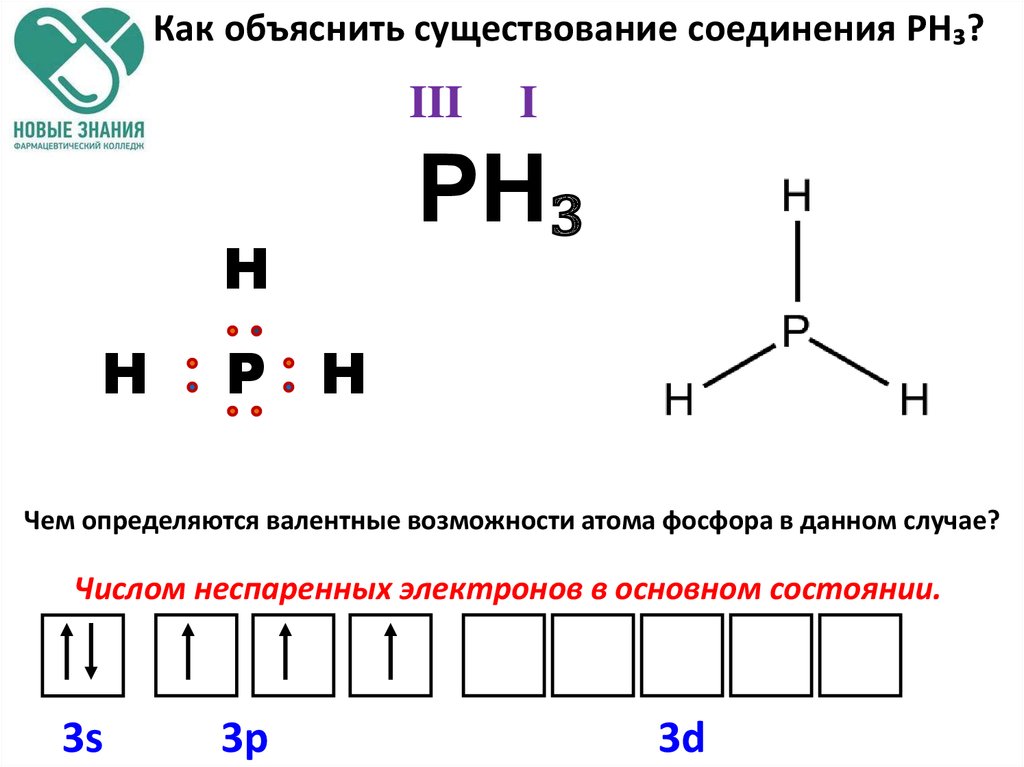
— фосфор – пятнадцатый элемент, находится в главной подгруппе.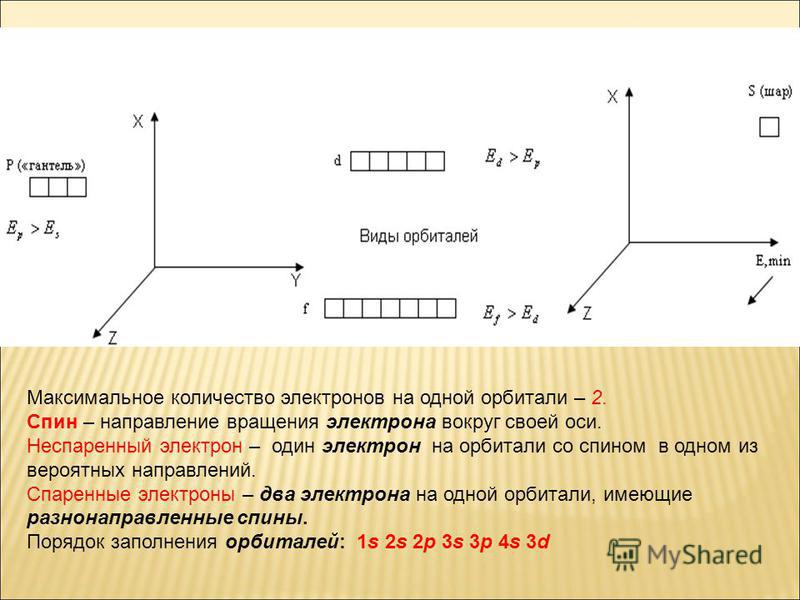 Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.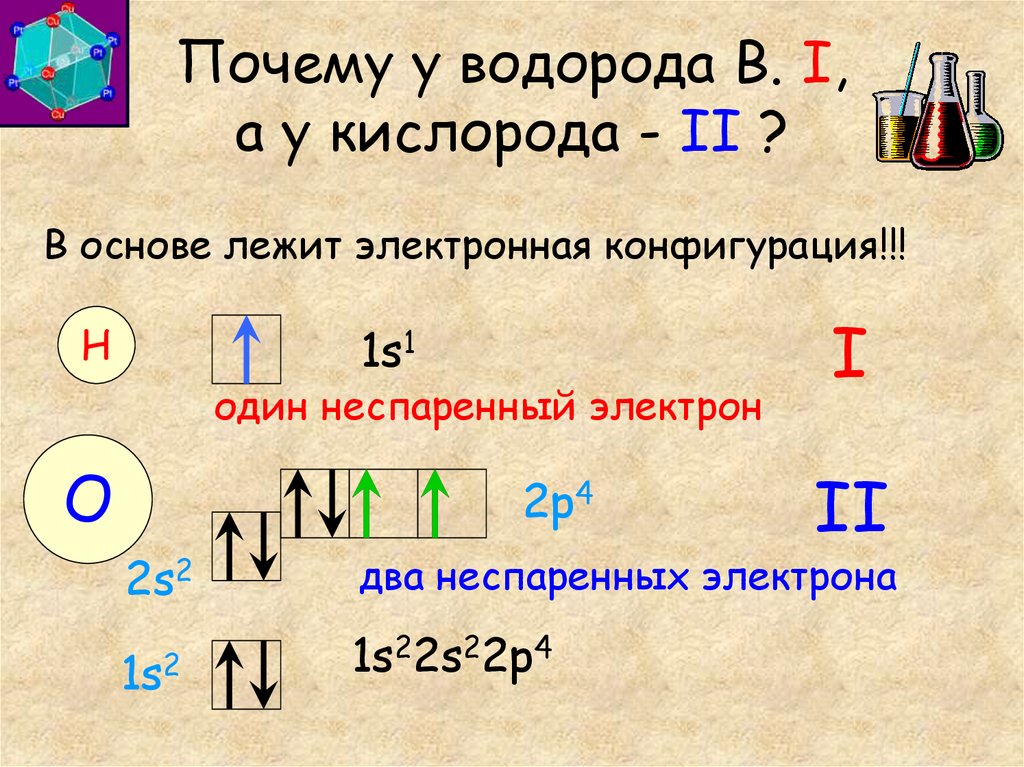
В атоме циркония в основном состоянии 2 неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
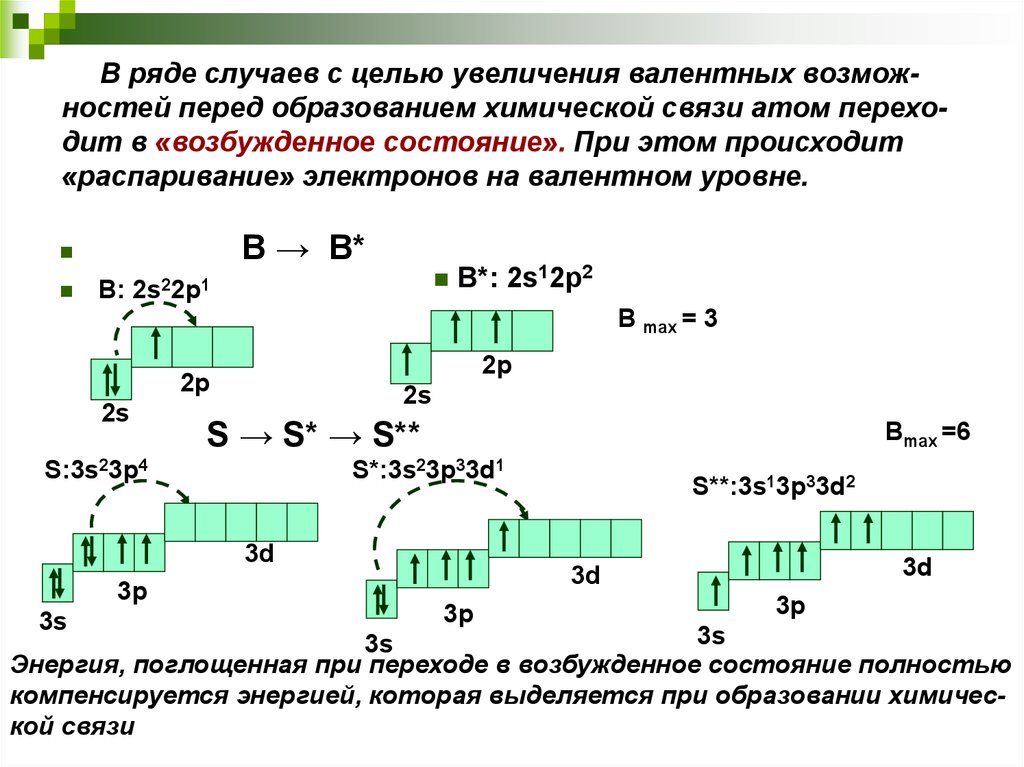
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39 - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях.
 Какие валентности способен проявлять хлор?
Какие валентности способен проявлять хлор? - Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Благодарим за то, что пользуйтесь нашими статьями. Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам. Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий. Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена: 08.03.2023
Примеры тестовых заданий к приложению1
1. Число нейтронов в ядре атома 39Ca равно
1.19 2.20 3.39 4.40
2.Ядро изотопа фосфора 31 Р содержит
1.15 2.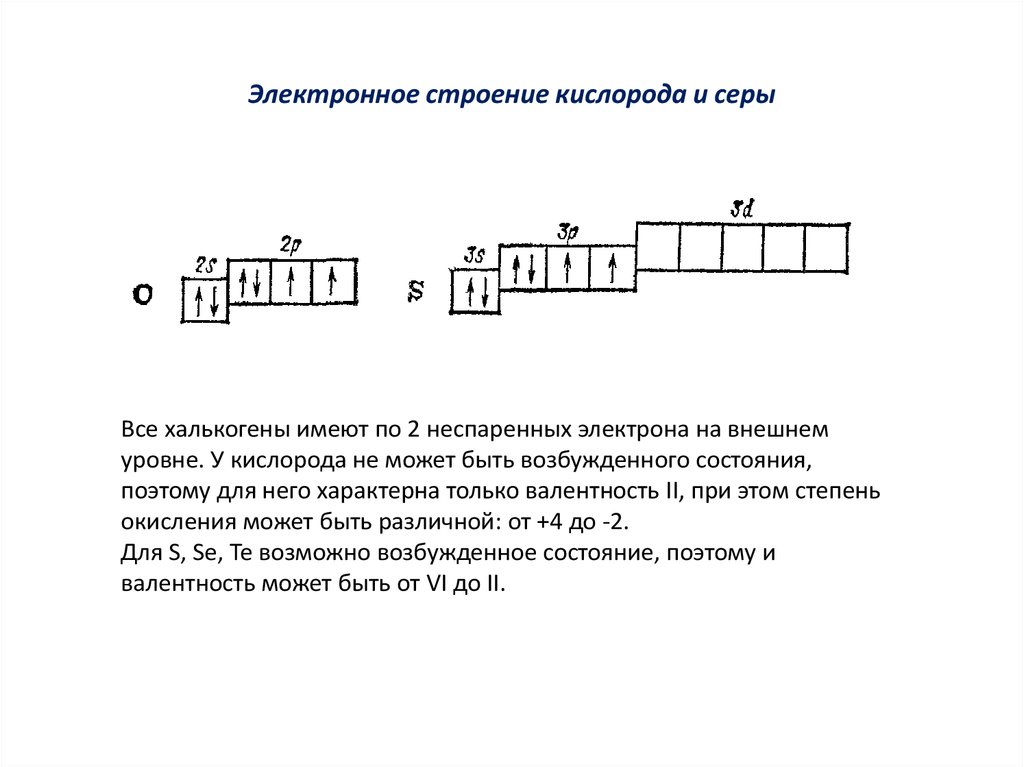 46 3.16 4.31
46 3.16 4.31
3. Электронная конфигурация 1s22s22p63s23p6соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4.Иону О2- соответствует электронная конфигурация…
1. 1s22s22p3 2. 1s22s22p4 3. 1s22s22p5 4. 1s22s22p6
5. Изотопы одного и того же элемента отличаются друг от друга
1) числом нейтронов и атомной массой 3) числом протонов и числом электронов
2) числом электронов и числом нейтронов 4) зарядом ядра и числом протонов
6.Орбитальное квантовое число может принимать значения…
1.1,2,3,…,∞ 2. 0,…,(n-1) 3. -l,0,+l 4. ±1/2
7. Химический элемент, формула высшего оксида которого R2O7, имеет электронную конфигурацию атома
1) 1s2 2s22р63s1 2) 1s22s22р63s23р5 3) 1s2 2s22р63s23р64s1 4) 1s2 2s1
8. Формула водородного
соединения элемента, образующего высший
оксид Э2О5, имеет вид…
Формула водородного
соединения элемента, образующего высший
оксид Э2О5, имеет вид…
1.ЭН 2.ЭН2 3. ЭН3 4. ЭН4
9.На внешнем энергетическом уровне атома элемента, образующего высший гидроксид состава НЭО4 содержится ____ электронов
1. 4 2. 5 3. 6 4. 7
10.В основном состоянии неспаренные электроны отсутствуют у атома
1. кремния 2.алюминия 3.магния 4.фосфора
11.Атом углерода в основном состоянии содержит__ неспаренных электронов
1. 2 2. 3. 3. 4 4. 0
12. наибольшее число неспаренных электронов в основном состоянии содержит атом…
1.хлора 2.фосфора 3.кремния 4.кислорода
13.Магнитное квантовое число может принимать значения…
1.1,2,3,…,∞ 2. 0,…,(n-1) 3. —ℓ,…0,…,ℓ 4. ±1/2
14. Неспаренные электроны в основном состоянии содержит частица…
1.Zn2+ 2.Ni2+ 3.Ca2+ 4.Ba2+
15. Число неспаренных электронов в атоме алюминия в основном состоянии равно
1)1 2)2 3)3 4)0
16. Сульфид-иону соответствует электронная
формула
Сульфид-иону соответствует электронная
формула
1) 1s2 2s22р63s23р6 3) 1s2 2s22р6
2)1s22s22р63s23р4 4)1s2 2s2 2р63s23р2
17. Электронная конфигурация 1s22s22р63s23р6 соответствует иону ‘
1)Sc2+ 2) Al3+ 3)Cr3+ 4) Ca2+
18. На 4s-энергетическом подуровне расположены все валентные электроны атома
1) железа 2) кальция 3) углерода 4) серы
19. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня
1) 3s23р4 2)2s22р2 3)2s22р4 4) 2s22р6
20. Электронную формулу 1s22s22р63s23р64s2 имеет атом элемента
Электронную формулу 1s22s22р63s23р64s2 имеет атом элемента
1) Ba 2) Mg 3) Са 4) Sr
Ответы к тестовым заданиям к приложению1: 1.1; 2.3;3.2;4.4;5.1;6.2;7.2; 8.3; 9.4; 10.3; 11.1; 12.2; 13.3; 14.2; 15.1; 16.1; 17.4; 18.2; 19.2;20.3
Ковалентная связь – связь, образованная за счет общей электронной пары.
Важнейшие
характеристики химической связи: длина,
энергия, полярность и поляризуемость. Энергия
связи – это энергия, выделяющаяся при
образовании связи или необходимая для
разъединения двух связанных атомов. Длина
связи – это
расстояние между центрами связанных
атомов Полярность
связи обусловлена
неравномерным распределением
(поляризацией) электронной плотности.
Полярность молекулы количественно
оценивают величиной ее дипольного
момента.
Полярность
связи можно показать стрелкой, указывающей
направление смещения электронной пары:
Н+ → F.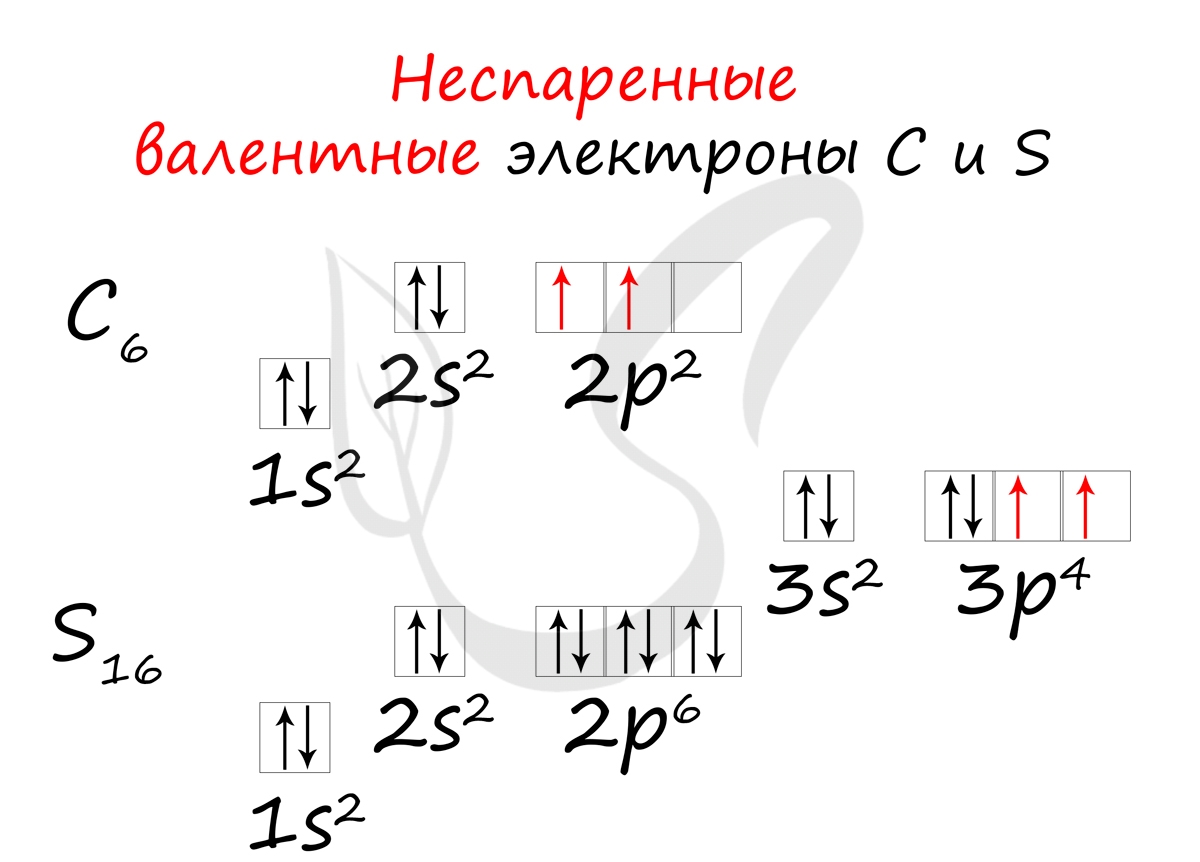 Таким образом, двухатомная молекула HF
обладает электрическим дипольным
моментом, который обусловлен
пространственным разделением
положительного и отрицательного зарядов.
Чем больше дипольный момент, тем полярнее
связь. Причиной полярности связи служит
различие в электроотрицательностях
связанных атомов. Электроотрицательность
– мера способности атома смещать к себе
электронную плотность химической связи. С увеличением электроотрицательности
атома возрастает степень смещения в
его сторону электронов связи.
Шкала
электроотрицательности по Полингу
Таким образом, двухатомная молекула HF
обладает электрическим дипольным
моментом, который обусловлен
пространственным разделением
положительного и отрицательного зарядов.
Чем больше дипольный момент, тем полярнее
связь. Причиной полярности связи служит
различие в электроотрицательностях
связанных атомов. Электроотрицательность
– мера способности атома смещать к себе
электронную плотность химической связи. С увеличением электроотрицательности
атома возрастает степень смещения в
его сторону электронов связи.
Шкала
электроотрицательности по Полингу
Элемент | K | Na | H | P | C | S | I | Br | Cl | N | O | F |
О. | 0,8 | 0,9 | 2,1 | 2,1 | 2,5 | 2,5 | 2,5 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
∆э.о.=0 – ковалентная неполярная связь
∆э.о.≤ 0,4 – малополярная ковалентная связь
∆э.о.>0,5 – сильно полярная ковалентная связь
∆э.о.> 2,0 – ионная связь
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость π-связи выше, т.к. π-электроны находятся дальше от ядра и более подвижны.
Классификация ковалентной связи по типу перекрывания электронных облаков
Поскольку
электронные облака имеют различную
форму, их взаимное перекрывание может
осуществляться разными способами. В
зависимости от способа перекрывания
различают
и -связи.
В
зависимости от способа перекрывания
различают
и -связи.
-связь осуществляется при лобовом перекрывании орбиталей вдоль линии, соединяющей центры атомов. Все одинарные связи являются -связями.
-связь возникает при боковом перекрывании р-орбиталей по обе стороны от линии соединения ядер атомов.
Например, возникновение π-связи в молекуле этилена СН2=СН2:
Или, например, в молекуле азота одна -связь и две -связи.
Электроны s-орбиталей могут участвовать лишь в -связывании, а р-электроны – как в -, так и в -связывании.
-связи
являются энергетически самыми выгодными
связями, т.к. имеет место глубокое
перекрывание облаков. Если между двумя
атомами возникает единственная связь,
то непременно -связь.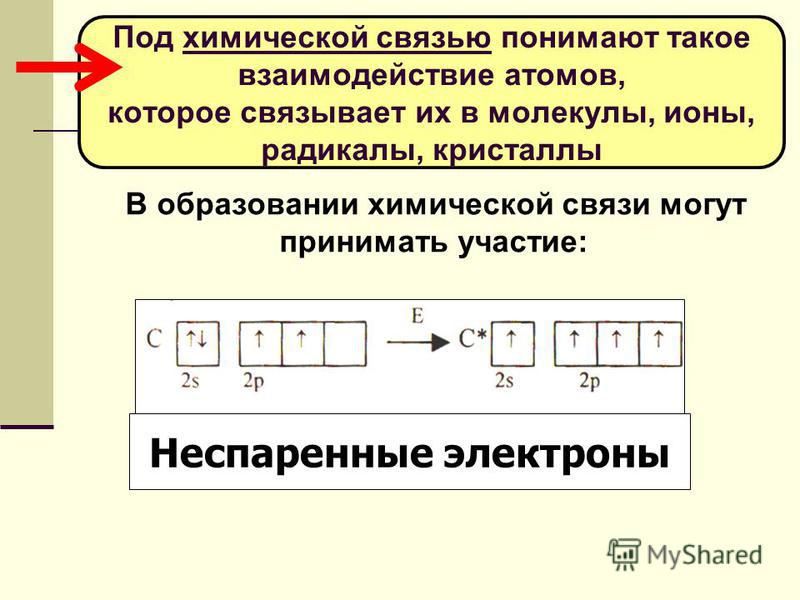
-связи возникают в том случае, если между двумя атомами образуются кратные связи (двойные или тройные). Например, в молекуле СО2 атом углерода образует с каждым атомом кислорода одну -связь и одну -связь:
2.2: Электронные конфигурации — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36079
Цели обучения
- Понять основы добавления электронов к атомным орбиталям
- Чтобы понять основы принципа Ауфбау
Электронная конфигурация элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химии.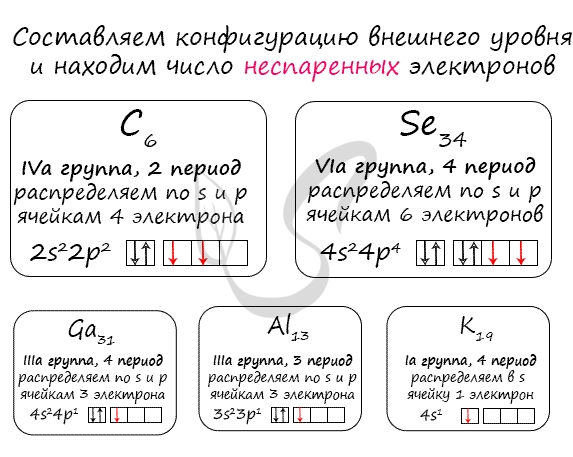
Принцип Ауфбау
Мы строим периодическую таблицу, следуя принципу Ауфбау (от немецкого, что означает «наращивание»). Сначала мы определяем число электронов в атоме; затем мы добавляем электроны по одному на самую низкоэнергетическую доступную орбиталь без нарушения принципа Паули . Мы используем диаграмму орбитальной энергии на рис. 2.1.1, признавая, что каждая орбиталь может содержать два электрона, один со спином вверх ↑, что соответствует м с = +½, что произвольно записывается первым, и один со спином вращение вниз ↓, соответствующее м с = −½. Заполненная орбиталь обозначена ↑↓, в которой спины электронов считаются спаренными . Вот схематическая орбитальная диаграмма атома водорода в его основном состоянии:
Некоторые авторы изображают орбитальную диаграмму горизонтально (удаляя неявную ось энергии и символ двоеточия):
Если нет причин показывать пустые орбитали с более высокой энергией, они часто опускаются на орбитальной диаграмме:
рис. 2.1.1), а электронная конфигурация записывается как 1 с 1 и читается как «один к одному».
2.1.1), а электронная конфигурация записывается как 1 с 1 и читается как «один к одному».Нейтральный атом гелия с атомным номером 2 ( Z = 2) имеет два электрона. Мы помещаем один электрон на орбиталь с наименьшей энергией, 1 с орбитальная. Из принципа запрета Паули мы знаем, что на одной орбитали могут находиться два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спариваются. Таким образом, орбитальная диаграмма атома гелия имеет вид
, записанный как 1 с 2 , где верхний индекс 2 означает спаривание спинов. В противном случае наша конфигурация нарушила бы принцип Паули.
Следующий элемент — литий с Z = 3 и три электрона в нейтральном атоме. Мы знаем, что орбиталь 1 s может удерживать два электрона со спаренными спинами. На рис. 2.1.1 показано, что следующей орбиталью с наименьшей энергией является 2 s , поэтому орбитальная диаграмма для лития имеет вид
. Эта электронная конфигурация записывается как 1 s 2 2 s 1 .
Эта электронная конфигурация записывается как 1 s 2 2 s 1 .
Следующий элемент — бериллий с Z = 4 и четырьмя электронами. Мы заполняем оба 1 s и 2 s орбиталей для получения 1 s 2 2 s 2 электронной конфигурации: пятый электрон на одной из 2 p орбиталей. Поскольку все три 2 p орбиталей вырождены, не имеет значения, какую из них мы выберем. Электронная конфигурация бора: 1 с 2 2 с 2 2 p 1 :
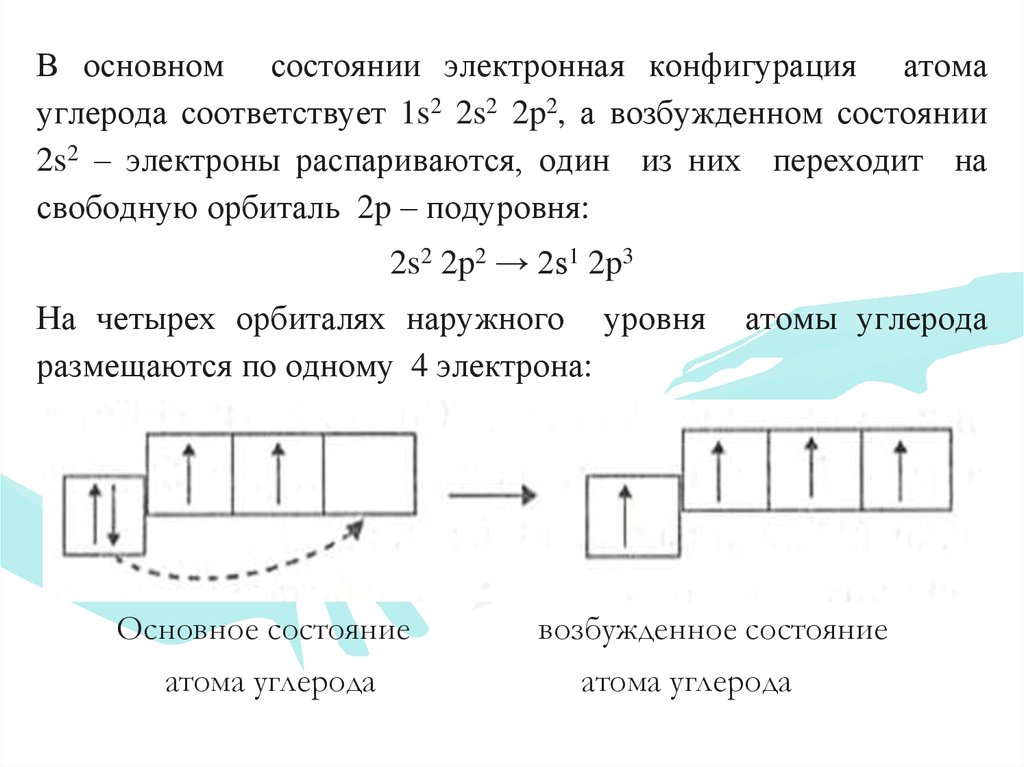
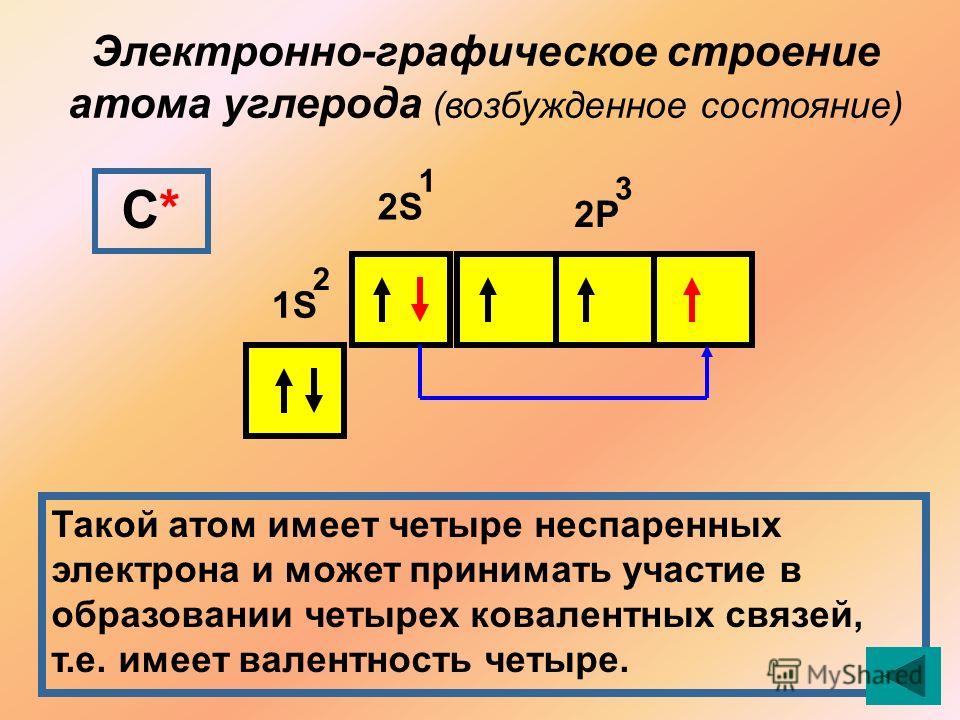
У углерода с Z = 6 и шестью электронами мы стоим перед выбором. Должен ли шестой электрон находиться на той же орбитали 2 p , на которой уже есть электрон, или он должен отправиться на одну из пустых орбиталей 2 p ? Если он попадет на пустую орбиту 2 p , будет ли спин шестого электрона совмещен со спином пятого электрона или противоположен ему?
Какая из следующих трех орбитальных диаграмм верна для углерода, учитывая, что 2 p орбитали вырождены?
Из-за электрон-электронных отталкиваний электрону энергетически выгоднее находиться на незанятой орбитали, чем на уже занятой; следовательно, мы можем исключить вариант a.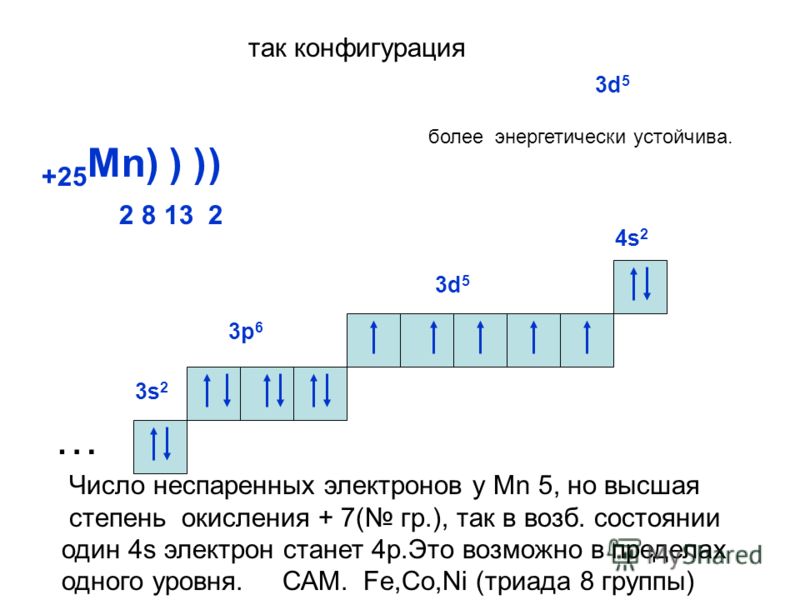 Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда (названное в честь немецкого физика Фридриха Х. Хунда, 189 г.).6–1997), в котором сегодня говорится, что самая низкоэнергетическая электронная конфигурация для атома — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. Согласно правилу Хунда, электронная конфигурация углерода 1 s 2 2 s 2 2 p 2 соответствует орбитальной диаграмме, показанной на c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда (названное в честь немецкого физика Фридриха Х. Хунда, 189 г.).6–1997), в котором сегодня говорится, что самая низкоэнергетическая электронная конфигурация для атома — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. Согласно правилу Хунда, электронная конфигурация углерода 1 s 2 2 s 2 2 p 2 соответствует орбитальной диаграмме, показанной на c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Упражнение 2.2.1
Изобразите орбитальную диаграмму азота, Z = 7. Какова электронная конфигурация этого атома?
- Ответить
Когда мы добираемся до азота ( Z = 7, с семью электронами), правило Хунда говорит нам, что расположение с наименьшей энергией равно
.
с тремя неспаренными электронами. Таким образом, электронная конфигурация азота 1 с 2 2 с 2 2 р 3 .
В кислороде с Z = 8 и восемью электронами у нас нет выбора. Один электрон должен быть спарен с другим на одной из 2 p орбиталей, что дает нам два неспаренных электрона и электронную конфигурацию Поскольку все 2 p орбиталей вырождены, не имеет значения, на какой из них находится пара электронов.
Аналогично, фтор имеет конфигурацию электрона 1 S 2 2 S 2 2 P 5 , а Orbital Diagram —
,
. = 10, мы заполнили подоболочку 2 p , дав 1 s 2 2 s 2 2 p 2 2 p 6 электронной схемы: неон, как и гелий, все орбитали через 2 p уровень полностью заполнены. Как вы увидите, этот факт очень важен для определения как химической активности, так и связи гелия и неона.
Как вы увидите, этот факт очень важен для определения как химической активности, так и связи гелия и неона.
Электроны ядра и валентности
По мере того, как мы продолжаем изучать периодическую таблицу таким образом, записывая электронные конфигурации все более и более крупных атомов, становится утомительно копировать конфигурации заполненных внутренних подоболочек. На практике химики упрощают обозначения, используя символ благородного газа в квадратных скобках для представления конфигурации благородного газа из предыдущей строки, потому что все орбитали в благородном газе заполнены. Например, [Ne] представляет 1 s 2 2 s 2 2 p 6 электронная конфигурация неона ( Z = 10), поэтому электронная конфигурация натрия равна 6 1 190 Z Z 9 s 2 2 s 2 2 p 6 3 s 1 , is written as [Ne] 3 s 1
| Полная электронная конфигурация | Сокращенная запись Nobel Gas | ||
| Неон | Z = 10 | Ne: 1 с 2 2 с 2 2 p 6 | Ne: [He] 2 s 2 2 p 6 |
| Натрий | Z = 11 | Нет: 1 с 2 2 с 2 2 р 6 3 с 1 | Na: [Ne] 3 с 1 |
Электроны на заполненных внутренних орбиталях находятся ближе к ядру и прочнее связаны с ним, поэтому редко участвуют в химических реакциях. Мы будем называть эти остовные электроны. Для репрезентативных элементов (столбцы 1, 2 и 13-18 Периодической таблицы) остовными электронами являются все электроны со значением n ниже максимального значения n в электронной конфигурации. Например, в атоме натрия наибольшее значение n равно 3. Таким образом, остовные электроны находятся на атомных орбиталях с n < 3, а именно на 1s-, 2s- и 2p-орбиталях. Итак, натрий имеет 10 остовных электронов. Позже мы вернемся к этому определению остовных электронов для переходных металлов.
Мы будем называть эти остовные электроны. Для репрезентативных элементов (столбцы 1, 2 и 13-18 Периодической таблицы) остовными электронами являются все электроны со значением n ниже максимального значения n в электронной конфигурации. Например, в атоме натрия наибольшее значение n равно 3. Таким образом, остовные электроны находятся на атомных орбиталях с n < 3, а именно на 1s-, 2s- и 2p-орбиталях. Итак, натрий имеет 10 остовных электронов. Позже мы вернемся к этому определению остовных электронов для переходных металлов.
Это означает, что химический состав атома в основном зависит от электронов в его самой внешней оболочке, имеющих наибольшее значение n, которые называются валентными электронами. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя это обозначение для сравнения электронных конфигураций натрия и лития, мы имеем:
| Натрий | 1 с 2 2 с 2 2 стр 6 3 с 1 | [Не] 3 с 1 |
| Литий | 1 с 2 2 с 1 | [Не] 2 с 1 |
Очевидно, что и натрий, и литий имеют по одному s электрону на валентной оболочке.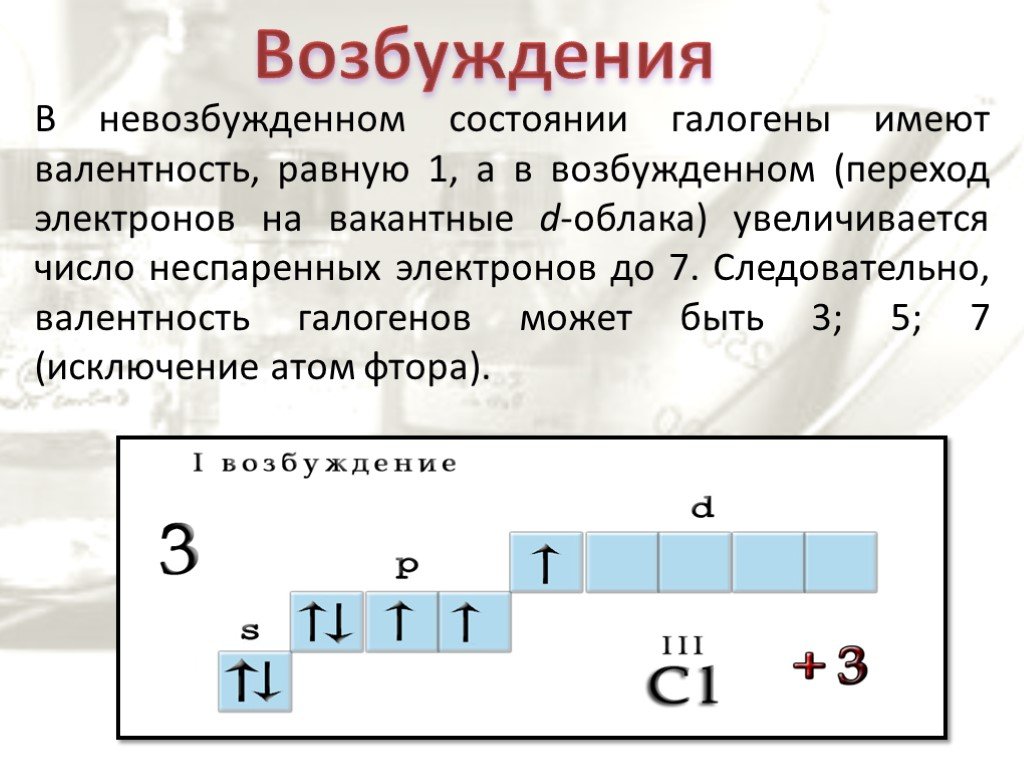 Таким образом, можно предположить, что натрий и литий имеют очень похожий химический состав, и это действительно так.
Таким образом, можно предположить, что натрий и литий имеют очень похожий химический состав, и это действительно так.
По мере того, как мы продолжаем строить восемь элементов периода 3, орбитали 3 s и 3 p заполняются по одному электрону за раз. Этот ряд завершает благородный газ аргон, имеющий электронную конфигурацию [Ne] 3 s 2 3 p 6 , соответствующую заполненной валентной оболочке.
Пример 2.2.2
Нарисуйте орбитальную диаграмму и используйте ее для получения электронной конфигурации фосфора, Z = 15. Какова его конфигурация валентных электронов?
Дано: атомный номер
Запрошено: орбитальная диаграмма и конфигурация валентных электронов для фосфора
Стратегия:
- Найдите ближайший инертный газ, предшествующий фосфору в периодической таблице. Затем вычтите количество его электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.

- Ссылаясь на рисунок 2.1.1, нарисуйте орбитальную диаграмму для представления этих валентных орбиталей. Следуя правилу Хунда, поместите валентные электроны на доступные орбитали, начиная с орбитали с наименьшей энергией. Запишите конфигурацию электрона из вашей орбитальной диаграммы.
- Не обращайте внимания на внутренние орбитали (те, которые соответствуют электронной конфигурации ближайшего инертного газа) и запишите конфигурацию валентных электронов для фосфора.
Решение:
A Поскольку фосфор находится в третьей строке периодической таблицы, мы знаем, что он имеет закрытую оболочку [Ne] с 10 электронами. Начнем с вычитания 10 электронов из 15 в фосфоре.
B Дополнительные пять электронов размещены на следующих доступных орбиталях, которые, как показывает рисунок 2.1.1, являются 3 s и 3 p орбитали:
Поскольку орбиталь 3 s имеет меньшую энергию, чем орбиталь 3 p , мы заполняем ее первой:
Правило Хунда говорит нам, что оставшиеся три электрона займут вырожденные 3 p орбиталей по отдельности, но с выровненными спинами:
Электронная конфигурация [Ne] 3 s 2 3 p 3 .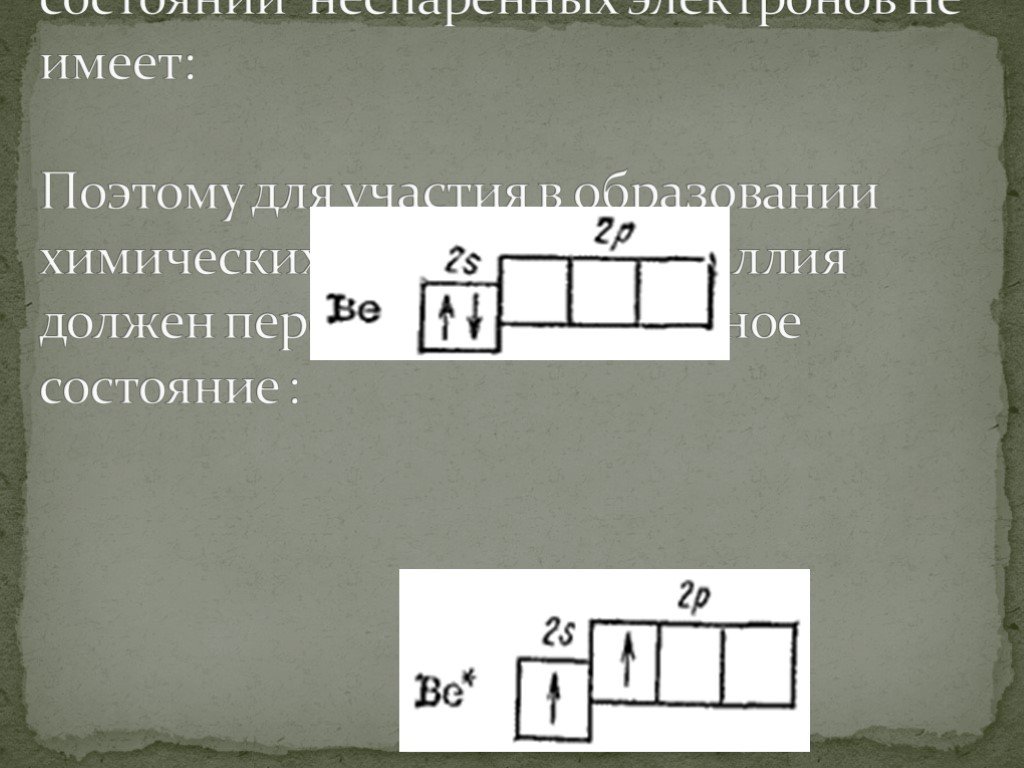
C Мы получаем конфигурацию валентного электрона, игнорируя внутренние орбитали, что для фосфора означает, что мы игнорируем замкнутую оболочку [Ne]. Это дает конфигурацию валентных электронов 3 с 2 3 р 3 .
Упражнение 2.2.2
Нарисуйте орбитальную диаграмму и используйте ее для получения электронной конфигурации хлора, Z = 17. Какова его конфигурация валентных электронов?
- Ответ:
- [Ne] 3 s 2 3 p 5
Валентная электронная конфигурация: 3 s 2 3 9
Общий порядок заполнения орбиталей показан на рис. 2.2.1. Подоболочки, соответствующие каждому значению n , записываются слева направо на последовательных горизонтальных линиях, где каждая строка представляет строку в периодической таблице. Порядок заполнения орбиталей обозначен диагональными линиями, идущими от верхнего правого угла к нижнему левому. Соответственно, орбиталь 4 s заполняется до орбитали 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которого начинается четвертый период, такова: [Ar] 4 s 1 , а конфигурация кальция [Ar] 4 s 2 . Пять орбиталей 3 d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последним членом этого ряда является благородный газ криптон ( Z = 36), Kr: [Ar] 4 s 2 3 d 10 4 p 4 6, заполнены 4 s , 3 d и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.
Соответственно, орбиталь 4 s заполняется до орбитали 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которого начинается четвертый период, такова: [Ar] 4 s 1 , а конфигурация кальция [Ar] 4 s 2 . Пять орбиталей 3 d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последним членом этого ряда является благородный газ криптон ( Z = 36), Kr: [Ar] 4 s 2 3 d 10 4 p 4 6, заполнены 4 s , 3 d и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.

Шестой ряд периодической таблицы будет отличаться от двух предыдущих, потому что 4 f орбиталей, которые могут содержать 14 электронов, заполнены между 6 s и 5 d орбиталями. Элементы, которые содержат 4 f орбиталей в своей валентной оболочке, являются лантаноидами. Когда 6 p орбиталей окончательно заполнены, мы достигли следующего (и последнего известного) благородного газа, радона ( Z = 86), Rn: [Xe] 6 s 2 4 f 14 5 d 10 6 p 6 . В последнем ряду 5 f орбиталей заполнены между 7 s и 6 d орбиталями, что дает 14 актинидных элементов. Поскольку большое количество протонов делает их ядра нестабильными, все актиноиды радиоактивны.
Пример 2.2.3
Напишите электронную конфигурацию ртути ( Z = 80), указав все внутренние орбитали.
Дано: атомный номер
Запрошено: полная электронная конфигурация
Стратегия:
Используя орбитальную диаграмму на рис. был размещен.
был размещен.
Решение:
Поместив электроны на орбитали в порядке, показанном на рис. 2.2.1, и используя периодическую таблицу в качестве ориентира, мы получим
| 1 с 2 | ряд 1 | 2 электрона |
| 2 с 2 2 р 6 | ряд 2 | 8 электронов |
| 3 с 2 3 р 6 | ряд 3 | 8 электронов |
| 4 с 2 3 д 10 4 р 6 | ряд 4 | 18 электронов |
| 5 s 2 4 d 10 5 p 6 | ряд 5 | 18 электронов |
| ряд 1–5 | 54 электрона |
После заполнения первых пяти рядов у нас остается еще 80 − 54 = 26 электронов для размещения. Согласно рисунку 2.2.2 нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. The result is mercury’s electron configuration:
Согласно рисунку 2.2.2 нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. The result is mercury’s electron configuration:
Hg: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 д 10 4 р 6 5 с 2 4 д 4 3
600037 6 6 s 2 4 f 14 5 d 10Hg: [Xe] 6 s 2 4 f 14 5 d 10
с заполненным 5 D Подпроводите, A 6 S 2 4 F 14 5 D 10 СПАСИЖДЕНИЕ ВАНСИЯ Оболочка и общая электрон. (Вы всегда должны проверять, чтобы общее количество электронов равнялось атомному номеру.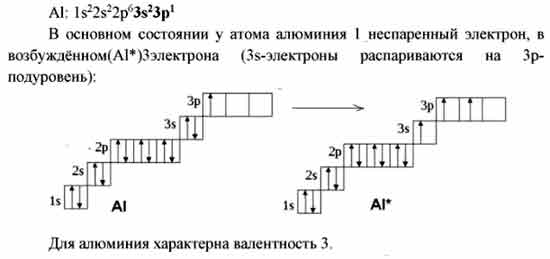 )
)
Упражнение 2.2.3
Хотя элемент 114 недостаточно стабилен, чтобы встречаться в природе, два изотопа элемента 114 впервые были получены в ядерном реакторе в 1999 году группой российских и американских ученых. Напишите полную электронную конфигурацию элемента 114.
- Ответ:
- 1 с 2 2 с 2 2 с 6 3 с 3 2 3 0063 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 2
Электронные конфигурации элементов представлены на рис.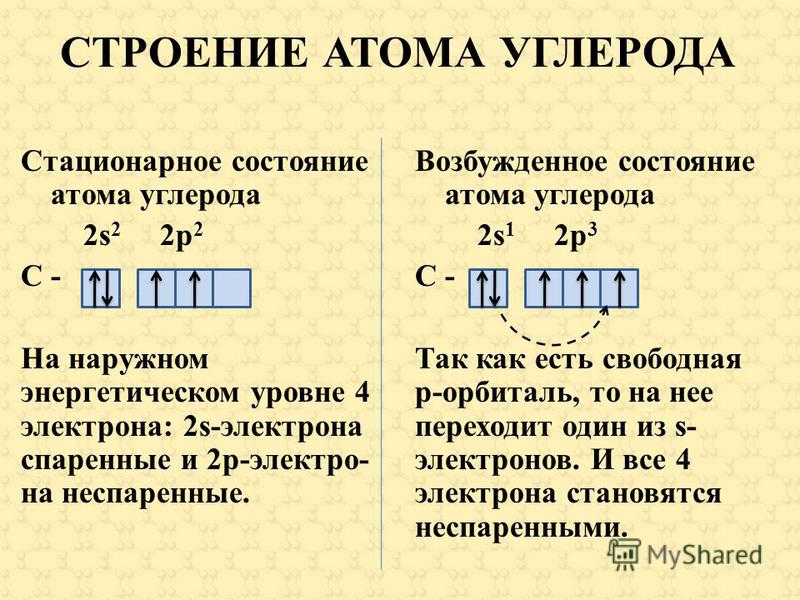 2.2.3, где орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от предсказанных на рис. 2.2.1. Некоторые из этих аномалий возникают как 3 d орбитали заполнены. Например, наблюдаемая электронная конфигурация основного состояния хрома [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 7 7 . Точно так же наблюдаемая электронная конфигурация меди [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9006. Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( ns 1 , np 3 , nd 5 , nf 7 ) or filled ( ns 2 , np 6 , nd 10 , нф 14 ) подоболочка.
2.2.3, где орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от предсказанных на рис. 2.2.1. Некоторые из этих аномалий возникают как 3 d орбитали заполнены. Например, наблюдаемая электронная конфигурация основного состояния хрома [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 7 7 . Точно так же наблюдаемая электронная конфигурация меди [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9006. Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( ns 1 , np 3 , nd 5 , nf 7 ) or filled ( ns 2 , np 6 , nd 10 , нф 14 ) подоболочка.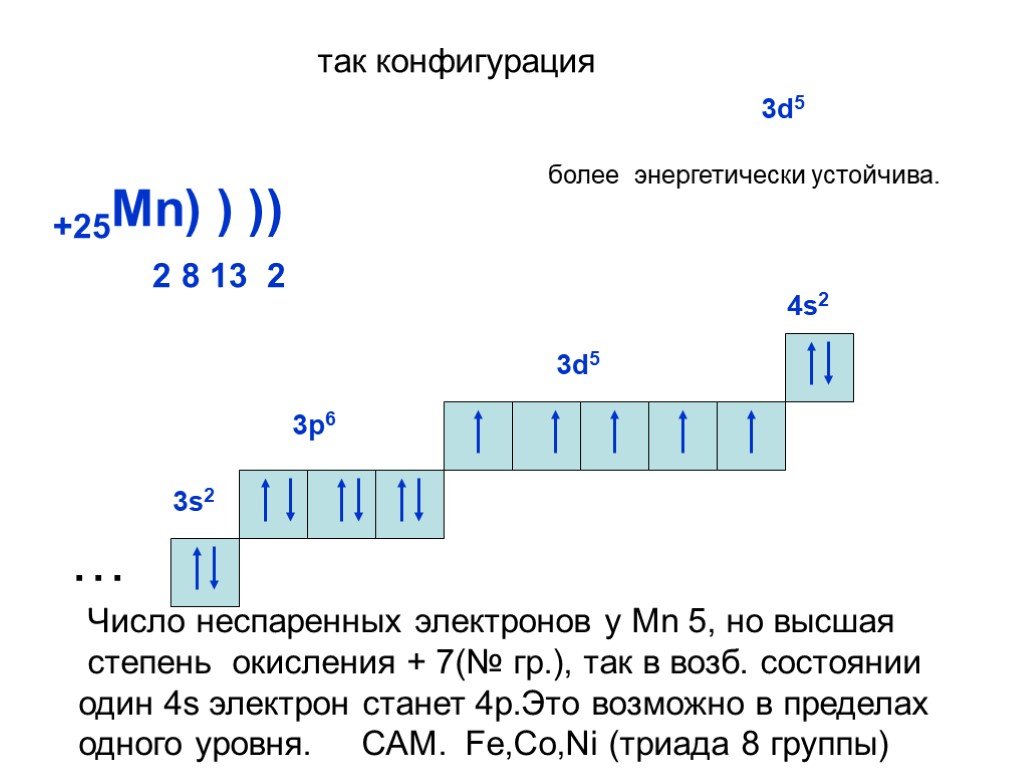 Учитывая небольшую разницу между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы переместить электрон с одной орбитали на другую. В более тяжелых элементах также могут быть важны другие более сложные эффекты, приводящие к некоторым из дополнительных аномалий, показанных на рис. 2.2.3. Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами. Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Учитывая небольшую разницу между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы переместить электрон с одной орбитали на другую. В более тяжелых элементах также могут быть важны другие более сложные эффекты, приводящие к некоторым из дополнительных аномалий, показанных на рис. 2.2.3. Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами. Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Примечание
Дополнительная стабильность связана с заполненными наполовину или заполненными подоболочками.
Резюме
Основываясь на принципе Паули и знании орбитальных энергий, полученных с использованием водородоподобных орбиталей, можно построить периодическую таблицу, заполнив доступные орбитали, начиная с орбиталей с самой низкой энергией ( принцип ауфбау ), что приводит к определенному расположению электронов для каждого элемента (его электронной конфигурации ).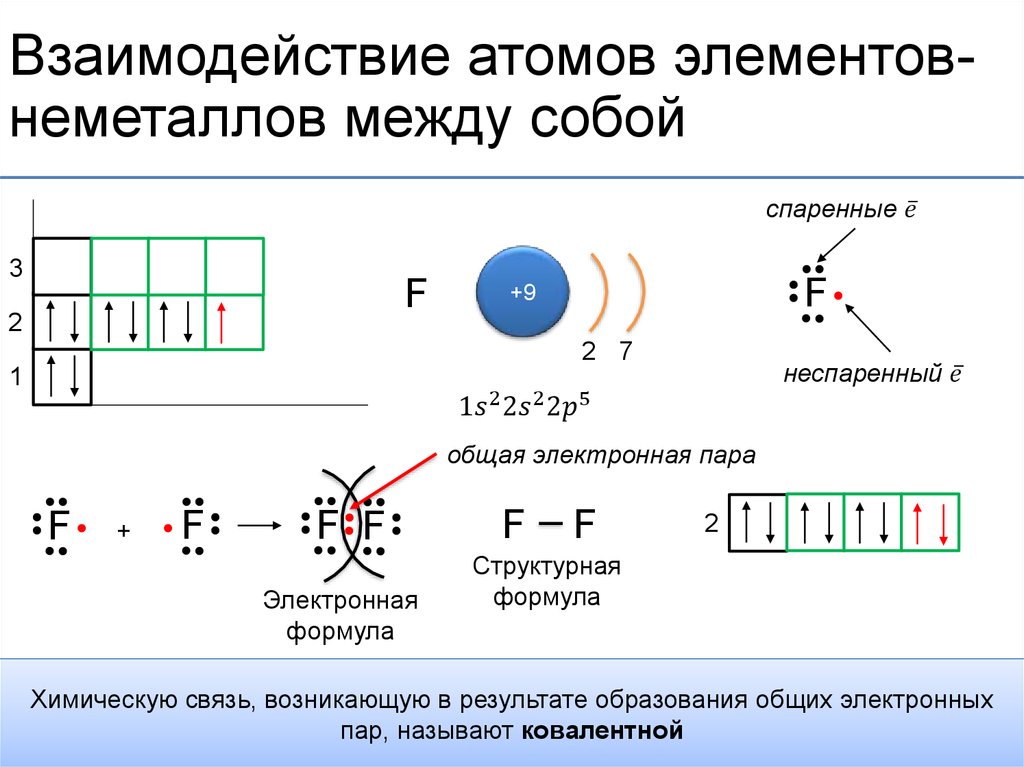 Правило Хунда гласит, что расположение электронов с наименьшей энергией — это то, которое помещает их на вырожденные орбитали с параллельными спинами. Для химических целей наиболее важными электронами являются те, которые находятся на самой внешней основной оболочке, валентных электронов .
Правило Хунда гласит, что расположение электронов с наименьшей энергией — это то, которое помещает их на вырожденные орбитали с параллельными спинами. Для химических целей наиболее важными электронами являются те, которые находятся на самой внешней основной оболочке, валентных электронов .
2.2: Electron Configurations распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0 9{3+}}$.
 Какой из них наиболее стабилен в водном растворе?
Какой из них наиболее стабилен в водном растворе?Last updated date: 03rd Mar 2023
•
Total views: 209.4k
•
Views today: 2.92k
Answer
Verified
209.4k+ views
Hint: For finding the number неспаренных электронов, то сначала надо найти атомный номер элемента потом записать конфигурацию в основном состоянии, потом по степени окисления вычесть количество электронов с внешней оболочки. Ион, который будет иметь наполовину или полностью заполненную конфигурацию, будет наиболее стабильным ионом в воде. 9{3+}}$), потому что у него три неспаренных электрона, и эти неспаренные электроны заполнены на ${{t}_{2}}g$-орбитали, что делает его заполненным наполовину.
Примечание:
В состоянии окисления, когда электроны удаляются из основной электронной конфигурации, электроны сначала удаляются с 4s-орбитали, поскольку она является самой внешней орбиталью.

 Какие валентности способен проявлять хлор?
Какие валентности способен проявлять хлор?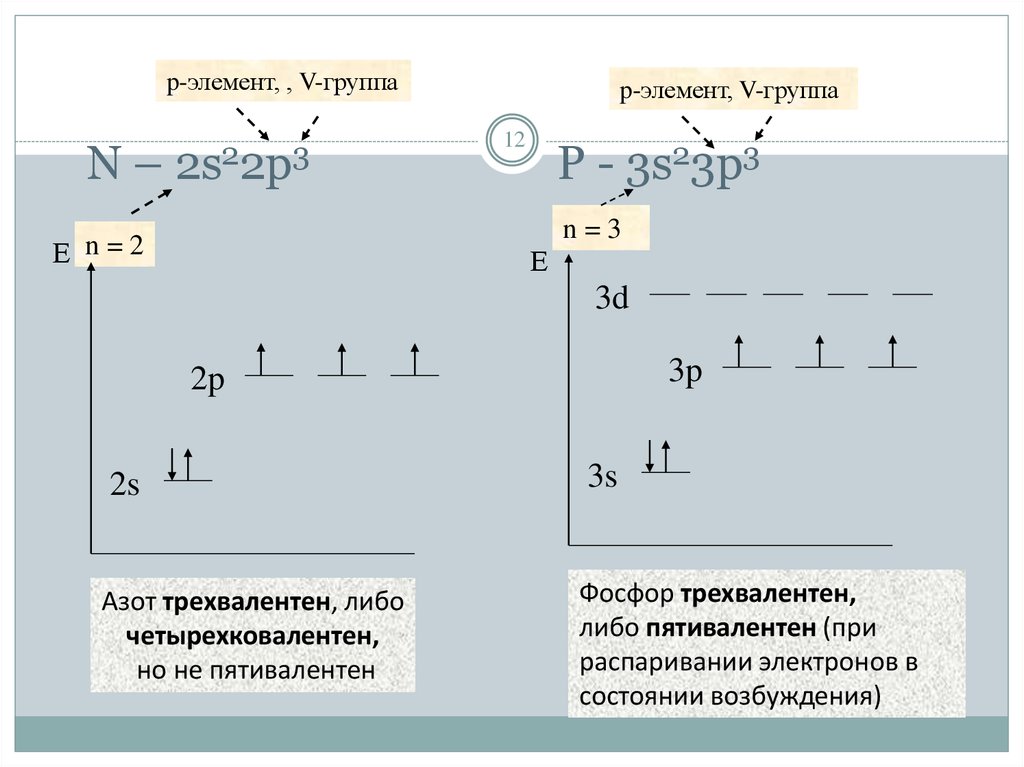 э.о.
э.о.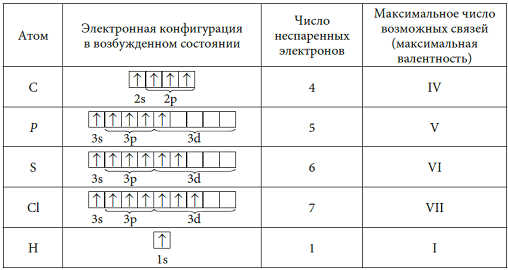
 Какой из них наиболее стабилен в водном растворе?
Какой из них наиболее стабилен в водном растворе?
Leave A Comment