Взаимодействие карбоната натрия с хлоридом кальция. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 4. – Рамблер/класс
Взаимодействие карбоната натрия с хлоридом кальция. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 4. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Проведите следующий опыт.
с хлоридом кальция.
В пробирку налейте 2 мл раствора карбоната натрия.
Затем добавьте несколько капель раствора хлорида кальция. Что наблюдаете? Запишите уравнение химической реакции и укажите её тип по признаку числа и состава исходных веществ и продуктов реакции.
ответы
Выполнение работы:
В пробирку налили 2 мл раствора сульфата натрия, затем добавили
несколько капель хлорида бария. Наблюдаем выделение белого металлокристаллического осадка:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
9. Определите ряд, в котором в обоих словах пропущена одна и та же буква.
9.
Определите ряд, в котором в обоих словах пропущена одна и та же буква. Выпишите
эти слова, вставив пропущенную букву. (Подробнее…)
ГДЗРусский языкЕГЭЦыбулько И.П.
9 класс. Химия. Реакции ионного обмена — Реакция ионного обмена
Комментарии преподавателяРеакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na2CO3 +CaCl2 = CaCO3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Na2CO3 = 2Na+ + CO32-
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.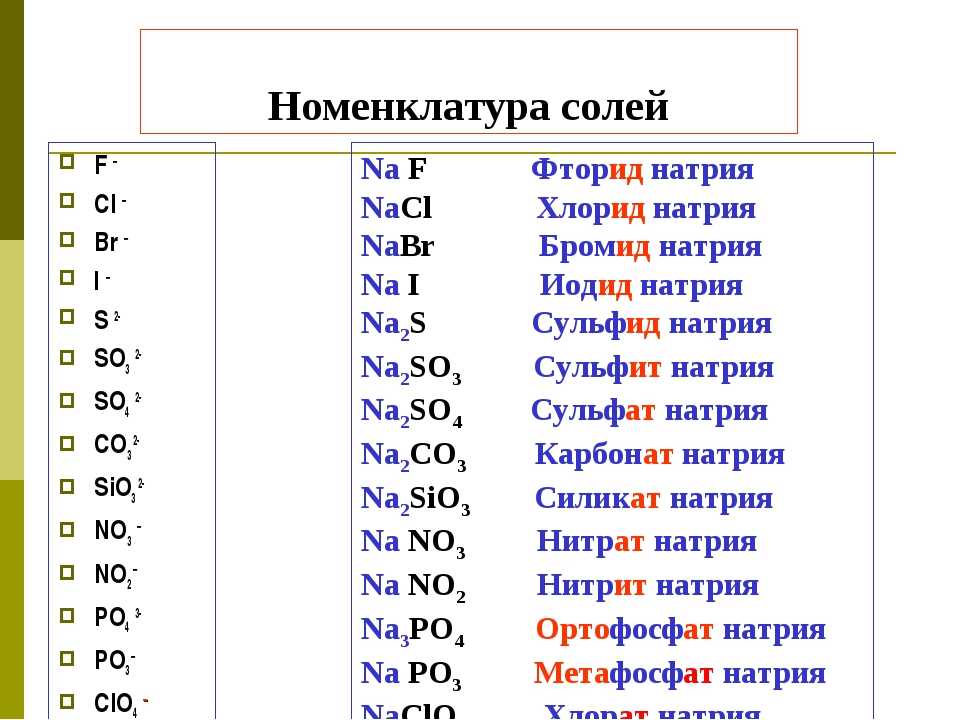
CaCl2 = Ca2+ + 2Cl-
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na+ + CO32- + Ca2+ + 2Cl- = CaCO3 ↓ + 2Na+ + 2Cl- — полное ионное уравнение.
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
Второй пример образования осадка карбоната кальция
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na2CO3 +Ca(NO3)2 = CaCO3 ↓ + 2NaNO3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na+ + CO32- + Ca2+ + 2NO3- = CaCO3 ↓ + 2Na+ + 2 NO3-– полное ионное уравнение
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Образование осадка сульфата бария
Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K2SO4 +BaCl2 = BaSO4 ↓ + 2KCl –молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓ + 2K+ + 2Cl- – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba2+ + SO42- = BaSO4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
Источники
http://www.youtube.com/watch?v=LaIeGmfgLzI
http://www.youtube.com/watch?t=2&v=-sm3RCNAjG8
http://www.youtube.com/watch?t=2&v=HToh5SytenA
заставка http://www.youtube.com/watch?t=6&v=TdlMOBnKGPw
источник презентации — http://ppt4web.ru/khimija/reakcii-ionnogo-obmena.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
Что происходит, когда вы смешиваете хлорид кальция и карбонат натрия?
Что такое хлорид кальция?
Хлорид кальция является одним из неорганических соединений, обозначающих CaCl2. Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Кальций хлористый на вид гигроскопичен, имеет 110,98·моль−1. Он имеет пять уровней плотности: безводный (2,15 г/см3), моногидрат (2,24 г/см3), дигидрат (1,85 г/см3), тетрагидрат (1,83 г/см3) и гексагидрат (1,71 г/см3). г/см3). Хлористый кальций кипит при 1,935°С.
Можно ли смешивать хлорид кальция с другими химическими соединениями?
Ответ на вопрос выше абсолютно да. Хлорид кальция можно смешивать с карбонатом натрия. Он имеет несколько названий, таких как стиральная сода, кальцинированная сода и кристаллическая сода.
Что такое карбонат натрия?
Карбонат натрия – одно из химических соединений, которое обозначает Na2CO3. Цвет белый и растворимый. Раньше карбонат натрия извлекали из пепла растений, произрастающих на натриевых почвах.
Карбонат натрия структурирован по молекулярной массе, плотности и температуре плавления. Молярная масса карбоната натрия состоит из безводного (105,9888 г/моль) и декагидрата (286,1416 г/моль).
Молярная масса карбоната натрия состоит из безводного (105,9888 г/моль) и декагидрата (286,1416 г/моль).
Плотность карбоната натрия делится на пять уровней, таких как безводный (2,54 г/см3), 856 °C, моногидрат (2,25 г/см3), гептагидрат (1,51 г/см3) и декагидрат (1,46 г/см3).
Точки плавления карбоната натрия составляют 851 °C, 100 °C, 33,5 °C и 34 °C.
Вы также можете прочитать о:
- Использование оксида кальция в повседневной жизни
- Использование альгината натрия во многих областях
Что произойдет, если смешать хлорид кальция и карбонат натрия?
Существует формула для смешивания хлорида кальция. Основываясь на этой формуле, вы можете уловить реакцию, например:
CaCl2(водн.) + Na2CO3(водн.) → CaCO3(тв.) + 2NaCl(водн.)
Во-первых, вы должны написать формулу этих соединений. Есть CaCl2 для хлорида кальция и Na2CO3 для карбоната натрия. Вы получите твердый карбонат кальция, и он выпадет в осадок.
Эту реакцию можно назвать реакцией осаждения, даже если эти соединения являются жидкими. Когда они смешаны, их разделяют в процессе фильтрации.
Вы также можете прочитать о:
- Использование хлорида ртути и потенциальное вредное воздействие
- Свойства кальция и его использование в повседневной жизни
Использование продуктов; карбонат кальция и поваренная соль
Продукты этой реакции могут быть использованы для получения многих преимуществ, а именно:
Карбонат кальция
Карбонат кальция означает CaCO3, который содержится в сельскохозяйственной извести. Есть так много преимуществ карбоната кальция, таких как:
- Карбонат кальция можно использовать в качестве антацида.
- Подходит в качестве вспомогательного средства при лечении остеопороза.
- Процесс очистки для горнодобывающих нужд.
- Бумажная промышленность и потребности в покрытиях.

- Карбонат кальция можно использовать для увеличения процесса усвоения питательных веществ растениями в сельскохозяйственных целях.
Поваренная соль
Поваренная соль или хлорид натрия имеет так много преимуществ для различных медицинских целей. Лучшие преимущества поваренной соли улучшают содержание в организме таких веществ, как натрий, кальций и калий.
Карбонат натрия — 100 фунтов
Паспорт безопасности продукта
Карбонат натрия (кальцинированная сода)
Из Википедии, свободной энциклопедии0004 или кальцинированной соды ), Na2CO3, представляет собой натриевую соль угольной кислоты. Чаще всего он встречается в виде кристаллического гептагидрата, который легко выцветает с образованием белого порошка, моногидрата. Он имеет охлаждающий щелочной вкус и может быть извлечен из пепла многих растений. Он синтетически производится в больших количествах из поваренной соли в процессе, известном как процесс Solvay.
Применение
- Наиболее важным применением карбоната натрия является химический состав стекла. При нагревании до очень высоких температур в сочетании с песком (SiO2) и карбонатом кальция (CaCO3) и очень быстром охлаждении карбонат натрия можно использовать для образования прозрачного некристаллического материала, широко известного как стекло.
- В химии карбонат натрия часто используется в качестве электролита. Это связано с тем, что электролиты обычно основаны на соли, а карбонат натрия действует как очень хороший проводник в процессе электролиза.
- В быту используется для смягчения воды при стирке. Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна.
 Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.
Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д. - Карбонат натрия широко используется в фотографических процессах в качестве регулятора pH для поддержания стабильных щелочных условий, необходимых для действия большинства проявляющих агентов.
- Карбонат натрия также используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструзии глины.
- Кальцинированная сода также является распространенной добавкой в муниципальных бассейнах, используемой для нейтрализации кислотного воздействия хлора и повышения pH.
- При литье моногидрат карбоната натрия называется «связующим веществом» и используется для прилипания влажного альгината к гелеобразному альгинату.
- Карбонат натрия часто используется в качестве основного стандарта для кислотно-щелочного титрования, поскольку он является твердым и стабильным на воздухе, что облегчает точное взвешивание.

Распространение
Карбонат натрия растворим в воде, но может встречаться естественным образом в засушливых регионах, особенно в месторождениях полезных ископаемых (эвапоритах), образующихся при испарении сезонных озер. Месторождения минерального натрона, представляющего собой комбинацию карбоната натрия и бикарбоната натрия, добывались на дне высохших озер в Египте с древних времен, когда натрон использовался для изготовления мумий и в раннем производстве стекла. Карбонат натрия имеет три известные формы гидратов: декагидрат карбоната натрия, гептагидрат карбоната натрия и моногидрат карбоната натрия.
Производство
Горнодобывающая промышленность
Трона, гидратированный бикарбонат натрия (Na3HCO3CO3·2h3O), добывается в нескольких районах Соединенных Штатов и обеспечивает почти весь отечественный карбонат натрия. Крупные естественные месторождения, обнаруженные в 1938 году у реки Грин, штат Вайоминг, сделали добычу полезных ископаемых более экономичной, чем промышленное производство в Северной Америке.
Его также добывают из некоторых щелочных озер, таких как озеро Магади в Кении, с помощью основного процесса дноуглубительных работ, и он также самовосстанавливается, поэтому никогда не иссякнет в своем естественном источнике.
Барилла и водоросли
Ряд «галофитных» (солеустойчивых) видов растений и видов морских водорослей могут быть переработаны в нечистую форму карбоната натрия, и эти источники преобладали в Европе и других местах до начала 19 века. Наземные растения или водоросли собирали, сушили и сжигали. Затем пепел «выщелачивали» (промывали водой) с образованием раствора щелочи. Этот раствор выпаривали, чтобы получить конечный продукт, который получил название «кальцинированная сода». это очень старое название относится к архетипическому растительному источнику кальцинированной соды, которым был небольшой однолетний кустарник Salsola soda («растение барилла»).
Концентрация карбоната натрия в кальцинированной соде варьировалась в очень широких пределах: от 2-3% для формы, полученной из морских водорослей («ламинарии»), до 30% для лучшей бариллы, полученной из галофитных растений в Испании. Источники растений и морских водорослей для кальцинированной соды, а также родственной щелочи «калий» становились все более неадекватными к концу 18-го века, и поиск коммерчески жизнеспособных способов синтеза кальцинированной соды из соли и других химических веществ усилился.
Источники растений и морских водорослей для кальцинированной соды, а также родственной щелочи «калий» становились все более неадекватными к концу 18-го века, и поиск коммерчески жизнеспособных способов синтеза кальцинированной соды из соли и других химических веществ усилился.
Процесс Леблана
В 1791 году французский химик Николя Леблан запатентовал процесс получения карбоната натрия из соли, серной кислоты, известняка и угля. Сначала морскую соль (хлорид натрия) кипятили в серной кислоте с получением сульфата натрия и газообразного хлористого водорода в соответствии с химическим уравнением
2 NaCl + h3SO4 → Na2SO4 + 2 HCl
Затем сульфат натрия смешивали с измельченным известняком. (карбонат кальция) и уголь, и смесь сжигалась, образуя карбонат натрия вместе с диоксидом углерода и сульфидом кальция.
Na2SO4 + CaCO3 + 2 C → Na2CO3 + 2 CO2 + CaS
Карбонат натрия экстрагировали из золы водой, а затем собирали, позволяя воде испариться.
Соляная кислота, полученная в процессе Леблана, была основным источником загрязнения воздуха, а побочный продукт сульфид кальция также создавал проблемы с утилизацией отходов. Однако он оставался основным методом производства карбоната натрия до конца 1880-х годов.
Сольвей Процесс
В 1861 году бельгийский промышленный химик Эрнест Сольвей разработал метод превращения хлорида натрия в карбонат натрия с использованием аммиака. Процесс Solvay был сосредоточен вокруг большой полой башни. Внизу карбонат кальция (известняк) нагревали для выделения углекислого газа:
CaCO3 → CaO + CO2
Вверху в башню поступал концентрированный раствор хлорида натрия и аммиака. Когда углекислый газ барботировал через него, бикарбонат натрия выпадал в осадок:
NaCl + Nh4 + CO2 + h3O → NaHCO3 + Nh5Cl
Затем бикарбонат натрия превращали в карбонат натрия путем его нагревания с выделением воды и углекислого газа:
2 NaHCO3 → Na2CO3 + h3O + CO2
Тем временем аммиак регенерировали из побочного продукта хлорида аммония путем обработки его известью. (гидроксид кальция), оставшийся после образования диоксида углерода:
(гидроксид кальция), оставшийся после образования диоксида углерода:
CaO + h3O → Ca(OH)2
Ca(OH)2 + 2 Nh5Cl→CaCl2 + 2 Nh4 + 2 h3O
он потреблял только рассол и известняк, а единственным продуктом жизнедеятельности был хлорид кальция. Это сделало его значительно более экономичным, чем процесс Леблана, и вскоре он стал доминировать в мировом производстве карбоната натрия. К 1900, 90% карбоната натрия производилось по процессу Сольве, а последний технологический завод Леблана закрылся в начале 1920-х годов.
Процесс Хоу
Разработан китайским химиком Хоу Дебангом в 1930-х годах. Это то же самое, что и процесс Solvay в первых нескольких шагах. Но вместо обработки оставшегося раствора известью в раствор закачивают углекислый газ и аммиак и добавляют хлорид натрия до насыщения при 40°С. Затем раствор охлаждают до 10°С. Хлорид аммония выпадает в осадок и удаляется. путем фильтрации раствор повторно используется для получения большего количества бикарбоната натрия.


 Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.
Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.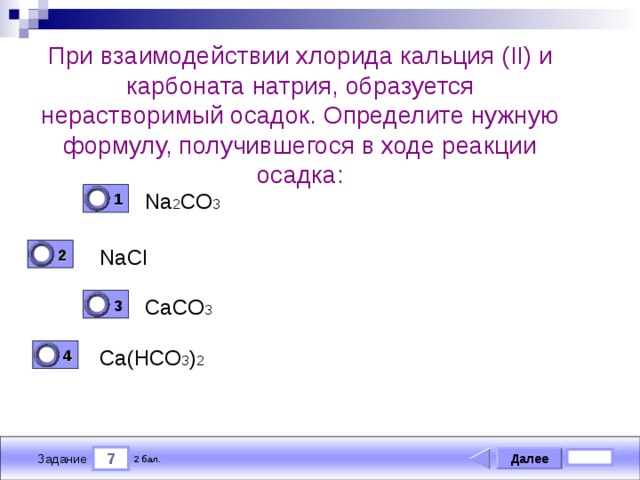
Leave A Comment