Атомы и электроны, подготовка к ЕГЭ по химии
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня: пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14 электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенно число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 4f
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
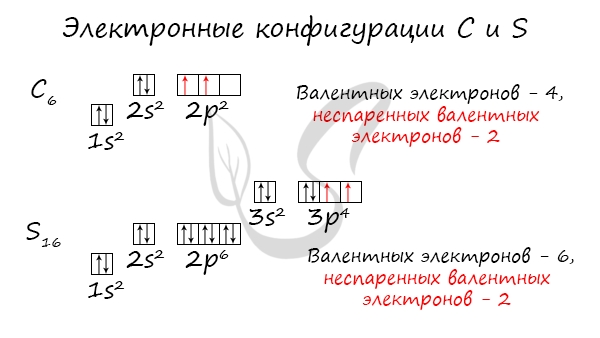
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную с учетом провала электрона.

Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота, кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
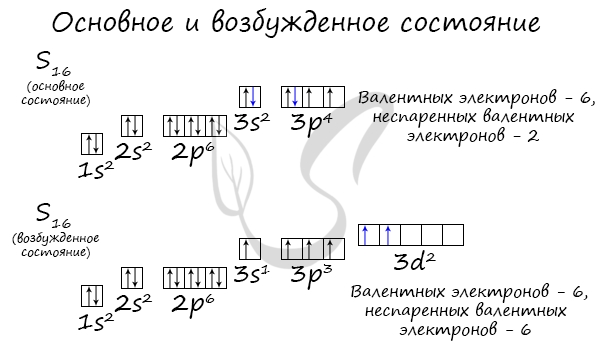
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Задание №1 ЕГЭ по химии 🐲 СПАДИЛО.РУ
Описание задания
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов Бал: 1 Сложность задания: ♦◊◊ Примерное время выполнения: 1 мин.Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
- P
- N
- S
- Al
- O
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
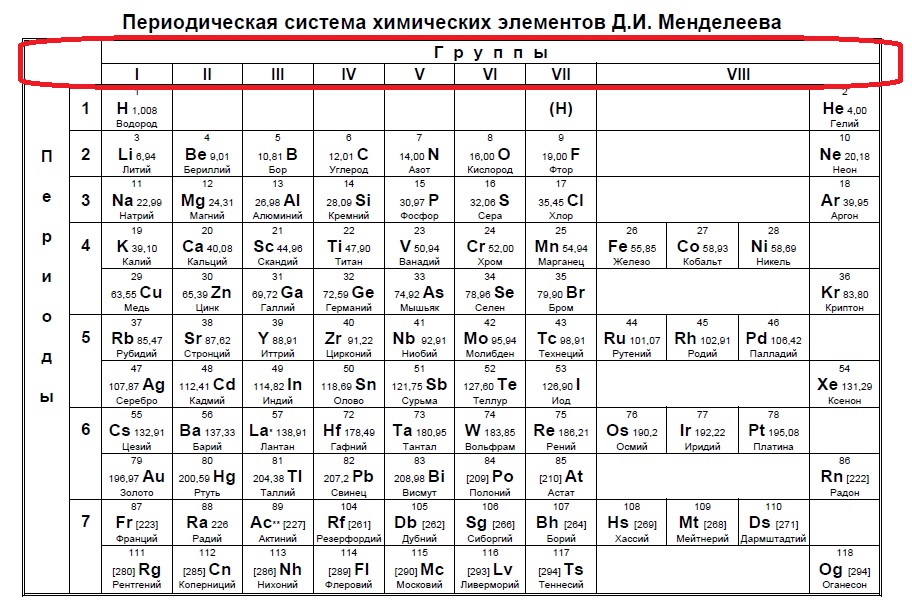

Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия: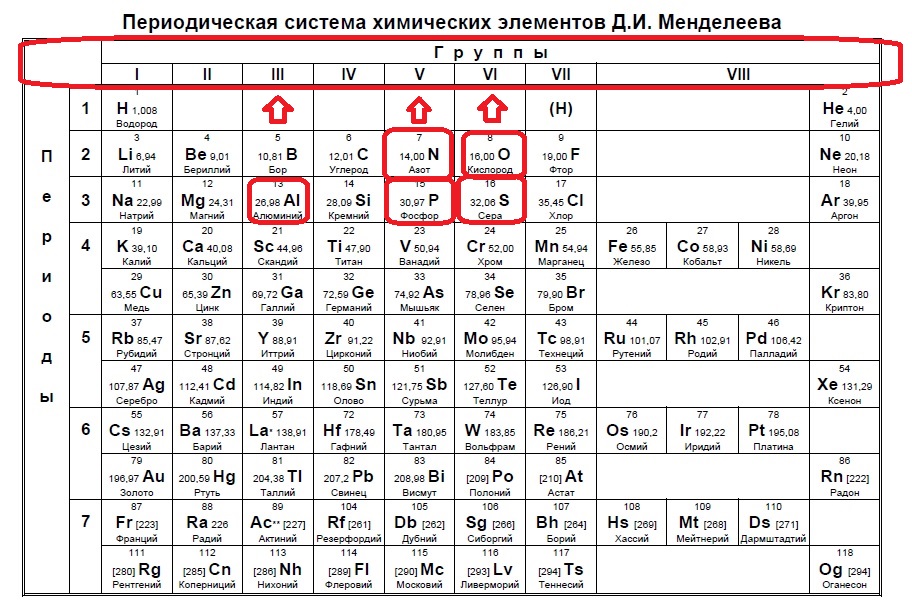

Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Ответ: 12Вариант 1ЕХ2
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
- Ba
- At
- Bi
- Mg
- Cs
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
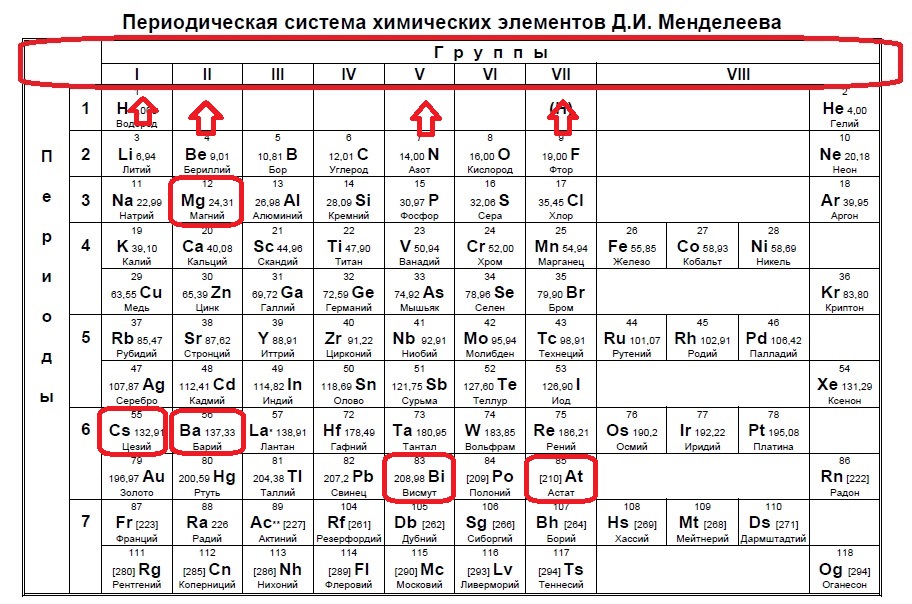
 В данном случае элементы второй группы — магний и барий. Ответ: 14
В данном случае элементы второй группы — магний и барий. Ответ: 14Вариант 1ЕХ3
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
- S
- Na
- Al
- Si
- Mg
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
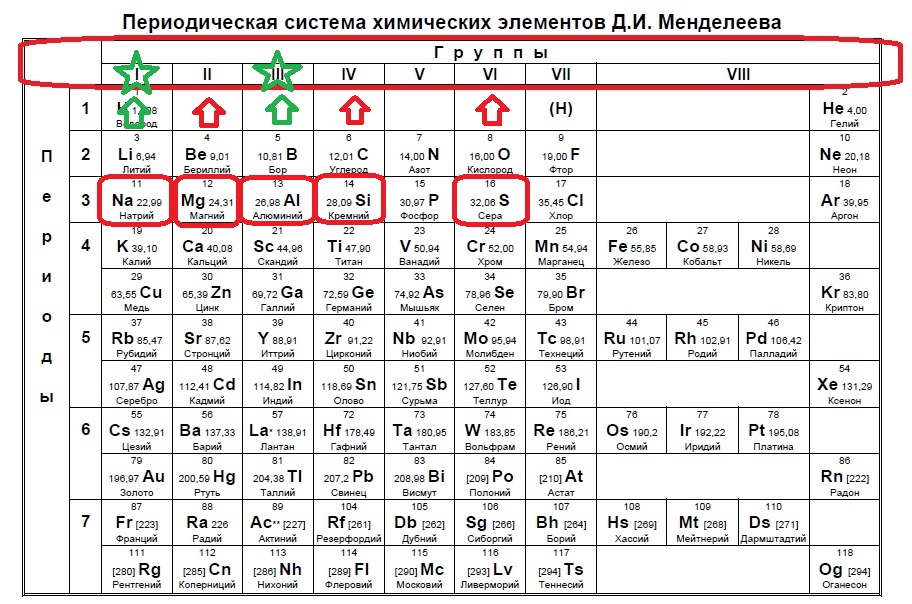

Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Ответ: 23Вариант 1ЕХ4
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
- S
- Mg
- C
- B
- Li
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
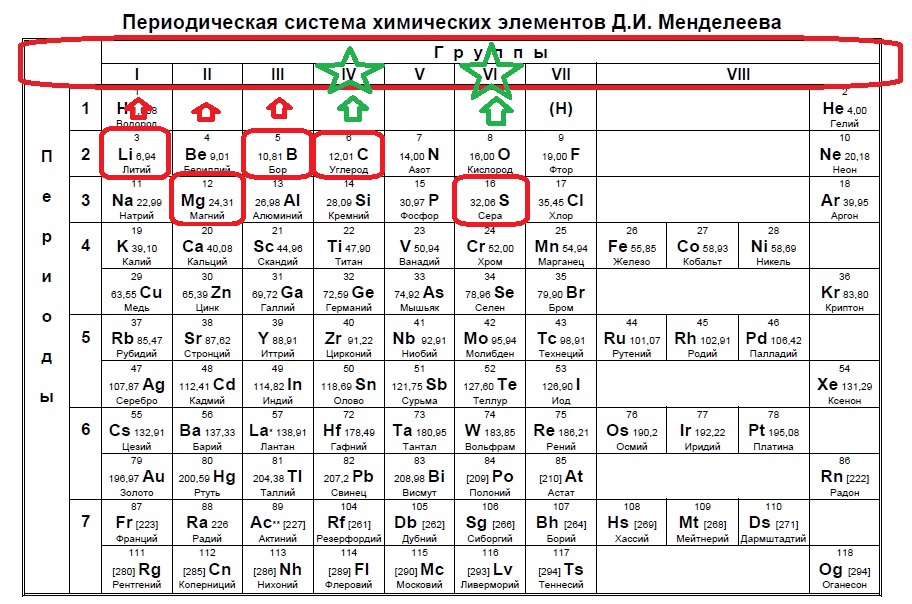
 В нашем случае это углерод и сера. Ответ: 13
В нашем случае это углерод и сера. Ответ: 13Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
- Na
- K
- N
- Li
- Al
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
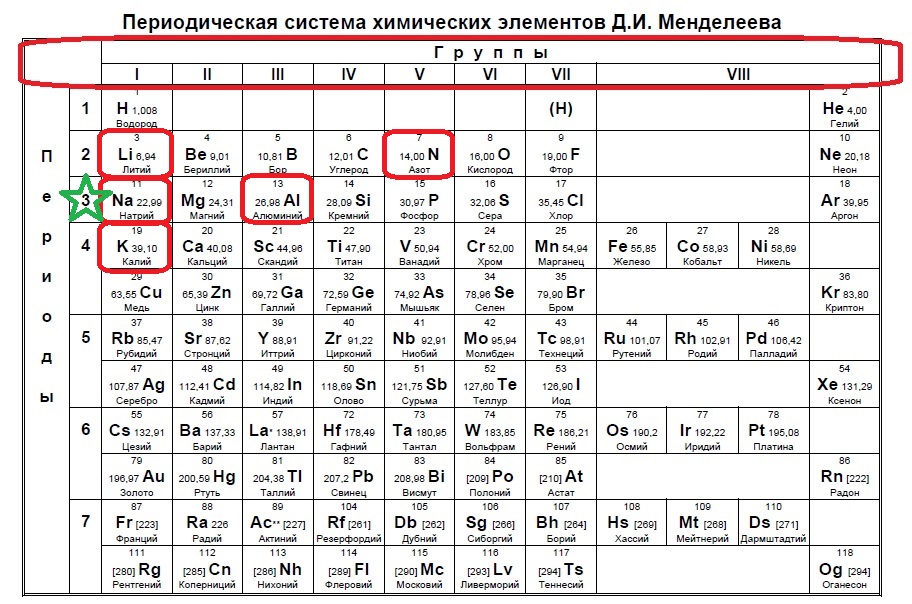

Нам подходят натрий и алюминий.
Ответ: 15Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
- N
- Al
- S
- Cl
- Ca
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
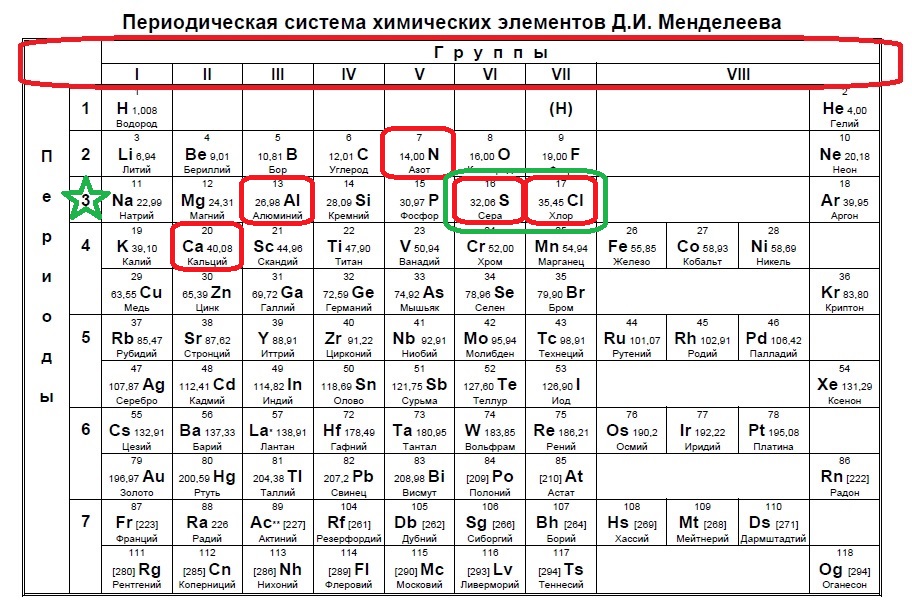

В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34Вариант 1ЕХ7
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
- H
- C
- F
- Be
- P
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
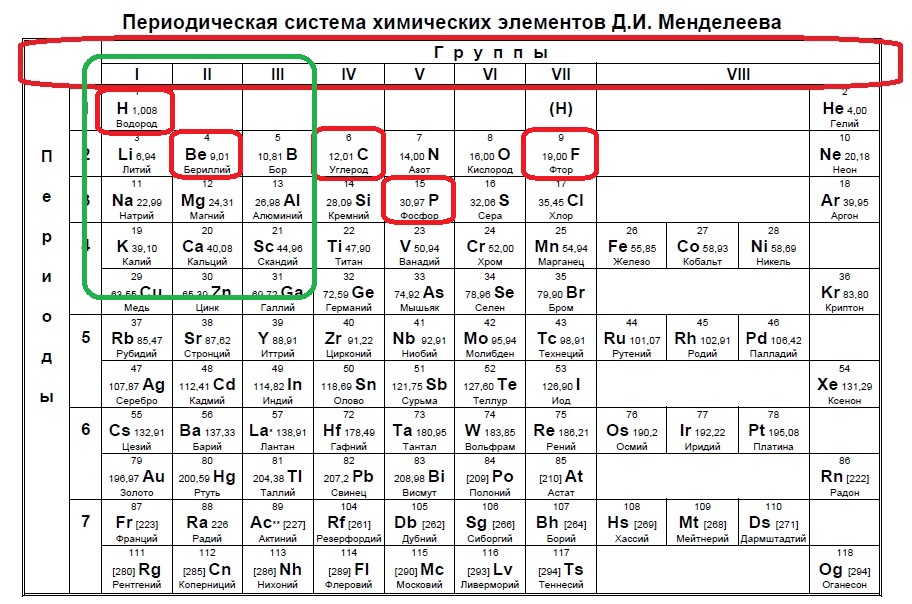
 Нам подходит водород и бериллий. Ответ: 14.
Нам подходит водород и бериллий. Ответ: 14.Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
«Как определить неспаренные и спаренные электроны?» – Яндекс.Кью
Всё дело в том, что на таких маленьких масштабах, как размеры атомов и меньше классическая механика, являющаяся по существу лишь приближением, работающим на масштабах пылинок и выше, перестаёт верно описывать механическое поведение частиц.
Квантовая механика утверждает, что электроны (и другие микрочастицы) описываются волновыми функциями, определяющими лишь вероятность обнаружить электрон в заданной точке. И в такой системе, как атом, электроны могут иметь лишь фиксированные энергии (занимать фиксированные энергетические уровни) — в атоме они как бы покоятся на этих фиксированных энергетических уровнях и потому не излучают. Картинки вида электронов (правильнее их уже называть электронными оболочками) можно увидеть на школьных уроках химии — это так называемые s-орбитали, p-орбитали и т д.
Это простой ответ, но ничего не объясняющий. Поэтому если автору хочется подробностей, то предлагаю читать текст дальше.
Согласно классической электродинамике любая ускоренно движущаяся заряженная частица должна излучать электромагнитные волны. А в планетарной модели атома Резерфорда (описывающей атом как структуру, состоящюую из положительно заряженного тяжёлого ядра в центре и движущихся вокруг него отрицательно заряженных лёгких электронов) электрон действительно движется с ускорением, поскольку вращается вокруг ядра. Классическая (неквантовая) электродинамика предсказывает, что т.к. эти непрерывно излучаемые электроном электромагнитные волны уносят с собой энергию электрона, то ему следовало бы упасть на ядро, т.к. теряя свою энергию, он должен сближаться с ядром.
Справиться с этим противоречием впервые попытался Нильс Бор, постулировав два факта, никак не объясняя их происхождение: Во первых он заявил, что в отличие от планет солнечной системы, электроны могут пребывать долго лишь на орбитах, на которых они имели бы определённую заданную энергию. А во вторых излучение электромагнитных волн может происходить лишь при переходе электрона с одной такой «орбиты» на другую, на которой он имел бы меньшую энергию.
Несмотря на то, что в чём-то эти постулаты соответствовали действительности, т.к. они по прежнему учитывали принципы классической механики, они приводили к некоторым противоречиям в теории и к тому же ни откуда не следовали. (Заглядывая вперёд сообщу, что противоречие заключалось в том, что эти постулаты могли быть описаны только появившейся уже позднее квантовой механикой, но само движение частиц по прежнему описывалось классической, в рамках которой эти постулаты являются чем-то чуждым ей, не выводящимся из неё и даже противоречащим ей. Это приводило к предсказанию неправильных эффектов, не наблюдавшихся в экспериментах. Был понятно, что мир нуждается в теории, в рамках которой постулаты Бора были бы следствием этой самой теории и что классическая механика нуждается в пересмотрении)
Разрешить эту проблему в 20 — 30 годы 20го века смогла развиваемая ещё молодыми в тот момент физиками (такими как Поль Дирак, Вернер Гейзенберг, Луи Де Бройль и др.) новая теория — Квантовая механика.
Квантовая механика разительно отличается от классической. Однако при переходе к макромасштабам превращается в классическую и в её силах описать принцип работы транзистора, решить противоречие с излучением электронов в атоме, объяснить уже известную из экспериментов на тот момент корпускулярно-волновую природу света, а так же объяснить дискретные спектры излучения атомов химических веществ, твёрдо опровергающие понимание физики микромира тех времён. А если использовать ещё и специальную теорию относительности — предсказать такую чисто квантово-механическую характеристику частиц, как спин, И это ещё далеко не всё, на что она способна.
Всё дело в том, что в квантовом мире (на микромасштабах) механикой частиц управляет не уравнение Ньютона, а так называемое уравнение Шрёдингера. Для решения накопившихся в механике проблем пришлось основательно пересмотреть понимание понятия измерения и взгляда на то, что такое частица.
Руководствуясь волновым поведением света в опыте Юнга, физики пришли к выводу, что распространяется свет как волна. Это позволило описать интерференционную картину, возникающую в упомянутом опыте. А соображения Макса Планка об излучении абсолютно черного тела и исследование Эйнштейна, касающееся фотоэффекта, твёрдо утверждали, что поглощаются и излучаются «порции» света дискретно — как частицы. (В то время как синтез классической механики и электродинамики описывал непрерывное излучение и поглощение электромагнитных волн ускоренно движущимися заряженными частицами. На макромасштабах порциальность или иначе — корпускулярность излучения просто становится незаметной, поскольку порции очень маленькие и приборы с низкой точностью смогут увидеть лишь непрерывный спектр).
Математически проблему можно решить, постулировав корпускулярно-волновую природу света, обнаруженную в эксперименте. Волновая природа закладывается в вид уравнения исходя из соображений получения интерференции на двух щелях в опыте Юнга и ещё некоторых экспериментов, утверждающих, что свет распространяется как волна. Корпускулярность решается элегантным способом — переходом к операторному методу описания физических величин. Операторный метод подразумевает, что состояние любой частицы описывается некоторой функцией, а теоретически рассчитать её физические параметры можно действием на эту функцию соответствующих операторов этих физических величин. (У каждой физической величины в квантовой механике есть свой оператор). Сам вид операторов строится таким образом, чтобы описание
Неспаренный электрон — Справочник химика 21
Такая общая электронная пара может образоваться как в результате спаривания двух неспаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и эа счет пары электронов одного атома — донора — и вакантной орбитали второго атома — акцептора (донорно-акцепторный механизм образования связи). [c.55]При полимеризации диенового мономера, например бутадиена, свободный радикал инициатора присоединяется к первому атому углерода с образованием относительно стабильного аллильного радикала, в котором неспаренный электрон сопряжен с двойной связью [c.141]
Пример. Определить гибридные орбитали и пространственную структуру комплексных ионов [N 01,] и [Ni( N) P , если известно, что первый из них содержит два неспаренных электрона, а второй — диамагнитен (р.=0). [c.181]
Кислород — вещество парамагнитное, что свидетельствует о наличии в его молекуле неспаренных электронов. [c.142]
С развитием электронных представлений о химической связи стало ясно, что в свободных радикалах, например в трифенилме-тиле, ненасыщенной связи (в терминах теории Кекуле) в рамках новых представлений соответствует неспаренный электрон. Обычно такие молекулы с неспаренным электроном исключительно реакционноспособны и быстро превращаются в другие вещества. [c.163]
Парамагнетизм иона [Mn( N)o] определяется единственным неспаренным электроном. Определить тип гибридизации АО иона Мп +, [c.212]
Изучение природы межмолекулярных сил, способствующих ассоциированию асфальтенов, является предметом многочисленных исследований. Обобщая имеющиеся сведения, можно объяснить стабилизацию надмолекупя1 юй структуры асфальтенов, учитьшая все виды взаимодействия, вносящие определенный вклад в суммарную энергию а) дисперсионное, которое выражается в виде обмена электронами между однотипными неполярными фрагментами и действует на очень близких расстояниях (0,3—0,4 нм) б) ориентационное, которое проявляется в виде переноса зарядов между фрагментами, содержащими диполи или гетероатомы, также относится к близкодействующим силам в) тг-взаимодействие ареновых фрагментов, формирующих блочную структуру г) радикальное взаимодействие между неспаренными электронами парамагнитных молекул д) взаимодействие за счет водородных связей между гетероатомами и водородом соседних атомов составляющих молекул е) взаимодействие функциональных групп, связанных водородными связями. [c.25]
Характерной особенностью перечисленных элементов является недостроенность их электронных d-оболочек, определяющая химические и многие физические свойства этих элементов. Для этих элементов характерно, что переход электронов из внещних с -оболочек во внешнюю s-оболочку (или наоборот) приводит к возникновению свободных валентностей. Например, для платины переход из считающегося основным состояния 5 i 6s2 3 состояние 5ii 6s приводит к образованию двух свобод ных валентностей (два неспаренных электрона). [c.363]
Образование начального активного центра полимеризации является второй стадией инициирования полимеризации. Под влиянием свободного радикала инициатора, несущего неспаренный электрон, происходит разрыв или раскрытие двойной связи мономера. Один из электронов п-связи мономера с неспаренным электроном свободного радикала инициатора образует простую о-связь, а второй электрон я-связи остается в молекуле мономера, в результате чего возникающий активный центр сохраняет свойства свободного радикала. Активный центр — это соединение свободного радикала инициатора с молекулой мономера, представляющее собой начало роста полимерной цепи [c.140]
Однако если молекула плоская и симметричная (как молекула трифенилметила), то неспаренный электрон может размазаться по всей молекуле, что приведет к стабилизации радикала. [c.163]
В дальнейшем молекулы бутадиена присоединяются в основном к четвертому атому углерода, так как в бутадиене облако я-электронов концентрируется преимущественно в области кратных связей. Однако вследствие делокализации неспаренного электрона и близкого значения энергий активации роста цепей в положениях 1,4- и 1,2- (28,8 и 31,5 кДж/моль соответственно) в некоторой мере образуются и звенья 1,2- [18]. [c.141]
Долгоживущие свободные радикалы относятся к числу наиболее активных частиц. Это объясняется тем, что из-за неспаренного электрона, сопряженного с подвижной сг- или я-связью, они имеют собственное магнитное поле (обладают парамагнитными свойствами). Поэтому свободные радикалы, энергично хемосорбируясь на металле, изменяют работу выхода электрона. Они играют существенную роль в проявлении смазочными маслами моющих, противоизносных, противокоррозионных и защитных свойств. [c.204]
Рост полимерной цепи. Рост полимерной цепи происходит путем присоединения молекулы мономера к начальному активному центру, несущему неспаренный электрон. Здесь также образуется а-связь между углеродными атомами молекул мономера, а возникающая полимерная цепь сохраняет свойства свободного макрорадикала. Сохранение растущей полимерной цепью свойств свободного радикала является наиболее характерным для полимеризации, протекающей по радикальному механизму [c.140]
Концентрация радикалов в реакционной системе обычно невелика и вероятность их столкновения между собой ничтожно мала. При термолизе более значительно преобладают взаимодействия между радикалом и молекулами исходного сырья. Поскольку радикал имеет свободный неспаренный электрон, то его реакция с молекулами, все электроны которых спарены, должна в силу принципа неуничтожимости свободной валентности привести к обра — зованию нового вторичного радикала. Если последний не является малоактивным, то он, в свою очередь вступит в реакцию с новой молекулой сырья и т.д. Так как число радикалов, могущих образоваться при термолизе, невелико, на некоторой стадии образуется радикал, принимавший участие в одной из предыдущих стадий, и возникает регулярное чередование двух или более последовательно параллельных элементарных реакций с образованием конечных продуктов. Этот процесс продолжится до тех пор, пока радикал не «гогибнет» в результате реакций рекомбинации или диспропорци-онирования. Реакции такого типа называются цепными. [c.26]
Какой тип гибридизации АО центрального атома реализуется в ионе [FeFe] «, если значение магнитного момента этого иона свидетельствует о наличии в нем четырех неспаренных электронов [c.211]
Согласно такому описанию, молекула О2 не содержит несиа-ренных электронов. Однако магнитные свойства кислорода указывают па то, что в молекуле О2 имеются два неспаренных электрона. [c.142]
Потому что 1) атом ко
Тематический тест на строение атома для подготовки к ЕГЭ по химии.
Задание №1
Четыре электрона на внешнем энергетическом уровне имеют атомы химических элементов:
- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Задание №2
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. V
- 3. As
- 4. Al
- 5. Li
Задание №3
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Se
- 3. Fe
- 4. S
- 5. Al
Задание №4
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Al
- 3. Cl
- 4. Fe
- 5. Mn
Задание №5
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Al
- 3. K
- 4. N
- 5. Cl
Задание №6
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Al
- 2. N
- 3. Ca
- 4. P
- 5. O
Задание №7
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Na
- 2. Ca
- 3. As
- 4. Cr
- 5. Al
Задание №8
Три неспаренных электрона в основном состоянии имеют атомы:
- 1. B
- 2. V
- 3. O
- 4. As
- 5. Ne
Задание №9
Одинаковое число неспаренных электронов в основном состоянии содержат атомы:
- 1. Ti
- 2. Al
- 3. C
- 4. Ba
- 5. N
Задание №10
Один неспаренный электрон в основном состоянии имеют атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Задание №11
В основном состоянии все валентные электроны расположены только на s-подуровне у атомов:
- 1. Sb
- 2. Ra
- 3. Fe
- 4. B
- 5. Na
Задание №12
Валентные электроны, расположенные на s- и d-подуровнях, содержат атомы:
- 1. Rb
- 2. Cr
- 3. Sr
- 4. V
- 5. P
Задание №13
Все валентные электроны расположены на третьем энергетическом уровне у атомов:
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Задание №14
К s-элементам относятся:
- 1. Cu
- 2. Rb
- 3. Sc
- 4. Al
- 5. Ra
Задание №15
К s-элементам относятся:
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Задание №16
К p-элементам относятся:
- 1. Cu
- 2. B
- 3. Cr
- 4. Ba
- 5. Sb
Задание №17
К d-элементам относятся:
- 1. Cs
- 2. Zn
- 3. Cl
- 4. Te
- 5. Mn
Задание №18
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. K
- 2. Sr
- 3. Mn
- 4. Ca
- 5. Br
Задание №19
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Задание №20
Валентных электронов на d-подуровне не содержат атомы химических элементов:
- 1. Ti
- 2. Br
- 3. Se
- 4. Sc
- 5. Ni
Задание №21
Одинаковое число нейтронов и протонов содержат атомы наиболее распространенных изотопов:
- 1. S
- 2. Al
- 3. K
- 4. Ca
- 5. Na
Задание №22
Число нейтронов большее, чем число протонов содержат ядра наиболее распространенных изотопов:
- 1. Ar
- 2. Si
- 3. K
- 4. Mg
- 5. O
Задание №23
Не могут переходить в возбужденное состояние атомы:
- 1. N
- 2. Ca
- 3. F
- 4. Sr
- 5. Se
Задание №24
Не могут переходить в возбужденное состояние атомы:
- 1. O
- 2. S
- 3. He
- 4. As
- 5. P
Задание №25
Не могут переходить в возбужденное состояние атомы:
- 1. Cl
- 2. F
- 3. B
- 4. Ne
- 5. C
Задание №26
Не могут переходить в возбужденное состояние атомы:
- 1. P
- 2. Br
- 3. Be
- 4. O
- 5. N
Задание №27
Не могут переходить в возбужденное состояние атомы:
- 1. Ca
- 2. P
- 3. O
- 4. F
- 5. S
Задание №28
Возможен переход в возбужденное состояние для атомов:
- 1. Cs
- 2. C
- 3. Al
- 4. Rb
- 5. N
Задание №29
Один неспаренный электрон в основном состоянии содержат атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Задание №30
Из предложенного перечня химических элементов выберите два таких, наиболее устойчивые катионы которых имеют одинаковые электронные конфигурации:
- 1. Al
- 2. Ca
- 3. Ba
- 4. Na
- 5. I
Задание №31
Три неспаренных электрона в основном состоянии содержат атомы:
- 1. B
- 2. N
- 3. Al
- 4. Se
- 5. P
Задание №32
В возбужденном состоянии электронную форму внешнего электронного уровня ns1np2 имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Задание №33
Электронную формулу внешнего энергетического уровня ns1 в основном состоянии имеют атомы:
- 1. Cr
- 2. Ca
- 3. Cs
- 4. Cl
- 5. Br
Задание №34
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. As
- 2. B
- 3. P
- 4. F
- 5. Al
Задание №35
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 4s24p6
- 1. Sr
- 2. Br
- 3. Rb
- 4. As
- 5. Se
Задание №36
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6
- 1. Na
- 2. Al
- 3. Br
- 4. Cu
- 5. Se
Задание №37
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np3 имеют атомы:
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Задание №38
Схожую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Al
- 2. Mg
- 3. Br
- 4. F
- 5. Na
Задание №39
Полностью завершенный второй энергетический уровень имеют атомы:
- 1. Ne
- 2. He
- 3. Na
- 4. F
- 5. O
Задание №40
Двух электронов до завершения внешнего энергетического уровня не хватает атомам:
- 1. Cr
- 2. Zn
- 3. O
- 4. S
- 5. Fe
Задание №41
Одного электрона до завершения внешнего энергетического уровня не хватает атому:
- 1. Na
- 2. Br
- 3. K
- 4. Ca
- 5. Cl
Задание №42
В основном состоянии электронную формулу внешнего энергетического уровня ns2np4 имеют атомы:
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Задание №43
Атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон:
- 1. P
- 2. Cu
- 3. Zn
- 4. Si
- 5. Cl
Задание №44
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Задание №45
Электронную конфигурацию ns1 имеют атомы:
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Задание №46
Валентные электроны и на s- и на d-подуровнях содержат атомы:
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Задание №47
До полного заполнения внешнего энергетического уровня не хватает одного электрона атомам:
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Задание №48
В основном состоянии во внешнем слое содержат один неспаренный электрон атомы:
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5. Si
Задание №49
Одинаковое число валентных электронов содержат атомы:
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Задание №50
Электронную конфигурацию ns1np3 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Задание №51
Электронную конфигурацию ns1np2 в возбужденном состоянии имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Задание №52
Электронную конфигурацию внешнего энергетического уровня ns2 в основном состоянии имеют атомы:
- 1. Na
- 2. Al
- 3. Fe
- 4. Ba
- 5. P
Задание №53
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Mg
- 2. Ca
- 3. Al
- 4. Li
- 5. Be
Задание №54
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Cl
- 2. О
- 3. Br
- 4. F
- 5. S
Задание №55
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. Cl
- 2. S
- 3. F
- 4. Br
- 5. O
Задание №56
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. S
- 2. Ca
- 3. Cl
- 4. K
- 5. Br
Задание №57
Содержат один неспаренный электрон в основном состоянии атомы:
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Задание №58
Шесть валентных электронов имеют атомы:
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Задание №59
Неспаренных электронов не содержат атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Задание №60
Как на s-, так и на d-подуровне расположены валентные электроны атомов:
- 1. Si
- 2. Cr
- 3. Mn
- 4. Br
- 5. C
Задание №61
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Cr
- 2. P
- 3. Mg
- 4. O
- 5. H
Задание №62
До завершения внешнего электронного слоя одного электрона не хватает атомам:
- 1. Ba
- 2. O
- 3. K
- 4. Cl
- 5. H
Задание №63
В основном состоянии один неспаренный электрон имеют атомы:
- 1. B
- 2. Mg
- 3. C
- 4. S
- 5. Rb
Задание №64
Электронную формулу внешнего энергетического уровня ns1np2 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. P
- 3. Cl
- 4. Cr
- 5. B
Задание №65
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. C
- 2. As
- 3. B
- 4. H
- 5. Ne
Задание №66
Одинаковое число d-электронов в основном состоянии содержат атомы:
- 1. Cr
- 2. V
- 3. Cu
- 4. Mn
- 5. Na
Задание №67
Одинаковое число валентных электронов имеют атомы:
- 1. O
- 2. Ba
- 3. P
- 4. Sr
- 5. C
Задание №68
Одинаковое число энергетических уровней, содержащих электроны, имеют атомы:
- 1. Ag
- 2. Rb
- 3. Li
- 4. Na
- 5. Cu
Задание №69
Определите химические элементы, анионы которых имеют конфигурацию внешнего электронного слоя 2s22p6:
- 1. Na
- 2. Cl
- 3. Mg
- 4. F
- 5. O
Задание №70
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Sb
- 3. Ni
- 4. Cu
- 5. Fe
Задание №71
Из предложенного перечня выберите p-элементы:
- 1. Sc
- 2. Fe
- 3. Li
- 4. Sb
- 5. Sn
Задание №72
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Si
- 2. Be
- 3. N
- 4. Rb
- 5. K
Задание №73
Из предложенного перечня выберите d-элементы:
- 1. Cs
- 2. As
- 3. Mn
- 4. Te
- 5. Zn
Задание №74
Одинаковое количество неспаренных электронов в основном состоянии содержат атомы:
- 1. S
- 2. Br
- 3. P
- 4. B
- 5. Zn
Задание №75
В наиболее распространенных изотопах атомов каких элементов число нейтронов больше, чем число электронов:
- 1. O
- 2. Se
- 3. S
- 4. Ar
- 5. Ca
Задание №76
На внешнем энергетическом уровне только два электрона содержат атомы:
- 1. Ca
- 2. Br
- 3. N
- 4. Cr
- 5. He
Задание №77
Атомам каких элементов для приобретения электронной конфигурации как у благородного газа не хватает двух электронов:
- 1. Cl
- 2. P
- 3. N
- 4. Se
- 5. S
Задание №78
Одного электрона до завершения внешнего электронного слоя не хватает атомам:
- 1. Al
- 2. Na
- 3. Cl
- 4. H
- 5. O
Задание №79
В возбужденном состоянии электронную конфигурацию внешнего энергетического уровня ns1np3 имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Задание №80
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. Si
- 3. Li
- 4. Ti
- 5. B
Задание №81
Одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Ca
- 2. F
- 3. Al
- 4. S
- 5. Na
Задание №82
К d-элементам относятся:
- 1. Ge
- 2. Te
- 3. S
- 4. Ni
- 5. Zn
Задание №83
К p-элементам относятся:
- 1. Ge
- 2. Sr
- 3. Se
- 4. Ni
- 5. Cu
Задание №84
d-Электроны содержат атомы:
- 1. Ca
- 2. P
- 3. Cu
- 4. Cl
- 5. Rb
Задание №85
Одинаковую электронную конфигурацию внешнего энергетического уровня в основном состоянии имеют наиболее распространенные изотопы элементов:
- 1. Li
- 2. Na
- 3. Al
- 4. N
- 5. С
Задание №86
Один электрон на s-подуровне внешнего энергетического уровня имеют в основном состоянии атомы:
- 1. V
- 2. Cr
- 3. Fe
- 4. Mn
- 5. Cu
Задание №87
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. O
- 2. S
- 3. Na
- 4. Mg
- 5. F
Задание №88
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. Si
- 4. Al
- 5. V
Задание №89
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. F
- 4. Ne
- 5. V
Задание №90
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Cu
- 2. V
- 3. Mg
- 4. Li
- 5. Cr
Задание №91
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np2 имеют атомы:
- 1. Se
- 2. Sn
- 3. S
- 4. Sb
- 5. Si
Задание №92
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. Zn
- 2. Ti
- 3. Sr
- 4. Cs
- 5. V
Задание №93
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. P
- 2. Ti
- 3. As
- 4. Al
- 5. B
Задание №94
Четыре неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. С
- 2. P
- 3. Al
- 4. V
- 5. Si
Задание №95
Одинаковое число валентных электронов содержат атомы:
- 1. As
- 2. V
- 3. Cl
- 4. Se
- 5. Na
Задание №96
Десять электронов на 3d-подуровне содержат атомы:
- 1. Cu
- 2. Mn
- 3. Ni
- 4. Co
- 5. Se
Задание №97
Пять электронов на 3d-подуровне содержат атомы:
- 1. Ga
- 2. Cr
- 3. As
- 4. Mn
- 5. V
Задание №98
Атомы каких химических элементов при потере двух электронов приобретают электронную конфигурацию как у благородного газа:
- 1. Ba
- 2. Al
- 3. Fe
- 4. Co
- 5. Be
Задание №99
Атомы каких химических элементов при потере одного электрона приобретают электронную конфигурацию как у благородного газа:
- 1. H
- 2. Rb
- 3. Cr
- 4. Mn
- 5. Cs
Задание №100
Наиболее стабильные анионы вида Э2- образуют химические элементы:
- 1. Ca
- 2. Zn
- 3. Se
- 4. Br
- 5. S
Задание №101
Наиболее стабильные катионы вида Э2+ образуют химические элементы:
- 1. Cl
- 2. S
- 3. Ca
- 4. Br
- 5. Zn
Разбор задания №1 ЕГЭ по химии
Система оценивания экзаменационной работы по химии
За правильный ответ на каждое из заданий 1-8, 12-16, 20, 21, 27-29 ставиться 1 балл.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Теория по заданию:
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) F 2) S 3) I 4) Na 5) Mg
Определите, атомам каких из указанных элементов в основном состоянии до завершения внешнего электронного слоя недостаёт одного электрона.
1
Решение
Восьмиэлектронная оболочка соответствует оболочке инертного газа. Для каждого из веществ в периоде котором они находятся соответствуют инерный газ, для фтора неон, для серы аргон, для йода ксенон, для натрия и магния аргон, но из перечисленных элементов, лишь фтору и йоду не хватает одного электрона до восьмиэлектронной оболочки, так как они находятся в седьмой группе.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.1) Be 2) H 3) N 4) K 5) C
Определите, атомам каких из указанных элементов в основном состоянии содержат одинаковое число неспаренных электронов.
1
Решение
Для решения данного задания необходимо расписать верхний электронный уровень элементов:4 Be Бериллий : 1s2 2s2
Число неспаренных электронов — 0
1 H Водород : 1s1
Число неспаренных электронов — 1
7 N Азот : 1s2 2s2 2p3
| 1s2 | 2s2 | 2p3 | ||
| ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
Число неспаренных электронов — 3
19 K Калий : [Ar] 4s1
Число неспаренных электронов — 1
6 C Углерод : 1s2 2s2 2p2
| 1s2 | 2s2 | 2p3 | ||
| ↑↓ | ↑↓ | ↑ | ↑ | |
Число неспаренных электронов — 2
Отсюда очевидно что для водорода и для калия число неспаренных электронов одинаково.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Ge 2) Fe 3) Sn 4) Pb 5) Mn
Определите, атомам каких из указанных в ряду элементов валентные электроны находятся как на s- так и на d-подуровнях.
1
Решение
Для решения данного задания необходимо расписать верхний электронный уровень элементов:- 32 Ge Германий : [Ar] 3d10 4s2 4p2
- 26 Fe Железо : [Ar] 3d6 4s2
- 50 Sn Олово : [Kr] 4d10 5s2 5p2
- 82 Pb Свинец : [Xe] 4f14 5d10 6s2 6p2
- 25 Mn Марганец : [Ar] 3d5 4s2
У железа и марганца валентные электроны находятся на s- и на d-подуровнях.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Br 2) Si 3) Mg 4) C 5) Al
Определите, атомам каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np3
1
Решение
Для не возбужденного состояния электронная формула ns1np3 будет представлять собой ns2np2, именно элементы такой конфигурации нам нужны. Распишем верхний электронный уровень элементов (либо простой найдем элементы четвертой группы):- 35 Br Бром : [Ar] 3d10 4s2 4p5
- 14 Si Кремний : [Ne] 3s2 3p2
- 12 Mg Магний : [Ne] 3s2
- 6 C Углерод : 1s2 2s2 2p2
- 13 Al Алюминий : [Ne] 3s2 3p1
У кремния и углерода верхний энергетический уровень совпадает с искомым
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Si 2) F 3) Al 4) S 5) Li
Определите, у наиболее распространенных изотопов каких из указанных в ряду двух элементов в составе атомного ядра число протонов равно числу нейтронов.
1
Решение
Сверим по таблице Менделеева порядковые номера элементов и их массы:- Порядковый номер 14 Si Кремний — масса 28
- Порядковый номер 9 F Фтор — масса 19
- Порядковый номер 13 Al Алюминий — масса 27
- Порядковый номер 16 S Сера — масса 32
- Порядковый номер 3 Li Литий — масса 7
Количество нейтронов равно массе элемента минус количество протонов, а количество протонов равно порядковому номеру и количеству электронов, тогда:
- Кремний — количество нейтронов равно: 28 — 14 = 14
- Фтор — количество нейтронов равно: 19 — 9 = 10
- Алюминий — количество нейтронов равно: 27 — 13 = 14
- Сера — количество нейтронов равно: 32 — 16 = 16
- Литий — количество нейтронов равно: 7 — 3 = 4
У кремния и серы количество протонов равно количеству нейтронов.
Таблица Менделеева и таблица растворимости:
Таблица Менделеева Таблица растворимостиСколько неспаренных электронов имеет атом серы в основном состоянии?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
Сколько неспаренных электронов в атоме фтора в основном состоянии?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
- Статистика
Сколько неспаренных электронов в атоме Mn?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
- Статистика
Сколько неспаренных электронов в атоме Mg?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
- Статистика
- тригонометрия

Leave A Comment