Сборка тестов по химии по теме «Строение вещества»
6 Июн
Posted on Author admin 0
Чтобы поделиться, нажимайте
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www.yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
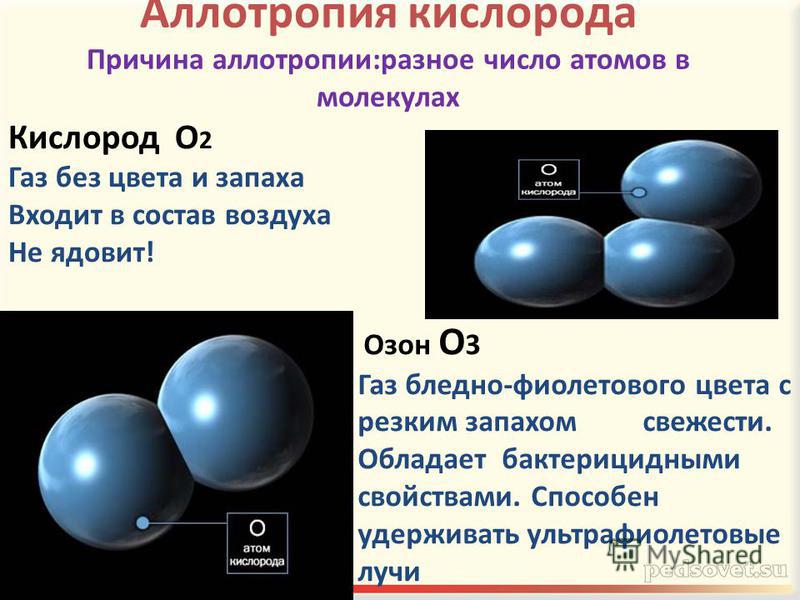
- Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ.
- Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ.
- Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород.

- Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор.
- Молекулярную кристаллическую решетку имеет: 1) фторид серы (VI), 2) сульфид натрия, 3) графит, 4) натрий.
- Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия.
- Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота.

- Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород.
- Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод.
- Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(IV).
- Молекулярное строение имеет: 1) оксид кремния(IV), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(II).

- Молекулярную кристаллическую решетку имеют: 1) H2O, CuO, 2) CuO, K2S, 3) K2S, H2SO4, 4) H2SO4, O2.
- Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота.
- Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь.
- Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.

- Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
- Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония.
- В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность.

- Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей.
- Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода.
- Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел.
- Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(IV), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(II).
- Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку.
 Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны.
Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. - Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность.
- В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (графит), 2) SiO2, 3) SiC, 4) CO2
- Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) SiH4, 3) O2, 4) Na.
- Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) NH

- Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия.
- Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия.
- Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(V), 4) хлорида цезия.

- Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия.
- Металлическую кристаллическую решетку имеет: 1) NH3, 2) AlCl3, 3) Cu3Al, 4) CuO.
- Один и тот же тип решетки в кристаллическом состоянии имеют вода и: 1) железо, 2) углекислый газ, 3) поваренная соль, 4) алмаз.
- Легкоплавкое кристаллическое вещество хорошо растворимо в этаноле и не проводит электрический ток ни в расплаве, ни в растворе. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Тугоплавкое кристаллическое вещество нерастворимо в воде и хорошо проводит теплоту и электрический ток.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Тот же тип кристаллической решетки, что и у сульфата натрия, имеет: 1) красный фосфор, 2) хлороводород, 3) серная кислота, 4) сульфид бария.
- Тот же тип кристаллической решетки, что и у натрия, имеет: 1) хлорид цинка, 2) сульфат натрия, 3) карбонат натрия, 4) золото.
- Тот же тип кристаллической решетки, что и у кислорода, имеет: 1) бром, 2) оксид натрия, 3) поваренная соль, 4) калий.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) фтор и фторид натрия, 2) хлор и хлорид калия, 3) хлорид натрия и гидроксид калия, 4) оксид хлора(VII) и гидроксид калия.

- Оксид алюминия в кристаллическом состоянии имеет тот же тип кристаллической решетки, что и: 1) алюминий, 2) кислород, 3) фтор, 4) фторид алюминия.
- Ванилин представляет собой легкоплавкое кристаллическое вещество с характерным запахом. Какой тип кристаллической решетки он имеет? 1) атомный, 2) молекулярный, 3) ионный, 4) металлический.
- Атомную решетку в кристаллическом состоянии имеет: 1) азот, 2) аммиак, 3) карбид кремния, 4) платина.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) натрий и хлорид натрия, 2) сульфат бария и барий, 3) сульфат бария и серная кислота, 4) серная кислота и оксид серы(VI).

- Для твердых веществ с молекулярной кристаллической решеткой характерна высокая: 1) плотность, 2) температура плавления, 3) летучесть, 4) энергия связи между молекулами.
- Для твердых веществ с металлической кристаллической решеткой характерна низкая: 1) теплопроводность, 2) плотность, 3) летучесть при комнатной температуре, 4) электропроводность.
- Для твердых веществ с ионной кристаллической решеткой характерна низкая: 1) температура плавления, 2) энергия связи между ионами, 3) растворимость в воде, 4) летучесть.
- Твердое вещество с ионной кристаллической решеткой расплавили.
 Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.
Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток. - Атомную кристаллическую решетку не образует: 1) кремний, 2) германий, 3) алюминий, 4) углерод.
- Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, не электропроводно, то его кристаллическая решетка: 1) молекулярная, 2) атомная, 3) ионная, 4) металлическая.
- Понятие «молекула» не применимо по отношению к структурной единице вещества: 1) хлороформа, 2) кислорода, 3) алмаза, 4) озона.

- Атомная кристаллическая решетка характерна для: 1) алюминия и карбида алюминия, 2) серы и йода, 3) оксида кремния и хлорида натрия, 4) алмаза и бора.
- Вещества, имеющие молекулярную кристаллическую решетку, как правило: 1) тугоплавкие и хорошо растворимые в воде, 2) легкоплавкие и летучие, 3) твердые и электропроводные, 4) теплопроводные и пластичные.
Ответы приведены в конце страницы.
А вот некоторые задания ЦТ и ЕГЭ с видео-объяснением:
А18 ЦТ 2010. Укажите названия веществ, в молекулах которых содержатся кратные связи и все атомы лежат в одной плоскости: а) стирол; б) фенилацетилен; в) сероводород; г) бутин-1:
- б, г
- а, г
- а, б
- б, в
А19 ЦТ 2010. Укажите название вещества, которое в твёрдом состоянии имеет атомную кристаллическую решётку:
- серная кислота
- оксид кремния (IV)
- алюминий
- водород
Досрочный ЕГЭ 2018. Из предложенного перечня веществ выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) этан;
2) азотная кислота;
3) гидроксид бария;
4) хлор;
5) аммиак;
Запишите в поле ответа номера выбранных веществ.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www. yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 2 | 1 | 1 | 4 | 1 | 1 | 3 | 1 | 4 | 3 | 4 | 4 | 1 | 1 | 3 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 1 | 2 | 4 | 3 | 3 | 4 | 3 | 1 | 2 | 2 | 1 | 4 | 1 | 1 | 3 |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 |
| 4 | 1 | 3 | 2 | 1 | 2 | 2 | 3 | 4 | 3 | 2 | 2 | 4 | 4 | 4 |
| 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| 1 | 3 | 4 | 2 | 3 | 4 | 3 | 3 | 4 | 4 | 3 | 3 | 3 | 4 | 2 |
А также вы можете проделать большое число заданий на эту тему с подробными видео-объяснениями в отдельном разделе «Химическая связь и строение вещества»
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Химия — 9
Таблица 12.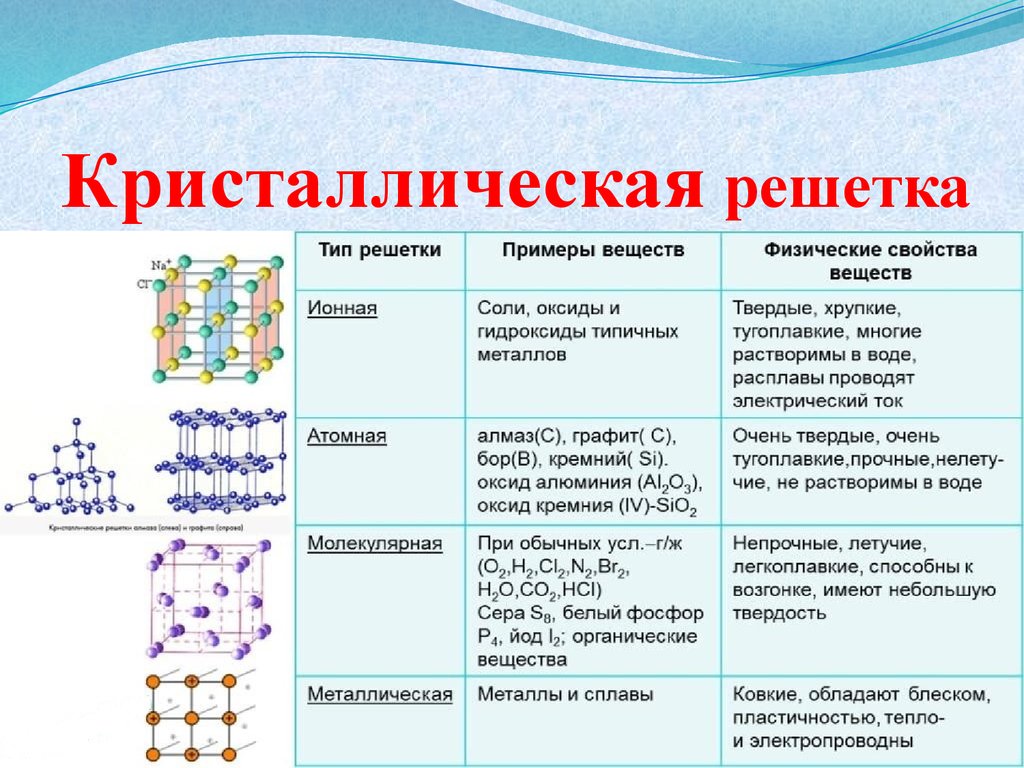 1. Положение неметаллов в Периодической системе
1. Положение неметаллов в Периодической системе
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| 1 | (h2s1 | He 1s2 | ||||||
|
ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 |
ns2np6 | |||||||
| 2 |
В главных подгруппах радиусы атомов увеличиваются, электроотрицательность убывает,
неметаллические
свойства ослабляют. |
|||||||
| 3 | ||||||||
| 4 | ||||||||
| 5 | ||||||||
| 6 | ||||||||
| 7 | ||||||||
В периоде слева направо радиусы атомов уменьшаются, электроотрицательность возрастает
неметаллические свойства усиливаются
2. Особенности строения атомов.
Особенности строения атомов.
В атомах неметаллов внешний энергетический уровень или завершен, или близок к завершению. Например, строение внешнего уровня атомов благородных газов – ns2np6 (у гелия 1s2), галогенов – ns2np5, элементов VIA подгруппы (халькогенов) – ns2np4.
При изменении электронного строения атома, металлические и неметаллические свойства элемента изменяются, как это указано в таблице 12.1.
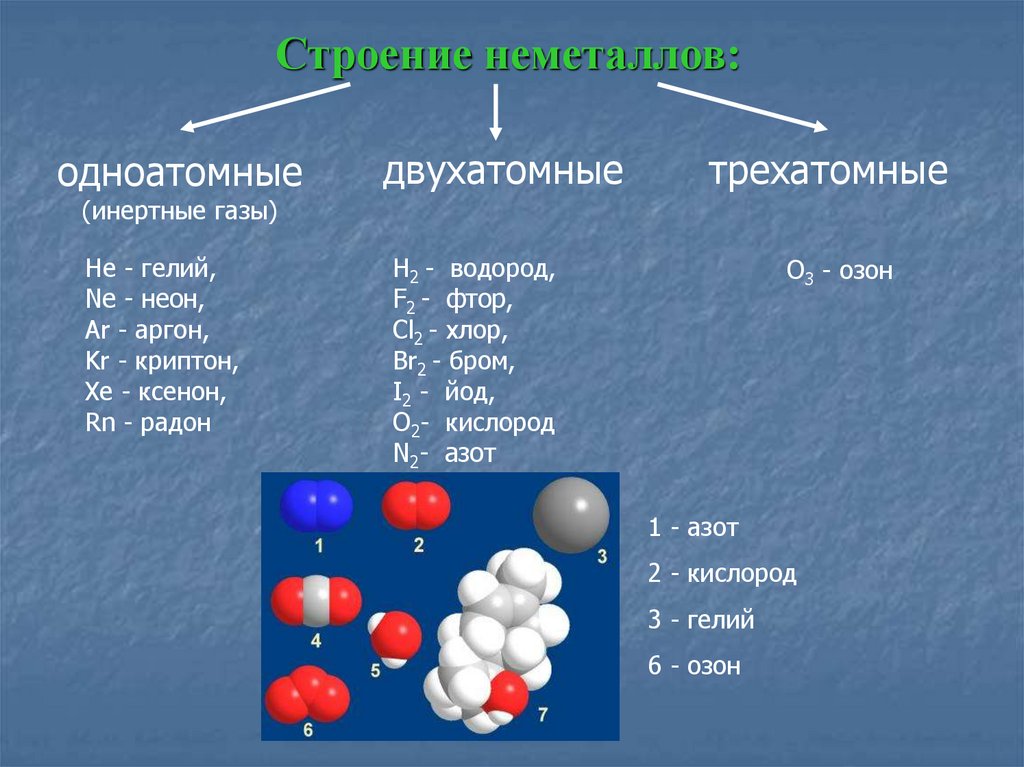
3. Особенности строения простых веществ.
Простые вещества неметаллов в твердом состоянии имеют как молекулярное, так и немолекулярное строение. К
простым веществам молекулярного
строения относятся галогены, кислород, водород, азот, озон О3, белый фосфор
Р4, кристаллическая сера S8 и др. В них силы притяжения между молекулами,
расположенными в узлах их кристаллических решеток, незначительны; поэтому
такие вещества характеризуются невысокими температурами плавления и
кипения. Например, молекулярная (кристаллическая) сера (S8) плавится примерно в области
112–119°С, белый фосфор – при 44°C, простые вещества водород, азот и кислород, взятые в жидком
состоянии, кипят в области –200°С.
В них силы притяжения между молекулами,
расположенными в узлах их кристаллических решеток, незначительны; поэтому
такие вещества характеризуются невысокими температурами плавления и
кипения. Например, молекулярная (кристаллическая) сера (S8) плавится примерно в области
112–119°С, белый фосфор – при 44°C, простые вещества водород, азот и кислород, взятые в жидком
состоянии, кипят в области –200°С.
Неметаллы с немолекулярным строением (C, Si, B или Cn, Sin, Bn) имеют атомную кристаллическую решетку. Такие вещества обладают высокой твердостью или высокой температурой плавления; например, алмаз – самое твердое вещество, а графит плавится при 3800°C.
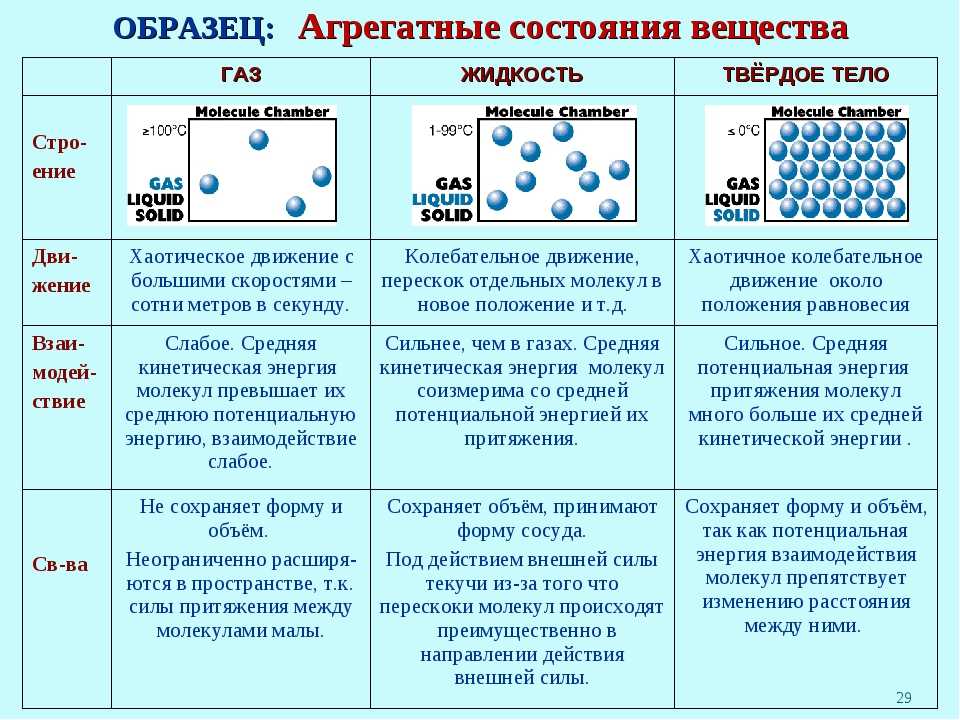
4. Особенности физических свойств твердых веществ. Неметаллы в твердом состоянии, как
правило, или диэлектрики, или плохие
проводники электричества и тепла; они не обладают пластичностью, металлическим блеском и являются
хрупкими веществами.
Неметаллы в твердом состоянии, как
правило, или диэлектрики, или плохие
проводники электричества и тепла; они не обладают пластичностью, металлическим блеском и являются
хрупкими веществами.
Шкатулка знаний • Kристаллический бор и кремний обладают полупроводниковыми свойствами. Из неметаллов графит, кристаллический йод и кремний имеют металлический блеск, а графит обладает также электропроводностью.
Молекулы в атмосфере
Элементы и молекулыПервичная атмосфера Земли, вероятно, была похожа на газовое облако, создавшее Солнце и планеты. Он состоял из водорода и гелия, а также метана, аммиака и воды. Это была восстановительная атмосфера. Не было молекулярного кислорода или других реактивных оксидов. Со временем часть этой первой атмосферы, особенно более легкие газы, испарилась и была потеряна. Возможно, при столкновении комет с поверхностью планеты прибыло больше воды. Вулканическая активность на ранней Земле вызвала серьезные изменения с выбросом водяного пара, углекислого газа и аммиака, а также небольшого количества SO 9.0008 2 , H 2 S, HCl, N 2 , NO 2 , He, Ar и другие благородные газы. Это произвело вторую атмосферу. Возможно, при столкновении комет с поверхностью планеты прибыло больше воды. Вулканическая активность на ранней Земле вызвала серьезные изменения с выбросом водяного пара, углекислого газа и аммиака, а также небольшого количества SO 9.0008 2 , H 2 S, HCl, N 2 , NO 2 , He, Ar и другие благородные газы. Это произвело вторую атмосферу.Воздействие кометы могло увеличить количество воды. Водяной пар образовал облака. Они произвели дождь. На протяжении тысячелетий жидкая вода накапливалась в виде рек, озер и океанов на поверхности Земли. Водоемы с жидкой водой действовали как поглотители углекислого газа. Химические и биологические процессы преобразовали газ CO 2 в карбонатные породы. Азот и аргон скапливались в атмосфере. Они не реагируют с водой или другими компонентами атмосферы. Кислород существовал лишь в следовых количествах до того, как зародилась жизнь. Живые существа создали большую часть третьей атмосферы, которая сейчас существует на Земле.
Азот и кислород являются наиболее распространенными газами в современной атмосфере. АзотАзот присутствует в атмосфере в основном в виде димерной молекулы N 2 . См. ниже краткую информацию об атомарном азоте. Есть два основных изотопа атомарного азота с соотношением 14 N/ 15 N = 272. Диазот чрезвычайно прочен с очень высокой теплотой диссоциации (944 кДж моль -1 ). Это бесцветный газ с температурой кипения -196°С.Процесс Габера — это метод производства аммиака, разработанный Германией во время Первой мировой войны. Немцы использовали аммиак в качестве источника азота для изготовления взрывчатых веществ. Этот процесс до сих пор используется промышленными химиками. Некоторые растения способны превращать диазот в аммиак при температуре окружающей среды посредством биохимического процесса с участием фермента нитрогеназы. Связывание в молекулярном азотеПочему N 2 такой нереактивный? Это связано с сильной тройной связью между атомами азота.КислородЖивые существа создали большую часть атмосферы, которая сейчас существует на Земле. Цианобактерии несут ответственность за повышение концентрации кислорода в атмосфере, начавшееся 2,3 миллиарда лет назад. Эти бактерии, водоросли и другие растения производят кислород путем фотосинтеза. Хотя большая часть этого кислорода используется на дыхание (биологическое окисление) или на атмосферное окисление углеродсодержащих продуктов, примерно 0,1 % органического вещества депонируется в отложениях, и это количество кислорода поступает в атмосферу. Со временем избыток кислорода накопился так, что теперь он составляет почти 20% газов, близких к Земле. Информация по кислороду представлена в таблице ниже. Атомарный кислород имеет три изотопа: 16 O (99,759 %), 17 O (0,0374 %), 18 O (0,2039 %). Наиболее распространенным видом кислорода в атмосфере является триплетный дикислород, бирадикал (температура кипения = -183°С). Синглетный молекулярный кислород диамагнетичен с двумя электронами на одной из разрыхляющих пи-орбиталей. Он имеет более высокую энергию, чем триплетный дикислород, и действует как электрофил в своих химических реакциях. Обозначения синглет/триплет возникают из-за количества переходов между спиновыми состояниями, когда молекула находится во внешнем магнитном поле. Где S — сумма всех электронных спинов, спиновое состояние = (2S + 1):
1 неспаренный электрон, дублетное состояние 2 неспаренных электрона, триплетное состояние Молекулярный кислород, O 2 , гораздо более реакционноспособен, чем молекулярный азот, N 2 . Связь между атомами O 2 значительно слабее, чем между атомами N 2 , поэтому гомолиз связи может происходить при более низкой энергии. Кроме того, в то время как диазот является диамагнитным, молекулярный кислород является парамагнитным и реагирует с другими радикалами в атмосфере. Озон или O 3 является другой аллотропной формой кислорода (температура кипения = -112°С). Это изогнутый диамагнитный вид. Озон является реактивной молекулой и играет важную роль в химии и фотохимии верхних слоев атмосферы. Фотолиз озона в стратосфере помогает защитить жизнь на Земле от высокоэнергетического УФ-излучения, а его истощение в озоновом слое в результате реакций с галогенированными соединениями вызывает серьезную озабоченность. Склеивание O2 Структуры Льюиса дают нам приблизительное представление о связи в молекулах. Это приближение не очень хорошо для молекулярного кислорода. Наилучшая структура Льюиса не указывает на свойства основного состояния молекулы: ее бирадикальную природу.
Вода, H2 О Вода присутствует в атмосфере в различных количествах, от 0 % до 4 %. В отличие от кислорода и азота, концентрация кислорода зависит от местных погодных условий и сильно меняется от места к месту на Земле. Вода в атмосфере составляет лишь очень небольшой процент от общего количества воды на Земле.В атмосфере вода существует в виде газа (водяной пар при испарении), жидкости (капли дождя и жидкой воды, покрывающей твердые частицы) и твердого тела (снег и лед). Его структура зависит от его состояния. Вода в газовой фазе имеет изогнутую структуру с углом H-O-H 104,5 градуса. Аргон, АргонАргон является одним из инертных или благородных газов. Поскольку он имеет электронную конфигурацию заполненной оболочки, аргон нереакционноспособен и присутствует в атмосфере в виде одноатомного газа. Аргон является продуктом процессов радиоактивного распада внутри Земли.
| ||||||||||||||
Здание Молекулы
Введение
Набор для сборки молекул шариков и стержней
Ковалентные связи образуются, когда электроны
распределяются между атомами. Водород, например, может разделять одну пару
электронов с другим атомом, поэтому мы говорим, что он образует одну связь.
Точно так же кислород образует два, азот обычно образует три, а углерод
формирует четыре. (Вспомните правило «HONC»… H=1, O=2, N=3, C=4, но учтите, что могут образовываться нестабильные молекулы, создавая исключения.) Соотношения
атомов в различных молекулах выражаются их химическими
формулы. Например, «Н 2 O» представляет собой воду, а
«C 6 H 12 O 6 » представляет собой глюкозу. Однако это только часть истории. В биологии форма
молекула часто так же важна, как и ее химическая формула. Ферменты, например, нуждаются в точном трехмерном
подходят к своим субстратам, точно так же, как бейсбольный мяч и поношенный
перчатка аутфилдера. В этом исследовании мы попытаемся построить молекулярные
модели некоторых распространенных веществ из биологии. В нескольких случаях
появятся необычные свойства, которые нельзя было предсказать из
плоские проекции, которые обычно рисуются на бумаге.
Водород, например, может разделять одну пару
электронов с другим атомом, поэтому мы говорим, что он образует одну связь.
Точно так же кислород образует два, азот обычно образует три, а углерод
формирует четыре. (Вспомните правило «HONC»… H=1, O=2, N=3, C=4, но учтите, что могут образовываться нестабильные молекулы, создавая исключения.) Соотношения
атомов в различных молекулах выражаются их химическими
формулы. Например, «Н 2 O» представляет собой воду, а
«C 6 H 12 O 6 » представляет собой глюкозу. Однако это только часть истории. В биологии форма
молекула часто так же важна, как и ее химическая формула. Ферменты, например, нуждаются в точном трехмерном
подходят к своим субстратам, точно так же, как бейсбольный мяч и поношенный
перчатка аутфилдера. В этом исследовании мы попытаемся построить молекулярные
модели некоторых распространенных веществ из биологии. В нескольких случаях
появятся необычные свойства, которые нельзя было предсказать из
плоские проекции, которые обычно рисуются на бумаге.
Подсказки : эфир образуется, когда кислород имеет углерод с обеих сторон. Альдегид образуется при присоединении углерода к водороду и двойной связи с кислородом. Кетон образуется, когда C=O находится в середине цепочки атомов углерода. Карбоновая кислота образуется, когда углерод соединен двойной связью с одним кислородом и присоединен ко второму кислороду группой -ОН. Группа -OH сама по себе составляет спирт .
Префиксы meth-eth-prop-but-pent-hex-hept-oct-non-dec- обозначают возрастающее количество атомов углерода от 1 до 10.
Методы
человек , используйте набор для построения молекул.
Мы будем работать с деревянными шарами, изображающими атомы. Водороды
(белый или желтый) имеют одно отверстие, кислород (красный) имеют два отверстия, азот (синий)
имеют три отверстия, а углероды (серые) имеют четыре отверстия. Используйте деревянные
дюбели для одинарного соединения и гибкая пластиковая трубка для двойного
облигации. Каждое отверстие должно быть заполнено, каждая «связка» должна быть закрыта. Для некоторых
больших примеров, может быть необходимо поделиться кусочками с
другие группы.
Используйте деревянные
дюбели для одинарного соединения и гибкая пластиковая трубка для двойного
облигации. Каждое отверстие должно быть заполнено, каждая «связка» должна быть закрыта. Для некоторых
больших примеров, может быть необходимо поделиться кусочками с
другие группы.
Поэкспериментируйте с каждым из следующих примеров, пока не удовлетворены тем, что у вас есть единственное правильное решение.
На отдельном листе бумаги нарисуйте каждый из этих примеров в виде Трехмерная форма, а не просто фигурка. Раскрасьте каждый эскиз как нужный.
Если вы делаете этот урок онлайн , используйте приложение Build a Molecule для создания молекул, перечисленных ниже. Вы будете двигаться от более простых структур к более сложным. Используйте вкладку «Большие молекулы» и нажимайте желтые стрелки, чтобы перемещаться между наборами атомов, чтобы найти тот, в котором есть все материалы, необходимые для каждой структуры. Просто перетащите атомы рядом друг с другом, и сформируется связь. Щелкните между атомами, чтобы разорвать связь. Бросайте ненужные куски обратно в лоток, и они сами разберутся. Нажмите Refill Kit, чтобы очистить весь экран. В руководстве для учителей есть больше инструкций по использованию этого инструмента, но он довольно интуитивно понятен, и вы, вероятно, сможете понять его после нескольких минут изучения.
Просто перетащите атомы рядом друг с другом, и сформируется связь. Щелкните между атомами, чтобы разорвать связь. Бросайте ненужные куски обратно в лоток, и они сами разберутся. Нажмите Refill Kit, чтобы очистить весь экран. В руководстве для учителей есть больше инструкций по использованию этого инструмента, но он довольно интуитивно понятен, и вы, вероятно, сможете понять его после нескольких минут изучения.
Соберите следующие
(Сначала попробуйте собрать их, используя только приведенные ниже подсказки. Затем проверьте свою работу, щелкнув ссылку.)
- Водород Газ — самая простая и самая маленькая из возможных молекул.
- Кислород Газ требует двойной связи.
- Озон имеет химическую формулу O 3
- Углекислый газ требует наличия двух двойных связей. (Подсказка: di- означает 2).
- Вы знакомы с водой (H 2 O), но перекись водорода , применяемая для обесцвечивания волос и дезинфекции срезов, имеет на один кислород больше.

- Добавьте один углерод в воду, и вы получите формальдегид , канцероген и консервант.
- Аммиак — простейшая молекула, состоящая из азота и водорода.
- Метан — простейшая молекула, состоящая из углерода и водорода.
- Метанол похож на метан, но также имеет один атом кислорода. Также называемый древесным спиртом, он токсичен для питья.
- Этанол имеет формулу C 2 H 6 O. (Подсказка: требуется одна связь O-H!). Этанол — это спирт, содержащийся в пиве, вине и крепких спиртных напитках.
- Диметиловый эфир представляет собой изомер этанола; то есть он имеет ту же химическую формулу, но другую структуру. (Подсказка: у него нет связи O-H!)
- Углекислота имеет формулу H 2 CO 3 и является критически важным буфером pH в вашей крови. (Подсказка: для этого требуется одна двойная связь и никаких трехатомных колец!)
- Уксусная кислота при смешивании с водой образует уксус и имеет формулу C 2 H 4 O 2
- Мочевина имеет формулу CH 4 N 2 O.
 Таким образом ваше тело выводит лишний азот из белков, которые вы едите. (Подсказка: левая и правая стороны симметричны!)
Таким образом ваше тело выводит лишний азот из белков, которые вы едите. (Подсказка: левая и правая стороны симметричны!) - Аланин — одна из самых простых аминокислот, из которых состоят белки. К его центральному углероду присоединены: атом водорода, аминогруппа (NH 2 ), метильную группу (СН 3 ) и карбоксильную группу (СО 2 Н). Посмотрите, сможете ли вы построить второй, который будет зеркальным отражением оригинала.
Обсуждение
- Почему углерод лежит в основе всех крупных примеров? Почему нет какой-то другой атом, например водород или кислород?
- Если вы нашли зеркальное отражение вашей аланиновой модели, было ли это каким-то образом вы могли бы повернуть или повернуть две версии, чтобы сделать их идентичны? Почему или почему нет?
- Почему могут существовать правосторонние и левосторонние версии аланина, а не мочевина или угольная кислота?
- Каким образом молекулы с одинаковой химической формулой, такие как этанол и диметиловый эфир, могут иметь разные физические свойства?
- Когда вино или пиво подвергаются воздействию кислорода, этанол превращается в уксусную кислоту и образуется вода.




 Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны.
Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.

 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.

 Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.
Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.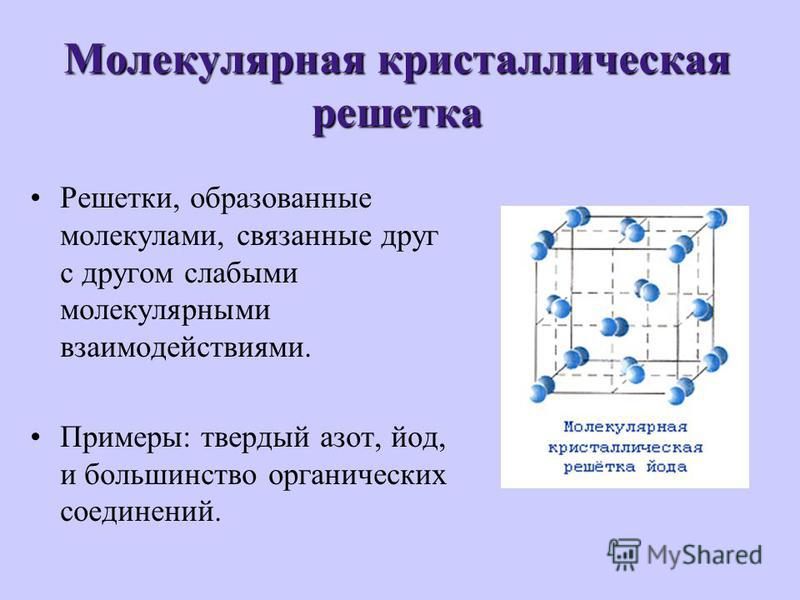
 Цианобактерии несут ответственность за повышение концентрации кислорода в атмосфере, начавшееся 2,3 миллиарда лет назад. Эти бактерии, водоросли и другие растения производят кислород путем фотосинтеза. Хотя большая часть этого кислорода используется на дыхание (биологическое окисление) или на атмосферное окисление углеродсодержащих продуктов, примерно 0,1 % органического вещества депонируется в отложениях, и это количество кислорода поступает в атмосферу. Со временем избыток кислорода накопился так, что теперь он составляет почти 20% газов, близких к Земле.
Цианобактерии несут ответственность за повышение концентрации кислорода в атмосфере, начавшееся 2,3 миллиарда лет назад. Эти бактерии, водоросли и другие растения производят кислород путем фотосинтеза. Хотя большая часть этого кислорода используется на дыхание (биологическое окисление) или на атмосферное окисление углеродсодержащих продуктов, примерно 0,1 % органического вещества депонируется в отложениях, и это количество кислорода поступает в атмосферу. Со временем избыток кислорода накопился так, что теперь он составляет почти 20% газов, близких к Земле. Другие присутствуют в небольших концентрациях. Другие более распространенные газы показаны в таблице ниже. Между первоначальной восстановительной атмосферой и нынешней окислительной атмосферой существует заметная разница.
Другие присутствуют в небольших концентрациях. Другие более распространенные газы показаны в таблице ниже. Между первоначальной восстановительной атмосферой и нынешней окислительной атмосферой существует заметная разница.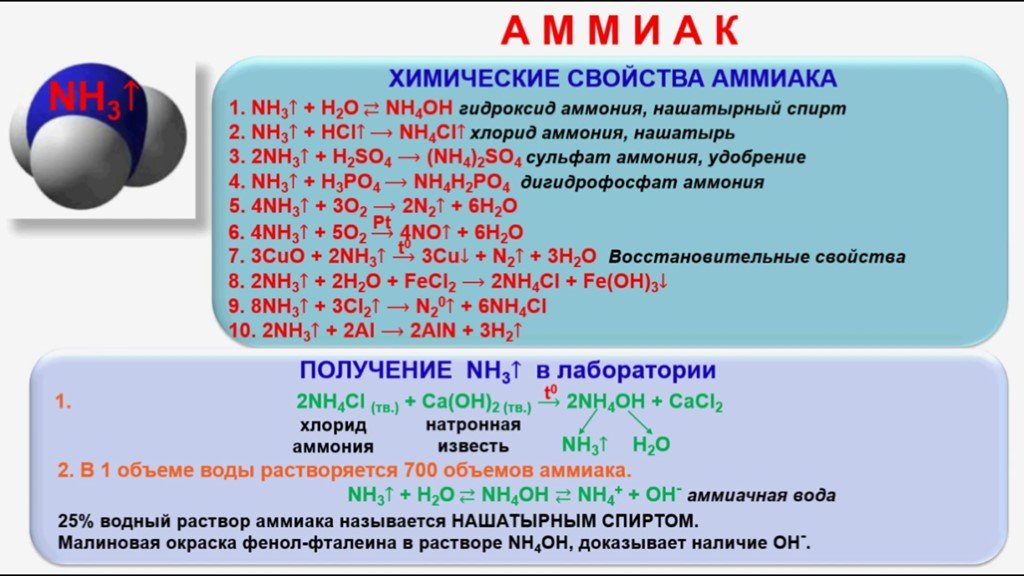 Молекулярный азот также реагирует с молекулярным кислородом во время грозы с образованием оксида азота NO. Кроме этого, практически отсутствует химия реакции N 2 в атмосфере. Это неактивный газ.
Молекулярный азот также реагирует с молекулярным кислородом во время грозы с образованием оксида азота NO. Кроме этого, практически отсутствует химия реакции N 2 в атмосфере. Это неактивный газ. Молекулы с одним или несколькими неспаренными спинами равны парамагнитны и притягиваются магнитными полями.
Молекулы с одним или несколькими неспаренными спинами равны парамагнитны и притягиваются магнитными полями. Реакционная способность озона делает его токсичным для человека. Реакции оксидов азота, углеводородов и кислорода вблизи поверхности Земли производят озон, и концентрация этого соединения часто используется в качестве меры загрязнения воздуха.
Реакционная способность озона делает его токсичным для человека. Реакции оксидов азота, углеводородов и кислорода вблизи поверхности Земли производят озон, и концентрация этого соединения часто используется в качестве меры загрязнения воздуха. В жидкой и твердой формах существуют водородные связи между атомами водорода одной молекулы H 2 O и атомами кислорода других молекул. Это дает трехмерную структуру, в которой каждый атом кислорода окружен тетраэдрическим массивом из 4 атомов водорода.
В жидкой и твердой формах существуют водородные связи между атомами водорода одной молекулы H 2 O и атомами кислорода других молекул. Это дает трехмерную структуру, в которой каждый атом кислорода окружен тетраэдрическим массивом из 4 атомов водорода.
 Таким образом ваше тело выводит лишний азот из белков, которые вы едите. (Подсказка: левая и правая стороны симметричны!)
Таким образом ваше тело выводит лишний азот из белков, которые вы едите. (Подсказка: левая и правая стороны симметричны!)
Leave A Comment