Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение.
 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен.
 Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4.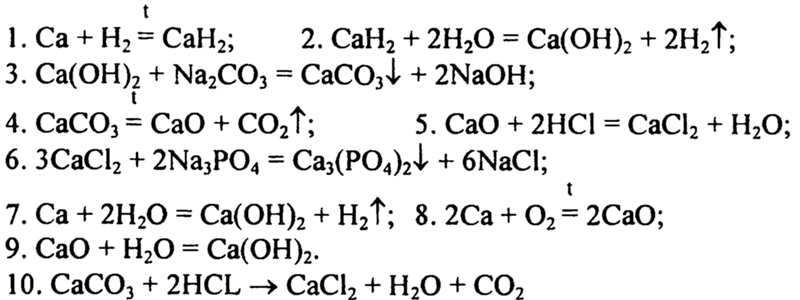 Необходимо их уравнять.
Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Какой углеводород получиться при нагревании над активированным углем пропина? Выберите один
Решено
Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями:
h3S + h3SO4 = SO2 + S + h3O МОЖНО ОВР
Решено
1) С какими из перечисленных веществ реагирует соляная кислота: нитрат калия, нитрат серебра(I), гидроксид калия, оксид углерода(IV), оксид
1. Преобразуйте схемы в уравнения реакций, укажите тип реакции. а) C + Al —> Al4C3 б) P + O2 —> P2O5 в) KClO3 —> KCl + O2 г) Fe2O3 + h3 —> Fe + h3O д) AgNO3 + CaI2 —> Ca(NO3)2 + AgI
Преобразуйте схемы в уравнения реакций, укажите тип реакции. а) C + Al —> Al4C3 б) P + O2 —> P2O5 в) KClO3 —> KCl + O2 г) Fe2O3 + h3 —> Fe + h3O д) AgNO3 + CaI2 —> Ca(NO3)2 + AgI
Пользуйтесь нашим приложением
Уравнения реакций — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31353
Ключевые слова
- Энергия, экзотермическая реакция, эндотермическая реакция
- Физические реакции, химические реакции, фазовые переходы
- Реактивы, продукты
- Стехиометрия реакции
Развитие навыков
- Отличие химических изменений от физических.

- Написать химические уравнения для описания химической реакции.
- Для расчета требуемых количеств реагентов или количеств, образующихся в результате химической реакции.
Изменения в материале или системе называются реакциями и делятся на химические и физические реакции. Энергия является движущей силой всех изменений, как физических, так и химических реакций. В этих реакциях всегда участвует энергия. Если система более стабильна, теряя часть энергии, происходит реакция с выделением энергии. Такая реакция называется экзотермической . Подача энергии в систему также вызывает реакцию. Реакции поглощения энергии называются эндотермические реакции
Уравнение можно использовать для описания физической реакции , которая включает изменение состояний.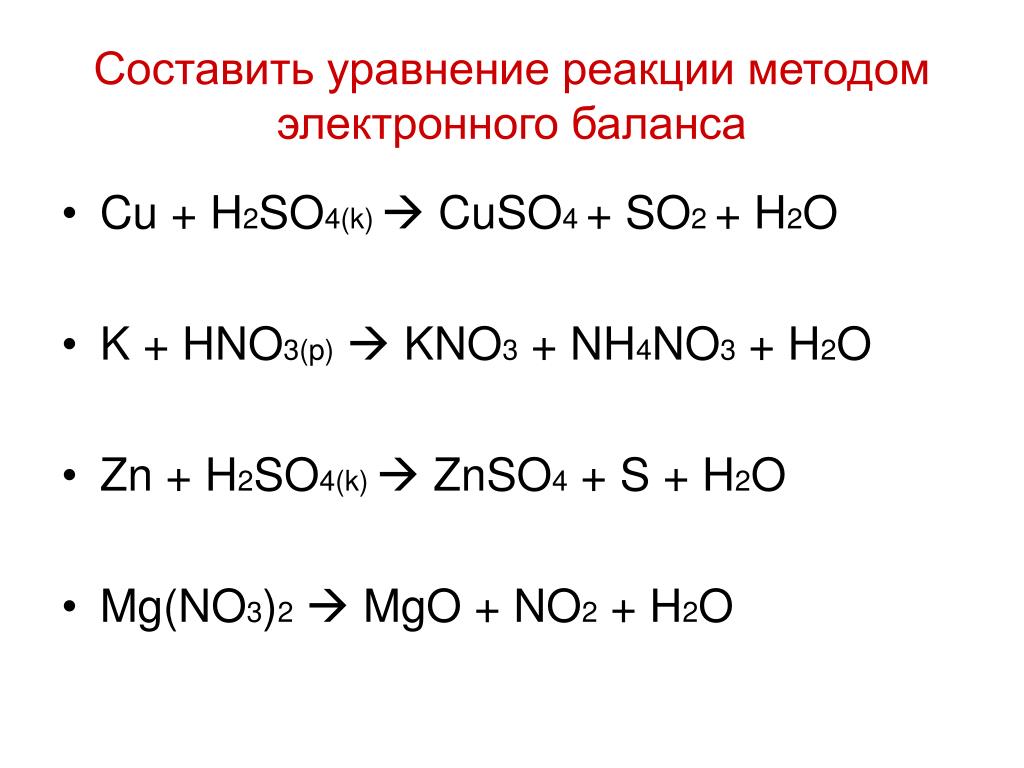 Например, плавление, сублимация, испарение и конденсация могут быть представлены следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
Например, плавление, сублимация, испарение и конденсация могут быть представлены следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
- плавление: \(\mathrm{H_2O(s) \rightarrow H_2O(l)}\)
- сублимация: \(\mathrm{H_2O(s) \rightarrow H_2O(g)}\)
- испарение: \(\mathrm{C_2H_5OH(l) \rightarrow C_2H_5OH(g)}\)
- конденсация: \(\mathrm{NH_3(g) \rightarrow NH_3(l)}\)
При этих изменениях химические связи не разрываются и не образуются, а молекулярная идентичность веществ не меняется.
Является ли фазовый переход между графитом и алмазом химической или физической реакцией?
\(\ mathrm{C(графит) \rightarrow C(алмаз)}\).
Кристаллические структуры алмаза и графита сильно различаются, и связи между атомами углерода также различаются в двух твердых состояниях. Поскольку химические связи разрываются и образуются новые связи, фазовый переход алмаза и графита представляет собой химическую реакцию.
Химические вещества или вещества изменяются, превращаясь в одно или несколько других веществ, и эти изменения называются химическими реакциями . На молекулярном уровне атомы или группы атомов перестраиваются, что приводит к разрыву и образованию некоторых химических связей в химической реакции. Вещества, претерпевающие изменения, называются реагентов , тогда как вновь образовавшиеся вещества называются продуктами . Внешний вид продуктов часто отличается от реагентов. Химические реакции часто сопровождаются появлением газа, огня, осадка, цвета, света, звука или запаха. Эти явления связаны с энергией и свойствами реагентов и продуктов. Например, при окислении пропана выделяется тепло и свет, а быстрая реакция — взрыв,
\(\mathrm{C_3H_8 + 5 O_2 \rightarrow 3 CO_2 + 4 H_2O}\)
Сбалансированное уравнение также показывает макроскопическую количественную зависимость. Это сбалансированное уравнение реакции показывает, что пять молей кислорода реагируют с одним молем пропана, образуя три моля углекислого газа и четыре моля воды, всего 7 молей продуктов реакции горения.
На молекулярном уровне это уравнение показывает, что на каждую молекулу пропана требуется 5 молекул кислорода. Три атома углерода превращаются в три молекулы углекислого газа, тогда как 8 атомов водорода в пропане окисляются до 4 молекул воды. Количество атомов \(\ce{H}\), \(\ce{C}\) и \(\ce{O}\) одинаково в обеих частях уравнения.
Мы изучаем свойства веществ, чтобы знать, как их использовать. Склонность вещества реагировать как с самим собой, так и с другими веществами является важным химическим свойством. Под свойствами мы понимаем химические реакции, которые лучше всего изучаются путем экспериментов и наблюдений. Проведя множество экспериментов, вы можете обобщить некоторые правила и факты. Знание этих правил и фактов позволяет решать проблемы, с которыми вы еще не сталкивались.
Наиболее важным аспектом химической реакции является знание того, что является реагентами и что является продуктами. Для этого лучшим описанием реакции является написание уравнения реакции. А 9Уравнение химической реакции 0048 дает реагенты и продукты, а сбалансированное уравнение химической реакции показывает соотношение молей реагентов и продуктов. Часто указывается количество энергии, участвующей в реакции. Рассмотрение количественного аспекта химических реакций называется стехиометрией реакции .
А 9Уравнение химической реакции 0048 дает реагенты и продукты, а сбалансированное уравнение химической реакции показывает соотношение молей реагентов и продуктов. Часто указывается количество энергии, участвующей в реакции. Рассмотрение количественного аспекта химических реакций называется стехиометрией реакции .
Например, при нагревании ракушек \(\ce{CaCO3}\) будет выделяться газ \(\ce{CO2}\), в результате чего останется белый порошок (твердый \(\ce{CaO}\) ) позади. Уравнение реакции записывается так:
\[\mathrm{CaCO_3 \rightarrow CaO + CO_2}\]
Уравнение показывает, что один моль \(\ce{CaCO3}\) дает по одному молю каждого из \(\ce{CaO}\) и \(\ce{CO2}\). Количества веществ, представленные химическими формулами, были введены на двух предыдущих страницах, и эти понятия должны помочь выяснить стехиометрию реакций, когда дано уравнение реакции.
Пример 1
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \(\ce{CaO}\), сколько оксида кальция должно быть получено? Если получается только 5,0 г \(\ce{CaO}\), каков фактический выход?
ПОДСКАЗКА
В идеальных условиях количество вещества в уравнении реакции указано ниже: \:100. 0 &&\:\:56 &&\:44\:\:\: \mathrm{г/моль\: (формула\: веса)}
0 &&\:\:56 &&\:44\:\:\: \mathrm{г/моль\: (формула\: веса)}
\end{alignat}\)
\[\mathrm{10.0 \: г\: CaCO_3\times\dfrac{1\: моль\: CaCO_3}{100\: г\: CaCO_3}\times\dfrac{1\: моль\: CaO}{1\: моль\: CaCO_3} \times\dfrac{56\: г\: CaO}{1\: моль\: CaO}= 5,6\: г\: CaO}\]
ОБСУЖДЕНИЕ
Здесь приведено неэффективное преобразование, но метод показывает детали рассмотрения. Если количество полученного \(\ce{CaO}\) не равно 5,6 г, можно сделать вывод, что образец может быть нечистым.
Пример 2
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \(\ce{CaO}\), сколько выделяется \(\ce{CO2}\) при стандартных условиях?
ПОДСКАЗКА
\[\mathrm{CaCO_3 \rightarrow CaO + CO_2}\]
\[\mathrm{10,0\: г\: CaCO_3\times\dfrac{1\: моль\: CO_2}{100\: г\: CaCO_3}\times\dfrac{22,4\: L\: CO_2}{ 1\:моль\:CO_2}= 2,24\:L\:CO_2}\]
ОБСУЖДЕНИЕ
В этой формулировке мы сделали более короткий путь по сравнению с примером 1. Примеры 1 и 2 иллюстрируют оценку величин в г и в л.
Примеры 1 и 2 иллюстрируют оценку величин в г и в л.
Написание уравнений химических реакций
Уравнения химических реакций действительно представляют изменения материалов. Для многих реакций мы можем написать уравнения только для общих реакций. Например, здравый смысл подсказывает нам, что при полном окислении сахара конечными продуктами являются углекислый газ и вода. Реакция окисления аналогична реакции горения. Таким образом, мы пишем
\[\ce{C12h32O11 + 12 O2 \rightarrow 12 CO2 + 11 h3O}\]
Это иллюстрирует методы, используемые для написания сбалансированных уравнений реакции:
- Определите реагенты и продукты : В этом случае продукты \(\ce{CO2}\) и \(\ce{h3O}\), определяемые здравым смыслом. Мы знаем это.
- Применить фундаментальный принцип сохранения атомов. Количество атомов каждого вида должно быть одинаковым до и после реакции.
- Сбалансируйте один тип атомов в времени : Для начала мы можем использовать \(\ce{H}\) или \(\ce{C}\).
 Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\).
Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\). - Баланс атомов кислорода с обеих сторон: Всего 35 атомов \(\ce{O}\) справа, и коэффициент для \(\ce{O2}\) должен быть 11.
Пример 3
Соединение \(\ce{N2O5}\) нестабильно при комнатной температуре. Он разлагается с образованием коричневого газа \(\ce{NO2}\) и кислорода. Напишите сбалансированное уравнение химической реакции его разложения.
ПОДСКАЗКА
Первый шаг — написать несбалансированное уравнение, указывающее только реагент и продукты:
\[\ce{N2O5 \rightarrow NO2 + O2}\]
A \(\ce{N2O5}\ ) распадается на две молекулы \(\ce{NO2}\) и половину молекулы \(\ce{O2}\).
\[\ce{N2O5 \rightarrow 2 NO2 + \dfrac{1}{2}O2}\]
Чтобы получить в уравнении целое число стехиометрических коэффициентов , умножим все стехиометрические коэффициенты на 2. Этот пример иллюстрирует шаги, используемые при написании сбалансированного уравнения для химической реакции. Это сбалансированное уравнение не говорит нам, как разлагается молекула \(\ce{N2O5}\), оно только иллюстрирует общую реакцию.
Этот пример иллюстрирует шаги, используемые при написании сбалансированного уравнения для химической реакции. Это сбалансированное уравнение не говорит нам, как разлагается молекула \(\ce{N2O5}\), оно только иллюстрирует общую реакцию.
Пример 4
При смешивании растворов \(\ce{CaCl2}\) и \(\ce{AgNO3}\) образуется белый осадок. Такой же осадок наблюдается и при смешивании раствора \(\ce{NaCl}\) с раствором \(\ce{AgCh4CO2}\). Напишите сбалансированное уравнение реакции между \(\ce{CaCl2}\) и \(\ce{AgNO3}\).
ПОДСКАЗКА
Общими ионами между \(\ce{NaCl}\) и \(\ce{CaCl2}\) являются ионы \(\ce{Cl-}\) и \(\ce{Ag+ }\) ионы являются общими для двух соединений, содержащих серебро. Вопрос иллюстрирует научную дедукцию, используемую при определении продуктов. Продукт \(\ce{AgCl}\), а сбалансированная реакция 92+}\) и \(\ce{NO3-}\) — иона-спектатора.
Химические реакции
Одной из самых важных тем в химии является химическая реакция . На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
- Избыток и ограничение Реагенты или реагенты, оставшиеся или израсходованные
- Особенности химических реакций или классификация реакций
- Химическая кинетика или скорость реакции
- Механизм реакции или как на самом деле протекает реакция
Балансировка окислительно-восстановительных реакций
Балансировка уравнений реакций окисления и восстановления немного сложнее, чем то, что мы обсуждали здесь. Вы должны обладать навыками определения степеней окисления, объяснения окисления и восстановления с точки зрения изменения степени окисления и написания уравнений полуреакций. Тогда вы сможете сбалансировать окислительно-восстановительные реакции. Все это дано в следующем модуле по химическим реакциям.
Проблемы развития навыков
- Какой продукт(ы) содержит(ют) углерод при сжигании метана, \(\ce{Ch5}\) , на воздухе?
Подсказка: \(\ce{CO2}\)
Обобщение:
Сгорание соединений, содержащих \(\ce{C}\), превращает все \(\ce{C}\) в \(\ce{CO2}\).
- Используйте метод здравого смысла, чтобы найти молекулярную формулу сероводорода, молекулярная масса которого составляет 34,1. (атомный вес, \(\ce{H}\) , 1,008; \(\ce{S}\) , 32.066)
Подсказка: \(\ce{h3S}\)
Обобщение:
Сера и кислород являются элементами группы 6, и они образуют \(\ce{h3O}\) и \(\ce{h3S}\).
- При нагревании 30,0 г \(\ce{Al}\) (атомный вес 27,0) в кислороде (атомный вес 16,0) образуется оксид алюминия \(\ce{Al2O3}\) , сформировался. Сколько оксида должно быть получено?
Совет: 56,7 г
Вариант A:
Сколько (в г) требуется кислорода?
- При нагревании \(\ce{KClO3}\) он разлагается с образованием твердого вещества \(\ce{KCl}\) и газообразного кислорода. Если собрать 0,500 моль \(\ce{O2}\) , сколько граммов \(\ce{KCl}\) должно получиться? (Атомная масса: \(\ce{K}\) , 39,098; \(\ce{Cl}\) , 35,453)
Совет: 24,9 г
Рекомендуемый метод:
Для реакции: \(\ce{2 KClO3 \rightarrow 2 KCl + 3 O2}\)
предложенная формулировка:
\(\mathrm{0,50\: моль\: O_2 \times\dfrac{2\: моль\: KCl}{3\: моль\: O_2}\times\dfrac{74,6\: г\: KCl}{1 \: моль\: KCl}=\: ??. -}\). 9-}{1\:моль\:BaSO_4}= 0,113\:моль}\)
-}\). 9-}{1\:моль\:BaSO_4}= 0,113\:моль}\)
- Электростанция сжигает уголь, и этот процесс эквивалентен сжиганию 999 кг серы в день. Сколько килограммов \(\ce{SO2}\) выбрасывается в день, если на электростанции нет устройств для очистки от загрязнений для извлечения серы? Атомная масса: \(\ce{C}\) , 12,00; \(\ce{O}\) , 16.00; \(\ce{S}\) , 32.06.
Подсказка: 1998 кг
Дальнейшее рассмотрение:
Молекулярная масса \(\ce{SO2}\) примерно в два раза больше атомной массы \(\ce{S}\). Таким образом, вес \(\ce{SO2}\) вдвое больше веса \(\ce{S}\).
Варианты: Сколько (в молях и л) \(\ce{SO2}\) образуется в день?
Если весь \(\ce{SO2}\) превратить в \(\ce{h3SO4}\), сколько (в молях и кг) серной кислоты получится? (3055 кг)
- Сколько молей воды образуется при сжигании одного моля пропана \(\ce{C3H8}\) в избыточном количестве воздуха?
Подсказка: 4 моля; \(\ce{C3H8 + 5 O2 \rightarrow 3 CO2 + 4 h3O}\)
Навык:
Составьте сбалансированное уравнение реакции.
Варианты:
Сколько граммов воды будет произведено?
Сколько молей \(\ce{CO2}\) будет произведено?
- Смесь, содержащая \(\ce{Na2SO4}\) , но не содержащая других сульфатов, анализируется осаждением с \(\ce{BaCl2}\) . Образец смеси массой 2,37 г давал осадок \(\ce{BaSO4}\) массой 2,57 г. Каково процентное содержание \(\ce{Na2SO4}\) в смеси?
Подсказка: 66,0%
Навык:
Задача иллюстрирует стратегию химического анализа.
- Предположим, что смесь 2,33 г \(\ce{CaCl2}\) и \(\ce{Ca(NO3)2}\) дает 2,22 г \(\ce{AgCl}\) когда \(\ce{Ag(NO3)}\) используется в качестве реагента для осаждения ионов хлорида \(\ce{Cl-}\) . Каково процентное содержание \(\ce{CaCl2}\) в смеси?
Подсказка: 36,9%
Атомный вес: \(\ce{N}\) , 14.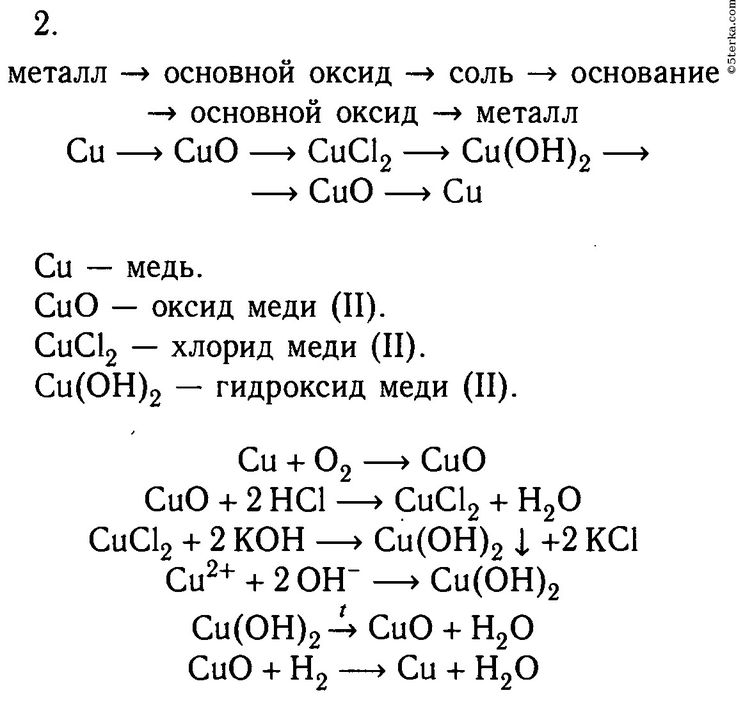 0; \(\ce{O}\) , 16,0; \(\ce{Cl}\) , 35,5; \(\ce{Ca}\) , 40,1; \(\ce{Ag}\) , 107.9.
0; \(\ce{O}\) , 16,0; \(\ce{Cl}\) , 35,5; \(\ce{Ca}\) , 40,1; \(\ce{Ag}\) , 107.9.
Навык:
Эта задача также иллюстрирует стратегию химического анализа.
Авторы и авторство
Reaction Equations распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- сбалансированное уравнение химической реакции
- химические изменения
- Химические реакции
- конденсат
- эндотермический
- эндотермическая реакция
- энергия
- Энергия равна
- испарение
- экзотермический
- экзотермическая реакция
- плавка
- степени окисления
- степень окисления
- Фазовый переход
- фазовых переходов
- физические изменения
- Физические реакции
- Реагенты
- Уравнения реакций
- Стехиометрия реакции
- Реакции
- стехиометрия
- сублимация
Как написать химическое уравнение?
Как написать химическое уравнение?
Все химические реакции представлены химическими уравнениями . Химическое уравнение представляет собой сокращенное представление химической реакции с использованием символов и формул вещества, участвующего в химической реакции.
Химическое уравнение представляет собой сокращенное представление химической реакции с использованием символов и формул вещества, участвующего в химической реакции.
Символы и формулы веществ (элементов или соединений) расположены так, чтобы показать реагенты и продукты химической реакции.
Химическая реакция происходит, когда исходные вещества вступают в реакцию с образованием новых веществ.
(a) Исходные вещества называются реагентами .
(b) Образовавшиеся новые вещества называются продуктами .
В уравнении реагенты записываются слева, а продукты — справа.
Например:
Люди также спрашивают
- Что такое относительная атомная масса и относительная молекулярная масса элемента?
- Что такое один моль и сколько частиц содержится в моле?
- Как рассчитать молярную массу вещества?
- Каков молярный объем газа при СТП?
- Как узнать порядок элементов в химической формуле
- Что такое эмпирическая и молекулярная формулы?
Составление химических уравнений
1. Согласно закону сохранения массы материя не может быть ни создана, ни уничтожена. Это означает, что количество атомов до и после химической реакции одинаково. Следовательно, химическое уравнение должно быть сбалансировано.
Согласно закону сохранения массы материя не может быть ни создана, ни уничтожена. Это означает, что количество атомов до и после химической реакции одинаково. Следовательно, химическое уравнение должно быть сбалансировано.
2. В таблице ниже показано, как можно составить химическое уравнение.
Таблица: Составление химического уравнения.
| Реакция: Железные опилки реагируют с хлоридом меди(II) с образованием раствора хлорида железа(III) и меди. | |
| Этап | Объяснение и пример |
| Определите реагенты, продукты и их формулы. | Реагенты: железо, Fe и хлорид меди(II), CuCl 2 Продукты: хлорид железа(III), FeCl 3 и медь, Cu |
| Напишите основную часть уравнения. | Fe + CuCl 2 ⟶ FeCl 3 + Cu Реагенты Продукты |
Определите число атомов каждого элемента в обеих частях уравнения. | Левая сторона Правая сторона Атом Fe: 1 Атом Fe: 1 Атом Cu: 1 Атом Cu: 1 Атом Cl: 2 |
| Сбалансируйте уравнение, регулируя коэффициенты. (Примечание: коэффициенты — это числа перед формулами.) | Атомы Cl сбалансированы. Fe + 3CuCl 2 ⟶ 2FeCl 3 + Cu В результате количество атомов Fe и Cu не сбалансировано. Затем атомы Fe уравновешиваются. 2Fe + 3CuCl 2 ⟶ 2FeCl 3 + Cu Наконец, атомы Cu сбалансированы. 2Fe + 3CuCl 2 ⟶ 2FeCl 3 + 3Cu |
| Убедитесь, что уравнение сбалансировано. | левая сторона правой стороны Fe Atom: 2 Fe Atom: 2 Cu Атом: 3 куб. |
| Укажите государственный символ каждого вещества. | 2Fe(s) + 3CuCl 2 (водн.) ⟶ 2FeCl 3 (водн.) + 3Cu(s) |
3. Символы состояния (s), (l) и (g) обозначают твердом, жидком и газообразном состояниях соответственно. Символ (aq) представляет собой водный раствор.
Символ (aq) представляет собой водный раствор.
4. Иногда для обозначения выхода газа используется символ «↑».
5. Иногда над стрелкой пишут «△», чтобы показать, что нагревание необходимо для осуществления химической реакции.
Правила написания химического уравнения:
При написании химического уравнения необходимо соблюдать определенные правила.
- Реагенты, участвующие в реакции, записываются их символами или молекулярными формулами в левой части уравнения.
- Знак плюс (+) добавляется между формулами реагентов.
- Продукты реакции записываются их символами или молекулярными формулами в правой части уравнения.
- Знак плюс (+) добавляется между формулами продуктов.
- Между реагентами и продуктами вставлена стрелка (⟶), указывающая, в каком направлении протекает реакция.
A + B ⟶ C + D
В этом химическом уравнении A и B — реагенты, а C и D — продукты. Стрелка указывает на то, что реакция протекает в направлении образования C и D.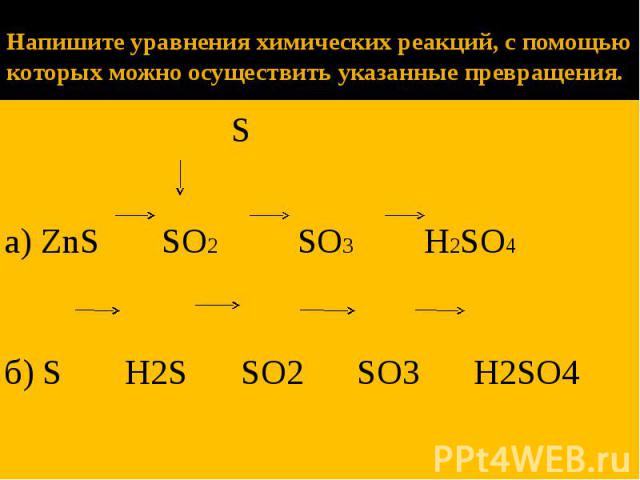
Как сбалансировать химические уравнения?
Первым шагом в балансировке уравнения является подсчет количества атомов каждого элемента в обеих частях уравнения. Например, реагенты X и Y 2 вступают в реакцию с образованием соединения XY. Уравнение слова для этой реакции будет
X + Y 2 ⟶ XY
Количество атомов элементов X и Y в вышеупомянутом уравнении показано ниже.
| Element | Number of atoms in LHS | Number of atoms in RHS |
| X | 1 | 1 |
| Y | 2 | 1 |
To balance Y с обеих сторон, умножьте RHS на 2, т. е.
X + Y 2 ⟶ 2XY
Теперь сбалансировано количество атомов Y, но не количество атомов X. Следовательно, умножьте X на левой стороне на 2. Таким образом, уравнение станет
2X + Y 2 ⟶ 2XY
Это сбалансированное уравнение, поскольку количество атомов X и Y с обеих сторон одинаково.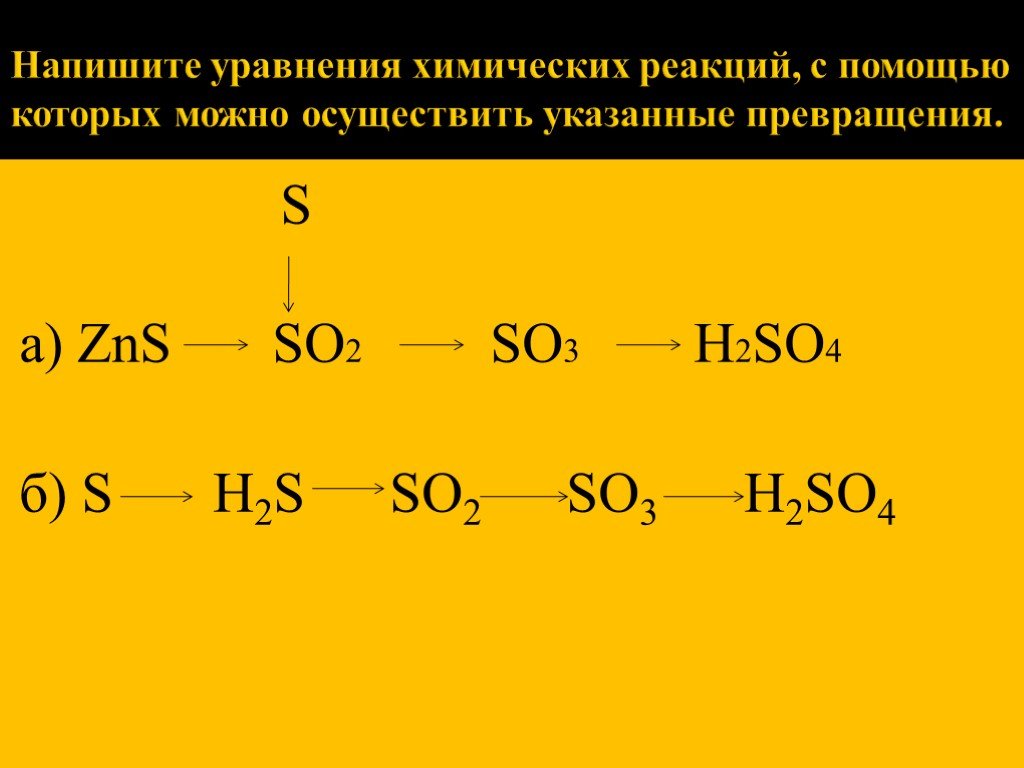
Помня об этих шагах, давайте теперь напишем химическое уравнение образования оксида магния.
Шаг 1: Магний сгорает в кислороде с образованием оксида магния. Здесь реагентами являются магний и кислород. Продукт представляет собой оксид магния.
Шаг 2: Таким образом, уравнение слова
Магний + Кислород ⟶ Оксид магния
Шаг 3: Заменив названия символами и формулами, получим химическое уравнение вида
Mg + O 2 ⟶ MgO
Шаг 4: Число of atoms of the elements are
| Element | Number of atoms in LHS | Number of atoms in RHS |
| Magnesium | 1 | 1 |
| Oxygen | 2 | 1 |
Чтобы уравновесить кислород с обеих сторон, умножьте RHS на 2, т. е.
Mg + O 2 ⟶ 2MgO
Теперь количество атомов кислорода сбалансировано, а количество атомов магния – нет. Следовательно, умножьте магний на левой шкале на 2. Таким образом, уравнение станет следующим:
Таким образом, уравнение станет следующим:
2Mg + O 2 ⟶ 2MgO
Это сбалансированное химическое уравнение.
Составление сбалансированных химических уравнений
Цель: Составление сбалансированных химических уравнений.
Материалы: порошок карбоната меди(II), известковая вода, концентрированная соляная кислота, концентрированный раствор аммиака
, раствор нитрата свинца(II) и раствор йодида калия.
Аппаратура: Пробирки, пробки, резиновая пробка с трубкой подачи, держатель пробирок, горелка Бунзена и стеклянная трубка.
Процедура:
A. Нагревание карбоната меди(II)
- Половину шпателя с порошком карбоната меди(II) помещают в пробирку.
- Устройство установлено, как показано на рисунке.
Рисунок: Нагрев карбоната меди(II) - Карбонат меди(II) нагревают, а образовавшийся газ пропускают через известковую воду.

- Наблюдаются изменения карбоната меди(II) и известковой воды.
- Когда реакция завершится, подающую трубку извлекают из известковой воды и снимают горелку Бунзена.
B. Образование хлорида аммония
- С помощью стеклянной трубки в пробирку капают три или четыре капли концентрированной соляной кислоты. Пробирку закрывают пробкой и оставляют на несколько минут.
- Используя чистую стеклянную пробирку, повторите шаг 1, используя концентрированный раствор аммиака.
- Обе пробки снимаются, а горлышки пробирок соединяются, как показано на рисунке.
- Все наблюдения записываются.
C. Осаждение йодида свинца(II)
- 2 см 3 раствора йодида калия добавляют к 2 см 3 раствора нитрата свинца(II), как показано на рисунке.
- Смесь встряхивают и наблюдают за любыми изменениями.
Наблюдения:
| Разрез | Наблюдение | Вывод |
Изменение цвета меди с зеленого на черный.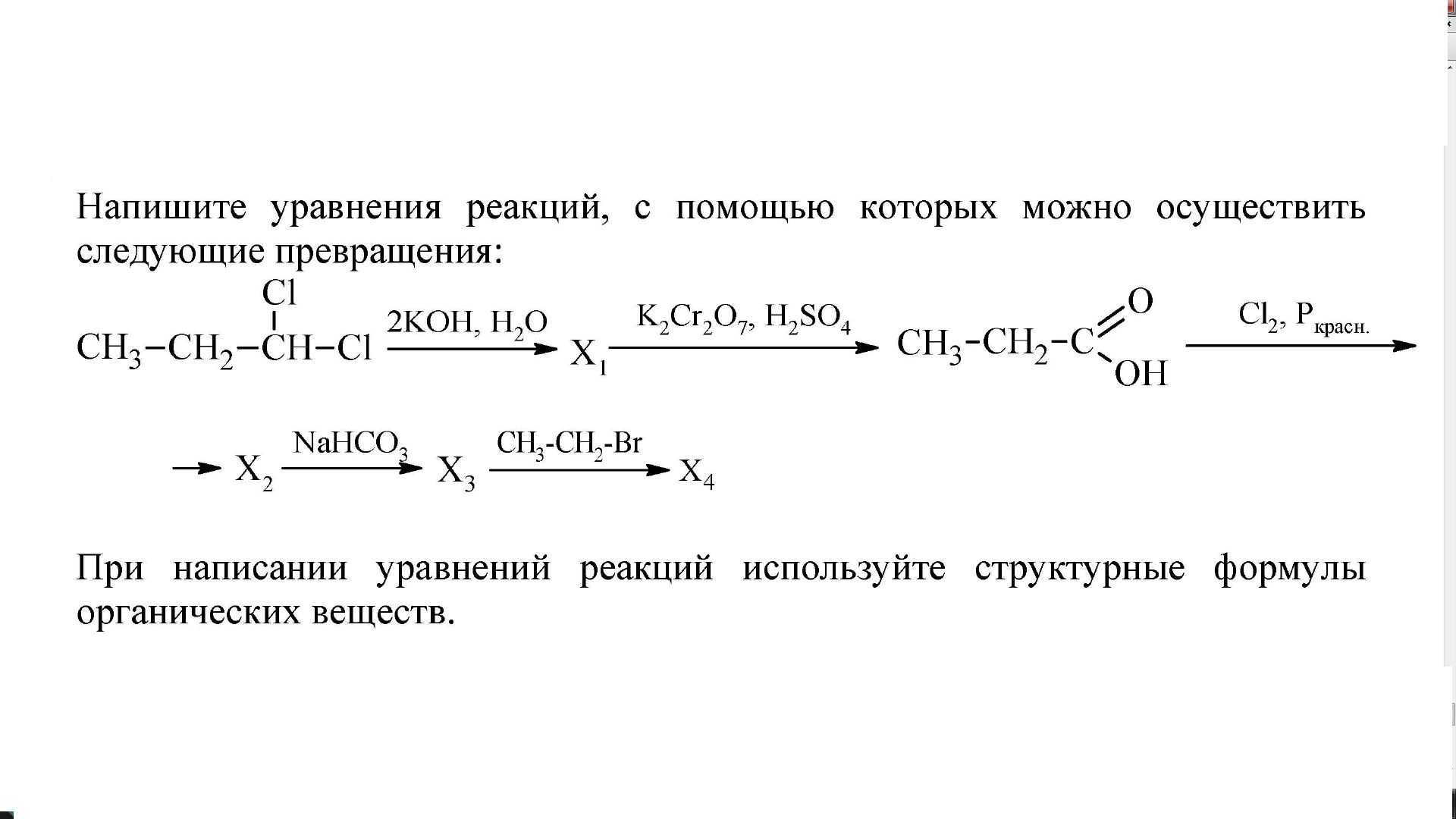 Известковая вода мутнеет. | Карбонат меди(II) разлагается на оксид меди(II), который имеет черный цвет. Выделяется углекислый газ. | |
| B | На горлышке пробирки образуется густой белый дым. | Белый дым представляет собой твердый хлорид аммония. |
| C | Образуется желтый осадок. | Желтый осадок представляет собой йодид свинца(II). |
Обсуждение:
- При нагревании карбонат меди(II) разлагается на оксид меди(II) и углекислый газ. Наличие углекислого газа определяется по известковой воде.
- Таким образом, сбалансированное уравнение для нагревания карбоната меди(II) имеет вид
- Концентрированная соляная кислота и концентрированный раствор аммиака оставляются на несколько минут для образования газообразного хлористого водорода и газообразного аммиака соответственно.
- Когда газообразный хлористый водород и газообразный аммиак объединяются, они реагируют с образованием мелких белых твердых частиц хлорида аммония.
 Они выглядят как густой белый дым.
Они выглядят как густой белый дым. - Сбалансированное уравнение образования хлорида аммония:
- При добавлении бесцветного раствора нитрата свинца(II) к бесцветному раствору йодида калия образуется желтый осадок йодида свинца(II). При этом также образуется бесцветный раствор нитрата калия.
- Сбалансированное уравнение для осаждения йодида свинца(II)
Качественные и количественные аспекты химических уравнений
- Химические уравнения дают нам следующую качественную информацию.
(а) Реагенты и продукты химической реакции.
(b) Физические состояния реагентов и продуктов. - В качестве примера возьмем следующее уравнение.
2C(т) + O 2 (г) ⟶ 2CO(г)
Из уравнения мы знаем, что реагентами являются твердый углерод и газообразный кислород. Продуктом реакции является угарный газ. - В количественном отношении коэффициенты в сбалансированном уравнении сообщают нам точные пропорции реагентов и продуктов в химической реакции.


 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду: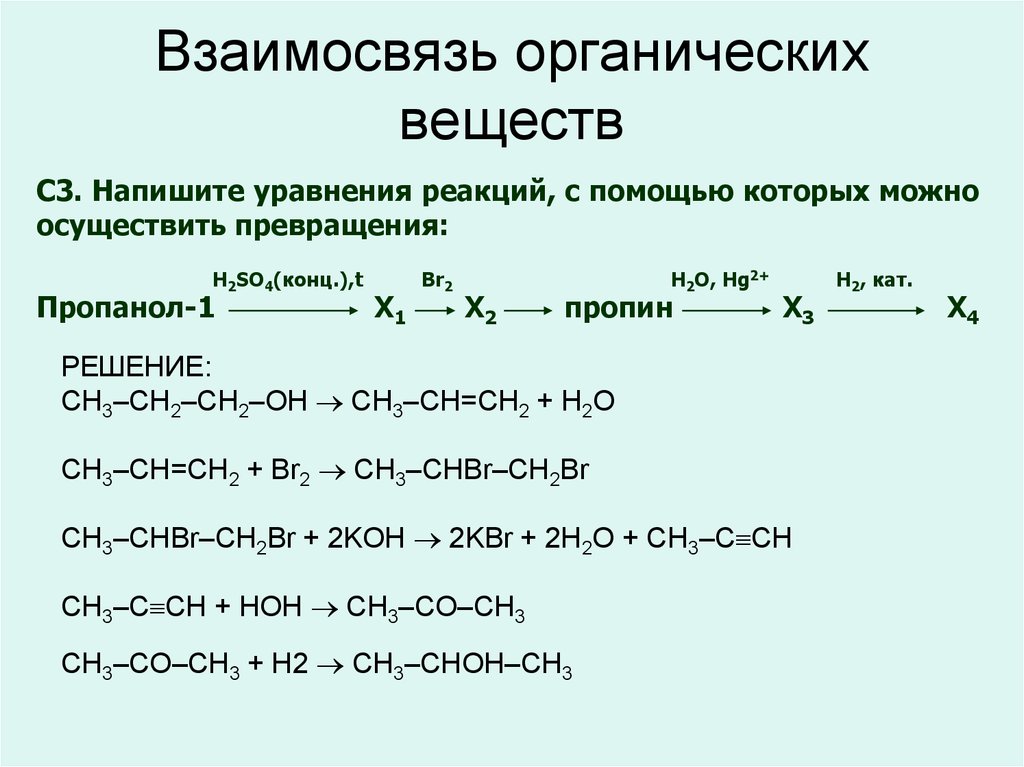 Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.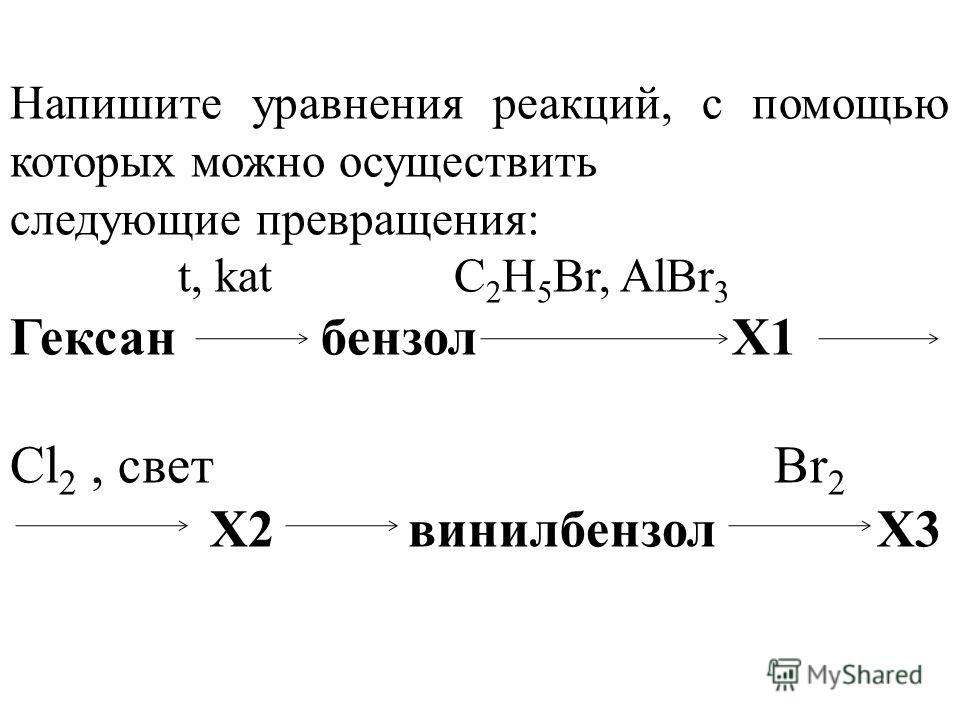 2 CuS + 3 O2 → 2 CuO + 2 SO2
2 CuS + 3 O2 → 2 CuO + 2 SO2  11.20
11.20
 Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\).
Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\).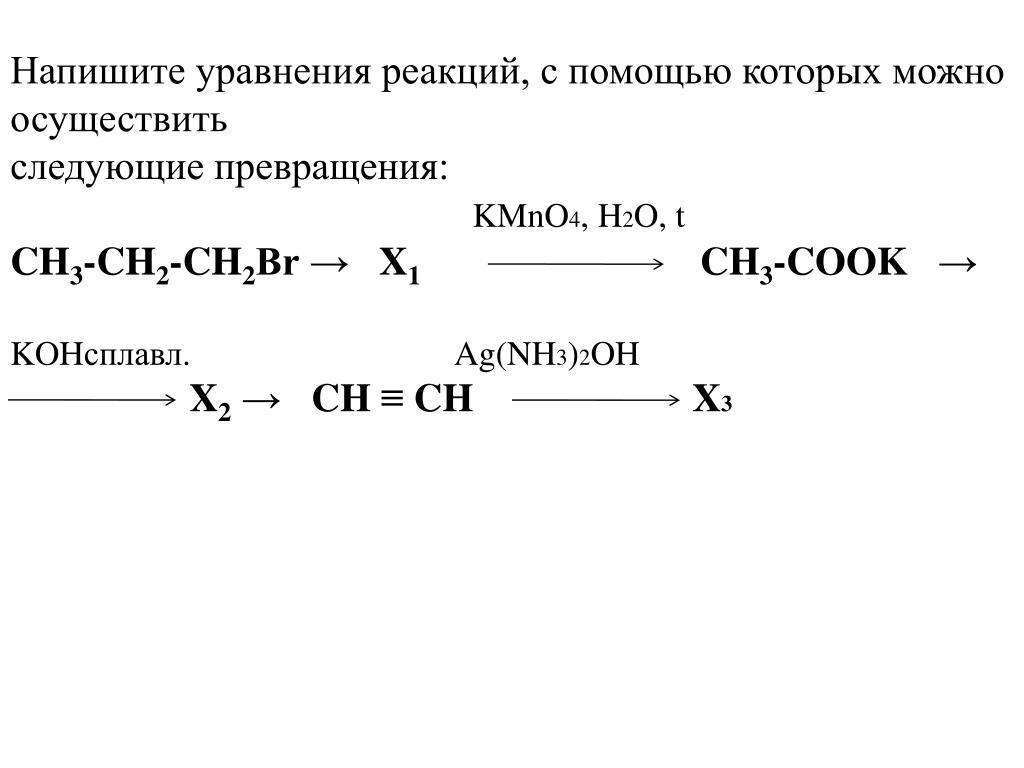

 Они выглядят как густой белый дым.
Они выглядят как густой белый дым.
Leave A Comment