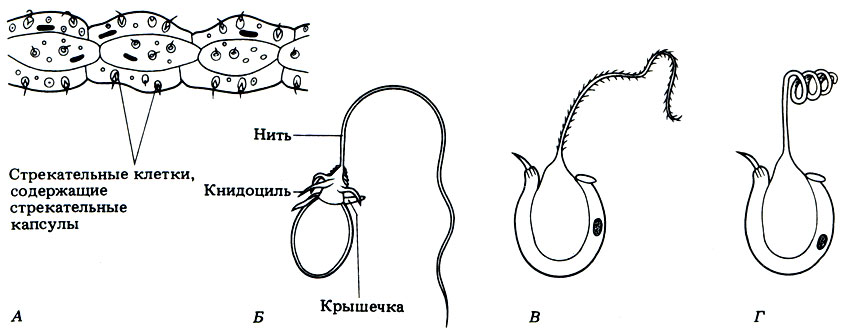
Особенно большое число стрекательных клеток у гидры находится на
Ваш ответ
| Отображаемое имя (по желанию): |
| Отправить мне письмо на это адрес если мой ответ выбран или прокомментирован:Отправить мне письмо если мой ответ выбран или прокомментирован |
Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений. |
| Анти-спам проверка: |
Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь. |
1 Ответ
0 голосов
Похожие вопросы
Наибольшее скопление стрекательных клеток у гидры
спросил от Вопросы и ответы в категории Животные, Растения
Яд стрекательных клеток по своему действию на организм крупных животных напоминает яд
спросил от Вопросы и ответы в категории Животные, Растения
На большое число городов в эпоху средневековья были сосредоточены
спросил от аноним в категории Образование
Разделите число 30 прямо пропорционально числам 1, 2 и 7. Найдите большое число?
Найдите большое число?
спросил от aiko в категории Өлеңдер, тақпақтар музыка тексттері
Непереваренные остатки пищи у гидры выбрасываются через
спросил от Айман в категории Животные, Растения
У гидры способны выпускать ложноножки клетки
спросил от Вопросы и ответы в категории Животные, Растения
Регенерация у гидры — это
спросил от Вопросы и ответы в категории Животные, Растения
Регенерацию у гидры обеспечивают клетки
спросил от Вопросы и ответы в категории Животные, Растения
Пищеварение у гидры
спросил от Вопросы и ответы в категории Животные, Растения
Первое число > 2-го на 4. разность м/у квадратами 1-го и 2-го равна 56.
разность м/у квадратами 1-го и 2-го равна 56.
спросил от aiko в категории Другое
Одно число меньше друг на 5. разность м/у квадратами меньшего и большего = 85
спросил от aiko в категории Өлеңдер, тақпақтар музыка тексттері
Количество ядер у клеток поперечнополосатых мышц
спросил от Вопросы и ответы в категории Животные, Растения
Число шейных позвонков у человека
спросил от Вопросы и ответы в категории Животные, Растения
Число пестиков в цветке у лилейных
спросил от Вопросы и ответы в категории Животные, Растения
Поврежденное место на теле гидры зарастает, благодаря клеткам
спросил от Вопросы и ответы в категории Животные, Растения
Тип Губки.
 Тип Кишечнополостные.
Тип Кишечнополостные.Тип Губки. Тип Кишечнополостные
А1.По способу питания большинство кишечнополостных являются
1) сапротрофами 2) хищниками 3) паразитами 4) фототрофами
А2.Лучевой симметрии тела НЕ имеет
1) медуза-корнерот 2) белая планария 3) пресноводная гидра 4) красный коралл
А3.Коралловые рифы образуются в результате жизнедеятельности
1) кишечнополостных 2) простейших 3) бурых водорослей 4) моллюсков
А4.Двустороннюю симметрию тела имеет
1) медуза 2) гидра 3) планария 4) актиния
А5.Тело кишечнополостных состоит из
1) одной клетки 2) одного слоя клеток 3) двух слоев клеток 4) трех слоев клеток
А6.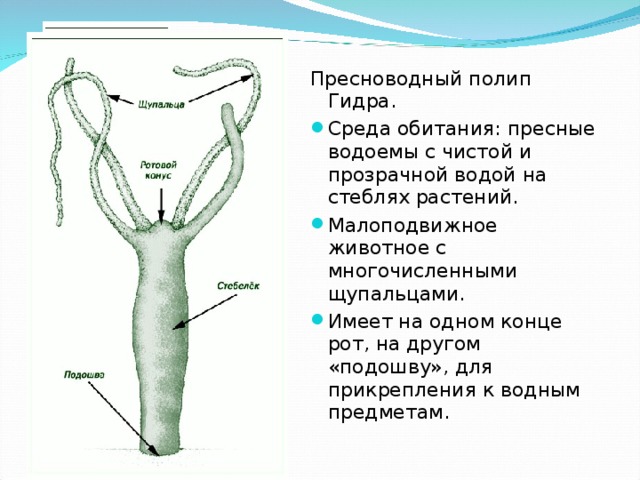 Какое животное размножается почкованием?
Какое животное размножается почкованием?
1) белая планария 2) пресноводная гидра 3) дождевой червь 4) большой прудовик
А7.Гидра получила название в честь чудовища греческой мифологии, у которого на месте отрубленных голов вырастали новые, так как она
1) размножается половым способом
2) способна к регенерации
3) удерживает добычу с помощью щупалец
4) парализует добычу стрекательными клетками
А8.Ответная реакция организма гидры на действие внешних раздражителей
1) регенерация 2) оплодотворение 3) рефлекс 4) почкование
А9.Колонии кораллов образуют животные, которые относятся к типу
1) моллюсков 2) кишечнополостных 3) ланцетников 4) простейших
А10. В состав эктодермы гидры не входит
В состав эктодермы гидры не входит
1) кожно-мускульные клетки
2) стрекательные клетки
3) нервные клетки
4) пищеварительные клетки
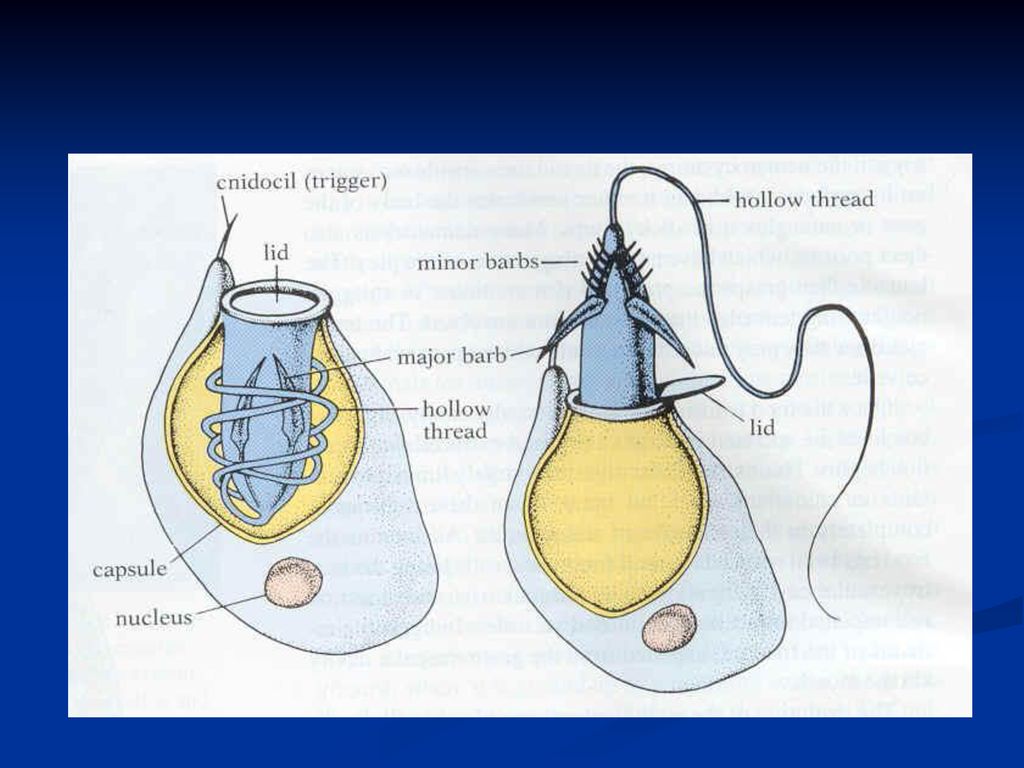
А11.Наибольшее скопление стрекательных клеток у гидры
1) у рта и на подошве
2) у рта и на стебельке тела
3) у рта и на щупальцах
4) у рта и на стенках кишечной полости
А12.Гидра обитает в
1) пресных водоёмах с быстрым течением
2) пресных водоёмах со стоячей водой
3) опреснённых лиманах
4) морях и океанах
А13.Кишечная (гастральная) полость медуз
1) простая мешкообразная
2) разделённая на передний и задний отделы
3) разветвлённая
4) не выражена
А14. По способу питания медузы
По способу питания медузы
1) хищники 2) паразиты 3) фильтраторы 4) растительноядные
А15.Тело кишечнополостных
1) не имеет клеточного строения
2) состоит из одной клетки
3) состоит из эктодермы, энтодермы и мезодермы
4) состоит из эктодермы и энтодермы
А16.Лучевую симметрию имеет
1) речная гидра 2) планария 3) ланцетник 4) рачок дафния
А17.Стрекательных клеток нет у
1) кольчатого червя нереиды 2) гидры 3) актинии 4) медузы аурелии
А18.У медузы нет
1) эктодермы 2) мезодермы 3) энтодермы 4) нервных клеток
А19. Гидра дышит
Гидра дышит
1) при помощи воздушных мешков
2) при помощи трахеи
3) жабрами
4) поглощая растворённый в воде кислород всей поверхностью тела
А20.Среди коралловых полипов есть гермафродиты, то есть животные
1) с признаками женского организма
2) с признаками мужского организма
3) обоеполые
4) однополые
А21.Какую функцию выполняют стрекательные клетки
1) дыхательную 2) движения 3) защитную 4) пищеварительную
А22.Стрекательные клетки характерны для представителей типа
1) моллюсков 2) кишечнополостных 3) членистоногих 4) хордовых
А23. Пресноводную гидру относят к типу Кишечнополостные, так как она
Пресноводную гидру относят к типу Кишечнополостные, так как она
1) питается плавающими животными
2) имеет два слоя клеток: эктодерму и энтодерму
3) обитает в пресном водоёме
4) реагирует на действие раздражителей
А24.Клетки, похожие на изображенные на рисунке, есть у
1) инфузории–туфельки
2) эвглены зеленой
3) амебы дизентерийной
4) пресноводной гидры
А25. Прикреплённый образ жизни ведёт
1) рак-отшельник 2) коралловый полип 3) амёба обыкновенная 4) аскарида человеческая
А26.Какой тип нервной системы характерен для кишечнополостных животных?
1) узловаяя 2) трубчатая 3) стволоваяя 4) диффузная
А27.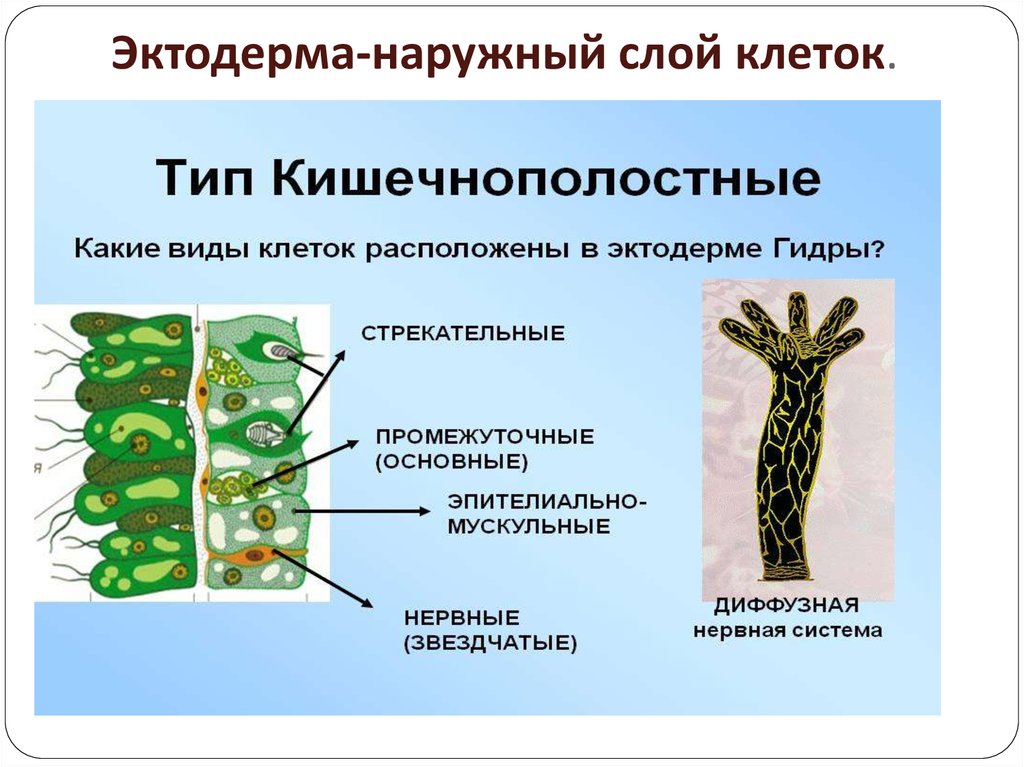 Какой признак отсутствует у кишечнополостных?
Какой признак отсутствует у кишечнополостных?
1) размножение почкованием
2) лучевая симметрия
3) многоклеточность
4) третий зародышевый листок
А28.Животных, для которых характерно как полостное, так и внутриклеточное пищеварение, относят к
1) кишечнополостным 2) моллюскам 3) кольчатым червям 4) инфузориям
Архитектура и механизм действия стрекательной органеллы книдарий
1. Тардент П. Книдоцит книдарий, высокотехнологичное клеточное оружие. Биоэссе. 1995; 17: 351–362. doi: 10.1002/bies.950170411. [CrossRef] [Google Scholar]
2. Озбек С., Баласубраманян П.Г., Гольштейн Т.В. Строение книдоцисты и биомеханика отделяемого. Токсикон. 2009;54:1038–1045. doi: 10.1016/j.toxicon.2009.03.006. [PubMed] [CrossRef] [Google Scholar]
3. Tardent P, Holstein T. Морфология и морфодинамика нематоцисты stenotele Hydra аттенуата Pall. (Hydrozoa, Cnidaria) Cell Tissue Res. 1982; 224: 269–290. doi: 10.1007/BF00216873. [PubMed] [CrossRef] [Google Scholar]
Морфология и морфодинамика нематоцисты stenotele Hydra аттенуата Pall. (Hydrozoa, Cnidaria) Cell Tissue Res. 1982; 224: 269–290. doi: 10.1007/BF00216873. [PubMed] [CrossRef] [Google Scholar]
4. Бекманн А., Озбек С. Нематоцисты: молекулярная карта стрекательных органелл кишечнополостных. Междунар. Дж. Дев. биол. 2012; 56: 577–582. doi: 10.1387/ijdb.113472ab. [PubMed] [CrossRef] [Google Scholar]
5. Tardent, P. The Biology of Nematocysts 309–332 (Academic Press, Сан-Диего, Калифорния, 1988).
6. Уотсон Г.М., Хессингер Д.А. Механорецепторы книдоцитов настраиваются на движения плавающей добычи с помощью хеморецепторов. Наука. 1989;243:1589–1591. doi: 10.1126/science.2564698. [PubMed] [CrossRef] [Google Scholar]
7. Лотан А., Фишман Л., Лойя Ю., Злоткин Е. Доставка нематоцистного токсина. Природа. 1995; 375:456. дои: 10.1038/375456a0. [PubMed] [CrossRef] [Google Scholar]
8. Лотан А., Фишман Л., Злоткин Е. Компартментация и доставка токсина в Cnidaria: трубочка нематоцисты как многоголовая ядовитая стрела.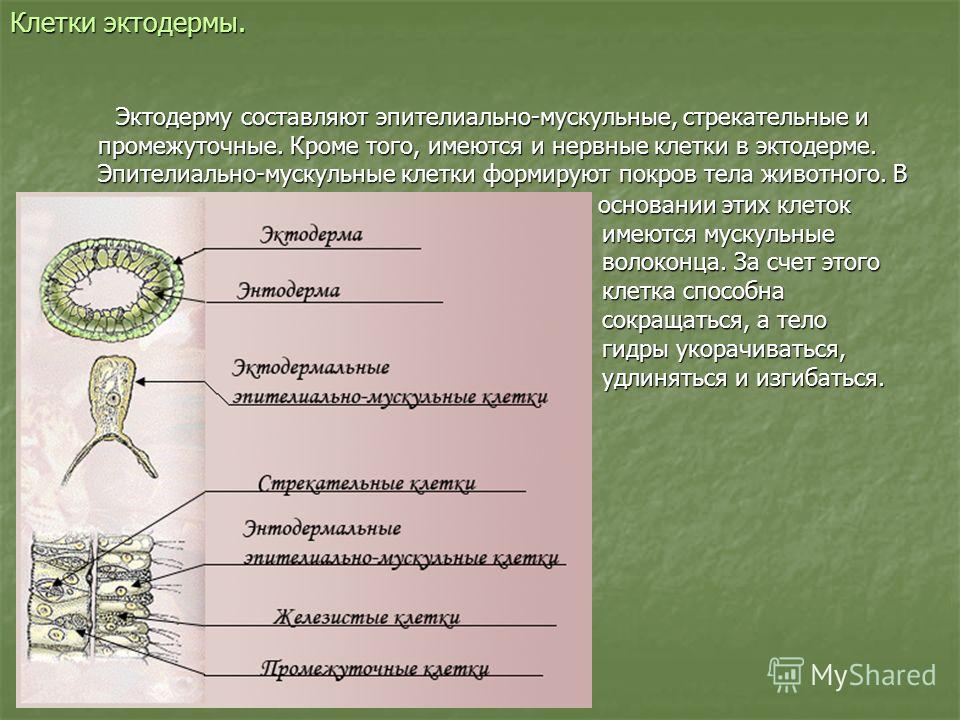 Дж. Эксп. Зоол. 1996; 275:444–451. doi: 10.1002/(SICI)1097-010X(19960815)275:6<444::AID-JEZ6>3.0.CO;2-O. [PubMed] [CrossRef] [Академия Google]
Дж. Эксп. Зоол. 1996; 275:444–451. doi: 10.1002/(SICI)1097-010X(19960815)275:6<444::AID-JEZ6>3.0.CO;2-O. [PubMed] [CrossRef] [Академия Google]
9. Касс-Саймон Г. Поведенческая физиология и физиология развития нематоцист. Может. J. Zool.-Rev. Канадиен Де. Зоология — Кан. Дж. Зул. 2002; 80: 1772–1794. doi: 10.1139/z02-135. [CrossRef] [Google Scholar]
10. Moran Y, et al. Анализ содержания растворимого белка в нематоцистах модели морского анемона проливает свет на эволюцию яда. Мар. Биотехнолог. 2013;15:329–339. doi: 10.1007/s10126-012-9491-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Гольштейн Т., Тардент П. Сверхскоростной анализ экзоцитоза: выделение нематоцист. Наука. 1984;223:830–833. doi: 10.1126/science.6695186. [PubMed] [CrossRef] [Google Scholar]
12. Нухтер Т., Бенуа М., Энгель У., Озбек С., Гольштейн Т.В. Кинетика выброса нематоцист в наносекундном масштабе. Курс. биол. 2006; 16: Р316–318. doi: 10.1016/j.cub.2006.03.089. [PubMed] [CrossRef] [Google Scholar]
13. Sakes A, et al. Механизмы стрельбы в природе: систематический обзор. ПЛОС Один. 2016;11:e0158277. doi: 10.1371/journal.pone.0158277. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Sakes A, et al. Механизмы стрельбы в природе: систематический обзор. ПЛОС Один. 2016;11:e0158277. doi: 10.1371/journal.pone.0158277. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Gavelis GS, et al. Гонка микробных вооружений: баллистические «нематоцисты» у динофлагеллят представляют собой новую крайность в сложности органелл. науч. Доп. 2017;3:e1602552. doi: 10.1126/sciadv.1602552. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
15. Weber J. Поли(гамма-глутаминовая кислота) являются основными составляющими нематоцист Hydra (Hydrozoa, Cnidaria) J. Biol. хим. 1990; 265:9664–9669. doi: 10.1016/S0021-9258(19)38721-6. [PubMed] [CrossRef] [Академия Google]
16. Вебер Дж. Новый вид полианионов как основных компонентов кишечнополостных нематоцист. Комп. Биохим. Физиол. Часть А: Физиол. 1991; 98: 285–291. doi: 10.1016/0300-9629(91)90534-J. [CrossRef] [Google Scholar]
17. Годкнехт А., Тардент П. Выделение и механизм действия щупальцевых нематоцист Anemonia sulcata (Anthozoa: Cnidaria) Mar. Biol. 1988; 100: 83–92. doi: 10.1007/BF00392958. [CrossRef] [Google Scholar]
Biol. 1988; 100: 83–92. doi: 10.1007/BF00392958. [CrossRef] [Google Scholar]
18. Beckmann A, et al. Шелкоподобный эластомер с быстрой отдачей способствует наносекундному разряду нематоцист. БМС Биол. 2015;13:3. дои: 10.1186/с12915-014-0113-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Carre D. Hypotèse sur le mecanisme de l’evagination du filament urticant des cnidocystes. Евро. Дж. Клеточная биология. 1980; 20: 265–271. [PubMed] [Google Scholar]
20. Park, S. et al. Жало нематоцисты приводится в движение канальцем, движущимся вперед. JR Soc. Интерфейс 14 , 20160917 (2017). [Бесплатная статья PMC] [PubMed]
21. Weill, R. Contribution a l’etude des cnidaires et de leurs nématocystes (Laboratoire d’Evolution des Ítres organisÈs: Les presses universitaires de France, 1934).
22. Östman C. Руководство по номенклатуре и классификации нематоцист, а также некоторые примечания о систематическом значении нематоцист.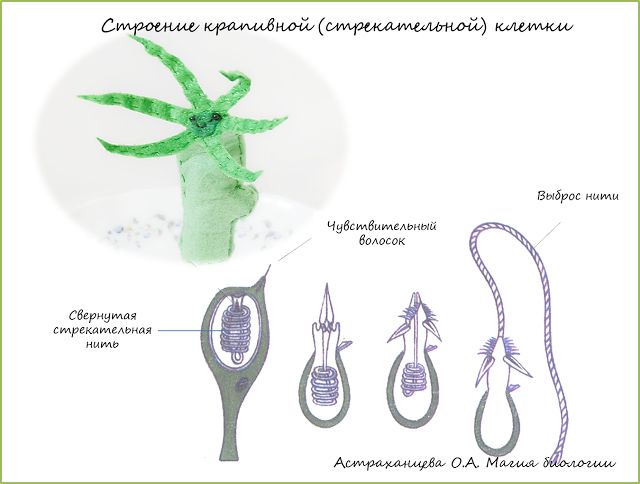 науч. март 2000 г .; 64: 31–46. doi: 10.3989/scimar.2000.64s131. [CrossRef] [Google Scholar]
науч. март 2000 г .; 64: 31–46. doi: 10.3989/scimar.2000.64s131. [CrossRef] [Google Scholar]
23. Фаутин Д.Г. Структурное разнообразие, систематика и эволюция cnidae. Токсикон. 2009;54:1054–1064. doi: 10.1016/j.toxicon.2009.02.024. [PubMed] [CrossRef] [Академия Google]
24. Zenkert C, Takahashi T, Diesner MO, Ozbek S. Морфологический и молекулярный анализ Nematostella vectensis cnidom. ПЛОС Один. 2011;6:e22725. doi: 10.1371/journal.pone.0022725. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Babonis LS, Martindale MQ. PaxA, но не PaxC, необходим для развития книдоцитов у актинии Nematostella vectensis . Еводево. 2017;8:14. doi: 10.1186/s13227-017-0077-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Уотсон Г.М., Марискал Р.Н. Ультраструктура выделений нематоцист из щупалец морского анемона Haliplanella luciae (Cnidaria: Anthozoa) Tissue Cell. 1985; 17: 199–213. doi: 10.1016/0040-8166(85)-8.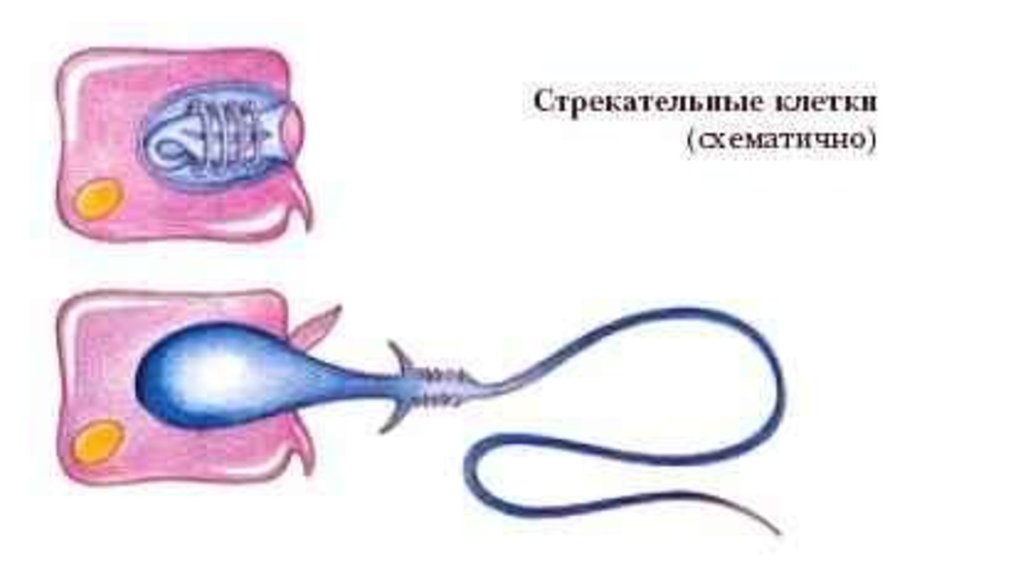 [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
27. Рефт А.Дж., Вестфолл Дж.А., Фаутин Д.Г. Формирование апикальных створок у нематоцист актиний (cnidaria: actiniaria) Biol. Бык. 2009; 217: 25–34. doi: 10.1086/BBLv217n1p25. [PubMed] [CrossRef] [Академия Google]
28. Рефт А.Дж., Дейли М. Морфология, распространение и эволюция апикальной структуры нематоцист в гексакораллиях. Дж. Морфол. 2012; 273:121–136. doi: 10.1002/jmor.11014. [PubMed] [CrossRef] [Google Scholar]
29. Skaer RJ, Picken LE. Структура нити нематоцист и геометрия отделяемого в corynactis viridis allman. Филос. Транс. Р. Соц. Лонд. биол. науч. 1965; 250: 131–164. doi: 10.1098/rstb.1965.0022. [CrossRef] [Google Scholar]
30. Hwang JS, et al. Нематогалектин, белок нематоцист с доменами GlyXY и галектин, демонстрирует специфический для нематоцитов альтернативный сплайсинг в Гидра . проц. Натл акад. науч. США. 2010;107:18539–18544. doi: 10.1073/pnas.1003256107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Watson GM, Hessinger DA. Книдоциты и соседние опорные клетки образуют рецепторно-эффекторные комплексы в щупальцах актиний. Тканевая клетка. 1989; 21:17–24. doi: 10.1016/0040-8166(89)
Watson GM, Hessinger DA. Книдоциты и соседние опорные клетки образуют рецепторно-эффекторные комплексы в щупальцах актиний. Тканевая клетка. 1989; 21:17–24. doi: 10.1016/0040-8166(89)
32. Aerne B, Stidwill R, Tardent P. Выделение нематоцисты в Hydra не требует наличия нервных клеток. Дж. Эксп. Зоол. — Дж. Эксп Зоол. 1991;258:137–141. doi: 10.1002/jez.1402580115. [CrossRef] [Google Scholar]
33. Westfall JA, Landers DD, McCallum JD. Различные нематоциты имеют разные синапсы у морского анемона Aiptasia pallida (Cnidaria, Anthozoa) J. Morphol. 1998; 238:53–62. doi: 10.1002/(SICI)1097-4687(199810)238:1<53::AID-JMOR4>3.0.CO;2-O. [PubMed] [CrossRef] [Google Scholar]
34. Thorington GU, Hessinger DA. Эфферентные механизмы разрядки cnidae: II. Реакция выброса нематоцисты в щупальце актинии. биол. Бык. 1998;195:145–155. дои: 10.2307/1542822. [PubMed] [CrossRef] [Google Scholar]
35. Вейр, К., Дюпре, К.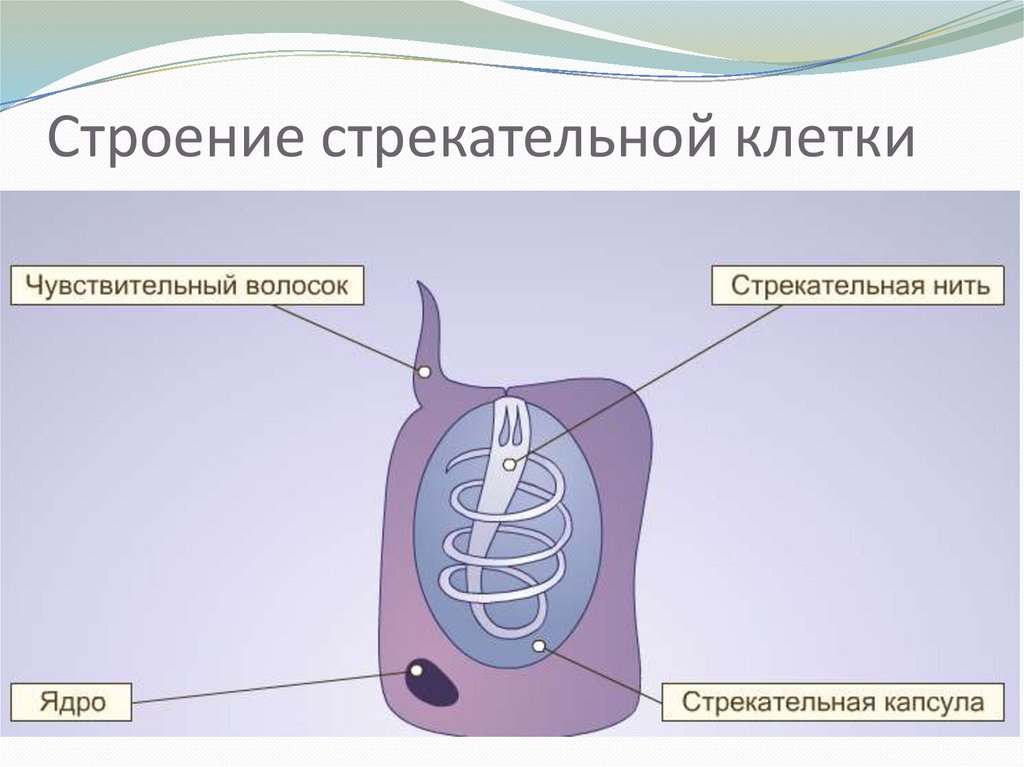 , ван Гизен, Л., Ли, А.С. и Беллоно, Н.В. Молекулярный фильтр для реакции на укус книдарии. Elife 9 , e57578 (2020). [Бесплатная статья PMC] [PubMed]
, ван Гизен, Л., Ли, А.С. и Беллоно, Н.В. Молекулярный фильтр для реакции на укус книдарии. Elife 9 , e57578 (2020). [Бесплатная статья PMC] [PubMed]
36. Holstein TW, et al. Волокнистые мини-коллагены в нематоцистах Hydra . Наука. 1994; 265:402–404. doi: 10.1126/science.265.5170.402. [PubMed] [CrossRef] [Google Scholar]
37. Tursch A, Mercadante D, Tennigkeit J, Grater F, Ozbek S. Богатые цистеином домены миниколлагена кодируют различные способы полимеризации с образованием стабильных капсул нематоцист. науч. 2016;6:25709. doi: 10.1038/srep25709. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Ozbek S, Engel U, Engel J. Переключение дисульфидной связи во время сборки миниколлагена в нематоцистах Hydra или как собрать 150-бар- устойчивая структура. Дж. Структура. биол. 2002; 137:11–14. doi: 10.1006/jsbi.2002.4436. [PubMed] [CrossRef] [Google Scholar]
39. David C, et al. Эволюция сложных структур: миниколлагены формируют книдариевые нематоцисты.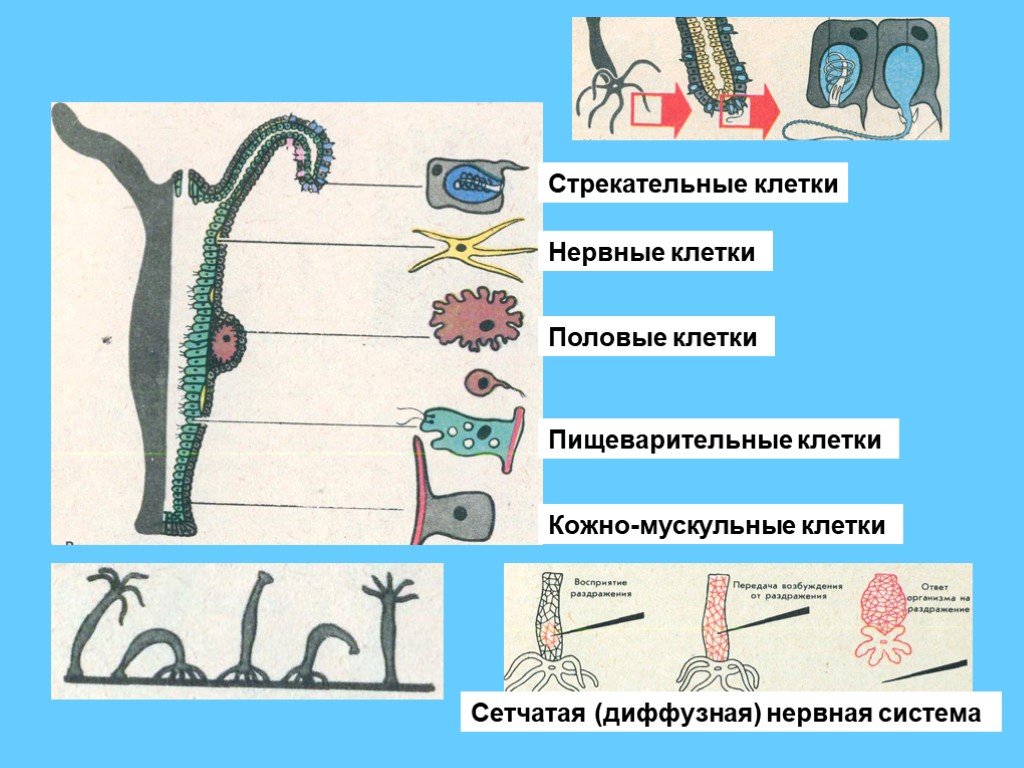 Тенденции Ген.: TIG. 2008; 24:431–438. doi: 10.1016/j.tig.2008.07.001. [PubMed] [CrossRef] [Академия Google]
Тенденции Ген.: TIG. 2008; 24:431–438. doi: 10.1016/j.tig.2008.07.001. [PubMed] [CrossRef] [Академия Google]
40. Adamczyk P, et al. Миниколлаген-15, новый миниколлаген, выделенный из Hydra , образует структуры канальцев в нематоцистах. Дж. Мол. биол. 2008; 376:1008–1020. doi: 10.1016/j.jmb.2007.10.090. [PubMed] [CrossRef] [Google Scholar]
41. Sunagar K, et al. Профилирование экспрессии специфического типа клеток раскрывает развитие и эволюцию стрекательных клеток у морских актиний. БМС Биол. 2018;16:108. doi: 10.1186/s12915-018-0578-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Weber J. Новые инструменты для изучения развития, миграции и оборота нематоцитов (стрекательных клеток книдарий) J. Cell Sci. 1995; 108: 403–412. doi: 10.1242/jcs.108.1.403. [PubMed] [CrossRef] [Google Scholar]
43. Крон Г. Выживание органелл в чужеродном организме: Hydra нематоцисты плоского червя Microstomum lineare. Евро. Дж. Клеточная биология. 2018;97:289–299. doi: 10.1016/j.ejcb.2018.04.002. [PubMed] [CrossRef] [Google Scholar]
2018;97:289–299. doi: 10.1016/j.ejcb.2018.04.002. [PubMed] [CrossRef] [Google Scholar]
44. Ozbek S, et al. Гликопротеин NOWA и миниколлагены являются частью полимера с дисульфидной связью, который образует стенку книдариевой нематоцисты. Дж. Биол. хим. 2004;279: 52016–52023. doi: 10.1074/jbc.M407613200. [PubMed] [CrossRef] [Google Scholar]
45. Yamada S, Morimoto H, Fujisawa T, Sugahara K. Гликозаминогликаны в Hydra magnipapillata (Hydrozoa, Cnidaria): Демонстрация хондроитина в развивающейся нематоцисте, стрекательной органелле, и структурная характеристика гликозаминогликанов. Гликобиология. 2007; 17: 886–894. doi: 10.1093/гликоб/cwm051. [PubMed] [CrossRef] [Google Scholar]
46. Adamczyk P, et al. Несульфатированный хондроитин стабилизирует трубчатость мембран в органеллах кишечнополостных. Дж. Биол. хим. 2010; 285:25613–25623. doi: 10.1074/jbc.M110.107904. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Озбек С. Книдариевая нематоциста: миниатюрный внеклеточный матрикс внутри секреторного пузырька.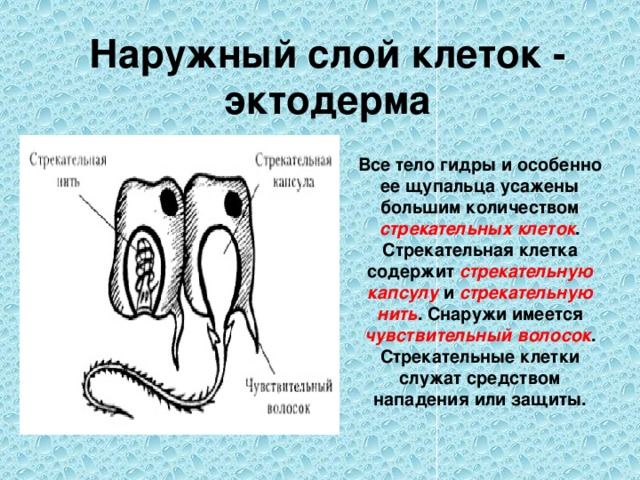 Протоплазма. 2011; 248:635–640. doi: 10.1007/s00709-010-0219-4. [PubMed] [CrossRef] [Google Scholar]
Протоплазма. 2011; 248:635–640. doi: 10.1007/s00709-010-0219-4. [PubMed] [CrossRef] [Google Scholar]
48. Ямада С., Сугахара К., Озбек С. Эволюция гликозаминогликанов: сравнительное биохимическое исследование. Коммуникативный интегр. биол. 2011;4:150–158. doi: 10.4161/cib.4.2.14547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Шпирер Э. и соавт. Разнообразие и эволюция миксозойных миниколлагенов и нематогалектинов. БМС Эвол. биол. 2014;14:205. doi: 10.1186/s12862-014-0205-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Itakura Y, Nakamura-Tsuruta S, Kominami J, Tateno H, Hirabayashi J. Профили связывания сахара с хитин-связывающими лектинами из семейства Hevein: Комплексное исследование. Междунар. Дж. Мол. науч. 2017;18:1160. doi: 10.3390/ijms18061160. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Koch AW, et al. Спиналин, новый богатый глицином и гистидином белок в шипах нематоцист Hydra .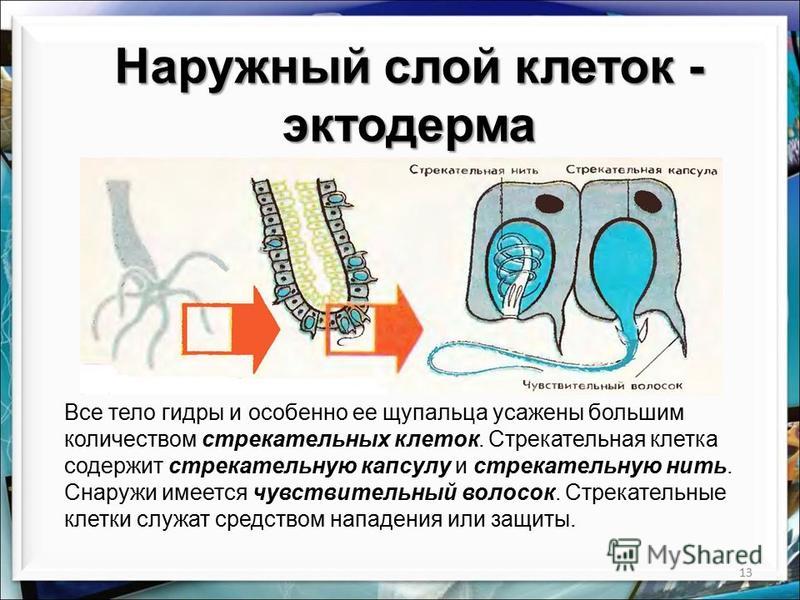 Дж. Клеточные науки. 1998; 111:1545–1554. doi: 10.1242/jcs.111.11.1545. [PubMed] [CrossRef] [Google Scholar]
Дж. Клеточные науки. 1998; 111:1545–1554. doi: 10.1242/jcs.111.11.1545. [PubMed] [CrossRef] [Google Scholar]
52. Hellstern S, et al. Структурно-функциональный анализ спиналина, шиповидного белка нематоцист Hydra . FEBS J. 2006; 273:3230–3237. doi: 10.1111/j.1742-4658.2006.05331.x. [PubMed] [CrossRef] [Google Scholar]
53. He S, et al. Аксиальный Hox-код контролирует сегментацию тканей и формирование паттерна тела в Nematostella vectensis . Наука. 2018; 361:1377–1380. doi: 10.1126/science.aar8384. [PubMed] [CrossRef] [Google Scholar]
54. Karabulut A, He S, Chen CY, McKinney SA, Gibson MC. Электропорация коротких шпилечных РНК для быстрого и эффективного нокдауна гена у морской анемоны звездочки, Nematostella vectensis . Дев. биол. 2019; 448:7–15. doi: 10.1016/j.ydbio.2019.01.005. [PubMed] [CrossRef] [Google Scholar]
55. Sebe-Pedros A, et al. Разнообразие и регуляция типов книдарийных клеток, выявленные с помощью одноклеточной РНК-Seq всего организма.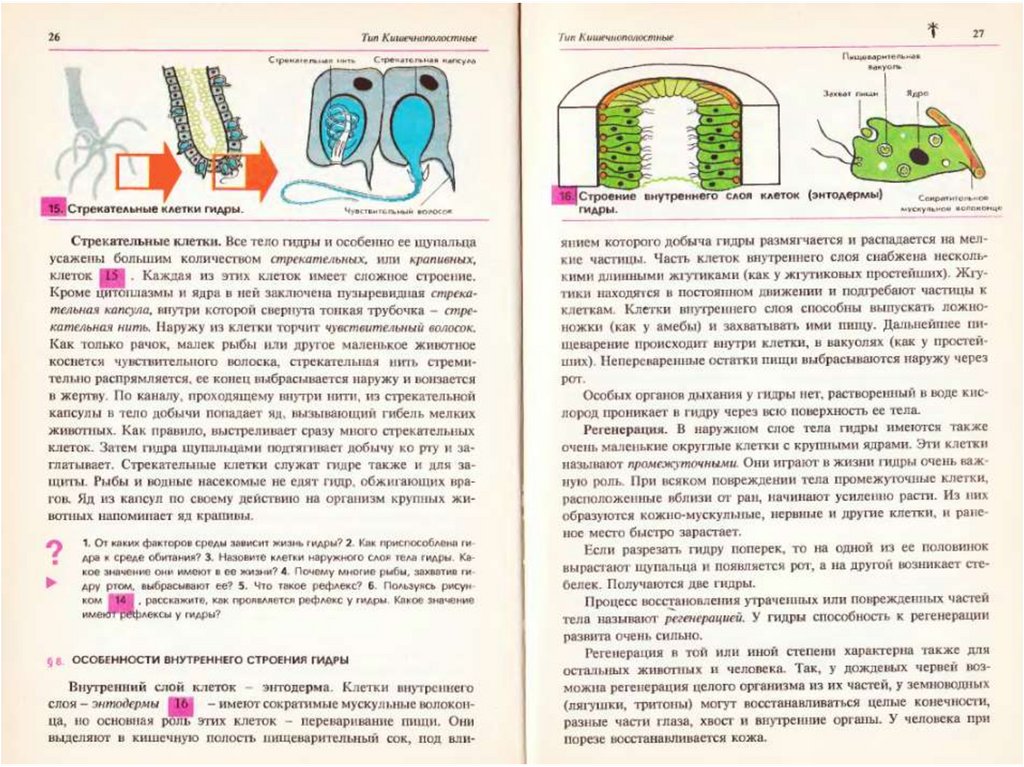 Клетка. 2018;173:1520–1534 e1520. doi: 10.1016/j.cell.2018.05.019. [PubMed] [CrossRef] [Google Scholar]
Клетка. 2018;173:1520–1534 e1520. doi: 10.1016/j.cell.2018.05.019. [PubMed] [CrossRef] [Google Scholar]
56. Кэмпбелл Р.Д. Структура нематоцист Hydra : геометрия соединения между торцом и канальцем. Транс. Являюсь. Микроскопические соц. 1977; 96: 149–152. дои: 10.2307/3225975. [CrossRef] [Google Scholar]
57. Рефт, А. Понимание морфологии и распределения нематоцист у морских анемонов и их родственников. Кандидатская диссертация (Университет штата Огайо, 2012 г.).
58. Генихович Г., Технау Ю. Индукция нереста у звёздчатой актинии Nematostella vectensis , оплодотворение гамет in vitro и дежелирование зигот. Харб Колд Спринг. протокол 2009;2009:прот5281. doi: 10.1101/pdb.prot5281. [PubMed] [CrossRef] [Google Scholar]
59. Renfer E, Amon-Hassenzahl A, Steinmetz PR, Technau U. Мышечная трансгенная репортерная линия морского анемона, Nematostella vectensis . проц. Натл акад. науч. США. 2010; 107:104–108. doi: 10.1073/pnas. 0909148107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
0909148107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Renfer E, Technau U. Генерация стабильных трансгенов в актинии Nematostella vectensis с помощью мегануклеазы. Нац. протокол 2017; 12:1844–1854. doi: 10.1038/nprot.2017.075. [PubMed] [CrossRef] [Google Scholar]
61. Йонгеблоед В.Л., Стокроос И., Ван дер Вант Дж.Дж., Каличаран Д. Методы фиксации без покрытия или избыточность проводящего покрытия, работа FE-SEM с низким кВ и комбинированная SEM/TEM биологических тканей. Дж. Микроск. 1999; 193: 158–170. дои: 10.1046/j.1365-2818.1999.00430.х. [PubMed] [CrossRef] [Google Scholar]
62. Кремер Дж. Р., Мастронард Д. Н., Макинтош Дж. Р. Компьютерная визуализация данных трехмерного изображения с использованием IMOD. Дж. Структура. биол. 1996; 116:71–76. doi: 10.1006/jsbi.1996.0013. [PubMed] [CrossRef] [Google Scholar]
63. Schindelin J, et al. Фиджи: Платформа с открытым исходным кодом для анализа биологических изображений. Нац. Методы. 2012; 9: 676–682. doi: 10.1038/nmeth.2019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Методы. 2012; 9: 676–682. doi: 10.1038/nmeth.2019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Sabin KZ, Jiang P, Gearhart MD, Stewart R, Echeverri K. AP-1(cFos/JunB)/miR-200a регулируют про- ответ регенеративных глиальных клеток при регенерации спинного мозга аксолотля. коммун. биол. 2019;2:91. doi: 10.1038/s42003-019-0335-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
стрекательных клеток, модулированных светом в гидре | Лаборатория эволюции Окли
Что хорошего в половине глаза? Биологи-эволюционисты, изучающие происхождение зрения, часто задают этот вопрос, и новое исследование Калифорнийского университета в Санта-Барбаре указывает на возможный ответ. Результаты, опубликованные сегодня в журнале BMC Biology, показывают, что даже при полном отсутствии глаз некоторые существа проявляют светочувствительность, которая использует тот же зрительный путь, который позволяет людям видеть.
Тодд Окли, профессор кафедры экологии, эволюции и морской биологии Калифорнийского университета в Сан-Франциско, стал соавтором статьи о генетическом поведении гидры, пресноводного полипа.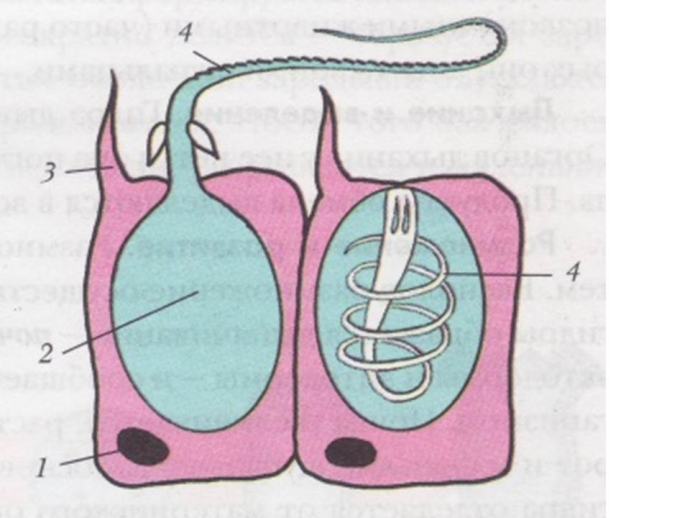 Наряду с медузами, морскими анемонами и кораллами, гидры относятся к семейству животных Cnidaria, которые используют стрекательные клетки, или книдоциты, для ловли добычи. Щупальца гидры содержат колючие, содержащие яд книдоциты, которые они используют для оглушения животных, таких как водяные блохи и планктон, перед тем, как съесть их заживо. Они также используют свои книдоциты для самозащиты и передвижения.
Наряду с медузами, морскими анемонами и кораллами, гидры относятся к семейству животных Cnidaria, которые используют стрекательные клетки, или книдоциты, для ловли добычи. Щупальца гидры содержат колючие, содержащие яд книдоциты, которые они используют для оглушения животных, таких как водяные блохи и планктон, перед тем, как съесть их заживо. Они также используют свои книдоциты для самозащиты и передвижения.
Исследование, проведенное в UCSB, показало, что свет или его отсутствие оказывает прямое влияние на склонность гидр активировать свои стрекательные клетки — открытие, по словам Окли, «рассказывает нам что-то совершенно новое о биологии этих животных, и мы думаем, что это может распространяться на других кишечнополостных».
«Уже было известно, что стрекательные клетки гидры чувствительны к прикосновению и вкусу, но никто никогда раньше не думал искать чувствительность к свету — вероятно, потому, что у них нет глаз», — сказал Окли. «Мы первыми обнаружили это. И мы обнаружили не только то, что гены светочувствительности экспрессируются вблизи стрекательных клеток гидры, но и то, что в разных условиях освещения эти клетки имеют разную склонность к срабатыванию».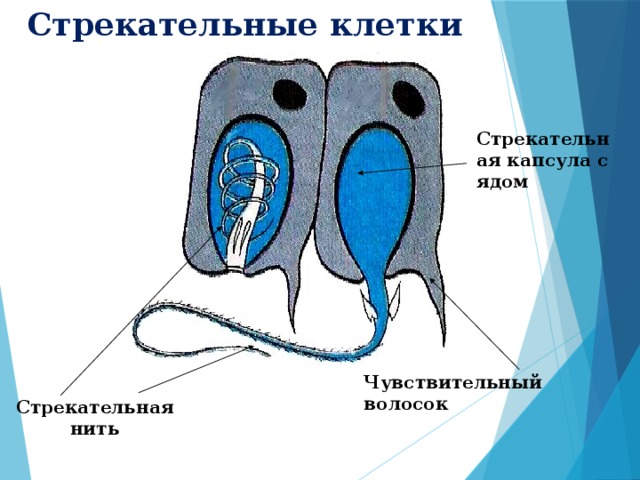
По словам Окли, изучая гидру как при ярком, так и при слабом освещении, исследователи обнаружили, что яркий свет на самом деле подавляет возбуждение стрекательных клеток — возможно, потому, что их добыча более активна в сумерках и после захода солнца. Он предположил, что свет может действовать как «ежедневный ритмичный сигнал», который говорит гидре, когда жалить, а когда нет.
Исследование показало, что светочувствительный белок опсин в сенсорных клетках регулирует возбуждение гарпунообразных книдоцитов гидры. Те же самые клетки присутствуют в механизмах, которые гидра использует, чтобы схватить добычу и перепрыгнуть через воду.
По словам ученых, связь опсина со стрекательными клетками помогает объяснить, как гидра может реагировать на свет, несмотря на отсутствие глаз, потому что сенсорные нейроны также содержат ионные каналы и дополнительные белки, необходимые для фототрансдукции — процесса преобразования света. к электрическим сигналам. Фототрансдукция у человека происходит в сетчатке.


Leave A Comment