Помогите, пожалуйста, решить задачу на смеси : Химия
Сообщения без ответов | Активные темы | Избранное
| acme |
| ||
18/01/11 |
| ||
| |||
| dr_alex |
| ||
31/03/11 |
| ||
| |||
| Tlalok |
| |||
14/03/10 |
| |||
| ||||
| dr_alex |
| ||
31/03/11 |
| ||
| |||
| Tlalok |
| |||
14/03/10 |
| |||
| ||||
| alisaV. |
| ||
05/04/11 |
| ||
| |||
| PAV |
| |||||
29/07/05 |
| |||||
| ||||||
| Показать сообщения за: Все сообщения1 день7 дней2 недели1 месяц3 месяца6 месяцев1 год Поле сортировки АвторВремя размещенияЗаголовокпо возрастаниюпо убыванию |
| Страница 1 из 1 | [ Сообщений: 7 ] |
Модераторы: photon, Toucan, Супермодераторы
Кто сейчас на конференции |
Сейчас этот форум просматривают: нет зарегистрированных пользователей |
| Вы не можете начинать темы Вы не можете отвечать на сообщения Вы не можете редактировать свои сообщения Вы не можете удалять свои сообщения Вы не можете добавлять вложения |
| Найти: |
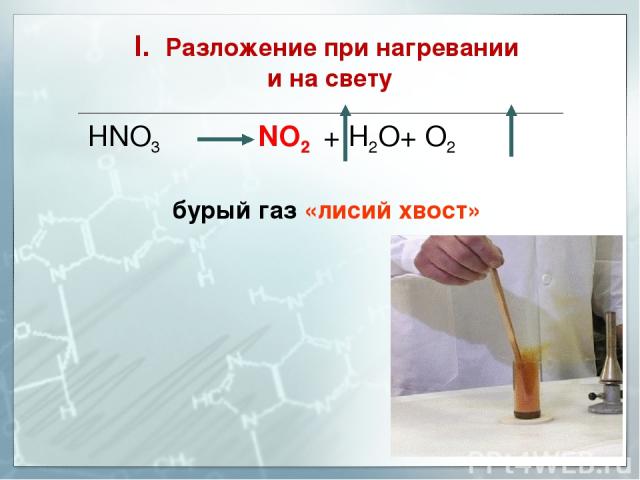
Карбонат натрия: хим.
 свойства и получение
свойства и получение
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
Na2O + CO2 = Na2CO3
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3↓ + H2O
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
NaHCO3 + NaOH = Na2CO3 + H2O
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Na2CO3 + H2SO4 = 2Na2SO4 + CO2↑ +H2O.
1. Карбонат натрия может реагировать с простыми веществами:
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом. При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
Na2CO3 + 3Cl2 = 5NaCl + NaClO3 + 3CO2↑
2. Карбонат натрия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
Na2CO3 + H2O + CO2 ↔ 2NaHCO3↓
2. 2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ +H2O
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
Na2CO3 + 2HF = 2NaF + H2O + CO2↑
2. 5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы. При этом образуются карбонат натрия и углекислый газ:
5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы. При этом образуются карбонат натрия и углекислый газ:
Na2CO3 + SO2 = Na2SO3 + CO2↑.
Понравилось это:
Нравится Загрузка…
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания CO2 перед сжиганием (журнальная статья)
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания CO2 перед сжиганием (журнальная статья) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Сиривардане, Ранджани V; Постон, Джеймс А; Робинсон, Кларк; Симони, Томас
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория энергетических технологий. (NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование
- Организация-спонсор:
- Департамент ископаемой энергии Министерства энергетики США (FE)
- Идентификатор ОСТИ:
- 1137144
- Номер(а) отчета:
- ТПР-3331
- Тип ресурса:
- Журнальная статья
- Название журнала:
- ЭНЕРГИЯ И ТОПЛИВО
- Дополнительная информация журнала:
- Объем журнала: 25; Выпуск журнала: 3
- Страна публикации:
- США
- Язык:
- Английский
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Сиривардане, Ранджани В. , Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
, Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . Соединенные Штаты. https://doi.org/10.1021/ef101486m
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. 2011.
«Влияние добавок на разложение карбоната натрия: регенерация сорбента с улавливанием CO2 перед сжиганием». Соединенные Штаты. https://doi.org/10.1021/ef101486m. https://www. osti.gov/servlets/purl/1137144.
osti.gov/servlets/purl/1137144.
Копировать в буфер обмена
@статья{osti_1137144,
title = {Влияние добавок на разложение карбоната натрия: регенерация сорбента с улавливанием CO2 перед сжиганием},
автор = {Сиривардане, Ранджани В. и Постон, Джеймс А. и Робинсон, Кларк и Симони, Томас},
abstractNote = {},
дои = {10.1021/ef101486m},
URL = {https://www.osti.gov/biblio/1137144},
журнал = {ЭНЕРГИЯ И ТОПЛИВО},
номер = 3,
объем = 25,
место = {США},
год = {2011},
месяц = {3}
}
Копировать в буфер обмена
Просмотреть журнальную статью (1,59 МБ)
https://doi.org/10.1021/ef101486m
Найдите в Google Scholar
Найдите в WorldCat библиотеки, в которых может храниться этот журнал
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
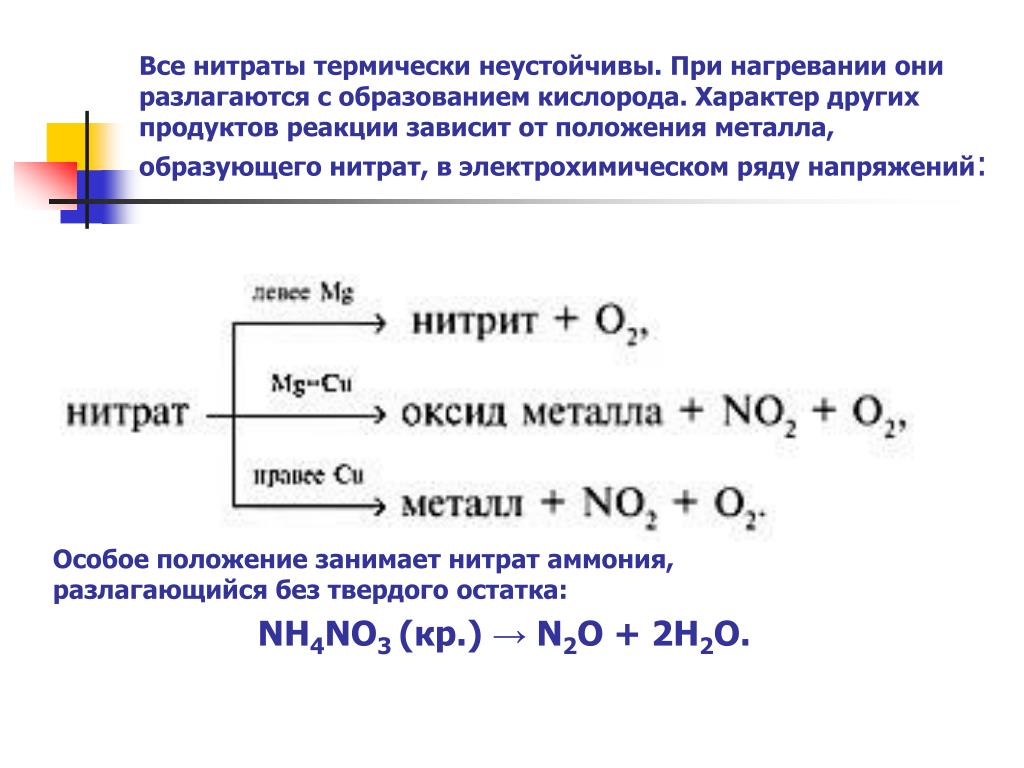
Когда $ N{a_2}C{O_3} $ нагревается, это дает: A. $ N{a_2}O $ B. $ C{O_2} $ C. И A, и BD. $ N{O_2} $
Ответ
Подтверждено
241,8 тыс.+ просмотров
Подсказка: Это реакция термического разложения. Продуктом реакции является оксид, который используется в керамике и стекле. Продукт представляет собой основной ангидрид гидроксида натрия. И его получают реакцией натрия с гидроксидом натрия, пероксидом натрия или нитритом натрия.
Завершить шаг за шагом Ответ: 9о}С $ .
Реакция термического разложения $N{a_2}C{O_3}$ будет:
$ N{a_2}C{O_3}(s) \to N{a_2}O(s) + C{O_2}(g ) $
При нагревании $ N{a_2}C{O_3} $ происходит разложение на $ N{a_2}O $, представляющее собой оксид натрия, и $ C{O_2} $, являющееся углекислым газом.
Продуктом будет оксид натрия и диоксид углерода.
Итак, вариант С правильный.
Дополнительная информация:
Карбонат натрия является пищевой добавкой. Он используется в качестве регулятора кислотности, стабилизатора, а также в качестве антислеживателя и разрыхлителя. Он также является компонентом раствора щелочных солей, называемого кансуи, который используется для придания лапше рамен аромата и вкуса. В кулинарии его иногда используют вместо гидроксида натрия (для заваривания). Карбонат натрия изменяет pH пищи и улучшает подрумянивание. Карбонат натрия вызывает коррозию посуды, фольги и посуды из алюминия.
Примечание:
$ N{a_2}C{O_3} $ – это неорганическое соединение, имеющее химическое название карбонат натрия, также известное как стиральная сода. Это сильное щелочное основание. Он используется в экологически чистых продуктах. А также встречается в виде порошка. Он также применяется в различных отраслях промышленности, например, в чистящих средствах и средствах личной гигиены, а также в качестве фунгицида, микробицида, гербицида и регулятора pH.


 03.2011, 23:00
03.2011, 23:00 
 е. нерастворимое вещество.
е. нерастворимое вещество. е. нерастворимое вещество.
е. нерастворимое вещество. 03.2011, 23:59
03.2011, 23:59  04.2011, 05:24
04.2011, 05:24  04.2011, 19:19
04.2011, 19:19
Leave A Comment