Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Содержание ▼
- Положение в периодической системе химических…
- Слайд №2
- Слайд №3
- Задание для…
- Положение водорода в периодической…
- Водород относится к химически активным веществам.…
- 2) с неметаллами, проявляющими более сильные…
- Положение в ПСХЭ Д. И. Менделеева лантаноидов и…
- У лантана (Z= 57) один электрон поступает на…
- В седьмом периоде 14 элементов с…
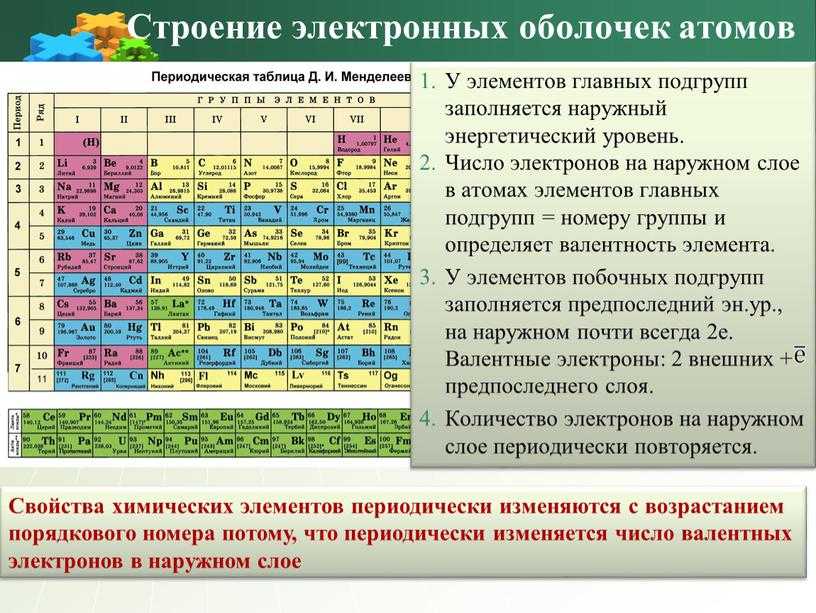
- Положение в периодической системе химических…
- Ответьте на вопросы тестов 1. Чему равен…
- 11. На внешнем энергоуровне элементов…
- 21. Металлические свойства простых…
- …
Вы можете ознакомиться и скачать презентацию на
тему Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов.
Доклад-сообщение содержит 15 слайдов. Презентации для любого класса можно скачать бесплатно.
Если материал и наш сайт презентаций Mypresentation Вам понравились – поделитесь
им с друзьями с помощью социальных кнопок и добавьте в закладки в своем
браузере.
Презентации для любого класса можно скачать бесплатно.
Если материал и наш сайт презентаций Mypresentation Вам понравились – поделитесь
им с друзьями с помощью социальных кнопок и добавьте в закладки в своем
браузере.
Слайд 1
Описание слайда:
Положение в периодической системе химических элементов Д. И. Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Слайд 2
Описание слайда:
Слайд 3
Описание слайда:
Слайд 4
Описание слайда:
Задание для закрепления:
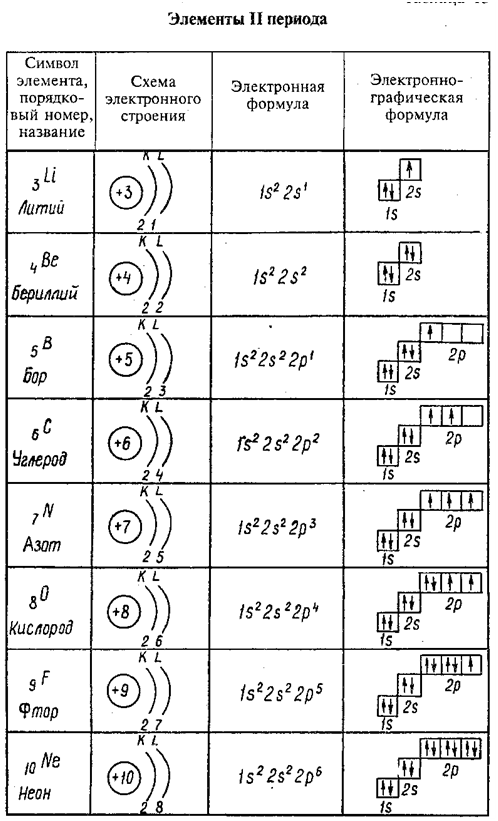
Каким набором квантовых чисел описывается движение 4 электрона в атоме бора; последнего электрона в атоме хлора; 25 электрона в атоме меди.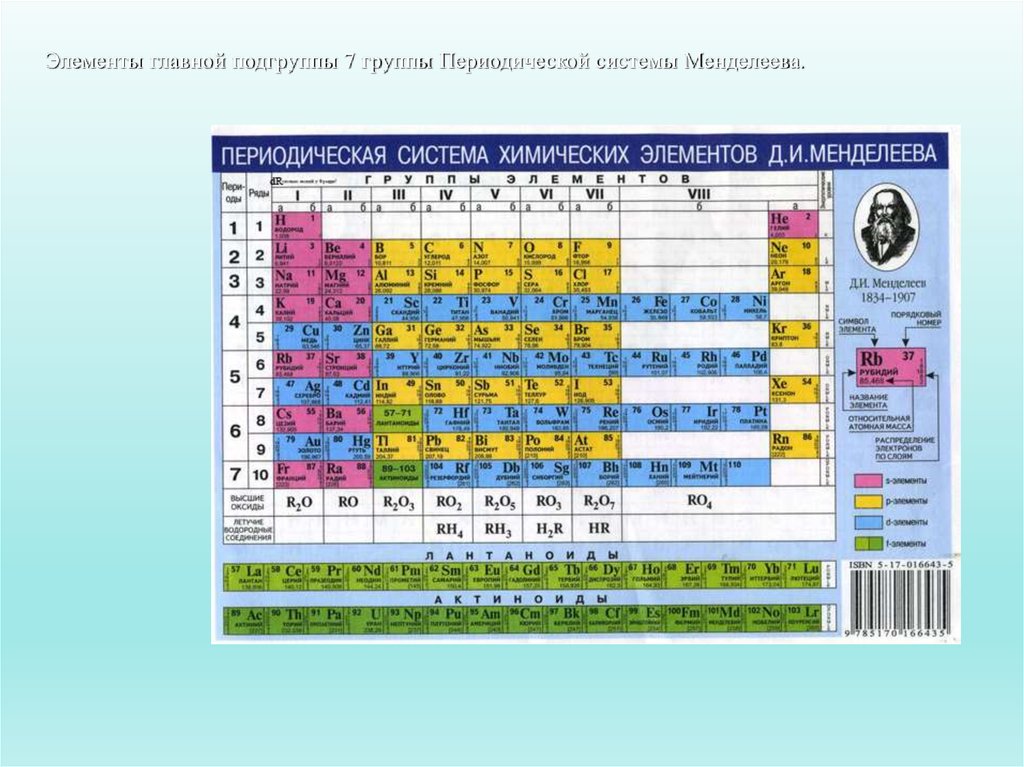
Слайд 5
Положение водорода в периодической системе Водород – самый распространённый химический элемент, самый лёгкий. Ядро водорода состоит из одного протона, вокруг которого вращается один электрон. Электронная формула 1s1. С учётом его свойств его помещают как в 1А так и в 7А группу.Возникает вопрос – почему?
Слайд 6
Описание слайда:
Водород относится к химически активным веществам. Он может выступать в роли восстановителя и окислителя.
Слайд 7
Описание слайда:
2) с неметаллами, проявляющими более сильные окислительные свойства, чем водород
2) с неметаллами, проявляющими более сильные окислительные свойства, чем водород
h3+Cl2 =2HCl
здесь водород – восстановитель H0 — 1e- → H+1
Сходный процесс происходит при взаимодействии щелочных металлов –металлов 1А группы
2К+Cl2=2КCl
Поэтому, водород помещают в 1А группу
ИЮПАК рекомендует размещать водород только в 1А группе.
Слайд 8
Описание слайда:
Положение в ПСХЭ Д. И. Менделеева лантаноидов и актиноидов В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает «подобные лантану», а “актиноиды” — «подобные актинию»).
Слайд 9
У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-уровень, семь орбиталей которого могут быть заняты 14 электронами. У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-уровень, семь орбиталей которого могут быть заняты 14 электронами.
Это происходит у атомов всех лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами.
У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-уровень, семь орбиталей которого могут быть заняты 14 электронами.
Это происходит у атомов всех лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами.
Слайд 10
Описание слайда:
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов.
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов.
У актиния и актиноидов заполнение уровней электронами подобно лантану и лантаноидам.
Они в своих соединениях проявляют больше различных степеней окисления.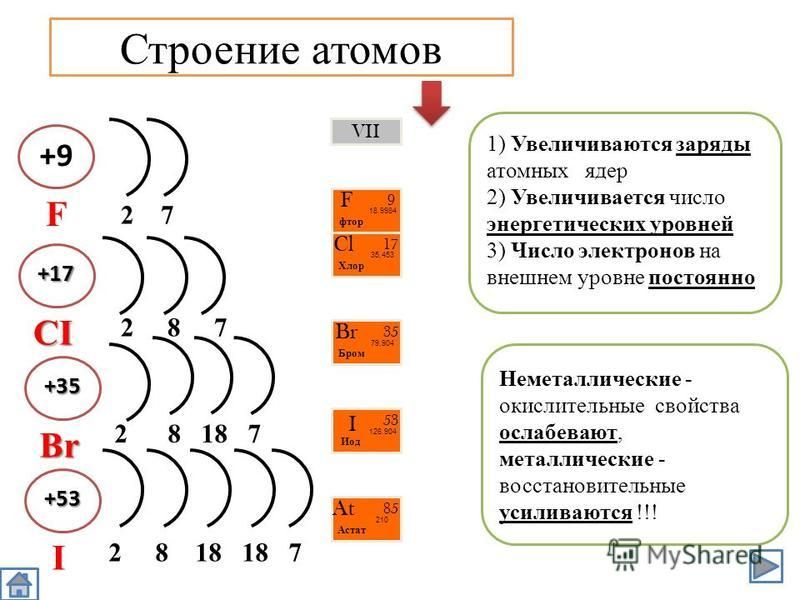
Слайд 11
Описание слайда:
Положение в периодической системе химических элементов Д. И. Менделеева искусственно полученных элементов К 2016 г. известно 119 химических элементов, из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные получены искусственно в результате ядерных реакций Первые 112 элементов имеют постоянные названия, остальные — временные.
Слайд 12
Описание слайда:
Ответьте на вопросы тестов
1. Чему равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
4. Что общего в атомах 14 7N и 14 6C?
1) массовое число; 2) число протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%), какой ещё изотоп входит в состав кремния, если атомная масса кремния 28,1.
1) 27; 2) 31; 3) 32; 4) 30.
9. Набор квантовых чисел (n, l, ml, ms) последнего электрона в атоме кислорода:
1) 2, 0, -1, -1/2; 2) 2, 1, +1, -1/2; 3) 2, 1, -1, -1/2; 4) 2, 1, 0, -1/2.
10.
Чему равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
4. Что общего в атомах 14 7N и 14 6C?
1) массовое число; 2) число протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%), какой ещё изотоп входит в состав кремния, если атомная масса кремния 28,1.
1) 27; 2) 31; 3) 32; 4) 30.
9. Набор квантовых чисел (n, l, ml, ms) последнего электрона в атоме кислорода:
1) 2, 0, -1, -1/2; 2) 2, 1, +1, -1/2; 3) 2, 1, -1, -1/2; 4) 2, 1, 0, -1/2.
10.
Слайд 13
Описание слайда:
11. На внешнем энергоуровне элементов главных подгрупп число
электронов :
1) равно 2; 2) равно номеру периода; 3) равно номеру группы; 4) равно 1.
12. Элементу 2-го периода до завершения внешнего уровня не хватает 3 электронов. Это элемент-…
1) бор; 2) углерод; 3) азот; 4) фосфор.
13. Элемент проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 3d7; 2) 2s22p5; 3) 3s23p5; 4) 3s24d5.
14. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 4d6; 2) 2s22p4; 3) 3s23p4; 4) 3s13d5. 15. Атому элемента марганец соответствует сокращённая электронная формула
1) [18Ar]4s23d5; 2) [18Ar,3d10]4s22p5; 3) [10Ne]3s23p5; 4) [36Kr]4d55s2.
16. Строение внешнего и предвнешнего электронных слоёв атома меди
1) 3s23p63d94s2; 2) 3s23p63d104s0; 3) 3s23p64s13d10; 4) 3s23p63d11.
17. Движение электрона в атоме описывается … квантовыми числами.
1) 1; 2) 5; 3) 4; 4) 3.
18. Изотопы одного элемента различаются
1) числом протонов 2) числом нейтронов 3) числом электронов 4) зарядом ядра
19. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
20. В периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
15. Атому элемента марганец соответствует сокращённая электронная формула
1) [18Ar]4s23d5; 2) [18Ar,3d10]4s22p5; 3) [10Ne]3s23p5; 4) [36Kr]4d55s2.
16. Строение внешнего и предвнешнего электронных слоёв атома меди
1) 3s23p63d94s2; 2) 3s23p63d104s0; 3) 3s23p64s13d10; 4) 3s23p63d11.
17. Движение электрона в атоме описывается … квантовыми числами.
1) 1; 2) 5; 3) 4; 4) 3.
18. Изотопы одного элемента различаются
1) числом протонов 2) числом нейтронов 3) числом электронов 4) зарядом ядра
19. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
20. В периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
Слайд 14
Описание слайда:
21. Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
22. Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
23. Все атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
24. Номер периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
25. В группе сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
26. Основные свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются в группах
2) уменьшаются в периодах и увеличиваются в группах
3) увеличиваются в периодах и уменьшаются в группах
4) увеличиваются в периодах и увеличиваются в группах
27.
Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
22. Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
23. Все атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
24. Номер периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
25. В группе сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
26. Основные свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются в группах
2) уменьшаются в периодах и увеличиваются в группах
3) увеличиваются в периодах и уменьшаются в группах
4) увеличиваются в периодах и увеличиваются в группах
27. Формула основания, соответствующая элементу четвертой группы в его высшей степени окисления
1) ЭОН 2) Э (ОН)2 3) Э (ОН)3 4) Э (ОН)4
28. Электронная формула валентного уровня 3d84s2 имеется у атомов
1) скандия 2) никеля 3) марганца 4) титана
Формула основания, соответствующая элементу четвертой группы в его высшей степени окисления
1) ЭОН 2) Э (ОН)2 3) Э (ОН)3 4) Э (ОН)4
28. Электронная формула валентного уровня 3d84s2 имеется у атомов
1) скандия 2) никеля 3) марганца 4) титана
Слайд 15
Описание слайда:
29. Электронная формула атома натрия
1) ls22s22p63s23p1 2) 1s22s22p63s23p3
3) 1s22s22p63s1 4) ls22s1
30. Число неспаренных электронов в основном состоянии атома бериллия равно
1) 0 2) 1 3) 2 4) 4
31. Элемент, атомы которого имеют в основном состоянии 4 неспаренных электронов
1) марганец 2) железо 3) ванадий 4) хром
32. Является f-элементом
1) Sr 2) Se 3) Sc 4) Sm
33. Никель является
1) s-элементом 2) р-элементом
3) d-элементом 4) f-элементом
34. Какой подуровень из перечисленных заполняется электронами первым?
1) 3d 2) 4d 3) 4p 4) 4s
Какой подуровень из перечисленных заполняется электронами первым?
1) 3d 2) 4d 3) 4p 4) 4s
группы | ||||||||
I | II | III | IV | V | VI | VII | VIII | |
Строение атома | Li+3)2)1 | Be+4)2)2 | B+5)2)3 | C+6)2)4 | N+7)2)5 | O+8)2)6 | F+9)2)7 | Ne+10)2)8 |
Высший оксид | Li2O | BeO | B2O3 | CO2 | N2O5 | — | — | — |
Гидроксид | LiOH осн | Be(OH)2 амф | H3BO3 кисл | H2CO3 кисл | HNO3 кисл |
|
|
|
2.6: Расположение электронов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16177
- Анонимный
- LibreTexts
Цели обучения
- Описать, как электроны группируются внутри атомов.
Хотя мы обсудили общее расположение субатомных частиц в атомах, мы мало сказали о том, как электроны занимают пространство вокруг ядра. Движутся ли они вокруг ядра случайным образом или существуют в каком-то упорядоченном порядке?
Современная теория поведения электрона называется квантовой механикой. Он делает следующие утверждения об электронах в атомах:
Он делает следующие утверждения об электронах в атомах:
- Электроны в атомах могут иметь только определенные удельные энергии. Мы говорим, что энергии электронов квантуются.
- Электроны организованы в соответствии с их энергиями в наборы, называемые оболочками (помечены главным квантовым числом, n ). Как правило, чем выше энергия оболочки, тем дальше она (в среднем) от ядра. Оболочки не имеют определенного фиксированного расстояния от ядра, но электрон в оболочке с более высокой энергией будет проводить больше времени дальше от ядра, чем электрон в оболочке с более низкой энергией.
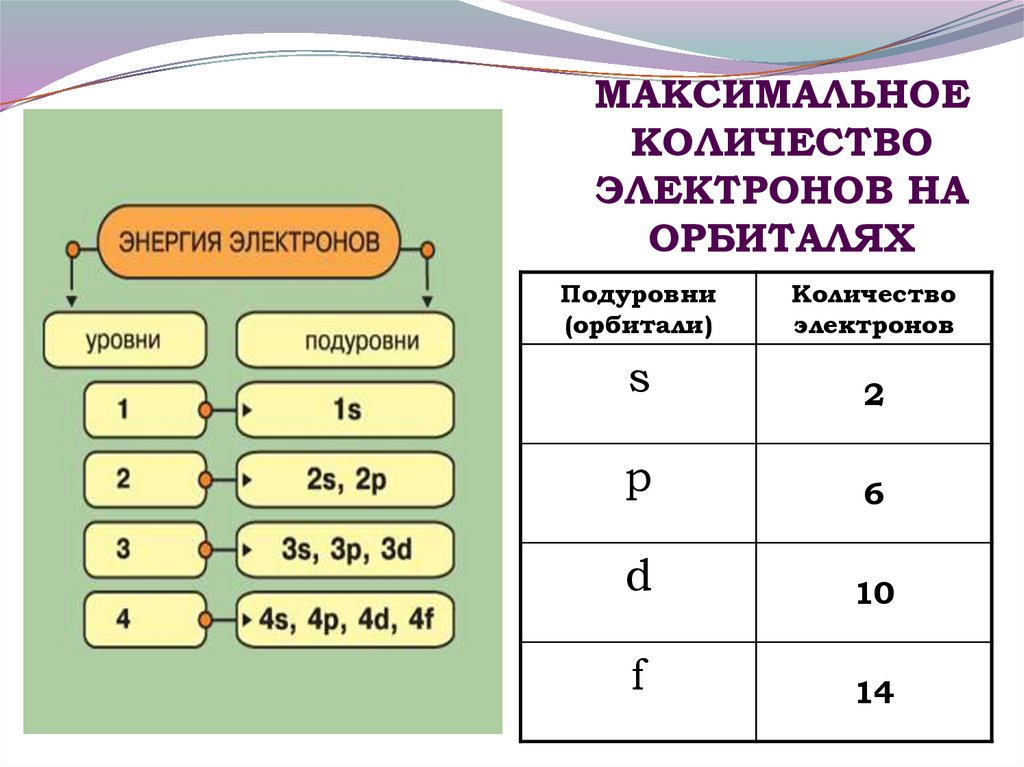
- Оболочки дополнительно делятся на подмножества электронов, называемые подоболочками . Первая оболочка имеет только одну подоболочку, вторая оболочка имеет две подоболочки, третья оболочка имеет три подоболочки и так далее. Подоболочки каждой оболочки по порядку помечены буквами s , p , d и f .
 Таким образом, первая оболочка имеет только одну подоболочку s (называемую 1 s ), the second shell has 2 s and 2 p subshells, the third shell has 3 s , 3 p , and 3 d and so forth.
Таким образом, первая оболочка имеет только одну подоболочку s (называемую 1 s ), the second shell has 2 s and 2 p subshells, the third shell has 3 s , 3 p , and 3 d and so forth.
| Корпус | Количество субоболочек | Имена подоболочек |
|---|---|---|
| 1 | 1 | 1 с |
| 2 | 2 | 2 шт. и 2 шт. и 2 шт. |
| 3 | 3 | 3s , 3p и 3d |
| 4 | 4 | 4с , 4п , 4д и 4ф |
- Различные подоболочки содержат разное максимальное количество электронов. Любая s подоболочка может содержать до 2 электронов; р , 6; д , 10; и ф , 14.
| Подоболочка | Максимальное количество электронов |
|---|---|
| с | 2 |
| р | 6 |
| д | 10 |
| ф | 14 |
Нас больше всего интересует расположение электронов в оболочках и подоболочках, поэтому мы сосредоточимся на этом.
Мы используем числа, чтобы указать, в какой оболочке находится электрон. Как показано в таблице \(\PageIndex{1}\), первой оболочкой, ближайшей к ядру и с электронами с самой низкой энергией, является оболочка 1. Эта первая оболочка имеет только одну подоболочку, которая обозначена как 1 s и может содержать максимум 2 электрона. Мы объединяем метки оболочки и подоболочки, когда говорим об организации электронов вокруг ядра, и используем верхний индекс, чтобы указать, сколько электронов находится в подоболочке. Таким образом, поскольку атом водорода имеет свой единственный электрон в s подоболочка первой оболочки, мы используем 1 s 1 для описания электронной структуры водорода. Эта структура называется электронной конфигурацией. Электронные конфигурации — это краткое описание расположения электронов в атомах. Электронная конфигурация атома водорода произносится вслух как «один-эс-один».
Атомы гелия имеют 2 электрона. Оба электрона вписываются в 1 с 9подоболочка 0050, потому что подоболочки s могут содержать до 2 электронов; следовательно, электронная конфигурация атомов гелия имеет вид 1 с 2 (произносится как «один-эсс-два»).
Подоболочка 1 s не может содержать 3 электрона (поскольку подоболочка s может содержать максимум 2 электрона), поэтому электронная конфигурация атома лития не может быть 1 s 0 30292 . Два электрона лития могут поместиться в подоболочку 1 s , но третий электрон должен попасть во вторую оболочку. Вторая оболочка имеет две подоболочки, s и p , которые заполняются электронами в указанном порядке. Подоболочка 2 s содержит максимум 2 электрона, а подоболочка 2 p содержит максимум 6 электронов. Поскольку последний электрон лития переходит в 2 s подоболочка, мы запишем электронную конфигурацию атома лития как 1 s 2 2 s 1 . Ниже показана оболочечная диаграмма атома лития. Ближайшая к ядру оболочка (первая оболочка) имеет 2 точки, представляющие 2 электрона в 1 s , а самая внешняя оболочка ( 2 s ) имеет 1 электрон.
Поскольку последний электрон лития переходит в 2 s подоболочка, мы запишем электронную конфигурацию атома лития как 1 s 2 2 s 1 . Ниже показана оболочечная диаграмма атома лития. Ближайшая к ядру оболочка (первая оболочка) имеет 2 точки, представляющие 2 электрона в 1 s , а самая внешняя оболочка ( 2 s ) имеет 1 электрон.
Следующий по величине атом, бериллий, имеет 4 электрона, поэтому его электронная конфигурация имеет следующий вид: Теперь, когда подоболочка 2 s заполнена, электроны в более крупных атомах начинают заполнять подоболочку 2 p . Таким образом, электронные конфигурации следующих шести атомов следующие:
- B: 1 с 2 2 с 2 2 р 1
- C: 1 с 2 2 с 2 2 р 2
- N: 1 с 2 2 с 2 2 р 3
- O: 1 с 2 2 с 2 2 стр.
 4
4 - F: 1 с 2 2 с 2 2 р 5
- Ne: 1 с 2 2 с 2 2 с 6
С неоном подоболочка 2 p полностью заполнена. Поскольку вторая оболочка имеет только две подоболочки, атомы с большим количеством электронов теперь должны начинать третью оболочку. Третья оболочка имеет три подоболочки, помеченные цифрой 9.0048 s , p , и d . Подоболочка d может содержать максимум 10 электронов. Первые две подоболочки третьей оболочки заполняются по порядку — например, электронная конфигурация алюминия с 13 электронами: 6 3 с 2 3 стр 1 . Однако после заполнения подоболочки 3 p происходит любопытная вещь: подоболочка 4 s начинает заполняться раньше, чем подоболочка 3 d .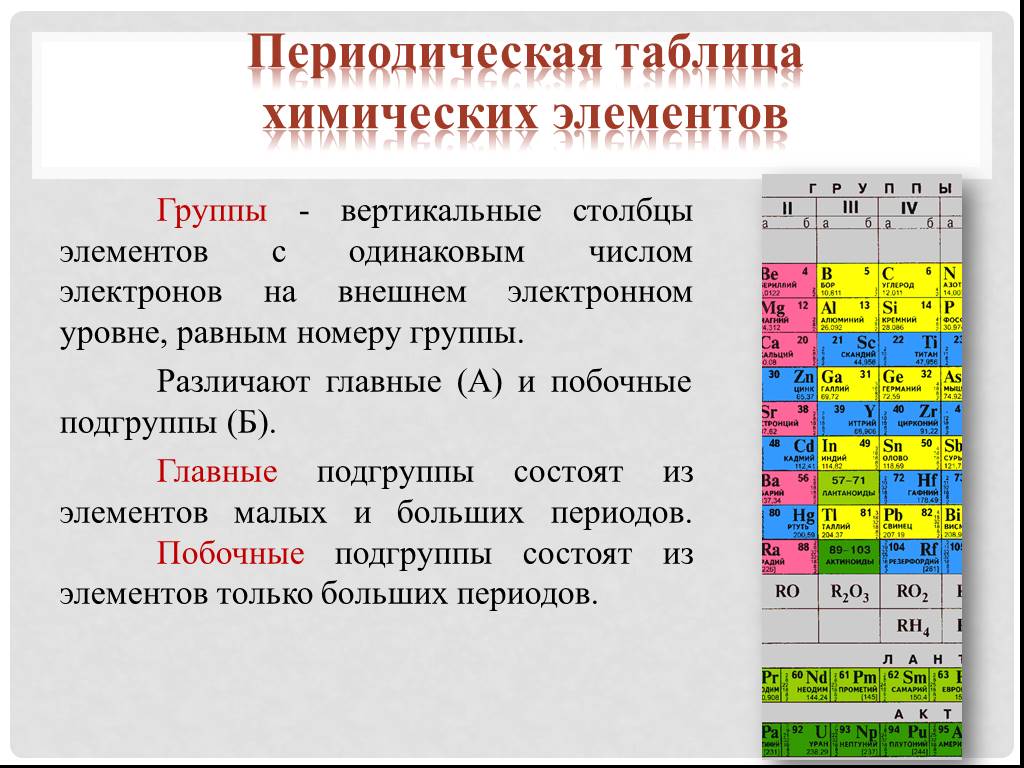 На самом деле точная упорядоченность подоболочек в этот момент усложняется (после аргона с его 18 электронами), поэтому мы не будем рассматривать электронные конфигурации более крупных атомов. Четвертая подоболочка, подоболочка f , необходима для завершения электронных конфигураций для всех элементов. f подоболочка может содержать до 14 электронов.
На самом деле точная упорядоченность подоболочек в этот момент усложняется (после аргона с его 18 электронами), поэтому мы не будем рассматривать электронные конфигурации более крупных атомов. Четвертая подоболочка, подоболочка f , необходима для завершения электронных конфигураций для всех элементов. f подоболочка может содержать до 14 электронов.
Электронное заполнение всегда начинается с 1 s подоболочки, ближайшей к ядру. Next is 2 s , 2 p , 3 s , 3 p , 4 s , 3 d , 4 p , 5s, 4d, 5p, 6s, и т. д., показанные на диаграмме порядка заполнения электронной оболочки на рисунке \(\PageIndex{2}\). Следуйте за каждой стрелкой в порядке сверху вниз . Подоболочки, которых вы достигаете вдоль каждой стрелки, задают порядок заполнения подоболочек в более крупных атомах.
Пример \(\PageIndex{1}\): электронная конфигурация атомов фосфора
Используя рисунок \(\PageIndex{2}\) в качестве руководства, запишите электронную конфигурацию нейтрального атома фосфора. Атомный номер P равен 15.
Решение
Нейтральный атом фосфора имеет 15 электронов. Два электрона могут перейти в 1 9Подоболочка 0048 s , 2 может войти в подоболочку 2 s , а 6 может войти в подоболочку 2 p . Остается 5 электронов. Из этих 5 электронов 2 могут перейти в подоболочку 3 s , а оставшиеся 3 электрона могут перейти в подоболочку 3 p . Таким образом, электронная конфигурация нейтральных атомов фосфора составляет 1 S 2 2 S 2 2 P 6 3 S 2 3 P59191919191919191919191919191919191919291919191.
Упражнение \(\PageIndex{1}\): Электронная конфигурация атомов хлора
Используя рисунок \(\PageIndex{2}\) в качестве руководства, запишите электронную конфигурацию нейтрального атома хлора. Атомный номер Cl равен 17.
Атомный номер Cl равен 17.
- Ответ
Нейтральный атом хлора имеет 17 электронов. Два электрона могут попасть в подоболочку 1 s , 2 — в подоболочку 2 s и 6 — в подоболочку 2 p . Остается 7 электронов. Из этих 7 электронов 2 могут перейти на 3 s подоболочка, а оставшиеся 5 электронов могут перейти в подоболочку 3 p . Таким образом, электронная конфигурация нейтральных атомов хлора составляет 1 S 2 2 S 2 2 P 6 3 S 2 3 P 05505050505050505050505050505. 0505050505050505. .
Поскольку расположение в периодической таблице основано на конфигурации электронов, на рисунке \(\PageIndex{3}\) представлен альтернативный метод определения конфигурации электронов. Порядок заполнения просто начинается слева вверху, с водорода (Z=1) и включает каждую подоболочку по возрастанию атомного номера ( Z) .
Например, первая строка (период 1) содержит только H и He, поскольку для заполнения подоболочки 1s требуется только два электрона. S-блок второй строки содержит только два элемента, Li и Be, для заполнения подоболочки 2s. За ним следует p-блок второй строки, содержащий 6 элементов (от B до Ne), поскольку для заполнения подоболочки 2p требуется шесть электронов. Третья строка аналогична элементам второй строки. Два электрона (Na и Mg) необходимы для заполнения подоболочки 3s, а шесть электронов (от Al до Ar) необходимы для заполнения подоболочки 3p. После заполнения 3 p блока до Ar, мы видим, что следующей подоболочкой будет 4s (K, Ca), за которой следует подоболочка 3 d , которые заполнены десятью электронами (от Sc до Zn). Далее подоболочка 4p заполняется шестью электронами (от Ga до Kr). Как видите, таблица Менделеева, показанная на рисунке \(\PageIndex{3}\), обеспечивает простой способ запомнить порядок заполнения подоболочек при определении электронной конфигурации. Порядок заполнения подоболочек тот же: 1s, 2 s , 2 p , 3 s , 3 p , 4 s , 3 d , 4 p , 5s , 4д, 5п, 6с, и т.д.
Далее подоболочка 4p заполняется шестью электронами (от Ga до Kr). Как видите, таблица Менделеева, показанная на рисунке \(\PageIndex{3}\), обеспечивает простой способ запомнить порядок заполнения подоболочек при определении электронной конфигурации. Порядок заполнения подоболочек тот же: 1s, 2 s , 2 p , 3 s , 3 p , 4 s , 3 d , 4 p , 5s , 4д, 5п, 6с, и т.д.
Пример \(\PageIndex{2}\): Алюминий
Используя рисунок \(\PageIndex{3}\) в качестве руководства, напишите электронную конфигурацию нейтрального атома алюминия. Атомный номер алюминия 13.
Решение
Алюминий имеет 13 электронов.
Начало в периоде 1 периодической таблицы, рисунок \(\PageIndex{3}\) . Поместите два электрона в подоболочку 1s ( 1s 2 ).
Перейти к периоду 2 (слева направо) . Поместите следующие два электрона в подоболочку 2s ( 2s 2 ) и следующие шесть электронов в подоболочку 2p ( 2p 6 ).
Перейти к периоду 3 (слева направо) . Поместите следующие два электрона в подоболочку 3s ( 3s 2 ) и последний электрон в подоболочке 3p ( 3p 1 ).
Электронная конфигурация алюминия составляет 1S 2 2S 2 2P 6 3S 2 3P 1
91 (2
\281 ( \281 \ 2 (
\ (). \PageIndex{3}\) в качестве руководства напишите электронную конфигурацию атома с 20 электронами- Ответить
Начать с периода 1 на рисунке \(\PageIndex{3}\) . Поместите два электрона в подоболочку 1s ( 1s 2 ).
Перейти к периоду 2 (слева направо) . Поместите следующие два электрона в подоболочку 2s ( 2s 2 ) и следующие шесть электронов в подоболочку 2p ( 2p 6 ).
Перейти к периоду 3 (слева направо) . Поместите следующие два электрона в подоболочку 3s ( 3s 2 ) и следующие шесть электронов в подоболочке 3p ( 3p 6 ).
Перейдите к этапу 4. Поместите оставшиеся два электрона в подоболочку 4s ( 4s 2 ).
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
66
Валентные электроны
При изучении химической реактивности мы обнаружим, что электроны на самом внешнем главном энергетическом уровне очень важны, поэтому им дается специальное название. 6\), имеет восемь валентных электронов.
6\), имеет восемь валентных электронов.
Щелочной металл натрия (атомный номер 11) имеет на один электрон больше, чем атом неона. This electron must go into the lowest-energy subshell available, the 3 s orbital, giving a 1 s 2 2 s 2 2 p 6 3 s 1 конфигурация. Электроны, занимающие самые внешние орбитали оболочки (максимальное значение n ) называются валентными электронами, а те, что занимают орбитали внутренних оболочек, называются остовными электронами ( Рисунок \PageIndex4 ). Поскольку электронные оболочки остова соответствуют электронным конфигурациям благородных газов, мы можем сократить электронные конфигурации, написав благородный газ, который соответствует остовной электронной конфигурации, вместе с валентными электронами в конденсированном формате. В нашем примере с натрием символ [Ne] представляет электроны остова (1 с 2 2 S 2 2 P 6 ), а наша сокращенная конфигурация или сжатая конфигурация — [NE] 3 S 111111129292.
Рисунок \(\PageIndex{4}\): Сокращенная конфигурация электронов ядра (справа) заменяет электроны ядра символом благородного газа, конфигурация которого соответствует конфигурации электронов ядра другого элемента. Аналогично сокращенная конфигурация лития может быть представлена как [He]2 91 \nonumber \]
Химическая реакция возникает в результате удаления электронов, добавления электронов или совместного использования валентных электронов различных атомов. Путь, по которому пойдет конкретный элемент, зависит от того, где в атоме находятся электроны и сколько их. Таким образом, удобно разделить электроны на две группы. Электроны валентной оболочки (или, проще говоря, валентных электронов ) — это электроны в оболочке с наибольшим номером или валентной оболочке, в то время как остовные электроны — это электроны в оболочках с меньшим номером. Мы можем видеть из электронной конфигурации атома углерода — 1 S 2 2 S 2 2 P 2 — что имеет 4 валентные электроны (2 S 2 2 P 9019 29292 2
). с 2 ). В следующих главах вы увидите, что химические свойства элементов определяются количеством валентных электронов.
с 2 ). В следующих главах вы увидите, что химические свойства элементов определяются количеством валентных электронов. Пример \(\PageIndex{3}\)
Начать с периода 1 на рисунке \(\PageIndex{3}\) . Поместите два электрона в подоболочку 1s ( 1s 2 ).
Перейти к периоду 2 (слева направо) . Поместите следующие два электрона в подоболочку 2s ( 2s 2 ) и следующие шесть электронов в подоболочку 2p ( 2p 6 ).
Перейти к периоду 3 (слева направо) . Поместите следующие два электрона в подоболочку 3s ( 3s 2 ) и следующие шесть электронов в подоболочке 3p ( 3p 6 ).
Перейдите к этапу 4. Поместите оставшиеся два электрона в подоболочку 4s ( 4s 2 ).
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
66 6\), имеет восемь валентных электронов.
6\), имеет восемь валентных электронов.
Изучите электронную конфигурацию нейтральных атомов фосфора в примере \(\PageIndex{1}\), 1 S 2 2 S 2 2 P 6 3 S 2 3 P 3 4 и ABRIVEITION ABRIVITIATION.
Решение
Фосфор имеет конфигурацию электрона, 1 S 2 2 S 2 2 P 6 3 S 2929292929929299292992929292992929299292929929299292992992929299292929299тели 2 9292929292929292929292929929292992929299299292992992992992992929292919299н.
Оболочка с наибольшим номером — это третья оболочка (3 s 2 3 p 3 ): 2 электрона в подоболочке 3 s и 3 электрона в подоболочке 3 p .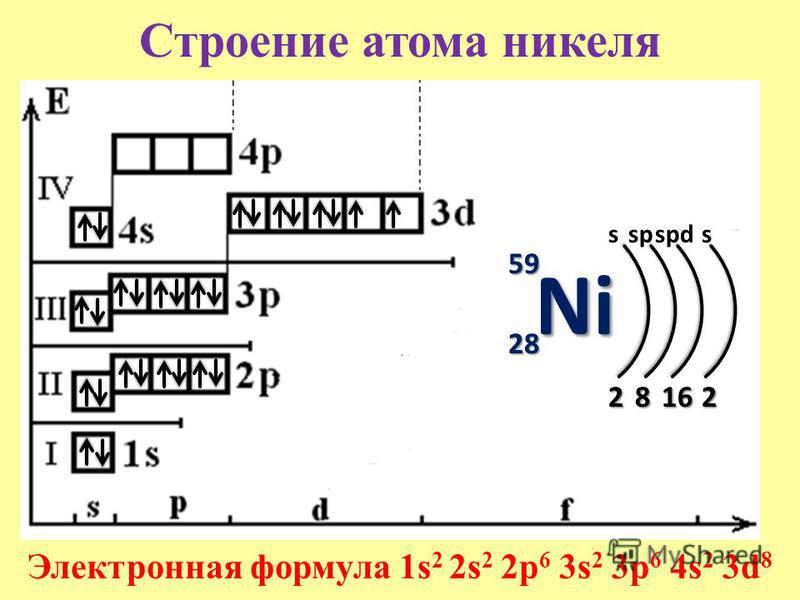 Это дает в общей сложности 5 валентных электронов .
Это дает в общей сложности 5 валентных электронов .
10 электронов внутренней оболочки (ядра), 1 с 2 2 с 2 2 p 6 можно заменить на [Ne] )). Сокращенное обозначение: [Ne]3 s 2 3 p 3
Упражнение \(\PageIndex{3}\)
Изучить электронную конфигурацию нейтрального атома кальция (Упражнение \(\PageIndex{2}\)), 1 с 2 2 с 0 0 2
- Ответить
Оболочка с наибольшим номером — четвертая оболочка 4s 2 , который имеет 2 электронов в подоболочке 4 s . Следовательно, кальций имеет 2 валентных электрона .
Электроны 18 Внутреннего оболочки (Core), 1 S 2 2 S 2 2 P 6 3 S 2 3 P2 .
 на [Ar], см. рисунок \(\PageIndex{3}\). Сокращенное обозначение: [Ar]4s 2
на [Ar], см. рисунок \(\PageIndex{3}\). Сокращенное обозначение: [Ar]4s 2
Пример \(\PageIndex{4}\)
Основываясь на их соответствующем расположении в периодической таблице (используйте рисунок \(\PageIndex{3}\)), определите количество валентных электронов и конфигурацию валентной оболочки элементов A, B и C.
Решение
Элемент А расположен в Периоде 2, 5-й позиции в 2р -блоке. Прежде чем электроны будут помещены в подоболочку 2p , сначала должна быть заполнена подоболочка 2s . Это означает, что A имеет двух валентных электронов в 2s ( 2s 2 ) и пять валентных электронов в 2p ( 2p 5 ). Ответ: 2s 2 2p 5 . Он имеет 2 + 5 = 7 валентных электронов.
Элемент B находится в периоде 3, 2-й позиции в 3s -блоке. Это означает, что B имеет два валентных электрона в 3s ( 3s 2 ). Ответ: 3с 2 .
Это означает, что B имеет два валентных электрона в 3s ( 3s 2 ). Ответ: 3с 2 .
Элемент С расположен в Периоде 5, 1-я позиция в 5с -блок). Это означает, что имеется только одного валентного электрона в 5s ( 5s 1 ). Ответ: 5s 1 .
Упражнение \(\PageIndex{4}\)
Используя положение Na в периодической таблице (рисунок \(\PageIndex{3}\)), нарисуйте оболочечную диаграмму атома натрия.
- Ответить
Натрий (Na) — первый элемент в 3-м ряду (период 3) периодической таблицы. Это означает, что первая и вторая оболочки атома Na заполнены до максимального числа электронов.
Первая оболочка (1s) заполнена 2 электронами . Вторая оболочка (2s и 2p) имеет всего 8 электронов .
 И, третья (последняя) оболочка имеет 1 электронов .
И, третья (последняя) оболочка имеет 1 электронов .Диаграмма оболочки атома Na показана ниже. Ближайшая к ядру оболочка (первая оболочка) имеет 2 электрона (2 точки), вторая оболочка имеет 8 электронов, а последняя (самая внешняя) оболочка имеет 1 электрон. ( 2.8.1 )
Упражнения для повторения концепции
- Как электроны организованы в атомах?
- Какую информацию несет электронная конфигурация?
- В чем разница между остовными электронами и валентными электронами?
Ответы
- Электроны организованы в оболочки и подоболочки вокруг ядер.
- Электронная конфигурация определяет расположение электронов в оболочках и подоболочках.
- валентных электрона находятся на оболочке с наибольшим номером; все остальные электроны являются остовными электронами.
Key Takeaway
- Электроны организованы в оболочки и подоболочки вокруг ядра атома.

- Валентные электроны определяют реакционную способность атома.
Упражнения
Эта страница под названием 2.6: Аранжировки электронов распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
- source@https://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological
2.6: Расположение электронов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 83053
Развитие навыков
- Чтобы описать, как электроны группируются внутри атомов.
Хотя мы обсудили общее расположение субатомных частиц в атомах, мы мало сказали о том, как электроны занимают пространство вокруг ядра. Движутся ли они вокруг ядра случайным образом или существуют в каком-то упорядоченном порядке?
Движутся ли они вокруг ядра случайным образом или существуют в каком-то упорядоченном порядке?
Современная теория поведения электрона называется квантовой механикой. Он делает следующие утверждения об электронах в атомах:
- Электроны в атомах могут иметь только определенные удельные энергии. Мы говорим, что энергии электронов квантуются.
- Электроны организованы в соответствии с их энергией в наборы, называемые оболочками. Как правило, чем выше энергия оболочки, тем дальше она (в среднем) от ядра. Оболочки не имеют определенного фиксированного расстояния от ядра, но электрон в оболочке с более высокой энергией будет проводить больше времени дальше от ядра, чем электрон в оболочке с более низкой энергией.
- Оболочки далее делятся на подмножества электронов, называемые подоболочками. Первая оболочка имеет только одну подоболочку, вторая оболочка имеет две подоболочки, третья оболочка имеет три подоболочки и так далее. Подоболочки каждой оболочки по порядку помечены буквами s , p , d и f .
 Таким образом, первая оболочка имеет только подоболочку s , вторая оболочка имеет подоболочку s и подоболочку p , третья оболочка имеет s , p и d подоболочек и т.д.
Таким образом, первая оболочка имеет только подоболочку s , вторая оболочка имеет подоболочку s и подоболочку p , третья оболочка имеет s , p и d подоболочек и т.д. - Различные подоболочки содержат разное максимальное количество электронов. Любая подоболочка с может содержать до 2 электронов; p подоболочка до 6 электронов; d подоболочка до 10; и f подоболочка до 14.
Расположение электронов в оболочках оказывает наибольшее влияние на химические свойства, поэтому здесь мы сосредоточимся в основном на оболочках.
Мы используем числа, чтобы указать, в какой оболочке находится электрон. Первая оболочка, ближайшая к ядру и с электронами с самой низкой энергией, — это оболочка 1. Эта первая оболочка имеет только одну подоболочку (обозначенную 1s) и может содержать максимум 2 электрона. Вот почему в первой строке периодической таблицы есть два элемента (H и He).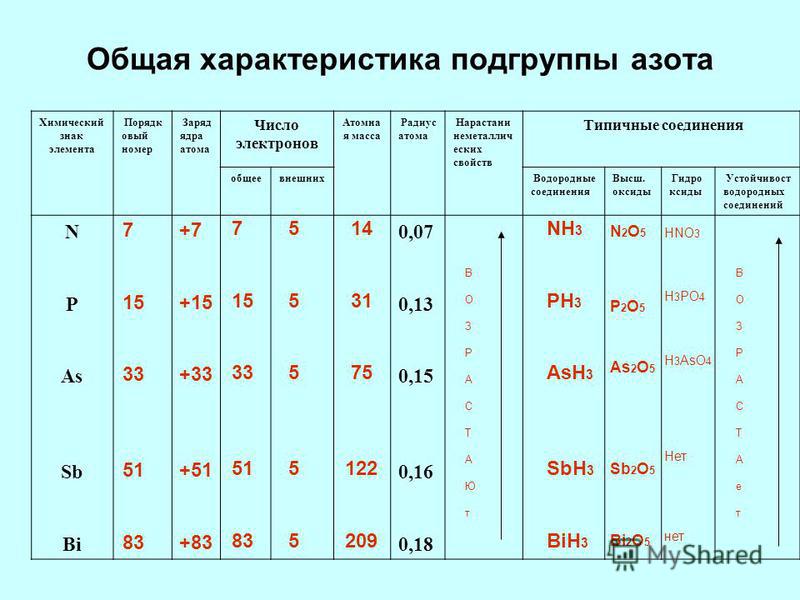
Поскольку первая оболочка может содержать максимум 2 электрона, третий электрон должен попасть во вторую оболочку. Следовательно, литий (Li), у которого всего три электрона, будет иметь два электрона на первой оболочке и один электрон на второй оболочке. Обратите внимание, что литий является первым элементом во второй строке периодической таблицы.
Вторая оболочка имеет две подоболочки (маркированные 2 s и 2 p). Подоболочка 2 s содержит максимум 2 электрона, а подоболочка 2 p содержит максимум 6 электронов. Это означает, что вторая оболочка может содержать максимум восемь электронов (2+6=8). Обратите внимание, что во второй строке периодической таблицы восемь элементов.
Только электроны в самой внешней оболочке, называемой ВАЛЕНЦИОННОЙ оболочкой, склонны реагировать (приобретаться, теряться или делиться). Вы можете себе представить, что если два атома столкнутся друг с другом, первыми будут взаимодействовать внешние электроны. Ниже приводится список всех электронов, электронов по оболочкам и валентных электронов для первых 10 элементов.
Ниже приводится список всех электронов, электронов по оболочкам и валентных электронов для первых 10 элементов.
- Водород имеет 1 электрон на первой оболочке (то есть один валентный электрон).
- Гелий имеет 2 электрона — оба на первой оболочке (то есть два валентных электрона).
- Литий имеет 3 электрона — 2 на первой оболочке и 1 на второй оболочке (то есть один валентный электрон).
- Бериллим имеет 4 электрона — 2 на первой оболочке и 2 на второй оболочке (то есть два валентных электрона).
- Бор имеет 5 электронов — 2 на первой оболочке и 3 на второй оболочке (таким образом, три валентных электрона).
- У углерода 6 электронов — 2 на первой оболочке и 4 на второй оболочке (то есть четыре валентных электрона).
- Азот имеет 7 электронов — 2 на первой оболочке и 5 на второй оболочке (то есть пять валентных электронов).
- Кислород имеет 8 электронов — 2 на первой оболочке и 6 на второй оболочке (то есть шесть валентных электронов).

- Фтор имеет 9 электронов — 2 на первой оболочке и 7 на второй оболочке (то есть семь валентных электронов).
- Неон имеет 10 электронов — 2 на первой оболочке и 8 на второй оболочке (то есть восемь валентных электронов).
На рис. 2.6.1 ниже перечислены атомные номера элементов основной группы. Атомный номер определяет количество протонов в ядре каждого атома. Для нейтральных атомов количество положительных протонов будет равно общему количеству отрицательных электронов (нулевой суммарный заряд). Например, бром (Br) имеет 35 протонов и 35 электронов. Периодические таблицы всегда указывают атомный номер.
Рисунок 2.6.1 — Атомный номер для каждого из элементов основной группы
Количество валентных электронов для каждого элемента основной группы можно определить по столбцу или группе, которую он занимает в периодической таблице. Таблица 2.6.2 ниже суммирует количество валентных электронов для каждого столбца основной группы элементов.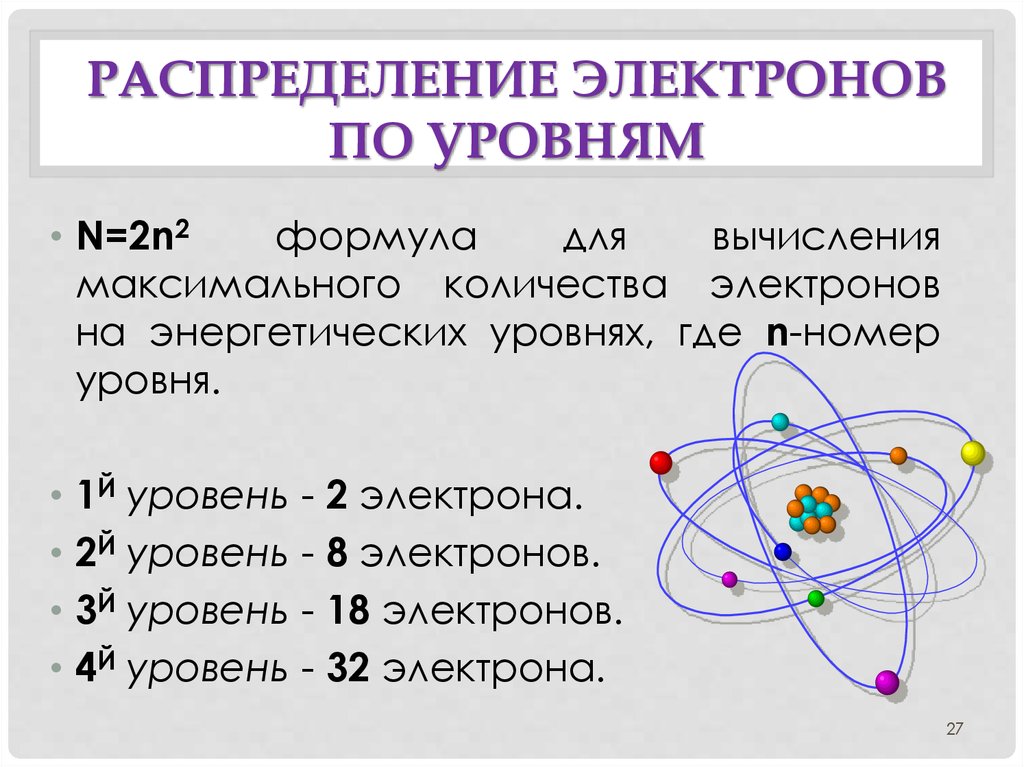 Например, все элементы в первом столбце (иногда обозначаемые IA) имеют один валентный электрон. Второй столбец (IIA) имеет два валентных электрона. Мы пропускаем короткий блок из десяти элементов в середине, потому что здесь подоболочка заполняется не по порядку. Элементы столбцов IIIA, IVA, VA, VIA, VIIA и VIIIA* имеют три, четыре, пять, шесть, семь и восемь* валентных электронов соответственно.
Например, все элементы в первом столбце (иногда обозначаемые IA) имеют один валентный электрон. Второй столбец (IIA) имеет два валентных электрона. Мы пропускаем короткий блок из десяти элементов в середине, потому что здесь подоболочка заполняется не по порядку. Элементы столбцов IIIA, IVA, VA, VIA, VIIA и VIIIA* имеют три, четыре, пять, шесть, семь и восемь* валентных электронов соответственно.
*Обратите внимание, что гелий (He) имеет только два валентных электрона. В некоторых периодических таблицах гелий помещается в столбец IIA, в других — в VIIIA, а в некоторых — в обоих местах.
Рисунок 2.6.2 — Количество валентных электронов для элементов основной группы
Пример \(\PageIndex{1}\): электроны фосфора
Сколько всего и валентных электронов содержится в нейтральном атоме фосфора?
РАСТВОР
Всего у нейтрального атома фосфора 15 электронов. На первую оболочку может попасть два электрона, на вторую — восемь, а на третью — еще пять. Третья оболочка является внешней валентной оболочкой, поэтому она имеет 5 валентных электронов.
Третья оболочка является внешней валентной оболочкой, поэтому она имеет 5 валентных электронов.
Количество электронов в каждой оболочке становится более сложным по мере добавления большего количества электронов, поскольку используется больше подоболочек и поскольку оболочка начинает заполняться не по порядку. Для элементов с атомным номером больше 20 (кроме кальция) мы просто сосредоточимся на том, сколько всего и сколько валентных электронов, а не на количестве в каждой оболочке. Мы заявили, что электроны внешней оболочки называются валентными. Внутренние (невалентные) оболочки и электроны часто называют остовом.
Пример \(\PageIndex{2}\): подсчет общего количества и валентных электронов в ксеноне
Сколько всего, валентных и остовных электронов содержится в нейтральном атоме ксенона?
РЕШЕНИЕ
Ксенон имеет всего 54, 8 валентных и 46 основных электронов.
Упражнения по обзору концепции
- Как электроны организованы в атомах?
- Какое максимальное количество электронов может поместиться на первых двух оболочках атома?
- В чем разница между остовными электронами и валентными электронами?
Ответы
- Электроны организованы в оболочки и подоболочки вокруг ядер.

- В первой оболочке может поместиться максимум два электрона, а во второй — максимум восемь электронов.
- валентных электрона находятся на внешней (внешней) оболочке с наибольшим номером; все остальные электроны являются остовными электронами.
Key Takeaway
- Электроны организованы в оболочки и подоболочки вокруг ядра атома.
Авторы
Анонимные
2.6: Arrangements of Electrons распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.




 Что происходит в периоде с ростом № химического элемента:
Что происходит в периоде с ростом № химического элемента: Домашнее задание
Домашнее задание Таким образом, первая оболочка имеет только одну подоболочку s (называемую 1 s ), the second shell has 2 s and 2 p subshells, the third shell has 3 s , 3 p , and 3 d and so forth.
Таким образом, первая оболочка имеет только одну подоболочку s (называемую 1 s ), the second shell has 2 s and 2 p subshells, the third shell has 3 s , 3 p , and 3 d and so forth. 4
4  с 2 ). В следующих главах вы увидите, что химические свойства элементов определяются количеством валентных электронов.
с 2 ). В следующих главах вы увидите, что химические свойства элементов определяются количеством валентных электронов. на [Ar], см. рисунок \(\PageIndex{3}\). Сокращенное обозначение: [Ar]4s 2
на [Ar], см. рисунок \(\PageIndex{3}\). Сокращенное обозначение: [Ar]4s 2 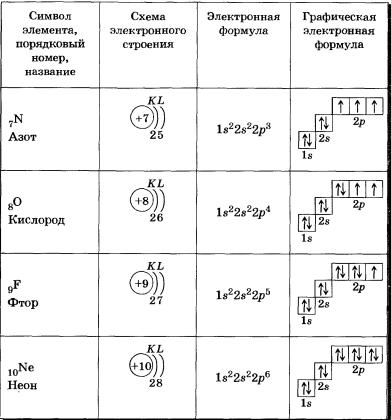 И, третья (последняя) оболочка имеет 1 электронов .
И, третья (последняя) оболочка имеет 1 электронов .
 Таким образом, первая оболочка имеет только подоболочку s , вторая оболочка имеет подоболочку s и подоболочку p , третья оболочка имеет s , p и d подоболочек и т.д.
Таким образом, первая оболочка имеет только подоболочку s , вторая оболочка имеет подоболочку s и подоболочку p , третья оболочка имеет s , p и d подоболочек и т.д.

Leave A Comment