MnO2 какой это оксид
К настоящему времени известно не менее 14 соединений состава , представляющих собой порошки черно-коричневого цвета. Формально они считаются полиморфными модификациями диоксида, хотя их состав часто существенно отличается.
Среди многочисленных реакций образования только некоторые предпочтительны благодаря легкости проведения и воспроизводимости. К ним относятся окисление соединений марганца (II) растворами хлоратов, перманганатов, персульфатов, хлором и озоном:
восстановление перманганатов действием пероксида водорода, соляной кислоты, сернистого газа, сульфитов, спиртов, солями марганца (II):
Оксид марганца (IV) проявляет кислотные свойства (MnO2 какой это оксид?), реагирует с водой и щелочами. Сильный окислитель. Прри нагревании происходит внутримолекулярная ОВР, сопровождающаяся выделением кислорода и постепенным понижением степени окисления марганца с последовательным образованием разных оксидов:
Оксиды марганца — это… Что такое Оксиды марганца?
Марганца оксиды — Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO 1780 °C зеленый Оксид марганца(II,III) Mn3O4 1590 °C коричневый Оксид марганца(II,IV) Mn5O8 … Википедия
МАРГАНЦА ОКСИДЫ — МАРГАНЦА ОКСИДЫ: MnO Mn2O3, Mn3O4, MnO2, Mn2O7 (т. н. марганцевый ангидрид), Mn5O8. Встречаются в природе, напр. MnO2 пиролюзит исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше,… … Большой Энциклопедический словарь
МАРГАНЦА ОКСИДЫ: — МАРГАНЦА ОКСИДЫ: МАРГАНЦА ОКСИДЫ: MnO, Mn2O3, Mn3O4, MnO2, Mn2O7 (т. н. марганцевый ангидрид), Mn5O8. Встречаются в природе, напр. MnO2 пиролюзит исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов… … Энциклопедический словарь
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, h3O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
МАРГАНЦА СЕМЕЙСТВО — ПОДГРУППА VIIB. СЕМЕЙСТВО МАРГАНЦА МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ Электронная конфигурация этих элементов марганца Mn, технеция Tc, рения Re характерна для переходных металлов. Каждый элемент имеет наполовину заполненную внутреннюю d оболочку, т.е.… … Энциклопедия Кольера
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, h3O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
марганца оксиды{:} — MnO, Mn3О4, Mn2О3, Mn5O8, MnO2, Mn2O7 (так называемый марганцевый ангидрид). Встречаются в природе, например. MnO2 пиролюзит исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше,… … Энциклопедический словарь
МАРГАНЦА ОКСИДЫ — МnО, Мn3О4, Мn2О3, Mn5Og, MnO2, Мn2О7 (т. н. марганцевый ангидрид). Встречаются в природе, напр. МnО3 пиролюзит исходный продукт для получения марганца и его соединений. МnО2 применяется в произ ве элементов Лекланше, катализаторов, как… … Естествознание. Энциклопедический словарь
Оксид марганца(II) — Общие … Википедия
Диоксид марганца — это… Что такое Диоксид марганца?
- Диоксид марганца
Диоксид марганца (MnO2, оксид марганца(IV), «двуокись марганца» (устар.)) — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре.Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
- 4HCl + MnO2 →(t) MnCl2 + 2H2O + Cl2↑.
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
- 2MnO2 + 2H2SO4 → 2MnSO4 + O2 + 2H2O.
При взаимодействии с сильными оксилителями диоксид марганца окисляется до соединений Mn7+ и Mn6+:
- 3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O.
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия образуется черный осадок соли Mn(SO4)
- MnO2 + CaO → CaMnO3.
Является катализатором разложения пероксида (перекиси) водорода:- 2H2O2 →(катализатор) 2H2O + O2↑.
Получение
В лабораторных условиях получают термическим разложением перманганата калия.
- 4KMnO4→(t)4MnO2+2K2O+3O2↑
Также можно получить реакцией перманганата калия с пероксидом водорода.
- 2KMnO4+H2O2→2KOH+2MnO2+O
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.:Высшая школа, 2001
См. также
Wikimedia Foundation. 2010.
- Диокл
- Диоксин
Смотреть что такое «Диоксид марганца» в других словарях:
марганца диоксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
марганца(IV) оксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Оксид марганца(IV)
МАРГАНЕЦ (химический элемент) — МАРГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55Mn.… … Энциклопедический словарь
Пиролюзит — Формула MnO2 Цвет Стальной серый, голубовато серый Цвет черты Чёрная Блеск Полуметаллический … Википедия
ЭЛЕКТРОСИНТЕЗ — (электрохимический синтез), способ получения хим. соед. в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит).… … Химическая энциклопедия
Соляная кислота — Модель молекулы хлороводорода Соляная кислота (хлороводородная, хлористоводородная, хлористый водород) … Википедия
Е507 — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлоридная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Оксид марганца(IV) — это… Что такое Оксид марганца(IV)?
Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+ и Mn6+:
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2.
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты:
Является катализатором разложения пероксида водорода:
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике эта реакция не представляет особого интереса т.к. образовавшийся MnO2 каталитически разлагает пероксид водорода, не оставляя возможности провести реакцию до конца.
При температуре выше 100 °C восстановлением перманганата калия водородом:
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Неорганическая химия под редакцией Ю. Д. Третьякова; Химия переходных элементов Кн.1
См. также
Оксид марганца(VI) — это… Что такое Оксид марганца(VI)?
- Оксид марганца(VI)
Оксид марганца(VI) — неорганическое соединение, окисел металла марганца с формулой MnO3, тёмно-красное аморфное вещество, реагирует с водой.
Получение
Физические свойства
Оксид марганца(VI) образует тёмно-красное аморфное вещество.
Химические свойства
- Разлагается при нагревании:
- Реагирует с водой:
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Соединения марганца
- Оксиды
Wikimedia Foundation. 2010.
- Оксид марганца(III)
- Оксид меди(III)
Смотреть что такое «Оксид марганца(VI)» в других словарях:
Оксид марганца(II) — Общие … Википедия
Оксид марганца(IV) — Общие … Википедия
Оксид марганца(II,IV) — Общие Систематическое наименование Оксид марганца(II,IV) Традиционные названия Окисел марганца Химическая формула Mn5O8 Физические свойства … Википедия
Оксид марганца (II) — Оксид марганца(II) Общие Систематическое наименование Оксид марганца(II) Традиционные названия Манганозит (минерал), окись марганца, монооксид марганца Химическая формула MnO … Википедия
оксид марганца — (MnO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN manganese oxide … Справочник технического переводчика
Оксид марганца(VII) — Mn2O7 зеленовато бурая маслянистая жидкость (tпл=5,9 °C), неустойчив при комнатной температуре; сильный окислитель, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Получить оксид марганца(VII) Mn2O7 можно… … Википедия
Оксид марганца(III) — Общие Систематическое наименование Оксид марганца(III) Традиционные названия Окисел марганца Химическая формула Mn2O3 Физические свойства … Википедия
Оксид марганца(II,III) — Общие Систематическое наименование Оксид марганца(II,III) Традиционные названия Окисел марганца Химическая формула Mn3O4 Физические свойства … Википедия
Марганца оксиды — Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO 1780 °C зеленый Оксид марганца(II,III) Mn3O4 1590 °C коричневый Оксид марганца(II,IV) Mn5O8 … Википедия
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
диоксид марганца — Manganese dioxide
 | |
| имена | |
|---|---|
| имена IUPAC Оксид марганца | |
| Другие имена Пиролюзит , перекись марганца, черный оксид марганца, оксид марганца | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ИКГВ InfoCard | 100.013.821 |
| Номер EC | 215-202-6 |
| номер RTECS | OP0350000 |
| |
| свойства | |
| MnO 2 | |
| Молярная масса | 86,9368 г / моль |
| Внешность | Коричнево-черная твердое вещество |
| плотность | 5,026 г / см 3 |
| Температура плавления | 535 ° С (995 ° F, 808 К) (разлагается) |
| нерастворимый | |
| + 2280,0 · 10 -6 см 3 / моль | |
| термохимия | |
| 53 Дж · моль -1 · К -1 | |
| -520 кДж · моль -1 | |
| опасности | |
| Паспорт безопасности | ICSC 0175 |
| Вредный ( Xn ) Окислитель ( О ) | |
| R-фразы (устаревшее) | R20 / 22 |
| S-фразы (устаревший) | (S2) , S25 |
| NFPA 704 |  |
| точка возгорания | 535 ° С (995 ° F, 808 К) |
| Родственные соединения | |
| Марганец дисульфид | |
| Диоксид технеция диоксид рения | |
| Марганец (II) , оксид марганца (II, III) , оксид марганца (III) , оксид марганца семиокись | |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 N проверить ( что ?) N проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
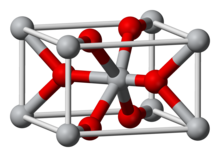
Оксид марганца (IV) , представляет собой неорганическое соединение с формулой MnO
2 . Это черновато или коричневое твердое вещество происходит естественнымвиде минералапиролюзита, который является основной рудоймарганцаи компонентамимарганца узелков. Основное использование дляMnO
2 для сухих клеточныхбатарей, такие какщелочная батареяибатарея цинка-углерод. MnO
2 также используетсякачествепигментаикачестве предшественника других соединений марганца, таких как KMnO
4 . Он используетсякачествереагентаворганическом синтезе, например, при окисленииаллиловых спиртов. MnO
2 в & alphaполиморфной модификации может включатьсебя множество атомов (а также молекулы воды) в «туннелях» или «каналы» между октаэдрами оксида марганца. Существует значительный интерес вальфа-MnO
2 в качестве возможного катода длялитийионных батарей.
Состав
Несколько полиморфных из MnO
2 востребованы, а также гидратированной форме. Какмногие другие диоксиды,MnO
2 кристаллизуется врутил кристаллической структуры(эта полиморфная модификация называетсяβ-MnO
2 ), с тремя-координатой оксида и октаэдрические металлические центрами. MnO
— Характернонестехиометрическая, будучи дефицитом кислорода. СложнымТвердотельный химическийиз этого материала имеет отношение к знаниям о «свежеприготовленного»MnO
2 ворганическом синтезе. Α-полиморфMnO
2 имеет очень открытую структуру с «каналами»которые могут вместить атомы металловтаких как серебро или бария. a-MnO
2 часто называютголландитом, после близкородственного минерала.
производство
Встречающиеся в природе диоксид марганца содержат примеси и значительное количество оксида марганца (III) . Только ограниченное количество месторождений содержит модификацию у в чистоте , достаточную для аккумуляторной промышленности.
Производство батарей и феррита (два из основных применений диоксида марганца) требует диоксида марганца высокой чистоты. Батареи требуют «электролитического диоксида марганца» в то время как ферриты требуют «химического диоксида марганца».
Химический диоксид марганца
Один способ начинается с диоксидом марганца естественно и преобразует его с помощью четырехокись азота и воды до марганца (II) , нитрат раствора. Выпаривание воды, покидает кристаллическую соль нитрата. При температуре 400 ° С, соль разлагается, высвобождая N
2 O
4 и оставляя остаток очищенного диоксида марганца. Эти два этапа можно суммировать следующим образом:
- MnO
2 + Н
2 O
4 ⇌ Mn (NO
3 )
2
В другом способе диоксид марганца carbothermically уменьшается до оксида марганца (II) , который растворяют в серной кислоте . Отфильтрованный раствор обрабатывают карбонатом аммония для осаждения МпСО
3 . Карбонатпрокаливаютна воздухе с получением смеси марганца (II) и марганца (IV) оксидов. Для того, чтобы завершить процесс, суспензию этого материала в серной кислоте, обрабатываютхлорат натрия. Хлорная кислота, который образует на месте, преобразует любой Mn (III) и Mn (II)окислов до диоксида хлора, высвобождаякачестве побочного продукта.
Третий процесс включает марганец семиокись и окись марганца . Два реагентов в сочетании с соотношением 1: 3 с образованием диоксида марганца:
- Миннесота
2 O
7 + 3 MnO → 5MnO
2
Наконец действие перманганата калия над сульфатом марганцем кристаллами дает желаемый оксид.
- 2 KMnO
4 + 3MnSO
4 + 2Н
2 O→ 5MnO
2 +К
2 SO
4 + 2Н
2 SO
4
Электролитический диоксид марганца
Электролитический диоксид марганца (EMD) используется в угольно-цинковых батарей вместе с хлоридом цинка и хлорида аммония . EMD , обычно используется в двуокиси марганца , цинка перезаряжаемые щелочные (Zn , RAM) клетки также. Для этих применений чистота чрезвычайно важна. EMD производится таким же образом , как электролитический жесткий шаг (ETP) медь : Двуокись марганца растворяет в серной кислоте (иногда в смеси с сульфатом марганца ) и подвергает тока между двумя электродами. МпО2 растворяется, поступает раствор в виде сульфата, и осаждается на аноде.
Реакции
Важные реакции MnO
2 связаны с его окислительновосстановительным, как окислением и восстановлением.
снижение
MnO
2 является главным предшественникомдляферромарганцаи родственных сплавов, которые широко используются в металлургической промышленности. Преобразования включаютКарботермическое восстановлениеиспользованиемкокса:
- MnO
2 + 2 C → Mn + 2 СО
Основные реакции MnO
2 в батареях является снижение одноэлектронного:
- MnO
2 + е— + Н +
→ MnO (OH)
MnO
2 катализируетнесколько реакцийкоторые образуютO
2 . В классической лабораторной демонстрации, нагревание смесихлората калияи диоксид марганца производит газообразный кислород. Диоксид марганца также катализирует разложениеперекиси водородадо кислорода иводы:
- 2 Н
2 O
2 → 2Н
2 O + O
2
Диоксид марганца разлагается при температуре выше примерно 530 ° С до марганца (III) оксид и кислород. При температурах , близких к 1000 ° С, со смешанной валентностью соединения Mn
3 вывода
4 формы. Более высокие температуры дают MnO.
Горячая концентрировали серная кислота снижает MnO
2 домарганца сульфат (II):
- 2 MnO
2 + 2Н
2 SO
4 → 2MnSO
4 + O
2 + 2Н
2 O
Реакции хлористого водорода с MnO
2 был использованШеелемв первоначальном выделениихлорагаза в 1774 году:
- MnO
2 + 4 HCl → MnCl
2 + Cl
2 + 2Н
2 O
В качестве источника хлористого водорода, Шеель обрабатывает хлорид натрия с концентрированной серной кислотой.
- E
о( MnO
2 (тв) + 4 Н +
+ 2 е — ⇌ Mn 2+ + 2 Н
2 O) = 1,23 В - Е
о( Cl
2 (г) + 2 е—⇌ 2 Cl—) = 1,36 V
- E
В стандартных электродных потенциалов для половины реакций показывают , что реакция является эндотермической при рН = 0 (1 М [ Н +
]), Но это способствует более низким рН , а также эволюции (и) удаление газообразного хлора.
Эта реакция является также удобным способом для удаления диоксида марганца осадка из матового стекла суставов после запуска реакции (то есть, окисление с помощью перманганата калия ).
оксидирование
Нагревание смеси KOH и MnO
2 в воздухе дает зеленыйМанганат калия:
- 2 MnO
2 + 4 + КОН вывода
2 → 2К
2 MnO
4 + 2Н
2 O
Калий Манганат является предшественником перманганата калия , общий окислитель.
Приложения
Преобладающее применение MnO
2 представляеткачестве компонентаклеточных сухихбатарей, так называемыхLeclanché клетки, илицинк-углеродных батарей. Приблизительно 500 000 тоннпотребляются для этого приложения ежегодно. Другие промышленные применения включают использованиеMnO
2 в качестве неорганическогопигментавкерамикеи встекловаренных.
Органический синтез
Специализированное использование диоксида марганца в качестве окислителя в органическом синтезе . Эффективность реагента зависит от способа получения, проблемы , которая является типичной для других гетерогенных реагентов , где площадь поверхности, в том числе других переменных, является существенным фактором. Минеральной пиролюзит делает плохой реагент. Обычно, однако, реагент генерируется на месте путем обработки водного раствора KMnO
4 с Mn (II) соли, обычно сульфата. MnO
2 окисляеталлиловыеспирты в соответствующиеальдегидыиликетоны:
- цис-RCH = СНСН
2 ОН + MnO
2 → цис-RCH = CHCHO + MnO + Н
2 O
- цис-RCH = СНСН
Конфигурация двойной связи сохраняется в реакции. Соответствующие ацетиленовые спирты также являются подходящими субстратами, хотя в результате пропаргиловых альдегиды могут быть весьма реактивными. Бензильное и даже неактивированными спирты также являются хорошими субстратами. 1,2- диолы расщепляются MnO
2 сдиальдегидамиилидикетонов. В противном случае применениеMnO
2 многочисленны, применимый ко многим видам реакцийвключаяаминноеокисление, ароматизацию,окислительное сочетание, итиоловоеокисление.
опасности
Хроническая подверженность загрязненного воздуха с частицами двуокиси марганца может вызвать отравление марганца . MnO
2 классифицируются как совокупный нейротоксинсоответствии с MSDS для диоксида марганца.
Смотрите также
Рекомендации
внешняя ссылка
Какова формула оксида марганца (IV)? + Пример
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
Какова степень окисления MnO2?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
- Статистика
Оксид | химическое соединение | Британника
Оксид , любой из большого и важного класса химических соединений, в котором кислород сочетается с другим элементом. За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
Как металлы, так и неметаллы могут достигать своих высших степеней окисления (т.е. отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом.Щелочные металлы и щелочноземельные металлы, а также переходные металлы и постпереходные металлы (в их более низких степенях окисления) образуют ионные оксиды, то есть соединения, содержащие анион O 2-. Металлы с высокой степенью окисления образуют оксиды, связи которых имеют более ковалентную природу. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионного к ковалентному наблюдается по мере того, как периодическая таблица проходит от металлов слева к неметаллам справа.Такое же изменение наблюдается в реакции оксидов с водой и в результате кислотно-основного характера продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион OH — ) и образующихся основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
| Источник: Источник: W.Робинсон, Дж. Одом и Х. Хольцкло-младший, Химия: концепции и модели, D.C. Heath and Co., 1992. | |||||||
| Реакция оксидов с водой и кислотно-основной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg (OH) 2 (слабое основание) | Al 2 O 3 не реагирует | SiO 2 не реагирует | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Cl 2 O 7 дает HClO 4 (сильная кислота) |
| соединение в оксидах | Na 2 O ионный | MgO ионный | Al 2 O 3 ионный | SiO 2 ковалентный | P 4 O 10 ковалентный | SO 3 ковалентный | Cl 2 O 7 ковалентный |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами.Таким образом, амины, фосфины и сульфиды образуют оксиды аминов, оксиды фосфина и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Оксиды металлов
Оксиды металлов — это твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской.Подпишитесь сегодня Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных кислородных соединений: (1) оксиды, содержащие ионы оксида, O 2-, (2) пероксиды, содержащие ионы пероксидов, O 2 2-, которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 — , которые также имеют ковалентные связи кислород-кислород, но с одним отрицательным зарядом меньше, чем ионы пероксида. Щелочные металлы (которые имеют степень окисления +1) образуют оксиды, M 2 O, пероксиды, M 2 O 2 , и супероксиды, MO 2 .(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены путем нагревания нитрата соответствующего металла с элементарным металлом.
2MNO 3 + 10M + тепло → 6M 2 O + N 2 Обычное получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 И оксиды щелочных металлов, и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M (OH) 2 (где M = металл группы 2)
Таким образом, эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важные основные оксиды являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорного кирпича и теплоизоляции, а также оксид кальция (СаО), также называемый негашеной или известь, широко используется в металлургической промышленности и в воде очистки.
Периодические тренды оксидов тщательно изучены. В любой данный период связывание в оксидах прогрессирует от ионного к ковалентному, а их кислотно-основной характер меняется от сильно основного до слабоосновного, амфотерного, слабокислого и, наконец, сильно кислого. В общем, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO

Leave A Comment