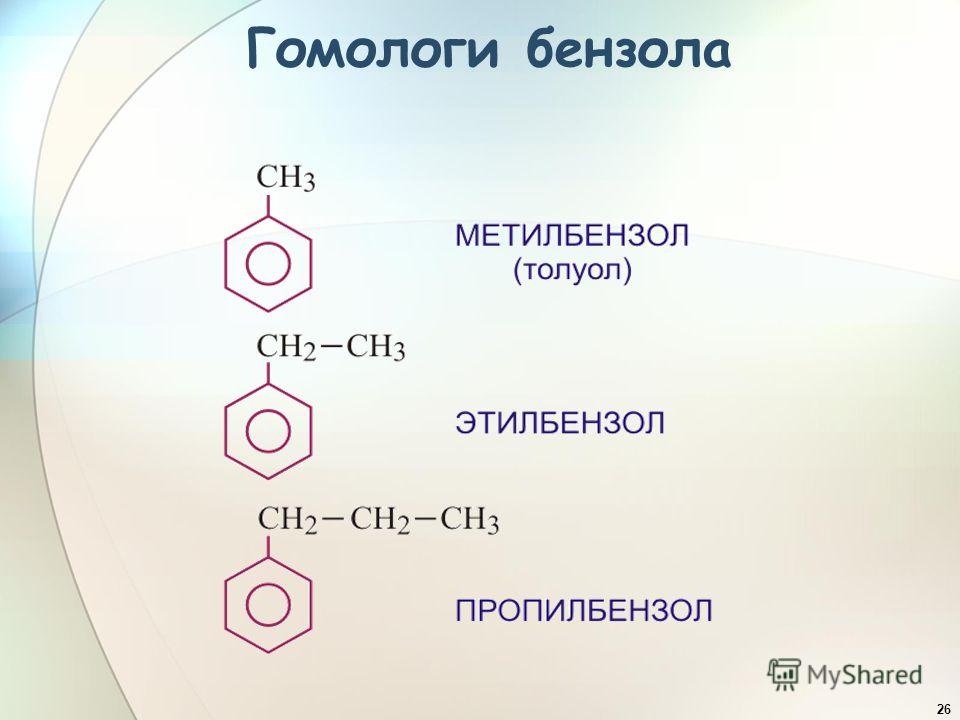
Толуол — Нефтехимия и газохимия
Толуол — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пельтье в 1835 г. при перегонке сосновой смолы.
История элемента Тонуол
В 1838 г. выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил свое название.
Характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие.
Смешивается в неограниченных пределах с углеводородами, многими спиртами и эфирами, не смешивается с водой.
Показатель преломления света 1,4969 при 20 °C.
Горюч, сгорает коптящим пламенем.
Химические свойства
Продукт каталитического риформинга бензиновых фракций нефти.
Выделяется селективной экстракцией и последующей ректификацией.
Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты нельзя забывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (менее 30 °C).
Толуол также образует с водой азеотропную смесь.
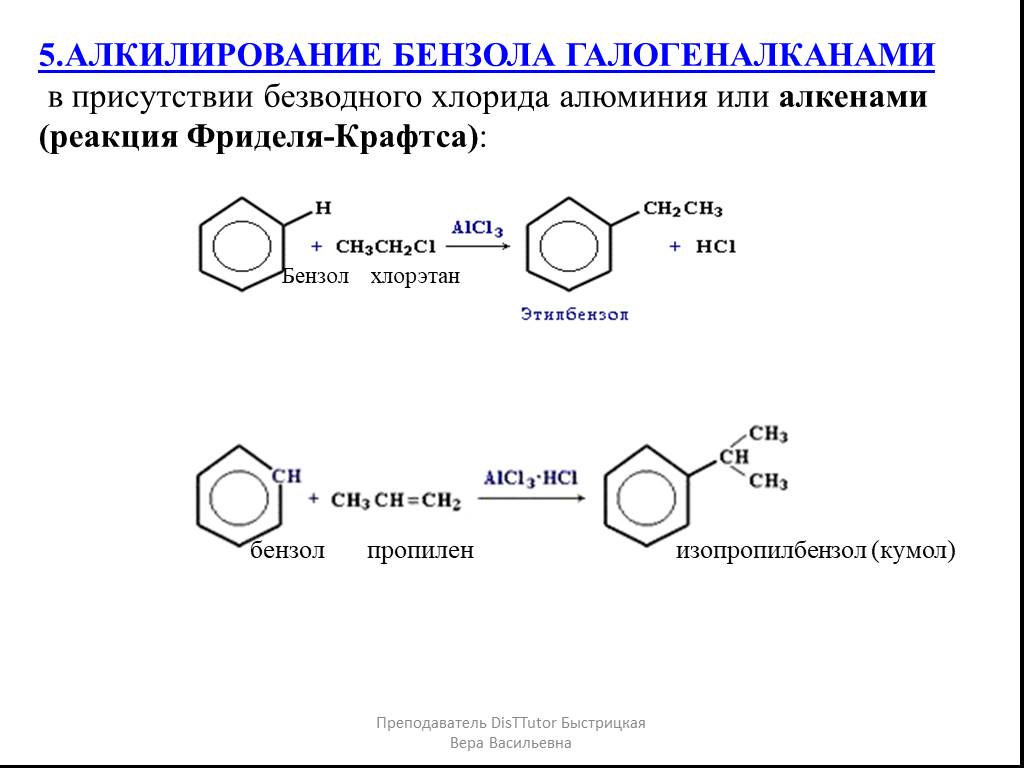
Толуол можно получить из бензола по реакции Фриделя-Крафтса:
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Пары могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или под тягой.
Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или под тягой.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Риск для здоровья
Согласно другим источникам, (САНПИН, меры предосторожности при работе с летучими органическими растворителями) — Толуол (метилбензол) — является сильно токсичным ядом, влияющим на функцию кроветворения организма, также, как и его предшественник, бензол. Нарушение кроветворения проявляется в цианозе, гипоксии.
Существует также толуольная токсикомания, которая имеет и канцерогенное влияние.
В целом, бензольные углеводороды очень токсичны, длительное их воздействие может привести к необратимым поражениям ЦНС, кроветворных органов, и создать предпосылки для возникновения энцефалопатии.
2. ПОЛУЧЕНИЕ МЕТИЛБЕНЗОЛА В ЛАБОРАТОРИИ И ПРОМЫШЛЕННОСТИ
Продукт каталитического риформинга бензиновых фракций нефти.
Выделяется селективной экстракцией и последующей ректификацией. Также
хорошие выходы достигаются при каталитическом дегидрировании гептана
через метилциклогексан.
В лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье
и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй
использовал толуанский бальзам, извлеченный из южноамериканского дерева
Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол.
В настоящее время значительное количество метилбензола дает перегонка
нефти и каменноугольной смолы с последующей очисткой. В процессе
коксования толуол извлекается из коксового газа. При синтезе стирола он
выделяется как побочный продукт реакции бензола и этилена. В лаборатории и
промышленности получение толуола проводится разными методами [4].
 Толуол получают из
гептана в присутствии катализатора при температуре 300 C°.
Толуол получают из
гептана в присутствии катализатора при температуре 300 C°.2. Алкилирование бензола, которое получило название реакция Фриделя- Крафтса. Проводится в присутствии катализатора AlCl3 или других катализаторов:
3. Взаимодействие с бромбензолом:
С6Н5–Br + СН3–Br + 2Na = С6Н5–СН3 + 2NaBr.
4. Смешивание цинка и крезола:
C6h5Ch4OH + Zn = C6H5Ch4 + ZnO.
5. Обработка толуолсульфоновой кислоты [5].
Рассмотрим подробнее указанные методы получения.
Извлечение ароматических углеводородов из каменного угля и нефти
Главным источником ароматических углеводородов являются нефть и каменный уголь. В основе промышленного получения ароматических углеводородов лежат реакции дегидрирования циклоалканов и дегидроциклизации алканов – каталитический риформинг нефти. Катализатором обычно является платина, нанесенная на окись алюминия высокой степени чистоты.
В этих условиях ароматические углеводороды получаются в результате трех основных типов реакций:
При дегидрировании этилбензола образуется производное бензола с
непредельной боковой цепью – винилбензол (стирол) C6H5-CН=СН2 (исходное
вещество для получения ценного полимера полистирола).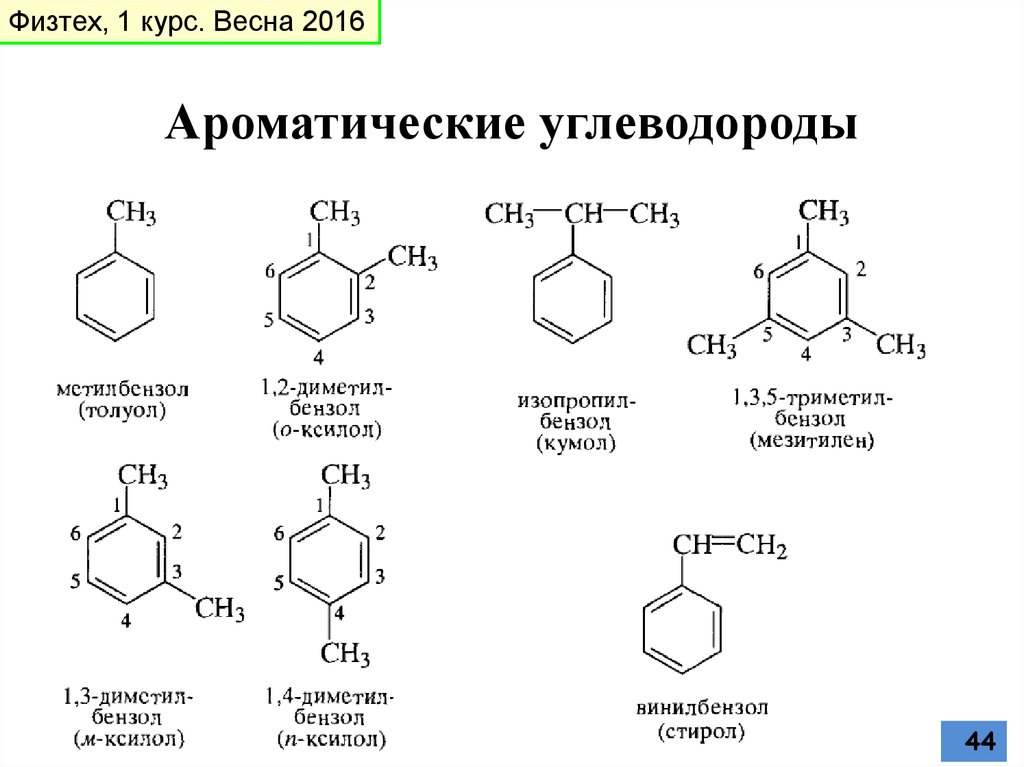
2) дегидроизомеризация гомологов циклопентана, например:
3) дегидроциклизация алканов (дегидрирование и циклизация), имеющих шесть и более атомов углерода, например:
Позднее аналогичные превращения были осуществлены нагреванием алканов с серой при 400 °С или селеном при 500 °С. Водород в этих случаях выделяется в виде сероводорода или селеноводорода.
В настоящее время около 90 % бензола и его гомологов получают в промышленности в результате каталитического риформинга нефти.
Важный источник ароматических соединений — коксование каменного угля. При коксовании каменного угля образуется кокс (75% от массы угля), коксовый газ (300 м3 на одну тонну угля) и каменноугольная смола (2-4% от массы угля).
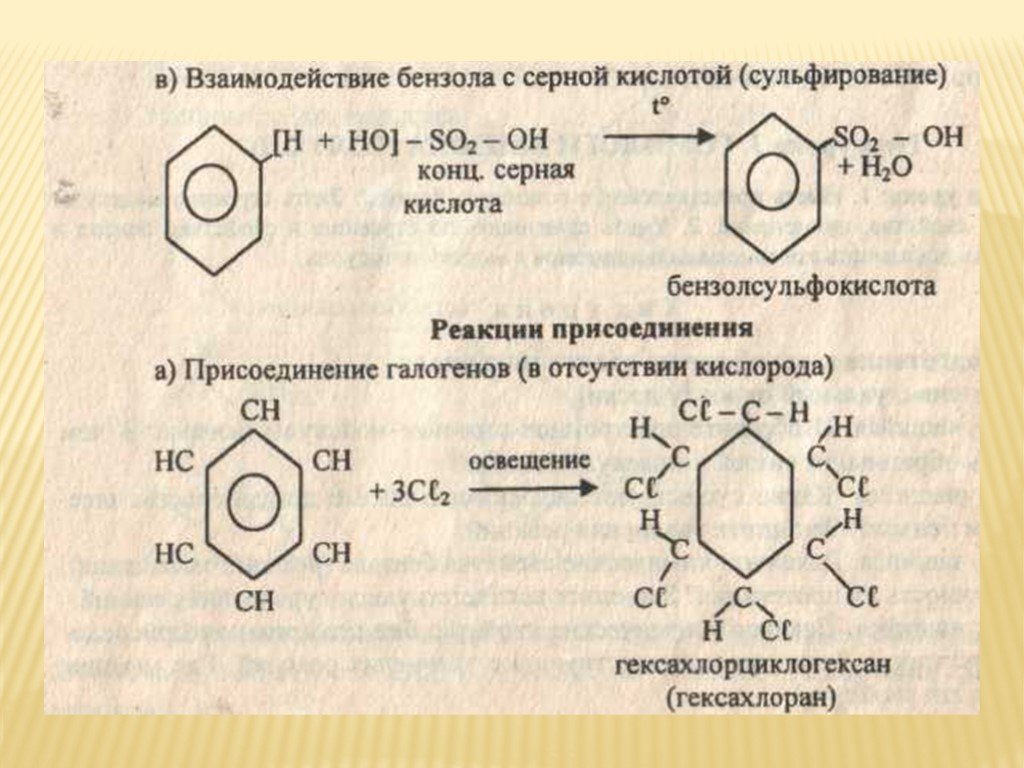
Таблица 2 – Продукты фракционной перегонки каменноугольной смолы
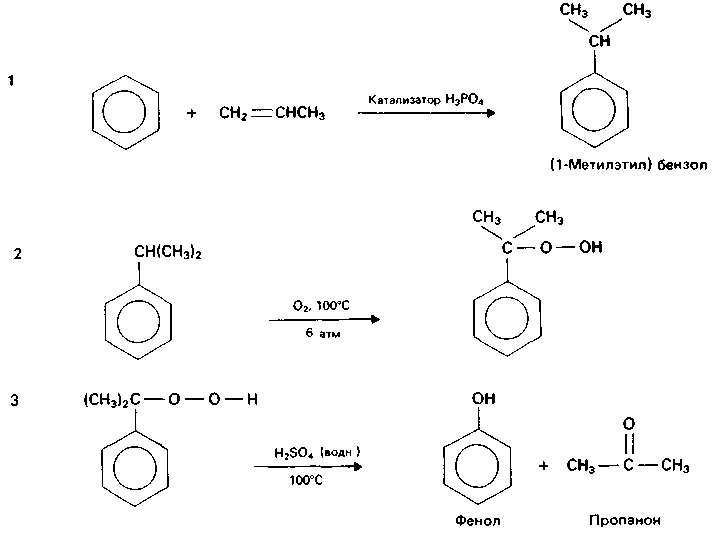
Наболее общим методом получения алкилбензолов является алкилирование бензола по Фриделю-Крафтсу с помощью алкилгалогенидов, спиртов или алкенов:
Галогенопроизводные могут быть замнены в этой реакции олефинами или спиртами. Например, реакции алкилирования бензола пропеном и спиртом имеют вид:
Здесь в качестве катализатора применяют фосфорную, серную и
фтористоводородную кислоты.
Другим классическим способом синтеза алкилбензолов является реакция
Вюрца-Фиттига (1864 год) — конденсация смеси алкилгалогенида и
арилгалогенида под действием металлического натрия:
Чистые ароматические углеводороды получаются восстановлением
соответствующих ароматических кетонов:
— гидразином в щелочной среде (восстановление по Кижнеру-Вольфу):
При этом исходные кетоны получают реакцией Фриделя – Крафтса:
Для нормального течения реакции следует использовать более одного моль
хлорида алюминия.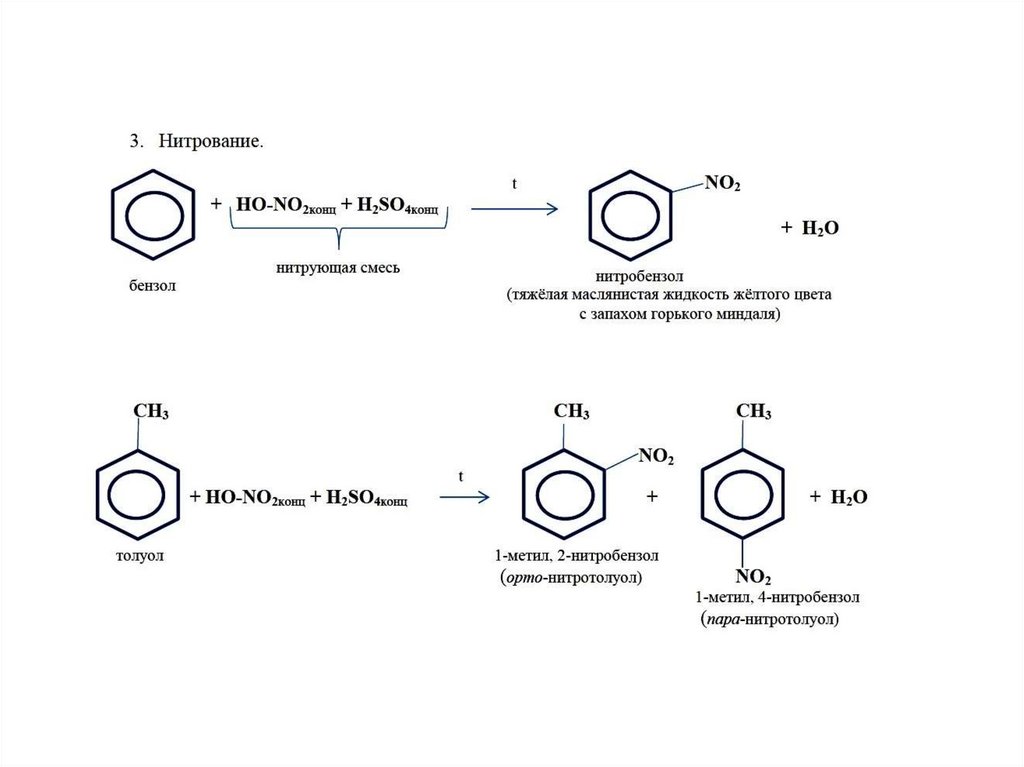 Предполагается, что хлорид алюминия образует с
хлорангидридом комплекс, который становится активным началом в реакции
под влиянием избытка хлорида алюминия:
Предполагается, что хлорид алюминия образует с
хлорангидридом комплекс, который становится активным началом в реакции
под влиянием избытка хлорида алюминия:
Ароматические углеводороды получаются при нагревании кетонов жирного ряда с серной кислотой. Так, например, из ацетона получается мезитилен:
Гомологи бензола можно получить также восстановлением соответствующих производных ароматических углеводородов водородом в присутствии катализаторов:
В качестве катализаторов данной реакции применяют никель, платину или
палладий.
Метод дает возможность восстанавливать самые различные карбонильные
соединения и оказался особенно удобным для синтеза углеводородов из
жирноароматических кетонов, образующихся по реакции Фриделя-Крафтса. В
качестве растворителей применяются как смешивающиеся, так и не
смешивающиеся с соляной кислотой вещества.
Ацетилен и его гомологи образуют арены при температуре красного
каления (Бертло).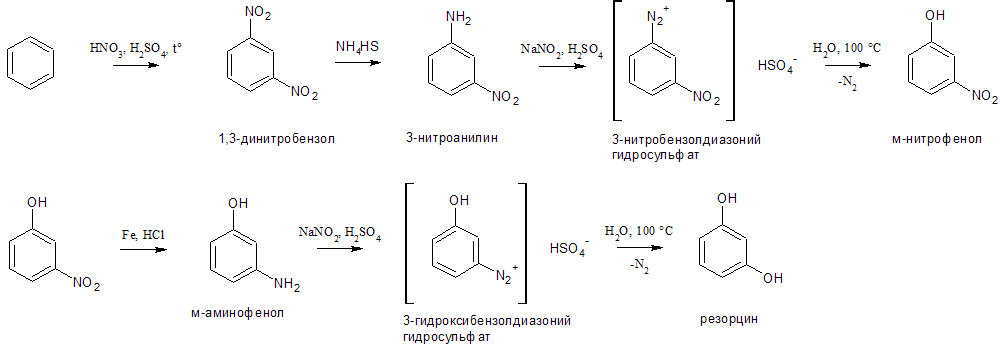
При нагревании в присутствии активированного угля (Н.Д. Зеленский) или
в присутствии катализатора – Ni(CO)2[(C6H5)3P]2 (В. Реппе) ацетилен образует
бензол.
Реакции получения аренов указывают на взаимосвязь между различными
группами углеводородов и на возможность их превращения друг в друга [6].
Способ извлечения ароматических углеводородов из коксового газа абсорбцией
Способ заключается в том, что сначала в скруббере коксовый газ приводят
в контакт с промывочной жидкостью и путем абсорбции отделяют
ароматические углеводороды от коксового газа. Затем обогащенную
ароматическими углеводородами промывочную жидкость нагревают и под
действием водяного пара отгоняют ароматические углеводороды из
промывочной жидкости. Промывочную жидкость после охлаждения снова
подают в скруббер. При этом в качестве промывочной жидкости применяют
дизельное биотопливо, причем дизельное биотопливо подают в скруббер при
температуре от 10 до 50°С. Для отгонки абсорбированных ароматических
углеводородов дизельное биотопливо нагревают до температуры от 100 до
250°С, воздействуя перегретым водяным паром с температурой свыше 150°С.
При коксовании углей выделяются ароматические углеводороды в
качестве компонента образующегося коксового газа. Для отвода ароматических
углеводородов для последующего использования и предупреждения их выброса
в окружающую среду их вымывают при очистке коксового газа в большинстве
случаев после отделения дегтя и аммиака из коксового газа. На практике в
качестве промывочной жидкости используется поглотительное масло на основе
фракции дегтярного масла, образуемой при переработке каменного угля. В
соответствии с основными содержащимися ароматическими углеводородами:
бензол, толуол, ксилол, эта технологическая операция называется, как правило,
промывкой БТК (бензол, толуол, ксилол) или бензольной промывкой.
Перечисленные ароматические углеводороды обозначаются также общим
понятием «сырой бензол», при этом доля сырого бензола, зависящая от
примененного в процессе коксования угля и технологического режима,
составляет обычно от 20 до 40 г на норм. м3
. В сыром бензоле обычно
содержатся 55-75% бензола, 13-19% толуола и 5-10% ксилолов. Кроме того, коксовый газ содержит мультициклические ароматические углеводороды, в
частности нафталин, которые поглощаются поглотительным маслом. При этом
в коксовом газе содержатся примеси, в частности h3S, HCN, Nh4, а также
органические сернистые соединения. Типичным составом коксового газа
является, например:
Кроме того, коксовый газ содержит мультициклические ароматические углеводороды, в
частности нафталин, которые поглощаются поглотительным маслом. При этом
в коксовом газе содержатся примеси, в частности h3S, HCN, Nh4, а также
органические сернистые соединения. Типичным составом коксового газа
является, например:
Таблица 3 – Состав коксового газа
Способы промывки БТК применяются на протяжении десятилетий без
коренного изменения и описаны, например, в книге О.Гроскински «Справочник
по коксованию» (О.Grosskinsky. Handbuch des Kokereiwesens), т.2, издание
1958 г., стр.137 и последующие. Промывка БТК проводится в одном или
нескольких последовательно расположенных скрубберах, при этом для
абсорбции ароматических углеводородов поглотительным маслом необходимо
обеспечить надежный контакт между коксовым газом и поглотительным
маслом в качестве промывочной жидкости. Надежный контакт может
достигаться, с одной стороны, за счет тонкого распыления поглотительного
масла и, с другой стороны, посредством тонких масляных пленок. Особо
оптимальной является комбинация из оросительного устройства, с одной
стороны, и хордовых насадок, наполнителей или прочих встроенных элементов,
с другой стороны, причем выходящие из оросительной установки масляные капли создают масляную пленку по возможности с большой поверхностью.
Растворимость бензола, толуола и ксилола зависит, в частности, от давления
пара разных компонентов, вследствие чего поглотительное масло подается в
скруббер при относительно низких температурах, предпочтительно при около
комнатной температуре. С другой же стороны, поглотительное масло должно
обладать также достаточной текучестью и малой вязкостью для того, чтобы оно
могло хорошо распыляться и образовывать большую площадь поверхности.
Обогащенное ароматическими углеводородами поглотительное масло,
накапливающееся на дне скруббера, отводится, при этом сырой бензол
отгоняется при повышенной температуре из поглотительного масла под
действием водяного пара. Затем после охлаждения поглотительного масла его
снова подают в скруббер.
Особо
оптимальной является комбинация из оросительного устройства, с одной
стороны, и хордовых насадок, наполнителей или прочих встроенных элементов,
с другой стороны, причем выходящие из оросительной установки масляные капли создают масляную пленку по возможности с большой поверхностью.
Растворимость бензола, толуола и ксилола зависит, в частности, от давления
пара разных компонентов, вследствие чего поглотительное масло подается в
скруббер при относительно низких температурах, предпочтительно при около
комнатной температуре. С другой же стороны, поглотительное масло должно
обладать также достаточной текучестью и малой вязкостью для того, чтобы оно
могло хорошо распыляться и образовывать большую площадь поверхности.
Обогащенное ароматическими углеводородами поглотительное масло,
накапливающееся на дне скруббера, отводится, при этом сырой бензол
отгоняется при повышенной температуре из поглотительного масла под
действием водяного пара. Затем после охлаждения поглотительного масла его
снова подают в скруббер.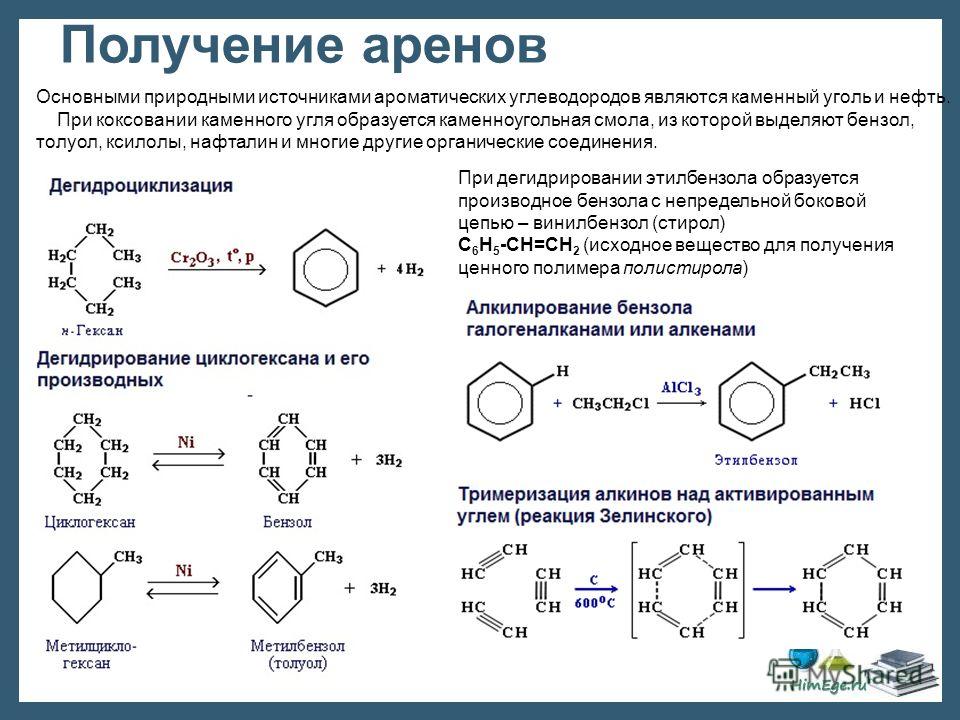 Для обеспечения значительной промывки сырого
бензола при максимально большой производительности коксового газа
поглотительное масло подается в скруббер в избытке. Для того, чтобы с учетом
образующегося на современных коксохимических заводах количества
коксового газа можно было провести промывку БТК, требуются большие
количества поглотительного масла [7].
Для обеспечения значительной промывки сырого
бензола при максимально большой производительности коксового газа
поглотительное масло подается в скруббер в избытке. Для того, чтобы с учетом
образующегося на современных коксохимических заводах количества
коксового газа можно было провести промывку БТК, требуются большие
количества поглотительного масла [7].
Очистка
Очищают толуол аналогично бензолу, только в случае применения
концентрированной серной кислоты следует учитывать, что толуол
сульфируется легче бензола, а, значит, необходимо поддерживать более низкую
температуру реакционной смеси (практически — менее 30 °C).
В нефтеперерабатывающей промышленности на установках экстракции
ароматических углеводородов очистка экстракта от примесей неароматических
углеводородов проводится методом простой ректификации в предбензольной
колонне. При этом до 20% экстракта отгоняется и возвращается в
экстракционную колонну. Таким образом, наиболее трудноудаляемые примеси
к аренам не выводятся из системы, а рециркулируют, ухудшая результаты
процесса экстракции. Другим недостатком простой ректификации является то,
что примеси, не образующие азеотропов с бензолом, остаются в экстракте,
снижая качество бензола и толуола.
Другим недостатком простой ректификации является то,
что примеси, не образующие азеотропов с бензолом, остаются в экстракте,
снижая качество бензола и толуола.
С целью исключения рецикла, снижения энергозатрат и повышения
качества бензола и толуола предлагают для их очистки вместо простой
ректификации использовать азеотропную ректификацию.
Известны способы очистки бензола и толуола от примесей
неароматических углеводородов азеотропной ректификацией с
диметоксиметаном и метанолом (пат. США 5405505, 1995), смесью метанола и
ацетона (пат. ЧССР 135677, 1970), ацетоном (пат. Франции 1510250, 1967).
Наиболее близок способ выделения бензола из смесей с парафиновыми и
нафтеновыми углеводородами сочетанием экстракции с последующей
азеотропной ректификацией экстракта с ацетоном (пат. Франции 1510250,
1967), принятый за прототип.
Химические свойства
Для толуола характерны реакции электрофильного замещения в
ароматическом кольце и замещения в метильной группе по радикальному
механизму.
Электрофильное замещение в ароматическом кольце идёт
преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения
(гидрирование), озонолиза. Некоторые окислители (щелочной раствор
перманганата калия, разбавленная азотная кислота) окисляют метильную
группу до карбоксильной. Температура самовоспламенения 535 °C.
Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется
бензойная кислота:
Взаимодействие с перманганатом калия в кислой среде:
Взаимодействие с перманганатом калия в нейтральной среде
Химические реакции ароматического ядра толуола
Бромирование, которое проводится в присутствии катализаторов.
Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.
Нитрование метилбензола осуществляется смесью, состоящей из
концентрированных азотной и серной кислот.
Нитрогруппа в толуоле может занимать орто- и пара-положение. Реакция
идет по механизму электрофильного замещения. При высокой температуре
образуется взрывчатое вещество тринитротолуол (тротил).
Реакция
идет по механизму электрофильного замещения. При высокой температуре
образуется взрывчатое вещество тринитротолуол (тротил).
Гидрирование водородом на катализаторе приводит к деароматизации и
получению метилциклогексана: C7H8 + 3h3 = C7h24.
Хлорирование при сильном нагревании или под действием УФ-излучения
завершается образованием гексахлорциклогексана [8].
РЕАКЦИИ ФРИДЕЛЯ-КРАФТА БЕНЗОЛА И МЕТИЛБЕНЗОЛА На этой странице подробно описаны реакции Фриделя-Крафтса бензола и метилбензола (толуола). Механизмы некоторых из этих реакций описаны в других разделах сайта, и вы найдете ссылки на них по мере продвижения. Ацилирование по Фриделю-Крафтсу Ацилирование бензола по Фриделю-Крафтсу Что такое ацилирование? Ацильная группа представляет собой алкильную группу, присоединенную к двойной связи углерод-кислород. Наиболее часто используемой ацильной группой является CH 3 CO-. Это называется этаноильной группой, и в этом случае реакцию иногда называют «этаноилированием». В следующем примере мы заменяем CH 3 СО-группу в кольцо, но с таким же успехом можно использовать любую другую ацильную группу. Факты Наиболее реакционноспособным веществом, содержащим ацильную группу, является ацилхлорид (также известный как хлорангидрид). Они имеют общую формулу RCOCl. Бензолобрабатывают смесью этанолилхлорида, CH 3 COCl и хлорида алюминия в качестве катализатора. Смесь нагревают примерно до 60°С в течение примерно 30 минут. Образуется кетон под названием фенилэтанон (старое название: ацетофенон). | ||
Примечание: Не беспокойтесь о названии «фенилэтанон» — важно только то, что вы можете нарисовать структуру. 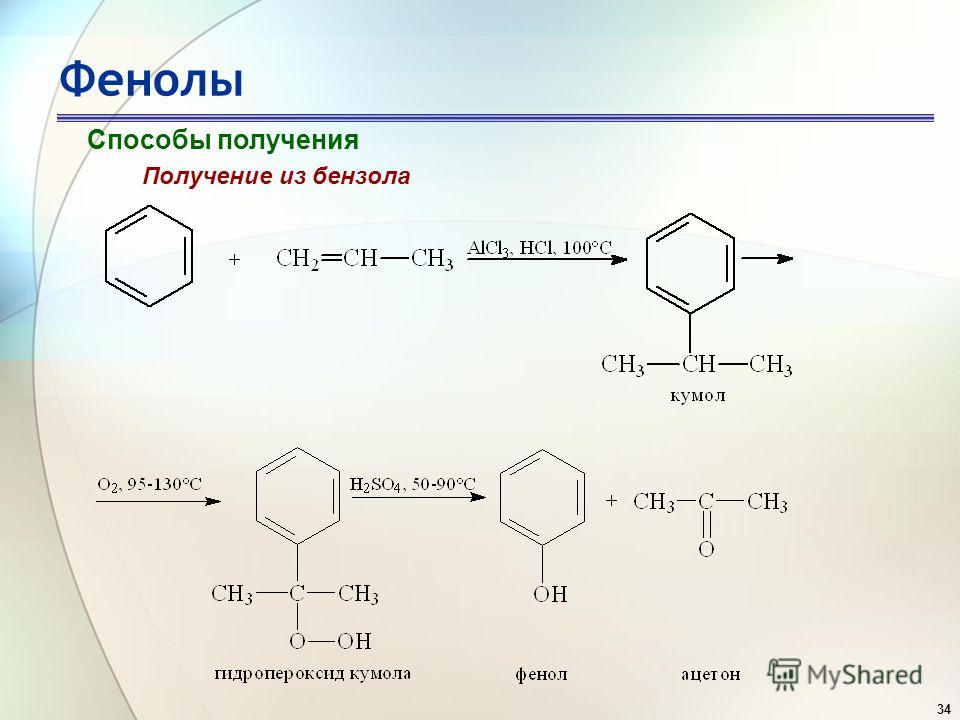 Вы можете найти небольшие вариации условий этой реакции. Различные рецепты, которые я нашел, варьируют температуру и время — например, используя более низкую температуру в течение более длительного времени. | ||
или, если вы хотите более компактную форму: Хлорид алюминия не вписан в эти уравнения, потому что он действует как катализатор. Если вы хотите включить его, вы можете написать AlCl 3 поверх стрелки (см. ниже). | ||
Примечание: Вы найдете механизм этой реакции в разделе механизмов на этом сайте. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | ||
Ацилирование метилбензола (толуола) по Фриделю-Крафтсу Реакция точно такая же, как и с метилбензолом, за исключением того, что вам нужно беспокоиться о том, где ацильная группа присоединяется к кольцу относительно метильной группы. Обычно метильная группа в метилбензоле направляет новые группы во 2-е и 4-е положения (при условии, что метильная группа находится в 1-м положении). Однако при ацилировании практически все замены происходят в 4-м положении. | ||
Примечание: Причина 2,4-направленного эффекта метильной группы находится за пределами уровня UK A. Причина, по которой вы практически не получаете 2-изомера в этом случае, заключается в размере входящей ацильной группы. Все становится слишком загроможденным (и, следовательно, менее стабильным), если вы пытаетесь поместить ацильную группу рядом с метильной группой. | ||
Алкилирование по Фриделю-Крафтсу Алкилирование бензола по Фриделю-Крафтсу Что такое алкилирование? Алкилирование означает замену алкильной группы на что-либо, в данном случае на бензольное кольцо. Факты Бензол реагирует при комнатной температуре с хлоралканом (например, хлорметаном или хлорэтаном) в присутствии хлорида алюминия в качестве катализатора. На этой странице мы рассмотрим замену метильной группы, но таким же образом можно использовать и любую другую алкильную группу. Замена метильной группы дает метилбензол. или: | ||
Примечание: Образовавшийся метилбензол более реакционноспособен, чем исходный бензол, поэтому реакция на этом не останавливается. Вы получаете дополнительные метильные группы, замещенные вокруг кольца. Вы можете повысить свои шансы получить монозамещение, используя большой избыток бензола. Вам не придется беспокоиться об этом для целей уровня A в Великобритании. Вы найдете механизм этой реакции в разделе механизмов этого сайта. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | ||
Алкилирование метилбензола (толуола) по Фриделю-Крафтсу Опять же, реакция точно такая же с метилбензолом, за исключением того, что вам нужно беспокоиться о том, где алкильная группа присоединяется к кольцу относительно метильной группы. К сожалению, на этот раз возникла проблема! Место, где оказывается входящая алкильная группа, в значительной степени зависит от температуры реакции. При 0°С, замещая метильные группы в метилбензол, получают смесь 2-,3- и 4-изомеров в соотношении 54%/17%/29%. Это более высокая доля 3-изомера, чем можно было бы ожидать. При 25°C пропорции меняются на 3% / 69% / 28%. Другими словами, доля 3-изомера увеличилась еще больше. Поднимите температуру еще немного, и тенденция сохранится. Причина этого снова выходит за рамки уровня UK A. | ||
Примечание: Проблема в этом случае заключается в том, что метильные группы, присоединенные к кольцу, могут снова отпасть и снова присоединиться в другом месте в присутствии хлорида алюминия. 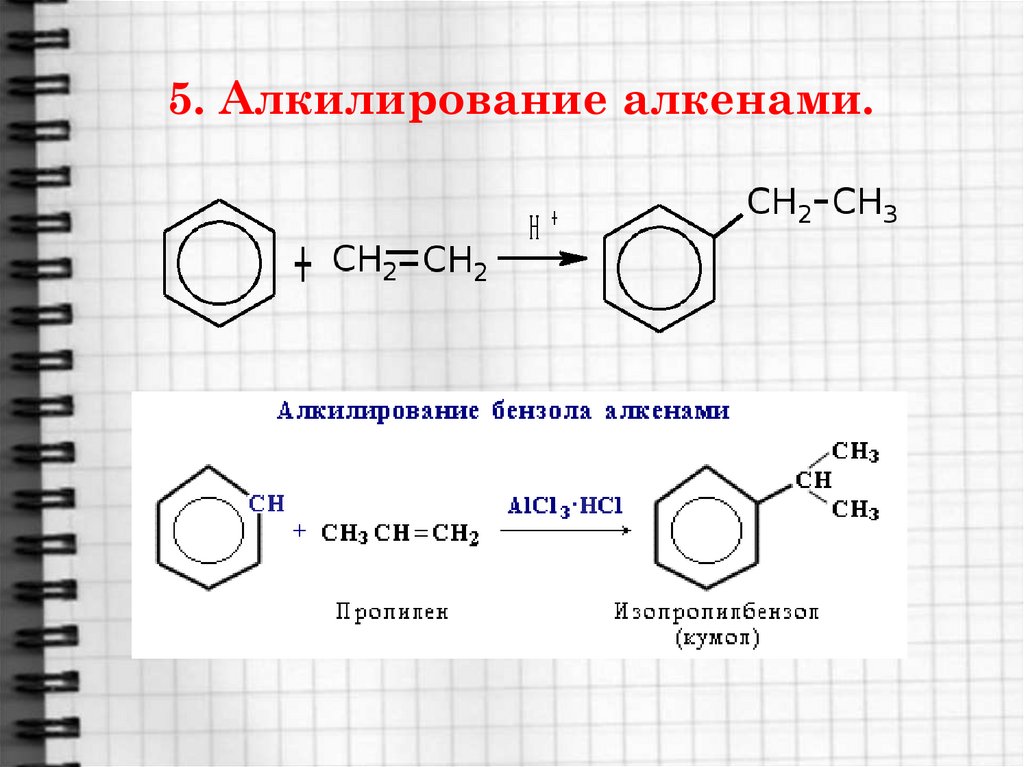 Вы можете установить равновесие между различными изомерами. Вы можете установить равновесие между различными изомерами.Причина 2,4-направляющего действия метильной группы в метилбензоле заключается в том, что 2- и 4-изомеры образуются быстрее, чем 3-изомер. Однако в этом случае 3-изомер является наиболее термодинамически стабильным из трех. Если вы повысите температуру или подождите больше времени, установится равновесие в пользу наиболее стабильного продукта. Вам НЕ нужно беспокоиться об этом для достижения уровня A. | ||
Алкилирование Фриделя-Крафтса в промышленности Производство этилбензола Этилбензол — важный промышленный химикат, используемый для производства стирола (фенилэтена), который, в свою очередь, используется для производства полистирола — поли(фенилэтена). Производится из бензола и этилена. Есть несколько способов сделать это, некоторые из которых используют вариант алкилирования Фриделя-Крафтса. Реакция проводится в жидком состоянии. Промоторы используются для улучшения работы катализаторов. Есть два варианта процесса. Один (процесс Union Carbide/Badger) использует температуру не выше 130°C и давление, достаточно высокое, чтобы все оставалось жидким. Другой (процесс Monsanto) использует немного более высокую температуру 160°C, что требует меньшего количества катализатора. (Предположительно — хотя я не смог этого подтвердить — давление также должно быть выше, чтобы все оставалось жидким при более высокой температуре.) или: Опять же, хлорид алюминия и HCl не вписаны в эти уравнения, потому что они действуют как катализаторы. Если вы хотите включить их, вы можете написать AlCl 3 и HCl поверх стрелки. | ||
Примечание: Вы найдете механизм этой реакции в разделе механизмов на этом сайте. 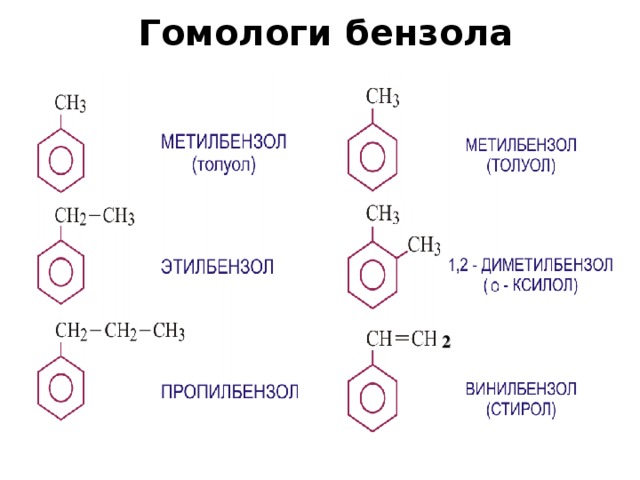 Это точно покажет, что HCl и хлорид алюминия делают в реакции. Это точно покажет, что HCl и хлорид алюминия делают в реакции. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | ||
© Джим Кларк, 2004 г. (изменено в феврале 2016 г.) | ||
Галогенирование бензола и метилбензола
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3978
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице рассматриваются реакции бензола и метилбензола (толуола) с хлором и бромом в различных условиях.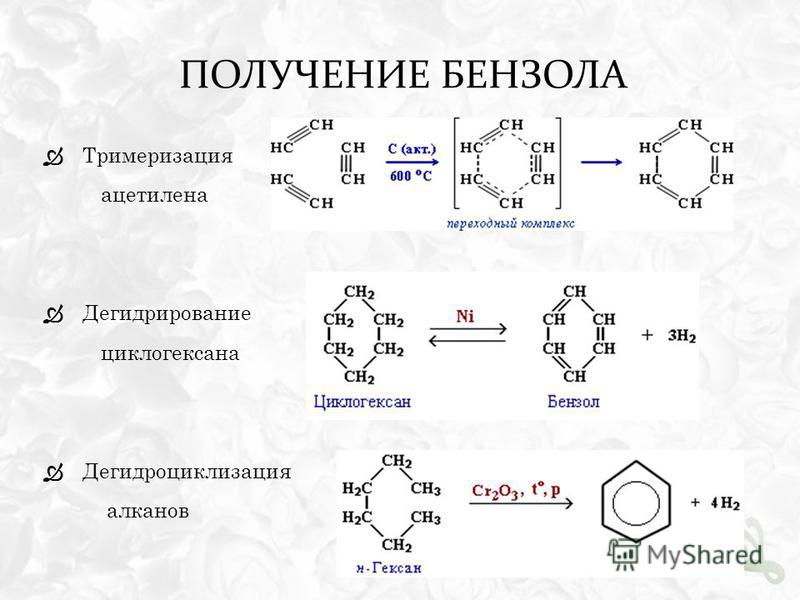
Галогенирование бензола
Реакции замещения
Бензол реагирует с хлором или бромом в присутствии катализатора, заменяя один из атомов водорода в кольце на атом хлора или брома. Реакции происходят при комнатной температуре. Катализатором является либо хлорид алюминия (или бромид алюминия, если вы взаимодействуете с бензолом с бромом), либо железо.
Строго говоря, железо не является катализатором, потому что в ходе реакции оно постоянно изменяется. Он реагирует с некоторым количеством хлора или брома с образованием хлорида железа (III), \(FeCl_3\), или бромида железа (III), \(FeBr_3\).
\[ 2Fe + 3Cl_2 \rightarrow 2FeCl_3\]
\[ 2Fe + 3Br_2 \rightarrow 2FeBr_3\]
Эти соединения действуют как катализатор и ведут себя точно так же, как хлорид алюминия \(AlCl_3\) или бромид алюминия, \ (AlBr_3\), в этих реакциях.
Реакция с хлором
Реакция между бензолом и хлором в присутствии хлорида алюминия или железа дает хлорбензол.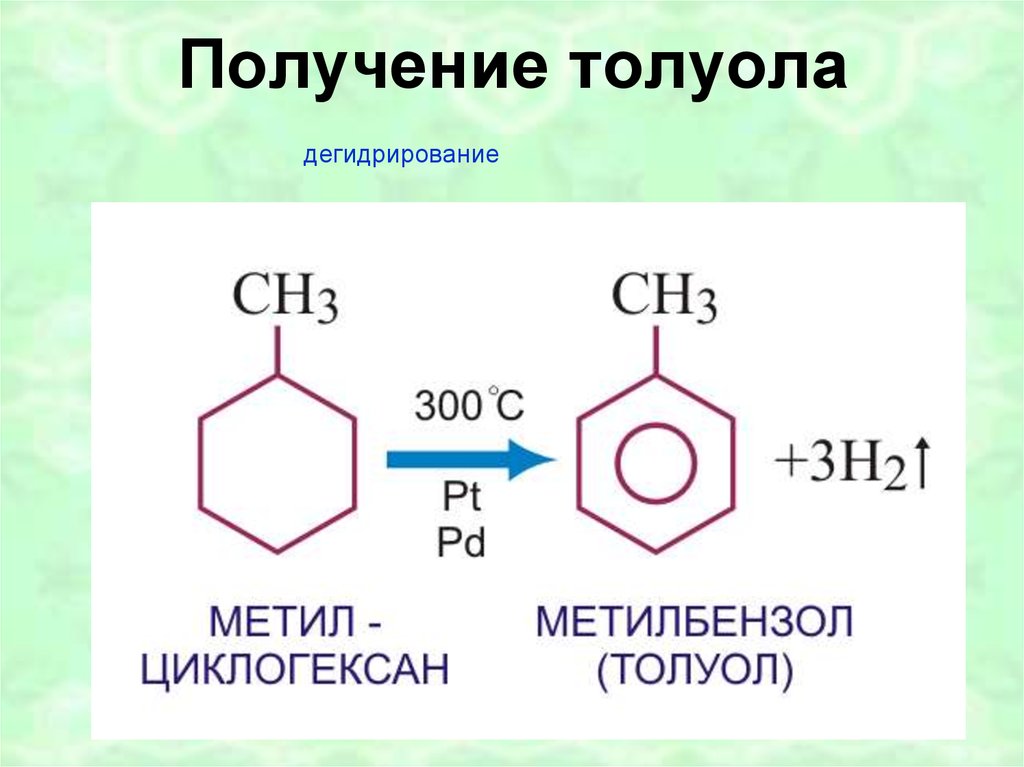
или, более компактно:
\[ C_6H_6 + Cl_2 \rightarrow C_6H_5Cl + HCl\]
Реакция с бромом
Реакция между бензолом и бромом в присутствии бромида алюминия или железа дает бромбензол. Железо обычно используется, потому что оно дешевле и более доступно.
или
\[C_6H_6 + Br_2 \rightarrow C_6H_5Br + HBr\]
Реакции присоединения
В присутствии ультрафиолетового света (но без катализатора) горячий бензол также подвергается реакции присоединения с хлором или бромом. Делокализация кольца постоянно нарушается, и к каждому атому углерода добавляется атом хлора или брома.
Например, если вы барботируете газообразный хлор через горячий бензол, подвергая его воздействию УФ-излучения в течение часа, вы получите 1,2,3,4,5,6-гексахлорциклогексан.
Бром ведет себя аналогично.
Атомы хлора и водорода могут произвольно торчать вверх и вниз над и под кольцом, что приводит к ряду геометрических изомеров. Хотя двойных углерод-углеродных связей нет, связи все еще «заперты» и не могут вращаться. Один из этих изомеров когда-то широко использовался в качестве инсектицида, известного как БГХ, ГХГ и Гаммексан. Это один из тех «хлорированных углеводородов», которые причинили столько вреда окружающей среде.
Хотя двойных углерод-углеродных связей нет, связи все еще «заперты» и не могут вращаться. Один из этих изомеров когда-то широко использовался в качестве инсектицида, известного как БГХ, ГХГ и Гаммексан. Это один из тех «хлорированных углеводородов», которые причинили столько вреда окружающей среде.
Галогенирование метилбензола
Реакции замещения
В зависимости от используемых условий можно получить две совершенно разные реакции замещения между метилбензолом и хлором или бромом. Хлор или бром могут замещаться в кольцо или в метильную группу.
Замещение в кольце
Замещение в кольце происходит в присутствии хлорида алюминия (или бромида алюминия, если вы используете бром) или железа и в отсутствие УФ-излучения. Реакции происходят при комнатной температуре. Это точно так же, как реакция с бензолом, за исключением того, что вам нужно беспокоиться о том, где атом галогена присоединяется к кольцу относительно положения метильной группы.
Метильные группы являются 2,4-направляющими, что означает, что входящие группы будут иметь тенденцию занимать 2 или 4 положения на кольце — при условии, что метильная группа находится в 1 положении. Другими словами, новая группа будет присоединена к кольцу рядом с метильной группой или напротив нее. С хлором замена в кольце дает смесь 2-хлорметилбензола и 4-хлорметилбензола.
Другими словами, новая группа будет присоединена к кольцу рядом с метильной группой или напротив нее. С хлором замена в кольце дает смесь 2-хлорметилбензола и 4-хлорметилбензола.
С бромом вы получите эквивалентные соединения брома.
Замещение в метильную группу
Если хлор или бром реагируют с кипящим метилбензолом в отсутствие катализатора, но в присутствии УФ-излучения, замещение происходит в метильной группе, а не в кольце. Например, с хлором (с бромом будет аналогично):
Органическим продуктом является (хлорметил)бензол. Скобки в названии подчеркивают, что хлор является частью присоединенной метильной группы, а не в кольце.
Один из атомов водорода в метильной группе заменен атомом хлора. Однако на этом реакция не останавливается, и все три атома водорода в метильной группе в свою очередь могут быть заменены атомами хлора. Это означает, что вы также можете получить (дихлорметил)бензол и (трихлорметил)бензол, поскольку другие атомы водорода в метильной группе заменяются по одному.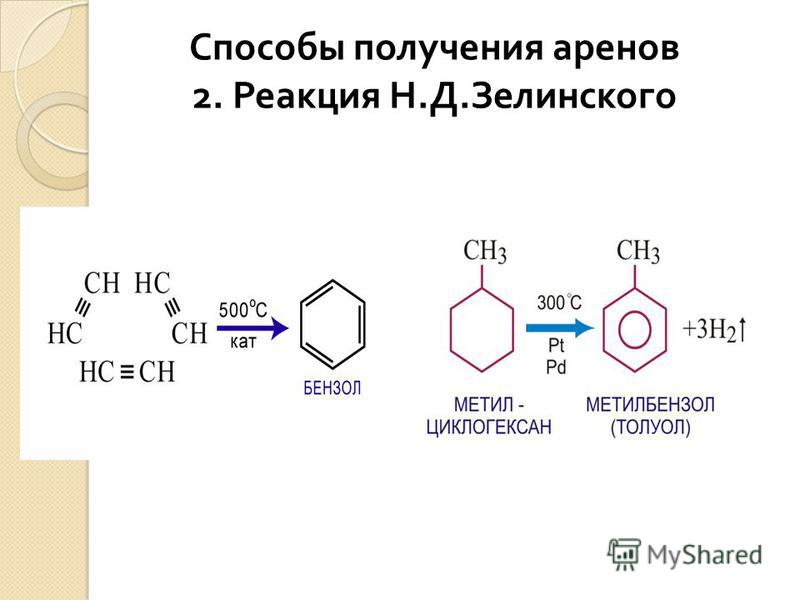

 Если «R» представляет собой любую алкильную группу, то ацильная группа имеет формулу RCO-. Ацилирование означает замену ацильной группы на что-либо, в данном случае на бензольное кольцо.
Если «R» представляет собой любую алкильную группу, то ацильная группа имеет формулу RCO-. Ацилирование означает замену ацильной группы на что-либо, в данном случае на бензольное кольцо.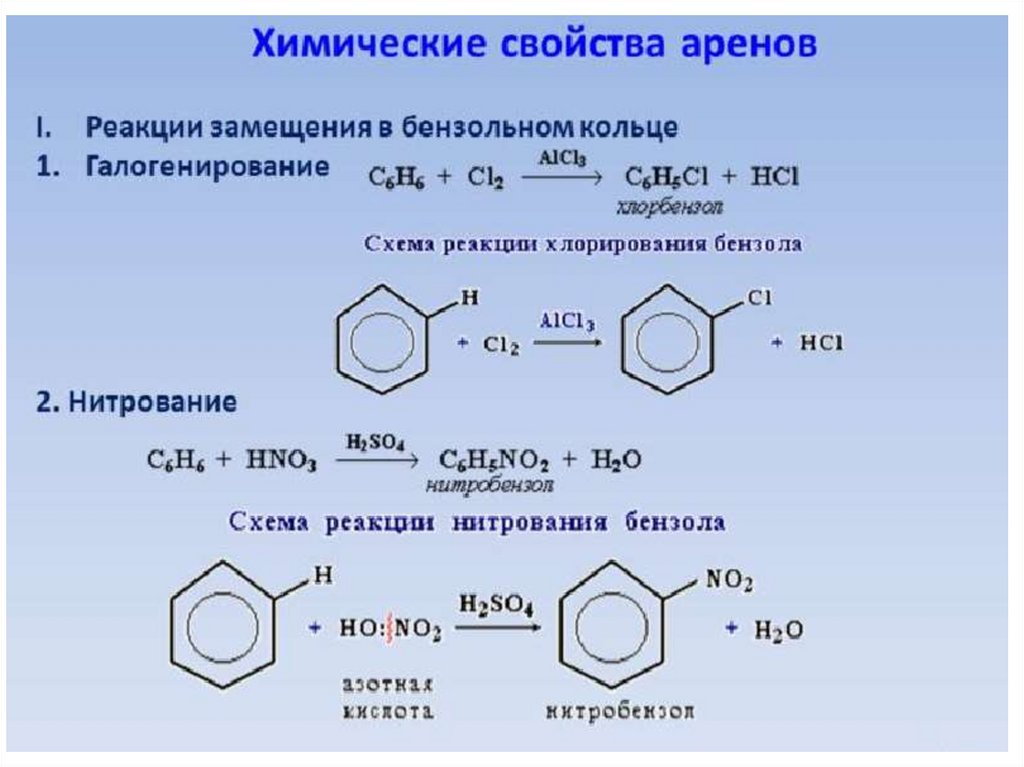
 Водород в кольце заменен группой, такой как метил или этил, и так далее.
Водород в кольце заменен группой, такой как метил или этил, и так далее.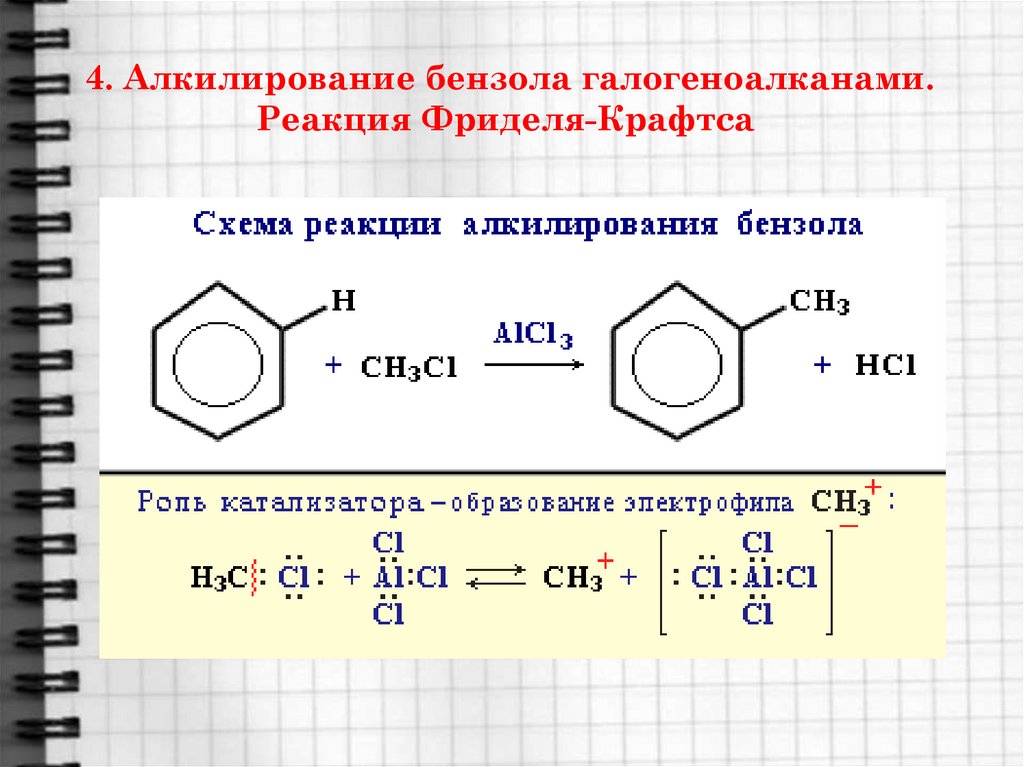
 Этен пропускают через жидкую смесь бензола, хлорида алюминия и промотора катализатора, которым может быть хлорэтан или хлористый водород. Будем считать, что это HCl.
Этен пропускают через жидкую смесь бензола, хлорида алюминия и промотора катализатора, которым может быть хлорэтан или хлористый водород. Будем считать, что это HCl.
Leave A Comment