404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Вариант 1
Главная \ Подготовка к ЕГЭ \ Химия \ Разбор вариантов 2017 года \ Вариант 1
Вариант взят из сборника для подготовки к ЕГЭ 2017-го года авторов Е. В. Савинкиной и О. Г. Живейновой.
В. Савинкиной и О. Г. Живейновой.
Задание 1.
Для элемента, атом которого имеет электронную формулу 3s2 3p5, число валентных электронов и номер периода, в котором расположен данный элемент в Периодической системе, равны соответственно
1. 5 и 3
2. 7 и 3
3. 5 и 2
4. 2 и 3
Объяснение: глядя на электронную формулу элемента, можно понять, что он находится в третьем периоде и число валентных электронов (а валентные электроны находятся только на последнем уровне) равняется семи. Этим элементом является хлор и, действительно, хлор проявляет степень окисления +7 (в HClO4), то есть может отдать все семь электронов. Правильный ответ — 1.
Задание 2.
Наибольший радиус из перечисленных элементов имеет атом
1. Бора
2. Кислорода
3. Фтора
4. Лития
Объяснение: радиус атома увеличивается в Периодической системе сверху вниз и справа налево, поэтому ищем либо самый нижний элемент или самый левый. Все элементы находятся во втором периоде ПС, самым левым элементом среди перечисленных является литий, он и будет иметь наибольший радиус. Правильный ответ — 4.
Все элементы находятся во втором периоде ПС, самым левым элементом среди перечисленных является литий, он и будет иметь наибольший радиус. Правильный ответ — 4.
Задание 3.
Ковалентные неполярные связи имеются в молекуле
1. HCl
2. Br2
3. h3O
4. CO2
Объяснение: ковалентная неполярная связь образуется между атомами одного и того же элемента (ковалентная полярная — между атомами разных неметаллов), то есть в простых двухатомных веществах — из приведенных вариантов выбираем бром. Правильный ответ — 2.
Задание 4.
В катионе аммония степень окисления азота равна
1. +3
2. -3
3. -4
4. +4
Объяснение: аммоний является производным аммиака, в аммиаке (Nh4) азот проявляет степень окисления -3 (а водород +1), поэтому и в аммиаке азот будет иметь такую же степень окисления. Правильный ответ — 2.
Задание 5.
Кристаллическая решетка хлорида натрия
1. Ионная
2. Атомная
3. Молекулярная
4. Металлическая
Объяснение: кристаллическая решетка хлорида — ионная, так как связь в этой молекуле (между ионом металла и ионом неметалла) — ионная. Правильный ответ — 1.
Задание 6.
Из перечисленных веществ выберите три вещества, которые являются амфотерными оксидами
1. Оксид алюминия
2. Диоксид углерода
3. Диоксид кремния
4. Оксид магния
5. Оксид цинка
6. Оксид хрома (III)
Объяснение: оксид алюминия — амфотерный оксид (реагирует как с кислотами, так и с основаниями)
диоксид углерода — кислотный оксид (при взаимодействии с водой образует угольную кислоту)
диоксид кремния — кислотный оксид (при взаимодействии с водой образует кремниевую кислоту)
оксид магния имеет основные свойства, так как магний — щелочно-земельный металл
оксид цинка — амфотерный оксид (так как взаимодействует и с кислотами и с основаниями)
оксид хрома (III) — амфотерный оксид зеленого цвета (растворяется в кислотах и сплавляется с щелочами)
Правильный ответ — 156.
Задание 7.
Не реагирует с жидкой водой
1. Натрий
2. Магний
3. Хлор
4. Углерод
Объяснение: щелочные и щелочноземельные металлы реагируют с водой с образованием соответствующих гидроксидов и водорода. Хлор растворяется в воде (при этом диспропорционируя на хлороноватистую и соляную кислоты). Правильный ответ — 4.
Задание 8.
Оксиды щелочноземельных элементов (Э) имеют состав
1. ЭО
2. Э2О
3. ЭО2
4. Э2О3
Объяснение: щелочноземельные металлы имеют валентность II, как и кислород, следовательно индексы в оксидах щелочноземельных металлов — единички. Правильный ответ — 1.
Задание 9.
Кремниевая кислота в водном растворе
1. реагирует с HCl и с NaOH
2. реагирует с HCl и не реагирует с NaOH
3. реагирует только с NaOH и не реагирует с HCl
4. не реагирует с HCl и с NaOH
Объяснение: кислоты не реагируют с веществами с кислотными свойствами, поэтому кремниевая кислота не будет взаимодействовать с соляной кислотой.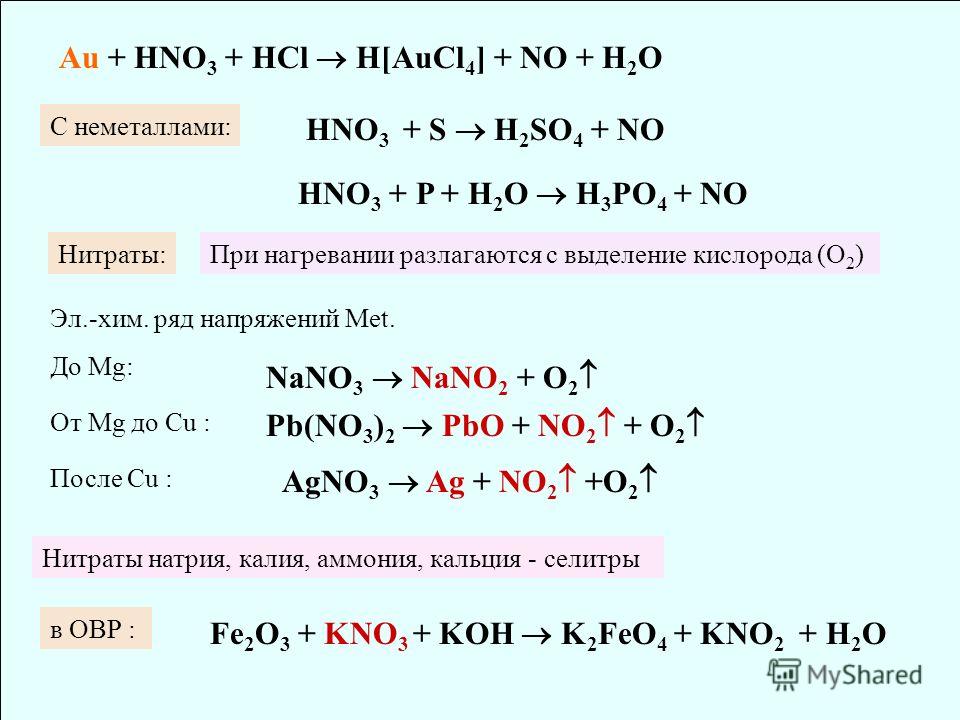 В реакции с гидроксидом натрия (а это реакция нейтрализации) получается силикат натрия и вода. Правильный ответ — 3.
В реакции с гидроксидом натрия (а это реакция нейтрализации) получается силикат натрия и вода. Правильный ответ — 3.
Задание 10.
Карбонат кальция реагирует с раствором каждого из двух веществ
1. h3SO4 и NaOH
2. NaCl и CuSO4
3. HCl и Ch4COOH
4. NaHCO3 и HNO3
Объяснение: запишем все возможные реакции.
1. h3SO4 + CaCO3 = h3O + CO2↑ + CaSO4
CaCO3 + 2NaOH ≠ Ca(OH)2 + Na2CO3 (образуется два растворимых вещества)
2. NaCl + CaCO3 ≠ CaCl2 + Na2CO3 (образуется два растворимых вещества)
CuSO4 + CaCO3 ≠ CuCO3 + CaSO4 — разлагается в воде
3. HCl + CaCO3 = CaCl2 + CO2↑ + h3O
2Ch4COOH + CaCO3 = (Ch4COO)2Ca + h3O + CO2↑
Обе реакции идут.
Правильный ответ — 3.
Задание 11.
В схеме превращения
Х Y
Fe → FeCl3 → Fe(OH)3 веществами «X» и «Y» являются
1. Cl2
Cl2
2. NaOH
3. HCl
4. Fe(OH)2
5. NaCl
Запишите номера выбранных веществ.
Объяснение:
Правильный ответ — 12.
Задание №12.
Изомерия для указанных соединений СН3-СН2-СН2-СН2-ОН и СН3-СН(СН3)-СН2-ОН относится к
1. Изомерии углеродной цепи
2. Изомерии положения кратной связи
3. Изомерии положения функциональной группы
4. Пространственной изомерии
Объяснение: в задании представлена линейная молекула и ее разветвленный изомер, то есть линейная цепь превращается в разветвленную, что называется изомерией углеродного скелета или углеродной цепи. Правильный ответ — 1.
Задание №13.
При взаимодействии алкена и бромной воды наблюдается
1. Появление окраски
2. Обесцвечивание раствора
3. Выпадение осадка
4. Выделение газа
Объяснение: приведем уравнение реакции взаимодействия бромной воды и этена: СН2=СН2 + Br2 → СН2Br-СН2Br. При этом происходит обесцвечивание раствора (так как водный раствор брома имеет желто-оранжевый цвет, а дибромэтан — бесцветная жидкость). Правильный ответ — 2.
При этом происходит обесцвечивание раствора (так как водный раствор брома имеет желто-оранжевый цвет, а дибромэтан — бесцветная жидкость). Правильный ответ — 2.
Задание №14.
В уравнении реакции
Этиленгликоль → гликолят натрия + водород
сумма коэффициентов равна:
1. 4
2. 5
3. 6
4. 7
Объяснение: запишем уравнение реакции: СН2(ОН)-СН2(ОН) + 2Na → СН2(ОNa)-СН2(ОNa) + h3↑ (то есть на одну молекулу этиленгликоля приходится две молекулы натрия). Сумма коэффициентов в левой части — 1+2, а в правой — 1+1, общая сумма — 5. Правильный ответ — 2.
Задание №15.
При гидролизе пропилформиата образуется спирт и
1. Муравьиная кислота
2. Уксусная кислота
3. Пропионовая кислота
4. Масляная кислота
Объяснение: пропилформиат — сложный эфир (получается в реакции этерификации, при этом взаимодействуют карбоновая кислота и спирт). Запишем уравнение гидролиза данного сложного эфира (при этом сложный эфир распадается обратно на карбоновую кислоту и спирт):
Запишем уравнение гидролиза данного сложного эфира (при этом сложный эфир распадается обратно на карбоновую кислоту и спирт):
НСОО-СН2-СН2-СН3 + Н2О → НСООН + СН3-СН2-СН2-ОН
То есть получается муравьиная кислота и пропиловый спирт. Правильный ответ — 1.
Задание №16.
В результате реакции Ch4CHClCh4 + NaOH (h3O) → образуется
1. СН3СН=СН2
2. СН3СН2СН2ОН
3. СН3СН(ОН)СН3
4. (СН3)2СН-О-СН(СН3)2
Объяснение: при взаимодействии алкена и водного раствора щелочи получается спирт.
Запишем полную реакцию: Ch4CHClCh4 + NaOH (h3O) → СН3СН(ОН)СН3 + NaCl. Правильный ответ — 3.
Задание №17.
Этиламин может взаимодействовать с
1. Пропаном
2. Хлорметаном
3. Гидроксидом натрия
4. Хлоридом калия
Объяснение: этиламин относится к классу аминов и выглядит так: C2H5Nh3. В задании речь идет о реакции алкилирования, в ходе которой из первичного амина получается вторичный. Запишем эту реакцию: C2H5Nh3 + Ch4Cl → C2H5Nh3+ Cl—Ch4. Правильный ответ — 2.
Запишем эту реакцию: C2H5Nh3 + Ch4Cl → C2H5Nh3+ Cl—Ch4. Правильный ответ — 2.
Задание №18.
В схеме превращений
Y
C6h3(OH)(NO2)3 ← X → C6H5ONa веществами X и Y являются
1. Бензоат натрия
2. Толуол
3. Фенол
4. Нитробензол
5. Гидроксид натрия
Объяснение: из бензола или гомолога не может в одну стадию получиться фенолят натрия, делаем вывод, что веществом Х является фенол. Проверим, записав реакции:
С6Н5ОН + NaOH → C6H5ONa + h3O
С6Н5ОН + 3HNO3 → C6h3(OH)(NO2)3 + 3h3O
Правильный ответ — 35.
Задание №19.
Реакция, уравнение которой CaO + 2HCl = CaCl2 + h3O, относится к реакциям
1. Разложения
2. Соединения
3. Замещения
4. Обмена
Объяснение: в данной реакции кальций (как более сильный элемент) вытесняет водород из его соединения. Поэтому, данная реакция является реакцией замещения. Правильный ответ — 3.
Поэтому, данная реакция является реакцией замещения. Правильный ответ — 3.
Задание №20.
За 10 секунд в реакторе объемом 100 литров из простых веществ образовалось 10,2 г сероводорода. Скорость реакции (моль/(л х с)) равна
1. 0,0001
2. 0,0002
3. 0,0003
4. 0,0006
Объяснение: скорость реакции — изменение концентрации реагента или продукта реакции в единицу времени, то есть υ = с/t. То есть нам нужно найти молярную концентрацию продукта в данном объеме и разделить ее на данное время — 10 секунд.
Для начала запишем уравнение реакции: Н2 + S = h3S
Найдем количество вещества сероводорода (для этого разделим массу сероводорода на его молярную массу, которая равна 34 г/моль):
n(h3S) = 10,2/34 = 0,3 моль
Теперь найдем молярную концентрацию сероводорода в данном объеме (для этого разделим количество вещества сероводорода на данный объем — 100 л):
с(h3S) = 0,3/100 = 0,003 моль/л
Теперь найденную концентрацию подставим в формулу нахождения скорости реакции и получим ответ:
υ = с/t = 0,003/10 = 0,0003 моль/(л х с)
Правильный ответ — 3.
Задание №21.
Наибольшее количество нитрат-ионов образуется в растворе при диссоциации 1 моль
1. Нитрата натрия
2. Нитрата меди
3. Нитрата алюминия
4. Нитрата кальция
Объяснение: запишем уравнения диссоциации всех веществ:
NaNO3 → Na+ + NO3‾ (количество нитрат-ионов — 1)
Cu(NO3)2 → Cu+ + 2NO3‾ (количество нитрат-ионов — 2)
Al(NO3)3 → Al+ + 3NO3‾ (количество нитрат-ионов — 3)
Ca(NO3)2 → Ca+ + 2NO3‾ (количество нитрат-ионов — 2)
Правильный ответ — 3.
Задание №22.
Реакция между дигидрофосфатом кальция и соляной кислотой протекает практически до конца, так как в результате образуется
1. Газ и малодиссоциирующее вещество
2. Малодиссоциирующее вещество
3. Газ
4. Осадок
Объяснение: запишем реакцию: Ca(h3PO4)2 + 2HCl = CaCl2 + 2h4PO4, то есть получается соль и кислота средней силы. Правильный ответ — 2.
Правильный ответ — 2.
Задание №23.
Одинаковую реакцию среды имеют растворы хлорида цинка и
1. Хлорида кальция
2. Нитрата натрия
3. Сульфата алюминия
4. Ацетата натрия
Объяснение: хлорид цинка имеет кислую среду, так как соляная кислота — сильная, а гидроксид цинка амфотерен, значит мы должны искать соль, в которой будет остаток сильной кислоты и слабый металл. Такой солью является сульфат алюминия (сульфат — остаток серной кислоты, а гидроксид алюминия амфотерен). Правильный ответ — 3.
Задание №24.
Определите массовую долю (%) нитрата калия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли. (Запишите число с точностью до сотых).
Объяснение: найдем массу вещества в первом растворе и во втором, разделим на общую массу раствора и переведем это число в проценты.
1-ый раствор — 250 г 10% ⇒ m = 250 х 0,1 = 25 г
2-ой раствор — 720 г 15% ⇒ m = 750 х 0,15 = 112,5 г
m(общего раствора) = 750 + 250 = 1000 г
m(вещества в растворе) = 25 + 112,5 = 137,5 г
ω(KNO3 в общем растворе) = 137,5/1000 х 100% = 13,75%
Ответ: массовая доля нитрата калия в растворе равна 13,75%.
Задание №25
В результате реакции, термохимическое уравнение которой
С + О2 = СО2 + 393 кДж
выделилось 786 кДж теплоты. Определите количество вещества (моль) кислорода. (запишите число с точностью до десятых).
Объяснение: представим, что 393 кДж так относится к 1 моль вещества, как 786 кДж к х моль вещества (в данном случае кислорода).
393 — 1
786 — х
⇒ х = 786/393 = 2 моль кислорода.
Ответ: 2 моль.
Задание №26.
Определите массу (г) уксусной кислоты, необходимой для получения 35,2 г этилацетата. (Запишите число с точностью до десятых.)
Объяснение: в ходе реакции этерификации из уксусной кислоты и этилового спирта получается этилацетат.
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О
М(эфира) = 88 г/моль
n(эфира) = 35,2/88 = 0,4 моль
n(кислоты) = n(кислоты) = 0,4 моль
М(уксусной кислоты) = 60 г/моль
m(кислоты) = 0,4 х 60 = 24 г.
Ответ: масса уксусной кислоты равна 24 г.
Задание №27.
Установите соответствие между формулой вещества и классом (группой) веществ, к которому(-ой) оно принадлежит
Формула вещества Класс (группа)веществ
1. LiOH 1. Основание
2. HIO3 2. Кислая соль
3. Ni(OH)2 3. Основная соль
4. CaHPO4 4. Кислота
5. Средняя соль
6. Оксид
Объяснение: кислоты содержат катион водорода, значит HIO3 — кислота, но кислые соли, помимо катиона металла, тоже содержат катион водорода, значит CaHPO4 — кислая соль. Основания содержат гидроксид-ионы, следовательно, LiOH и Ni(OH)2 — основания. Правильный ответ — 1412.
Задание №28.
Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются в ходе реакций.
Исходные вещества
А) серная кислота (разб) + цинк →
Б) серная кислота (разб) + железо →
В) серная кислота (конц) + медь →
Г) серная кислота (конц) + цинк →
Продукты
1. ZnSO4 + h3S + h3O
2. FeSO4 + h3
3. FeSO4 + SO2 + h3O
4. CuSO4 + h3
5. CuSO4 + SO2 + h3O
6. ZnSO4 + h3
Объяснение: для решения данного задания рекомендуем повторить тему Классификация неорганических соединений (химические свойства классов веществ)
В первой реакции получается сульфат цинка и водород (так как кислоты (неконцентрированные) реагируют в металлами, стоящими в ряду напряжений металлов до водорода), а значит во второй реакции получается сульфат железа и водород тоже, при реакции с концентрированной серной кислотой получается высший оксид металла, оксид серы (VI) и вода. Правильный ответ: 6251
Правильный ответ: 6251
Задание №29.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора.
Формула соли
А) CuSO4
Б) AgNO3
В) K2S
Г) NaOH
Продукт на катоде
1. Водород
2. Кислород
3. Металл
4. Аммиак
5. Сера
6. Диоксид азота
Объяснение: при электролизе водных растворов на катоде выделяется водород при наличии катионов металлов, стоящих в ряду напряжений металлов левее алюминия, из перечисленных это — калий и натрий, медь и серебро стоят правее водорода, поэтому выделяются на катоде сами. Правильный ответ: 3311.
Задание №30.
Установите соответствие между названием соли и типом гидролиза этой соли.
Название соли
А) ортофосфат натрия
Б) гидрокарбонат кальция
В) карбонат аммония
Г) нитрат цинка
Тип гидролиза
1. По катиону
По катиону
2. По аниону
3. По катиону и аниону
4. Гидролиз отсутствует
Объяснение: для решения задания рекомендуем повторить тему гидролиз здесь.
Ортофосфат натрия вступает в гидролиз по аниону, как и гидрокарбонат кальция. Карбонат аммония гидролизуется и по катиону и по аниону, а нитрат цинка гидролизуется по катиону. Правильный ответ: 2231
Задание №31.
Установите соответствие между исходными веществами, вступающими в реакцию обмена в водном растворе, и сокращенными ионными уравнениями этих реакций.
Исходные вещества
А) гидрокарбонат натрия + уксусная кислота
Б) гидрокарбонат натрия + соляная кислота
В) гидрокарбонат натрия + гидроксид бария
Г) гидрокарбонат натрия + гидроксид натрия
Ионные уравнения
1. HCO3‾ + Ch4COOH = CO2 + h3O + Ch4COO‾
2. HCO3‾ + H+ = CO2 + h3O
3. H+ + OH‾ = h3O
4. HCO3‾ +OH‾ = CO3²‾ + h3O
5. CO3²‾ + 2H+ = CO2 + h3O
CO3²‾ + 2H+ = CO2 + h3O
6. HCO3‾ + Ba²+ + OH‾ = BaCO3 + h3O
Объяснение: разберем каждое уравнение подробно.
1. NaHCO3 + Ch4COOH = Ch4COONa + h3O + CO2↑
Гидрокарбонат здесь и во всех последующих реакциях будет диссоциировать на катион натрия и анион гидрокарбоната, в продуктах: углекислый газ улетает из раствора, вода остается водой, а ацетат натрия диссоциирует на катион натрия и остаток уксусной кислоты. Таким образом, сокращенное ионное уравнение выглядит как №1.
2. NaHCO3 + HCl = h3O + CO2↑ + NaCl
Полное ионное уравнение: Na+ + HCO3‾ + H+ +Cl‾ = h3O + CO2↑ + Na+ + Cl‾
Остаются: гидрокарбонат-ион, ион водорода, вода и углекислый газ.
3. NaHCO3 + Ba(OH)2 = BaCO3↓ + NaOH + h3O
Полное ионное уравнение: Na+ + HCO3‾ + Ba²+ + 2OH‾ = BaCO3↓ + Na+ + OH‾ + h3O
В сокращенном ионном уравнении остаются: ионы гидрокарбоната, бария и гидроксид-ионы, а также карбонат бария и вода.
4. NaHCO3 + NaOH = Na2CO3 + h3O
Полное ионное уравнение: Na+ + HCO3‾ + Na+ + OH‾ = 2Na+ + CO3²‾ + h3O
В сокращенном ионном уравнении остаются: гидрокарбонат-ионы, гидроксид-ионы, карбонат-ионы и вода.
Правильный ответ — 1264.
Задание №32.
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе.
Уравнение реакции
А) h3S(г) ⇔ h3(г) + S(г)
Б) 2NO(г) + O2(г) ⇔ 2NO2(г)
В) 2SO2(г) + O2(г) ⇔ 2SO3(г)
Г) h3(г) + I2(г) ⇔ 2HI(г)
Направление смещения химического равновесия
1. Смещается в сторону продуктов реакции
2. Смещается в сторону исходных веществ
3. Не происходит смещения равновесия
Объяснение: так как при увеличении давления равновесие смещается в сторону уменьшения количества газообразных веществ, то есть в сторону понижения давления, то в первой реакции равновесие сместится с торону исходных веществ, вторая и третья реакции — в сторону продуктов, а в последней реакции равновесие не сместится, так как количества газообразных веществ одинаковы (2=2). Правильный ответ — 2113.
Правильный ответ — 2113.
Задание №33.
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
Формула вещества
А) Н2
Б) Cl2
В) N2
Г) Br2
Реагенты
1) FeO, Li, O2
2) Li, O2, B
3) Na, h3O, KBr
4) NaClO, h3O, Na
5) h4PO4, BaCl2, CuO
Объяснение: водород реагирует с оксидом железа (при этом железо восстанавливается о простого вещества), с литием (с образованием гидрида лития) и с кислородом. Хлор реагирует с натрием, водой и вытесняет бром из его соли. Азот реагирует с литием, кислородом и бором (при этом образуется нитрид бора). Бром реагирует с гипохлоритом натрия, водой и натрием. Правильный ответ — 1324.
Задание №34.
Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются при их взаимодействии с хлором.
Формула вещества
А) С2Н6
Б) С3Н8
В) СН2Cl2
Г) С3Н6
Продукт хлорирования
1. C2h5Cl2 и HCl
2. C2h3Cl4
3. C3H6Cl2 и HCl
4. CCl4 и HCl
5. CCl4 и HCl
6. C3H6Cl2
Объяснение: первые два вещества алканы, с галогенами они вступают в реакцию замещения и при взаимодействии с двумя молекулами хлора получатся варианты 1 и 3 соответственно. В — это дихлорметан, хлорируем его еще дважды и получаем №5. Последняя молекула — пропен, он вступает в реакцию присоединения с хлором (так как не все связи предельные), то есть получается №6.
Задание №35.
Установите соответствие между реагентами и продуктами, которые преимущественно образуются при их взаимодействии.
Реагенты
А) Бензальдегид и Cu(OH)2
Б) Фенол и FeBr3
В) Фенол и Br2(р-р)
Г) Фенол и СН2О
Продукты
1. Фенолят железа
Фенолят железа
2. Трибромфенол
3. Бромфенол
4. Фенолформальдегидная смола
5. Бензойная кислота
6. Бромбензол
Объяснение: бензальдегид при помощи гидроксида меди (II) окисляется до бензойной кислоты, при этом образуется медь и вода. Фенол с бромидом железа (III) вступает в реакцию замещения, в результате чего образуется фенолят железа и бромоводород. Фенол реагирует с бромной водой (в отличие от бензола), продуктом реакции является трибромфенол. И при взаимодействии фенола и формальдегида получается фенолформальдегидная смола. Правильный ответ — 5124.
Задание №36.
Составьте уравнение реакции, используя метод электронного баланса:
KMnO4 + K2SO3 + h3SO4 = K2SO4 + MnSO4 + h3O
Объяснение:
Mn(+7) → +5e Mn(+2) | 2
S(+4) → S(+6) | 5
2KMnO4 + 5K2SO3 + 3h3SO4 = 6K2SO4 + 2MnSO4 + 3h3O
Задание №37.
Составьте уравнения реакций, отвечающих схеме превращений:
Zn → ZnO → ZnSO4 → ZnCl2 → K2[Zn(OH)2]
Объяснение:
2Zn + O2 → 2ZnO
ZnO + h3SO4 → ZnSO4 + h3O
ZnSO4 + BaCl2 → ZnCl2 + BaSO4↓
ZnCl2 + KOH → K2[Zn(OH)2]
Задание №38.
Составьте схемы реакций, отвечающие следующим превращениям, и назовите образующиеся соединения:
Cr2O3 HCl NaOH, h3O h3SO4, t>150C
пропан → Х1 → Х2 → Х3 → Х4
Объяснение: пропан при помощи оксида хрома (III) в качестве катализатора вступает в реакцию дегидрирования, в результате чего образуется пропен. Пропен реагирует с хлороводородной кислотой (реакция присоединения) и становится 2-хлорпропаном. 2-хлорпропан реагирует с водным раствором гидроксида натрия и становится спиртом — пропанолом-2. Пропанол-2 при помощи серной кислоты (сильный водоотнимающий агент) и температуры превращается в пропен.
Пропанол-2 при помощи серной кислоты (сильный водоотнимающий агент) и температуры превращается в пропен.
Задание №39.
Смесь 220 г сульфида железа (II) и 77,6 г сульфида цинка обработали избытком соляной кислоты. Выделившийся газ пропустили через раствор сульфата меди (II). Рассчитайте объем (л) 10%-ного раствора сульфата меди (р=1,1 г/мл), израсходованного на поглощение образовавшегося газа.
Объяснение: сероводород получается в реакции соляной кислоты и с сульфидом железа и с сульфидом цинка. Поэтому, чтобы найти количество вещества сероводорода, нужно сложить количества веществ сульфидов железа и цинка (так как коэффициенты — единички). Затем, подставляем все известные числа в формулу нахождения количества вещества через плотность, массовую долю и объем. Находим объем раствора.
FeS + 2HCl → FeCl2 + h3S↑
ZnS + 2HCl → ZnCl2 + h3S↑
Mr(FeS) = 56+32 = 88 г/моль
Mr(ZnS) = 65,5+32 = 97,5 г/моль
n(FeS) = 220/88 = 2,5 моль
n(ZnS) = 77,6/97,5 = 0,8 моль
n(h3S) = n(FeS) + n(ZnS) = 2,5 + 0,8 = 3,3 ⇒ n(CuSO4) = 3,3 моль
n = (ρ x ω x V)/Mr
Mr(CuSO4) = 63,5+32+64 = 159,5 г/моль
⇒ 3,3 = (1,1 х 0,1 х V)/159,5 ⇒ V = 4785 мл или 4,8 л
Ответ: объем израсходованного сероводорода равен 4,8 л.
Задание №40.
В результате действия 200 г 4,6%-ного раствора карбоновой кислоты на избыток карбоната калия выделился газ, при пропускании которого через известковую воду образовалось 10 г осадка. Какую кислоту использовали?
Объяснение: записываем обе реакции. Находим количество вещества карбоната кальция. Количество кислоты будет в два раза больше, так как коэффициент перед кислотой — 2. Следовательно, находим количество атомов углерода в кислоте.
2Cnh3n+1COOH + K2CO3изб → 2Cnh3n+1COOK + h3O + CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + h3O
m(кислоты) = 200 х 0,046 = 9,2 г
m(CaCO3) = 10 г
n(CaCO3) = 10/100 = 0,1 моль
Mr(CaCO3) = 40+12+48 = 100 г/моль
n(кислоты) = 2n(СО2) = 2n(CaCO3) = 0,2 моль
⇒ Mr(кислоты) = 9,2/0,2 = 46 г/моль
12n + 2n + 1 + 12 + 32 + 1 = 46
14n + 46 = 46
14n = 0
Следовательно, в реакцию вступила муравьиная кислота — НСООН.
Ответ: НСООН — муравьиная кислота.
Каково ионное уравнение для Zn + HNO3 => Zn(NO3)2 + h3 и если уравнение не сбалансировано, сделайте так
Выберите область веб-сайта для поиска
Искать на этом сайте
Цитата страницы Начать эссе значок-вопрос Задайте вопросНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяУкажите эту страницу следующим образом:
«Что такое ионное уравнение гнезда для Zn + HNO3 => Zn(NO3)2 + h3 также, если уравнение не сбалансировано, сделайте это». -№3-2-х3-360706. По состоянию на 30 апреля 2023 г.
9(2+)+H_2_(g)`
См. eNotes без рекламы
Начните с 48-часовой бесплатной пробной версией , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые ответили наши эксперты.
Уже зарегистрированы? Войдите здесь.
Утверждено редакцией eNotes
Задайте вопрос
Похожие вопросы
Просмотреть всеНаука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 19 сентября 2015 г. в 21:37:47.
Каковы четыре основные функции компьютерной системы?
2 Ответы воспитателя
Наука
Последний ответ опубликован 07 декабря 2018 г. в 12:04:01.
в 12:04:01.
Расположите следующие элементы в порядке от большего к меньшему: клетка, хромосома, ген, ДНК, организм, ядро.
3 Ответы воспитателя
Наука
Последний ответ опубликован 06 июля 2009 г.в 21:23:22
Каковы функции компьютера?
7 Ответы педагога
Наука
Последний ответ опубликован 21 июня 2018 г. в 17:01:30.
Какие десять примеров решений вы можете найти у себя дома?
2 Ответа воспитателя
Стабильность оксида цинка(II) в щелочных растворах фосфата натрия при повышенных температурах (Технический отчет)
Стабильность оксида цинка(II) в щелочных растворах фосфата натрия при повышенных температурах (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Показано, что оксид цинка (ZnO) превращается в одно из двух фосфатсодержащих соединений в относительно разбавленных щелочных растворах фосфата натрия при повышенных температурах через ZnO(s) + Na{sup +} + H{sub 2}PO{sub 4}{ суп {минус}} {r_обратимый} NaZnPO{sub 4}(s) + H{sub 2}O или 2 ZnO(s) + H{sub 3}PO{sub 4}(aq) {r_reversible} Zn{sub 2 }(OH)PO{sub 4}(s) + H{sub 2}O. Рентгеноструктурный анализ показывает, что NaZnPO{sub 4} обладает орторомбической элементарной ячейкой с параметрами решетки a = 8,710 {+-} 0,013, b = 15,175 {+-} 0,010 и c = 8,027 {+-} 0,004 {ангстрем} . Термодинамические равновесия для этих реакций были определены в системе ZnO-Na{sub 2}O-P{sub 2}O{sub 5}-H{sub 2}O для мольных отношений Na/P от 2,1 до 3. На основании наблюдаемой реакции пороговые значения для концентрации и температуры фосфата натрия, стандартной энтропии (S{градусов}) и свободной энергии образования ({Delta}G{sub f}{градусов}) для NaZnPO{sub 4} были рассчитаны как 169.0,0 Дж/моль-К и {минус}1510,6 кДж/моль соответственно; аналогичные значения для Zn{sub 2}(OH)PO{sub 4} (тарбуттит) составляли 235,9 Дж/моль-К и {минус}1604,6 кДж/моль. Добавление сульфита и сульфата натрия не изменило вышеуказанные реакции.
Рентгеноструктурный анализ показывает, что NaZnPO{sub 4} обладает орторомбической элементарной ячейкой с параметрами решетки a = 8,710 {+-} 0,013, b = 15,175 {+-} 0,010 и c = 8,027 {+-} 0,004 {ангстрем} . Термодинамические равновесия для этих реакций были определены в системе ZnO-Na{sub 2}O-P{sub 2}O{sub 5}-H{sub 2}O для мольных отношений Na/P от 2,1 до 3. На основании наблюдаемой реакции пороговые значения для концентрации и температуры фосфата натрия, стандартной энтропии (S{градусов}) и свободной энергии образования ({Delta}G{sub f}{градусов}) для NaZnPO{sub 4} были рассчитаны как 169.0,0 Дж/моль-К и {минус}1510,6 кДж/моль соответственно; аналогичные значения для Zn{sub 2}(OH)PO{sub 4} (тарбуттит) составляли 235,9 Дж/моль-К и {минус}1604,6 кДж/моль. Добавление сульфита и сульфата натрия не изменило вышеуказанные реакции.
- Авторов:
- Земняк, С.
 Е.; Опалка Е П
Е.; Опалка Е П
- Дата публикации:
- Исследовательская организация:
- Лаборатория атомной энергии Ноллса. (KAPL), Нискаюна, Нью-Йорк (США)
- Организация-спонсор:
- Министерство сельского хозяйства США, Вашингтон, округ Колумбия (США)
- Идентификатор ОСТИ:
- 10194886
- Номер(а) отчета:
- КАПЛ-4762
ПО: DE94003316; РНН: 93:004656
- Номер контракта с Министерством энергетики:
- АК12-76СН00052
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: PBD: апрель 1993 г.

- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; 15 ГЕОТЕРМАЛЬНАЯ ЭНЕРГЕТИКА; ОКСИДА ЦИНКА; ХИМИЧЕСКИЕ РЕАКЦИИ; ВЫХОД ХИМИЧЕСКОЙ РЕАКЦИИ; ДИФРАКЦИЯ РЕНТГЕНОВСКИХ ЛУЧЕЙ; ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА; ЭНТРОПИЯ; ПАРАМЕТРЫ РЕШЕТКИ; СТАБИЛЬНОСТЬ; ВОДНЫЕ РАСТВОРЫ; ФОСФАТЫ НАТРИЯ; ТЕРМОДИНАМИКА; КОРРОЗИЯ; ОБРАЗОВАНИЕ БЕСПЛАТНОЙ ЭНЕРГИИ; ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ; ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ; геотермальное наследие; 400201; 152001; ХИМИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА; СВОЙСТВА ВОДНЫХ РАСТВОРОВ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Земняк С. Е. и Опалка Э.П. 90–198 Стабильность оксида цинка (II) в щелочных растворах фосфата натрия при повышенных температурах 90–199 . США: Н. П., 1993.
Веб. дои: 10.2172/10194886.
Е. и Опалка Э.П. 90–198 Стабильность оксида цинка (II) в щелочных растворах фосфата натрия при повышенных температурах 90–199 . США: Н. П., 1993.
Веб. дои: 10.2172/10194886.
Копировать в буфер обмена
Зимняк, С.Е., и Опалка, Е.П. Стабильность оксида цинка(II) в щелочных растворах фосфата натрия при повышенных температурах . Соединенные Штаты. https://doi.org/10.2172/10194886
Копировать в буфер обмена
Земняк С.Э. и Опалка Э.П. 1993.
«Стабильность оксида цинка (II) в щелочных растворах фосфата натрия при повышенных температурах». Соединенные Штаты. https://doi.org/10.2172/10194886. https://www.osti.gov/servlets/purl/10194886.
Копировать в буфер обмена
@статья{osti_10194886,
title = {Стабильность оксида цинка (II) в щелочных растворах фосфата натрия при повышенных температурах},
автор = {Земняк С. Е. и Опалка Е.П.},
Е. и Опалка Е.П.},
abstractNote = {Показано, что оксид цинка (ZnO) превращается в одно из двух фосфатсодержащих соединений в относительно разбавленных щелочных растворах фосфата натрия при повышенных температурах через ZnO(s) + Na{sup +} + H{sub 2}PO{sub 4}{sup {минус}} {r_reversible} NaZnPO{sub 4}(s) + H{sub 2}O или 2 ZnO(s) + H{sub 3}PO{sub 4}(aq) {r_reversible} Zn {sub 2}(OH)PO{sub 4}(s) + H{sub 2}O. Рентгеноструктурный анализ показывает, что NaZnPO{sub 4} обладает орторомбической элементарной ячейкой с параметрами решетки a = 8,710 {+-} 0,013, b = 15,175 {+-} 0,010 и c = 8,027 {+-} 0,004 {ангстрем} . Термодинамические равновесия для этих реакций были определены в системе ZnO-Na{sub 2}O-P{sub 2}O{sub 5}-H{sub 2}O для мольных отношений Na/P от 2,1 до 3. На основании наблюдаемой реакции пороговые значения для концентрации и температуры фосфата натрия, стандартной энтропии (S{градусов}) и свободной энергии образования ({Delta}G{sub f}{градусов}) для NaZnPO{sub 4} были рассчитаны как 169.

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав Е.; Опалка Е П
Е.; Опалка Е П
Leave A Comment