Метиламин, Ch4Nh3, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Что такое метиламин?
Метиламин — близкий родственник аммиака, первичный алифатический амин. Его химическая формула Ch4Nh3. В обычных условиях является прозрачным газообразным веществом, с узнаваемым аммиачным запахом. Именно поэтому его долго принимали за сам аммиак, до тех пор, пока в 1849 году химик Шарль Вюрц, родом из Франции, не выяснил и не доказал, что это отдельное, самостоятельное вещество.
Молярная масса его равна 31,1 грамм/моль. При температуре -6 °С он начинает кипеть, при -94 °С — плавиться. Плотность равна 0,9 г/см куб. При реакции с кислотой образуются соли. Реакция с альдегидами ведет к образованию оснований Шиффа (N-замещенных иминов, органических веществ с формулой R1R2C=NR3). Взаимодействуя со сложными эфирами и ацилхлоридами образует амиды.
В промышленном производстве используют реакцию метанола и аммиака, проходящую в условиях высоких температур и давления. При этом используется гетерогенный катализатор – цеолит (водный алюмосиликат кальция и натрия из подкласса каркасных силикатов).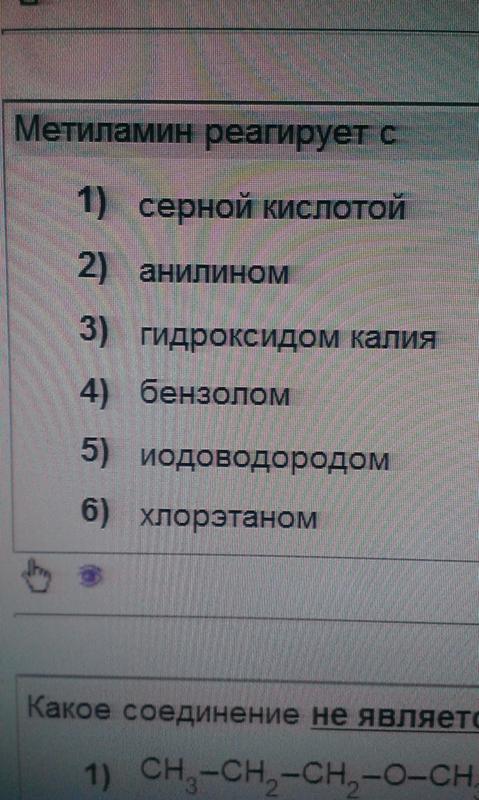 Побочными продуктами такой реакции является вода и некоторое количество диметиламина с триметиламином. После получения метиламина его очищают с помощью многократной перегонки.
Побочными продуктами такой реакции является вода и некоторое количество диметиламина с триметиламином. После получения метиламина его очищают с помощью многократной перегонки.
Другая методика получения метиламина базируется на реакции формалина и хлористого аммония с нагревом. В лабораториях метиламин синтезируют реакцией ацетамида с гипобромитом натрия (или смесью NaОН+Вr2). Сам ацетамид при этом получают нагревом ледяной уксусной кислоты с мочевиной.
Он широко используется в целом ряде направлений:
- при разработке и синтезе лекарств;
- в индустрии фотографии;
- в аграрной сфере.
Метиламин применяется в изготовлении составов бытовой химии (клей, некоторые красители и растворители). Фармацевтические компании используют метиламин при изготовлении лекарств с теофиллином или кофеином и многих антидепрессантов. Он входит в состав большей части гербицидов и инсектицидов.
Влияние на человека
Внимание! Метиламин относится к веществам третьего класса опасности для человека по мировому стандарту NFPA 704. Даже его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Такой же класс опасности имеют хлор и серная кислота. При контакте провоцирует раздражение кожных покровов, органов зрения, носовой полости и гортани. Вдыхание вещества первоначально приводит к стимуляции, а потом к угнетению нервной системы. Смерть наступает от дыхательной недостаточности.
Даже его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Такой же класс опасности имеют хлор и серная кислота. При контакте провоцирует раздражение кожных покровов, органов зрения, носовой полости и гортани. Вдыхание вещества первоначально приводит к стимуляции, а потом к угнетению нервной системы. Смерть наступает от дыхательной недостаточности.
Горючесть
Метиламин очень горюч. Этим он отличается от аммиака, от которого его долго не могли отличить из-за одинакового запаха. По стандарту NFPA 704 это вещество имеет четвёртый класс, то есть является максимально огнеопасным. Быстро или полностью испаряется при нормальном атмосферном давлении и температуре, легко рассеивается в воздухе и легко возгорается. Температура вспышки ниже 23 °C.
Нейтрализуют метиламин водой или 10%-ным раствором соляной кислоты (например, 100 л соляной кислоты и 900 л воды) с нормой расхода: 10 тонн раствора на 1 тонну вещества.
Важно! Манипуляции с метиламином обязывают соблюдать все требования безопасности:
- все действия с ним следует проводить в вытяжном шкафу, исключив любые источники открытого огня;
- использовать полный комплект средств индивидуальной защиты: перчатки, спецодежду, респираторную маску и очки;
- в шаговой доступности при работе с химикатом устанавливается противогаз;
- при утечке вещества его смывают проточной водой, место пролива пересыпают песком, который потом утилизируют.
Чтобы нивелировать опасность этого вещества, его используют в виде водных и спиртовых растворов, с концентрацией 38-40%. Такие растворы можно приобретать и хранить без каких-либо негативных последствий.
Амины в качестве оснований
Это «Амины как основания», раздел 15.13 из книги «Введение в химию: общую, органическую и биологическую» (т. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Там вы можете просматривать или скачивать дополнительные книги. Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Помогла ли вам эта книга? Рассмотрите возможность передачи:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их классные проекты, от художественных принадлежностей до книг и калькуляторов.
Предыдущий раздел
Содержание
Следующий раздел
15.13 Амины как основания
Цели обучения
- Назовите типичные реакции, протекающие с аминами.

- Опишите гетероциклические амины.
Напомним, что аммиак (NH 3 ) действует как основание, потому что атом азота имеет неподеленную пару электронов, которая может принять протон. Амины также имеют неподеленную электронную пару на своих атомах азота и могут принимать протон от воды с образованием замещенных ионов аммония (NH 4 + ) и гидроксида (OH − ) ионы:
В качестве конкретного примера метиламин реагирует с водой с образованием иона метиламмония и иона OH − .
Почти все амины, в том числе плохо растворимые в воде, реагируют с сильными кислотами с образованием солей, растворимых в воде.
Соли амина называются так же, как и другие соли: за названием катиона следует название аниона.
Пример 15
Каковы формулы кислоты и основания, которые реагируют с образованием [CH 3 NH 2 CH 2 CH 3 ] + CH 3 COO − ?
Раствор
Катион имеет две группы – метильную и этильную – присоединенные к атому азота. Его получают из этилметиламина (CH 3 NHCH 2 CH 3 ). Анион представляет собой ацетат-ион. Его получают из уксусной кислоты (CH 3 COOH).
Его получают из этилметиламина (CH 3 NHCH 2 CH 3 ). Анион представляет собой ацетат-ион. Его получают из уксусной кислоты (CH 3 COOH).
Упражнение по развитию навыков
Каковы формулы кислоты и основания, которые реагируют с образованием (CH 3 CH 2 CH 2 ) 3 NH + I − ?
Для вашего здоровья: соли амина в качестве лекарств
Соли анилина правильно называются соединениями анилина , но более старая система, все еще используемая для обозначения лекарств, идентифицирует соль анилина и соляной кислоты как «анилина гидрохлорид». Эти соединения являются ионными — это соли, и свойства соединений (например, растворимость) характерны для солей. Многие лекарства, являющиеся аминами, превращают в гидрохлориды для повышения их растворимости в водном растворе.
Гетероциклические амины
Оглядываясь назад на различные циклические углеводороды, представленные в главе 12 «Органическая химия: алканы и галогенированные углеводороды» и главе 13 «Ненасыщенные и ароматические углеводороды», мы видим, что все атомы в кольцах этих соединений являются углеродными. атомы. В других циклических соединениях гетероциклическими соединениями называют циклическое соединение, в котором один или несколько атомов в кольце представляют собой элемент, отличный от атома углерода. (греч. гетерос , что означает «другой»), азот, кислород, сера или какой-либо другой атом включен в кольцо. Многие гетероциклические соединения имеют важное значение в медицине и биохимии. Некоторые составляют часть структуры нуклеиновых кислот, которые, в свою очередь, составляют генетический материал клеток и направляют синтез белка. (Для получения дополнительной информации о нуклеиновых кислотах см. главу 19.«Нуклеиновые кислоты».)
атомы. В других циклических соединениях гетероциклическими соединениями называют циклическое соединение, в котором один или несколько атомов в кольце представляют собой элемент, отличный от атома углерода. (греч. гетерос , что означает «другой»), азот, кислород, сера или какой-либо другой атом включен в кольцо. Многие гетероциклические соединения имеют важное значение в медицине и биохимии. Некоторые составляют часть структуры нуклеиновых кислот, которые, в свою очередь, составляют генетический материал клеток и направляют синтез белка. (Для получения дополнительной информации о нуклеиновых кислотах см. главу 19.«Нуклеиновые кислоты».)
Многие гетероциклические амины встречаются в природе в растениях. Как и другие амины, эти соединения являются основными. Такое соединение представляет собой алкалоидное азотсодержащее органическое соединение, полученное из растений, обладающее физиологическими свойствами, название которого означает «похожий на щелочи». Многие алкалоиды физиологически активны, включая известные наркотики кофеин, никотин и кокаин.
Для вашего здоровья: три хорошо известных алкалоида
Кофеин — это стимулятор, содержащийся в кофе, чае и некоторых безалкогольных напитках. Механизм его действия не совсем понятен, но считается, что он блокирует активность аденозина, гетероциклического основания, действующего как нейротрансмиттер, вещества, передающего сообщения через крошечную щель (синапс) от одной нервной клетки (нейрона) к другой. клетка. Эффективная доза кофеина составляет около 200 мг, что соответствует примерно двум чашкам крепкого кофе или чая.
Никотин действует как стимулятор по другому механизму; вероятно, он имитирует действие нейротрансмиттера ацетилхолина. Люди проглатывают этот препарат при курении или жевании табака. Его стимулирующий эффект кажется преходящим, так как за этой первоначальной реакцией следует депрессия. Никотин очень токсичен для животных. Он особенно смертелен при инъекциях; смертельная доза для человека оценивается примерно в 50 мг. Никотин также использовался в сельском хозяйстве в качестве контактного инсектицида.
Кокаин действует как стимулятор, препятствуя захвату нервными клетками допамина, другого нейротрансмиттера, из синапса. Таким образом, высокие уровни дофамина доступны для стимуляции центров удовольствия в мозгу. Считается, что усиление действия дофамина отвечает за «кайф» кокаина и его вызывающие привыкание свойства. После переедания дофамин истощается менее чем за час. Это оставляет пользователя в состоянии без удовольствия и (часто) тягу к большему количеству кокаина.
Кокаин используется в виде соли гидрохлорида кокаина и в виде раздробленных кусков свободного (ненейтрализованного) основания, которое называется крэк-кокаин .
Поскольку гидрохлорид кокаина растворим в воде, он легко всасывается через водянистые слизистые оболочки носа при вдыхании. Крэк-кокаин более летуч, чем гидрохлорид кокаина. Испаряется при температуре горящей сигареты. При курении кокаин достигает мозга за 15 с.
Упражнения по обзору концепции
Объясните основность аминов.

Сравните физические свойства аминов со свойствами спиртов и алканов.
Что такое гетероциклическое соединение?
Ответы
Амины имеют неподеленную пару электронов на атоме азота и поэтому могут действовать как акцепторы протонов (основания).
Растворимость аминов аналогична растворимости спиртов; температуры кипения первичных и вторичных аминов аналогичны температурам кипения спиртов; температуры кипения третичных аминов, которые не могут вступать в водородную связь, поскольку у них нет атома водорода при атоме азота, сравнимы с температурами кипения алканов.
Гетероциклические соединения представляют собой кольцевые соединения с атомами, отличными от атомов углерода в кольце.

Ключевые выводы
- Амины являются основаниями; они реагируют с кислотами с образованием солей.
- Соли анилина правильно называются соединениями анилина , но для обозначения лекарств используется более старая система: соли аминовых препаратов и соляной кислоты называются «гидрохлоридами».
- Гетероциклические амины представляют собой циклические соединения с одним или несколькими атомами азота в кольце.
Упражнения
Какая соль образуется в каждой реакции? Напишите его сокращенную структурную формулу.
- CH 3 NH 2 (водн.) + HBr (водн.) →
- CH 3 NHCH 3 (водн.) + HNO 3 (водн.) →
Какая соль образуется в каждой реакции? Нарисуйте его структуру.

Ответить
- CH 3 NH 3 + Br − (водн.)
- [Ч 3 NH 2 CH 3 ] + НЕТ 3 − (водн.)
Метиламин | Во все тяжкие вики
в: Химия
Посмотреть источникУолт и Джесси крадут бочку с метиламином («Сделка без грубости») .
- » Метиламин продолжает течь, несмотря ни на что. Мы не замедляемся.
Мы только начинаем. Ничто не остановит этот поезд. »
- ―Walter White [src]
Метиламин (CH 3 NH 2 ) представляет собой органическое соединение. Газ является производным аммиака, но с одним атомом Н, замененным метильной группой. Это простейший первичный амин. Он продается в виде раствора в метаноле, этаноле, ТГФ и воде или в виде безводного газа в металлических контейнерах под давлением.
В Во все тяжкие Уолтер Уайт и Джесси Пинкман используют метиламин, поскольку они используют восстановительное аминирование фенилацетона (P2P) для получения метамфетамина — процесс, который они разработали, чтобы обойти необходимость покупать псевдоэфедрин. Этот повар на основе P2P и метиламина производит то, что стало печально известно как «Голубое небо» на юго-западе Америки. Хотя метамфетамин на основе метиламина традиционно считался менее очищенной версией по сравнению с его аналогом на основе псевдоэфедрина (Хэнк Шредер назвал его «байкерским метамфетамином»), химический опыт Уолта помог устранить любые различия в качестве между двумя методами.
В ходе сериала метиламин не синтезируется ни Уолтером Уайтом, ни Джесси Пинкманом, поэтому поиск метиламина для использования в качестве прекурсора метамфетамина является важным сюжетным моментом на протяжении всего сериала. Например, Уолт и Джесси однажды украли метиламин со склада, а позднее — с товарного поезда. Источником метиламина во время их кулинарных сессий в суперлаборатории была компания Golden Moth Chemical.
Содержание
- 1 Производство
- 2 История
- 2.1 Во все тяжкие
- 2.1.1 Сезон 1
- 2.1.2 Сезон 2
- 2.1.3 Сезон 3
- 2.1.4 Сезон 4
- 2.1.5 Сезон 5
- 2.1 Во все тяжкие
- 3 Общая информация
- 4 Внешние ссылки
Производство
Химическая формула метиламина.
Метиламин получают в промышленных масштабах путем реакции аммиака с метанолом в присутствии силикоалюминатного катализатора. Диметиламин и триметиламин производятся совместно; кинетика реакции и соотношение реагентов определяют соотношение трех продуктов. Продуктом, наиболее благоприятным для кинетики реакции, является триметиламин.
Продуктом, наиболее благоприятным для кинетики реакции, является триметиламин.
- CH 3 OH + NH 3 → CH 3 NH 2 + H 2 O
Таким образом, ежегодно производится более 40,0 кг.
В лаборатории гидрохлорид метиламина легко получают обработкой формальдегида хлоридом аммония.
- NH 4 Cl + H 2 CO → [CH 2 =NH 2 ]Cl + H 2 O
- [СН 2 =NH 2 ]Cl + Н 2 CO + H 2 O → [CH 3 NH 3 ]Cl + HCOOH
Другой способ включает кипячение сульфаминовой кислоты с метанолом в течение нескольких часов, что дает метилсульфат аммония, который перегруппировывается при высокой температуре. с образованием сульфата метиламина.
Бесцветная метиламмониевая соль может быть превращена в амин добавлением сильного основания, такого как NaOH:
[CH 3 NH 3 ]X + NaOH → CH 3 NH 2 + NaX + H 2 О
Газообразный метиламин высушивают с использованием основного осушителя, такого как безводный гидроксид натрия.
История
Во все тяжкие
Сезон 1
Поняв, что они не могут найти материалы, необходимые для продолжения производства метамфетамина, Уолтер Уайт и Джесси Пинкман решают украсть бочку метиламина из лаборатории, чтобы иметь возможность продолжить («Сделка без грубости») .
Сезон 2
Уолт и Джесси продолжают использовать бочку для приготовления пищи, после того как Сол Гудман дает Уолту совет готовить метамфетамин, «пока светит солнце», Уолт и Джесси проводят два дня, готовя в пустыне, используя большую часть метиламин внутри ствола. В конце концов Джесси приходит к пониманию, что требование Уолта приготовить всю бочку до того, как метиламин денатурируется, было уловкой для создания их запасов, и что метиламин не испортится.
Сезон 3
Ряды бочек с метиламином в суперлаборатории
Уолт вынужден уничтожить фургон, так как расследование Хэнка Шрейдера привело его к нахождению фургона и почти к открытию того, что Уолт стоит за производством «Голубого неба». Дом на колесах уничтожен на свалке, и предполагается, что вместе с ним была уничтожена бочка с метиламином.
Дом на колесах уничтожен на свалке, и предполагается, что вместе с ним была уничтожена бочка с метиламином.
Сезон 4
Уолт и Джесси готовят для Густаво Фринга в суперлаборатории, который снабжает их метиламином.
Сезон 5
Джесси и Лидия используют погрузчик, чтобы получить бочку метиламина
Уолт, Джесси и Сол говорят о том, как они собираются найти больше метиламина, понимая, что он им нужен, прежде чем снова начать готовить. Позже выясняется, что Лидия Родарт-Куэйл в прошлом снабжала Гаса метиламином. Майк Эрмантраут спрашивает Лидию, может ли она достать немного метиламина, и Джесси отправляется на склад Мадригала за бочкой. Лидия и Джесси обнаруживают, что в бочке была ошибка Управления по борьбе с наркотиками, из-за которой они не могли ее использовать, но Лидия предлагает им еще один план по краже метиламина из товарного поезда.
Уолт, Джесси и Тодд Алквист украли метиламин из поезда и закачали его в большой пластиковый бак, который они хранили в штаб-квартире Вамоноса-вредителя. В какой-то момент Джесси и Майк решили продать свою часть метиламина другому дилеру, поэтому Уолт спрятал бак на принадлежащей ему автомойке и убедил Майка позволить ему продолжать использовать метиламин для производства.
В какой-то момент Джесси и Майк решили продать свою часть метиламина другому дилеру, поэтому Уолт спрятал бак на принадлежащей ему автомойке и убедил Майка позволить ему продолжать использовать метиламин для производства.
Общая информация
- Хотя в сериале делается большой шум из-за получения метиламина вместо других важных прекурсоров, таких как фенилацетон, на самом деле метиламин гораздо легче синтезировать, чем другие прекурсоры метамфетамина, и ни один из прекурсоров метиламина не трудно найти или ограниченный. Помимо того, что сценаристы не хотят показывать зрителям, как делать незаконные наркотики, во вселенной есть несколько объяснений этой сюжетной точки:
- Одна из возможностей состоит в том, что Уолт не знал, что метиламин был прекурсором Списка I, хотя это маловероятно, так как он был в списке с 1991 года, и Уолт сказал Джесси, что некоторые предметы в списке покупок трудно найти. найти, чтобы он знал;
- Ему срочно понадобилось большое количество самого простого прекурсора, чтобы он мог сосредоточиться на производстве фенилуксусной кислоты и фенилацетона, которые сделать сложнее;
- Из-за своего эго он счел «ниже своего достоинства» производить метиламин, так как это настолько простая реакция, что любой старшеклассник мог бы это сделать, поэтому вместо этого он хотел получить его другими способами, особенно незаконными, чтобы удовлетворить свои потребности.
 нарциссизм, который подходит его персоне;
нарциссизм, который подходит его персоне;
- Чистый метиламин при стандартных условиях представляет собой газ, но в сериале мы видим, что он представлен в виде жидкости. Наиболее вероятное объяснение состоит в том, что метиламин либо растворяется в воде или каком-то другом растворителе, либо в воде в виде соли (метиламин из поезда все-таки заменяют водой), тем более, что ни один персонаж из сериала никогда не жалуется на запах метиламина. , который должен иметь гнилостный рыбный запах. Однако в сцене, где Джесси читает список покупок Уолта, Уолт попросил 9 штук.0251 безводный метиламин, который будет храниться не в бочках, а в газовых баллонах. Вполне вероятно, что Джесси не смог найти безводный метиламин и вместо этого остановился на растворе метиламина, который Уолт очистил, чтобы получить безводный метиламин.
- Точно так же, если бы метиламин из поезда был безводным, они не смогли бы так легко вскрыть пломбы, а если добавить воду, то весь метиламин дымился бы и кипел от контакта с относительно теплой водой, т.

- Точно так же, если бы метиламин из поезда был безводным, они не смогли бы так легко вскрыть пломбы, а если добавить воду, то весь метиламин дымился бы и кипел от контакта с относительно теплой водой, т.




 Мы только начинаем. Ничто не остановит этот поезд. »
Мы только начинаем. Ничто не остановит этот поезд. » нарциссизм, который подходит его персоне;
нарциссизм, который подходит его персоне;
Leave A Comment