Химические свойства металлов
РЕПЕТИЦИОННЫЙ ЕГЭ ПО ХИМИИ—ДИСТАНЦИОННО, БЕСПЛАТНО
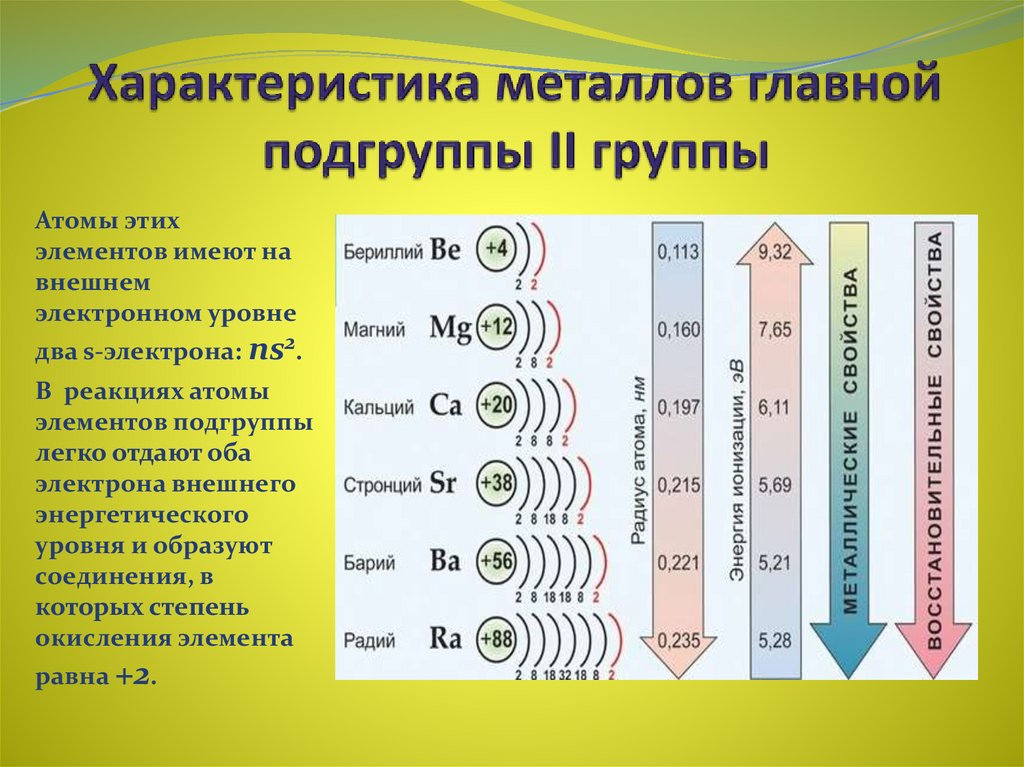
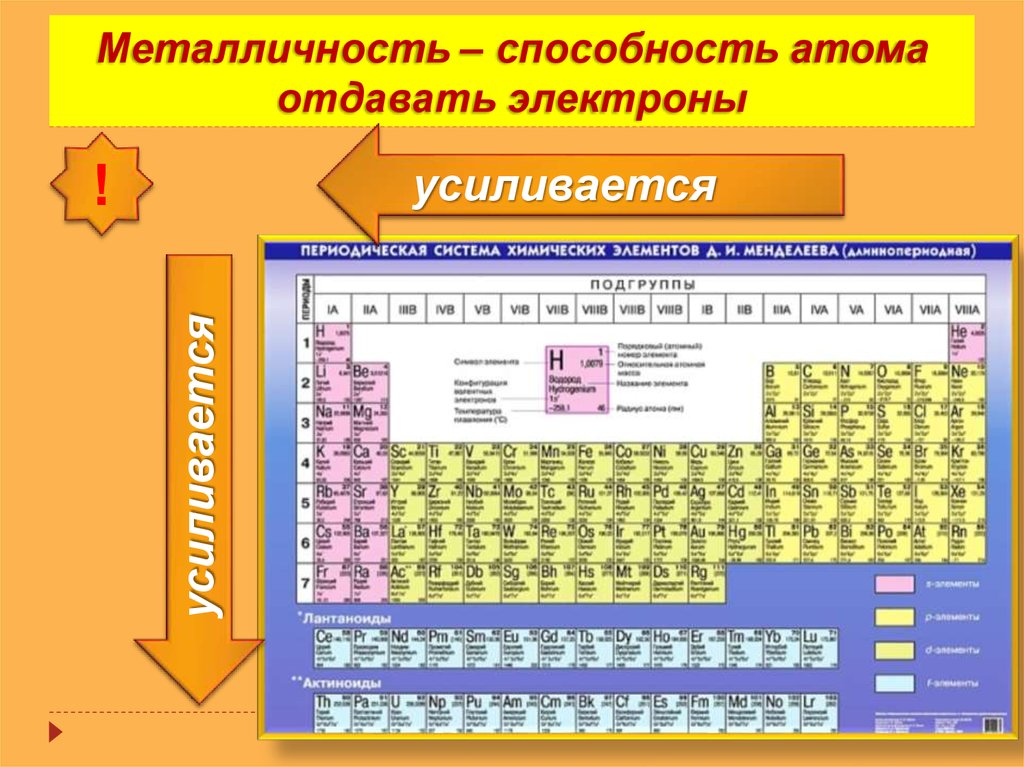
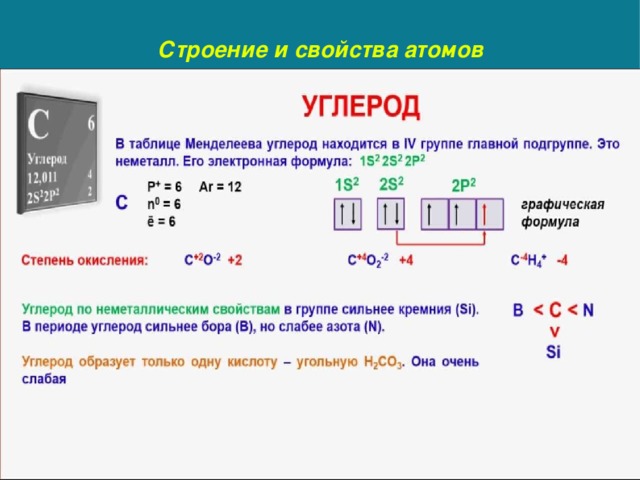
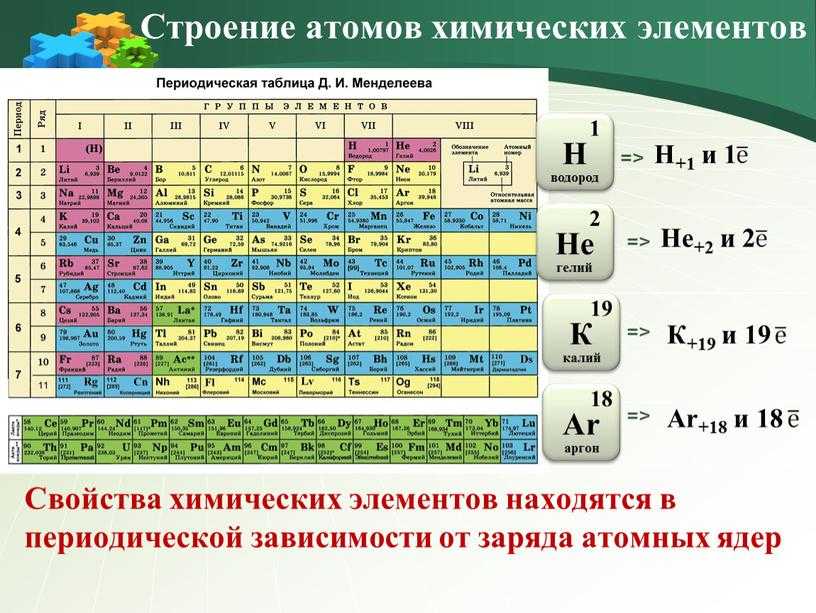
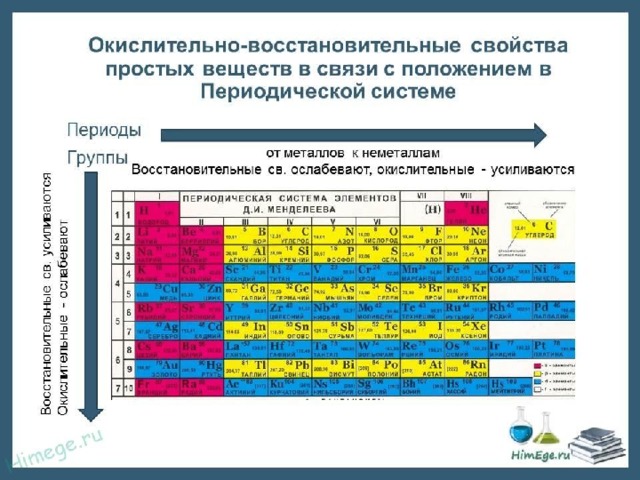
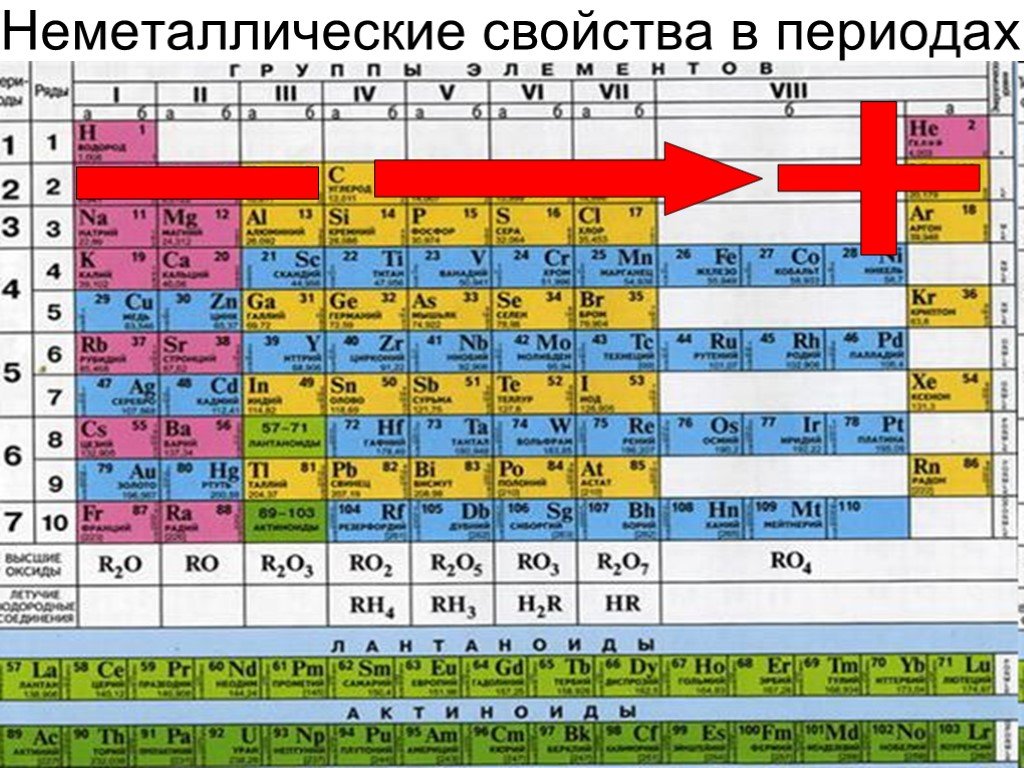
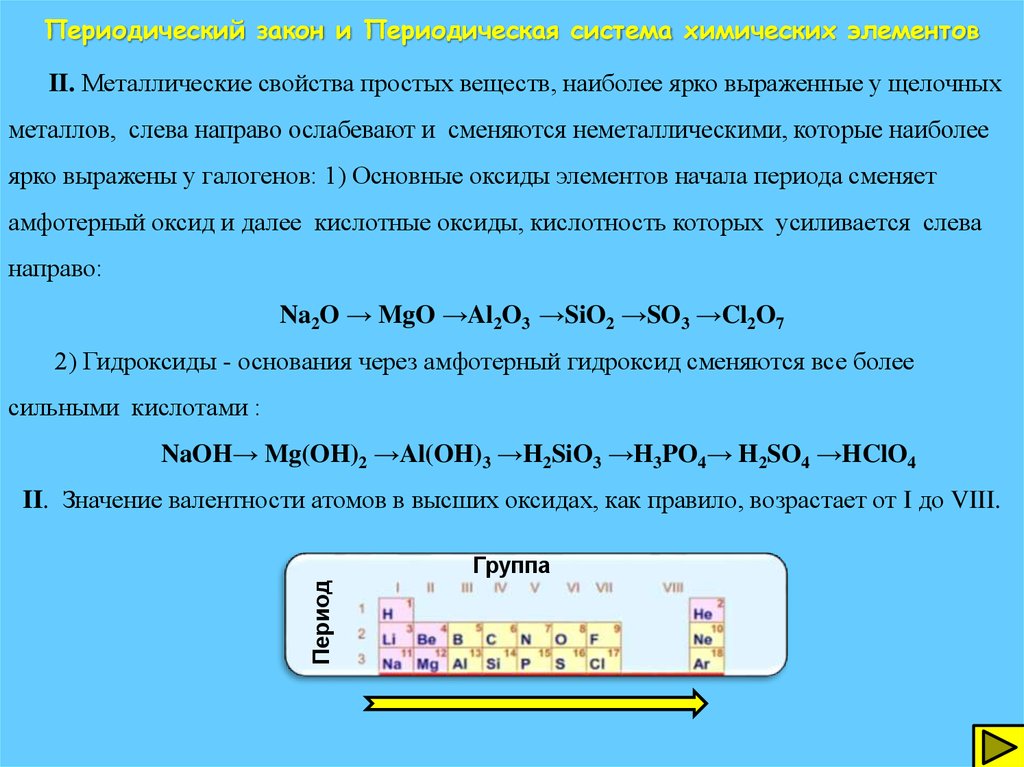
Общая характеристика металлов главных подгрупп IА – IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов.
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий —>магний —>алюминий
В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
9.
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Си(ОН)2
2) Fe(OH)3 и Сг(ОН)2
3) Fe(OH)2 и Ca(OH)2
4) Fe(OH)3 и Сг(ОН)3
14. При нагревании меди с концентрированной серной кислотой образуется
При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV)
2) водород
3) оксид серы (VI)
4) сероводород
15. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
16. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
20. При обычных условиях практически осуществима реакция между железом и
1) серой (тв)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
21. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
22. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
23. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
24.
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
25. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
26. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Оцените справедливость суждений о металлах:
А.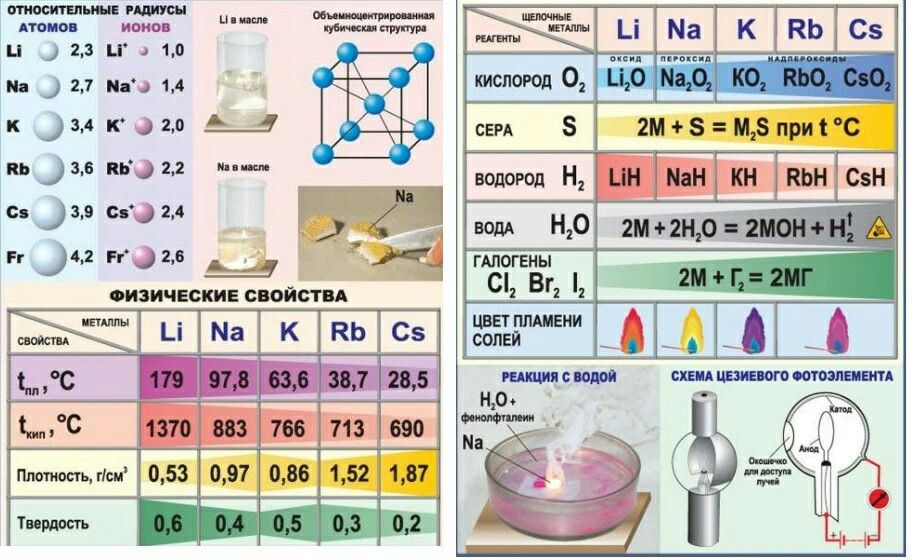 Для атомов металлов характерно малое число валентных
Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. При обычных условиях из двухатомных молекул состоят
При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
31. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами.
Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
32. Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
33. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
34. Соединения состава NaHЭO3 и NaHЭO4 может образовать
Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
35. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
36 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
37. Водород проявляет окислительные свойства при реакции с
1) натрием 2) хлором 3) азотом 4) кислородом
38. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
39. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
40. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
41. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
42. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
43. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
44. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
45. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
46. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
47. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
48. Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
49. Окислительные свойства фосфор проявляет при взаимодействии с
Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
3) хлором
4) серой
50. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3} хлором 4) кислородом
52. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4} HClO4
53. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
54. Оцените справедливость суждений о неметаллах:
Оцените справедливость суждений о неметаллах:
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
55. Оцените справедливость суждений о неметаллах:
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. Оцените справедливость суждений о неметаллах:
А. В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.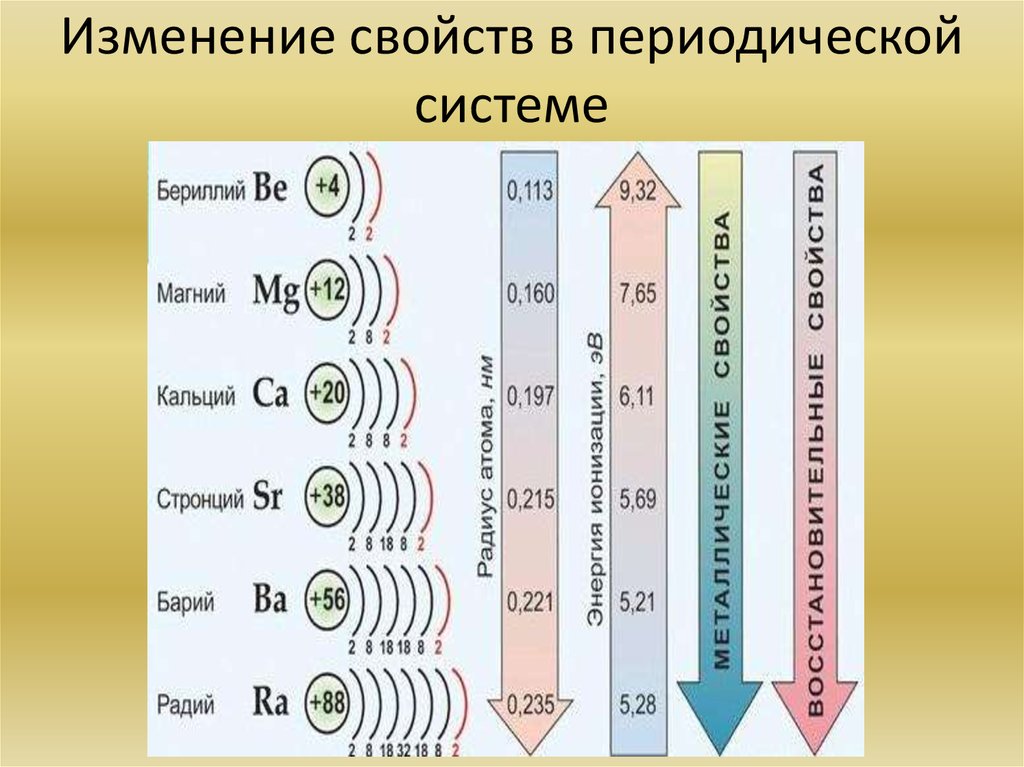
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
57. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
58. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
59. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
Ответы: 1-4, 2-1, 3-4, 4-2, 5-1, 6-4, 7-3, 8-1, 9-3, 10-2, 11-3, 12-2, 13-3, 14-1, 15-4, 16-3, 17-3, 18-3, 19-2, 20-3, 21-2, 22-2, 23-4, 24-1, 25-4, 26-2, 27-1, 28-4, 29-1, 30-4, 31-4, 32-3, 33-2, 34-2, 35-1, 36-1, 37-1, 38-3, 39-2, 40-4, 41-1, 42-4, 43-1, 44-4, 45-1, 46-4, 47-4, 48-1, 49-2, 50-3, 51-1, 52-4, 53-1, 54-3, 55-2, 56-3, 57-1, 58-2, 59-4
| ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
Элементальный контейнер | Основные характеристики алюминия
Что такое алюминий?
Алюминий (Aluminium) – серебристо-белый мягкий металл, отличающийся легкостью, высокой отражательной способностью, высокой теплопроводностью, высокой электропроводностью, нетоксичностью и коррозионной стойкостью. Алюминий — самый распространенный металлический элемент, составляющий 1/12 часть земной коры. Однако он никогда не встречается в природе в виде элементарного металла, а только в сочетании с кислородом и другими элементами. На обычном языке алюминий часто означает алюминиевый сплав.
Алюминий — самый распространенный металлический элемент, составляющий 1/12 часть земной коры. Однако он никогда не встречается в природе в виде элементарного металла, а только в сочетании с кислородом и другими элементами. На обычном языке алюминий часто означает алюминиевый сплав.
Среди всех видов металлических материалов алюминий выигрывает либо потому, что его свойства и характеристики превосходны, либо потому, что технологии изготовления позволяют производить готовый продукт по конкурентоспособной цене. Использование алюминия продолжает увеличиваться и расширяться; новые рынки, такие как автомобильный сектор, начинают признавать его истинные беспрецедентные преимущества.
Где и как получить алюминий
Боксит, минерал, добываемый из земли, является основным источником алюминия. Бокситы измельчают и опрыскивают водой, удаляют глину и кремнезем, затем сушат в печи и смешивают с кальцинированной содой и дробленой известью. Затем смесь обрабатывается в варочном котле, затем сгущается под давлением и направляется в отстойник, где удаляются дополнительные примеси.
После фильтрации, охлаждения и дальнейшей обработки в осадителе смесь сгущают и еще раз фильтруют перед нагреванием в обжиговой печи. Полученный материал представляет собой оксид алюминия, порошкообразную химическую комбинацию кислорода и алюминия.
Плавка
Глинозем должен пройти процессы плавки и легирования, чтобы стать алюминием общего пользования. Алюминиевый завод содержит криолитовую ванну (в которой минеральный криолит плавится с помощью электрического тока). Глинозем в виде порошка помещают в криолитовую ванну, где он плавится и отделяется от кислородного компонента, оседая под криолитом. Расплавленный алюминий перекачивается из нижней части плавильной печи и помещается в тигель, затем формуется в слиток или переносится в печь для легирования.
Легирование
В печи для легирования алюминиевый слиток расплавляется и смешивается с легирующими металлами, такими как магний, кремнезем, медь и т. д., с образованием алюминиевого сплава, обладающего широким диапазоном конкретных свойств материала. Физические свойства сплава во многом определяются содержанием сплава.
Физические свойства сплава во многом определяются содержанием сплава.
Например:
- Марганец обладает хорошей коррозионной стойкостью
- Магний подходит для сварки
- Медь обеспечивает превосходную обрабатываемость
- Цинк обладает очень высокой прочностью
Смесь расплавленных металлов затем отливается в твердые бревна. Бревна можно разрезать, чтобы получить более управляемую заготовку. Бревна и заготовки отправляются на экструдеры для экструзии алюминия.
Основные характеристики алюминия
Алюминий при использовании в виде листов, рулонов или прессованных форм имеет ряд преимуществ по сравнению с другими металлами и материалами. В то время как другие материалы могут обладать некоторыми полезными характеристиками алюминия, они не могут обеспечить весь спектр преимуществ, которые может дать алюминий. Экструзия алюминия — это универсальный процесс формовки металла, который позволяет дизайнерам, инженерам и производителям в полной мере использовать широкий спектр физических характеристик:
Легкий вес:
Алюминий имеет удельный вес 2,7 и весит всего 0,1 фунта на кубический дюйм. Он весит меньше по объему, чем большинство других металлов. На самом деле, это около одной трети веса железа, стали, меди или латуни. Легкий алюминий проще в обращении, дешевле в транспортировке и является привлекательным материалом для применения в таких областях, как аэрокосмическая промышленность, высотное строительство и автомобильный дизайн. При использовании в области транспорта он может дать значительные преимущества в сокращении расхода топлива.
Он весит меньше по объему, чем большинство других металлов. На самом деле, это около одной трети веса железа, стали, меди или латуни. Легкий алюминий проще в обращении, дешевле в транспортировке и является привлекательным материалом для применения в таких областях, как аэрокосмическая промышленность, высотное строительство и автомобильный дизайн. При использовании в области транспорта он может дать значительные преимущества в сокращении расхода топлива.
Strong:
Алюминиевые профили могут быть изготовлены настолько прочными, насколько это необходимо для большинства применений. Когда температура падает, он становится еще прочнее, поэтому этот материал чаще всего используется в холодных условиях.
Высокое соотношение прочности к весу:
Алюминий предлагает уникальное сочетание легкости и высокой прочности. Более высокие прочности могут быть получены путем добавления одного или нескольких из следующих компонентов: марганца, кремния, меди, магния или цинка. Увеличение также может быть достигнуто с помощью специальной термической обработки. В настоящее время аэрокосмическая промышленность и автомобильная промышленность в значительной степени зависят от алюминия как материала.
Увеличение также может быть достигнуто с помощью специальной термической обработки. В настоящее время аэрокосмическая промышленность и автомобильная промышленность в значительной степени зависят от алюминия как материала.
Коррозионная стойкость:
Превосходная коррозионная стойкость алюминия обусловлена наличием тонкой твердой защитной пленки оксида алюминия, прочно сцепляющейся с поверхностью. Это происходит естественным образом и может достигать толщины 0,2 миллионных дюйма. Дополнительная защита может быть выполнена путем нанесения краски или анодирования. Не ржавеет, как сталь.
Превосходный теплопроводник:
Алюминий является превосходным проводником как тепла, так и холода. Эти факторы делают алюминий идеальным для применения в теплообменниках, испарителях холодильников и компонентах двигателей. Процесс экструзии алюминия идеально подходит для изготовления нестандартных форм, которые оптимально используют свойства теплопроводности.
Отличный проводник электричества:
Алюминий — наименее дорогой металл с достаточно высокой электропроводностью для использования в качестве электрического проводника. Из-за своей низкой плотности алюминий проводит более чем в два раза больший ток, чем медь эквивалентного веса. Различные алюминиевые сплавы имеют разную электропроводность и могут быть адаптированы для специальных электрических применений, например, для линий электропередач.
Из-за своей низкой плотности алюминий проводит более чем в два раза больший ток, чем медь эквивалентного веса. Различные алюминиевые сплавы имеют разную электропроводность и могут быть адаптированы для специальных электрических применений, например, для линий электропередач.
Немагнитный:
Поскольку алюминий немагнитен, его можно использовать в высоковольтных устройствах, а также в электронике. Он также используется для защиты чувствительных электронных устройств.
Эластичность:
Алюминий легко формуется или перерабатывается в другую форму. Алюминий сочетает в себе прочность и гибкость и может изгибаться под нагрузкой или пружинить при ударе. Существует множество различных процессов переработки алюминия, наиболее распространенными из которых являются: экструзия, прокатка, ковка и волочение.
Отражающий:
Полированный алюминий является отличным отражателем лучистой энергии во всем диапазоне длин волн. Отражение видимого света алюминия (более 80%) привело к его широкому использованию в качестве отражателей ламп.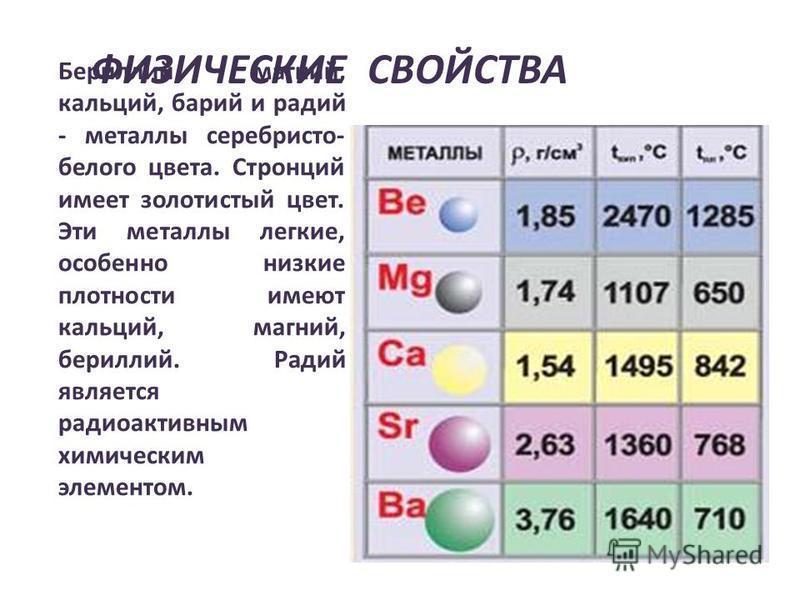 Его можно использовать для защиты продуктов или областей от света, радиоволн или инфракрасного излучения.
Его можно использовать для защиты продуктов или областей от света, радиоволн или инфракрасного излучения.
Негорючий:
Алюминий не воспламеняется и не горит, даже при очень высоких температурах он не выделяет токсичных паров.
Подходит для экстремально низких температур:
Алюминий подходит для криогенных целей. Прочность алюминия фактически увеличивается при очень низких температурах. Это привело к использованию его в космическом пространстве, а также для самолетов и для строительства в высоких широтах.
Пригоден для вторичной переработки:
Алюминий может быть переработан за долю первоначальных производственных затрат. Его можно перерабатывать снова и снова, не теряя при этом своих характеристик. Это привлекает производителей, конечных пользователей и экологические консорциумы.
Привлекательный внешний вид:
Алюминий имеет неотъемлемое преимущество перед большинством других металлов благодаря своему привлекательному внешнему виду и хорошей коррозионной стойкости.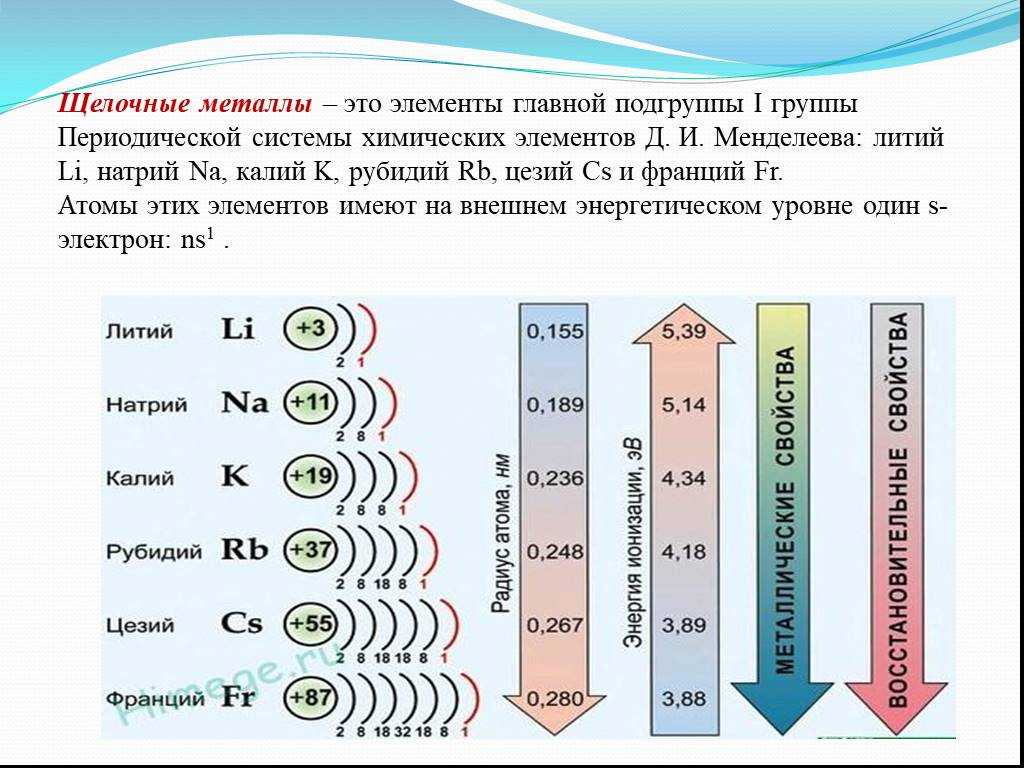 Существует множество различных методов отделки, которые можно использовать. Наиболее распространенными являются: жидкая краска (включая акриловые, алкидные, полиэфирные и другие), порошковые покрытия, анодирование или гальваническое покрытие.
Существует множество различных методов отделки, которые можно использовать. Наиболее распространенными являются: жидкая краска (включая акриловые, алкидные, полиэфирные и другие), порошковые покрытия, анодирование или гальваническое покрытие.
Обрабатываемость:
Сложные формы могут быть реализованы в цельных экструдированных алюминиевых профилях без применения методов механического соединения. Полученный профиль, как правило, прочнее, чем сравнимая сборка, с меньшей вероятностью протекания или ослабления с течением времени. Области применения: бейсбольные биты, холодильные трубки и теплообменники. Алюминиевые детали можно соединять с помощью сварки, пайки или пайки, а также с помощью клея, зажимов, болтов, заклепок или других средств крепления. Методы цельного соединения могут быть особенно полезны для определенных конструкций. Клеевое соединение используется для таких работ, как соединение алюминиевых компонентов самолета.
Экономичный:
Инструменты или формовочные детали (штампы) относительно недороги и могут быть изготовлены в короткие сроки. Различные типы используемых инструментов можно быстро и часто менять во время производственных циклов, что делает его рентабельным для небольших производственных циклов.
Различные типы используемых инструментов можно быстро и часто менять во время производственных циклов, что делает его рентабельным для небольших производственных циклов.
Переработанный алюминий
Исторически сложилось так, что алюминий является одним из самых важных материалов в успешных программах переработки. Алюминий предлагает высокую стоимость лома, широкое признание потребителей, а переработка алюминия пользуется значительной поддержкой отрасли.
Алюминий можно перерабатывать и использовать снова и снова без потери своих характеристик. При использовании переработанного алюминия нет потери качества. Переработка алюминия требует меньше энергии и может обеспечить значительную экономию средств. Во время многих производственных процессов, связанных с алюминием, образуется лом. Обычно его возвращают на плавильные или литейные заводы и повторно используют для повторного производства сырья. По сравнению с первоначальными четырьмя фунтами руды для производства одного фунта алюминия каждый фунт переработанного алюминия экономит четыре фунта руды.
Физические свойства алюминия
Учитывая, что алюминий является неотъемлемой частью нашей жизни, может показаться, что этот удивительный металл существовал всегда. Правда в том, что использование алюминия в производстве и промышленности имеет короткую историю, чуть более века. Это потому, что на протяжении большей части истории человечества мы даже не знали о существовании алюминия.
Несмотря на то, что алюминий является третьим по распространенности элементом в земной коре, его трудно найти. В своей самой чистой форме алюминий очень реактивен и легко связывается с другими минералами, а это означает, что он встречается крайне редко. Вместо этого он является неотъемлемым компонентом обычных руд, таких как квасцы и бокситы.
После нескольких столетий открытий ученым наконец удалось выделить чистый алюминий в 1800-х годах. Потребовалось еще несколько десятилетий, чтобы разработать коммерчески жизнеспособный метод извлечения алюминия для промышленных целей.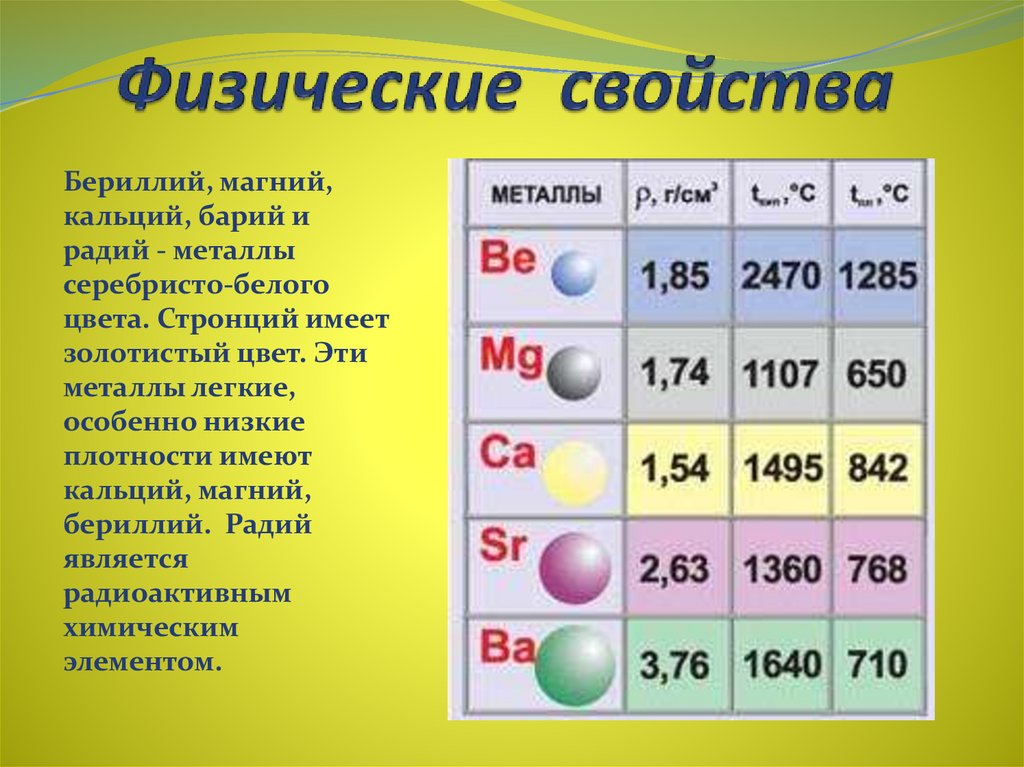 Вот почему только в начале двадцатого века этот металл стал легкодоступным.
Вот почему только в начале двадцатого века этот металл стал легкодоступным.
Как только технология открыла секрет производства алюминиевых сплавов в больших масштабах, вскоре она начала преобразовывать все отрасли промышленности. От авиации до медицины и всего, что между ними, удивительные свойства алюминия делают его одним из самых важных материалов, используемых сегодня. В сегодняшней статье мы рассмотрим эти свойства, и, надеюсь, вы лучше поймете, почему алюминий такой особенный.
Что такое алюминий?
Первое, что вам нужно знать об алюминии, это то, что он является 13-м -м -м элементом в периодической таблице и имеет атомный символ Al. В естественном виде это серебристо-белый, немагнитный, пластичный металл. Согласно массе, он составляет 8% земной коры, что делает его самым распространенным металлом из существующих.
Внешний вид алюминия может варьироваться в зависимости от обработки его поверхности. Полированная алюминиевая поверхность может отражать около 92% видимого света.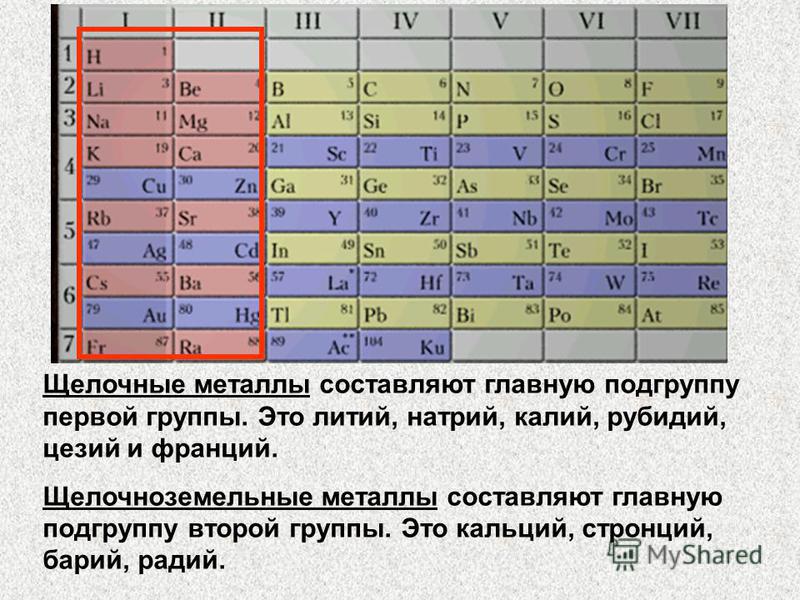 Он также полезен для отражения среднего и дальнего инфракрасного излучения.
Он также полезен для отражения среднего и дальнего инфракрасного излучения.
Большинство коммерческих сортов алюминия имеют плотность 0,0975 фунта/дюйм³. По сравнению со сталью он примерно на треть плотнее. Это связано с тем, что алюминиевое ядро намного легче, но не заметно меньше. На практике единственные металлы, которые легче алюминия, относятся к группе 1 и 2, которые по большей части слишком реакционноспособны для конструкционного использования. Единственными исключениями являются бериллий и магний.
Все дело в весе
Если бы вам нужно было сосредоточиться только на одном свойстве алюминия как на самом важном, большинство людей согласились бы с его легким весом. Это, в сочетании с его относительно высокой прочностью, делает алюминий таким ключевым материалом практически в каждой коммерческой отрасли, о которой вы только можете подумать.
В то время как чистому алюминию не хватает прочности, необходимой в некоторых высокопроизводительных областях, в сплаве с другими элементами он становится чрезвычайно прочным.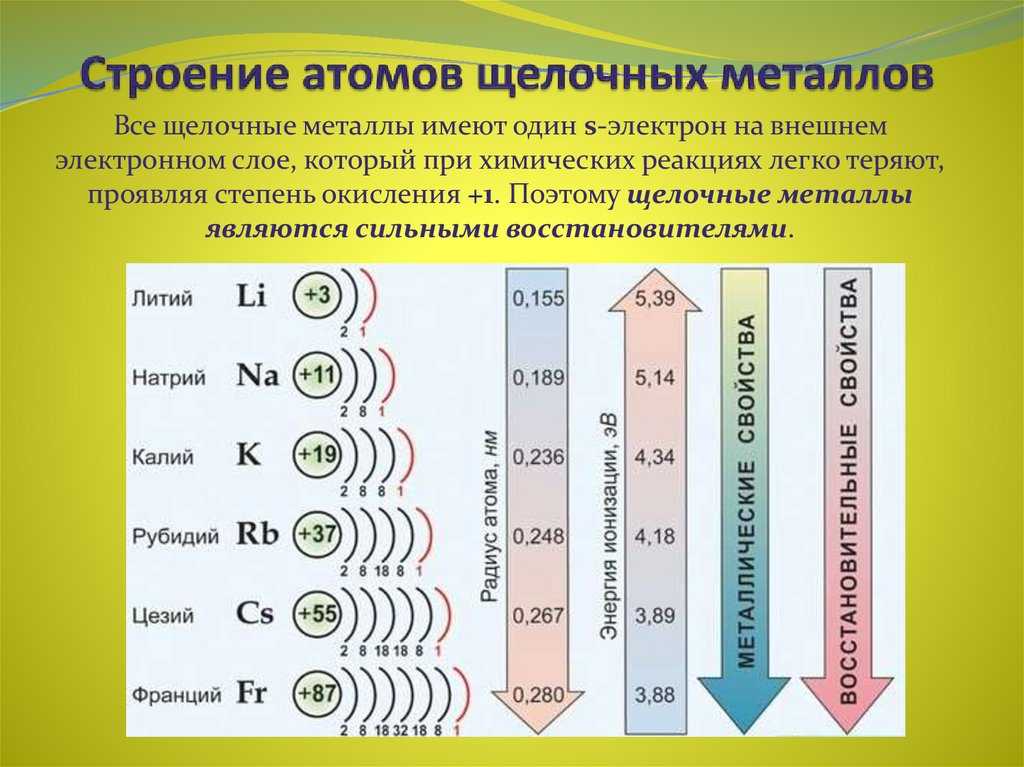 Хотя он и не такой прочный, как сталь, его вес составляет треть веса, что означает, что алюминий может использоваться во всех видах приложений, где вес имеет решающее значение. Дополнительным преимуществом является то, что предел прочности алюминия при понижении температуры увеличивается без потери ударной вязкости, в то время как сталь в аналогичных условиях становится более хрупкой.
Хотя он и не такой прочный, как сталь, его вес составляет треть веса, что означает, что алюминий может использоваться во всех видах приложений, где вес имеет решающее значение. Дополнительным преимуществом является то, что предел прочности алюминия при понижении температуры увеличивается без потери ударной вязкости, в то время как сталь в аналогичных условиях становится более хрупкой.
Не забывайте о коррозионной стойкости
Реакционная способность алюминия на первый взгляд может показаться труднопреодолимым препятствием, но это главная причина, по которой алюминий обладает такой высокой устойчивостью к коррозии. Под воздействием кислорода алюминий естественным образом образует так называемый пассивирующий слой. Это тонкий поверхностный слой оксида алюминия, форма окисления и тот же процесс, который приводит к ржавчине железа.
Однако в алюминии этот слой оксида алюминия защищает металл от дальнейшей коррозии. На самом деле, если металл поцарапан или иным образом поврежден, он быстро восстановится за счет пассивации.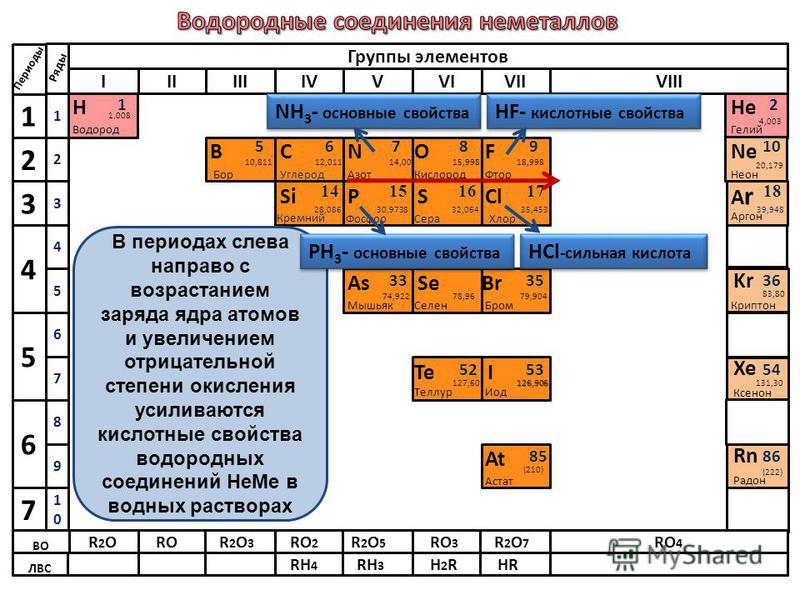
Следует отметить, что некоторые алюминиевые сплавы плохо образуют оксидный слой, что делает их более восприимчивыми к коррозии. К счастью, существуют методы усиления окисления, такие как анодирование, хроматное конверсионное покрытие или промывка металла раствором азотной кислоты, перекиси и деионизированной воды.
С другой стороны, было разработано несколько сплавов, которые повышают естественную коррозионную стойкость алюминия, что делает его пригодным для использования в экстремальных условиях, таких как морская вода или присутствие токсичных химических веществ.
Алюминий обладает массой других полезных свойств
Если бы это были все положительные качества алюминия, сегодня он не был бы таким вездесущим. Алюминий — универсальный металл, поэтому его можно использовать для любых целей. Это начинается с превосходной формуемости алюминия. Из-за своей пластичности алюминий можно изготавливать различными способами, а его прочность на растяжение и долговечность означают, что он по-прежнему способен сохранять свою естественную упругость. Вот почему вы видите большое разнообразие всевозможных алюминиевых деталей.
Вот почему вы видите большое разнообразие всевозможных алюминиевых деталей.
Еще одним положительным свойством алюминия является его отличная теплопроводность. Он часто используется в качестве радиатора для различных устройств, таких как светодиодные фонари, компьютеры, мобильные телефоны и электротехнические изделия. Алюминий также выгодно отличается от меди по электропроводности. Хотя он не такой проводящий, как медь, поскольку он составляет 1/3 веса меди, для проведения того же количества электричества требуется только половина веса алюминиевого провода, что делает его проверенным вариантом для линий электропередачи.
Другие преимущества алюминия включают отражательную способность (как упоминалось ранее) и эстетичный внешний вид, что делает его пригодным для архитектурных и инженерных решений. Алюминий также легко перерабатывается, он нетоксичен и обладает многими другими преимуществами с точки зрения устойчивости. Он не имеет запаха и непроницаем, обладает превосходными гигиеническими свойствами, что помогает объяснить, почему он так важен для производства продуктов питания и напитков, медицинского оборудования и химической промышленности.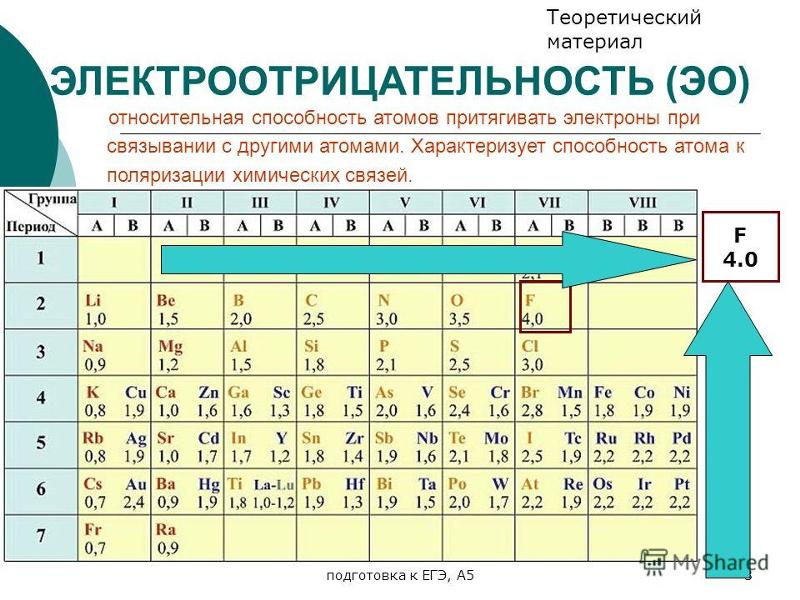

 narod.ru
Народ.Ру
Яндексе
narod.ru
Народ.Ру
Яндексе
 K — калий порядковый номер:
K — калий порядковый номер: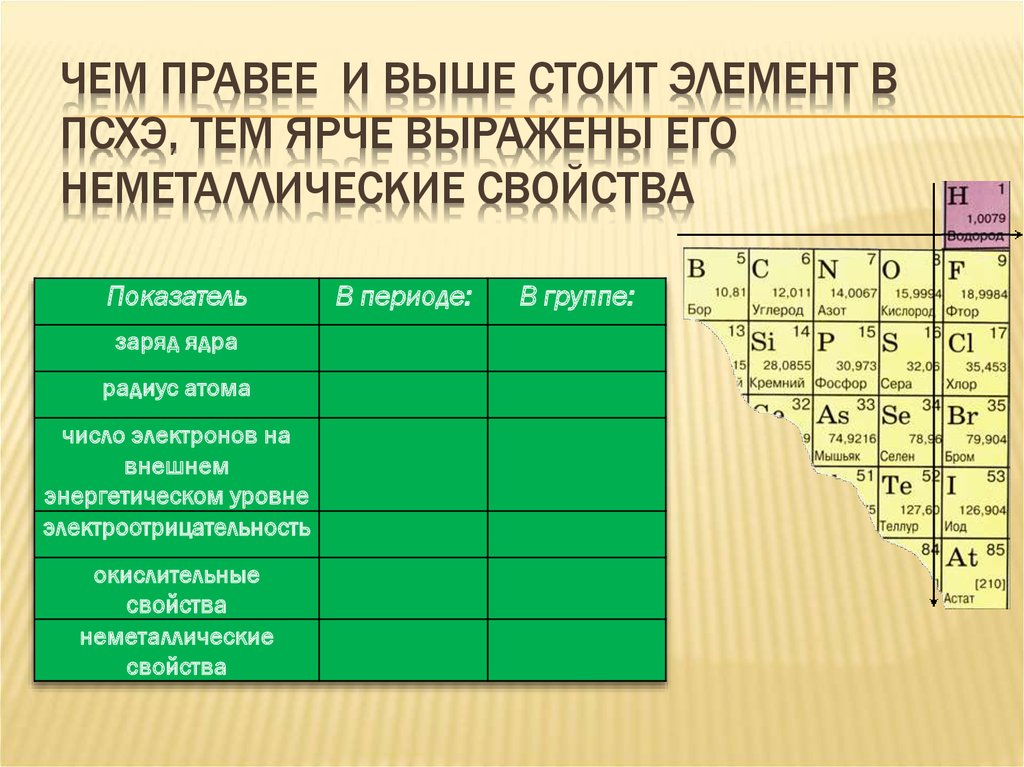 Какой тип связи наблюдается в нем? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором4 в) серой; г) азотом N2; д) соляной кислотой.
Какой тип связи наблюдается в нем? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором4 в) серой; г) азотом N2; д) соляной кислотой.
 Рассмотрите их с позиций процессов окисления-восстановления.
Рассмотрите их с позиций процессов окисления-восстановления.


Leave A Comment