Водородные соединения. Оксиды
Само название «водородные соединения» говорит о том, что в состав данных соединений входит водород. К таким соединениям относятся гидриды и летучие водородные соединения. Давайте разберемся, в чем их отличие.
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
Рассмотрим
свойства хлороводорода – HCl.
Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде.
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в желудочном соке человека и некоторых животных.
Еще одни важным летучим водородным соединением является метан – СН4. Метан – бесцветный газ, плохо растворим в воде, легче воздуха, не имеет запаха. Его еще называют болотным газом, т.к. он образуется на дне болот и водоемов при разложении растительных остатков без доступа кислорода. Кроме того, метан содержится в природном и попутном нефтяном газе.
Известным
и распространенным водородным соединением является аммиак – NH3.
Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется
700 объёмов аммиака, он почти в 2 раза легче воздуха.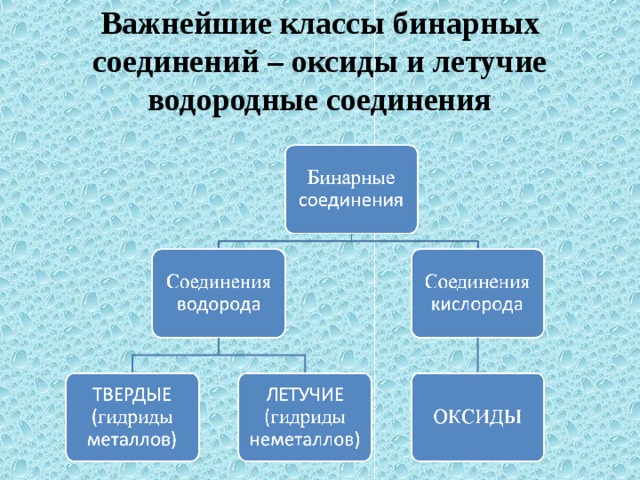 Раствор аммиака в воде
называют нашатырным спиртом, который широко используют в медицине.
Раствор аммиака в воде
называют нашатырным спиртом, который широко используют в медицине.
Сероводород – H2S – тоже известное летучее водородное соединение. Он является
Оксиды
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.
Например: CaO – оксид кальция, K2O – оксид калия
 Например: Fe2O3
– оксид железа (III)
(читается:
«оксид железа три»), CuO
– оксид меди (II)
(читается: «оксид меди два»), CrO3
Например: Fe2O3
– оксид железа (III)
(читается:
«оксид железа три»), CuO
– оксид меди (II)
(читается: «оксид меди два»), CrO3По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
Вода
– Н2О – самое распространенное и самое
необходимое вещество на планете. Почти ¾ поверхности земного шара
занято водой. Однако, это вода морей и океанов, которая является солёной.
В
природе постоянно происходит круговорот воды. Под влиянием солнечного
тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются
водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в
более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а
 Т.к. углекислый газ не поддерживает горение, его используют
для тушения пожаров. В медицине углекислый газ используют для углекислотных
ванн.
Т.к. углекислый газ не поддерживает горение, его используют
для тушения пожаров. В медицине углекислый газ используют для углекислотных
ванн.Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.
Летучее водородное соединение — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Летучие водородные соединения — наиболее практически важная группа соединений с водородом.
Летучие водородные соединения В и элементов подгрупп IVA-VIIA газообразны; в них связь близка к ковалентной. [2]
Летучие водородные соединения — наиболее практически важная группа соединений с водородом. К ним относятся такие часто встречающиеся в природе или используемые в промышленности вещества, как вода, метан и другие углеводороды, аммиак, сероводород, галогеноводороды. Многие из летучих водородных соединений находятся в виде растворов в почвенных водах, в составе живых организмов, а также в газах, образующихся при биохимических и геохимических процессах, поэтому весьма велика их биохимическая и геохимическая роль. [3]
[3]
Летучие водородные соединения галогенов ( галоводороды) НЭ хорошо растворимы в воде. В водных растворах они ведут себя как кислоты. Объясняется это общим уменьшением прочности связи Н — Э в молекулах галоводородов от фтора к астату. Молекулы наиболее слабой фтороводородной кислоты склонны к ассоциации, поэтому для нее известны кислые соли. [5]
Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется Гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000 С.
[6]
В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется Гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000 С.
[6]
Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется р3 — гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000 С.
[7]
Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000 С.
[7]
Какие летучие водородные соединения образуют элементы подгруппы углерода. [8]
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения, которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В меньшей степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, ограничивается объединением двух радикалов. [9]
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения t которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В меньшей степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, ограничивается объединением двух радикалов.
[10]
Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В меньшей степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, ограничивается объединением двух радикалов.
[10]
| Водородные соединения элементов главных подгрупп периодической системы. [11] |
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения, которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В определенной степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, в основном ограничивается объединением двух радикалов. [12]
[12]
Неметаллы образуют летучие водородные соединения ЭНх, где х 8 — номер группы Эти соединения способны проявлять кислотные и основные свойства. Кислотность также увеличивается сверху вниз по группе из-за уменьшения прочности связи элемент — водород, например: HF — кислота средней силы, HI — сильная кислота. [13]
Усиление восстановительных свойств летучих водородных соединений в подгруппах по мере увеличения порядкового номера элемента является общей закономерностью для всех главных подгрупп. [14]
Как изменяются свойства летучих водородных соединений в периодах. [15]
Страницы: 1 2 3 4
Летучие органические соединения (ЛОС) | Центр научного образования
Большинство антропогенных летучих органических соединений поступают из выхлопных газов автомобилей и промышленных процессов. ЛОС, которые поступают из бытовых растворителей, оказывают наибольшее влияние на качество воздуха в помещении.
Летучие органические соединения, или ЛОС, представляют собой органические химические вещества, которые испаряются в атмосферу при комнатной температуре. Некоторые ЛОС также могут растворяться в грунтовых водах. Их называют органическими соединениями, потому что они содержат элемент углерод. Существует много типов ЛОС. Например, углеводородные ЛОС имеют атомы водорода и углерода и включают бензол и толуол. Оксигенатные летучие органические соединения содержат углерод, водород и кислород и являются результатом выхлопных газов автомобилей и химических реакций в атмосфере. Растения производят безвредные летучие органические соединения, чаще всего терпены или масла, которые придают некоторым растениям их характерный запах, а лесные пожары также выделяют летучие органические соединения. Некоторые летучие органические соединения токсичны и оказывают негативное воздействие на атмосферу. ЛОС могут оказывать как краткосрочное, так и долгосрочное воздействие на здоровье и вызывать ухудшение качества воздуха внутри и снаружи помещений.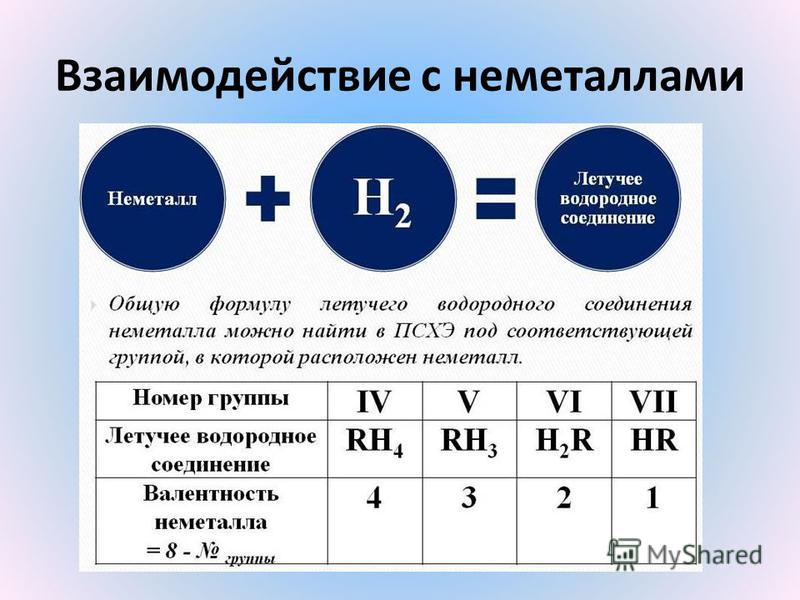
ЛОС влияют на качество воздуха
ЛОС, влияющие на качество воздуха в помещении, поступают из многих видов бытовых товаров, включая краски и лаки, средства для снятия краски, чистящие средства, пестициды, ковровые и виниловые полы, строительные материалы и мебель, офисное оборудование и ремесленные изделия. такие материалы, как клей и маркеры. Большая часть запаха, связанного с этими продуктами, исходит от летучих органических соединений, но выделение летучих органических соединений также может не иметь запаха, что затрудняет их обнаружение. Все эти продукты могут выделять летучие органические соединения во время их использования и хранения. Концентрации летучих органических соединений обычно намного выше в помещении, чем на открытом воздухе. Люди с астмой, респираторными заболеваниями и химической чувствительностью подвергаются наибольшему риску от загрязнителей ЛОС внутри помещений.
Бензин и природный газ являются основными источниками летучих органических соединений, влияющих на качество наружного воздуха. Выхлопы автомобилей и сжигание ископаемого топлива, древесины и мусора — все это приводит к выбросу летучих органических соединений в атмосферу. ЛОС в воздухе реагируют с солнечным светом и оксидами азота с образованием тропосферного озона, еще одного вредного загрязнителя воздуха. Некоторые летучие органические соединения действуют как парниковые газы, которые способствуют потеплению климата.
Выхлопы автомобилей и сжигание ископаемого топлива, древесины и мусора — все это приводит к выбросу летучих органических соединений в атмосферу. ЛОС в воздухе реагируют с солнечным светом и оксидами азота с образованием тропосферного озона, еще одного вредного загрязнителя воздуха. Некоторые летучие органические соединения действуют как парниковые газы, которые способствуют потеплению климата.
ЛОС могут нанести вред здоровью человека
Краски и бытовые чистящие средства являются источниками ЛОС. Использование и хранение таких продуктов, как краски и бытовая химия, без надлежащей вентиляции может привести к нездоровому уровню содержания летучих органических соединений в воздухе.
Некоторые типы летучих органических соединений более опасны, чем другие. Известно, что бензол вызывает рак и содержится в табачном дыме, нефти и газе, а также в выхлопных газах автомобилей. Полициклические ароматические углеводороды (ПАУ) также могут вызывать рак и выделяются при сжигании угля, нефти и газа. Бутадиен содержится в выхлопных газах бензиновых двигателей и сигаретном дыме и также может вызывать рак. Длительное воздействие высоких уровней ЛОС также связано с повреждением печени, почек и нервной системы. Кратковременное воздействие ЛОС может включать такие симптомы, как головокружение, головная боль, раздражение глаз, носа и горла, тошнота и потеря памяти.
Бутадиен содержится в выхлопных газах бензиновых двигателей и сигаретном дыме и также может вызывать рак. Длительное воздействие высоких уровней ЛОС также связано с повреждением печени, почек и нервной системы. Кратковременное воздействие ЛОС может включать такие симптомы, как головокружение, головная боль, раздражение глаз, носа и горла, тошнота и потеря памяти.
Уменьшение воздействия ЛОС
Чтобы уменьшить воздействие ЛОС, ограничьте использование и хранение продуктов, содержащих ЛОС, в вашем доме и не курите. Покупайте продукты, например краски, с пометкой «низкое содержание летучих органических соединений». Если вам необходимо использовать летучие органические соединения, обязательно обеспечивайте достаточную вентиляцию или используйте их на открытом воздухе. Установка очистителей воздуха может помочь удалить летучие органические соединения из помещений, а добавление горшечных растений в помещение также снижает уровень некоторых летучих органических соединений.
© 2020 UCAR с частями, адаптированными из Windows для Вселенной (© 2012 NESTA)
Отличие углеводородов от летучих органических соединений
Отслеживание летучих органических соединений или ЛОС является признанным средством улучшения качества воздуха.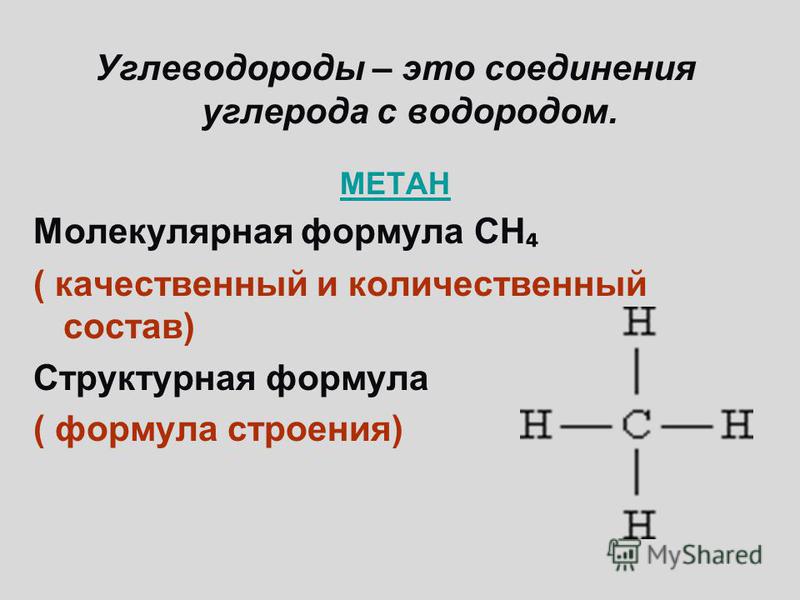 Дома или в профессиональных условиях люди используют устройства, измеряющие летучие органические соединения в стандартных единицах, чтобы понять, как окружающая среда может повлиять на их здоровье. Но как насчет других опасных химических веществ?
Дома или в профессиональных условиях люди используют устройства, измеряющие летучие органические соединения в стандартных единицах, чтобы понять, как окружающая среда может повлиять на их здоровье. Но как насчет других опасных химических веществ?
Прежде чем они смогут по-настоящему контролировать воздух, которым они дышат, потребители должны понимать факты о веществах, которые подвергают их опасности. Это краткое руководство раскрывает некоторые различия.
Основы органической химии
Летучие химические вещества могут превращаться в газы. По сравнению с такими соединениями, как вода, эти вещества гораздо легче испаряются, а значит, могут быстро загрязнять воздух в помещении.
Органическое химическое вещество — это вещество, содержащее углерод, но многие углеродсодержащие молекулы исключены из этого определения по различным историческим и техническим причинам. Например, хотя некоторые интеллектуальные мониторы качества воздуха в помещении отслеживают такие вещества, как двуокись углерода и окись углерода, эти химические вещества не являются летучими органическими соединениями.
Летучие химические вещества имеют множество источников. Например, четыреххлористый углерод в основном производится компаниями, которые используют его для производства химических веществ, таких как хлорфторуглероды или фреоны. Хотя это запрещенное химическое вещество (1), оно все же может встречаться в некоторых потребительских товарах. Дихлорметан, или метиленхлорид, является химически летучим и опасным в своей обычной жидкой форме, но не входит в группу летучих органических соединений.
Углеводороды
Углеводороды, к которым относятся многие органические соединения, полученные из ископаемого топлива, содержат исключительно атомы водорода и углерода. Хотя углеводороды известны своей склонностью к испарению, не все органические соединения являются летучими, а некоторые химически летучие вещества не классифицируются правительством как опасные для человека. Потенциальная путаница, связанная с этими терминами, делает еще более разумным для потребителей начать отслеживать качество воздуха и выбросы.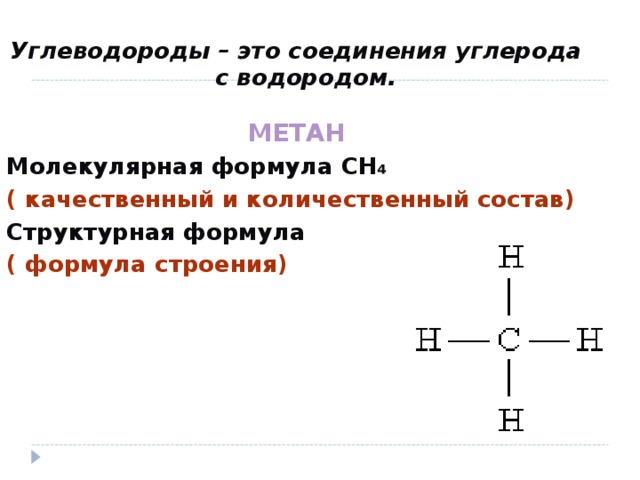
Некоторые из наиболее опасных летучих органических химикатов представляют многочисленные угрозы, например, полициклические ароматические углеводороды или ПАУ. Эти органические химические вещества, содержащие кольца из атомов углерода, создают серьезные проблемы вблизи источников возгорания, таких как решетки на заднем дворе и сигареты. Благодаря их известной роли в возникновении различных форм рака, ПАУ строго регулируются во всем мире.
Последствия качества воздуха
Понимание тенденций концентрации летучих органических соединений в атмосферной среде, с одной стороны, и внутри домов и офисов, с другой стороны, — это разумный способ начать улучшать здоровье людей. Концентрации ПАУ и ЛОС могут меняться в зависимости от множества факторов. Например, выбросы летучих органических соединений из строительных материалов могут быть более вероятными при определенных погодных условиях, и многие опасные строительные продукты могут вызывать проблемы с воздействием на протяжении всего срока их службы (2).

Leave A Comment