Лакмус как индикатор — Справочник химика 21
Приборы и реактивы. Водяная баыя. Ацетат натрия. Карбонат натрия. Карбонат аммоиия. Хлорид калия. Хлорид алюминия. Хлорид олова (II). Сульфит натрия. Ацетат аммония. Индикаторы универсальная индикаторная бумага, лакмус (нейтральный), фенолфталеин. Растворы ацетата натрия (0,5 и.) карбоната натрия (0,5 и.) хлорида алюминия (0,5 и.) хлорида магния (0,5 н,) хлорида сурьмы (III) (0,5 и.) сульфида аммония (0,5 и.) .хлорида олова (II) (0,5 н.)( хлорида аммония (0,1 н.) хлороводородной кислоты (2 н.). [c.86]Одной из характерных качественных реакций на кислоты или щелочи, известных еще в древние времена, является изменение окраски лакмуса (индикатора). [c.125]
При титровании уксусной кислоты едким натром в точке эквивалентности образуется уксуснокислый натрий. Эта соль вследствие гидролиза имеет щелочную реакцию (pH 9).
На первый взгляд может показаться, что должен быть употреблен обязательно такой индикатор, окраска которого меняется при pH 7, т. е. как раз в точке эквивалентности данного титрования, например, лакмус или бромтимоловый синий, показатели титрования которых около 7.
Кислотно-основные индикаторы изменяют свой цвет в зависимости от pH раствора. Как известно, лакмус в кис- [c.56]
Наоборот, если к раствору лакмуса прибавить ш ОН -ионы будут связывать Н+-ионы индикатора в ней ные молекулы НгО. В результате этого равновеси индикатора сместится вправо, т. е. в сторону накоп, 1 творе анионов Ind , и раствор посинеет. [c.239]
В результате этого равновеси индикатора сместится вправо, т. е. в сторону накоп, 1 творе анионов Ind , и раствор посинеет. [c.239]
Окраска индикатора в области перехода меняется постепенно. Поэтому с помощью различных индикаторов можно определить значение pH. Так, если исследуемый раствор краснеет при прибавлении лакмуса и желтеет от ме- [c.187]
Многие вещества, такие, как фенолфталеин, метиловый оранжевый и лакмус, имеют разную окраску в кислых или основных растворах поэтому они используются в качестве кислотно-основных индикаторов (см. рис. 5-7). Хотя п-нитрофенол-плохой индикатор, потому что изменение его окраски мало заметно, он имеет очень простую молекулу, на примере которой удобно показать, что происходит, когда индикатор меняет окраску. Поскольку фенолы обладают в растворах свойствами слабых кислот, они вступают в следующую реакцию
В конце XIX в. в практике титриметрического анализа стали применять синтетические индикаторы сначала фенолфталеин, а затем азокрасители и другие соединения. Использование синтетических индикаторов позволило существенно повысить точность титриметрических методов анализа, так как растительные экстракты, представляющие собой смесь различных природных веществ, имели ограниченную устойчивость и не всегда давали воспроизводимые результаты. Из растительных экстрактов до настоящего времени сохранили определенное значение лишь лакмус и куркума, применяемые главным образом для качественных испытаний.
Использование синтетических индикаторов позволило существенно повысить точность титриметрических методов анализа, так как растительные экстракты, представляющие собой смесь различных природных веществ, имели ограниченную устойчивость и не всегда давали воспроизводимые результаты. Из растительных экстрактов до настоящего времени сохранили определенное значение лишь лакмус и куркума, применяемые главным образом для качественных испытаний.
Числа относятся к индикатору лакмоиду, названному так вследствие сходства получаемых при его применении окрасок с окрасками лакмуса. [c.248]
Процессов электролиза водного раствора сульфата натрия используйте установку из предыдущего опыта (см. рис. 37). В электролизер налейте 1 М раствор сульфата натрия, к которому добавьте несколько капель раствора нейтрального фиолетового лакмуса. Погрузите электроды в раствор, подключите установку к источнику тока и при помощи реостата установите в цепи силу тока 2Л.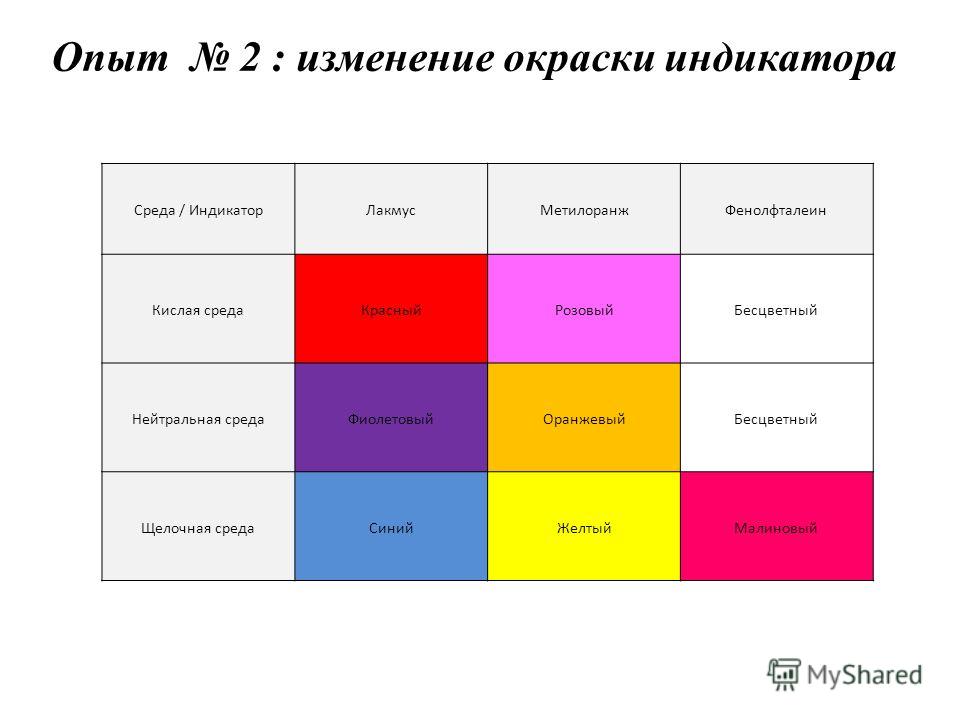
Изменится или останется неизменным цвет следующих индикаторов а) метилового фиолетового б) метилового оранжевого в) лакмуса г) бромтимолового синего д) фенолфталеина — при изменении pH раствора а) с 3,0 до 6,0 6) с 8,0 до 10,0 [c.63]
Из этой кривой видно, что скачок pH здесь меньше по величине, а именно лежит в пределах от 5 до 9. Поэтому метиловый оранжевый (рТ = 4) и тимолфталеин (рТ = 10) здесь применять нельзя. Наоборот, метиловый красный, лакмус, фенолфталеин и т. п. индикаторы подойдут и в этом случае. Таким образом, величина скачка pH при титровании сильных кислот сильными основаниями (или наоборот) зависит от концентрации титруемых растворов. Кроме того, она зависит от температуры, так как с изменением температуры изменяется степень ионизации воды.
Для количественного определения pH существуют различные способы. Простейшим способом оценки pH является использование индикаторов. Индикатор представляет собой окрашенное вещество, обычно растительного происхождения, способное существовать в двух формах-кислой и основной, в которых он имеет различную окраску. Если добавить небольшое количество какого-либо индикатора к раствору и заметить его окраску, то можно определить, находится ли. индикатор в кислой или основной форме. Если известно значение pH, при котором индикатор переходит из одной формы в другую, то по наблюдаемой окраске раствора можно судить о том, выше или ниже его pH, чем pH перехода окраски данного индикатора. Например, лакмус, один из наиболее распространенных индикаторов, изменяет окраску при pH, близком к 7. Однако изменение окраски лакмуса происходит не очень резко. Красный раствор лакмуса имеет pH, приблизительно равный 5 или ниже, а синий раствор лакмуса имеет pH, приблизительно равный 8,2 или выше.
Титрование сильных оснований. В результате титрования образуется соль сильного основания и сильной кислоты. Такая соль не подвергается гидролизу и pH раствора поэтому не изменяется. Следовательно, pH в точке эквивалентности будет равен 7 или несколько меньше, так как обычно в растворе присутствует растворенная двуокись углерода.
Поэтому нельзя применять индикатор типа лакмуса, который изменяет окраску в нейтральном растворе (при рН -7). [c.317]
Работа в. Растворы индикаторов метиловый оранжевый, фенолфталеин, лакмус, метиловый красный, фенолрот, универсальный. [c.177]
Лакмусовая бумага представляет собой фильтровальную бумагу, пропитанную раствором лакмуса. Индикатор лакмус чувствителен к слабым и сильным кислотам и основаниям. Кислоты окрашивают его в красный цвет, основания—в синий. Лакмус—природный продукт, содержащий всего 4,5% красящего вещества (азолитмина) и до 90% минеральных веществ. В нейтральной среде лакмус окрашен в сиреневый цвет его окраска изменяется на краснук> при рН=6 и на синюю при pH 8.
Например, при титровании Nh50H (рК == 4,70) можно применить индикаторы с рт 6,24. Следовательно, ни фенолфталеин (рТ = 9), ни лакмус (рТ = 7) здесь не подойдут. Наоборот, метиловый красный (рТ = 5,5) и метиловый оранжевый (рТ = 4) должны быть вполне пригодными. [c.289]
Наоборот, метиловый красный (рТ = 5,5) и метиловый оранжевый (рТ = 4) должны быть вполне пригодными. [c.289]
Пробирки с сухими реактивами удобно располагать в штативе-шкафчике на нижней полке, в штативе круглом — на самой верхней. Рабочие пробирки для проведения реакций в обоих случаях целесообразно держать на нижней полке. Вторая полочка снизу предназначается для дистиллированной воды, кислот и щелочей, раствора лакмуса и других индикаторов. Остальные полочки предназначены для всех других реактивов, которые могут меняться в соответствии с темой работы.
Если на лакмус реакция раствора окажется кислая, уточнить рн, пользуясь табл. 9 Приложения следующим образом. Взять в другую пробирку 5 капель исследуемого раствора и прибавить к нему каплю метилового красного. При появлении оранжевой окраски раствора можно считать pH 5 (в области перехода индикатора). Красная окраска раствора покажет, что pH с 4,4. В этом случае следует продолжить уточнение pH. Взять снова в чистую пробирку 5 капель исследуемого раствора и добавить каплю метилового оранжевого. Если раствор окрасится в оранжево-желтый цвет, это значит, что pH 4,4. Объединяя наблюдения с метиловым красным и метиловым оранжевым, считать pH 4,4. Если с метиловым оранжевым раствор окрасится в красный цвет — следовательно в нем pH с 3,1. В этом случае следует снова взять в чистую пробирку 5 капель раствора и прибавить каплю тимолового синего. Появление желтой окраски (первая область перехода) укажет, что pH > 2,8. Объединяя наблюдения с метиловым оранжевым и тимоловым синим сделать вывод, что 3,1 > рн > 2,8 и принять pH = (3,1 + 2,8)/2 == = 2,95.. [c.82]
Взять снова в чистую пробирку 5 капель исследуемого раствора и добавить каплю метилового оранжевого. Если раствор окрасится в оранжево-желтый цвет, это значит, что pH 4,4. Объединяя наблюдения с метиловым красным и метиловым оранжевым, считать pH 4,4. Если с метиловым оранжевым раствор окрасится в красный цвет — следовательно в нем pH с 3,1. В этом случае следует снова взять в чистую пробирку 5 капель раствора и прибавить каплю тимолового синего. Появление желтой окраски (первая область перехода) укажет, что pH > 2,8. Объединяя наблюдения с метиловым оранжевым и тимоловым синим сделать вывод, что 3,1 > рн > 2,8 и принять pH = (3,1 + 2,8)/2 == = 2,95.. [c.82]
В том случае, если реакция раствора на лакмус оказалась щелочная, уточнить pH, аналогично описанному выше с помощью индикаторов, область перехода которых лежит в щелочной среде, начиная с фенолфталеина или тимолового синего (вторая область перехода последнего). [c.82]
Для пригстсвлеиия нейтрального лакмуса индикатор трижды обрабатывают на водяной бане 85%-ным раствором сйирта. Затем растворяют в слабощелочной воде (I г в 100 мл) и осторожно нейтрализуют уксусной кислотой до фиолетового цвета нейтрального лакмуса. Подробнее см, Палауэов В. Н. Химические реактивы, свойства, получение, методы испытаний и применение. Научно-техническое издательство Украины, 1935, с. 333. [c.234]
Затем растворяют в слабощелочной воде (I г в 100 мл) и осторожно нейтрализуют уксусной кислотой до фиолетового цвета нейтрального лакмуса. Подробнее см, Палауэов В. Н. Химические реактивы, свойства, получение, методы испытаний и применение. Научно-техническое издательство Украины, 1935, с. 333. [c.234]
Выполнение работы. Определить окраску кислотной и щелочной форм наиболее часто применяемых четырех индикаторов метилоранжа, метилового красного, лакмуса и фенолфталеина. Наблнэдение провести в сильнокислой и сильнощелочной средах, чтобы в первом случае pH был заведомо ниже, а во втором — за- [c.80]
Шприцман Э. М. Заменитель лакмуса. (Индикатор из отходов виноделия). Виноделие и виноградарство Молдавии, 1949, № 1, с. 18—19. 636 [c.31]
Взаимодействие ангидридов с водой. 1. В чашку с дистиллированной водой внесите микрошпатель оксида фосфора (V) и перемешайте. В полученном растворе определите наличие фосфорной кислоты с помощью индикатора (раствора лакмуса или метилоранжа) и образования труднорастворимых солей Ваз(Р04)2 и AgзP04 при добавлении к раствору ВаСЬ и АеЫОз. [c.60]
[c.60]
Вещества, претерпевающие, подобно К2СГО4, какое-либо легко различимое изменение при титровании (например, перемену окраски, выпадение в осадок и т. д.) и тем самым позволяющие фиксировать точку эквивалентности, называются индикаторами. К ним относятся, например, лакмус, фенолфталеин, метиловый оранжевый и некоторые другие вещества, употребляемые при реакции нейтрализации. [c.194]
Таким образом, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только прп условии, если величина показателя титрования индикатора рТ не менее чем на 3 единицы превышает величину показателя кислоты рЛ. Например, можно сказать заранее, что дост аточно точно оттитровывать уксусную кислоту (рК = 4,76) можно только при использовании таких индикаторов, показатель титрования которых рТ 7,76, т. е. ни метиловый оранжевый (рТ = 4), ни метиловый красный (рТ = 5,5), пи даже лакмус (рТ = 7) для данного титрования непригодны. Наоборот, фенолфталеин (рТ = 9) должен оказаться пригодным. [c.288]
Наоборот, фенолфталеин (рТ = 9) должен оказаться пригодным. [c.288]
Важной особенностью таких растворов является то, что химические свойства электролита в них как бы складываются из свойств соответствующих ионов в таких растворах. Логически это понятно, так как если недиссоциированных молекул в растворе практически нет, то и на свойства раствора они не влияют. Это приводит, например, к появлению у электролитов групповых химических свойств, присущих всем электролитам, содержащим ион данного вида. Так, все хлориды и соляная кислота содержат ион хлора, и поэтому им свойственна реакция-образования осадка А С1 при взаимодействии с AgNOз. Подобные групповые реакции широко используются в аналитической химии. Напрнмер, действием иона водорода обусловлены все кислотные свойства способность изменять цвет лакмуса или метилоранжа в красный цвет или соответственно изменять окраску других индикаторов, растворять некоторые металлы с выделенцем водорода и образованием соли, нейтрализовать основания и т. д. Можно убедиться, что во всех указанных процессах кислота действует не своим анионом и не недиссоциированной молекулой, а именно водородным ионом. Чем больше концентрация водородных ионов, тем более резко проявляются все кислотные свойства раствора. Подобным же образом все свойства, общие для оснований, осуществляются действием гидроксильных ионов. Чем выше концентрация гидроксильных ионов, тем сильнее все основные свойства раствора. К групповым свойствам принадлежит также окраска раствора, вызываемая присутствием какого-нибудь иона (синий цвет гидратированных ионов Си +, зеленый — N 2- ). [c.397]
д. Можно убедиться, что во всех указанных процессах кислота действует не своим анионом и не недиссоциированной молекулой, а именно водородным ионом. Чем больше концентрация водородных ионов, тем более резко проявляются все кислотные свойства раствора. Подобным же образом все свойства, общие для оснований, осуществляются действием гидроксильных ионов. Чем выше концентрация гидроксильных ионов, тем сильнее все основные свойства раствора. К групповым свойствам принадлежит также окраска раствора, вызываемая присутствием какого-нибудь иона (синий цвет гидратированных ионов Си +, зеленый — N 2- ). [c.397]
Лакмус получается из тех же лишайников, из которых получается орсейль. Их обрабатываю аммиаком, известью и поташом, после чего массу оставляют бродить. Лакмус тоже пе является индивидуальным веществом с помощью спирта его можно разделить на спирторастворимую и спнртонерастворимую фракции. В крашении лакмус не играет теперь никакой роли и лишь иногда используется для подкраски пищевых продуктов. Наиболее ш-нроко лакмус применяется в качестве индикатора на водородные и гидроксильные ионы, причем первыми он окрашивается в красный, а вторыми — в синий цвет. [c.552]
Наиболее ш-нроко лакмус применяется в качестве индикатора на водородные и гидроксильные ионы, причем первыми он окрашивается в красный, а вторыми — в синий цвет. [c.552]
Специальный термин химический анализ впервые применил в первой половине XVII в. английский ученый Р. Бойль для обозначения химических реакций, с помощью которых можно открыть одно вещество в присутствии других. Он же описал применение индикаторов — различных природных красителей (лакмус и др.) для распознавания кислот и оснований. Бойль описал также реакции открытия серной и соляной кислот посредством солей кальция и серебра, применил таннин для открытия железа и изучил ряд других реакций. [c.10]
Выбор индикатора. Для обнаружения точки эквивалентности в титриметрическом анализе применяют индикаторы (от. лат. indi are — показывать, обнаруживать). В первых титриметрических определениях (1729) в качестве основания использовали карбонат калия (потащ) и точку эквивалентности устанавливали по прекращению выделения газа. Впоследствии в методе кислотно-основного титрования наиболее широкое распространение получили цветные индикаторы, окраска которых зависела от pH раствора. Первое титрование с применением цветного индикатора выполнил У. Льюис в 1767 г. и первым индикатором, использованным для этой цели, был лакмус, хотя индикаторные свойства различных растительных экстрактов были известны значительно раньше. [c.194]
Впоследствии в методе кислотно-основного титрования наиболее широкое распространение получили цветные индикаторы, окраска которых зависела от pH раствора. Первое титрование с применением цветного индикатора выполнил У. Льюис в 1767 г. и первым индикатором, использованным для этой цели, был лакмус, хотя индикаторные свойства различных растительных экстрактов были известны значительно раньше. [c.194]
Колориметрический метод основан на изменении окраски индикаторов в зависимости от концентрации водородных ионов. Индикаторы представляют собой слабые кислоты или слабые основания, недиссоциированная форма которых имеет иную окраску, чем диссоциированная. Например, недиссоциированная молекула лакмуса Hind имеет красный цвет, а ион Ind — синий. В раство- [c.58]
Работа 8. Лабораторный рН-метр ЛП-58, к нему каломельный электрод (насыш,енный), платиновый или стеклянный электрод. Бюретки — две на 25 мл. Пробирки, Стакан на 25 мл. Индикаторы метиловый оранжевый, фенолфталеин, лакмус, метиловый красный, фенолрот, универсальный. Растворы буферная смесь для стеклянного электрода (0,1 и. СН3СООН — 720 мл л и 0,1 н. Ha OONa — 280 мл л), Nh5 I —50 г/л. [c.177]
Растворы буферная смесь для стеклянного электрода (0,1 и. СН3СООН — 720 мл л и 0,1 н. Ha OONa — 280 мл л), Nh5 I —50 г/л. [c.177]
Индикагоры, которые в кислой и щелочной средах имеют различную окраску, получили название двухцветных (метиловый красный, лакмус и др.), а индикаторы, которые имеют одну окраску — одноцветных (фенолфталеин и др.)- [c.218]
Приборы и реактивы. Прибор для получения хлороводорода (рис. 40). Стеклянные палочки. Сетка асбе-стнрованная. Кристаллизатор или чашка фарфоровая. Стакан химический (вместимостью 100 мл). Электрическая плитка. Диоксид марганца. Хлорид натрия. Бромид натрия. Иодид калия. Дихромат калия. Соль Мора. Перхлорат калия. Перманганат калия. Хлорат калия. Магний (порошок). А люминий (порошок). Цинк (порошок). Индикаторы лакмусовая бумажка, лакмус синий. Органический растворитель. Растворы хлорной воды бромной воды йодной воды сероводородной воды хлорида натрия (0,5 и.) бромида натрия (0,5 н.) иодида калия (0,1 н. ) нитрата серебра (0,1 н.) хлорида хлората калия (насыщенный) перхлорат калия (0,5 и.) дихромата калия (0,5 н.) перманганата калия (0,5 н.) тиосульфата натрия (0,5 н,) едкого натра (2 н.) хлороводородной кислоты (плотность 1,19 г/см ) серной кислоты (плотность 1,84 г/см 70%-ной) фосфорной кислоты (концент-рироввиная). [c.132]
) нитрата серебра (0,1 н.) хлорида хлората калия (насыщенный) перхлорат калия (0,5 и.) дихромата калия (0,5 н.) перманганата калия (0,5 н.) тиосульфата натрия (0,5 н,) едкого натра (2 н.) хлороводородной кислоты (плотность 1,19 г/см ) серной кислоты (плотность 1,84 г/см 70%-ной) фосфорной кислоты (концент-рироввиная). [c.132]
Приборы и реактивы. рН-метр. Стаканчики вместимостью 20—30 мл стеклянные палочки безразмерные пипетки (стеклянные трубки с оттянутым концом). Индикаторы лакмус, фенолфталеин, метиловый оранжевый, метиловый красный,. тимоловый синий, ализарин желтьуй, индиго-кармин, универсальная индикаторная бумага. Растворы хлороводородной кислоты (0,1 н.) уксусной кислоты (0,1 н.) едкого натра (0,1 н. 1 н.) аммиака (0,1 н.) ацетата натрия (0,1 и.) клорида аммония (0,1 н.). [c.79]
Приборы и реактивы. Прибор для получения оксида азота (П). Кристаллизатор или фарфоровая чашка. Тигель фарфоровый. Микроколба. Лучина. Стеклянная палочка.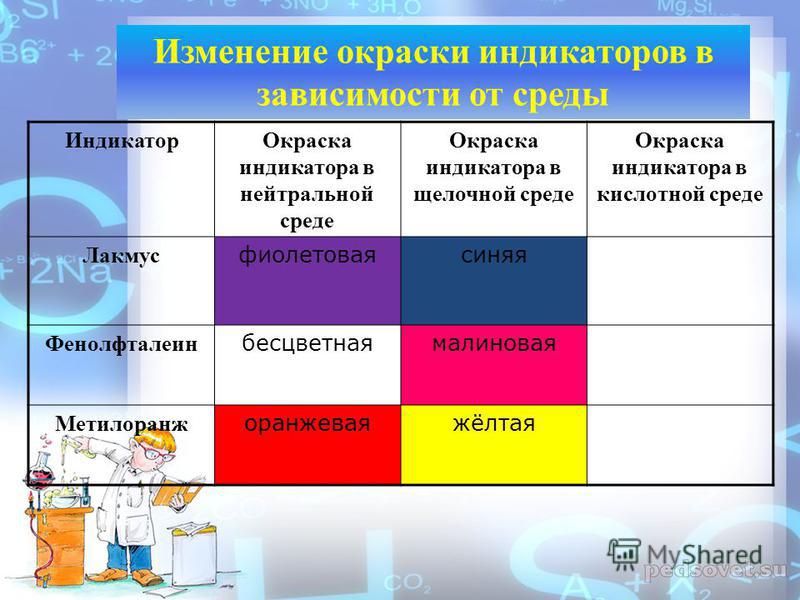 Нитрат свинца. Ацетат аммония. Нитрат калия. Хлорид аммония. Сульфат аммония. Магний — порошок. Нитрит калия. Нитрат серебра. Медь (стружка). Гашеная известь. Индикаторы красная лакмусовая бумажка, феиол-фталеилакмус красный. Растворы бромной воды хлорида аммония (0,5 и,, насыщенный) нитрита калия (0,5 н., насыщенный) иодида калия (0,1 н.) сульфата алюминия (0,5 н.) перманганата калия (0,5 н.) дихромата калия (0,5 н.) азотной кислоты (плотность 1,4 г/см и 1,12 г/см ) серной кислоты (2 н.) хлороводородной кислоты (плотность 1,19 г/см ) едкого натра (2 и.) аммиака (2 н. и 25%-ным). [c.148]
Нитрат свинца. Ацетат аммония. Нитрат калия. Хлорид аммония. Сульфат аммония. Магний — порошок. Нитрит калия. Нитрат серебра. Медь (стружка). Гашеная известь. Индикаторы красная лакмусовая бумажка, феиол-фталеилакмус красный. Растворы бромной воды хлорида аммония (0,5 и,, насыщенный) нитрита калия (0,5 н., насыщенный) иодида калия (0,1 н.) сульфата алюминия (0,5 н.) перманганата калия (0,5 н.) дихромата калия (0,5 н.) азотной кислоты (плотность 1,4 г/см и 1,12 г/см ) серной кислоты (2 н.) хлороводородной кислоты (плотность 1,19 г/см ) едкого натра (2 и.) аммиака (2 н. и 25%-ным). [c.148]
Индикаторы изменяющие окраску в зависимости
При титровании уксусной кислоты едким натром в точке эквивалентности образуется уксуснокислый натрий. Эта соль вследствие гидролиза имеет щелочную реакцию (pH 9). Если в качестве индикатора взять лакмус, который изменяет окраску уже при очень небольшом отклонении от строго нейтральной среды (pH 7), очевидно, титрование будет неточным.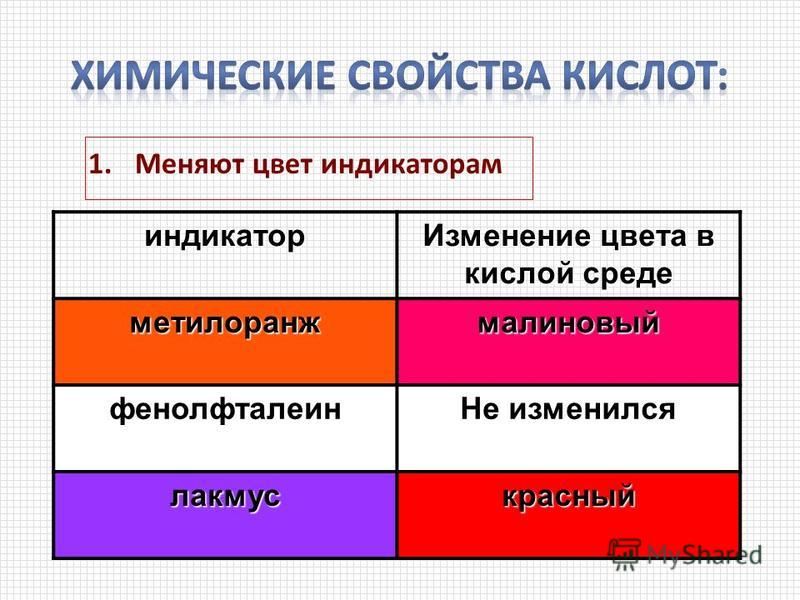 Для названного титрования берут другой индикатор, а именно фенолфталеин. Фенолфталеин бесцветен в кислой и в нейтральной среде, он окрашивается в красный цвет только в слабощелочной среде (pH 9), т. е. соответствует точке эквивалентности при данном титровании. Подобные же зависимости имеют место в других методах объемного анализа. [c.274]
Для названного титрования берут другой индикатор, а именно фенолфталеин. Фенолфталеин бесцветен в кислой и в нейтральной среде, он окрашивается в красный цвет только в слабощелочной среде (pH 9), т. е. соответствует точке эквивалентности при данном титровании. Подобные же зависимости имеют место в других методах объемного анализа. [c.274] Индикаторы, изменяющие окраску при определенном окислительном потенциале раствора, известны (см. ниже). Однако большая часть таких индикаторов имеет существенные недостатки. Так, в зависимости от pH раствора обычно изменяется значение потенциала, при котором наблюдается переход индикатора из одной формы в другую. Иногда изменение- [c.361]
Индикаторами называются вещества, которые способны изменять свою окраску в зависимости от активности или от концентрации водородных ионов в растворе. Многие индикаторы используются при титровании кислот щелочами или наоборот, но очень немногие индикаторы изменяют окраску вблизи точки нейтрализации, т. е. когда pH раствора мало отличается от 7. Изменение окраски (см. табл. XVIII, 6) происходит в интервале 1,5—2 единиц pH и в зависимости от г рироды индикатора может происходить как в кислых, так и в щелочных [c.487]
е. когда pH раствора мало отличается от 7. Изменение окраски (см. табл. XVIII, 6) происходит в интервале 1,5—2 единиц pH и в зависимости от г рироды индикатора может происходить как в кислых, так и в щелочных [c.487]
При помощи таких индикаторов, как лакмус, можно установить, каким является раствор — кислым, нейтральным или щелочным. Индикаторы изменяют свою окраску с изменением pH раствора не резко, а в интервале одной-двух единиц pH. Обусловливается это наличием химического равновесия между двумя различно окрашенными формами данного индикатора, а зависимость окраски от концентрации ионов водорода объясняется участием ионов водорода в таком равновесии. [c.335]
Выше указывалось, что признаком достижения точки эквивалентности служит приобретение раствором определенного значения pH. Индикаторами в методе кислотно-основного титрования служат вещества, окраска которых меняется в зависимости от изменения Ех личины pH. Поэтому эти вещества называют кислотно-основными индикаторами. Окраска каждого из индикаторов изменяется внутри определенного узкого интервала значений pH, причем этот интервал зависит только от свойств данного рН-индикатора и совершенно не зависит от природы реагирующих между собой кислоты и основания. [c.238]
Окраска каждого из индикаторов изменяется внутри определенного узкого интервала значений pH, причем этот интервал зависит только от свойств данного рН-индикатора и совершенно не зависит от природы реагирующих между собой кислоты и основания. [c.238]
Для определения реакции среды (кислотной, щелочной, нейтральной) обычно применяют индикаторы, которые изменяют окраску в зависимости от концентрации ионов водорода и гидроксила. Они представляют собой слабодиссоциирующие органические кислоты или основания. [c.216]
В-третьих, окраска индикатора изменяется в зависимости от ионной силы раствора. [c.413]
В-третьих, окраска индикатора изменяется в зависимости от ионной силы раствора, и при значительной ионной силе окраска индикатора может изменяться и не в связи с изменением величины pH. [c.785]
Определение гидроксида К- Аэрозоль КОН в воздухе определяется денситометрическим методом, основанным на способности кислотно-щелочных индикаторов изменять окраску в зависимости от pH среды чувствительность 4 мкг в анализируемом объеме [46]. [c.50]
[c.50]
Индикаторами называются химические соединения, способные изменять окраску раствора в зависимости от условий среды, не влияя при этом непосредственно на испытуемый раствор и иа направление реакции. Так, кислотно-щелочные индикаторы изменяют окраску в зависимости от pH среды окислительно-восстановительные индикаторы — от потенциала среды адсорбционные индикаторы — от степени адсорбции и т. д. [c.51]
Окраска, характерная для используемого в этой пробе индикатора, изменяется в зависимости от количества выделившейся синильной кислоты. Изменение окраски бумаги конго из красной в синюю отчетливо заметно [c.212]
Для приблизительного определения pH пользуются индикаторами, т. е. веществами, меняющими свою окраску в зависимости от щелочности или кислотности среды. Часто с этой целью употребляют лакмус, фенолфталеин, метиловый оранжевый. Изменение окраски различных индикаторов происходит при вполне определенных для каждого из них значениях pH. Например, окраска метилового оранжевого от красной до желтой меняется в интервале pH от 3,1 до 4,4. Промежуток между двумя значениями pH, в котором изменяется окраска индикатора, называется интервалом индикатора. [c.127]
Например, окраска метилового оранжевого от красной до желтой меняется в интервале pH от 3,1 до 4,4. Промежуток между двумя значениями pH, в котором изменяется окраска индикатора, называется интервалом индикатора. [c.127]
Качественное определение реакции среды (кислая, нейтральная или щелочная) осуществляется при помощи обычных индикаторов (лакмус, фенолфталеин, метиловый оранжевый). Индикаторы, как известно, изменяют свою окраску в зависимости от pH среды, в которой они растворены. Так, например, лакмус при pH 5 имеет красную окраску, при pH 8 — синюю. В интервале pH от 5 до 8 происходит изменение окраски лакмуса от красной к синей. Этот промежуток между двумя значениями pH называется областью перехода или интервалом индикатора. Он определяется для каждого индикатора. Фенолфталеин изменяет окраску в интервале pH от 8,2 до 10, метиловый оранжевый — от 3,1 до 4,4. [c.111]
Значения pH растворов можно экспериментально определить при помощи к и с л о т и о — о с и о в и ы х индикаторов— веществ, которые изменяют окраску в зависимости от концентрации водородных ионов. Так, фенолфталеин изменяет окраску с бесцветной (кислая форма индикатора) на красную (щелочная форма) при переходе от кислой среды к щелочной в интервале pH от 8,2 до 10,0. Интервалы изменения окраски некоторых индикаторов приведены в табл. 5.1. [c.91]
Так, фенолфталеин изменяет окраску с бесцветной (кислая форма индикатора) на красную (щелочная форма) при переходе от кислой среды к щелочной в интервале pH от 8,2 до 10,0. Интервалы изменения окраски некоторых индикаторов приведены в табл. 5.1. [c.91]
Многие из фталеинов находят применение в качестве индикаторов вследствие способности изменять окраску в зависимости от концентрации водородных ионов (pH) в растворе. Так, бесцветный фенолфталеин, имеющий строение лактона, при действии щелочей образует (с разрывом лактонного кольца) соль, причем одно нз бензольных ядер принимает хиноидное строение и становится, таким образом, хромофором [c.191]
Индикаторы различают также по типу, химической реакции, в которой их применяют. Индикаторы методов кислотно-основного титрования — это окрашенные органические соединения, существующие в двух формах, в зависимости от pH раствора. Чаще всего обе формы различаются по окраске, это так называемые двухцветные индикаторы. Реже применяют одноцветные индикаторы, в которых окрашена только одна форма. Кислотно-основные индикаторы изменяют окраску в зависимости от концентрации водородных ионов раствора и в этом смысле являются специфическими индикаторами на ионы водорода. Индикаторы этой группы являются обратимыми. [c.144]
Реже применяют одноцветные индикаторы, в которых окрашена только одна форма. Кислотно-основные индикаторы изменяют окраску в зависимости от концентрации водородных ионов раствора и в этом смысле являются специфическими индикаторами на ионы водорода. Индикаторы этой группы являются обратимыми. [c.144]
Колориметрический метод измерения pH. Колориметрический метод определения pH основан на свойстве индикаторов изменять свою окраску в зависимости от активности ионов водорода в определенном интервале pH. Колориметрическое определение pH производят при помощи индикаторов (табл. 2) и стандартных буферных растворов. [c.115]
Для измерения pH и рОН существуют различные методы. Качественно реакцию среды можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых изменяется в зависимости от концентрации Н — и ОН -ионов в растворе. [c.109]
Помимо этой группы веществ (индикаторов), в методах окисления-восстановления нашли широкое практическое применение другие индикаторы, называемые ре5-ОАС-индикаторами, которые изменяют окраску в зависимости от величины окислительно-восстановительного потенциала ( ). [c.186]
[c.186]
Определять концентрацию водородных ионов pH очень часто требуется как в жидкостях, так и в твердых материалах (бетонах, цементном камне, продуктах коррозии бетона и арматуры и т. д.). Для установления pH жидкостей пользуются индикаторами, т. е. такими соединениями, окраска которых изменяется в зависимости от pH среды, где они растворены. Индикаторы принадлежат к совершенно различным типам органических соединений среди них есть нитросоединения, диазосоединения, фталеины, соединения трифенилметанового ряда и многие другие. Но все они являются или слабыми кислотами, или слабыми основаниями [16]. [c.112]
Величины pH растворов учитывают при выполнении операций осаждения ионов и растворения осадков. Качественно реакцию раствора определяют при помощи индикаторов, т.е. специальных реактивов, окраска которых изменяется в зависимости от концентрации водородных ионов. [c.40]
Спектрофотометр ичеокие характеристики реакций (13)—>(14) металлохромных индикаторов, как правило, не мог т быть даны на основании более простых систем, которые рассматривались в предыдущих параграфах. Подобное упрощение возможно только в том случае, если реактив берется в очень большом избытке. Тогда изменением его концентрации можно пренебречь, а наложение собственной окраски реактива можно элиминировать, например, пропуская контрольный световой поток через раствор свободного реактива той же концентрации. Однако очевидно, что при любом методе измерения большой избыток окрашенного реактива вносит серьезные трудности. Поэтому обычно применяют необходимый, но небольшой избыток окрашенного реактива. В результате окраска растворов с переменным количеством определяемого металла изменяется в зависимости не только от концентрации образующегося комплекса, но и от концентрации избытка свободного реактива. Еще в большей мере это характерно для системы рН-индикато-ров (15). [c.54]
Подобное упрощение возможно только в том случае, если реактив берется в очень большом избытке. Тогда изменением его концентрации можно пренебречь, а наложение собственной окраски реактива можно элиминировать, например, пропуская контрольный световой поток через раствор свободного реактива той же концентрации. Однако очевидно, что при любом методе измерения большой избыток окрашенного реактива вносит серьезные трудности. Поэтому обычно применяют необходимый, но небольшой избыток окрашенного реактива. В результате окраска растворов с переменным количеством определяемого металла изменяется в зависимости не только от концентрации образующегося комплекса, но и от концентрации избытка свободного реактива. Еще в большей мере это характерно для системы рН-индикато-ров (15). [c.54]
Индикаторы изменяют свою окраску с изменением pH раствора не резко изменение окраски происходит в интервале одной-двух единиц pH. Обусловливается это наличием химического равновесия между двумя различно окрашенными формами данного индикатора, а зависимость окраски [c.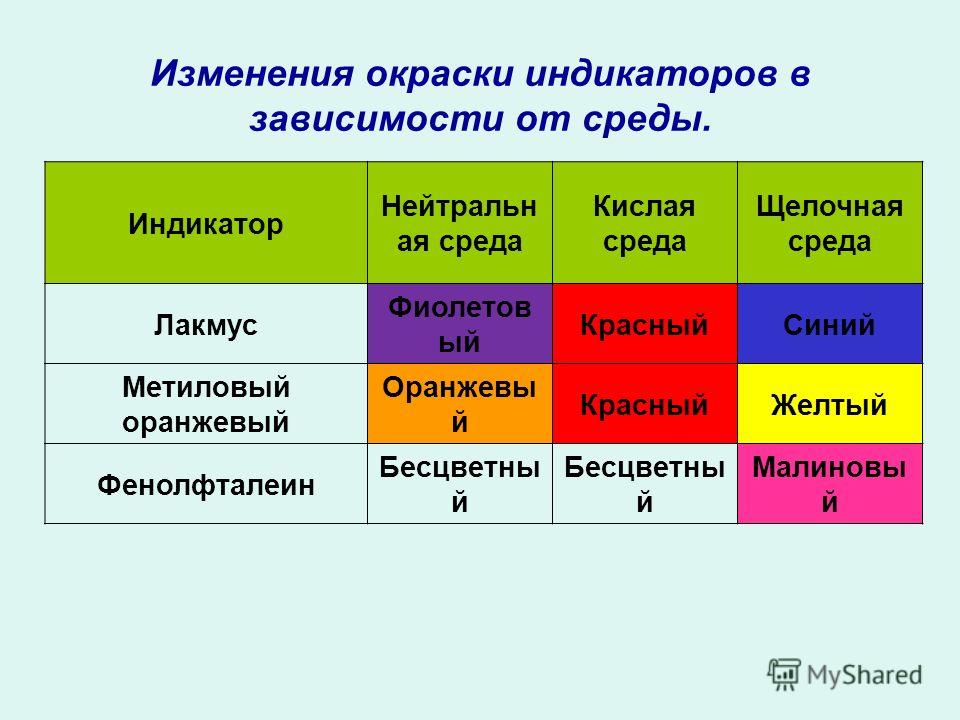 354]
354]
Адсорбционные индикаторы представляют собой специальный тип индикаторов для титрования методом осаждения. Это — органические вещества, ионы которых адсорбируются на осадке в зависимости от заряда на поверхности его решетки. Адсорбированный индикатор поляризуется в результате взаимодействия поверхностного заряда осадка и электронной системы индикатора. Возникающее при этом смещение электронных энергетических уровней в большей или меньшей степени изменяет спектр поглощения индикатора или может приводить к тушению флуоресценции. Установлено, что некоторые индикаторы образуют соединения с ионами осадка. Действие большинства адсорбционных индикаторов зависит только от поляризационных эффектов, возникающих после соосаждения (адсорбции). Известно, однако, небольшое число окислительно-восстановительных и комплексонометрических индикаторов, которые изменяют окраску в результате адсорбции одного из своих собственных ионов на осадке, так как локальная концентрация этого иона на поверхности осадка оказывается значительно большей, чем в растворе, и, таким образом, изменение окислительно-восстановительного потенциала или значения рМ, как это может иметь место в данном случае, будет достаточным для начала реакции индикатора.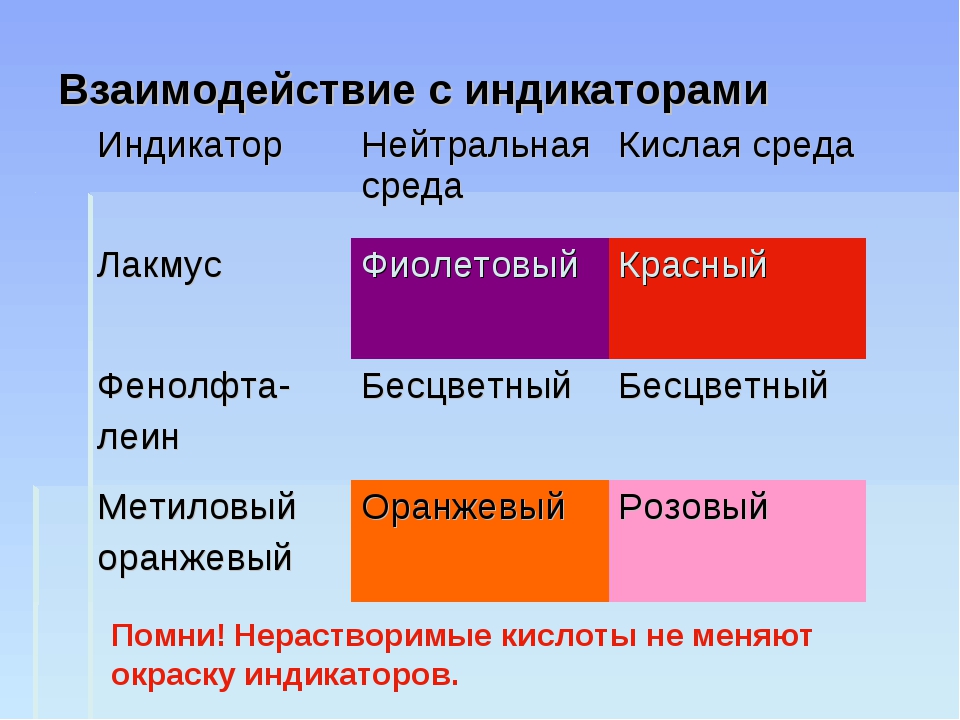 [c.341]
[c.341]
Принцип метода. / 1етод основан на способности кислотно-ще-лочных индикаторов изменять окраску в зависимости от pH среды. При использовании смешанного индикатора окраска изменяется от желто-оранжевого цвета нейтрального раствора до зеленого с переходом при сильнощелочной среде в фиолетовую. Чувствительность метода 0,16 мг/м NaOH в 5 мл. [c.292]
Методы определения. В воздухе. Определение аэрозоля едких щелочей основано на способности кислотно-основных индикаторов изменять окраску в зависимости от pH среды. При использовании денситометрического метода чувствительность 4 мкг в анализируемом объеме раствора [46], колориметрических методов—1 мкг на 5 мл пробы (Демченко, Гузь Виль-нер). Определение хлорита Н. иодометрическим методом с чувствительностью 0,08 мг/м [31]. В природных водах определение Н. ионной хроматографией предел определения 0,05 мг/л (Basta, Tabatabai). В промышленных и бытовых сточных водах. Определение Н. методом пламенно-эмиссионной спектрометрии с чувствительностью менее 0,1 мг/л или посредством гравиметрического метода с осажде- [c. 41]
41]
Экспрессные косвенные методы, предназначенные для периодического производственного контроля микропора-женкя СОЖ, основаны на способности некоторых индикаторов изменять окраску жидкости в зависимости от ферментативной активности микроорганизмов. Применяются индикаторы двух типов химические и бактериологические. [c.169]
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ИНДИКАТОРЫ, вещества, способные изменять окраску в зависимости от окисл.-восстановит, потенциала р-ра. Прпмен. для установления конечной точки окисл.-восстановит, титрования 11 для колориметрич. определения о кис л.-восстановит, потенциала (преим. в биологии). Такими индикаторами служат, как иравило, в-ва, к-рые сами подвергаются окисл. или восст., причем окисленная (1иох) и восстановленная (iHRed) формы имеют разные окраски. [c.398]
Индикаторами называются вещества, которые способны изменять свою окраску в зависимости от активности или от концентрации водородных ионов 6 растворе. Многие индикаторы используютбя при титровании кислот оделочами или наоборот, но очень немногие индикаторы изменяют окраску вблизй точки нейтрализации, т. е. [c.458]
Многие индикаторы используютбя при титровании кислот оделочами или наоборот, но очень немногие индикаторы изменяют окраску вблизй точки нейтрализации, т. е. [c.458]
Существуют различные методы определения активности ионов водорода. Одним из простейших является метод с использованием веществ, называемых индикаторами, которые способны при определенных условиях изменять окраску в зависимости от pH раствора. Чаще всего применяются кислотно-основные индикато-)ы. Условимся всякую индикаторную кислоту обозначать через iind, а ионы ее — через Ind-. Тогда, например, для диссоциации такого индикатора, как лакмус, можно написать [c.297]
Определение общей жесткости воды. Кош1лек-сометрическое определение суммы кальция и магния производится в присутствии индикатора азокрасителя эриохромовый черный Т или хромогеновый черный ЕТ. Водные растворы этого соединения обладают способностью изменять окраску в зависимости от pH. В кислой среде с Н 6 раствор окрашен в красный цвет, при pH = = 7—11 в синий, а при pH > 11,5 в оранжевый.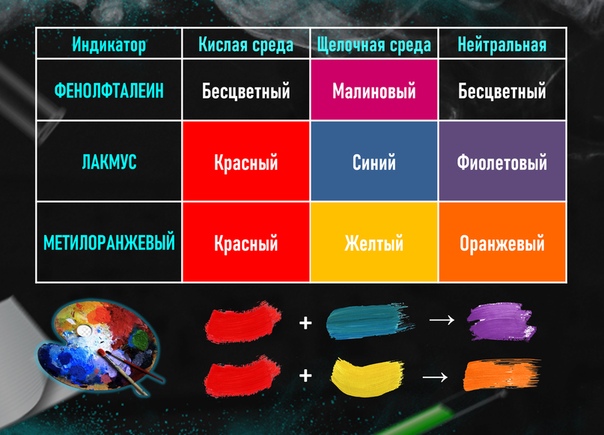 Резкий переход цветов синего в красный наблюдается при pH 10 и достигается добавлением к испытуемому раствору аммиачной буферной смеси. [c.323]
Резкий переход цветов синего в красный наблюдается при pH 10 и достигается добавлением к испытуемому раствору аммиачной буферной смеси. [c.323]
КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ (рН-ииди каторы), вещества, способные изменять окраску или люминесценцию в зависимости от pH среды. Примен. для уста новления конца р-ции между к-тами и основаниями (гл. обр. при кислотно-основном титровании) или др. р-ций, если в них участвуют ионы Н , а также для колориметрич. определения pH р-ров. Равновесие в водном р-ре К.-о. и. можно представить в виде 1п -Н Н2О 1пь -1- НзО- -, где 1пя и 1пб — соотв. кислая и основная формы, к-рые у цветного индикатора окрашены различно. Константа равновесия этого процесса наз. константой индикатора Kta- [c.257]
В качестве окислительно-восстановительных индикаторов могут применяться органические вещества, которые изменяют окраску (или по-разному флуоресцируют) в зависимости от окислительно-восстановительного потенциала (ОВ-потенциала) системы. В дополнение к использованию этих индикаторов конечную точку титрования можно установить с помощью подходящей цветной реакции, позволяющей обнаружить одно из соединений, принимающих участие в определении [например, раствор крахмала, применяющийся в иодометрии тиоцианат, используемый при титанометрическом определении железа(III), и т. д.]. [c.343]
В дополнение к использованию этих индикаторов конечную точку титрования можно установить с помощью подходящей цветной реакции, позволяющей обнаружить одно из соединений, принимающих участие в определении [например, раствор крахмала, применяющийся в иодометрии тиоцианат, используемый при титанометрическом определении железа(III), и т. д.]. [c.343]
Для слабых кислот, таких как соляная, зависимость между концентрациями индикатора и кислоты более сложная и подробно она не будет здесь рассматриваться. Однако следует все же указать, что окраска изменяется в зависимости от концентрации аниона. Так, повышение концентрации хлорид-иона ведет к подавлению диссоциации индикаторной соли 1пН+С1 и соот-ветствуюшему уменьшению отношения Е[1пН+]/[1п]. Однако если концентрация хлорид-иона превысит какую-то определенную величину, то образуются ионные агрегаты более высоких порядков, например СЬ1пН+С1 , и окраска снова сдвигается в сторону кислой формы. [c.98]
Окраска индикатора изменяется под влиянием изменения концентрации ионов Н в растворе.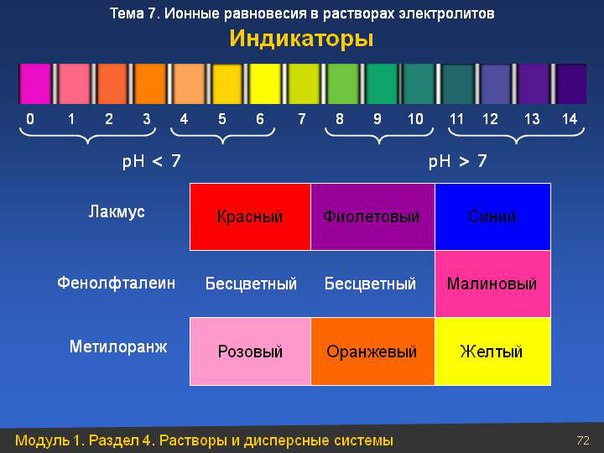 Индикатор постепенно ме няет свою окраску в определенном интервале значений pH, ко торый называется областью перехода индикатора. Каждый ин дикатор имеет особую, характерную для него область перехо да. При значениях pH, лежащих внутри области перехода, ок раска индикатора получается смещанная, приближаясь по от тенку либо к цвету индикатора в сильнокислой среде, либо ь его цвету б сильнощелочной среде в зависимости ог pH расгвора, Области перехода индикаторов (в единицах pH) см. в При ло кепии, табл. 9. [c.94]
Индикатор постепенно ме няет свою окраску в определенном интервале значений pH, ко торый называется областью перехода индикатора. Каждый ин дикатор имеет особую, характерную для него область перехо да. При значениях pH, лежащих внутри области перехода, ок раска индикатора получается смещанная, приближаясь по от тенку либо к цвету индикатора в сильнокислой среде, либо ь его цвету б сильнощелочной среде в зависимости ог pH расгвора, Области перехода индикаторов (в единицах pH) см. в При ло кепии, табл. 9. [c.94]
Аурин относится к кислым трифенилметановым красителям и, пвдобно другим веществам этого типа, окраска его изменяется в зависимости от кислотности среды аурин иногда применяется в качестве индикатора при ацидиметри-ческом титровании. [c.299]
Шндикатлром вообще называют такое вещество, которое дает указание относительно какого-нибудь исследуемого явления, в частнос ги указывает концентрацию водородных ионов в растворе. Индикаторный метод определения концентрации водородных ионов основан на том, что к испытуемому раствору добавляют какое-нибудь органическое красящее вещество, окраска которого изменяется в зависимости от концентрации водородных ионов. Сравнением цвета испытуемой жидкости, содержащей индикатор, с цветом контрольного раствора с тем же индикатором, но с известной концентрацией водородных ионов, удается определить концентрацию водородных ионов в испытуемой жидкости при помощи обычных колориметрических приемов. См. также гл. 18. [c.102]
Сравнением цвета испытуемой жидкости, содержащей индикатор, с цветом контрольного раствора с тем же индикатором, но с известной концентрацией водородных ионов, удается определить концентрацию водородных ионов в испытуемой жидкости при помощи обычных колориметрических приемов. См. также гл. 18. [c.102]
Индикаторами называются вещества, прибавляемые в небольшом количестве в анализируемый раствор и позволяющие по изменению какого-либо физического свойства титруемого раствора наблюдать конец титрования . Индикаторы нейтрализации изменяют окраску в растворе в зависимости от изменения pH среды окислительно-восстановительные индикаторы — от изменений потенциала раствора адсорбционные индикаторы — от степени электростатической адсорбции. Флуоресцентные индикаторы изменяют свою окраску при освещении титруемого раствора ультрафиолетовыми лучами и применяются как индикаторы кислотнощелочные, окислительно-восстановительные и адсорбционные. [c.424]
Существуют индикаторы, которые полностью изменяют окраску в кислой среде, как, например, метиловый оранжевый, константа диссоциации которого /Снм = и индикаторы, которые меняют окраску в щелочной среде, например фенолфталеин. Есть индикаторы, меняющие окраску в нейтральной среде, например бром-тимоловый синий, у которого константа диссоциации Кнт = 10 . Таким образом, по величине константы диссоциации индикатора сразу же можно приблизительно определить середину интервала изменения его окраски, так называемый показатель титрования рТ. Например,для метилового оранжевого этот показатель рТ = 4, для фенолфталеина рТ = 9, для бром-ти-молового синего рТ = 7. Соответствующие интервалы изменения окраски индикатора для метилового оранжевого pH = 3,1—4,4, для бром-тимолового синего pH = 6,0—7,6, для фенолфталеина pH =8,0—10,0, в зависимости от различной интенсивности окраски недиссоциированных молекул и ионов и различной восприимчивости глаза к разным цветам, хотя теоретически каждый из этих интервалов должен равняться двум единицам. [c.428]
Есть индикаторы, меняющие окраску в нейтральной среде, например бром-тимоловый синий, у которого константа диссоциации Кнт = 10 . Таким образом, по величине константы диссоциации индикатора сразу же можно приблизительно определить середину интервала изменения его окраски, так называемый показатель титрования рТ. Например,для метилового оранжевого этот показатель рТ = 4, для фенолфталеина рТ = 9, для бром-ти-молового синего рТ = 7. Соответствующие интервалы изменения окраски индикатора для метилового оранжевого pH = 3,1—4,4, для бром-тимолового синего pH = 6,0—7,6, для фенолфталеина pH =8,0—10,0, в зависимости от различной интенсивности окраски недиссоциированных молекул и ионов и различной восприимчивости глаза к разным цветам, хотя теоретически каждый из этих интервалов должен равняться двум единицам. [c.428]
| | Навигация по справочнику TehTab.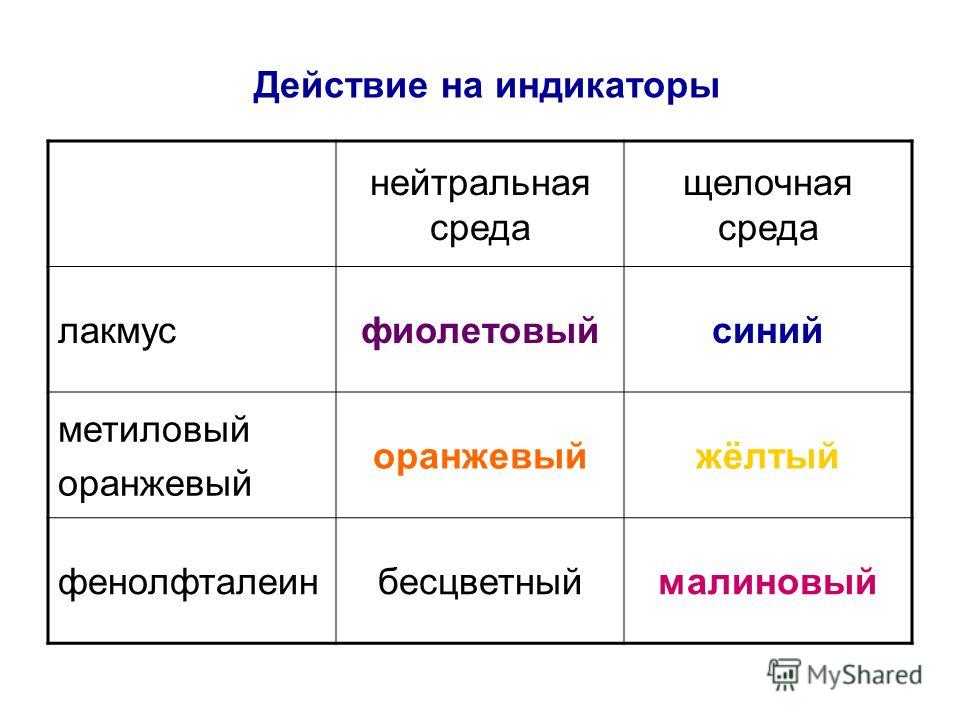 ru: главная страница / / Техническая информация / / Химический справочник / / Водородный показатель pH. Таблицы показателей pH. / / Изменение окраски простейших кислотно-основных индикаторов в зависимости от pH раствора. Лакмус, фенолфтолеин, метилоранж. ru: главная страница / / Техническая информация / / Химический справочник / / Водородный показатель pH. Таблицы показателей pH. / / Изменение окраски простейших кислотно-основных индикаторов в зависимости от pH раствора. Лакмус, фенолфтолеин, метилоранж.
| ||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | |||||||||||||||||||||||||
| TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||||||||||||
Индикаторы. Кислотно-основные индикаторы. Изменение окраски в зависимости от рН (кислотности среды)
Изменение окраски индикаторов в зависимости от pH
Кислотно-основные индикаторы — это соединения, окраска которых меняется в зависимости от кислотности среды.
Например, лакмус в кислой среде окрашен в красный цвет, а в щелочной — в синий. Это свойство можно использовать для быстрой оценки pH растворов.
Кислотно-основные индикаторы находят широкое применение в химии. Известно, например, что многие реакции по-разному протекают в кислой и щелочной средах. Регулируя pH, можно изменить направление реакции. Индикаторы можно использовать не только для качественной, но и для количественной оценки содержания кислоты в растворе (метод кислотно-основного титрования).
Применение индикаторов не ограничивается «чистой» химией. Кислотность среды необходимо контролировать во многих производственных процессах, при оценке качества пищевых продуктов, в медицине и т. д.
В таблице 1 указаны наиболее «популярные» индикаторы и отмечена их окраска в нейтральной, кислой и щелочной средах.
Таблица 1
| Кислая среда | Нейтральная среда | Щелочная среда | |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Лакмус
Метилоранж
Фенолфталеин
В действительности, каждый индикатор характеризуется своим интервалом рН, в котором происходит изменение цвета (интервал перехода). Изменение окраски происходит из-за превращения одной формы индикатора (молекулярной) в другую (ионную). По мере понижения кислотности среды (с ростом рН) концентрация ионной формы повышается, а молекулярной — падает. В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
Изменение окраски происходит из-за превращения одной формы индикатора (молекулярной) в другую (ионную). По мере понижения кислотности среды (с ростом рН) концентрация ионной формы повышается, а молекулярной — падает. В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
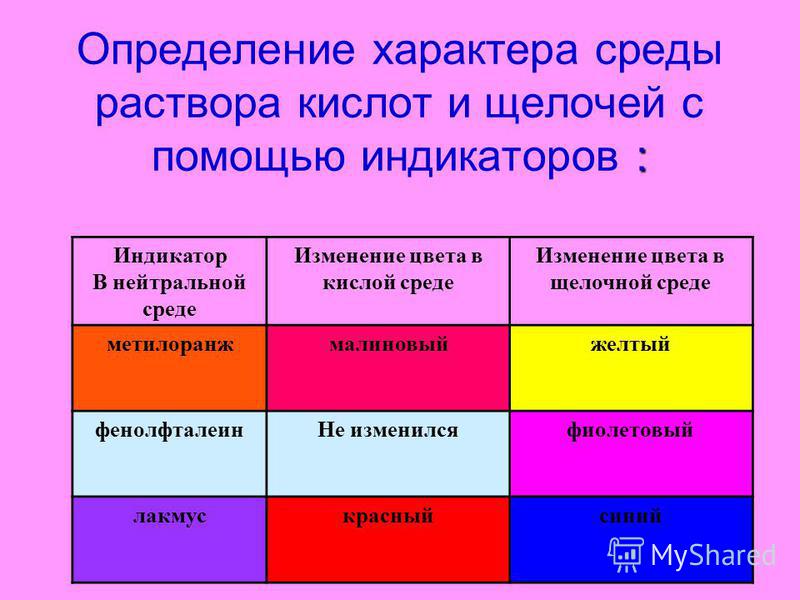
| Название индикатора | Цвет в кислой среде | Интервал перехода (pH) | Цвет в щелочной среде |
| Метиловый оранжевый | Красный | 3 — 5 | Желтый |
| Метиловый красный | Красный | 4-6 | Желтый |
| Бромкрезоловый пурпурный | Желтый | 5,5 — 7,5 | Фиолетовый |
| Феноловый красный | Желтый | 7-9 | Красный |
| Фенолфталеин | Бесцветный | 8-10 | Малиновый |
Значение слова «ла́кмус»
а, м.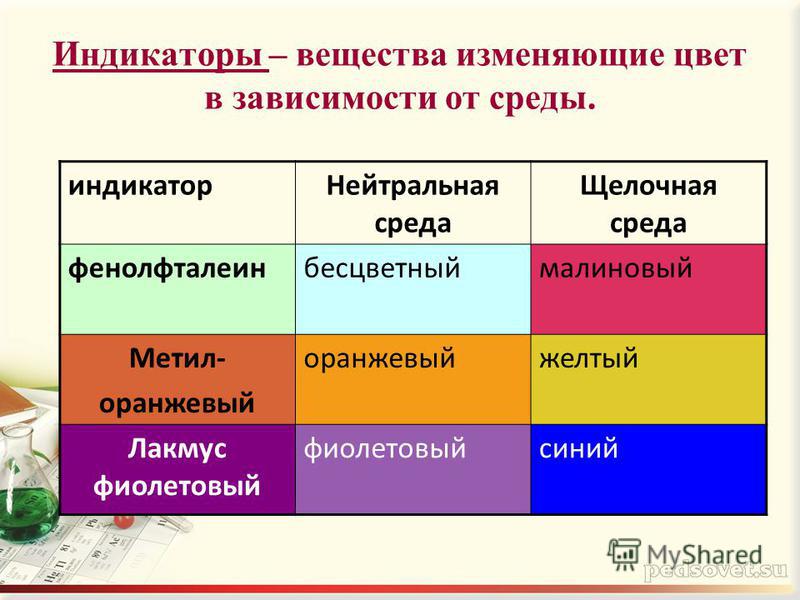
[Lackmus, голл. lakmoes]
1. Хим.Красящее вещество, добываемое из некоторых видов лишайников, применяемое как индикатор для определения реакции среды: в кислой среде окрашивается в красный цвет, в щелочной — в синий, в нейтральной не изменяет окраски.
Водный раствор лакмуса.
2. Хим.То же, что лакмусовая бумага.
Опустить лакмус в раствор щелочи. Лакмус покраснел в ходе реакции.
Данные других словарей
| Большой толковый словарь русского языка Под ред. С. А. Кузнецова | ла́кмус-а; м. [голл. lakmoes] 1. Красящее вещество, добываемое из морских лишайников, меняющее цвет под действием кислот на красный, под действием щелочей — на синий. 2. Фильтровальная бумага, пропитанная раствором лакмуса, употребляемая как реактив на щёлочи и на кислоты; лакмусовая бумага. Ла́кмусовая бумага (бумажка).Способ, с помощью которого можно безошибочно проверить кого-, что‑л.-ая, -ое. Л-ые краски. Л-ая настойка. | |
| Толковый словарь иноязычных слов Л. П. Крысин | ла́кмуса, м. [нидерл. lakmoes 1. Хим. Красящее вещество, применяемое в лабораторной практике как индикатор (во 2-м знач.). —Водный раствор лакмуса (фиолетового цвета) от действия щелочей синеет, от действия кислот краснеет. — относящийся к лакмусу. Лакмусовая бумажка —1) бумажка, пропитанная раствором лакмуса; 2) перен. о том, с помощью чего можно безошибочно проверить кого-что-н.Ср. метилоранж. |
Лакмус — Энциклопедия по машиностроению XXL
Качественная реакция на щелочи и щелочные соли — окрашивание раствора их индикатором — фенолфталеином в малиново-красный цвет. Лакмус от щелочей окрашивается в синий цвет, метилоранж — в желтый. [c.96]Лакмус употребляют обычно в виде реактивной бумаги, пропитанной раствором этого индикатора. От щелочей и щелочных солей он окрашивается в синий цвет, от кислот — в красный, в нейтральной среде — в фиолетовый.
[c.156]
От щелочей и щелочных солей он окрашивается в синий цвет, от кислот — в красный, в нейтральной среде — в фиолетовый.
[c.156]
Ремонтируемую поверхность тщательно очищают песком из пескоструйного аппарата, промывают струей воды под давлением и продувают сжатым воздухом. При другом способе поверхность очищают, поливают 25—30%-ным раствором соляной кислоты (0,4—0,5 л/м ) и растирают жесткими щетками. С исчезновением пены покрытие тщательно промывают струей воды под давлением для получения нейтральной реакции по лакмусу и продувают для высушивания сжатым воздухом. [c.178]
Как щелочи, так и кислоты способны действовать на некоторые краски, изменяя их цвет. Так, например, краска лакмус в щелочной среде принимает синий цвет, а в кислой — красный. Этим пользуются при установлении реакции среды. Растворы веществ, не действующие на лакмус, называются нейтральными. В них лакмус имеет фиолетовый цвет.
 [c.21]
[c.21]В чем заключается сущность способа определения реакции среды помощью лакмуса [c.23]
Нейтрализация полученного раствора производится 25 %-ным аммиаком до нейтральной реакции на лакмус. На Московском альбуминном заводе в настоящее время употребляется нижеследующая рецептура ра- [c.321]
Растворимые в воде кислоты распознаются индик ато рами — веществами, изменяющими свою окраску под действием кислот и щелочей. Так, например, фиолетовый лакмус в растворах щелочей окрашивается в синий, а в растворах кислот — в красный цвет. [c.358]
Индикаторами служат лакмус, фенолфталеин и. метилоранж. [c.184]
Патока кормовая (мелясса). Сухие вещества —не менее 75о/о зола — не более 10% удельный вес — не менее 1,3, реакция (проба на лакмус) — щелочная прочность на разрыв в смеси с песком (технологическая проба) — не менее 3 кг/см . [c.93]
При нейтрализации щелочей кислотами в качестве индикаторов применяют фенолфталеин и метилоранж, изменение окраски которых указывает на коввц реакции. При изменении реакции растворов на нейтральную и кислую, фенолфталеин обесцвечивается, лакмус изменяет оттенок из синего в фиолетовый, а метилоранж переходит из желтого в оранжевый при нейтральной реакции и в розовый — в случае кислой реакции.
[c.96]
При изменении реакции растворов на нейтральную и кислую, фенолфталеин обесцвечивается, лакмус изменяет оттенок из синего в фиолетовый, а метилоранж переходит из желтого в оранжевый при нейтральной реакции и в розовый — в случае кислой реакции.
[c.96]
Реакция растворов различных соединений (щелочная, кислая, нейтральная) определяются с помощью индикаторов. Для химических анализов применяют следующие индикаторы, которые изменяют свой цвет при изменении реакции фенолфталеин, лакмус, метилоранж, конгокрасный, метилрот и др. Чаще всего применяют первые три индикатора. [c.155]
Полученный раствор нейтрализуют по лакмусу 25%-ным ЫН40Н и в случае необходимости фильтруют. Содержимое раствора соответствует железо-аммиачному оксалату и представляет собой концентрат ванны крашения. [c.43]
Питательная вода для паровых котлов должна на лакмусо вую бумажку давать щелочную реакцию, содержать мало твердых V газообразных веществ. Она должна давать лишь незначительные отложения на С енках котла и практически не содержать масла I жиров. Вода должна мало содержать нитратов, кремневой кислоты хлористой магнезии и гипса. Особенно вреден гипс. При 15° в 1 у
[c.1260]
Она должна давать лишь незначительные отложения на С енках котла и практически не содержать масла I жиров. Вода должна мало содержать нитратов, кремневой кислоты хлористой магнезии и гипса. Особенно вреден гипс. При 15° в 1 у
[c.1260]
Неорганические О. — окиси и гидраты окисей (гидроокиси) металлов—характеризуются особыми, т. н. основными свойствами они растворимы в кислотах растворимые в воде О. (щелочи) отличаются щелочным (мыльным) вкусом, окрашивают красный лакмус в синий цвет, бесцветный фенолфталеин— в малиновокрасный и метилоранж— в желтый (см. Индикаторы в химии). Типичными, сильными основаниями являются гидроокиси щелочных и щелочноземельных металлов, О. средней силы—гидроокиси аммония и магния, окись серебра слабые О.—гидроокиси тяжелых металлов. [c.132]
Интенсивная сладость С. обусловливается исключительно его анионом, поэтому она зависит от концентрации (разведения).
 Для обычных концентраций принято считать С. в 550 раз слаще сахара. В виду малой растворимости С. чаще применяется его натриевая соль. Для получения последней нейтрализуют (на лакмус) С. раствором соды, упаривают и подвергают медленной кристаллизации прозрачные кристаллы соли отфуговывают и высушивают. Обычно для продажи С. таблетируют в сдхеси с двууглекислой содой.
[c.73]
Для обычных концентраций принято считать С. в 550 раз слаще сахара. В виду малой растворимости С. чаще применяется его натриевая соль. Для получения последней нейтрализуют (на лакмус) С. раствором соды, упаривают и подвергают медленной кристаллизации прозрачные кристаллы соли отфуговывают и высушивают. Обычно для продажи С. таблетируют в сдхеси с двууглекислой содой.
[c.73]СЕРОВОДОРОД, HgS, при комнатной бесцветный газ, неприятно пахнущий (запах тухлых яиц). Плотность по воздуху Л = 1,1906 вес 1 л (при 0°, 760 мм) 1,5392 г теплопроводность (приО°) 3,045 10 al /слгск. °С. Вязкость (при O «) 1154-пуаза уд. теплоемкость (11- 20°) 0,24318 al/г. С. диамагнитен магнитная проницаемость /г = 0,034- 10 В присутствии воды С. окрашивает лакмус в красный цвет. С. легко сжижается (при обыкновенной Г под давлением 17 atm) в бесцветную жидкость приторно-слад-коватого вкуса с УД- жидкого [c.320]
Тосле щелочной обработки поверхность металла следует промыть 2—3 раза горячей водой (проба на фенолфталеин или лакмус), а затем тщательно вытереть аппарат тряпками и возможно быстрее высушить. [c.538]
[c.538]
Константа диссоциации К. зависит только от t°, причем это влияние для различных К. выражается различным образом. Так, при 0° кремневая к-та, HjSiOg, является более сильной К., чем вода, а при 300° вода сильнее кремневой К. Для качественного открытия К. пользуются индикаторами (см. Индикаторы в х и м и и)—красителями, обладающими способностью менять свою окраску при достижении определенной концентрации ионов водорода в растворе. Напр, водные растворы лакмуса в присутствии свободных К. окрашиваются в красный цвет, красные (щелочные) растворы фенолфталеина и желтые и-нитрофенола становятся бесцветными, желтые растворы метилрота и метилоранжа окрашиваются соответственно в красный и розовый цвета, а красный конго (от сильных К.)—в синий. [c.133]
Испытание К. состоит прежде всего в осмотре, к-рым устанавливается относительное содержание более ценного hondrus ris-pus и присутствие иных водорослей и мшанко-вых налетов. Отбелка сернистой кислотой, вообще понижающая ценность товара и недопустимая при изготовлении медицинского карагена, узнается по отсутствию кислой реакции (на лакмус) слизи (1 ч.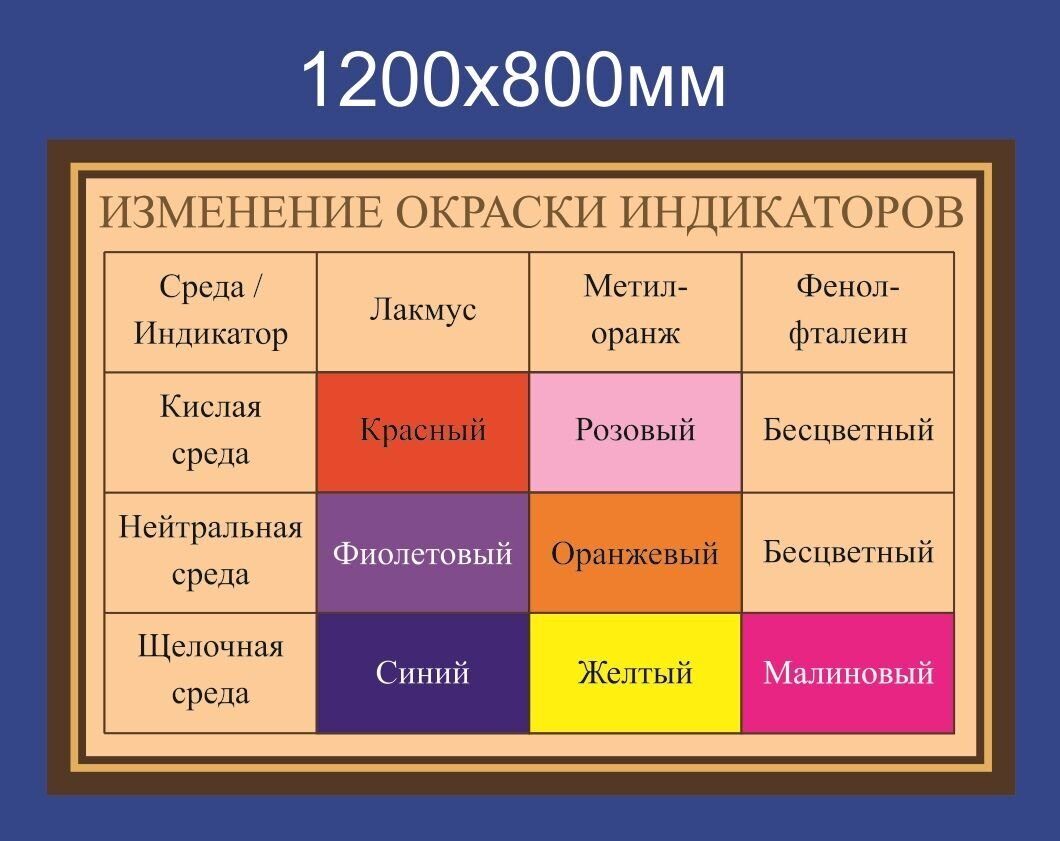 К. на 30 ч. воды) эта же слизь не должна окрашиваться иодом в синий цвет.
[c.481]
К. на 30 ч. воды) эта же слизь не должна окрашиваться иодом в синий цвет.
[c.481]
Висмутовая белая Растворяется в избытке азотной кислоты 1 Не растворима Из кислого раствора — желтый осадок, переходящий вчер-ный Дает красно-i коричневый j дым, окра-1 шинающий 1 лакмус, бу- магу в красный цвет [c.183]
При окислении в присутствии Са(ОН)а и аммиака эти продукты, переходя через орсин, дают красители неизвестного строения, содержащие азот. Главным из них является орсейль, широко применявшийся в средние века для окраски шелка в красный цвет. 1)0лее длительная обработка вышеприведенных продуктов приводит к лакмусу (см.), применяемому гл. обр. в качестве индикатора. Строение лакмуса также неизвестно. [c.200]
Посла рафинирования сыворотки и отстоя в течение 1—2 суток сыворотку декантируют в отдельный сборник и перед заливкой на тазики сушилок нейтрализуют (на лакмус) 25%-ным аммиаком. Для белковых раство-рэв нейтрализация на лакмус неточна и ее следует производить по концентрации водородных ионов электрометрическим или колориметрическим путем. На практикеоднако часто производят определение нейтрализации по лакмусовой бумажке до наступления нейтральной реакции или внесением эквивалентного количества щелочи, которое по расчету должно нейтрализовать кислотность сыворотки, обработанной при рафинировании кислотами. Осадок в светлой сыво-ротке на практике получался около 1—1,3% от веса светлой сыворотки. Этот осадок пока применения не нашел. Б.Щелочной способ обработки сыворотки состоит в обработке светлой сыворотки растворами щелочей, причем последующая нейтрализация производится какой-либо слабой к-той. Приготовление щелочного р аств о ра а) 8%-ный раствор NaOH (доза рецептуры на 1 кг свежей сыворотки прибавляют 20 8 раствора, тщательно перемешивают и затем отстаивают 6—8 ч. в закрытом чане), б) Раствор перекиси водорода 1 кг пергидроля (33,5%-ная Н О ) растворяют в
[c.322]
На практикеоднако часто производят определение нейтрализации по лакмусовой бумажке до наступления нейтральной реакции или внесением эквивалентного количества щелочи, которое по расчету должно нейтрализовать кислотность сыворотки, обработанной при рафинировании кислотами. Осадок в светлой сыво-ротке на практике получался около 1—1,3% от веса светлой сыворотки. Этот осадок пока применения не нашел. Б.Щелочной способ обработки сыворотки состоит в обработке светлой сыворотки растворами щелочей, причем последующая нейтрализация производится какой-либо слабой к-той. Приготовление щелочного р аств о ра а) 8%-ный раствор NaOH (доза рецептуры на 1 кг свежей сыворотки прибавляют 20 8 раствора, тщательно перемешивают и затем отстаивают 6—8 ч. в закрытом чане), б) Раствор перекиси водорода 1 кг пергидроля (33,5%-ная Н О ) растворяют в
[c.322]
Количество аммиака должно задаваться точно по норме, определенной электрометрически или грубо—по химическому эквивалентному расчету на нейтрализацию. Лакмус в качестве индикатора здесь непригоден, так как сыворотка окрашена в темнокрасный цвет. Осадка получается от 1 до 1,5% от веса черной сыворотки. Порядок задавания химич. веществ следующий 1) добавка уксусной кислоты, 8) помешивание, 3) задавание скипидара, 4) помешивание около получаса, 5) отстаивание в течение 24 часов.
[c.322]
Лакмус в качестве индикатора здесь непригоден, так как сыворотка окрашена в темнокрасный цвет. Осадка получается от 1 до 1,5% от веса черной сыворотки. Порядок задавания химич. веществ следующий 1) добавка уксусной кислоты, 8) помешивание, 3) задавание скипидара, 4) помешивание около получаса, 5) отстаивание в течение 24 часов.
[c.322]
ЛАКМУС, широко применяемый химич. индикатор, красящее вещество естественного происхождения, получаемое путем длительной обработки лишайников Ro ella или Le anora водным раствором аммиака и угле- [c.382]
Белый кристаллический порошок беа запаха, горьковатого В1суса с 191°. Растворяется в 145 ч. холодной и 12 ч. кипящей воды. Легко растворим в эфире, ацетоне, горячем спирте, водных щелочах. ] одный раствор В. имеет на лакмус слабокислую реакцию. Является самым распространенным снотворным средством. Исходным материалом для приготовления В. обычно служит малоновый эфир, к-рый с алкоголятом натрия и бромистым этилом дает диэтилмалоновый эфир
[c. 293]
293]
Непосредственно на месте также определяются 1) Реакция на лакмус и ринндикато-рами. 2) Содержание азотистой к-ты, для чего 10 см воды с 0,5 см реактива Гриса нагревают в течение 5 мин. до 70—80° на свечке и затем наблюдают полученное окрашивание (табл. 6). [c.445]
Если в электролите присутствовали соли железа и алюминия, то из полученного раствора их осаждают добавлением аммиака до щелочной реакции по лакмусу. Осадок отфильтровывается, промывается и анализируется затем, каж указано выше, на содержание железа и алюминия. Фильтрат же подкислшот соляной кислотой, и цинк определяют объемным методом, титруя раствором K4Fe( N)e (см. выше). [c.183]
Что такое кислотный индикатор. Индикаторы
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом среды или за протеканием химической реакции. Одни из самых распространенных – кислотно-основные индикаторы, которые изменяют цвет в зависимости от кислотности раствора. Происходит это потому, что в кислой и щелочной среде молекулы индикатора имеют разное строение. Примером может служить распространенный индикатор фенолфталеин, который раньше использовали также в качестве слабительного средства под названием пурген. В кислой среде это соединение находится в виде недиссоциированных молекул, и раствор бесцветен, а в щелочной – в виде однозарядных анионов, и раствор имеет малиновый цвет (см . ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ). Однако в сильнощелочной среде фенолфталеин снова обесцвечивается! Происходит это из-за образования еще одной бесцветной формы индикатора – в виде трехзарядного аниона. Наконец, в среде концентрированной серной кислоты снова появляется красная окраска, хотя и не такая интенсивная. Ее виновник – катион фенолфталеина. Этот малоизвестный факт может привести к ошибке при определении реакции среды.
Происходит это потому, что в кислой и щелочной среде молекулы индикатора имеют разное строение. Примером может служить распространенный индикатор фенолфталеин, который раньше использовали также в качестве слабительного средства под названием пурген. В кислой среде это соединение находится в виде недиссоциированных молекул, и раствор бесцветен, а в щелочной – в виде однозарядных анионов, и раствор имеет малиновый цвет (см . ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ). Однако в сильнощелочной среде фенолфталеин снова обесцвечивается! Происходит это из-за образования еще одной бесцветной формы индикатора – в виде трехзарядного аниона. Наконец, в среде концентрированной серной кислоты снова появляется красная окраска, хотя и не такая интенсивная. Ее виновник – катион фенолфталеина. Этот малоизвестный факт может привести к ошибке при определении реакции среды.
Кислотно-щелочные индикаторы весьма разнообразны; многие из них легко доступны и потому известны не одно столетие. Это отвары или экстракты окрашенных цветов, ягод и плодов. Так, отвар ириса, анютиных глазок, тюльпанов , черники, ежевики, малины, черной смородины, красной капусты, свеклы и других растений становится красным в кислой среде и зелено-голубым – в щелочной. Это легко заметить, если помыть кастрюлю с остатками борща мыльной (т.е. щелочной) водой. С помощью кислого раствора (уксус) и щелочного (питьевая, а лучше – стиральная сода) можно также сделать надписи на лепестках различных цветов красного или синего цвета.
Так, отвар ириса, анютиных глазок, тюльпанов , черники, ежевики, малины, черной смородины, красной капусты, свеклы и других растений становится красным в кислой среде и зелено-голубым – в щелочной. Это легко заметить, если помыть кастрюлю с остатками борща мыльной (т.е. щелочной) водой. С помощью кислого раствора (уксус) и щелочного (питьевая, а лучше – стиральная сода) можно также сделать надписи на лепестках различных цветов красного или синего цвета.
Обычный чай – тоже индикатор. Если в стакан с крепким чаем капнуть лимонный сок или растворить несколько кристалликов лимонной кислоты, то чай сразу станет светлее. Если же растворить в чае питьевую соду, раствор потемнеет (пить такой чай, конечно, не следует). Чай же из цветков («каркаде») дает намного более яркие цвета.
Вероятно, самый старый кислотно-основной индикатор – лакмус. Еще в 1640 ботаники описали гелиотроп (Heliotropium Turnesole) – душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество.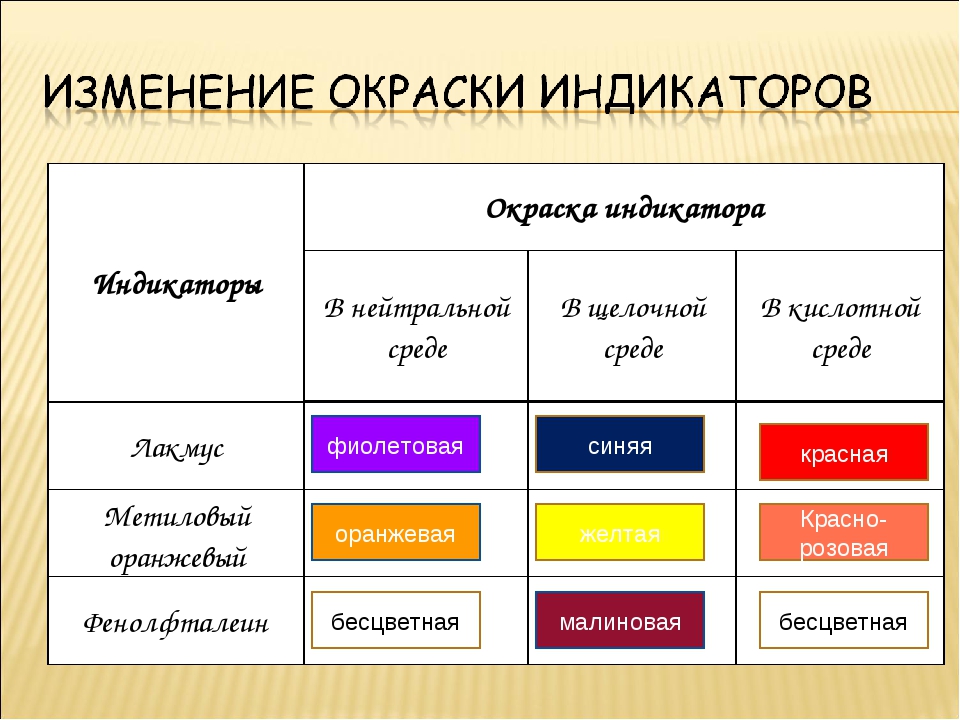 Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной – синим. Об этом можно прочитать в трудах знаменитого физика и химика XVII века Роберта Бойля. Вначале с помощью нового индикатора исследовали минеральные воды, а примерно с 1670 года его начали использовать в химических опытах. «Как только вношу незначительно малое количество кислоты, – писал в 1694 французский химик Пьер Поме о „турнесоле», – он становится красным, поэтому если кто хочет узнать, содержится ли в чем-нибудь кислота, его можно использовать». В 1704 немецкий ученый М.Валентин назвал эту краску лакмусом; это слово и осталось во всех европейских языках, кроме французского; по-французски лакмус – tournesol, что дословно означает «поворачивающийся за солнцем». Так же французы называют и подсолнечник; кстати, «гелиотроп» означает то же самое, только по-гречески. Вскоре оказалось, что лакмус можно добывать и из более дешевого сырья, например, из некоторых видов лишайников.
Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной – синим. Об этом можно прочитать в трудах знаменитого физика и химика XVII века Роберта Бойля. Вначале с помощью нового индикатора исследовали минеральные воды, а примерно с 1670 года его начали использовать в химических опытах. «Как только вношу незначительно малое количество кислоты, – писал в 1694 французский химик Пьер Поме о „турнесоле», – он становится красным, поэтому если кто хочет узнать, содержится ли в чем-нибудь кислота, его можно использовать». В 1704 немецкий ученый М.Валентин назвал эту краску лакмусом; это слово и осталось во всех европейских языках, кроме французского; по-французски лакмус – tournesol, что дословно означает «поворачивающийся за солнцем». Так же французы называют и подсолнечник; кстати, «гелиотроп» означает то же самое, только по-гречески. Вскоре оказалось, что лакмус можно добывать и из более дешевого сырья, например, из некоторых видов лишайников.
К сожалению, почти у всех природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся – скисают или плесневеют (более устойчивы спиртовые растворы). Другой недостаток – слишком широкий интервал изменения цвета. При этом трудно или невозможно отличить, например, нейтральную среду от слабокислой или слабощелочную от сильнощелочной. Поэтому в химических лабораториях используют синтетические индикаторы, резко изменяющие свой цвет в достаточно узких границах рН. Таких индикаторов известно множество, и каждый из них имеет свою область применения. Например, метиловый фиолетовый изменяет окраску от желтой до зеленой в интервале рН 0,13 – 0,5; метиловый оранжевый – от красной (рН
В лабораториях нередко используются универсальные индикаторы – смесь нескольких индивидуальных индикаторов, подобранных так, что их раствор поочередно меняет окраску, проходя все цвета радуги при изменении кислотности раствора в широком диапазоне рН (например, от 1 до 11). Раствором универсального индикатора часто пропитывают полоски бумаги, которые позволяют быстро (хотя и с не очень высокой точностью) определить рН анализируемого раствора, сравнивая окраску полоски, смоченной раствором, с эталонной цветовой шкалой.
Помимо кислотно-основных, применяют и другие типы индикаторов. Так, окислительно-восстановительные индикаторы изменяют свой цвет в зависимости от того, присутствует в растворе окислитель или восстановитель. Например, окисленная форма дифениламина фиолетовая, а восстановленная – бесцветная. Некоторые окислители сами могут служить индикатором. Например, при анализе соединений железа(II) в ходе реакции
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 ? 5Fe 2 (SO 4) 3 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
добавляемый раствор перманганата обесцвечивается, пока в растворе присутствуют ионы Fe 2+ . Как только появится малейший избыток перманганата, раствор приобретает розовую окраску. По количеству израсходованного перманганата легко рассчитать содержание железа в растворе. Аналогично в многочисленных анализах с использованием метода иодометрии индикатором служит сам иод; для повышения чувствительности анализа используют крахмал, который позволяет обнаруживать малейший избыток иода.
Широкое распространение получили комплесонометрические индикаторы – вещества, образующие с ионами металлов (многие из которых бесцветны) окрашенные комплексные соединения. Примером может служить эриохром черный Т; раствор этого сложного органического соединения имеет синий цвет, а в присутствии ионов магния, кальция и некоторых других образуются комплексы, окрашенные в интенсивный винно-красный цвет. Анализ ведут так: к раствору, содержащему анализируемые катионы и индикатор, добавляют по каплям более сильный, по сравнению с индикатором, комплексообразователь, чаще всего – трилон Б. Как только трилон полностью свяжет все катионы металлов, произойдет отчетливый переход от красного цвета к синему. По количеству добавленного трилона легко вычислить содержание катионов металла в растворе.
Примером может служить эриохром черный Т; раствор этого сложного органического соединения имеет синий цвет, а в присутствии ионов магния, кальция и некоторых других образуются комплексы, окрашенные в интенсивный винно-красный цвет. Анализ ведут так: к раствору, содержащему анализируемые катионы и индикатор, добавляют по каплям более сильный, по сравнению с индикатором, комплексообразователь, чаще всего – трилон Б. Как только трилон полностью свяжет все катионы металлов, произойдет отчетливый переход от красного цвета к синему. По количеству добавленного трилона легко вычислить содержание катионов металла в растворе.
Известны и другие виды индикаторов. Например, некоторые вещества адсорбируются на поверхности осадка, изменяя его окраску; такие индикаторы называются адсорбционными. При титровании мутных или окрашенных растворов, в которых практически невозможно заметить изменение окраски обычных кислотно-основных индикаторов, используют флуоресцентные индикаторы. Они светятся (флуоресцируют) разным цветом в зависимости от рН раствора. Например, флуоресценция акридина изменяется от зеленой при рН = 4,5 до синей при рН = 5,5; при этом важно, что свечение индикатора не зависит от прозрачности и собственной окраски раствора.
Например, флуоресценция акридина изменяется от зеленой при рН = 4,5 до синей при рН = 5,5; при этом важно, что свечение индикатора не зависит от прозрачности и собственной окраски раствора.
Илья Леенсон
Вещества, изменяющие окраску при изменении реакции среды, – индикаторы – чаще всего сложные органические соединения – слабые кислоты или слабые основания. Схематично состав индикаторов можно выразить формулами НInd или IndOH, где Ind – сложный органический анион или катион индикатора.
Практически
индикаторы применяли давно, но первая
попытка в объяснении их действия была
сделана в 1894 году Оствальдом, создавшим
так называемую ионную теорию. Согласно
этой теории, недиссоциированные
молекулы индикатора и его Ind–ионы
имеют в растворе разную окраску, и
окраска раствора изменяется в зависимости
от положения равновесия диссоциации
индикатора. Например, фенолфталеин
(кислотный индикатор) имеет молекулы
бесцветные, а анионы малиновые; метилоранж
(основной индикатор) – желтые молекулы
и красные катионы.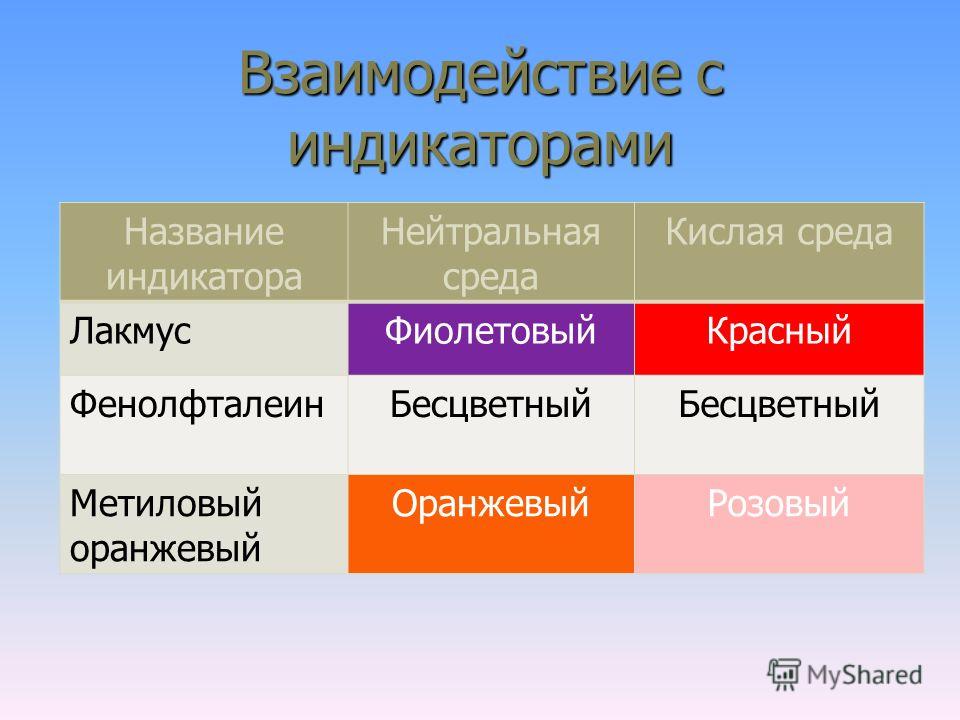
фенолфталеин метилоранж
HIndH +
+ Ind –
IndOH
Ind +
+ OH –
бесцв. малинов. желт. красн.
Изменение в соответствии с принципом Ле-Шателье приводит к смещениию равновесия вправо или влево.
Согласно хромофорной теории (Ганч), появившейся позднее, изменение окраски индикаторов связано с обратимой перегруппировкой атомов в молекуле органического соединения. Такая обратимая перегруппировка в органической химии называется таутомерией. Если в результате таутомерного изменения строения в молекуле органического соединения появляются особые группировки, называемые хромофорами, то органическое вещество приобретает окраску. Хромофорами называются группы атомов, которые содержат одну или несколько кратных связей, вызывающие избирательное поглощение электромагнитных колебаний в УФ области. В роли хромофорных групп могут выступать группировки атомов и связей, как −N=N− , =С=S , −N=О, хиноидные структуры и т.д.
Когда
таутомерное превращение ведет к изменению
строения хромофора – окраска изменяется;
если же после перегруппировки молекула
не содержит более хромофора – окраска
исчезнет.
Современные представления основывываются на ионно-хромофорной теории, согласно которой изменение окраски индикаторов обусловлено переходом из ионной формы в молекулярную, и наоборот, сопровождающегося изменением структуры индикаторов. Таким образом, один и тот же индикатор может существовать в двух формах с разным строением молекул, причем эти формы могут переходить одна в другую, и в растворе между ними устанавливается равновесие.
В качестве примера можно рассмотреть структурные изменения в молекулах типичных кислотно-основных индикаторов – фенолфталеина и метилового оранжевого под действием растворов щелочей и кислот (при различных значениях рН).
Реакция, в результате которой, благодаря таутомерной перестройке структуры молекулы фенолфталеина в ней возникает хромофорная группировка, обусловливающая появление окраски, протекает согласно следующему уравнению:
бесцветный бесцветный бесцветный
малиновый
Индикаторы,
как слабые электролиты, имеют малые
величины констант диссоциации. Например,
К д
фенолфталеина равна 2∙10 -10
и в нейтральных средах он находится
преимущественно в виде своих молекул
вследствие очень малой концентрации
ионов, почему и остается бесцветным.
При добавлении щелочи Н + -ионы
фенолфталеина связываются, «стягиваются»
с ОН – -ионами
щелочи, образуя молекулы воды, и положение
равновесия диссоциации индикатора
смещается вправо – в сторону увеличения
концентрации Ind – -ионов.
В
щелочной среде образуется двунатриевая
соль, имеющая хиноидное строение, что
вызывает окраску индикатора. Смещение
равновесия между таутомерными формами
происходит постепенно. Поэтому и цвет
индикатора изменяется не сразу, а
переходя через смешанную окраску к
цвету анионов. При
добавлении в этот же раствор кислоты
одновременно с нейтрализацией щелочи
– при достаточной концентрации Н + -ионов
– положение равновесия диссоциации
индикатора смещается влево, в сторону
моляризации, раствор снова обесцвечивается.
Например,
К д
фенолфталеина равна 2∙10 -10
и в нейтральных средах он находится
преимущественно в виде своих молекул
вследствие очень малой концентрации
ионов, почему и остается бесцветным.
При добавлении щелочи Н + -ионы
фенолфталеина связываются, «стягиваются»
с ОН – -ионами
щелочи, образуя молекулы воды, и положение
равновесия диссоциации индикатора
смещается вправо – в сторону увеличения
концентрации Ind – -ионов.
В
щелочной среде образуется двунатриевая
соль, имеющая хиноидное строение, что
вызывает окраску индикатора. Смещение
равновесия между таутомерными формами
происходит постепенно. Поэтому и цвет
индикатора изменяется не сразу, а
переходя через смешанную окраску к
цвету анионов. При
добавлении в этот же раствор кислоты
одновременно с нейтрализацией щелочи
– при достаточной концентрации Н + -ионов
– положение равновесия диссоциации
индикатора смещается влево, в сторону
моляризации, раствор снова обесцвечивается.
Аналогично
происходит изменение окраски метилоранжа:
нейтральные
молекулы метилоранжа придают раствору
желтый цвет, который в результате
протонирования переходит в красный,
соответствующий хиноидной структуре. Этот переход наблюдается в интервале
рН 4.4–3.1:
Этот переход наблюдается в интервале
рН 4.4–3.1:
желтый красный
Таким образом, окраска индикаторов зависит от рН-среды. Интенсивность окраски таких индикаторов достаточно велика и хорошо заметна даже при введении небольшого количества индикатора, не способного существенно повлиять на рН раствора.
Раствор, содержащий индикатор, непрерывно изменяет свою окраску при изменении рН. Человеческий глаз, однако, не очень чувствителен к таким изменениям. Диапазон, в котором наблюдается изменение окраски индикатора, определяется физиологическими пределами восприятия цвета человеческим глазом. При нормальном зрении глаз способен различить присутствие одной окраски в смеси ее с другой окраской только при наличии как минимум некоторой пороговой плотности первой окраски: изменение окраски индикатора воспринимается только в той области, где имеется 5-10-кратный избыток одной формы по отношению к другой. Рассматривая в качестве примера HInd и характеризуя состояние равновесия
HInd
H +
+ Ind –
соответствующей константой
,
можно написать, что индикатор проявляет свою чисто кислотную окраску, обычно улавливаемую наблюдателем, при
,
а чисто щелочную окраску при
Внутри
интервала, определяемого этими величинами,
проявляется смешанная окраска индикатора.
Таким образом, глаз наблюдателя различает изменение окраски лишь при изменении реакции среды в интервале около 2-х единиц рН. Например, у фенолфталеина этот интервал рН от 8,2 до 10,5: при рН=8,2 глаз наблюдает начало появления розовой окраски, которая все усиливается до значения рН=10,5, а при рН=10,5 усиление красной окраски уже незаметно. Этот интервал значений рН, в котором глаз различает изменение окраски индикатора, называют интервалом перехода окраски индикатора. Для метилового оранжевого К Д = 1,65·10 -4 и рК = 3,8. Это означает, что при рН = 3,8 нейтральная и диссоциированные формы находятся в равновесии в приблизительно равных концентрациях.
Указанный
диапазон рН величиной приблизительно
в 2 единицы для различных индикаторов
не приходится на одну и ту же область
шкалы рН, так как его положение зависит
от конкретного значения константы
диссоциации каждого индикатора: чем
более сильная кислота HInd , тем в более
кислой области находится интервал
перехода индикатора. В табл. 18 приведены
интервалы перехода и цвета наиболее
распространенных кислотно-основных
индикаторов.
В табл. 18 приведены
интервалы перехода и цвета наиболее
распространенных кислотно-основных
индикаторов.
Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый «Универсальный индикатор Кольтгоффа»). Полоску индикаторной бумаги обмакивают в исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH.
Таблица 18.
Интервалы перехода и окраска в различных средах
наиболее распространенных кислотно-основных индикаторов
Название | Цвет индикатора в различных средах | ||
Фенолфталеин | бесцветный | малиновый 8.0 | малиновый |
фиолетовый 5 | |||
Метиловый оранжевый | оранжевый | ||
3. | |||
Метиловый фиолетовый | фиолетовый | ||
Бромкрезоловый | |||
Бромтимоловый | |||
Тимоловый | 2,5 | ||
Существуют различные методы определения концентрации (точнее активности) ионов водорода (и, соответственно, концентрации гидроксид-ионов). Один из простейших (колориметрический) основан на использовании кислотно-основных индикаторов. В качестве таких индикаторов могут служить многие органические кислоты и основания, которые изменяют свою окраску в некотором узком интервале значений рН.
Индикаторы
представляют собой слабые кислоты или
основания, которые в недиссоциированной
и в диссоциированной (ионной) формах
имеют разную окраску.
Пример.
1.Фенолфталеин представляет собой кислоту, которая в молекулярной форме (HJnd) при рН8,1 бесцветна. Анионы фенолфталеина (Jnd -) при рН9,6 имеют красно-фиолетовую окраску:
H Jnd H + + Jnd —
Бесцветный красно-фиолетовый
рН8,1 рН9,6
При уменьшении концентрации ионов Н + и увеличении концентрации ионовOH — молекулярная форма фенолфталеина переходит в анионную из-за отрыва от молекул иона водорода и связывания его с гидроксид-ионом в воду. Поэтому при рН9,6 раствор в присутствии фенолфталеина приобретает красно-фиолетовую окраску. Наоборот, в кислотных растворах при рН8,1 равновесие смещается в сторону молекулярной формы индикатора, не имеющей окраски.
2.Метиловый оранжевый представляет собой слабое основание JndOH, которое в молекулярной форме при рН 4,4 имеет желтый цвет. Катионы Jnd + при рН3,0 окрашивают раствор в красный цвет:
JndOH Jnd + + OH —
желтый красный
рН4,4 рН3,0
Кислотной
формой индикатора
называют форму, которая преобладает в
кислотных растворах, а основной формой – ту, которая существует в основных
(щелочных) растворах. В некотором
промежутке значений рН в растворе может
одновременно находиться в равновесии
некоторое количество обеих форм
индикатора, вследствие чего возникает
переходная окраска индикатора, — это
интервал рН перехода окраски индикатора,
или просто интервал
перехода индикатора.
В некотором
промежутке значений рН в растворе может
одновременно находиться в равновесии
некоторое количество обеих форм
индикатора, вследствие чего возникает
переходная окраска индикатора, — это
интервал рН перехода окраски индикатора,
или просто интервал
перехода индикатора.
В табл.1 показаны интервалы перехода некоторых часто используемых индикаторов.
Таблица 1
Кислотно-основные индикаторы
Индикатор | Значение рН | |||||||||||||
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 | ||||||||||||||
Тимоловый синий | ||||||||||||||
Метиловый оранжевый | желто-оранжевая | |||||||||||||
Бромфеноловый синий | ||||||||||||||
Ализариновый красный | фиолетовая | |||||||||||||
Метиловый красный | ||||||||||||||
Феноловый красный | ||||||||||||||
Фенолфталеин | бесцветная | красная (розовая) | ||||||||||||
Ализариновый желтый | бледно-желтая | желто-коричн-евая | ||||||||||||
Индиго карминовый | 11,6-14,0 14- желтая | |||||||||||||
Для быстрого
определения рН удобно также пользоваться
раствором универсального индикатора,
представляющего собой смесь различных
индикаторов и имеющего большой интервал
перехода (значения рН от 1 до 10). На основе
универсального индикатора промышленностью
выпускаются специальные бумажные ленты
для определения рН у растворов путем
сравнения со специальной шкалой изменения
их окраски под действием испытуемого
раствора.
На основе
универсального индикатора промышленностью
выпускаются специальные бумажные ленты
для определения рН у растворов путем
сравнения со специальной шкалой изменения
их окраски под действием испытуемого
раствора.
В колориметрическом методе для точного определения рН применяются стандартные буферные растворы, значение водородного показателя которых точно известно и постоянно.
Буферными растворами называются смеси слабых кислот или оснований с их солями. Такие смеси сохраняют определенное значение рН как при разбавлении, так и при прибавлении небольших количеств сильных кислот или щелочей.
Изменение окраски индикаторов в зависимости от pHКислотно-основные индикаторы — это соединения, окраска которых меняется в зависимости от кислотности среды.
Например, лакмус в кислой среде окрашен в красный цвет, а в щелочной — в синий. Это свойство можно использовать для быстрой оценки pH растворов.
Кислотно-основные индикаторы находят широкое применение в химии. Известно, например, что многие реакции по-разному протекают в кислой и щелочной средах. Регулируя pH, можно изменить направление реакции. Индикаторы можно использовать не только для качественной, но и для количественной оценки содержания кислоты в растворе (метод кислотно-основного титрования).
Известно, например, что многие реакции по-разному протекают в кислой и щелочной средах. Регулируя pH, можно изменить направление реакции. Индикаторы можно использовать не только для качественной, но и для количественной оценки содержания кислоты в растворе (метод кислотно-основного титрования).
Применение индикаторов не ограничивается «чистой» химией. Кислотность среды необходимо контролировать во многих производственных процессах, при оценке качества пищевых продуктов, в медицине и т. д.
В таблице 1 указаны наиболее «популярные» индикаторы и отмечена их окраска в нейтральной, кислой и щелочной средах.
Таблица 1
Метилоранж
Фенолфталеин
В действительности, каждый индикатор характеризуется своим интервалом рН, в котором происходит изменение цвета (интервал перехода). Изменение окраски происходит из-за превращения одной формы индикатора (молекулярной) в другую (ионную). По мере понижения кислотности среды (с ростом рН) концентрация ионной формы повышается, а молекулярной — падает. В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
В кислой среде раствора рН 7. Чем меньше рН, тем больше кислотность раствора. При значениях рН > 7 говорят о щелочности раствора.
Существуют различные методы определения рН раствора. Качественно характер среды раствора определяют с помощью индикаторов. Индикаторы – вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора. На практике чаще всего применяют лакмус, метиловый оранжевый, фенолфталеин и универсальный индикатор (табл. 2).
Таблица 2
Окраска индикаторов в различных средах растворов
Водородный показатель имеет очень важное значение для медицины, его отклонение от нормальных величин даже на 0,01 единицы свидетельствует о патологических процессах в организме. При нормальной кислотности желудочный сок имеет рН = 1,7; кровь человека имеет рН = 7,4; слюна – рН = 6,9.
Реакции ионного обмена и условия их протекания
Поскольку
молекулы электролитов в растворах
распадаются на ионы, то и реакции в
растворах электролитов протекают между
ионами. Реакции
ионного обмена –
это реакции между ионами, образовавшимися
в результате диссоциации электролитов.
Сущность таких реакций заключается в
связывании ионов путем образования
слабого электролита. Другими словами,
реакция ионного обмена имеет смысл и
протекает практически до конца, если в
результате нее образуются слабые
электролиты (осадок, газ, Н 2 О
и др.). Если в растворе нет ионов, которые
могут связываться между собой с
образованием слабого электролита, то
реакция обратима; уравнения таких
реакций обмена не пишут.
Реакции
ионного обмена –
это реакции между ионами, образовавшимися
в результате диссоциации электролитов.
Сущность таких реакций заключается в
связывании ионов путем образования
слабого электролита. Другими словами,
реакция ионного обмена имеет смысл и
протекает практически до конца, если в
результате нее образуются слабые
электролиты (осадок, газ, Н 2 О
и др.). Если в растворе нет ионов, которые
могут связываться между собой с
образованием слабого электролита, то
реакция обратима; уравнения таких
реакций обмена не пишут.
При записи реакций ионного обмена используют молекулярную, полную ионную и сокращенную ионную формы. Пример записи реакции ионного обмена в трех формах:
K 2 SO 4 + BaCl 2 = BaSO 4 + 2KCl,
2K + + SO 4 2– + Ba 2+ + 2Cl – = BaSO 4 + 2K + + 2Cl – ,
Ba 2+ + SO 4 2– = BaSO 4 .
Правила составления уравнений ионных реакций
1. Формулы слабых электролитов записывают в молекулярном виде, сильных – в ионном.
2.
Для реакции берут растворы веществ,
поэтому даже малорастворимые вещества
в случае реагентов записывают в виде
ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма зарядов ионов в левой части уравнения должна быть равна сумме зарядов ионов в правой части.
Тест по теме «Теория электролитической диссоциации. Реакции ионного обмена»
1. Реакция, которая происходит при растворении гидроксида магния в серной кислоте, описывается сокращенным ионным уравнением:
а) Mg 2+ + SO 4 2– = MgSO 4 ;
б) H + + OH – = H 2 O;
в) Mg(OH) 2 + 2H + = Mg 2+ + 2H 2 O;
г) Mg(OH) 2 + SO 4 2– = MgSO 4 + 2OH – .
2. В четырех сосудах содержится по одному литру 1М растворов перечисленных ниже веществ. В каком растворе содержится больше всего ионов?
а) Сульфат калия; б) гидроксид калия;
в) фосфорная кислота; г) этиловый спирт.
3. Степень диссоциации не зависит от:
а) объема раствора; б) природы электролита;
в)
растворителя; г) концентрации.
4. Сокращенное ионное уравнение
Al 3+ + 3OH – = Al(OH) 3
соответствует взаимодействию:
а) хлорида алюминия с водой;
б) хлорида алюминия с гидроксидом калия;
в) алюминия с водой;
г) алюминия с гидроксидом калия.
5. Электролит, который не диссоциирует ступенчато, – это:
а) гидроксид магния; б) фосфорная кислота;
в) гидроксид калия; г) сульфат натрия.
6. Слабым электролитом является:
а) гидроксид бария;
б) гидроксид алюминия;
в) плавиковая кислота;
г) йодоводородная кислота.
7. Сумма коэффициентов в кратком ионном уравнении взаимодействия баритовой воды и углекислого газа равна:
а) 6; б) 4; в) 7; г) 8.
8. В растворе не могут находиться следующие пары веществ:
а) хлорид меди и гидроксид натрия;
б) хлорид калия и гидроксид натрия;
в) соляная кислота и гидроксид натрия;
г) серная кислота и хлорид бария.
9. Вещество, добавление которого к воде не изменит ее электропроводности, – это:
а) уксусная кислота; б) хлорид серебра;
в)
серная кислота; г) хлорид калия.
10. Как будет выглядеть график зависимости накала электрической лампочки, включенной в цепь, от времени, если электроды погружены в раствор известковой воды, через который длительное время пропускают углекислый газ?
а) Линейное возрастание;
б) линейное убывание;
в) сначала убывание, затем возрастание;
г) сначала возрастание, затем убывание.
Лакмусовая бумага и лакмусовая бумага
Вы можете сделать бумажные тест-полоски для определения pH водного раствора, обработав фильтровальную бумагу любым из обычных индикаторов pH. Одним из первых индикаторов, использованных для этой цели, была лакмусовая бумажка.
Лакмусовая бумага — это бумага, обработанная специальным индикатором — смесью от 10 до 15 натуральных красителей, полученных из лишайников (в основном Roccella tinctoria ), которая становится красной в ответ на кислые условия (pH 7). Когда pH нейтральный (pH = 7), краситель пурпурный.
История
Первое известное использование лакмуса было около 1300 г.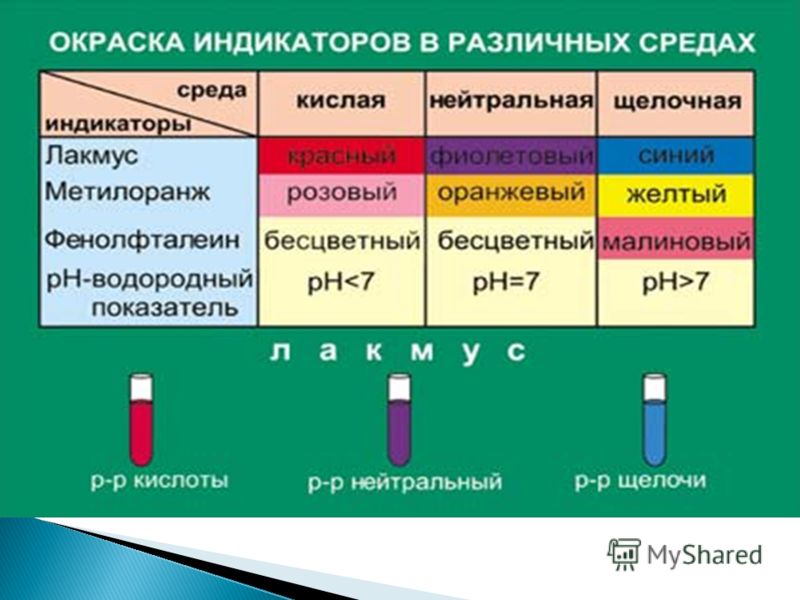 н.э. испанским алхимиком Арнальдусом де Вилья Нова. Синий краситель добывают из лишайников с 16 века. Слово «лакмус» происходит от древнескандинавского слова «краситель» или «цвет».
н.э. испанским алхимиком Арнальдусом де Вилья Нова. Синий краситель добывают из лишайников с 16 века. Слово «лакмус» происходит от древнескандинавского слова «краситель» или «цвет».
Хотя вся лакмусовая бумажка действует как pH-бумага, обратное неверно. Неверно называть всю pH-бумагу «лакмусовой бумажкой».
Быстрые факты: лакмусовая бумага
- Лакмусовая бумага — это тип pH-бумаги, который изготавливается путем обработки бумаги натуральными красителями из лишайников.
- Лакмусовая бумажка выполняется путем нанесения небольшой капли образца на цветную бумагу.
- Обычно лакмусовая бумага бывает красной или синей. Красная бумага становится синей, когда pH становится щелочным, а синяя бумага становится красной, когда pH становится кислым.
- В то время как лакмусовая бумага чаще всего используется для проверки pH жидкостей, ее также можно использовать для проверки газов, если бумага смочена дистиллированной водой перед воздействием газа.

Лакмусовый тест
Для проведения теста поместите каплю жидкого образца на небольшую полоску бумаги или окуните кусочек лакмусовой бумаги в небольшой образец образца.В идеале не окунайте лакмусовую бумагу в целую емкость с химическим веществом — краситель может загрязнить потенциально ценный образец.
Лакмусовая бумажка — это быстрый метод определения того, является ли жидкий или газообразный раствор кислотным или основным (щелочным). Тест можно проводить с использованием лакмусовой бумаги или водного раствора, содержащего лакмусовый краситель.
Изначально лакмусовая бумага бывает либо красной, либо синей. Синяя полоска меняется на красный, указывая на кислотность где-то между диапазоном pH 4.5 к 8.3. (Обратите внимание, что 8.3 — это щелочь.) Красная лакмусовая бумажка может указывать на щелочность с изменением на синий. Обычно лакмусовая бумага красного цвета при pH ниже 4,5 и синего при pH выше 8,3.
Если бумага становится фиолетовой, это означает, что pH близок к нейтральному. Красная бумага, которая не меняет цвет, указывает на то, что образец — кислота. Голубая бумага, не меняющая цвет, означает, что образец является основой.
Красная бумага, которая не меняет цвет, указывает на то, что образец — кислота. Голубая бумага, не меняющая цвет, означает, что образец является основой.
Помните, что кислоты и основания относятся только к водным растворам (на водной основе), поэтому pH-индикатор не меняет цвет в неводных жидкостях, таких как растительное масло.
Лакмусовую бумагу можно смочить дистиллированной водой для изменения цвета газообразной пробы. Газы меняют цвет всей лакмусовой бумажки, так как вся поверхность обнажена. Нейтральные газы, такие как кислород и азот, не изменяют цвет pH-бумаги.
Лакмусовая бумага, цвет которой изменился с красного на синий, можно повторно использовать в качестве синей лакмусовой бумаги. Бумагу, цвет которой изменился с синего на красный, можно повторно использовать в качестве красной лакмусовой бумаги.
Ограничения
Лакмусовая бумажка выполняется быстро и просто, но имеет несколько ограничений.Во-первых, это не точный индикатор pH; он не дает числового значения pH. Вместо этого он примерно указывает, является ли образец кислотой или основанием. Во-вторых, бумага может менять цвет по другим причинам, помимо кислотно-щелочной реакции.
Вместо этого он примерно указывает, является ли образец кислотой или основанием. Во-вторых, бумага может менять цвет по другим причинам, помимо кислотно-щелочной реакции.
Например, синяя лакмусовая бумага становится белой в газообразном хлоре. Это изменение цвета связано с обесцвечиванием красителя от ионов гипохлорита, а не с кислотностью / основностью.
Альтернативы лакмусовой бумаге
Лакмусовая бумага удобна в качестве общего кислотно-щелочного индикатора, но вы можете получить гораздо более конкретные результаты, если используете индикатор, который имеет более узкий диапазон тестирования или предлагает более широкий диапазон цветов.
Например, сок краснокочанной капусты меняет цвет в зависимости от pH от красного (pH = 2) через синий (нейтральный pH) до зеленовато-желтого (pH = 12), плюс вы с большей вероятностью найдете капусту в местных магазинах. продуктовый магазин, чем лишайник. Красители орсеин и азолитмин дают результаты, сопоставимые с результатами лакмусовой бумаги.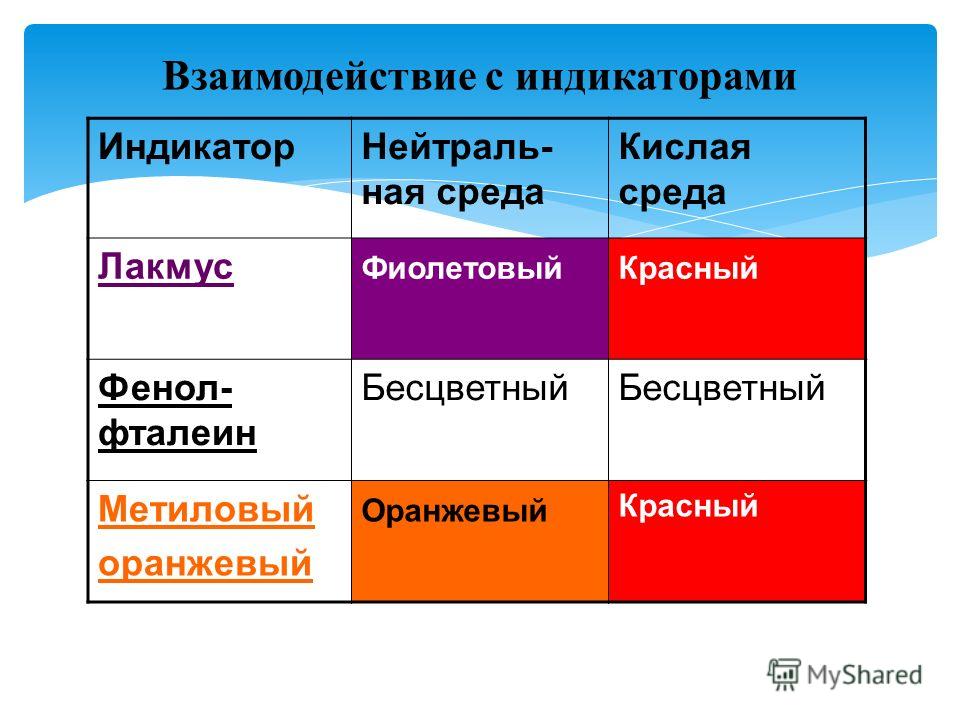
типов лакмусовой бумаги | Sciencing
Лакмусовая бумага — это кислотно-щелочной индикатор, который меняет цвет для идентификации щелочей и кислот. Лакмус — это краситель, сделанный из природных веществ, в том числе лишайников (грибов), наиболее часто используемым из которых является разновидность roccella tinctoria.Эти лишайники обрабатываются в течение нескольких недель смесью мочи, поташа и извести, в течение которых они ферментируются и меняют цвет. Позже добавляют гипс или мел и лепят из лакмуса лепешки. Бумага, обработанная лакмусовой бумажкой, называется лакмусовой бумагой или лакмусовой бумажкой. Они широко используются в лабораториях и учебных заведениях для проверки кислотности или щелочности вещества.
Красная лакмусовая бумага
Красная лакмусовая бумага используется в химических лабораториях для идентификации оснований.Основа — это вещество, которое принимает ионы водорода (H +) в воде. Цвет красной лакмусовой бумаги остается неизменным в кислых условиях и становится синим в основных условиях. Вещества, которые превращают красную лакмусовую бумажку в синий цвет, включают пищевую соду, известь, аммиак, бытовые чистящие средства и человеческую кровь. Красная лакмусовая бумага получается обработкой простой бумаги лакмусовой краской, которая покраснела небольшим количеством разбавленной серной кислоты (h3SO4) и высушена на воздухе.
Вещества, которые превращают красную лакмусовую бумажку в синий цвет, включают пищевую соду, известь, аммиак, бытовые чистящие средства и человеческую кровь. Красная лакмусовая бумага получается обработкой простой бумаги лакмусовой краской, которая покраснела небольшим количеством разбавленной серной кислоты (h3SO4) и высушена на воздухе.
Синяя лакмусовая бумага
Синяя лакмусовая бумага становится красной в кислых условиях и остается неизменной в основных условиях.Кислота — это вещество, выделяющее ионы водорода в водном растворе. Синяя лакмусовая бумага изготавливается путем обработки простой бумаги лишайниково-голубой лакмусовой бумагой. Синяя лакмусовая бумага обычно используется для проверки кислот, таких как:
- серная кислота
- соляная кислота
- азотная кислота
- этановая кислота
- лимонная кислота
- уксус
Пурпурная / нейтральная лакмусовая бумага
Пурпурная или нейтральная лакмусовая бумага меняет цвет с первоначального фиолетового на красный, чтобы обозначить кислоту, и становится синим в щелочных (или основных) условиях. Нейтральная лакмусовая бумажка содержит от десяти до пятнадцати различных красителей, включая азолитмин, лейказолитмин, лейкоорсин и спаниолитмин. Многие химические лаборатории заменяют красную и синюю лакмусовую бумагу на пурпурную лакмусовую бумагу для ее удобства и универсальности. Они могут указывать на присутствие как кислот, так и оснований и менять цвет на синий или красный, чтобы обозначить основание или кислоту соответственно.
Нейтральная лакмусовая бумажка содержит от десяти до пятнадцати различных красителей, включая азолитмин, лейказолитмин, лейкоорсин и спаниолитмин. Многие химические лаборатории заменяют красную и синюю лакмусовую бумагу на пурпурную лакмусовую бумагу для ее удобства и универсальности. Они могут указывать на присутствие как кислот, так и оснований и менять цвет на синий или красный, чтобы обозначить основание или кислоту соответственно.
Лакмусовая бумага — это индикаторная бумага pH, покрытая органическим красителем, который меняет цвет в присутствии кислот и оснований. Часто в одном эксперименте используются оба типа лакмусовой бумаги.Основной раствор намочит кусок голубой лакмусовой бумаги, и изменения цвета не будет. (Бумага может казаться более синей из-за того, что она намокла, но изменения цвета не произойдет.) Однако отсутствие изменения цвета окончательно не указывает на то, что раствор является основным, поскольку нейтральные растворы не вызывают изменения цвета. (Точно так же кислота смачивает красную лакмусовую бумагу без изменения цвета. Щелочная бумага, универсальная индикаторная бумага, может проверять как кислоты, так и щелочи и указывать приблизительный pH раствора. Индикатор изменит цвет при смачивании раствором аналита, а значение pH будет приблизительно соответствовать новому цвету (в месте, где образец смочил бумагу) со стандартной цветовой диаграммой. Обычно цветная диаграмма доступна вместе с диспенсером индикаторной бумаги, но цветовую диаграмму можно приготовить, смочив несколько кусочков индикаторной бумаги серией буферных растворов (растворов с известным pH). |
Кислотно-основные показатели
Magic Pitcher Demonstration:
Фенолфталеин — индикатор кислот (бесцветный) и щелочей.
(розовый). Гидроксид натрия — это основа, и она была в кувшине. вначале, поэтому при добавлении фенолфталеина в химические стаканы
2 и 4 он стал розовым (верхняя половина рисунка).
вначале, поэтому при добавлении фенолфталеина в химические стаканы
2 и 4 он стал розовым (верхняя половина рисунка).
Пояснение:
Равновесие: HIn -> H + + In —
бесцветный красный
Равновесие смещается вправо, HIn уменьшается, а In — увеличивается.При повышении pH от 8,2 до 10,0 цвет становится красный из-за сдвигов равновесия, образуя в основном В — ионы.
В третьем стакане находится только NaOH, но нет фенолфталеина, так он остался бесцветным. Первый стакан содержит уксусную кислоту. и сначала пропускается.
После наполнения стаканов 2, 3, 4 обратно в кувшин розовый раствор.
Нижняя половина рисунка: Когда затем наливают кувшин
обратно в мензурки 2, 3, 4 — раствор розового цвета.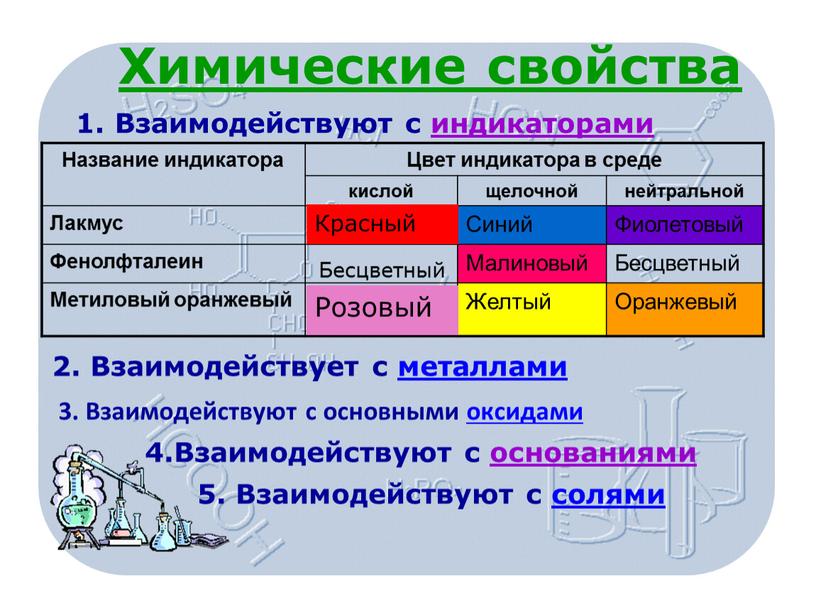
В первом стакане происходит странная вещь — розовый раствор, выходящий из кувшина, теперь становится бесцветным. Это происходит потому, что в первом стакане находится немного уксуса или уксусная кислота, которая нейтрализует NaOH и изменяет раствор от основного до кислого. В кислых условиях фенолфталеин индикатор бесцветный.
Нейтрализация: HC 2 H 3 O 2 + NaOH -> Na (C 2 H 3 O 2 ) + HOH
Объясните изменение цвета индикатора:
Используйте принципы равновесия для объяснения изменения цвета фенолфталеин в конце демонстрации.
Решение:
Упрощенная реакция: H + + OH — -> HOH
При добавлении ионов OH — они потребляются
избыток кислоты уже в стакане, как указано выше
уравнение. Ионы гидроксида продолжают уменьшаться, а водород
ионы увеличиваются, pH снижается.
Ионы гидроксида продолжают уменьшаться, а водород
ионы увеличиваются, pH снижается.
См. Нижнее уравнение: равновесие индикатора смещается влево, В — уменьшаются ионов.При pH ниже 8,2 индикатор бесцветен. Поскольку количество ионов H + увеличивается, а pH уменьшается до pH 4-5 достигается индикаторное равновесие и изменяется в бесцветную форму HIn.
Равновесие: HIn -> H + + In —
бесцветный красный
Оценка pH — кислотно-щелочные индикаторы
Оценка pH — кислотно-основные показатели Один из самых простых способов определить pH раствора — это добавить вещество, цвет которого зависит от pH.Такие соединения называются кислотно-щелочными индикаторами или просто индикаторами. Лакмус, пожалуй, самый распространенный кислотно-щелочной индикатор. Если поместить в относительно кислые растворы (pH 8), лакмус будет синим. Обратите внимание, что есть диапазон, в котором лакмус не является ни красным, ни синим (от 5 до 8). Это называется областью изменения цвета лакмуса и представляет собой диапазон значений pH, в котором лакмус изменяется от одного цвета к другому. Лакмус так широко используется, потому что его область изменения цвета сосредоточена вокруг pH 7 (нейтральный раствор).
Обратите внимание, что есть диапазон, в котором лакмус не является ни красным, ни синим (от 5 до 8). Это называется областью изменения цвета лакмуса и представляет собой диапазон значений pH, в котором лакмус изменяется от одного цвета к другому. Лакмус так широко используется, потому что его область изменения цвета сосредоточена вокруг pH 7 (нейтральный раствор).
Некоторые области изменения цвета | индикатор | область изменения цвета | изменение цвета | метиловый зеленый | 0,2 — 1,8 | от желтого до синего | конго красный | 3,0 — 5,0 | от синего к красному | лакмусовая бумага | 5,0 — 8,0 | красный к синему | фенол красный | 6. |  4 — 8,0 4 — 8,0 от желтого до красного | тимолфталин | 9,4 — 10,6 | от бесцветного до синего | | ||
Область изменения цвета Thymolphthalien составляет от 9,4 до 10,6. Эта информация позволяет нам кое-что сказать о pH раствора, содержащего небольшое количество тимолфталеина. Если он бесцветный, pH меньше 9,4. Если он синий, pH больше 10,5. Промежуточный цвет означает промежуточный pH (9.4
Некоторые индикаторы имеют более одной области изменения цвета. Тимоловый синий является примером. При pH менее 2,5 он красный. При pH выше примерно 7,5 он синий. Между этими значениями pH он желтый.
Тестируя раствор с более чем одним индикатором, с разными областями изменения цвета, мы часто можем сузить pH до единицы или около того. Рассмотрим этот пример:
Тестовый раствор становится синим при добавлении к нему небольшого количества лакмуса и остается бесцветным при добавлении тимолфталеина. Что такое pH? Что такое pH? |
Кислотно-щелочной индикатор
— изменения, решение, красный цвет и индикаторы
Кислотно-щелочной индикатор не всегда является синтетическим химическим веществом. Часто это комплексный органический краситель , который претерпевает изменение цвета , когда pH раствора изменяется в определенном диапазоне pH. Многие пигменты plant и другие натуральные продукты являются хорошими индикаторами, также доступны и широко используются синтетические, такие как фенолфталеин и метиловый красный. Бумага , погруженная в смесь нескольких индикаторов, а затем высушенная, называется pH-бумагой, полезной для получения приблизительного значения pH раствора. Синяя лакмусовая бумага становится красной в кислом растворе, а красная лакмусовая бумага становится синей в щелочном растворе.
Значение pH, при котором цвет индикатора изменяется, называется переходом , интервал . Химики используют соответствующие индикаторы, чтобы сигнализировать об окончании кислотно-щелочной реакции нейтрализации . Такая реакция обычно осуществляется титрованием — медленным добавлением отмеренного количества основания к отмеренному количеству кислоты (или наоборот) из бюретки .(Бюретка представляет собой длинную трубку с отметками объема для точного измерения и запорным краном внизу для контроля потока жидкости.) Когда реакция завершена, то есть когда нет избытка кислоты или основания, а есть только продукты реакции, что называется конечной точкой титрования. Индикатор должен менять цвет при pH, соответствующем этой конечной точке.
Химики используют соответствующие индикаторы, чтобы сигнализировать об окончании кислотно-щелочной реакции нейтрализации . Такая реакция обычно осуществляется титрованием — медленным добавлением отмеренного количества основания к отмеренному количеству кислоты (или наоборот) из бюретки .(Бюретка представляет собой длинную трубку с отметками объема для точного измерения и запорным краном внизу для контроля потока жидкости.) Когда реакция завершена, то есть когда нет избытка кислоты или основания, а есть только продукты реакции, что называется конечной точкой титрования. Индикатор должен менять цвет при pH, соответствующем этой конечной точке.
Индикатор меняет цвет из-за собственной нейтрализации в растворе. Различные индикаторы имеют разные интервалы перехода, поэтому выбор индикатора зависит от согласования интервала перехода с ожидаемым pH раствора, когда реакция достигает точки полной нейтрализации.Фенолфталеин изменяется от бесцветного до розового в диапазоне от pH 8,2 до pH 10. Метиловый красный меняется с красного на желтый в диапазоне от pH 4,4 до pH 6,2. Это два наиболее распространенных индикатора, но доступны и другие для более высоких и более низких значений pH. Метиловый фиолетовый, например, меняет цвет с желтого на синий в интервале перехода от pH 0,0 до pH 1,6. Желтый ализарин R изменяется с желтого на красный в интервале перехода от pH 10,0 до pH 12,1. Другие индикаторы доступны для большей части диапазона pH и могут использоваться при титровании широкого диапазона слабых кислот и оснований .
Метиловый красный меняется с красного на желтый в диапазоне от pH 4,4 до pH 6,2. Это два наиболее распространенных индикатора, но доступны и другие для более высоких и более низких значений pH. Метиловый фиолетовый, например, меняет цвет с желтого на синий в интервале перехода от pH 0,0 до pH 1,6. Желтый ализарин R изменяется с желтого на красный в интервале перехода от pH 10,0 до pH 12,1. Другие индикаторы доступны для большей части диапазона pH и могут использоваться при титровании широкого диапазона слабых кислот и оснований .
Измерение pH с помощью лакмусовой бумаги
Почти все вокруг состоит из кислоты или основания, за исключением воды. Вода не является ни кислой, ни щелочной, а скорее нейтральной. Кислые вещества имеют кислый вкус, например, цитрусовые, такие как лимоны, апельсины и лаймы, все кислые и имеют слегка кислый вкус. Основания, с другой стороны, горькие на вкус и могут быть скользкими. Основы часто используются в качестве чистящих средств, например, мыла и моющих средств.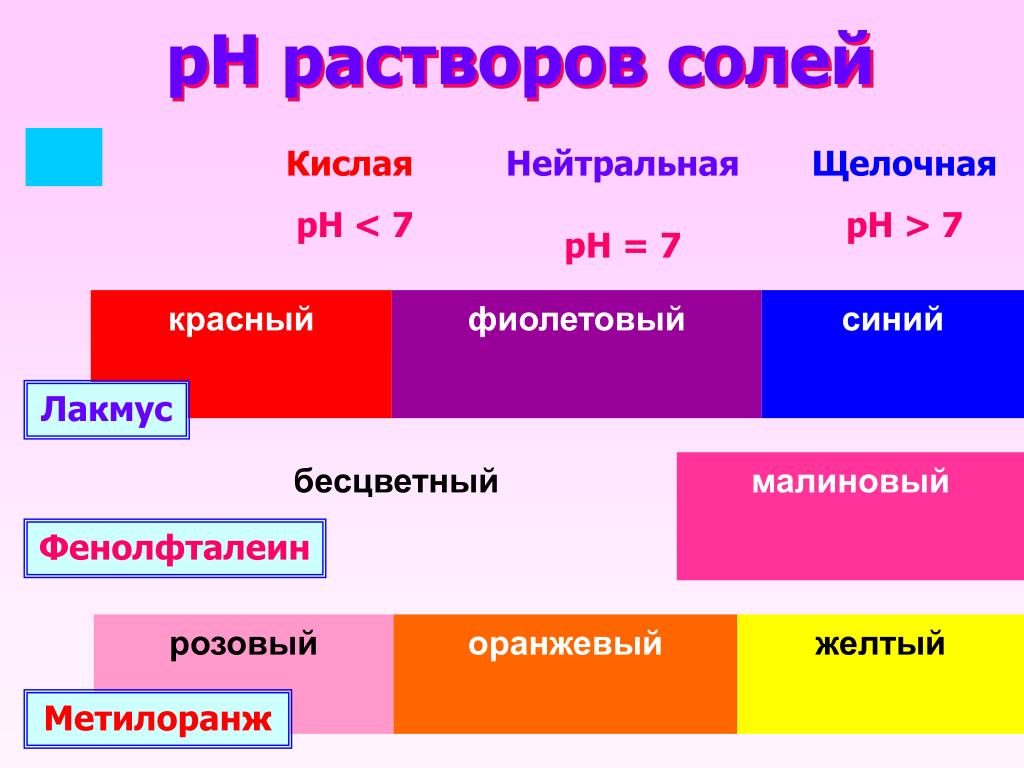 (То, что мы говорим, что кислоты на вкус кислый, а основания горькие, не означает, что вам следует проверить эту теорию.Не пробуйте чистящие средства, чтобы проверить, подходит ли это.)
(То, что мы говорим, что кислоты на вкус кислый, а основания горькие, не означает, что вам следует проверить эту теорию.Не пробуйте чистящие средства, чтобы проверить, подходит ли это.)
Шкала pH была разработана для измерения кислотности или щелочности вещества. Эта шкала измеряет pH от 0 до 14. Кислоты имеют значение pH от 0 до 7, а основания — от 7 до 14. Чистая вода нейтральна и имеет pH ровно 7.
Индикаторы используются для измерения pH вещества. Часто растительные экстракты меняют цвет при воздействии кислотных или основных условий, и поэтому их можно использовать для определения того, является ли вещество кислотой или основанием.Сегодняшний эксперимент сфокусирован на использовании лакмусовой бумаги, самой простой pH-бумаги, созданной много лет назад. Лакмус извлекается из определенного лишайника, чтобы сформировать лакмусовый порошок, который затем используется в химическом растворе для обработки бумаги, разрезания на полоски и та-да! Изготовлена лакмусовая бумага. У нас есть три разных типа лакмусовой бумаги: синяя, красная и нейтральная.
У нас есть три разных типа лакмусовой бумаги: синяя, красная и нейтральная.
Синяя лакмусовая бумага станет красной в кислых растворах и останется синей в щелочных растворах. Красная лакмусовая бумажка становится синей в щелочных растворах и остается красной в кислых растворах.Нейтральная лакмусовая бумага становится красной в кислых растворах и синей в щелочных. При нейтральном pH ни одна из лакмусовых бумажек не меняет цвет.
Итак, давайте начнем с нескольких вопросов:
- Какой цвет станет голубой лакмусовой бумажкой, если ее окунуть в раствор с pH 3?
- Какой цвет станет голубой лакмусовой бумажкой, если погрузить ее в раствор с pH 9?
- Какой цвет станет красной лакмусовой бумажкой, если ее окунуть в раствор с pH 2?
- Какой цвет станет красной лакмусовой бумажкой, если окунуть ее в раствор с pH 10?
- Какой цвет станет нейтральной лакмусовой бумажкой, если ее окунуть в раствор с pH 4?
- Какой цвет станет нейтральной лакмусовой бумажкой, если ее окунуть в раствор с pH 11?
Теперь давайте проверим несколько веществ с помощью красной и синей лакмусовой бумаги.
- Красная лакмусовая бумага
- Голубая лакмусовая бумага
- Стержни перемешивания
- Стаканы маленькие
- Лимонный сок
- Апельсиновый сок
- Аспирин
- Шампунь
- Водопроводная вода
- Кусковое мыло
- Уксус
- Мыло для посуды
- Жидкий очиститель для рук
- Мойщик окон
Наша цель — классифицировать каждое тестируемое вещество как кислотное или основное.Для начала сформулируйте гипотезу для каждого вещества о том, будет ли оно кислым, основным или нейтральным. Запишите все свои выводы в лабораторный блокнот, используя приведенную ниже таблицу в качестве руководства.
| Тестируемое вещество | Прогноз (кислота, щелочь, нейтраль) | Результат теста красный лакмус | Результат теста синий лакмус | Это кислота или основание? |
|---|---|---|---|---|
- Если образец твердый, например аспирин, раздавите его и смешайте с водой до тех пор, пока он не растворится, чтобы получился жидкий раствор.
 Перемешайте каждый раствор другой мешалкой, чтобы убедиться, что он полностью перемешан.
Перемешайте каждый раствор другой мешалкой, чтобы убедиться, что он полностью перемешан. - Удалите кусочек лакмусовой бумаги из флакона
- Удерживая один конец лакмусовой бумаги, окуните полоску в раствор и удалите. Если изменение цвета должно произойти, это произойдет немедленно.
- Отметьте изменение цвета, если оно есть, и запишите в блокнот.
Ответьте на следующие вопросы после завершения лабораторной работы.
- На каких факторах вы строили свои прогнозы?
- Были ли образцы, которые не меняли цвет как на синей, так и на красной лакмусовой бумаге? Если да, то что это говорит о pH образца?
- Сможете ли вы использовать хотя бы одну лакмусовую бумажку, чтобы определить, является ли неизвестное вещество кислотным, основным или нейтральным? Почему или почему нет?
Если смешать кислоту и основание, получится более нейтральный раствор.

 1
1
 Лакмусовая бумага используется при определении кислотности раствора или щелочности. Лакмусовая бумага не дает точной информации о концентрации кислоты или основания. Есть два типа лакмусовой бумаги: красная и синяя. Красная лакмусовая бумага используется для проверки основности (красная бумага становится синей при воздействии оснований), а синяя лакмусовая бумага используется для проверки кислотности (синяя бумага становится красной при воздействии кислот). (Инструмент памяти: b lue для b asic.)
Лакмусовая бумага используется при определении кислотности раствора или щелочности. Лакмусовая бумага не дает точной информации о концентрации кислоты или основания. Есть два типа лакмусовой бумаги: красная и синяя. Красная лакмусовая бумага используется для проверки основности (красная бумага становится синей при воздействии оснований), а синяя лакмусовая бумага используется для проверки кислотности (синяя бумага становится красной при воздействии кислот). (Инструмент памяти: b lue для b asic.) ) Таким образом, если изменения цвета не наблюдается, раствор следует тестировать с помощью лакмусовой бумаги противоположного цвета, чтобы подтвердить кислотность или основность.
) Таким образом, если изменения цвета не наблюдается, раствор следует тестировать с помощью лакмусовой бумаги противоположного цвета, чтобы подтвердить кислотность или основность. Перемешайте каждый раствор другой мешалкой, чтобы убедиться, что он полностью перемешан.
Перемешайте каждый раствор другой мешалкой, чтобы убедиться, что он полностью перемешан.
Leave A Comment