Сколько протонов, нейтронов и электронов у калия?
Калий состоит из 19 протонов, 20 нейтронов и 19 электронов. Заряды протонов и электронов нейтрализуют друг друга, поэтому чистый заряд нейтрального атома калия равен нулю.
Атомный номер элемента такой же, как количество протонов в элементе. Поскольку у калия атомный номер 19, в нем 19 протонов.
У нейтрального атома одинаковое количество протонов и электронов, поэтому у одного нейтрального атома калия также должно быть 19 электронов.
Согласно данным Управления естественнонаучного образования Томаса Джефферсона, количество нейтронов в элементе равно массовому числу элемента за вычетом количества протонов в одном атоме элемента. Чтобы найти массовое число, округлите атомный вес элемента, который находится под символом элемента в периодической таблице, до ближайшего целого числа. У калия атомный вес 39,0983, поэтому его массовое число равно 39. Протонов 19, поэтому должно быть 20 нейтронов, что составляет массовое число 39 минус 19 протонов.
Похожие посты
Что такое модель Бора для серебра?
Кто открыл протоны, электроны и нейтроны?
Сколько протонов и нейтронов в алюминии?
Что составляет атом?
В чем разница между жесткой и мягкой водой?
Каковы свойства идеального газа?
Каковы природные ресурсы Японии?
Каковы уровни энергии электронов?
При какой температуре кипит вода?
Почему важно качество воды?
Где в мире используется энергия ветра?
Есть ли схема позвоночника, на которой обозначены все его части?
Что делают бронхиолы?
Что такое пример порядочности?
Что такое современная семья?
Кто является лидером христианства?
Что такое таинства католицизма?
Что такое хорошая жизнь по Платону?
Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.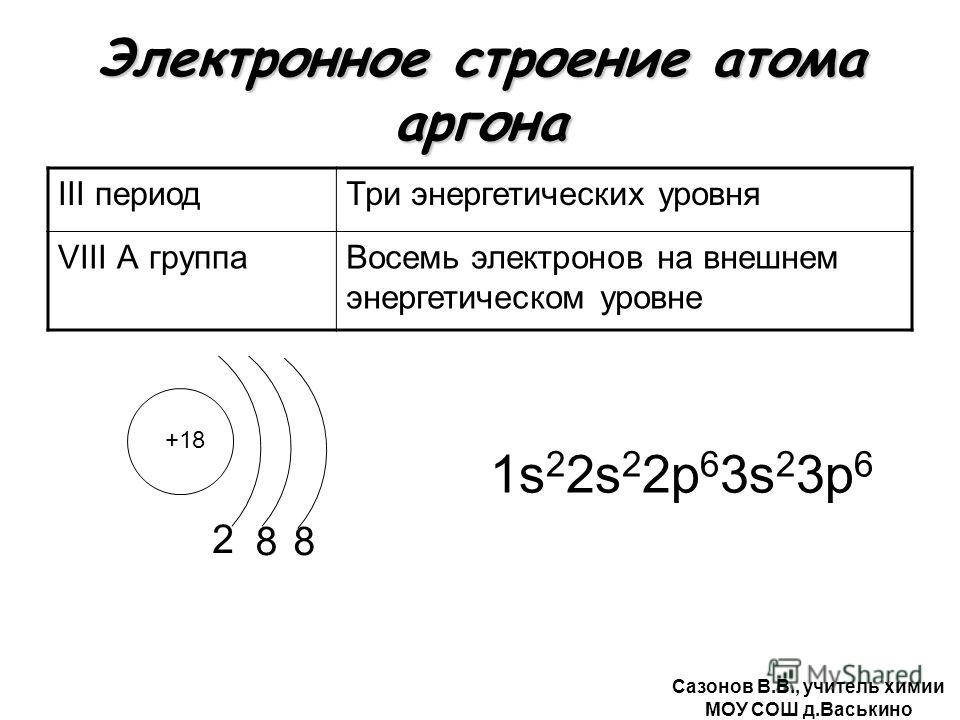 ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Электронная конфигурация атомов
Электронная конфигурация атомов
Электронная конфигурация атома описывает распределение его электронов на атомных орбиталях, упорядоченных по энергетическим уровням орбиталей. Самая простая конфигурация для водорода: 1s 1 . Верхний индекс показывает, что на 1s-орбитали находится один электрон.
В периодической таблице помимо гелия (He) электронная конфигурация каждого элемента показана в сокращенной форме, которая начинается с предшествующего ему символа инертного газа. Например, сокращенная конфигурация для Neon: [He] 2s 2 2п 6 . Конфигурация для гелия [He]: 1s 2 .
Таким образом, замена конфигурации He дает полную конфигурацию Neon: 1s 2 2s 2 2p 6
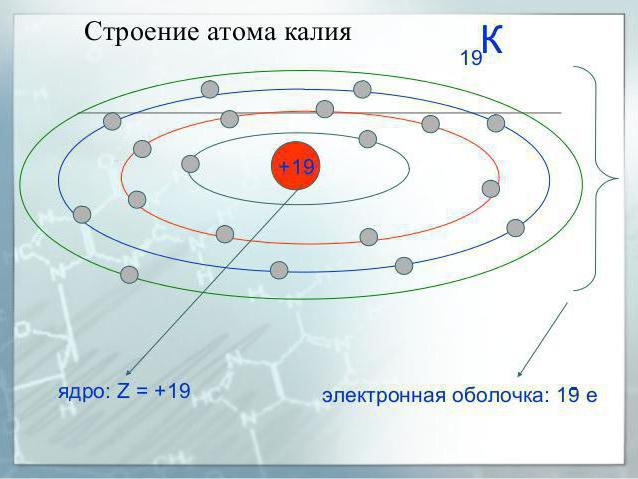
Например, для калия (K) (атомный номер 19) предшествующим благородным газом является аргон. (Ar) (атомный № 18). Таким образом, для калия показана конфигурация [Ar]4s 1 (см. таблицу ниже).
Атом калия (К) имеет 19 электронов. Полная электронная конфигурация калия (К) равна 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
Сокращенная форма — [Ar]4s 1 — означает электронную конфигурацию аргона (Ar), плюс один электрон на 4s-орбитали. Аргон имеет 18 электронов. Одна дополнительная электронная конфигурация завершает картину для 19 электронов калия.
Обратите внимание, что в электронной конфигурации как K, так и Ca орбиталь 4s заполняется до орбитали 3d. Причина этого в том, что энергетический уровень орбитали 4s немного ниже, чем у орбитали 3d.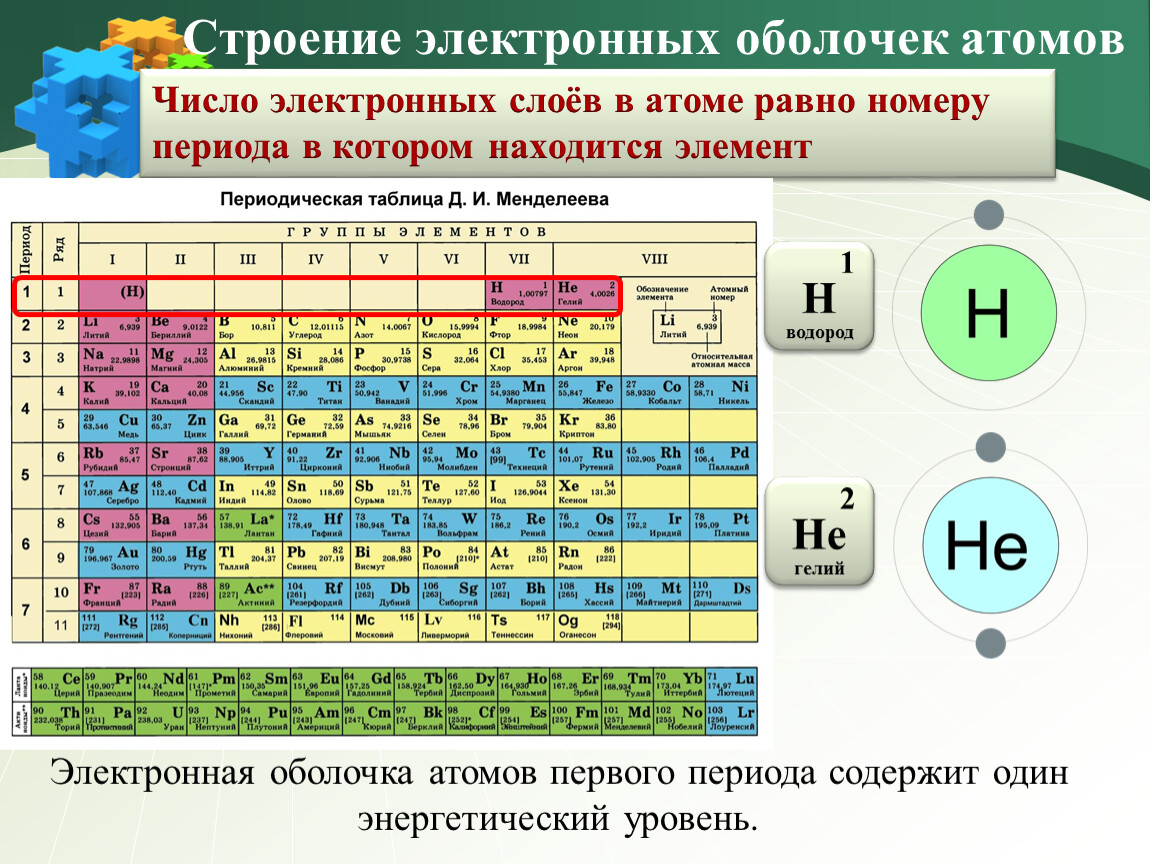 Следовательно, орбиталь 4s заполнена электронами раньше, чем орбиталь 3d.
Следовательно, орбиталь 4s заполнена электронами раньше, чем орбиталь 3d.
| Основной уровень энергии Квантовый номер: n | Доступные подуровни Квантовый номер: l |
|---|---|
| 1 2 3 4 5 1 7 6 | 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s 6p 6d 6f 6g 6h |
Начиная со скандия (Sc, атомный номер 21), 3d-орбиталь имеет более низкую энергию, чем 4s. Таким образом, электронная конфигурация Sc такова: [Ar] 3d 1 4с 2 . Для объяснения этих аспектов см. ссылку Schwarz, указанную ниже.
В таблице ниже показаны полные формы электронных конфигураций благородных газов.
| № | А. вес | Имя | Символ | Группа | Электронная конфигурация |
|---|---|---|---|---|---|
| 2 | 4. 003 003 | Гелий | He | 18 | 1s 2 |
| 10 | 20.180 | Neon | Ne | 18 | 1s 2 2s 2 2p 6 |
| 18 | 39.948 | Argon | Ar | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| 36 | 83.800 | Krypton | Kr | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 |
| 54 | 131.293 | Xenon | Xe | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 |
| 86 | 222. 000 000 | Radon | Rn | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5S 2 5p 6 4F 14 5d 10 6S 2 6P 6 |
Аббревисти в атоме. Каждый элемент однозначно определяется своим атомным номером.
Атомная масса: Масса атома в первую очередь определяется количеством протонов и нейтронов в его ядре. Атомная масса измеряется в единицах атомной массы (а.е.м.), которые масштабируются по отношению к углероду, 12 C, который считается стандартным элементом с атомной массой 12. Этот изотоп углерода имеет 6 протонов и 6 нейтронов. Таким образом, каждый протон и каждый нейтрон имеют массу около 1 а.е.м.
Ссылка
Schwarz E.W. Полная история электронных конфигураций переходных элементов.
Журнал химического образования (2010) 87 (4) 444-448. https://doi.org/10.1021/ed8001286
https://doi.org/10.1021/ed8001286
См. также: Орбитрон: Галерея атомных орбиталей и несколько молекулярных орбиталей


Leave A Comment