Определите число протонов, электронов и нейтронов в атомах элементов. Химия. 8 класс. Габриелян. ГДЗ. § 7. Глава 1. Вопрос 2. – Рамблер/класс
Определите число протонов, электронов и нейтронов в атомах элементов. Химия. 8 класс. Габриелян. ГДЗ. § 7. Глава 1. Вопрос 2. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите определить число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.
ответы
Вот твое определение.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.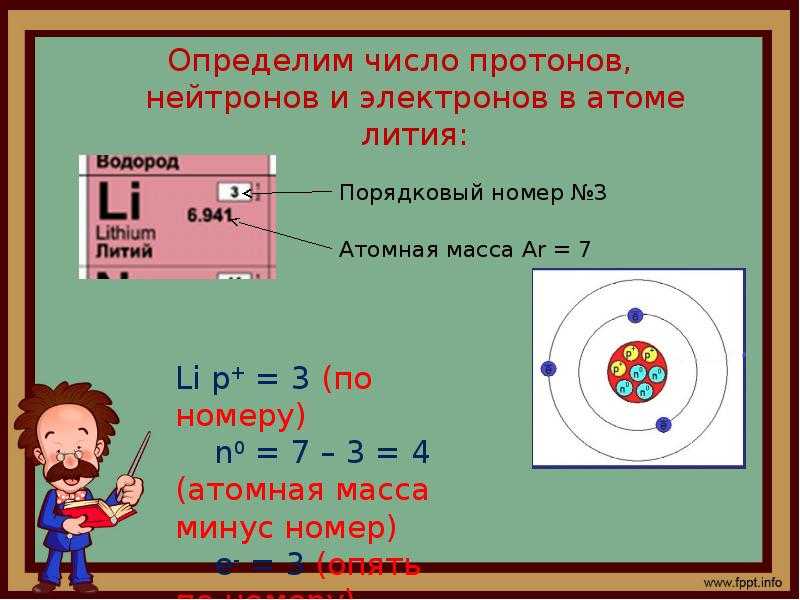
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
11. Выпишите слово, в котором на месте пропуска пишется буква Е. Русский язык ЕГЭ-2017 Цыбулько И. П. ГДЗ. Вариант 12.
11.
Выпишите слово, в котором на месте пропуска пишется буква Е.
произнос., шь (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц.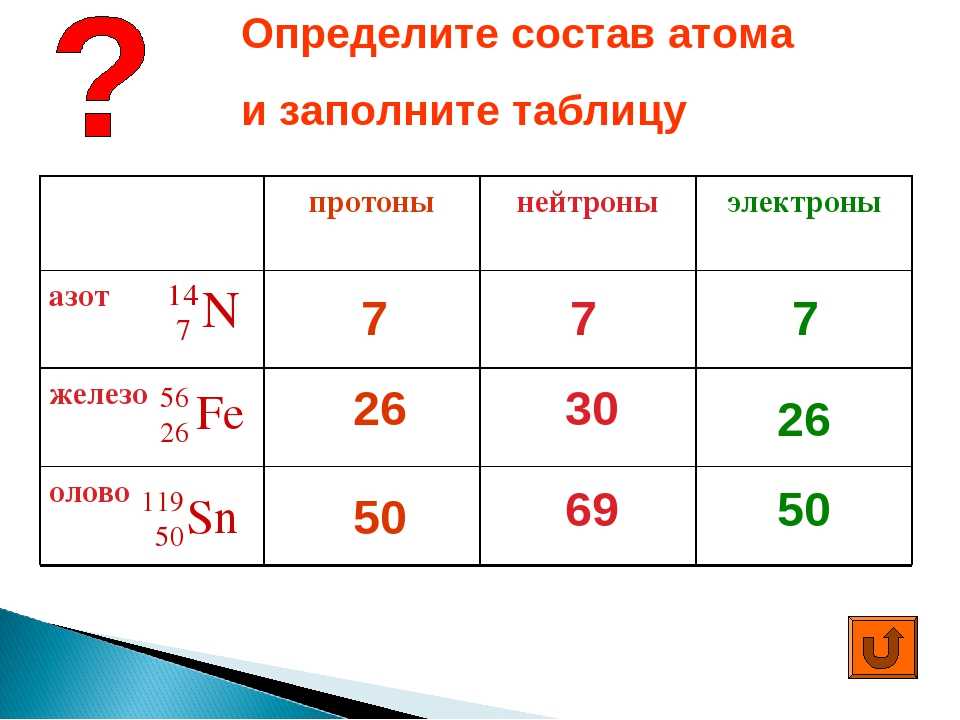 У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).

Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частицИз таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.

- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень.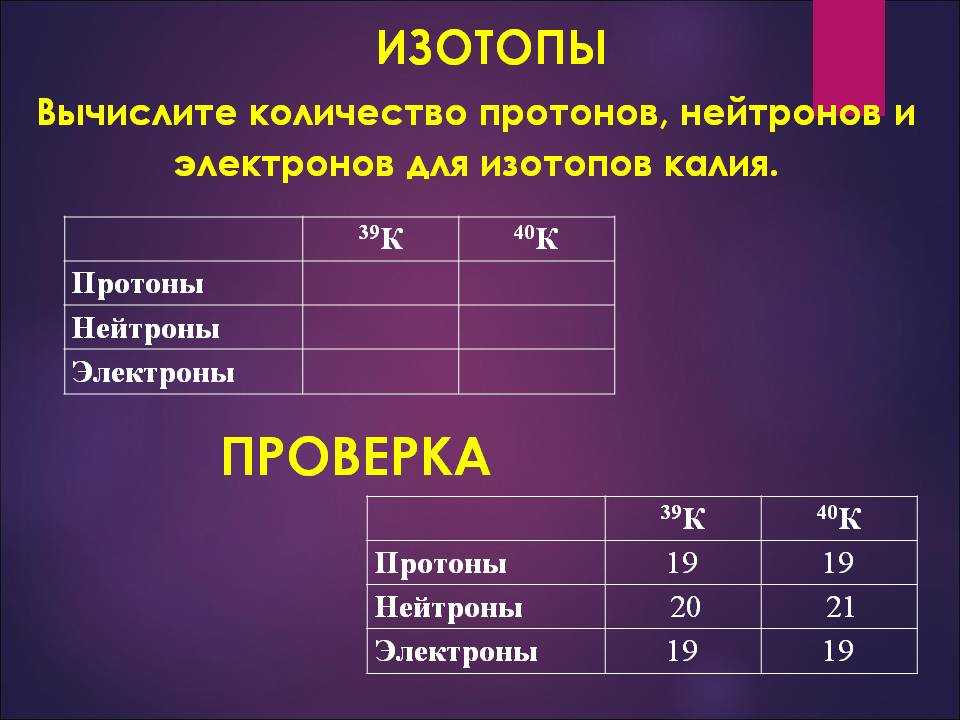 В результате, конфигурация меди выглядит как 3d104s11
В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.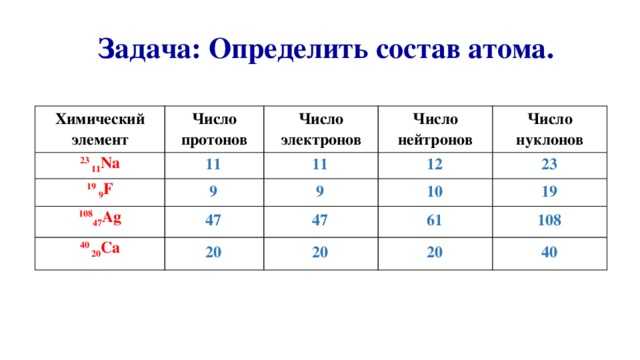
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Фосфор — Протоны — Нейтроны — Электроны
Фосфор как элемент существует в двух основных формах — белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается на Земле в свободном виде.
Подавляющее большинство добываемых соединений фосфора потребляется в качестве удобрений. Фосфат необходим для замены фосфора, который растения удаляют из почвы, и его ежегодная потребность растет почти в два раза быстрее, чем рост населения.
Преобладающим источником фосфора в наше время является фосфатная порода (в отличие от предшествующего гуано).
Протоны и нейтроны в фосфоре
Фосфор — это химический элемент с атомным номером 15 , что означает, что в его ядре 15 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Фосфора равны 31.
Основные изотопы Фосфора
23 известны изотопы фосфора в диапазоне от 25P до 47P. Только 31P является стабильным и, следовательно, присутствует в количестве 100%.
Фосфор-31 состоит из 15 протонов, 16 нейтронов и 15 электронов. Полуцелый ядерный спин и высокое содержание 31P делают спектроскопию ЯМР фосфора-31 очень полезным аналитическим инструментом при исследовании фосфорсодержащих образцов.
Фосфор-32 состоит из 15 протонов, 17 нейтронов и 15 электронов. 32 P, бета-излучатель (1,71 МэВ) с периодом полураспада 14,3 дня, который обычно используется в медико-биологических лабораториях, в основном для производства ДНК- и РНК-зондов с радиоактивной меткой.
Фосфор-33 состоит из 15 протонов, 18 нейтронов и 15 электронов. 33P, бета-излучатель (0,25 МэВ) с периодом полураспада 25,4 дня. Он используется в медико-биологических лабораториях в приложениях, в которых выгодны более низкие энергетические бета-излучения, таких как секвенирование ДНК.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Фосфора равно 15. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Фосфора : [Ne] 3s2 3p3 .
Возможные степени окисления +3,5/-3 .
Как элемент, фосфор существует в двух основных формах — белый фосфор и красный фосфор — но поскольку он очень реактивен, фосфор никогда не встречается на Земле в виде свободного элемента. Наиболее распространенными соединениями фосфора являются производные фосфата, тетраэдрического аниона. Фосфат представляет собой сопряженное основание фосфорной кислоты, которое производится в больших масштабах для использования в удобрениях.
Наиболее распространенное соединение фосфора
Фосфорная кислота — это слабая кислота с химической формулой H 3 PO 4 . Пищевая фосфорная кислота используется для подкисления пищевых продуктов и напитков, таких как различные колы и джемы, для придания им острого или кислого вкуса. Безалкогольные напитки, содержащие фосфорную кислоту, в том числе кока-колу, иногда называют фосфатными газированными напитками или фосфатами.
Пищевая фосфорная кислота используется для подкисления пищевых продуктов и напитков, таких как различные колы и джемы, для придания им острого или кислого вкуса. Безалкогольные напитки, содержащие фосфорную кислоту, в том числе кока-колу, иногда называют фосфатными газированными напитками или фосфатами.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/c 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон – это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой благодаря своему положительному заряду. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов для формирования стабильного ядра требуется возрастающее отношение нейтронов к числу протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические химические свойства атома определяются количеством протонов, фактически числом и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Фосфор |
| Количество протонов | 15 |
| Число нейтронов (типичные изотопы) | 31 |
| Число электронов | 15 |
| Электронная конфигурация | [Не] 3s2 3p3 |
| Степени окисления | +3,5/-3 |
Источник: www. { {\text{31}}}{\text{P}}$.
{ {\text{31}}}{\text{P}}$.
-Верхняя величина описывает атомную массу атома, которая равна $31$, а нижняя величина описывает атомный номер этого атома, равный $15$.
Атомный номер (${\text{Z}}$) = Количество электронов = Количество протонов
Из приведенного выше соотношения ясно, что количество электронов, находящихся вне ядра на орбитали атома фосфора, равно $15$ и количество протонов, находящихся внутри ядра, также равно $15$, так как атомный номер (${\text{Z}}$) фосфора составляет $15$.
— Связь между атомной массой, протонами и нейтронами описывается следующим образом:
Атомная масса (${\text{A}}$) = Число протонов + Число нейтронов
Дано, что атомная масса фосфора = $31$
А также мы знаем, что количество протонов в фосфоре = $15$
Количество нейтронов = $31 — 15 = 16$.





Leave A Comment