Реакции с выделением газов — Справочник химика 21
Для приготовления соли Рейнеке 90 г роданистого аммония нагревают в фарфоровой чашке, непрерывно помешивая стеклянной палочкой. Когда соль почти расплавится, нагревание прекращают и тут же прибавляют небольшими порциями при перемешивании 30 г тонко растертого бихромата аммония. При этом происходит бурная реакция с выделением газов. Перемешивание продолжают и после добавления всего бихромата аммония до получения густой массы. Сырой продукт обрабатывают небольшими порциями воды при комнатной температуре сначала отмывают избыток бихромата аммония, затем выщелачивают соль Рейнеке. [c.164]РЕАКЦИИ С ВЫДЕЛЕНИЕМ ГАЗОВ [c.157]
Для зарядки аппарата Киппа нужно отобрать достаточно крупные гранулы цинка. Мелкие гранулы могут проваляться в нижний резервуар и там начнется реакция с выделением газа. В этом случае может возникнуть довольно значительное давление и кислота может быть выброшена через воронку.
Для приготовления соли Рейнеке 90 г роданида аммония нагревают в фарфоровой чашке, непрерывно перемешивая толстой стеклянной палочкой. Когда соль почти расплавилась, нагревание прекращают и тут же прибавляют небольшими порциями и при перемешивании 30 г тонкорастертого бихромата аммония. При этом происходит бурная реакция с выделением газов. Перемешивание продолжают и после прибавления всего бихромата аммония до получения густой массы.
Реакции с выделением газов (газовыделительные реакции). Выше уже приводилась реакция растворения карбоната кальция в кислотах, при которой выделяется газообразный диоксид углерода. Укажем еще на некоторые газовыделительные реакции. [c.15]
[c.15]
В реакциях с выделением газов имеются две фазы, и так же как и реакции осаждения, экстракции, ионного обмена, реакции с выделением газов можно использовать для разделения, меняя pH раствора, создавая условия для образования комплексных соединений и т. п. Сдвигая равновесия в растворе в одну сторону, можно осуществлять и количественные определения.
В стакане происходит реакция с выделением газа СО3. Составить уравнение реакции. Когда выделение пузырьков газа сильно замедлится, нагреть стакан до 60—70 °С. Выделение пузырьков сначала усилится когда оно прекратится, можно считать реакцию законченной. Слить образовавшийся раствор с оставшихся кусочков мрамора и промыть их 2 раза дистиллированной водой методом декантации. [c.50]
В реакции с выделением газа измеряют объем его через некоторые промежутки времени. В качестве примеров можно привести реакцию металла с кислотой (рис. 14.2) и разложение пероксида водорода  325]
325]
Тетрагидридоборат(П1) натрия Na[Bh5] вносят в горячую воду, при этом наблюдают выпадение осадка и выделение газа. Периодически определяют pH раствора. Установлено, что выделение газа уменьшается (до почти полного прекращения) при увеличении щелочности среды при подкислении реакция с выделением газа возобновляется. Объясните результаты опыта. [c.75]
Необходимо контролировать равномерность распределения I, катализатора в смоле, а также определять температуру, при которой начинается экзотермическая реакция с выделением газов и паров, образующих в смоле пузырьки (температура газообразования).
Выполнение опыта. В пробирку налить 5—7 капель 30 %-го раствора гидроксида натрия и опустить кусочек алюминия. Наблюдать протекание реакции с выделением газа. [c.186]
Это же правило распространяется на растворы газов в жидкости и на смеси, при стоянии которых возможны реакции с выделением газов. [c.106]
[c.106]
Наблюдайте бурный процесс реакции с выделением газа. [c.224]
Чтобы получить хорошие полые гранулы, следует уничтожить плавающую пленку закиси меди. Для этого нужно ее восстановить до металлической меди. Этот процесс называют дразнением . Процесс дразнения проводят следующим образо.м. При неработающей форсунке в медь погружают конец сырого деревянного шеста и держат его в спокойном состоянии. При этом протекает реакция с выделением газов (водяной пар, углеводороды, сернистый газ), вследствие чего происходит бурное кипение меди и идет восстановление закиси меди в медь. По прошествии 5—8 мин дразнение прекращают. В печь на поверхность меди забрасывают серу и хорошо перемешивают гребками расплавленную медь для лучшего поглощения серы. Дальнейшая обработка меди идет по нормальному технологическому режиму.
Получение хлористой хлорметилртути [69]. В раствор 13,6 г сулемы в 200 мл эфира при размешивании пропускают эквимолекулярное количество диазометана (2,1 г), получаемого медленным прибавлением 12 г нитрозометилуретана к смеси 60 мл эфира, и 18 мл 25%-ного раствора едкого калн в метиловом спирте с такой скоростью, чтобы реакционная смесь была бесцветна. Быстро происходит реакция с выделением газа, под конец выделяются кристаллы. После испарения эфира остается хлористая хлорметил-ртуть. Выход количественный. Кристаллизация из спирта. Т. пл. 131°С.
Быстро происходит реакция с выделением газа, под конец выделяются кристаллы. После испарения эфира остается хлористая хлорметил-ртуть. Выход количественный. Кристаллизация из спирта. Т. пл. 131°С.
В стакане происходит реакция с выделением газа СОз. Составить уравнение реакции. Когда выделение пузырьков газа сильно замедлится, нагреть стакан до 60—70°. Выделение пузырьков [c.47]
Такими условиями могут быть концентрация каждого из начальных и конечных веществ температура в сфере реакции для реакций с участием газов (хотя бы одного) и реакцией с выделением газов — давление. [c.11]
Глинистые материалы (глины и сланцы) содержат много минеральных компонентов в различных пропорциях и с повышением температуры в них и между ними происходят различные топохимические реакции с выделением газов. В области относительно низких температур выделяются пары воды — происходит сушка материала, а примерно от 500—700° С начинается разложение и взаимодействие различных окислов и органических составляющих.
Другой реакцией, по-видимому, также протекающей по свободно-радикальному механизму, является алкилирование хинонного кольца перекисями ацилов нли тетраацнлатами свинца (М. Физер и др., 1942). Если раствор 2-метил-1,4-нафтохинона в уксусной кислоте нагревать с перекисью ацетила, взятой в количестве немного более 1 акв, или с 3— 4 экв тетраацетата свинца, то происходит энергичная реакция с выделением газа, и исходное вещество превращается в 2,3-диметилнафтохи-нон (т. пл. 127 °С)
В реакционный сосуд I (рис. 264) насыпают германид магния в виде тонкого порошка, а в колбочку 2 — 50%-ный избыток ЫН4Вг. Сначала через трубку 3 сжижают столько чистого чтобы сосуд I был заполнеи на 2/3. После этого пропускают медленный поток аммиака для перемешивания и порциями добавляют Nh5Br из колбочки 2, для чего ее поворачивают вверх.
Роданиды щелочных металлов растворяются, например, в триэтилалюминии с образованием второго слоя. Однако при этом (часто самопроизвольно) в особенности при легком нагревании протекает энергичная реакция (с выделением газа), приводящая к глубокому изменению исходных реагентов. По наблюдениям Боница, азиды щелочных металлов также образуют с алюминийтриалкилами комплексные соединения, которые, по-видимому, должны быть более стойкими, чем комплексы рода-нидов щелочных металлов.
В длинную и узкую пробирку я положил 2 г падугольного калия, 0,5 г твердой фосфорной кислоты и, наполнив пробирку эфиром, пустил в нее 2 или 3 капли воды. Как только вода коснулась дна, произошла сильная реакция с выделением газа. Реакцию можно до известной степени умерить, поставив пробирку в охладительную смесь.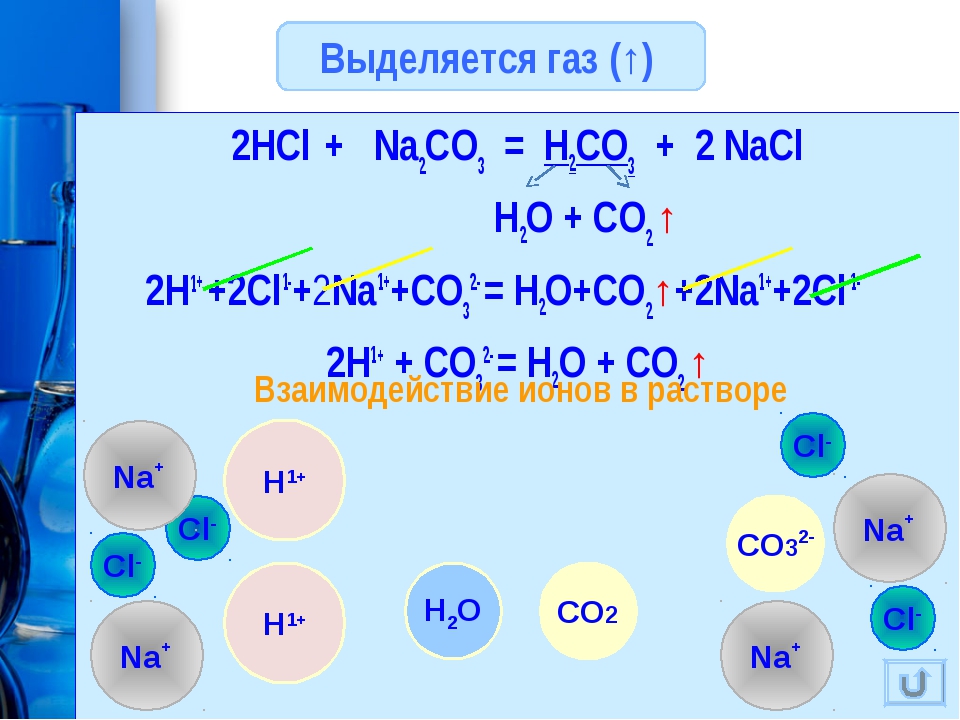 Когда выделение ] аза прекратилось, эфирный раствор был слит, профильтрован и обработан спиртовым раствором едкого кали. Образовался синевато-белый осадок, 1 оторый после фильтрования и высушивания в безвоздушном пространстве оказался тождественным с надугольным калием эфир, который хорошо растворяет перекись водорода и надхромовую кислоту, повидимому, является хорошим растворителем и для надугольной кислоты.
Когда выделение ] аза прекратилось, эфирный раствор был слит, профильтрован и обработан спиртовым раствором едкого кали. Образовался синевато-белый осадок, 1 оторый после фильтрования и высушивания в безвоздушном пространстве оказался тождественным с надугольным калием эфир, который хорошо растворяет перекись водорода и надхромовую кислоту, повидимому, является хорошим растворителем и для надугольной кислоты.
По мере ее хода добавляется новый хлористый метил и пускается в ход охлаждение так, чтобы поддерживать температуру около 75°. При более высокой температуре наступает побочная реакция с выделением газа. Об окончании реакции судят по прекращению поглощения хлористого метила. Реакция протекает количественно. Медь остается незатронутой. На 60 миллимолей А1 потреблено 89 миллимолей h4 I. Полученный жидкий продукт — эквимолекулярную смесь h4AI I2 и (СНз)2А1С1 — декантируют со стружек или прямо отгоняют, конечно в токе азота. [c.77]
Постепенно небольшими порциям вносили 37 г ди-/г-анизилдифенил-этанона в эфирный раствор этилмагнийбромида, приготовленного из 22 г бромистого этила и 4,8 г магния. Каждое прибавление пинаколина сопровождалось быстрой реакцией с выделением газа. После нрибав [c.249]
Каждое прибавление пинаколина сопровождалось быстрой реакцией с выделением газа. После нрибав [c.249]
Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
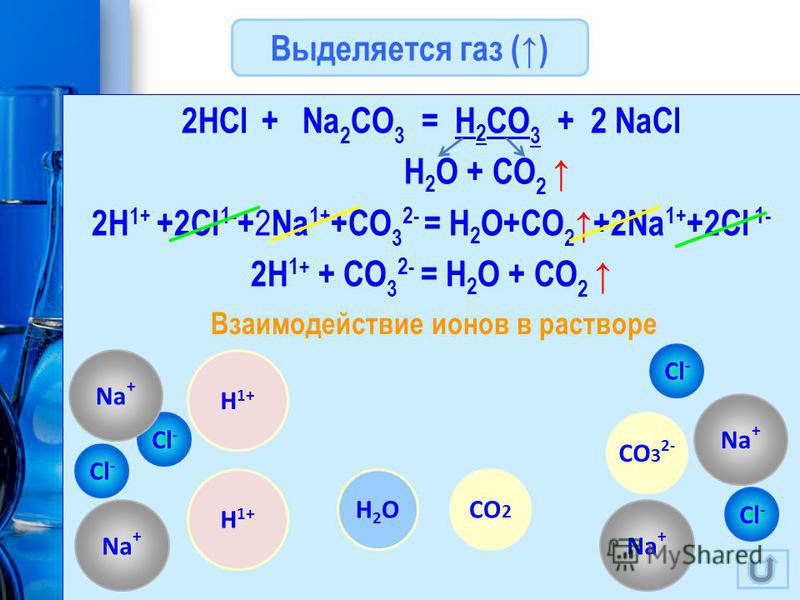
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
а с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba2+ | SO42- | Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| Cu2+ | 1) OH− 2) S2- | 1) Выпадение осадка голубого цвета: Cu2+ + 2OH− = Cu(OH)2↓ 2) Выпадение осадка черного цвета: Cu2+ + S2- = CuS↓ |
| Pb2+ | S2- | Выпадение осадка черного цвета: Pb2+ + S2- = PbS↓ |
| Ag+ | Cl− | Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O: Ag+ + Cl− → AgCl↓ |
| Fe2+ | 1) OH− 2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6] | 1) Выпадение белого осадка, зеленеющего на воздухе: Fe2+ + 2OH− = Fe(OH)2↓ 2) Выпадение синего осадка (турнбулева синь): K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
| Fe3+ | 1) OH− 2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) Роданид-ион SCN− | 1) Выпадение осадка бурого цвета: Fe3+ + 3OH− = Fe(OH)3↓ 2) Выпадение синего осадка (берлинская лазурь): K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ 3) Появление интенсивно-красного (кроваво-красного) окрашивания: Fe3+ + 3SCN− = Fe(SCN)3 |
| Al3+ | Щелочь (амфотерные свойства гидроксида) | Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи: OH− + Al3+ = Al(OH)3 и его растворение при дальнейшем приливании: Al(OH)3 + NaOH = Na[Al(OH)4] |
| NH4+ | OH−, нагрев | Выделение газа с резким запахом: NH4+ + OH− = NH3↑ + H2O Посинение влажной лакмусовой бумажки |
| H+ (кислая среда) | Индикаторы: − лакмус − метиловый оранжевый | Красное окрашивание |
Качественные реакции на анионы
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции Уравнение реакции |
| SO42- | Ba2+ | Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| NO3− | 1) Добавить H2SO4(конц.) и Cu, нагреть 2) Смесь H2SO4 + FeSO4 | 1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| PO43- | Ag+ | Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
| CrO42- | Ba2+ | Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
| S2- | Pb2+ | Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
| CO32- | 1) Ca2+ 2) H+ | 1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
| CO2 | Известковая вода Ca(OH)2 | Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| SO32- | H+ | Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
| F− | Ca2+ | Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
| Cl− | Ag+ | Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц. Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
| Br− | Ag+ | Выпадение светло-желтого осадка, не растворимого в HNO3: Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
| I− | Ag+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.): Ag+ + I− = AgI↓ (осадок темнеет на свету) |
| OH− (щелочная среда) | Индикаторы: — лакмус — фенолфталеин | — синее окрашивание — малиновое окрашивание |
Реакции ионного обмена » HimEge.ru
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно – восстановительных реакции).
При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно – восстановительных реакции).
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в воде газов) или растворимые вещества — слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены.
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости.
Примеры реакций с выпадением осадков:
a) Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
Ba2+ + SO42- = BaSO4↓
б) AgNO3 + KI = AgI↓ + KNO3
Ag+ + I— = AgI↓
в) MgCl2 + 2KOH = Mg(OH)2↓ + 2KCl
Mg2+ + 2OH— = Mg(OH)2↓
г) 3Zn(CH3COO)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6Na(CH3COO)
3Zn2+ + 2PO43- = Zn3(PO4)2↓
Обратите внимание, AgCO3, BaCO3 и CaCO3 ПРАКТИЧЕСКИ НЕРАСТВОРИМЫЕ В ВОДЕ И ВЫПАДАЮТ В ОСАДОК КАК ТАКОВЫЕ, НАПРИМЕР:
Ba(NO3)2 + K2CO3 = BaCO3↓ + 2KNO3
Ba2+ + CO32- = BaCO3↓
Соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимые в воде, но не осаждаются из водного раствора при проведении ионных реакций (т. е. их нельзя получить этим способом).
е. их нельзя получить этим способом).
Например карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и K2CO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:
2FeSO4 + H2O + 2Na2CO3 = 2Na2SO4 + Fe2CO3(OH)2↓ + CO2↑
2Fe2+ + H2O + 2CO32- = Fe2CO3(OH)2↓ + CO2↑
Аналогично FeCO3, сульфид хрома (3) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
2CrCl3 + 6H2O + 3Na2S = 6NaCl + 2Cr(OH)3↓ + 3H2S↑
2Cr3+ + 6H2O + 3S2- = 2Cr(OH)3↓ + 3H2S↑
Некоторые соли разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома(III) Cr(CH3COO)3:
а) Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
б) Cr(CH3COO)3 + 2H2O= Cr(CH3COO)(OH)2↓ + 2CH3COOH
Следовательно, эти соли нельзя получить по обменной реакции в растворе:
а) 2AlCl3 + 6H2O +3K2S = 6KCl + 2Al(OH)3↓ +3H2S↑
2Al3+ + 6H2O + 3S2- = 2Al(OH)3↓ + 3H2S↑
б) CrCl3 + 2H2O + 3Na(CH3COO) =
3NaCl + Cr(CH3COO)(OH)2↓ + 2CH3COOH
Cr3+ + 2H2O + 3CH3COO— =
Cr(CH3COO)(OH)2↓ + CH3COOH
Примеры реакций с выделением газа:
а) BaS + 2HCl = BaCl2 + H2S↑
S2- + 2H+ = H2S↑
б) Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
CO32- + 2H+ = CO2↑+ H2O
в) CaCO3(T) + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
CaCO3(T) + 2H+ = Ca2+ + CO2↑ + H2O
Примеры реакций с образованием слабых электролитов:
а) 3NaOH + H3PO4 = Na3PO4 + 3H2O
3OH— + H3PO4 = PO43- + 3H2O
б) Mg(CH3COO)2 + H2SO4 = MgSO4 + 2CH3COOH
CH3COO— + H+ = CH3COOH
в) NH4F + HBr = NH4Br + HF
F— + H+ = HF
Если реагенты и продукты обменной реакции не являются сильными электролитам, ионный вид уравнения отсутствует, например:
Mg(OH)2(T) + 2HF = MgF2↓ + 2H2O
выделение газа — Перевод на английский — примеры русский
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
На полное выделение газа уходит примерно 12 дней.
It seems to take about 12 days to give off all the gas it can.Когда какой-либо металл вступает в реакцию с кислотой, происходит выделение газа.
2 Выделение газа в результате давления или химической реакции
«Зона или площадка должна контролироваться таким образом, чтобы выделение газа из обработанного груза не привело к образованию неприемлемых уровней концентрации (т.е. уровней концентрации фосфина, превышающих нормы промышленной гигиены.)»».
«The area of site must be monitored to ensure that liberation of gas from the treated commodity does not result in the development of unacceptable levels (i. e., over industrial hygiene levels of phosphine).»
e., over industrial hygiene levels of phosphine).»Предложить пример
Другие результаты
Нагревание не приводит к выделению газа… Никаких признаков реакций разложения.
Heating it does not cause a gas to form… nor any other signs of decomposition.Техпроцесс осуществляется почти без выделения газа из расплава, что значительно сокращает затраты средств на изготовление оборудования по удалению и очистке газа.
The production process is carried out without releasing a gas from melt, thereby substantially reducing the expenditures for providing gas removing and cleaning facilities. З марта — Главные японские компании-производители планируют принять цели снижения выделения газов ввиду глобального потепления.
Выделение газов и вулканическая активность привели к возникновению первичной атмосферы.
Outgassing and volcanic activity produced the primordial atmosphere.Солнечные лучи вызовут повышение температуры… до 350 градусов… и бурное выделение газов.
The sun striking the comet will cause the temperature to rise 350 degrees in just a few minutes and activate the high-speed gas jets.С. В автоматической остановке отливных насосов в случае выделения газа
C Automatic stopping of the unloading pumps if there is a gas release Должны быть также приняты меры по сокращению количества образующегося метана и регулированию процесса выделения газов.
Сложные полисахариды, реагируя с диоксидом углерода, создают необычную комбинацию строения и выделения газа.
The complex polysaccharides in reaction with the carbon dioxide produces an unusual combination of texture and effervescence.Показания выше 10 pCi/L требуют только дополнительного краткосрочного теста, дабы избежать чрезмерного промедления в борьбе с выделением газа.
Measurements over 10 pCi/L warrant only another short term test so that abatement measures are not unduly delayed.
Остается лишь гарантировать, что эти транспортные единицы можно закрыть таким образом, чтобы свести выделение газов к минимуму.
Пункт 4.1.1.8 допускает наличие на таре, включая КСГМГ, вентиляционного отверстия, если внутри упаковки за счет выделения газов ее содержимым может повыситься давление.
Sub-Section 4.1.1.8 allows packages, including IBCs, to be fitted with a vent where pressure may develop by the emission of gas from the contents.А. В автоматическом закрытии вентилей в соединительных трубопроводах между береговым сооружением и судном в случае выделения газа
A Automatic closure of valves in the connecting pipes between the shore installation and the vessel during gas release При дехлорировании ПХД образуются дифенил, хлористый натрий, ацетон и вода, но не происходит выделения газов, таких, как водород или газообразный хлорид водорода.
По мере охлаждения продукта реакции, ведущие к выделению газа, также замедляются (предложение С).
As the products cools down, gas creating reactions also slow down (Proposal C).Выпускное устройство должно быть сконструировано таким образом, чтобы избыточное давление, возникающее в результате выделения газов, не превышало 10 кПа.
The venting device shall be so designed that an overpressure caused by gases does not exceed 10 kPa. Схема установки позволяет достигать высоких значений инерционного поля, действующего на электролит, тем самым создает условия для интенсивного разделения ионов электролита и прохождения электрохимической реакции с выделением газов.
Реакции ионного обмена и условия их осуществления
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
- Na2CO3 + h3SO4 → Na2SO4 + CO2↑ + h3O
- 2Na(+) + CO3(2-) + 2H(+) + SO4(2-) → 2Na(+) + SO4(2-) + CO2↑ + h3O
- 2H(+) + CO3(2-) → CO2↑ + h3O
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
Диссоциации не подвергаются:
- оксиды
- газообразные вещества
- вода
Реакция ионного обмена идет до конца, если образуется газ, осадок или вода:
- Na2CO3 + 2HCl → CO2↑ + 2NaCl + h3O
- 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
- NaOH + HCl → NaCl + h3O
Полезные ссылки
Источник материала
Реакции ионного обмена (видео)
Видеоурок «Качественные реакции в химии»
Многие вещества, которые нас окружают, мы можем определить по их специфическим признакам и свойствам. Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь — металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь — металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Такие жидкости, как уксусная кислота и этиловый спирт, также легко различить. Уксусная кислота очень хорошо растворима в воде. Этиловый спирт имеет характерный запах и хорошо смешивается с водой.
Кристаллы медного купороса имеют синий цвет, легко растворяются в воде, образуя голубой раствор.
У всех в аптечке есть марганцовка, её также несложно распознать. Марганцовка представляет собой тёмно-фиолетовые кристаллы, которые хорошо растворяются в воде и образуют раствор ярко-розового цвета.
Однако многие вещества определить достаточно сложно. Как распознать кислород и углекислый газ, ведь эти газы бесцветны и не имеют запаха? Или как узнать, какое вещество находится в пробирке: раствор кислоты или соли? Какой газ находится в сосуде?
Для этого проводят химические реакции, в результате которых происходят изменения с веществами. Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.
Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.
То есть качественные реакции — это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Основными признаками химических реакций являются: изменение окраски, выпадение осадка, выделение газа, появление запаха, выделение тепла и света.
Такие явления при проведении качественных реакций называются аналитическими сигналами.
Если опустить тлеющую лучинку в пробирку с кислородом и углекислым газом, то в одной пробирке лучинка гаснет, а в другой — ярко вспыхивает. Этот опыт позволяет определить, в какой пробирке кислород, а в какой — углекислый газ. В той пробирке, где лучинка гаснет, находится углекислый газ, так как углекислый газ не поддерживает горение. В той пробирке, где лучинка вспыхнула, находится кислород, потому что кислород поддерживает горение.
А как отличить, например, углекислый газ от азота, ведь азот, как и углекислый газ, не поддерживает горение? Для этого существует качественная реакция на углекислый газ.
Если в стакан с углекислым газом добавить небольшое количество известковой воды и встряхнуть жидкость в стакане, то жидкость мутнеет. Таким образом, с помощью известковой воды или раствора гашёной извести можно обнаружить углекислый газ.
Если в пробирку с прозрачной известковой водой опустить стеклянную трубку и продуть через неё выдыхаемый воздух, то раствор мутнеет. Значит, и в выдыхаемом воздухе есть углекислый газ.
То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество.
В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду.
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или немногими веществами. В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
Например, крахмал можно обнаружить с помощью раствора йода и наоборот. Если капнуть несколько капель йодной настойки на кусочек картофеля, то наблюдается появление сине-фиолетовой окраски. Данная реакция является качественной на крахмал и подтверждает наличие крахмала в картофеле.
Таким образом, с помощью качественных реакций проводят распознавание веществ. Качественная реакция сопровождается аналитическим сигналом. Кислород и углекислый газ можно распознать с помощью тлеющей лучинки. Реактивом на углекислый газ является известковая вода и наоборот. Реактивом на крахмал является раствор йода.
наука детям
Газы
Продолжение темы о кислотах и щелочах . Повторяем про воду, кислоту и щелочь. Переходим к газам. Атом водорода, атом кислорода. Разница между атомом и молекулой газа Углекислый газ (СО2), строение молекулы. Сходство с молекулой воды, но разные атомы. Выделение СО2 при дыхании и горении. Поглощение СО2 растениями для создания глюкозы и выделения другого газа — кислорода (О2). Необходимость кислорода для всех (почти) живых организмов. Упоминание бактерий, живущих в бескислородной среде. Необходимость кислорода для горения. Невозможность костра на Луне.
Сходство с молекулой воды, но разные атомы. Выделение СО2 при дыхании и горении. Поглощение СО2 растениями для создания глюкозы и выделения другого газа — кислорода (О2). Необходимость кислорода для всех (почти) живых организмов. Упоминание бактерий, живущих в бескислородной среде. Необходимость кислорода для горения. Невозможность костра на Луне.
Демонстрация. Выделение углекислого газа и кислорода.
СО2. Для выделения СО2 мы использовали соду и кислоту. Всем розданы стаканы, добавлена ложка соды и вода, растворение соды. После этого к раствору соды добавлена уксусная кислота (уксус) и мы наблюдаем химическую реакцию с выделением СО2. Чтобы убедиться в свойствах этого газа, мы опускаем в полупустой стакан с реакцией (в газ) горящую спичку — она тухнет. После этого каждый аккуратно переливает газ (не жидкость) из своего стакана в другой стакан с горящей «чайной» свечкой (tea candle) – свеча тоже тухнет. СО2 тяжелее воздуха, поэтому он остается в стакане, а не улетучивается (если стакан не трясти) и его можно перелить из одной емкости в другую. Но через некоторое время он все равно смешивается с воздухом и «перестает работать» как тушитель огня. Говорим об использовании сжатого СО2 в огнетушителях. Также о необходимости проветривания помещений, где находится много людей — для доступа свежего воздуха, обогащенного кислородом.
Но через некоторое время он все равно смешивается с воздухом и «перестает работать» как тушитель огня. Говорим об использовании сжатого СО2 в огнетушителях. Также о необходимости проветривания помещений, где находится много людей — для доступа свежего воздуха, обогащенного кислородом.
О2. Для выделения кислорода мы использовали перекись водорода (Н2О2) и марганцовку (перманганат калия). При добавлении раствора марганцовки к перекиси проходит бурная реакция с выделением газа — кислорода, и выделением тепла (стакан нагревается). Проверяем свойства газа — опускаем горящую спичку в стакан — она разгорается намного ярче. Опускаем тлеющую лучинку — она вспыхивает ярким пламенем. Это происходит 2-3 раза, но потом кислород заканчивается — он превращается в СО2. Для возобновления эффекта необходимо добавить новых реагентов — перекиси водорода и марганцовки. Аналогичная реакция возникает при добавлении кристаллов марганцовки к раствору перекиси водорода, но с большим выделением тепла и паров воды. Смысл реакции в том, что марганцовка разлагает перекись водорода – «отрывает» от нее кислород, а сама превращается в другое соединение. Но мы в дальнейшие тонкости не вдавались. Если кому-то интересно, то формула реакции – KMnO4 + h3O2 + h3O = O2 + MnO2 + KOH
Смысл реакции в том, что марганцовка разлагает перекись водорода – «отрывает» от нее кислород, а сама превращается в другое соединение. Но мы в дальнейшие тонкости не вдавались. Если кому-то интересно, то формула реакции – KMnO4 + h3O2 + h3O = O2 + MnO2 + KOH
Обсуждение экспериментов. Взрывоопасность чистого кислорода. Опасность СО2. Обсуждаем и записываем 3 основных признака химической реакции:
1) Изменение цвета реакции
2) Изменение температуры реакции
3) Выделение газа Занятие
Продолжение темы Газы.
Повторение прошлого занятия. Строение атома и молекулы кислорода. СО2. Обсуждение строения атома в целом. Атом водорода. Молекула. Самый легкий газ.
Демонстрация. Выделение водорода. Используем алюминиевую фольгу. Каждый скатывает небольшие шарики из фольги и складываем их в бутылку. Заливаем шарики жидкостью для прочистки канализационных труб, которая содержит высокую концентрацию щелочи (NaOH) или чистую щелочь. Натягиваем на горлышко бутылки воздушный шарик и оставляем на некоторое время. Начинается реакция (выделяются пузырьки газа), которая занимает некоторое время — чтобы шарик надулся до размера 20-25см. После того, как шарик достаточно надут, завязываем его — он наполнен водородом. Надуваем ртом еще один шарик похожего размера и тоже завязываем — он надут воздухом с повышенным содержанием СО2 (параллельно говорим о составе воздуха). В темноте поджигаем шарик с воздухом — он лопается с тихим хлопком и ничего не видно. Потом поджигаем шарик с водородом — он лопается с громким хлопком и ярким коротким пламенем — маленький взрыв! Обсуждаем опасность эксперимента, говорим о дирижаблях, взрывах и воздушных шарах.
Натягиваем на горлышко бутылки воздушный шарик и оставляем на некоторое время. Начинается реакция (выделяются пузырьки газа), которая занимает некоторое время — чтобы шарик надулся до размера 20-25см. После того, как шарик достаточно надут, завязываем его — он наполнен водородом. Надуваем ртом еще один шарик похожего размера и тоже завязываем — он надут воздухом с повышенным содержанием СО2 (параллельно говорим о составе воздуха). В темноте поджигаем шарик с воздухом — он лопается с тихим хлопком и ничего не видно. Потом поджигаем шарик с водородом — он лопается с громким хлопком и ярким коротким пламенем — маленький взрыв! Обсуждаем опасность эксперимента, говорим о дирижаблях, взрывах и воздушных шарах.
Для «закрепленя материала» о газах проводим традиционный эксперимент с elephant’s toothpaste. Используем перекись водорода, дрожжи, жидкое мыло (Fairy)/ Смешиваем дрожжи с водой, растворяем. В другой емкости смешиваем перекись водорода с жидким мылом. Каждый получает по 2 маленьких стакана и 1 большой. Наливаем в один маленький стакан раствор дрожжей, в другой — перекись с мылом. После этого аккуратно сливаем содержимое маленьких стаканов в большой и наблюдаем за реакцией. Появляется быстро растущая пена, заполняющая весь большой стакан и даже переливающаяся через край. Объем увеличивается в 10+ раз. Обсуждаем эксперимент. В дрожжах содержится белок (вещество), так же разлагающее перекись водорода, как и марганцовка. При этом выделяется кислород. Когда он пытается улететь из реакции, он встречается с раствором мыла и создает огромное количество (миллионы!) микроскопических мыльных пузырей, которые растут и создают пену. И мы это видим как продукт реакции.
Наливаем в один маленький стакан раствор дрожжей, в другой — перекись с мылом. После этого аккуратно сливаем содержимое маленьких стаканов в большой и наблюдаем за реакцией. Появляется быстро растущая пена, заполняющая весь большой стакан и даже переливающаяся через край. Объем увеличивается в 10+ раз. Обсуждаем эксперимент. В дрожжах содержится белок (вещество), так же разлагающее перекись водорода, как и марганцовка. При этом выделяется кислород. Когда он пытается улететь из реакции, он встречается с раствором мыла и создает огромное количество (миллионы!) микроскопических мыльных пузырей, которые растут и создают пену. И мы это видим как продукт реакции.
Стехиометрия газа | Безграничная химия
Стехиометрия газа
При стандартной температуре и давлении один моль любого газа занимает объем 22,4 л.
Цели обучения
Рассчитайте объемы газов, потребляемых / образующихся в реакции, используя стехиометрию газа.
Основные выводы
Ключевые моменты
- При стандартной температуре и давлении (STP) 1 моль любого газа будет занимать объем 22,4 л.

- Закон идеального газа, наряду со сбалансированным химическим уравнением, можно использовать для определения количества (по объему или массе) газа, потребляемого или производимого в химической реакции.
Ключевые термины
- стехиометрия : исследование и расчет количественных (измеримых) соотношений реагентов и продуктов в химических реакциях (химические уравнения)
Стехиометрия — это количественное исследование относительных количеств реагентов и продуктов в химических реакциях; стехиометрия газа включает химические реакции, в которых образуются газы.Стехиометрия основана на законе сохранения массы, означающем, что масса реагентов должна быть равна массе продуктов. Это предположение можно использовать для определения неизвестных количеств реагентов или продуктов.
Стехиометрические расчеты для идеальных газов на STP
Стехиометрические расчеты с участием газов позволяют нам переводить массу, количество молей и, что наиболее важно, объема и газа. Следующее соотношение делает это возможным:
Следующее соотношение делает это возможным:
- 1 моль любого газа при стандартной температуре и давлении (273 К и 1 атм) занимает объем 22.4 л.
Хотя указанное выше соотношение является приблизительным, оно является относительно хорошим приближением для STP и может надежно использоваться в расчетах.
Пример
[латекс] 4 \; NH_3 (г) +7 \; O_2 (г) \ rightarrow4 \; NO_2 (г) +6 \; H_2O (л) [/ латекс]
- Согласно приведенной выше реакции, какой объем NO 2 ( г ) образуется при сжигании 100 г NH 3 ( г ), если предположить, что реакция протекает при стандартной температуре и давлении?
- Из периодической таблицы мы можем определить, что молярная масса аммиака, NH 3 ( г, ), составляет 17 г / моль, и выполнить следующий стехиометрический расчет:
- [латекс] \ left (\ frac {\ text {100 г} NH_3} {} \ right) \ times \ left (\ frac {\ text {1 mol} NH_3} {\ text {17} g} \ right) \ times \ left (\ frac {\ text {4 mol} NO_2} {\ text {4 mol} NH_3} \ right) \ times \ left (\ frac {\ text {22.
 4} L} {\ text {1 mol} NO_2} \ right) = \ text {132 L} NO_2 (g) [/ latex]
4} L} {\ text {1 mol} NO_2} \ right) = \ text {132 L} NO_2 (g) [/ latex]
Обратите внимание на окончательный коэффициент пересчета. Поскольку нам говорят, что реакция происходит в STP, мы можем связать объем, 22,4 л, с 1 моль NO 2 .
Стехиометрия, граммы в литры газа — YouTube : показывает, как использовать стехиометрию для преобразования граммов газа в литры.
реакций газообразования | Grandinetti Group
Иногда в реакции раствора в качестве одного из реагентов или продуктов участвует газ.Например,
2 HCl (водн.) + Na 2 S (водн.) → H 2 S (газ) + 2 NaCl (водн.)
В этом примере полное ионное уравнение будет:
2 H + (водн.) + 2Cl — (водн. ) + 2Na + (водн.) + S 2- (водн.) →
H 2 S (г) + 2Na + (водн.) + 2Cl — (водн.)
) + 2Na + (водн.) + S 2- (водн.) →
H 2 S (г) + 2Na + (водн.) + 2Cl — (водн.)
Удаляя ионы-зрители, получаем чистое ионное уравнение:
2 H + (водн.) + S 2- (водн.) → H 2 S (г)
H 2 S — это лишь один пример газообразного вещества, которое может образовываться в реакции раствора.Еще один способ образования газов в растворе — разложение слабых электролитов. Например, H 2 CO 3 легко разлагается на H 2 O и газ CO 2 ,
H 2 CO 3 (водн.) → H 2 O (л) + CO 2 (г)
Итак, любая реакция раствора, которая приводит к производству H 2 CO 3 , например
HCl (водн. ) +
NaHCO 3 (водн.) →
NaCl (водн.) +
H 2 CO 3 (водн.)
) +
NaHCO 3 (водн.) →
NaCl (водн.) +
H 2 CO 3 (водн.)
HCl (водн.) + NaHCO 3 (водн.) → NaCl (водн.) + H 2 O (л) + CO 2 (г)
Если мы исключим все ионы-наблюдатели, мы запишем чистое ионное уравнение как
H + (водн.) + HCO 3 — (водн.) → H 2 O (л) + CO 2 (г)
Два других вещества, которые будут разлагаться и образовывать газы: H 2 SO 3 и NH 4 OH:
H 2 SO 3 (водн.) → H 2 O (л) + SO 2 (г)
NH 4 OH (водн. ) →
H 2 O (л) +
NH 3 (г)
) →
H 2 O (л) +
NH 3 (г)
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
4.19, 4.21, 4.23, 4.25, 4.27, 4.39, 4.41, 4.43, 4.45, 4.47, 4.49, 4.51, 4.53, 4.55, 4.57
Химические реакции с выделением водорода
[Депонировать фотографии]Водород — элемент, который содержится в большом количестве в природе и во Вселенной, занимает первое место в Периодической таблице.
Например, водород присутствует в воде, практически во всех органических веществах, звездах и межзвездном газе, галактических планетах и т. Д., поэтому трудно переоценить значение этого элемента в мире и Вселенной. В свободной форме встречается редко; объемное содержание водорода в воздухе около 5 ∙ 10-5. Водород H₂ — легкий газ, не имеющий запаха, цвета и вкуса.
Получение чистого водорода в лаборатории считается одним из самых опасных экспериментов, поскольку H₂ является взрывоопасным и горючим газом в сочетании с воздухом.
via GIPHY
Сам по себе водород безвреден для жизни человека и не токсичен.Следует также отметить, что этот газ растворяется в этаноле и некоторых металлах, таких как железо, никель, титан и т. Д.
История получения водорода
Что касается истории получения водорода, то этот газ добывался с тех пор, как химия стала отдельной наукой, и выделение горючего газа наблюдалось при взаимодействии металлов и кислот.
Ранее в алхимии выделяющийся горючий газ был известен как флогистон, гипотетическая сверхтонкая субстанция, состоящая из огня, которая заполняла все горючие вещества и выделялась из них в момент возгорания.Но известный русский эрудит Михаил Ломоносов показал, что в этих реакциях флогистон не выделяется. В 1766 году ученый Генри Кавендиш назвал этот газ легковоспламеняющимся воздухом. В момент горения этот газ активно выделял воду, но вера Кавендиша в алхимические знания об огненном веществе помешала ему сделать объективные выводы.
Позже, в 1766 году, было установлено, что в воде присутствует легковоспламеняющийся воздух, из которого можно извлечь.К таким выводам пришли Антуан Лавуазье и Жан Менье.
В момент горения этот газ активно выделял воду, но вера Кавендиша в алхимические знания об огненном веществе помешала ему сделать объективные выводы.
Позже, в 1766 году, было установлено, что в воде присутствует легковоспламеняющийся воздух, из которого можно извлечь.К таким выводам пришли Антуан Лавуазье и Жан Менье.
Области применения
Водород активно используется в химической промышленности для производства многих веществ, например аммония, метанола и H2, также используется для производства мыла и пластмасс.
В пищевой промышленности маргарин производится с использованием водорода. Водород также используется в авиастроении для надувания дирижаблей, но из-за его взрывоопасности был заменен гелием.
В настоящее время проводятся исследования по замене традиционного бензина на водородное топливо.
[Депонировать фотографии]Реакции с выделением водорода
В настоящее время наиболее распространенным методом получения водорода в промышленных масштабах является конверсия метана CH₄ или природного газа. Метан — это природный газ, простой углеводород. При нагревании метана парами воды при высоких температурах (1000 ° С) выделяется водород:
Метан — это природный газ, простой углеводород. При нагревании метана парами воды при высоких температурах (1000 ° С) выделяется водород:
CH₄ + Н₂О → C + 2H₂
В промышленности водород получают также путем пропускания воды над раскаленным коксом.
Получение водорода на аппарате Киппа.
АппаратКиппа является наиболее известным устройством для получения газов и состоит из колбы, воронки и газовой трубы. В этом аппарате водород получают с цинком, соляной и серной кислотами.Аппарат позволяет собирать газ в пробирку или другой контейнер, но эксперименты с выделением H2 можно проводить и без него, просто добавляя кусочек цинка и соляной кислоты в пробирку:
Zn + 2HCl → ZnCl₂ + H₂ ↑.
Реакция с выделением водорода из алюминия и щелочи позволяет получить более чистый водород. Этот эксперимент можно провести на открытом воздухе, наполнив водородом обычный баллон.Его нельзя проводить дома, так как эксперимент может быть очень взрывоопасным.
2Al + 2NaOH + 6H₂O → 2Na [Al (OH) ₄] + 3H₂ ↑
Здесь вы найдете безопасные эксперименты, которые можно проводить дома.
Вместо алюминия можно использовать алюминиевую фольгу: добавить ее в раствор гидроксида натрия.
[Депонировать фотографии]Гидроксид натрия — это обычная жидкость для очистки труб, которую можно купить в строительном магазине.Если вы наполните баллон водородом, поместив его над колбой, из которой выпускается газ, баллон поднимется в воздух. Получение водорода этим методом довольно просто объяснить: поверхность алюминия покрыта специальной оксидной пленкой, которая начинает разрушаться при взаимодействии со щелочами.
Реакция с выделением водорода с использованием сульфата меди, алюминия и соли
Добавьте в колбу поваренную соль (хлорид натрия) и сульфат меди CuSO₄ ∙ 5Н₂О. Затем добавьте воды. Полученная смесь должна стать зеленой, но если жидкость останется прозрачной, добавьте еще соли и медного купороса. Затем добавьте в колбу кусочки алюминия или фольги, свернутые в шар. Начнется реакция выделения водорода, поскольку образующийся в колбе хлорид меди удалит оксидную пленку с алюминия.
Затем добавьте воды. Полученная смесь должна стать зеленой, но если жидкость останется прозрачной, добавьте еще соли и медного купороса. Затем добавьте в колбу кусочки алюминия или фольги, свернутые в шар. Начнется реакция выделения водорода, поскольку образующийся в колбе хлорид меди удалит оксидную пленку с алюминия.
Реакция с выделением водорода с использованием щелочных и щелочноземельных металлов и воды.
Литий — легкий щелочной металл, не тонущий в воде.Если добавить кусочек лития в теплую воду, произойдет немедленная реакция с выделением газа:
Li + h3O = LiOH + H₂ ↑.
Таким образом, при контакте щелочных металлов с водой образуется щелочь и выделяется водород.
Реакция выделения водорода с использованием кальция и воды
Кальций — мягкий щелочноземельный металл, и если добавить очищенный металлический кальций в воду, произойдет бурная реакция с выделением водорода и гидроксида кальция:
Ca + 2H₂O → Ca (OH) ₂ ↓ + H₂ ↑
Таким образом, при контакте щелочноземельных металлов с водой образуется основание и выделяется водород.
Получение водорода электролизом
Простейшим методом получения водорода электролизом является гидролиз воды. Этот метод можно использовать для получения чистого кислорода и водорода в лаборатории.
2Н₂О = 2Н₂ ↑ + О₂ ↑
ХИМИЧЕСКИЕ РЕАКЦИИ
Что такое химическая реакция?
А химический реакция — это изменение вещества в новое, которое имеет другую химическую идентичность.
Как определить, идет ли химическая реакция? происходит?
химикат реакция обычно сопровождается легко наблюдаемыми физическими эффектами, такими как излучение тепла и света, образование осадка, эволюция газа или изменение цвета. Абсолютное подтверждение химического изменения может быть подтверждено только химическим анализом продукты!
Взгляните на следующее изображение и опишите, что вы видите? Каковы ключевые индикаторы химического изменения? Ключ — наблюдение!
Нажмите на Шерлока Холмса, чтобы проверить свои способности. наблюдение!
наблюдение!
О.. не забудьте проверить лай собаки!
Есть много разных типов химические реакции. У химиков есть классифицировал множество различных реакций на общие категории. Химические реакции, которые мы рассмотрим, представляют собой представление типов реакций, обнаруженных в каждой группе.Есть общее описание основных типы реакций и конкретные примеры, указанные в полях для выбора.
Реакция синтеза (Комбинированная реакция)
В синтезе В результате реакции два или более веществ объединяются с образованием нового соединения. Этот тип
реакция представлена следующим уравнением.
A + B AB
А и В
представляют собой реагирующие элементы или соединения, тогда как AB представляет собой соединение как
продукт.
Следующие ниже примеры представляют синтез Реакция .
Алюминий и бром | Образование бромида алюминия: Когда Al При размещении на поверхности жидкого Br 2 происходит экзотермическая реакция. Al окисляется до Al 3+ с помощью Br 2 , который восстанавливается до ионов Br — .Ионный продукт, AlBr 3 , можно наблюдать на часах. стакан после реакции. |
Натрий и хлор | Образование хлорида натрия: Расплавленный натрий горит, когда он
положить в емкость с газообразным хлором. В реакции ион натрия теряет
электрон с образованием катиона натрия и атом хлора одновременно получает
электрон с образованием хлорид-аниона. |
цинк и кислород | Образование оксида цинка: Окисление — это потеря электронов а уменьшение — это выигрыш электронов. Окисление металлического Zn O 2 с образованием ZnO (s) проиллюстрировано на молекулярном уровень.Показан перенос электронов от Zn к O 2 . Атомы можно наблюдать изменяться при окислении или восстановлении до ионной формы. |
Натрий и калий в воде | Образование гидроксида натрия и калия
Гидроксид: При добавлении небольшого количества Na
к раствору, содержащему индикатор, свидетельство реакции может быть
наблюдается по изменению цвета раствора по мере образования NaOH, по
плавление Na и движение Na, вызванное образованием водорода
газ. |
Одинарная замена Реакция
В единичной замене реакция (реакция вытеснения) один элемент заменяет аналогичный элемент
в комплексе. Одинарная замена реакции могут быть представлены следующими уравнениями.
AB + C AC + B
Утюг (III) Оксид и алюминий Реакция 2 | Реакция термитов: В реакции термитов Al
восстанавливает Fe 2 O 3 до Fe в чрезвычайно экзотермической реакции, в которой Al окисляется до
Аl 2 О 3 . В результате реакции выделяется достаточно тепла, чтобы расплавить железо. |
Медь (II) Оксид и углерод | Восстановление CuO: Когда сажа и черный оксид меди нагревают вместе Cu 2+ ионы восстанавливаются до металлической Cu и выделяется газ. Когда газ собирается в Ca (OH) 2 , образуется белый осадок CaCO 3 .Реакция, которая происходит восстановление ионов Cu 2+ углеродом, который окисляется в CO 2 . |
Серебро Нитраты и медь | Образование кристаллов серебра: Когда
медная проволока помещается в раствор AgNO 3 , Cu восстанавливает Ag + до металлического Ag. |
Олово (II) Хлорид и цинк | Образование кристаллов олова: Окисление-восстановление химия Sn и Zn. Когда подкисленный Sn (II) Cl 2 добавляется в стакан, содержащий части Zn, часть Sn 2+ реагирует с H + в растворе с образованием газа H 2 .Немедленные изменения также могут наблюдаться на поверхности Zn, поскольку он быстро покрывается Sn кристаллы. После того, как реакция какое-то время прогрессирует, иглы Sn можно наблюдается на поверхности Zn. |
Двойная замена Реакция
в реакция двойного замещения, ионы двух соединений меняются местами в водный раствор
с образованием двух новых соединений. Реакция двойной замены может быть представлена следующим
уравнение.
Реакция двойной замены может быть представлена следующим
уравнение.
AB + CD AC + BD
Кальций карбонат и сернистая кислота | Эта мраморная статуя была разрушена кислотным дождем. Мрамор — это материал, имеющий CaCO 3 в качестве основного компонента. Кислоты реагируют и растворить мрамор.В кислота поступает из диоксида серы в атмосфере, соединяясь с водой с образованием сернистая кислота. |
Свинец (II) Нитрат и йодид калия | Водный раствор йодида калия добавляют к водной
раствор нитрата свинца (II) иодида свинца (II). Образование осадка происходит при
катионы одного реагента соединяются с анионами другого реагента с образованием
образуют нерастворимое или малорастворимое соединение. |
Разложение Реакция
В реакции разложения отдельное соединение подвергается реакция, которая дает два или более простых
вещества. Разложение Реакция может быть представлена следующим уравнением.
AB A + B
Вода в водород и кислород | Электролиз воды: Когда
постоянный ток проходит через воду, она разлагается с образованием кислорода и
водород.Объем газообразного водорода, образующегося на отрицательном электроде, составляет
вдвое больше объема газообразного кислорода, образовавшегося на положительном электроде. Этот
указывает на то, что вода содержит вдвое больше атомов водорода, чем атомов кислорода,
что является иллюстрацией закона постоянного состава. |
Азот Трииодид | Разложение Трииодид азота: Трииодид азота крайне неустойчиво в сухом состоянии.Прикосновение к нему пером заставляет его разлагаются взрывоопасно. Взрыв происходит, когда химическая энергия выделяется разложение трииодида азота до N 2 и I 2 . После взрыва можно наблюдать фиолетовые пары йода. |
Горение Реакция
в реакция горения, вещество соединяется с кислородом, выделяя большое количество энергии в виде
света и тепла.Для органических соединений, таких как углеводороды, продукты реакции горения — углекислый газ и вода.
СН 4 + 2 O 2 CO 2 + 2 H 2 O
Водород и кислород Реакция II | при горении водорода в качестве продукта реакции образуется водяной пар. |
Различный Вещества с кислородом | Реакция с кислородом. Сжигаются магний, стальная вата, белый фосфор и сера. в кислороде. Результирующие реакции представляют собой комбинированные реакции, в которых два вещества вступают в реакцию с образованием одного продукта.Продукты, образующиеся в этих реакциях являются MgO, Fe 2 O 3 , P 4 O 10 и SO 2 . Все эти реакции горения очень экзотермичны. |
фосфор и кислород | горение желтого фосфора происходит в кислородной атмосфере. |
Что такое экзотермическая реакция?
Джеральд Р. Ван Хек, профессор химии в колледже Харви Мадда, дает следующий ответ:
Изображение: NASA ЗАПУСК. Чтобы поднять космический корабль в воздух, необходимы высоко экзотермические химические реакции. Следующие за кораблем белые шлейфы — это газообразные продукты реакции, рассеивающие оксид алюминия. |
Мы все понимаем, что вода не закипает самопроизвольно при комнатной температуре; вместо этого мы должны его нагреть. Поскольку мы должны добавлять тепло, кипячение воды — это процесс, который химики называют эндотермическим. Ясно, что если одни процессы требуют тепла, то другие должны выделять тепло, когда они происходят. Они известны как экзотермические. Для целей этого обсуждения процессы, требующие или выделяющие тепло, будут ограничены изменениями состояния, известными как фазовые переходы, и изменениями в химическом составе или химическими реакциями.
Изменения состояния включают плавление твердого тела, замерзание жидкости, кипение жидкости или конденсацию газа. Когда пар, который представляет собой газообразную воду, конденсируется, выделяется тепло. Точно так же при замерзании жидкой воды выделяется тепло. Фактически необходимо постоянно отводить тепло от замерзающей воды, иначе процесс замерзания остановится. Наш опыт позволяет нам легко понять, что для кипячения воды или любой жидкости и, таким образом, преобразования в газ требуется тепло, а процесс является эндотермическим. Менее интуитивно понятно, что когда газ конденсируется в жидкость, выделяется тепло, и процесс является экзотермическим.
Возможно, легче объяснить экзотермический фазовый переход, используя следующий аргумент. В жидкую воду нужно было вложить энергию, чтобы она стала паром, и эта энергия не теряется. Вместо этого он задерживается газообразными молекулами воды. Когда эти молекулы снова конденсируются, образуя жидкую воду, энергия, вложенная в систему, должна высвободиться. И эта накопленная энергия испускается в виде экзотермического тепла. Тот же аргумент можно привести в отношении процесса замораживания: энергия вкладывается в жидкость во время плавления, поэтому замораживание жидкости в твердое тело снова возвращает эту энергию в окружающую среду.
И эта накопленная энергия испускается в виде экзотермического тепла. Тот же аргумент можно привести в отношении процесса замораживания: энергия вкладывается в жидкость во время плавления, поэтому замораживание жидкости в твердое тело снова возвращает эту энергию в окружающую среду.
Как и фазовые переходы, химические реакции могут происходить с приложением или выделением тепла. Те, которые требуют тепла, описываются как эндотермические, а те, которые выделяют тепло, как экзотермические. Хотя мы, как правило, хорошо знакомы с эндотермическими фазовыми переходами, мы, вероятно, еще лучше знакомы с экзотермическими химическими реакциями: почти каждый испытал тепло камина или костра. При сжигании древесины выделяется тепло за счет экзотермической химической реакции кислорода (O) с целлюлозой (C 6 H 10 O 5 ), основным химическим компонентом древесины, с образованием диоксида углерода (CO 2 ), пара. (H 2 O) и нагрейте.Химическая реакция, описывающая процесс: C 6 H 10 O 5 + 6O 2 = 6CO 2 + 5H 2 O + тепло.
В сегодняшнюю космическую эру, наверное, каждый видел запуск ракеты по телевидению или, если повезет, лично. В основе этих ракет лежат экзотермические химические реакции. В одном ракетном топливе используется смесь твердого перхлората аммония (NH 4 ClO 4 ) и металлического алюминия (Al) для производства твердого оксида алюминия, газообразной соляной кислоты, газообразного азота, пара и тепла: химическая реакция может быть описана как 6NH 4 ClO 4 + 10Al = 5Al 2 O 3 + 6HCl + 3N 2 + 9H 2 O + тепло.
Огромные клубы белых облаков, видимые за запущенными ракетами, на самом деле представляют собой газообразные продукты, рассеивающие порошок белого оксида алюминия. Откуда берется экзотермическая тепловая энергия? Тепло исходит из энергии, хранящейся в химических связях молекул реагентов, которая больше, чем энергия, хранящаяся в химических связях молекул продукта. В эндотермических химических реакциях ситуация обратная: больше химической энергии хранится в связях молекул продукта, чем в связях молекул реагентов.
Химические изменения | |||
I Это F нашего июля в Провиденс, Род-Айленд. Блестящий фейерверки взрываются в ночном небе. Когда ты смотришь на фейерверк, вы видите ослепительные искры красной, белой и синей струйкой вниз во всех направлениях. Взрыв фейерверка — это пример химического изменения. Во время химического изменения вещества заменяются на другие вещества. Другими словами, состав изменения содержания. | |||
Знаки химических изменений Как узнать, является ли изменение химическое изменение? Если вы думаете, что не знакомы с химическими изменениями, подумай еще раз. | Физические изменения относительно легко
идентифицировать. Если изменяется только форма вещества, вы наблюдаете
физическое изменение. Обычное физическое изменение происходит, когда материя меняется от одной фазы к другой. Когда кубик льда тает за Например, становится жидкой водой. Твердый лед и жидкая вода имеют такой же состав. Единственное отличие — форма. | ||
| C ol o r
Изменения Как и в случае с осенними листьями, изменение окраски ключ, чтобы указать на химическое изменение. Возможно, вы нашли наполовину съеденное яблоко, которое коричневый. Причина в том, что химические изменения происходят, когда еда портит. | Вы только что стали свидетелями впечатляющего
химическое изменение, если вы видели изменение листьев
цвет осенью. | ||
| Когда ты испечь пирог, тесто поглощает энергию, поскольку оно превращается в жидкое смешать в торт. | энергии — Поглощено или высвобождено Еще один признак химического изменения — выброс или усиление энергии объектом.Многие вещества поглощают энергию, чтобы пройти через химическое изменение. Энергия поглощается во время химических изменений. в кулинарии, как при выпекании торта. | ||
| Энергия также может быть выпущена во время химической смены. Фейерверки
которые были упомянуты выше, выделяют энергию в виде света
что вы можете видеть. Вы также можете видеть, что энергия высвобождается в этом
видеоролик, когда натрий и хлор смешиваются с водой. | |||
| Запах
Изменения Достаточно одного опыта с тухлым яйцом, чтобы научиться что они пахнут иначе, чем свежие яйца. Когда портятся яйца и еда, они претерпевают химические изменения. Изменение запаха — ключ к разгадке химическая замена . | Когда вы чувствуете странный запах в еде такие как курица, свинина из майонеза, вы знаете, что еда подверглась химическое изменение.Вы можете использовать эту подсказку, чтобы не есть испорченные еда и заболевание. | ||
| Производство
Газы или твердые вещества Образование газа — ключ к разгадке химического
изменения. Пузырьки газа, которые вы наблюдали, образуются при приеме антацида.
падение в воду — пример перемен. Еще один признак того, что произошло химическое изменение, — это образование твердого тела.Твердое вещество, выделяющееся из раствора во время химическое изменение называется осадком. | |||
| Когда дерево горит, оно превращается в кучу золы и газы, поднимающиеся в воздух. После того, как дрова обожжены, его нельзя восстановлен в первоначальном виде в виде бревна. | Не легко
перевернутый Чем отличаются друг от друга физические и химические изменения Другой? Подумайте на мгновение о льду.После того, как лед тает в жидкую воду, вы можете повторно заморозить ее в твердый лед, если температура капли. Замораживание и таяние — это физические изменения. Вещества образуется во время химических изменений, однако не может легко вернуться в исходные вещества. | ||
| Химические и физические Смена | T Самая важная важная вещь , которую нужно запомнить, это
что при физическом изменении состав вещества не меняется
а при химическом изменении состав вещества
изменять. | ||
| Химическая промышленность
Реакции Химические изменения также называются химическими Реакции. Химические реакции включают сочетание различных вещества. В результате химической реакции образуется новое вещество с новым и различные физические и химические свойства. Дело никогда уничтожено или создано химическим путем реакции. Частицы одного вещества перестраиваются, образуя новое вещество. То же количество частиц, что существуют до реакции существуют после реакции. | |||
| Чтобы создать собственное химическое изменение,
нажмите на Fireworks. Найти
больше интересной информации о фейерверках, которые вы видите, нажмите
здесь. Хранение потребительских фейерверков в Род-Айленде запрещено законом. | |||
Энергия Изменения, сопровождающие химические реакции
Все изменения, химические или физические, сопровождаются изменением энергия. Каждая реагирующая молекула обладает определенным количеством энергии за счет природа химических связей.Так делает каждая молекула продукта. Поскольку облигации реагирующие молекулы разрываются и образуются новые связи продуктов, выделяется энергия или абсорбируется, в зависимости от того, имеют ли реагенты более высокую или более низкую энергию чем продукты.
Мы можем измерить изменение энергии несколькими способами. Два вида изменения энергии
Наиболее интересными для нас являются: (1) изменение свободной энергии (
G), который представляет собой энергию, доступную для полезной работы (обсуждается в главе 13),
и (2) изменение энтальпии (
H), которая представляет собой тепловую энергию, поглощенную или выделенную в результате реакции и измеренную
при постоянном давлении. Большинство химических реакций протекает при постоянном
давление атмосферы. Энергия, выделяемая или поглощаемая такими реакциями.
изменение энтальпии,
H, который можно представить как
Большинство химических реакций протекает при постоянном
давление атмосферы. Энергия, выделяемая или поглощаемая такими реакциями.
изменение энтальпии,
H, который можно представить как
H реакция = H продукты — H реагенты
В отчетных значениях H верхний индекс используется для обозначения температуры, при которой проводились измерения. сделали. Например, символ H 0 ° C показывает, что изменение энтальпии было измерено при 0 ° C.Если нет температуры Как показано, изменение энтальпии было измерено при 25 ° C. Все изменения измеряются при давлении в одну атмосферу.
Значение H дано
с уравнением относится к этому конкретному уравнению. При изменении энтальпии
был измерен, физические состояния компонентов были такими, как указано в
уравнение. Если физические состояния разные, будет другая энтальпия
изменять. Это различие иллюстрируется следующими двумя уравнениями для формации
воды. Они отличаются изменением энтальпии. В первом образуется газообразная вода,
а во втором — жидкая вода; разница между их энтальпиями
Изменения отражают разницу в содержании энергии между газом и жидкостью.
(См. Главу 9 для более подробного обсуждения
эта точка.)
Они отличаются изменением энтальпии. В первом образуется газообразная вода,
а во втором — жидкая вода; разница между их энтальпиями
Изменения отражают разницу в содержании энергии между газом и жидкостью.
(См. Главу 9 для более подробного обсуждения
эта точка.)
Изменение энтальпии, указанное для реакции, также зависит от коэффициентов используется в уравнении реакции.Таким образом, если уравнение образования воды написано
изменение энтальпии вдвое больше, чем в предыдущем уравнении для образование газообразной воды, когда коэффициент воды был 1. Эта последняя проблема можно решить, выполнив то же самое, что и в нескольких уравнениях, где мы сообщаем энтальпию изменение на моль одного компонента реакции, что устраняет любую двусмысленность в интерпретации.
A. Эндотермические и экзотермические реакции
Реакция с поглощением энергии — это эндотермическая реакция; изменение его энтальпии
(H) положительно. В
энтальпия продуктов реакции больше, чем у реагентов.
Энергия поглощается из окружающей среды. Следующие реакции являются эндотермическими.
В
энтальпия продуктов реакции больше, чем у реагентов.
Энергия поглощается из окружающей среды. Следующие реакции являются эндотермическими.
- Образование иодистого водорода:
- Разложение воды:
Реакция с высвобождением энергии является экзотермической реакцией; его энтальпия изменение отрицательное.Энтальпия продуктов меньше, чем у реагентов. Энергия передается в окружающую среду. Следующие реакции являются экзотермическими.
- Сжигание метана:
- Образование воды:
Обратите внимание, что разложение воды (уравнение b) является эндотермическим и требует расход энергии 285,8 кДж на моль разложившейся воды. Обратная реакция, образование одного моля воды из водорода и кислорода (уравнение d), является экзотермический и высвобождает 285.Энергия 8 кДж. Количество энергии такое же, но знак изменения энергии другой.
Другой пример — взаимосвязь между изменением энергии и направлением
одной из реакций является образование и разложение глюкозы. Глюкоза (C 6 H 12 O 6 )
образуется из углекислого газа и кислорода в клетках зеленых растений в
процесс называется фотосинтезом. Фотосинтез — это эндотермическая реакция. В
источником энергии для образования глюкозы является свет (лучистая энергия),
обычно от солнца.
Глюкоза (C 6 H 12 O 6 )
образуется из углекислого газа и кислорода в клетках зеленых растений в
процесс называется фотосинтезом. Фотосинтез — это эндотермическая реакция. В
источником энергии для образования глюкозы является свет (лучистая энергия),
обычно от солнца.
Таким образом, зеленые растения обладают замечательной способностью улавливать энергию солнечного света. и использовать эту энергию для производства глюкозы из двуокиси углерода и воды. Энергия хранится в глюкозе. Клетки животных и растений обладают одинаково замечательными способность метаболизировать глюкозу и использовать высвобождаемую энергию для поддержания температуры тела или выполнять биологическую работу, например сокращать мышцы или думать.
Пример Решение а. Изменение энтальпии положительное; реакция эндотермическая. В обратная реакция: б.Изменение энтальпии отрицательное; реакция экзотермическая. Обратное реакция: с. Изменение энтальпии отрицательное; реакция экзотермическая. Обратное реакция: |
Б. Стехиометрия изменений энергии Изменение энергии, связанное с реакцией, является стехиометрической величиной и
можно рассматривать арифметически, как и изменения массы в разделе 8.4. Для многих
реакции, изменения энтальпии были определены и занесены в таблицу в химическом
литература. Изменения, перечисленные в таких источниках, относятся только к форме
уравнение они сопровождают, как объяснялось ранее.
Пример Решение Уравнение Разыскиваются: Дано Коэффициенты пересчета Арифметическое уравнение |

 ):
):
 4} L} {\ text {1 mol} NO_2} \ right) = \ text {132 L} NO_2 (g) [/ latex]
4} L} {\ text {1 mol} NO_2} \ right) = \ text {132 L} NO_2 (g) [/ latex] Продукт реакции — ионный
соединение хлорид натрия, которое представляет собой наблюдаемое белое твердое вещество.
Продукт реакции — ионный
соединение хлорид натрия, которое представляет собой наблюдаемое белое твердое вещество. K более реакционноспособен, чем Na, о чем свидетельствует его реакция с водой.
В результате этой реакции выделяется достаточно тепла для воспламенения образовавшегося H 2 .
K более реакционноспособен, чем Na, о чем свидетельствует его реакция с водой.
В результате этой реакции выделяется достаточно тепла для воспламенения образовавшегося H 2 . Из-за
высокая температура, выделяемая в реакции термитов, используется в промышленности для
сваривать утюг.
Из-за
высокая температура, выделяемая в реакции термитов, используется в промышленности для
сваривать утюг. В то же время,
Cu окисляется до Cu 2+ .По мере протекания реакции можно видеть, что кристаллы Ag
образуются на медной проволоке, и раствор становится синим в результате
образование ионов Cu 2+ .
В то же время,
Cu окисляется до Cu 2+ .По мере протекания реакции можно видеть, что кристаллы Ag
образуются на медной проволоке, и раствор становится синим в результате
образование ионов Cu 2+ .

 Три воздушных шара с водородом и один шар
смешанные с водородом и кислородом образуют взрывоопасную смесь
Три воздушных шара с водородом и один шар
смешанные с водородом и кислородом образуют взрывоопасную смесь В
Главный продукт этой реакции — пятиокись фосфора.
В
Главный продукт этой реакции — пятиокись фосфора.


 однако есть еще много возможностей насладиться прекрасным
Показать.Хотя редко
случается, возможно, что компонент фейерверка упадет на землю
без взрыва. Что вы
делать?
однако есть еще много возможностей насладиться прекрасным
Показать.Хотя редко
случается, возможно, что компонент фейерверка упадет на землю
без взрыва. Что вы
делать? (2) Напишите уравнение обратной реакции:
и укажите сопутствующее изменение энтальпии, H
(2) Напишите уравнение обратной реакции:
и укажите сопутствующее изменение энтальпии, H (C 3 H 8 ).
(C 3 H 8 ).
Leave A Comment