Реакции с выделением газов — Справочник химика 21
Для приготовления соли Рейнеке 90 г роданистого аммония нагревают в фарфоровой чашке, непрерывно помешивая стеклянной палочкой. Когда соль почти расплавится, нагревание прекращают и тут же прибавляют небольшими порциями при перемешивании 30 г тонко растертого бихромата аммония. При этом происходит бурная реакция с выделением газов. Перемешивание продолжают и после добавления всего бихромата аммония до получения густой массы. Сырой продукт обрабатывают небольшими порциями воды при комнатной температуре сначала отмывают избыток бихромата аммония, затем выщелачивают соль Рейнеке. [c.164]РЕАКЦИИ С ВЫДЕЛЕНИЕМ ГАЗОВ [c.157]
Для зарядки аппарата Киппа нужно отобрать достаточно крупные гранулы цинка. Мелкие гранулы могут проваляться в нижний резервуар и там начнется реакция с выделением газа. В этом случае может возникнуть довольно значительное давление и кислота может быть выброшена через воронку. Чтобы исключить попадание твердого вещества в нижний резервуар, в отверстие между нижним и средним резервуаром вставляют резиновый диск с отверстием для трубки воронки. В нем прорезают несколько мелких отверстий, через которые свободно может пройти жидкость, но не провалятся гранулы цинка.
Для приготовления соли Рейнеке 90 г роданида аммония нагревают в фарфоровой чашке, непрерывно перемешивая толстой стеклянной палочкой. Когда соль почти расплавилась, нагревание прекращают и тут же прибавляют небольшими порциями и при перемешивании 30 г тонкорастертого бихромата аммония. При этом происходит бурная реакция с выделением газов. Перемешивание продолжают и после прибавления всего бихромата аммония до получения густой массы.
Реакции с выделением газов (газовыделительные реакции). Выше уже приводилась реакция растворения карбоната кальция в кислотах, при которой выделяется газообразный диоксид углерода. Укажем еще на некоторые газовыделительные реакции. [c.15]
В реакциях с выделением газов имеются две фазы, и так же как и реакции осаждения, экстракции, ионного обмена, реакции с выделением газов можно использовать для разделения, меняя pH раствора, создавая условия для образования комплексных соединений и т. п. Сдвигая равновесия в растворе в одну сторону, можно осуществлять и количественные определения.
В стакане происходит реакция с выделением газа СО3. Составить уравнение реакции. Когда выделение пузырьков газа сильно замедлится, нагреть стакан до 60—70 °С. Выделение пузырьков сначала усилится когда оно прекратится, можно считать реакцию законченной. Слить образовавшийся раствор с оставшихся кусочков мрамора и промыть их 2 раза дистиллированной водой методом декантации. [c.50]
В реакции с выделением газа измеряют объем его через некоторые промежутки времени. В качестве примеров можно привести реакцию металла с кислотой (рис. 14.2) и разложение пероксида водорода [c.325]
Тетрагидридоборат(П1) натрия Na[Bh5] вносят в горячую воду, при этом наблюдают выпадение осадка и выделение газа. Периодически определяют pH раствора. Установлено, что выделение газа уменьшается (до почти полного прекращения) при увеличении щелочности среды при подкислении реакция с выделением газа возобновляется. Объясните результаты опыта.
Необходимо контролировать равномерность распределения I, катализатора в смоле, а также определять температуру, при которой начинается экзотермическая реакция с выделением газов и паров, образующих в смоле пузырьки (температура газообразования). [c.97]
Выполнение опыта. В пробирку налить 5—7 капель 30 %-го раствора гидроксида натрия и опустить кусочек алюминия. Наблюдать протекание реакции с выделением газа.
Это же правило распространяется на растворы газов в жидкости и на смеси, при стоянии которых возможны реакции с выделением газов. [c.106]
Наблюдайте бурный процесс реакции с выделением газа. [c.224]
Чтобы получить хорошие полые гранулы, следует уничтожить плавающую пленку закиси меди. Для этого нужно ее восстановить до металлической меди. Этот процесс называют дразнением . Процесс дразнения проводят следующим образо.м. При неработающей форсунке в медь погружают конец сырого деревянного шеста и держат его в спокойном состоянии. При этом протекает реакция с выделением газов (водяной пар, углеводороды, сернистый газ), вследствие чего происходит бурное кипение меди и идет восстановление закиси меди в медь. По прошествии 5—8 мин дразнение прекращают. В печь на поверхность меди забрасывают серу и хорошо перемешивают гребками расплавленную медь для лучшего поглощения серы. Дальнейшая обработка меди идет по нормальному технологическому режиму.
Получение хлористой хлорметилртути [69]. В раствор 13,6 г сулемы в 200 мл эфира при размешивании пропускают эквимолекулярное количество диазометана (2,1 г), получаемого медленным прибавлением 12 г нитрозометилуретана к смеси 60 мл эфира, и 18 мл 25%-ного раствора едкого калн в метиловом спирте с такой скоростью, чтобы реакционная смесь была бесцветна. Быстро происходит реакция с выделением газа, под конец выделяются кристаллы. После испарения эфира остается хлористая хлорметил-ртуть. Выход количественный. Кристаллизация из спирта. Т. пл. 131°С.
В стакане происходит реакция с выделением газа СОз. Составить уравнение реакции. Когда выделение пузырьков газа сильно замедлится, нагреть стакан до 60—70°. Выделение пузырьков [c.47]
Такими условиями могут быть концентрация каждого из начальных и конечных веществ температура в сфере реакции для реакций с участием газов (хотя бы одного) и реакцией с выделением газов — давление. [c.11]
Глинистые материалы (глины и сланцы) содержат много минеральных компонентов в различных пропорциях и с повышением температуры в них и между ними происходят различные топохимические реакции с выделением газов. В области относительно низких температур выделяются пары воды — происходит сушка материала, а примерно от 500—700° С начинается разложение и взаимодействие различных окислов и органических составляющих. При более высоких температурах выделяющиеся газы могут в свою очередь реагировать с некоторыми твердыми компонентами (например, HgO + С
Другой реакцией, по-видимому, также протекающей по свободно-радикальному механизму, является алкилирование хинонного кольца перекисями ацилов нли тетраацнлатами свинца (М. Физер и др., 1942). Если раствор 2-метил-1,4-нафтохинона в уксусной кислоте нагревать с перекисью ацетила, взятой в количестве немного более 1 акв, или с 3— 4 экв тетраацетата свинца, то происходит энергичная реакция с выделением газа, и исходное вещество превращается в 2,3-диметилнафтохи-нон (т. пл. 127 °С)
www.chem21.info
Реакции ионного обмена » HimEge.ru
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (
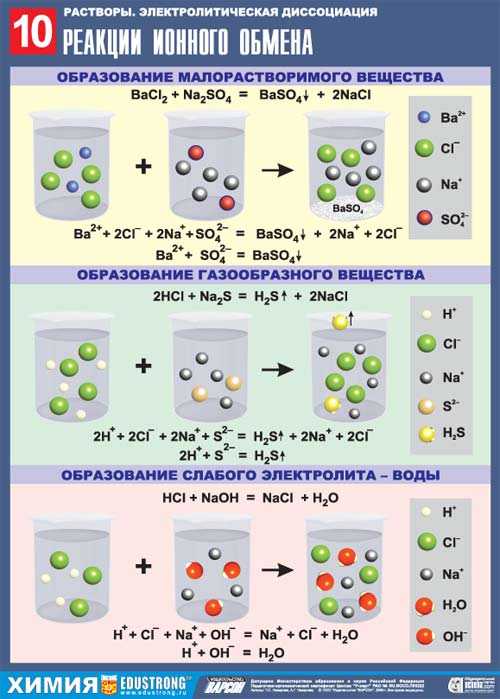
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в воде газов) или растворимые вещества — слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены.
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости.
Примеры реакций с выпадением осадков:
a) Ba(OH)
Ba2+ + SO42- = BaSO4↓
б) AgNO3 + KI = AgI↓ + KNO3
Ag+ + I— = AgI↓
в) MgCl2 + 2KOH = Mg(OH)2↓ + 2KCl
Mg2+ + 2OH— = Mg(OH)2↓
г) 3Zn(CH3COO)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6Na(CH3COO)
3Zn2+ + 2PO43- = Zn3(PO4)2↓
Обратите внимание, AgCO3, BaCO3 и CaCO3 ПРАКТИЧЕСКИ НЕРАСТВОРИМЫЕ В ВОДЕ И ВЫПАДАЮТ В ОСАДОК КАК ТАКОВЫЕ, НАПРИМЕР:
Ba2+ + CO32- = BaCO3↓
Соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимые в воде, но не осаждаются из водного раствора при проведении ионных реакций (т.е. их нельзя получить этим способом).
Например карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO
2FeSO4 + H2O + 2Na2CO3 = 2Na2SO4 + Fe2CO3(OH)2↓ + CO2↑
2Fe2+ + H2O + 2CO32- = Fe2CO3(OH)2↓ + CO2↑
Аналогично FeCO3, сульфид хрома (3) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
2CrCl3 + 6H2O + 3Na2S = 6NaCl + 2Cr(OH)3↓ + 3H2S↑
2Cr3+ + 6H2O + 3S2- = 2Cr(OH)3↓ + 3H2S↑
Некоторые соли разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома(III) Cr(CH3COO)3:
а) Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
б) Cr(CH3COO)3 + 2H2O= Cr(CH3COO)(OH)2↓ + 2CH3COOH
Следовательно, эти соли нельзя получить по обменной реакции в растворе:
а) 2AlCl3 + 6H2O +3K2S = 6KCl + 2Al(OH)3↓ +3H2S↑
2Al3+ + 6H2O + 3S2- = 2Al(OH)3↓ + 3H2S↑
б) CrCl3 + 2H2O + 3Na(CH3COO) =
3NaCl + Cr(CH3COO)(OH)2↓ + 2CH3COOH
Cr3+ + 2H2O + 3CH3COO— =
Cr(CH3COO)(OH)2↓ + CH3COOH
Примеры реакций с выделением газа:
а) BaS + 2HCl = BaCl2 + H2S↑
S2- + 2H+ = H2S↑
б) Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
CO32- + 2H+ = CO2↑+ H2O
в) CaCO3(T) + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
CaCO3(T) + 2H+ = Ca2+ + CO2↑ + H2O
Примеры реакций с образованием слабых электролитов:
а) 3NaOH + H3PO4 = Na3PO4 + 3H2O
3OH— + H3PO4 = PO43- + 3H2O
б) Mg(CH3COO)2 + H2SO4 = MgSO4 + 2CH3COOH
CH3COO— + H+ = CH3COOH
в) NH4F + HBr = NH4Br + HF
F— + H+ = HF
Если реагенты и продукты обменной реакции не являются сильными электролитам, ионный вид уравнения отсутствует, например:
Mg(OH)2(T) + 2HF = MgF2↓ + 2H2O
himege.ru
При соединении каких веществ выделяется газ?
Пиво и стенка желудка
Гарох + человек= газ
Мб щелочь + растворимое основание? Что-то типа того. Была какое-то уравнение, где водород выделяется
карбид кальция + вода = ацетилен
при разъеденении двух ягодиц
Бобы + человек = газ газ. напитки + человек = газ
1)Кислота (кроме НNO3)+металл (должен быть в ряду активности до водорода) =соль+Н2(газ) 2)Кислота+соль=кислота+соль (если в итоге реакции появились либо h3CO3 либо h3SO3,то они разлагаются на CO2(газ) и h3O(h3CO3),SO2(газ) и h3O(h3SO3)
touch.otvet.mail.ru
приведите пример выделения газа в результате химической реакции
Вот примеры, где в результате химической реакции выделяются газы: <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-643.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-644.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-645.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-646.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-647.jpg» ><img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-648.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-649.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-650.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-651.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-653.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-654.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-655.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-656.jpg» > <img src=»//otvet.imgsmail.ru/download/56abdb71f15fb427aa24f20ff3ac3544_i-657.jpg» >
горение! выделяется обычно углекислый газ и еще чего-нибудь
Уксуса или любой другой кислоты налей в соду или ее раствор, вот и получишь выделение углекислого газа…
херььььььььььььь
touch.otvet.mail.ru
Когда в реакции изменяется цвет, появляется запах, выделяется газ и растворяется осадок?
<a href=»/» rel=»nofollow» title=»15907216:##:1OQmRak»>[ссылка заблокирована по решению администрации проекта]</a>
Учи агрегатные состояния веществ и их физические характеристики. Что конкретно непонятно-то?
Наиболее частые признаки реакций — это образование (или растворение) осадков, т. е. нерастворимых в воде веществ, и выделение газа. Они легко видимы глазами. Изменение цвета, как и появления пахучих веществ — очень редко встречающиеся признаки, можно только запомнить некоторые. Например: Na2S + 2HCl = 2NaCl + h3S газ с очень неприятным запахом (тухлых яиц) FeCl3 + 3KSCN = 3KCl + Fe(SCN)3 растворимое вещество кроваво-красного цвета (исходные вещества — почти бесцветны)
touch.otvet.mail.ru
Ответы@Mail.Ru: вопрос по химии
Реакции ионного обмена протекают до конца в трех случаях: когда выделяется газ, осадок и вода. в результате реакции нейтрализации образуется вода, т. е. это один из вариантов реакций ионного обмена. а в твоем примере реакция вообще не идет, потому что реакция нейтрализации-это реакция, при которой взаимодействуют кислота и основание, а в результате образуется соль и вода. при этом происходит ионный обмен
Потому что реакция ионного обмена, вегда сопровождается либо выпадением осадка, либо образованием слаборастворимого соединения
реакции ионного обмена протекают до конца в трех случаях: когда выделяется газ, осадок и вода. в результате реакции нейтрализации образуется вода, т. е. это один из вариантов реакций ионного обмена. а в твоем примере реакция вообще не идет
потому что реакция нейтрализации-это реакция, при которой взаимодействуют кислота и основание, а в результате образуется соль и вода. при этом происходит ионный обмен
touch.otvet.mail.ru
Выделение — бурый газ — Большая Энциклопедия Нефти и Газа, статья, страница 1
Выделение — бурый газ
Cтраница 1
Выделение бурого газа МСЬ, замеченное при предварительном исследовании образца, служит доказательством присутствия нитрятов. Однако это наблюдение следует подтвердить, проделав следующие пеакции. [1]
На белом фоне наблюдают выделение бурого газа. [2]
Анионы МОГ открывают из отдельной пробы или действием минеральных кислот ( выделение бурого газа), или иодидом калия, или сульфаниловой кислотой и ос-нафтиламином. [3]
Анионы МОГ открывают из отдельной пробы или действием минеральных кислот ( выделение бурого газа), или иодидом калия, или сульфанило-вой кислотой и а-нафтиламином. [4]
Смесь цинка и сульфида цинка обработали концентрированной азот ной кислотой и увидели выделение красно бурого газа К полученному бесцветному раствору добавили хлорид бария, и выпал белый осадок, нерастворимый в азотной кислоте Какие вещества содержались в рас творе над осадком. [5]
При стирании цинкового порошка с твердым нитратом серебра происходит высокоэкзотермичная реакция, расплавление системы и выделение бурого газа. По окончании реакции остается темное твердое вещество. Протеканием какой реакции могут быть вызваны все эти эффекты. [6]
Тонко растертый реактив высушивают, нагревая в фарфоровой чашке прп перемешивании до момента, когда прекратится потрескивание и начнется выделение бурого газа. [7]
Тонко растертый реактив высушивают, нагревая в фарфоровой чашке при перемешивании до момента, когда прекратится потрескивание и начнется выделение бурого газа. [8]
Поместив его в фарфоровую чашку под тягой, прокаливают, перемешивая стеклянной палочкой до того момента, когда прекратится потрескивание и начнется выделение бурого газа, после чего ставят для охлаждения в эксикатор. [9]
Согласно условию задачи, металл, образовавшийся в результате разложения соли А ( уравнение 2), растворяется в концентрированной азотной кислоте с выделением бурого газа ( NO) и образованием исходной соли А, следовательно, соли А и Б — нитраты, поскольку они являются солями одной и той же кислоты. [10]
Гор заметил, что на платиновом катоде осаждается графи топодобная масса Снятая с электрода масса после промывки водой и сушки на воздухе стала серебристо белой и приобрела металлический блеск Когда химик попытался собрать ее с фильтровальной бумаги, серебристая масса с легким хлопком распалась, выделяя белый дым Остатки ее Гор обработал концентрированной азотной кислотой и увидел выделение красно бурого газа В результате у химика получился светло желтый порошок состава Э2О5 Что за вещество получил Гор. [11]
Если никакого газа не выделяется, раствор слегка подогревают. Выделение бурого газа NO2 ( двуокись азота) указывает на присутствие в растворе иона NO ( стр. [12]
Если никакого газа не выделяется, раствор слегка подогревают. Выделение бурого газа NO, ( двуокись азота) указывает на присутствие в растворе иона NO2 ( стр. [13]
Одним из способов определения солей азотной кислоты является следующий: в твердую соль добавляют серную кислоту и немного меди и слегка нагревают. При этом наблюдается выделение бурого газа. [14]
Серебро растворяется, и при реакции выделяются бурые ядовитые газы, поэтому операцию растворения серебра следует проводить под интенсивной вытяжкой или непосредственно в вытяжном шкафу. Нагревание ведут до полного растворения металлического серебра и полного прекращения выделения бурых газов. Растворенное серебро остужают, затем, перемешивая, добавляют 3 — 4 части дистиллированной воды. Если для приготовления азотнокислого серебра применяется легированное серебро с присадкой меди, то раствор азотнокислой меди удаляют промыванием хлористого серебра, которое готовят из азотнокислого. [15]
Страницы: 1 2
www.ngpedia.ru

Leave A Comment