KMnO4, степень окисления марганца и др элементов
Общие сведения о перманганате калия и степени окисления в KMnO4
Брутто формула – KMnO4. Молярная масса перманганата калия равна – 158 г/моль.
Рис. 1. Кристаллы перманганата калия. Внешний вид.
Раствор KMnO4 имеет темно-малиновый цвет, а при большой концентрации – фиолетовый цвет, свойственный перманганат ионам (MnO4—).
В ОВР проявляет сильные окислительные свойства (окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т.д.).
KMnO4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав перманганата калия, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления калия постоянна и равна номеру группы в Периодической таблице Д.И. Менделеева, в которой он находится, со знаком плюс, т.е. (+1).Степень окисления кислорода в составе неорганических кислот, а, следовательно, и в составе их кислотных остатков, всегда равна(-2). Для нахождения степени окисления марганца примем её значение за «х» и определим его при помощи уравнения электронейтральности:
(+1) + х + 4×(-2) = 0;
1 + х — 8 = 0;
x — 7 = 0;
x = +7.
Значит степень окисления марганца в перманганате калия равна (+7):
K+1Mn+7O-24.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| Определить кислотность pH | 0.76M(HCl)(solution) | ||
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| Найти число нейтронов | Fe | ||
| 8 | Найти число нейтронов | Tc | |
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | H_2O | ||
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | ||
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | ||
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| 37 | Найти число нейтронов | Na | |
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | H_2SO_4 | ||
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
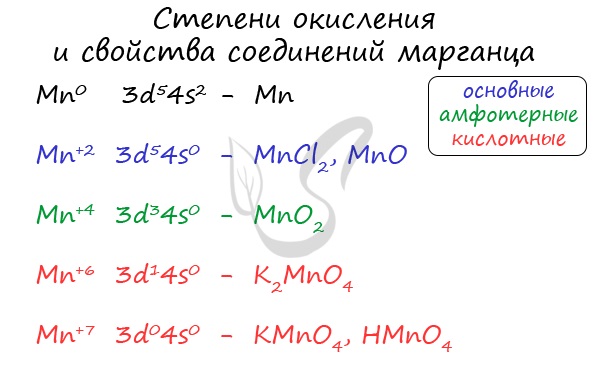
Марганец, цинк и серебро, подготовка к ЕГЭ по химии
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца II
Для соединений марганца II характерны основные свойства. Оксид марганца II может быть получен разложением карбоната марганца, либо восстановлением оксида марганца IV до оксида марганца II.
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца II.
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца II на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца IV.
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца II проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца II получается при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца IV проявляют амфотерный характер. Оксид марганца IV можно получить разложением нитрата марганца II.
Mn(NO3)2 = (t) MnO2 + NO2 + O2

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца VI — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца VII — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
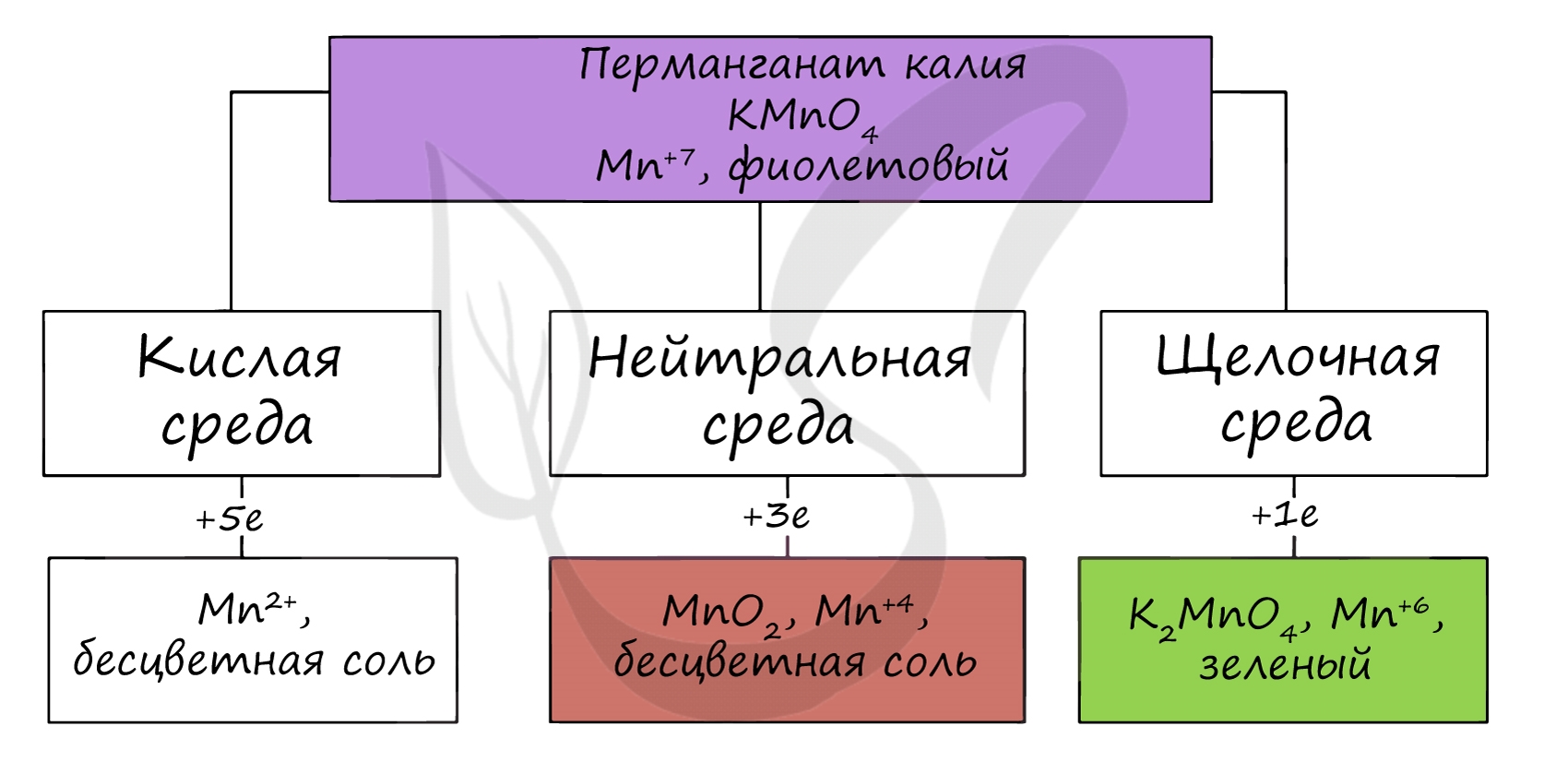
Оксид марганца VII получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4
При растворении оксида марганца VII (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца II.
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком 🙂
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
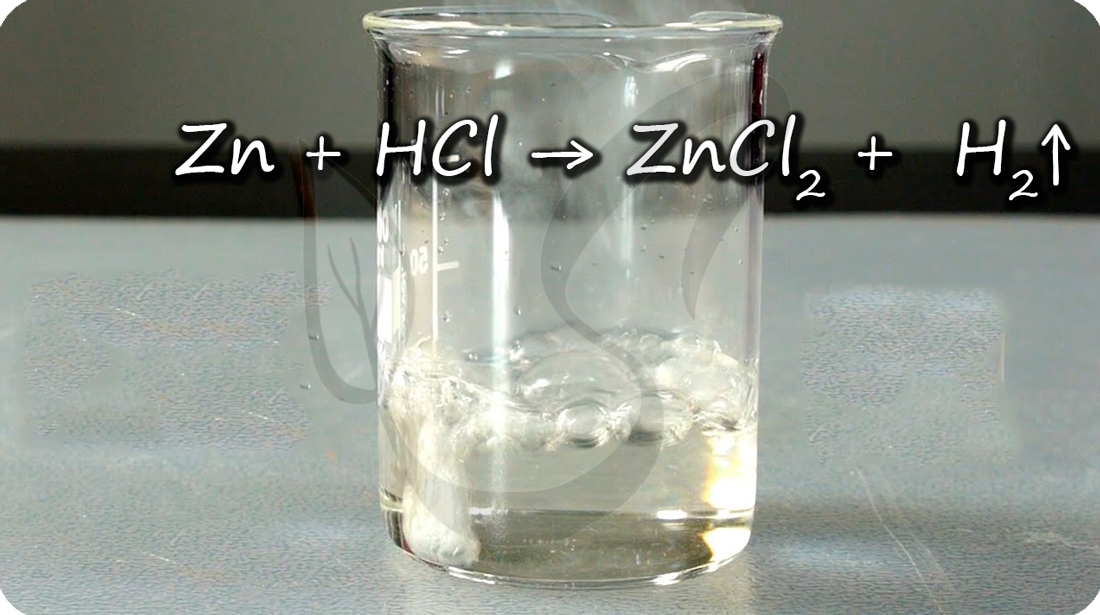
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка II
Эти соединения обладают амфотерными свойствами. Оксид цинка II можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка II проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка II может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка II получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка II обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ЕГЭ. Правила составления окислительно-восстановительных реакций (марганец)
8. Химические свойства соединений марганца с точки зрения изменения степеней окисления
Правило 8.1. В кислой среде соединения марганца, как правило, восстанавливаются до Mn+2, образуя соли соответствующих кислот:
Примеры реакций соединений с Mn+7:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn+4:
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn+6:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
Правило 8.2. В щелочной среде, как правило, реакции протекают с образованием соединений Mn+6, т.е. манганат-иона:
Примеры реакций соединений с Mn+7:
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn+4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
Правило 8.3. В нейтральной среде соединения Mn+7, как правило, восстанавливаются до Mn+4, образуя оксид марганца (IV):
Примеры реакций соединений с Mn+7:
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
алкенов и манганат калия (VII) (перманганат)
Если продукт имеет одну углеводородную группу и один водород
Например, предположим, что первая стадия реакции была:
В этом случае первая молекула продукта имеет метильную группу и водород, присоединенный к карбонильная группа. Это другой вид соединения, известный как альдегид.
Альдегиды легко окисляются с образованием карбоновых кислот, содержащих группу -COOH.Таким образом, на этот раз реакция пойдет на следующую стадию с получением этановой кислоты, CH 3 COOH.
Структура кислоты была немного изменена, чтобы она больше походила на то, как мы обычно извлекаем кислоты, но в итоге кислород оказался между углеродом и водородом.
Таким образом, общий эффект манганата калия (VII) на этот вид алкена составляет:
Очевидно, если бы к обоим атомам углерода на концах двойной связи углерод-углерод был присоединен атом водорода, вы бы получили две молекулы карбоновой кислоты, которые могли бы быть одинаковыми или разными, в зависимости от того, были ли одинаковые алкильные группы. или другое.
Поиграйте с этим, пока не будете довольны. Нарисуйте несколько алкенов, каждый из которых имеет водород, присоединенный к обоим концам двойной углерод-углеродной связи. Меняйте алкильные группы — иногда одинаковые на каждом конце двойной связи, иногда разные. Окислите их, чтобы образовались кислоты, и посмотрите, что у вас получится.
Если продукт содержит два атома водорода, но не содержит углеводородной группы
Можно было ожидать, что при этом будет образована метановая кислота, как в уравнении:
Но это не так! Это потому, что метановая кислота также легко окисляется раствором манганата калия (VII).Фактически, он полностью окисляет его до двуокиси углерода и воды.
Таким образом, уравнение в таком случае могло бы быть, например:
Точная природа другого продукта (в данном примере пропанона) будет варьироваться в зависимости от того, что было присоединено к правому атому углерода в двойной связи углерод-углерод.
Если бы на обоих концах двойной связи было по два атома водорода (другими словами, если бы у вас был этен), то все, что вы получили бы, — это диоксид углерода и вода.
Сводка
Подумайте о обоих концах двойной связи углерод-углерод по отдельности, а затем объедините результаты.
Если на одном конце связи есть две алкильные группы, эта часть молекулы даст кетон.
Если есть одна алкильная группа и один водород на одном конце связи, эта часть молекулы даст карбоновую кислоту.
Если на одном конце связи есть два атома водорода, эта часть молекулы даст диоксид углерода и воду.
В чем смысл всего этого?
Работа с результатами поможет вам определить структуру алкена. Например, алкен C 4 H 8 имеет три структурных изомера:
Определите, какие из них дали бы каждый из следующих результатов, если бы их обрабатывали горячим концентрированным раствором манганата (VII) калия. Вышеуказанные изомеры: , а не в порядке A, B и C.
Не читайте ответы в зеленой рамке, пока не попробуете это.
Изомер A дает кетон (пропанон) и диоксид углерода.
Изомер B дает карбоновую кислоту (пропановую кислоту) и диоксид углерода.
Изомер C дает карбоновую кислоту (этановую кислоту).
Перманганат калия (Kmno4) | Применение, физические и химические свойства перманганата калия
Что такое перманганат калия?
Перманганат калия — это универсальное химическое соединение пурпурного цвета.
Это калиевая соль марганцевой кислоты.
Также известный как перманганат калия, он имеет много других названий, таких как минерал хамелеон, кристаллы Конди и гипермаган.
Перманганат калия был впервые произведен немецким химиком Иоганном Рудольфом Глаубером в 1659 году, но вскоре о нем забыли.Он был заново открыт британским химиком Генри Конди, который производил дезинфицирующие средства, известные как «кристаллы Конди». Перманганат калия имел большой успех.
Обладает окислительными свойствами, поэтому нашло разнообразное применение в медицинской и химической промышленности.
Его химическая формула — KMnO4.
Физические свойства перманганата калия — KMnO4
Это химическое соединение ярко-фиолетового или бронзового цвета.
Имеет плотность 2.7 г / мл, а его молярная масса составляет 158,034 г / моль.
Состав не имеет запаха, то есть не имеет запаха, но имеет сладкий вкус.
Он имеет высокую температуру плавления 2400 C.
Он в основном встречается в виде порошка, кристаллов или таблеток.
Химические свойства перманганата калия
Перманганат калия растворим в ацетоне, воде, пиридине, метаноле и уксусной кислоте.Он также легко растворяется в неорганических растворителях.
Имеет насыщенный фиолетовый цвет в концентрированном растворе и розовый цвет в разбавленном растворе.
Концентрированные и разбавленные растворы перманганата калия
Не горючий, но поддерживает горение других веществ.
В нормальных условиях это очень стабильное соединение, но при нагревании разлагается с образованием MnO2 и высвобождением кислорода.
2KMnO4 ∆ → K2MnO4 + MnO2 + O2
Это сильный окислитель (соединение, которое может легко переносить свой кислород на другие вещества), образуя темно-коричневый диоксид марганца (MnO2), который окрашивает все, что есть органический.Он легко может принимать электроны от других веществ.
Он бурно реагирует с серной кислотой, приводя к взрыву.
Он немедленно вступает в реакцию с глицерином и простыми спиртами с образованием пламени и дыма.
Структура перманганата калия — KMnO4
Перманганат калия представляет собой ионное соединение, состоящее из катиона калия (K +) и перманганат-аниона (MnO4-).
В перманганат-анионе (MnO4-) атом марганца связан с четырьмя атомами кислорода тремя двойными связями и одной одинарной связью.Его структуру можно записать следующим образом.
Степень окисления марганца в этой соли +7.
Кристаллическая структура твердого KMnO4 орторомбическая. Каждая структура MnO4- присутствует в тетраэдрической геометрии.
Реакции перманганата калия (KMnO4)
Большинство реакций с перманганатом калия представляют собой окислительно-восстановительные реакции (химическая реакция, при которой одно вещество окисляется, а другое восстанавливается).
KMnO4 может окислять многие неорганические соединения.Среда раствора играет важную роль в определении продуктов реакции.
2KMnO4 + 5Na2SO3 + 3h3SO4🡪 2MnSO4 + 5Na2SO₄ + K2SO4 + 3h3O
2KMnO4 + 3K2SO3 + h3O 🡪 3K2SO4 + 2MnO2 + 2KOH
.Окисление органических молекул KMnO4
Перманганат калия, KMnO 4 , является мощным окислителем и имеет множество применений в органической химии.
Введение
Из всех окислителей, обсуждаемых в учебниках по органической химии, перманганат калия, KMnO 4 , вероятно, является наиболее распространенным и наиболее применимым. Как будет показано ниже, KMnO 4 можно использовать для окисления широкого спектра органических молекул.o = 0,6 \, V \]
Общая реакционная способность с органическими молекулами
KMnO 4 способен окислять атомы углерода, если они содержат достаточно слабые связи, включая
- атомов углерода со связями \ (\ pi \), как в алкенах и алкинах
- Атомы углерода со слабыми связями CH, такие как
- Углероды с исключительно слабыми связями CC, такие как
- CC-связи в гликоле
- CC-связи рядом с ароматическим кольцом И кислородом
KMnO 4 также окисляет фенол до пара-бензохинона.
Пример
Примеры углеродов, которые не окисляются
- Алифатические атомы углерода (кроме альфа-атомов углерода в ароматическое кольцо, как указано выше)
- Ароматические углеродные атомы (кроме фенола, как указано выше)
- Углероды без связи CH, за исключением в (3) выше
Исчерпывающее окисление органических молекул KMnO 4 будет продолжаться до образования карбоновых кислот. Следовательно, спирты будут окисляться до карбонилов (альдегидов и кетонов), а альдегиды (и некоторые кетоны, как в (3) выше) будут окисляться до карбоновых кислот.
Реакции со специфическими функциональными группами
Используя приведенные выше принципы, мы ожидаем, что KMno 4 будет реагировать с алкенами, алкинами, спиртами, альдегидами и ароматическими боковыми цепями. Примеры приведены ниже. Легче всего начать сверху.
Альдегиды
Альдегиды RCHO легко окисляются до карбоновых кислот.
Если не прилагать больших усилий для поддержания нейтрального pH, окисление KMnO 4 будет происходить в щелочных условиях.Фактически, наиболее эффективные условия для окисления альдегида KMnO 4 включают t -бутанола в качестве растворителя с буфером NaH 2 PO 4 . 2 Вышеуказанные реакции не являются сбалансированными уравнениями. Уравновешивание реакций потребует использования методов, изученных в общей химии, требующих половины реакций для всех процессов.
Спирты
Первичные спирты, такие как октан-1-ол, могут эффективно окисляться KMnO 4 в присутствии основных солей меди. 3 Однако продукт представляет собой преимущественно октановую кислоту с небольшим количеством альдегида, образующегося в результате чрезмерного окисления.
Хотя чрезмерное окисление представляет собой меньшую проблему для вторичных спиртов, KMnO 4 все еще считается не очень подходящим для превращения спиртов в альдегиды или кетоны.
Алкены 4
В мягких условиях перманганат калия может влиять на превращение алкенов в гликоли. Однако он способен к дальнейшему окислению гликоля с разрывом углерод-углеродной связи, поэтому необходим тщательный контроль условий реакции.Циклический сложный диэфир марганца является промежуточным звеном в этих окислениях, что приводит к образованию гликолей при присоединении syn .
При добавлении тепла и / или более концентрированного KMnO 4 гликоль может быть дополнительно окислен, разрывая связь C-C.
.Степени окисления марганца — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
Требуемое обучение | Необходимые СИЗ |
|---|---|
Основы безопасности в лаборатории UC | Лабораторный халат, защитные очки / защитные очки, нитриловые перчатки |
Оборудование | Химические вещества |
Четыре мензурки по 50 мл | 60 мл 0.01М КМно 4 |
Белый лист бумаги | 4 мл 3M H 2 SO 4 |
60 мл 0,02 М NaHSO 3 | |
6 мл 2M NaOH | |
Процедура:
- Налейте 15 мл 0.01M KMnO 4 на каждый из четырех стаканов объемом 50 мл, обозначенных A, B, C и D. Поместите стаканы на белый лист бумаги, чтобы улучшить видимость.
- Отложите стакан D в сторону для справки; это +7 степень окисления Mn (фиолетовый)
- В стакан A добавьте 4 мл 3M H 2 SO 4 (кислая среда). При перемешивании медленно добавить ~ 32 мл 0,02 М NaHSO 3 . Обратите внимание на изменение цвета от пурпурного до бесцветного. Это +2 состояние Mn
2MnO4 — (водн.) + H + (водн.) + 5HSO 3 — (водн.) ↔ 2Mn 2+ (водн.) + 5SO 4 2- (водн.) + 3H 2 O (л)
4) В стакан B добавьте 6 мл 2M NaOH (основное состояние).При перемешивании медленно добавить ~ 8 мл 0,02 М NaHSO 3 . Обратите внимание на изменение цвета с фиолетового на зеленый. Это +6 состояние Mn.
2MnO 4 — (водн.) + 3OH — (водн.) + HSO 3 — (водн.) ↔ 2MnO 4 2- (водн.) + SO 4 2- (водн.) + 2H 2 O (л)
5) При перемешивании медленно добавить ~ 20 мл 0.02M NaHSO 3 в стакан C (нейтральное состояние). Обратите внимание на образование коричневого осадка, указывающего на состояние +4 Mn.
OH — + 2MnO 4 — (водн.) + 3HSO 3 — (водн.) ↔ 2MnO 2 (с) + 3SO 4 2- ( водн.) + 2H 2 O (л)
Опасности:
Перманганат калия — сильный окислитель, поэтому держите его подальше от восстановителей.KMnO 4 также окрашивает кожу. Серная кислота и гидроксид натрия могут вызвать сильные ожоги. При попадании на кожу промыть большим количеством воды.
СОП:
Коррозионное вещество — гидроксид натрия, серная кислота,
Окислитель — перманганат калия
Утилизация (складское помещение)
Цель состоит в том, чтобы превратить все соединения марганца в Mn (II) и выбросить его в раковину. Наполните пластиковый контейнер объемом 1 л 200 мл водопроводной воды.Поочередно добавляйте в этот контейнер содержимое каждого стакана. При необходимости подкислите раствор 1M HCl. Добавляют 2% NaHSO3 небольшими порциями при перемешивании, пока весь коричневый диоксид марганца не уменьшится (раствор станет прозрачным). Нейтрализуйте и промойте раковину большим количеством воды (как минимум в 10 раз больше общего объема раствора).
.
Leave A Comment