Гидролиз в химии — что это такое? Примеры и определение
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
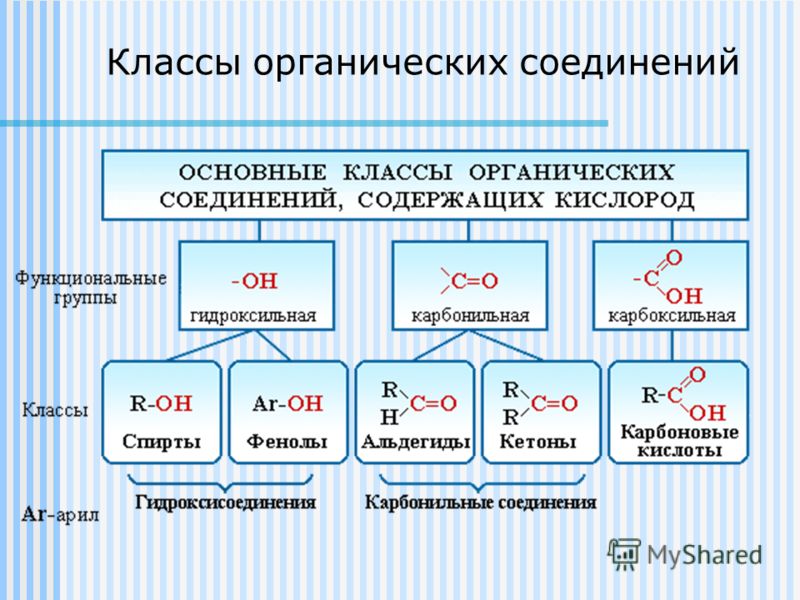
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения. |
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает в себя часть гидроксида и часть кислоты. За часть гидроксида отвечает катион металла, а за кислоту — анион кислотного остатка.
Например:
сульфат меди CuSO4 состоит из основания Cu(ОН)2 и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
карбонат натрия Na2CO3 состоит из основания NaOH и кислоты H2CO3.

В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H
Запоминаем!
Важное условие гидролиза — наличие в составе соли слабого иона.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так: XY + HOH = XOH + HY В данном случае: |
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Важно!
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
 Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.
Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Пример:
Нитрат аммония NH4NO3 состоит из слабого основания NH
Молекулярное уравнение: NH4NO3 + H2O ↔ NH3 · H2O + HNO3
Ионное уравнение: NH4+ + NO3− + HOH ↔ NH4OH + H+ + NO3−
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону.
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Пример:
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K+ + NO2− + HOH ↔ HNO2 + K+ + OH−
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Среда водного раствора: нейтральная.
Реакция индикаторов: могут не изменить свой цвет.
Пример:
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4+ + CN− + HOH ↔ NH4OH + HCN
Среда в данном случае будет нейтральной.
Обобщим все эти сведения в таблице гидролиза солей.
Важно!
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: KHCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Важно!
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто. В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимый гидролиз имеет место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
CaC2+ 2H2O= Ca(OH)2+ C2H2↑
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h = nгидр/nобщ. h — степень гидролиза, nгидр. — количество гидролизованного вещества, nобщ. — общее количество растворенного в воде вещества. |
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.

Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Бикарбонат натрия (NaHCO3) – структура, свойства и применение
Вы когда-нибудь пробовали испечь торт? Если да, то вы, вероятно, знаете, что пищевая сода является одним из основных ингредиентов воздушного торта. Химическое название пищевой соды — бикарбонат натрия, а ее молекулярная структура — NaHCO 3 . Пищевая сода, обычно доступная в виде мелкого порошка, имеет белый цвет. Николя Леблан, французский ученый, создал карбонат натрия, иногда известный как кальцинированная сода, в 1791 году. Рыбаки использовали бикарбонаты калия и натрия для сохранения рыбы в 1800-х годах. Позже, в 1846 году, два американских пекаря по имени Остин Черч и Джон Дуайт впервые произвели пищевую соду на своей фабрике с использованием карбоната натрия и углекислого газа.
Химическое название пищевой соды — бикарбонат натрия, а ее молекулярная структура — NaHCO 3 . Пищевая сода, обычно доступная в виде мелкого порошка, имеет белый цвет. Николя Леблан, французский ученый, создал карбонат натрия, иногда известный как кальцинированная сода, в 1791 году. Рыбаки использовали бикарбонаты калия и натрия для сохранения рыбы в 1800-х годах. Позже, в 1846 году, два американских пекаря по имени Остин Черч и Джон Дуайт впервые произвели пищевую соду на своей фабрике с использованием карбоната натрия и углекислого газа.
Химическое вещество производится в больших масштабах путем реакции холодных и концентрированных солевых растворов (хлорида натрия) с CO2 и аммиаком. Метод Solvay, используемый для производства карбоната натрия, выглядит следующим образом (стиральная сода).
Химическая реакция:
NaCl + H 2 O + CO 2 + NH 3 -> NH 4 Cl + Nahco 3
Одино . Он распадается на карбонат натрия и углекислый газ при нагревании до 373 К.
Он распадается на карбонат натрия и углекислый газ при нагревании до 373 К.
2NAHCO 3 -> NA 2 CO 3 + H 2 O + CO 2
Бикарбонатный бикарбонат натрие карбонат, пищевая сода. NaHCO 3 это формула бикарбоната натрия. В воде вещество, представляющее собой соль, разделяется на катион натрия (Na+) и карбонат-анионы (CO 3 –). Пищевая сода, обычно продаваемая в виде порошка, представляет собой щелочное белое кристаллическое вещество. На вкус немного соленый. В карбонат натрия при разложенииПищевая сода распадается на карбонат натрия, стиральную соду и воду при температуре выше 50 °C (122 °F). При типичных температурах выпечки разложение происходит довольно быстро и зависит от температуры. Реакция обезвоживания:
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
°F). Ответ:
Na 2 CO 3 → Na 2 O + CO 2
Сухие порошковые огнетушители на основе пищевой соды используют эту реакцию. Углекислый газ помогает потушить пламя.
Углекислый газ помогает потушить пламя.
- Его природа слабоосновная. Его щелочной рН обусловлен гидролизом бикарбоната натрия.
NaHCO 3 + H 2 O -> H 2 CO 3 + NaOH
H 2 CO 3 -> H 2 O+CO 2
- рН раствора бикарбоната натрия.
- Только частично растворяется в воде.
- Он имеет температуру плавления 500 °C и температуру кипения 8510 °C.
- Молекулярная масса составляет 84,0066 г/моль, что является молярной массой.
- С метилоранжем он становится желтым, тогда как фенолфталеин не вызывает изменения цвета.
- При нагревании разлагается с выделением углекислого газа и образует карбонат натрия. Пищевая сода подвергается этой реакции при нагревании во время приготовления пищи.
 Продукция производит разрыхлители и шипучие напитки.
Продукция производит разрыхлители и шипучие напитки.
2NAHCO 3 -> NA 2 CO 3 + H 2 O + CO 2
Структура бикарбоната натрия- NAHCO 3 ISIUM.
- Катион натрия (Na+) и анион бикарбоната (HCO 3-).
- Имеет моноклинную решетчатую структуру.
- Один атом натрия, один атом углерода, один атом водорода и три атома кислорода составляют соединение.
Пищевая сода является многофункциональным химическим веществом. Из-за его использования и разумной цены он стал типичным предметом домашнего обихода. Его многочисленные области применения включают:
Дома:- Это отличный бытовой химикат, в основном используемый в качестве чистящего средства, кулинарного ингредиента и дезинфицирующего средства.

- Такие продукты, как нут и желтый горошек, часто готовятся быстрее при добавлении пищевой соды.
- Старые ковры, коврики, шкафы, обувь, холодильники и пылесосы могут извлечь выгоду из его дезодорирующих свойств.
- Удаляет стойкие пятна с пола, одежды и мебели.
- Служит кондиционером и смягчителем воды, удаляет грязь с одежды при стирке.
- Белое горючее вещество также тушит пожары.
- Является основным компонентом порошковых огнетушителей и ручных многоцелевых огнетушителей.
- Многоцелевые огнетушители тушат различные виды пламени в домах, на рабочих местах и в автомобилях.
- Производители и пользователи шлифовальных машин в последнее время заинтересовались пищевой содой. Для сохранения или удаления верхнего слоя многих материалов, включая металл или дерево, сыпучий отбеливающий бикарбонат натрия является отличным абразивом.

Бикарбонат натрия, используемый в качестве вспомогательного средства для физических упражнений, был предметом исследований, хотя некоторые утверждают, что он может повысить уровень выносливости, что может повысить производительность. Помогая буферизовать любые кислотные отходы, которые появляются во время продолжительной активности, высокий уровень pH порошка снижает усталость у тех, кто занимается высокоинтенсивными видами деятельности.
В саду:- Бикарбонат натрия используется в качестве натурального инсектицида в саду для уничтожения опасных насекомых и грибков, наносящих вред растениям.
- Вы можете добавить его в почву, чтобы повысить уровень pH и сделать ее более щелочной. Некоторые растения предпочитают щелочные почвы.
- Также подходит для очистки садовых инструментов.
- В косметическом секторе также широко используется пищевая сода.
 Зубная паста, дезодоранты, маски для лица, пены для мытья тела и лица и гели содержат кристаллический бикарбонат натрия.
Зубная паста, дезодоранты, маски для лица, пены для мытья тела и лица и гели содержат кристаллический бикарбонат натрия. - Кроме того, это высоко ценимый ингредиент, используемый в косметических порошках, шипучих бомбочках для ванн, моющих средствах и таблетках, используемых для очистки брекетов или зубных имплантатов.
Поскольку бикарбонат натрия оказывает успокаивающее и осветляющее действие на кожу, его применение:
- Перед процедурами в спа-салонах или дома для очищения рук и ног,
- Производство кремов для ног и рук
- Делайте маски для волос от перхоти.
Новые продукты для мужчин, женщин и детей на основе натрия находятся в разработке. Жидкости для полоскания рта, отбеливающие зубные пасты и омолаживающие лосьоны содержат неорганическое вещество.
В медицине:- Применяется как антацид при изжоге и расстройстве желудка.
 Снижая желудочную кислоту, он действует быстро, принося мгновенное облегчение. Благодаря своему щелочному составу уменьшает расстройство желудка, нейтрализуя избыток соляной кислоты в желудке.
Снижая желудочную кислоту, он действует быстро, принося мгновенное облегчение. Благодаря своему щелочному составу уменьшает расстройство желудка, нейтрализуя избыток соляной кислоты в желудке. - Врачи используют инфузию 5% бикарбоната натрия при медицинских кризах, таких как тяжелая почечная недостаточность, сердечный приступ, неконтролируемый диабет и так далее.
- Из него изготавливают косметику, предметы личной гигиены и ухода за собой.
- Для уменьшения негативных последствий химиотерапии.
- Его противомикробные свойства делают его идеальным средством для чистки полости рта и зубов.
Во время беременности бикарбонат натрия, вводимый внутривенно (через IV) или перорально, ВОЗМОЖНО НЕБЕЗОПАСЕН. Это может повысить опасность дисбаланса рН тканей или задержки воды. Безопасность потребления бикарбоната натрия при грудном вскармливании недостаточно хорошо изучена. Избегайте использования, чтобы быть в безопасности.
Безопасность потребления бикарбоната натрия при грудном вскармливании недостаточно хорошо изучена. Избегайте использования, чтобы быть в безопасности.
При внутривенном введении младенцам и детям, находящимся под надлежащей медицинской помощью, бикарбонат натрия, возможно, безопасен. Из-за сообщений о том, что у молодых людей после употребления бикарбоната натрия (пищевой соды) повышается уровень соли в крови, это вещество ВОЗМОЖНО НЕБЕЗОПАСНО при нанесении на кожу. Когда дело доходит до безопасности перорального приема бикарбоната натрия детьми, достоверной информации недостаточно. Избегайте использования, чтобы быть в безопасности.
3. Диабетический кетоацидоз:Бикарбонат натрия повышает уровень кислот в крови, известных как кетоны, что связано с диабетическим осложнением, характеризующимся повышенным уровнем кислот в крови. Избегайте бикарбоната натрия, если у вас есть это состояние.
4. Отек (отек):
Отек (отек): Поскольку бикарбонат натрия содержит соль, он может повышать риск отека, вызванного избытком жидкости. Используйте бикарбонат натрия с осторожностью, если у вас есть сердечная недостаточность, заболевание печени или другие заболевания, которые могут привести к задержке жидкости.
5. Высокий уровень кальция в крови:Люди с высоким уровнем кальция в крови могут испытывать трудности с выделением бикарбоната. Следовательно, прием бикарбоната натрия может повысить вероятность таких проблем, как молочно-щелочной синдром.
6. Гипертония:Бикарбонат натрия может повышать артериальное давление. Использование бикарбоната натрия следует избегать тем, у кого уже есть высокое кровяное давление.
7. Низкий уровень калия в крови:Бикарбонат натрия может снизить уровень калия в крови. Избегайте бикарбоната натрия, если у вас уже низкий уровень калия.
8. Дефицит железа:
Дефицит железа: Бикарбонат натрия снижает количество железа, поглощаемого организмом. Пациенты с дефицитом железа должны принимать бикарбонат натрия и препараты железа отдельно.
ЗаключениеЧтобы ответить простым языком, что такое бикарбонат натрия, нам нужно только помнить, что другое название бикарбоната натрия — пищевая сода. Понятно, что пищевая сода является важной молекулой соли и играет особую роль в наших домах и повседневной жизни. Если это разрешено, это может быть дешевым и легкодоступным решением, которое вы можете использовать для борьбы с проблемами со здоровьем зубов, усталостью при занятиях спортом и бытовыми запахами.
Часто задаваемые вопросы о бикарбонате натрия 1. Как бикарбонат натрия используется в качестве пищевой соды? Пищевая сода является основным ингредиентом при создании разрыхлителя, который представляет собой комбинацию пищевой соды и умеренной кислоты, такой как винная кислота. При выпечке хлеба, пирожных и т. д. этот разрыхлитель является разрыхлителем (химическое вещество, которое добавляется в жидкое тесто и тесто, чтобы заставить тесто выделять газ, подниматься и расширяться). Когда разрыхлитель и вода в тесте смешиваются, натрий бикарбонат и винная кислота реагируют с образованием углекислого газа.
При выпечке хлеба, пирожных и т. д. этот разрыхлитель является разрыхлителем (химическое вещество, которое добавляется в жидкое тесто и тесто, чтобы заставить тесто выделять газ, подниматься и расширяться). Когда разрыхлитель и вода в тесте смешиваются, натрий бикарбонат и винная кислота реагируют с образованием углекислого газа.
NaHCO 3 + H+ (из винной кислоты) -> CO 2 + H 2 O + Тартрат натрия.
Образующийся углекислый газ способствует «подъему» и рыхлости тортов и хлеба. Без разрыхлителя пирог получается твердым и крошечным по размеру.
2. Как работают огнетушители из натронной кислоты? Пищевая сода является компонентом содовых кислотных огнетушителей. Этот огнетушитель имеет две емкости с раствором гидрокарбоната натрия и серной кислотой. Кислота вступает в реакцию с раствором соды, выделяя большое количество углекислого газа при нажатии на ручку огнетушителя. Вместе с протекающей жидкостью выделяется и газ CO2. Он попадает в горящий материал, блокируя подачу воздуха и гася пламя. Помимо охлаждения горящего материала, попадающая на него жидкость способствует снижению температуры воспламенения, что гасит огонь.
Он попадает в горящий материал, блокируя подачу воздуха и гася пламя. Помимо охлаждения горящего материала, попадающая на него жидкость способствует снижению температуры воспламенения, что гасит огонь.
В целом бикарбонат натрия не представляет опасности для человека. Однако, если потребляемое количество значительно возрастает, это может вызвать некоторые проблемы, такие как желудочно-кишечный дискомфорт, тяжесть в желудке, потеря аппетита, рвота и т. д. Вдыхание также может вызвать кашель и чихание. Врачи советуют своим пациентам избегать употребления бикарбоната натрия или пищевой соды, особенно пациентам с заболеваниями почек и беременным женщинам.
Бикарбонат натрия — NaHCO3 | Структура, применение и побочные эффекты бикарбоната натрия
Вы когда-нибудь пробовали печь торт? Если да, то вы, должно быть, знаете, что пищевая сода является одним из самых важных материалов, необходимых для получения пышного торта. Широко известная пищевая сода химически называется бикарбонатом натрия с молекулярной структурой NaHCO 3 . Пищевая сода белого цвета, в основном в виде мелкого порошка.
Широко известная пищевая сода химически называется бикарбонатом натрия с молекулярной структурой NaHCO 3 . Пищевая сода белого цвета, в основном в виде мелкого порошка.
В этой статье мы проведем подробное обсуждение темы бикарбоната натрия, чтобы дать учащимся полное понимание темы.
Table of Contents
Sodium Bicarbonate — An introduction
What is Sodium Bicarbonate
History of Sodium Bicarbonate
Production of Sodium Bicarbonate
Properties of Sodium Bicarbonate
Структура бикарбоната натрия
Использование бикарбоната натрия
Разница между пищевой содой и разрыхлителем
Основные выводы из главы
Часто задаваемые вопросы
Что такое бикарбонат натрия?
Это химическое соединение, состоящее из углерода, натрия, кислорода и водорода.

Это мононатриевая соль угольной кислоты.
Это белое кристаллическое твердое вещество без запаха, имеющее горький вкус.
Обычное название бикарбоната натрия: пищевая сода/пищевая сода/хлебная сода/бикарбонат соды. Он широко используется в хлебопекарной и фармацевтической промышленности.
История
Карбонат натрия или кальцинированная сода была получена французским химиком Николя Лебланом в 1791 году. В 1800-х годах рыбаки использовали бикарбонаты натрия и калия для сохранения рыбы. Позже, в 1846 году, два американских пекаря Остин Черч и Джон Дуайт впервые изготовили пищевую соду из карбоната натрия и углекислого газа на своей фабрике.
Происхождение
Нахколит — это минерал, в котором гидрокарбонат натрия встречается в природе. Это природный источник соединения, который также содержится во многих минеральных источниках.
Это природный источник соединения, который также содержится во многих минеральных источниках.
Производство бикарбоната натрия
В больших масштабах его можно производить путем взаимодействия холодных и концентрированных растворов рассола (хлорида натрия) с аммиаком и двуокисью углерода. Это процесс Solvay, используемый для производства карбоната натрия (стиральной соды).
Реакция может быть записана следующим образом:
\[ NaCl + H_{2}O + CO_{2} + NH_{3} \rightarrow NH_{4}Cl + NaHCO_{3} \]
Гидрокарбонат натрия является промежуточным продуктом этого процесса. При нагревании до 373 К он разлагается с выделением углекислого газа и образует карбонат натрия.
\[ 2NaHCO_{3} \rightarrow Na_{2}CO_{3} + H_{2}O + CO_{2} \]
Свойства бикарбоната натрия
Он слабоосновной по своей природе. Раствор бикарбоната натрия слабощелочной из-за гидролиза бикарбоната натрия.

\[ NaHCO_{3} + H_{2}O → H_{2}CO_{3} + NaOH \]
\[H_{2}CO_{3} →H_{2}O + CO_{ 2}\]
pH раствора гидрокарбоната натрия равен 8,3.
С фенолфталеином не меняет окраску, а метилоранж дает желтую окраску.
Умеренно растворим в воде.
Его температура кипения составляет 851°C, а температура плавления составляет 500°C.
Молярная масса или молекулярная масса составляет 84,0066 г/моль.
При нагревании разлагается с выделением углекислого газа и образованием карбоната натрия.
\[2NaHCO_{3} \rightarrow Na_{2}CO_{3} + H_{2}O + CO_{2}\]
Эта реакция происходит, когда пищевая сода нагревается в процессе приготовления.
 Он используется для приготовления разрыхлителя и шипучих напитков.
Он используется для приготовления разрыхлителя и шипучих напитков.
Структура бикарбоната натрия
Бикарбонат натрия можно химически записать как NaHCO 3 .
Состоит из катиона натрия (Na + ) и аниона бикарбоната (HCO 3 — ).
Имеет моноклинную решетчатую структуру.
(Изображение будет загружено в ближайшее время)
Использование бикарбоната натрия
Пищевая сода — универсальный компонент. Он довольно дешев и благодаря своей полезности стал обычным бытовым веществом. Его различные области применения:
В медицине —
В качестве антацида — используется для лечения несварения желудка и изжоги.
 Его быстрое действие обеспечивает временное облегчение за счет снижения кислотности желудка. Его щелочная природа нейтрализует избыток соляной кислоты в желудке и облегчает расстройство желудка.
Его быстрое действие обеспечивает временное облегчение за счет снижения кислотности желудка. Его щелочная природа нейтрализует избыток соляной кислоты в желудке и облегчает расстройство желудка.Инъекция 5% бикарбоната натрия проводится при неотложных состояниях, таких как серьезная почечная недостаточность, сердечный приступ, неконтролируемый диабет и т. д.
Используется для изготовления ушных капель.
Используется внутривенно для уменьшения симптомов химиотерапии.
Благодаря своим антибактериальным свойствам используется для чистки полости рта и зубов.
Дома-
Это чудодейственное химическое вещество в доме используется в основном как очищающее средство, ингредиент для приготовления пищи и дезинфицирующее средство.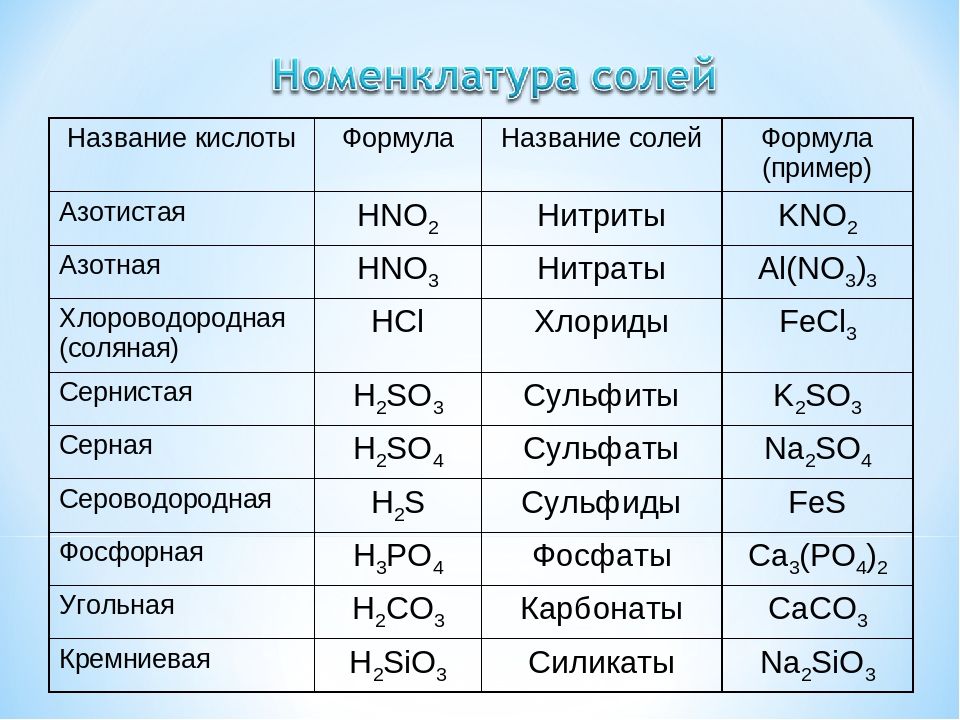 Его различные области применения:
Его различные области применения:
В качестве пищевой соды он используется для приготовления теста из муки. Пищевая сода используется для приготовления разрыхлителя, который представляет собой смесь пищевой соды и слабой кислоты, такой как винная кислота. Этот разрыхлитель используется в качестве разрыхлителя (химическое вещество, используемое в тесте и тесте, которое выделяет газ и заставляет тесто подниматься и расширяться) при выпечке хлеба, тортов, печенья, блинов, пирожков и т. д.
Когда разрыхлитель смешивается с водой, присутствующей в тесте для пирога, тогда гидрокарбонат натрия реагирует с винной кислотой с образованием углекислого газа:
NaHCO 3 + H + (из винной кислоты)→ CO + H 2 O + Тартрат натрия. Образующийся углекислый газ помогает пирогам и хлебу «подняться» и стать мягкими и пористыми. При отсутствии разрыхлителя пирог получается твердым и небольшого размера.
При отсутствии разрыхлителя пирог получается твердым и небольшого размера.
(Изображение скоро будет загружено)
Differences Between Baking Soda and Baking Powder
Baking Soda | Baking Powder |
Sodium bicarbonate | Sodium bicarbonate + cream of tartar |
Придает пище горький вкус, если не используется вместе с кислой средой, такой как пахта. | В пищевую соду добавляют винную кислоту, чтобы разрыхлитель не горчил при добавлении в пищу. Имеет нейтральный эффект. |
Имеет короткий процесс разрыхления, выделяет CO 2 при контакте с кислой средой. | Длительный процесс заквашивания, постепенное выделение CO 2 во время выпекания. |
Пищевая сода часто добавляется для более быстрого приготовления пищи, такой как грамм или чана.
Используется для приготовления газированной газированной воды и газированных напитков.
Пищевая сода используется в огнетушителях содово-кислотного типа. Этот огнетушитель содержит раствор гидрокарбоната натрия и серную кислоту в двух отдельных контейнерах внутри них. При нажатии на ручку огнетушителя кислота смешивается с раствором соды с образованием большого количества углекислого газа. Газ CO 2 выходит вместе с текущей жидкостью. Он падает на горящее вещество и перекрывает доступ воздуха, тем самым гася огонь.
Жидкость, попадающая на горящее вещество, также охлаждает его и способствует снижению температуры воспламенения, тем самым гася огонь.

Используется в качестве чистящего средства для мытья полов, умывальников, кухонной утвари и т. д.
Пищевая сода используется в качестве дезинфицирующего средства для уничтожения бактерий на поверхностях.
Используется для уничтожения тараканов и других вредителей.
Может использоваться для нейтрализации последствий коррозии.
Может использоваться в качестве дезодоранта для освежения старых ковров, ковриков, шкафов, обуви, холодильников и пылесосов.
Удаляет стойкие пятна с пола, одежды и мебели.
Используется при стирке белья для удаления грязи и в качестве кондиционера/смягчителя воды.

В саду-
Пищевая сода может использоваться в саду в качестве природного пестицида для уничтожения вредных вредителей и грибков, поражающих растения.
Его можно добавлять в почву для повышения уровня pH, чтобы почва стала щелочной. Некоторые растения предпочитают щелочные почвы.
Также можно использовать для очистки садовых инструментов.
Опасность для здоровья
Концентрированный раствор бикарбоната натрия вызывает сильное раздражение глаз и кожи. В обычных условиях не токсичен и не опасен. Передозировка бикарбоната натрия может привести к одышке, мышечным спазмам, изменениям настроения, подергиваниям и припадкам. Следует соблюдать осторожность при назначении бикарбоната натрия пациентам, страдающим почечной недостаточностью, высоким кровяным давлением, сердечной недостаточностью и камнями в почках.

 * 100%
* 100%
 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав Продукция производит разрыхлители и шипучие напитки.
Продукция производит разрыхлители и шипучие напитки.

 Зубная паста, дезодоранты, маски для лица, пены для мытья тела и лица и гели содержат кристаллический бикарбонат натрия.
Зубная паста, дезодоранты, маски для лица, пены для мытья тела и лица и гели содержат кристаллический бикарбонат натрия. Снижая желудочную кислоту, он действует быстро, принося мгновенное облегчение. Благодаря своему щелочному составу уменьшает расстройство желудка, нейтрализуя избыток соляной кислоты в желудке.
Снижая желудочную кислоту, он действует быстро, принося мгновенное облегчение. Благодаря своему щелочному составу уменьшает расстройство желудка, нейтрализуя избыток соляной кислоты в желудке.

 Он используется для приготовления разрыхлителя и шипучих напитков.
Он используется для приготовления разрыхлителя и шипучих напитков. Его быстрое действие обеспечивает временное облегчение за счет снижения кислотности желудка. Его щелочная природа нейтрализует избыток соляной кислоты в желудке и облегчает расстройство желудка.
Его быстрое действие обеспечивает временное облегчение за счет снижения кислотности желудка. Его щелочная природа нейтрализует избыток соляной кислоты в желудке и облегчает расстройство желудка.

Leave A Comment