Элементы кислотно амфотерные — Справочник химика 21
Периодичность изменения химических свойств элементов на примере их бинарных соединений с водородо.м и оксидов. Кислотные, основные и амфотерные свойства. [c.302]Характер оксида элементов главных подгрупп можно определить по положению элемента в таблице Д.И. Менделеева. Линия Ве—А1—Ge—Sn—РЬ соединяет элементы, все оксиды которых амфотерны. Левее этой линии амфотерные оксиды имеют галлий и индий. Амфотерным оксидом элемента, расположенного правее этой линии, является ЗЬгОз. Левее элементов с амфотерными оксидами в главных подгруппах расположены элементы, имеющие основные оксиды, а правее — элементы, имеющие кислотные оксиды . - [c.10]
Как видно из приведенных примеров, химическая природа однотипных оксидов и сульфидов, гидроксидов и гидросульфидов закономерно изменяется в пределах периода. Сульфиды, как и оксиды, бывают основными, кислотными и амфотерными. Основные свойства проявляют сульфиды наиболее типичных металлических элементов, кислотные — сульфиды неметаллических элементов. Различие химической природы сульфидов проявляется в реакциях сольволиза и при взаимодействии сульфидов разной химической природы между собой. Так,
Цинк принадлежит к группе элементов, образующих амфотерные гидроокиси вместе с бериллием, алюминием и хромом (4-я группа по кислотно-щелочному методу). Поэтому цинк отделяется от кадмия и ртути, которые реагируют с гидроокисью аммония, образуя комплексные аммиакаты. Кобальт, никель, медь, кадмий, ртуть образуют группу элементов, гидроокиси которых растворяются в гидроокиси аммония (6-я группа по кислотно-щелочному методу).
В соответствии с природой элемента в положительной степени окисления характер оксидов в периодах и группах периодической системы закономерно изменяется. В периодах уменьшается отрицательный эффективный заряд на атомах кислорода и осуществляется постепенный переход от основных через амфотерные оксиды к кислотным, например [c. 313]
313]
Деление оксидов на оснбвные и кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотер-ным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4 — 1,8 и степенями окисления (+2) — (+4). Если при степени окисления +2, +3 электроотрицательность менее 1,4, то оксиды (й отвечающие им гидроксиды) обладают оснбвными свойствами. Так, ОЭО [Са(+2)] составляет 1,0, ОЭО лантаноидов [Ьп (+3)] равна 1,2 — 1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С(+4), 81(+4), Се(+4) равны соответственно 2,6, 1,9 и 2,0. Если электроотрицательность элемента находится в пределах 1,4 — 1,8 или даже несколько превышает этот интервал, а степень окисления + 1, оксид принадлежит к оснбвным (у Ag ОЭО 1,9). Когда же степени окисления элементов превышают +4 и значения ОЭО высоки, соответствующие оксиды кислотные.
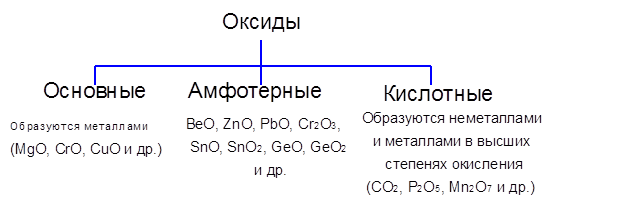
Окислы это соединения элементов с кислородом. По химическим свойствам они подразделяются на солеобразующие и несолеобразующие или безразличные. Солеобразующие окислы в свою очередь подразделяются на основные, кислотные амфотерные. Основным окислам отвечают основания, кислотным — кислоты. Амфо-терным окислам отвечают гидраты, проявляющие и кислотные, и основные свойства. Явление амфотерности рассматривается в 87. Безразличные окислы не образуют ни кислот, ни оснований. [c.36]
Подобно оксидам, фториды иногда подразделяют на основные, кислотные и амфотерные. К кислотным фторидам относятся фториды элементов подфупп 1УА- 11А периодической системы. Они реагируют с основными фторидами с образованием комплексных соединений, в которых катион — элемент основного фторида, а элемент кислотного фторида входит в состав комплексного аниона РРб]»-
На примере гидридов и оксидов типических элементов хорошо иллюстрируется корреляция между валентностью и номером группы элемента. Элементы, расположенные в левом нижнем углу периодической системы, представляют собой металлы. Они образуют ионные гидриды и оксиды, водные растворы которых обладают основными свойствами. Элементы, расположенные в верхнем правом углу периодической системы, являются неметаллами. Их соединения с водородом и оксиды представляют собой небольщие молекулы с ковалентными связями при нормальных условиях они существуют в форме жидкостей или газов и проявляют кйслотные свойства. В промежуточной части периодической таблицы между ее верхним правым и нижним левым углами находятся элементы, которые обнаруживают постепенно изменяющиеся свойства. По мере перехода от неметаллических элементов к семиметаллическим и далее к металлам их соединения с водородом становятся вместо кислотных инертными или нейтральными и далее основными (хотя эта общая закономерность осложняется многими отклонениями), а оксиды переходят более закономерным образом от кислотных к амфотерным и далее к основным.
Элементы, расположенные в левом нижнем углу периодической системы, представляют собой металлы. Они образуют ионные гидриды и оксиды, водные растворы которых обладают основными свойствами. Элементы, расположенные в верхнем правом углу периодической системы, являются неметаллами. Их соединения с водородом и оксиды представляют собой небольщие молекулы с ковалентными связями при нормальных условиях они существуют в форме жидкостей или газов и проявляют кйслотные свойства. В промежуточной части периодической таблицы между ее верхним правым и нижним левым углами находятся элементы, которые обнаруживают постепенно изменяющиеся свойства. По мере перехода от неметаллических элементов к семиметаллическим и далее к металлам их соединения с водородом становятся вместо кислотных инертными или нейтральными и далее основными (хотя эта общая закономерность осложняется многими отклонениями), а оксиды переходят более закономерным образом от кислотных к амфотерным и далее к основным.
Свойства гидроксидов (оксид-гидрокспдов) определяются характером электроположительного элемента. Гидроксиды активных металлов являются основаниями, т. е. акцепторами протонов. По мере уменьшения активности металлов, а особенно при переходе к неметаллическим элементам свойства их гидроксидов (оксид-гидроксидов) непрерывно изменяются происходит переход от типичных оснований к амфотерным соединениям и к кислотам, т. е. донорам протонов. В основных гидроксидах электроположительный элемент с кислородом связан ионной связью, а водород с кислородом — ковалентной. В кислотных гидроксидах, наоборот, связь кислорода с электроположительным элементом ковалентная, а с водородом — нонная или, во всяком случае, сильно полярная. Амфотерные гидроксиды обладают промежуточными свойствами. Изменение состава и характера гидроксидов (и оксид-гидроксидов) элементов можно видеть на примере соединений элементов третьего периода системы Д. И. Менделеева
Оксиды — соединения элементов с кислородом (кроме соединений фтора) не образуют соединений с кислородом только Не, Ые и Аг. Степень окисления кислорода в оксидах равна — II. По составу и химическим свойствам делятся на основные, кислотные, амфотерные, двойные и несолеобразующие оксиды.
Степень окисления кислорода в оксидах равна — II. По составу и химическим свойствам делятся на основные, кислотные, амфотерные, двойные и несолеобразующие оксиды.
Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются, В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (П1) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (III) по сравнению с бором (III), а также у алюминия (III) по сравнению с кремнием (IV) можно проиллюстрировать на следующих примерах [c.461]
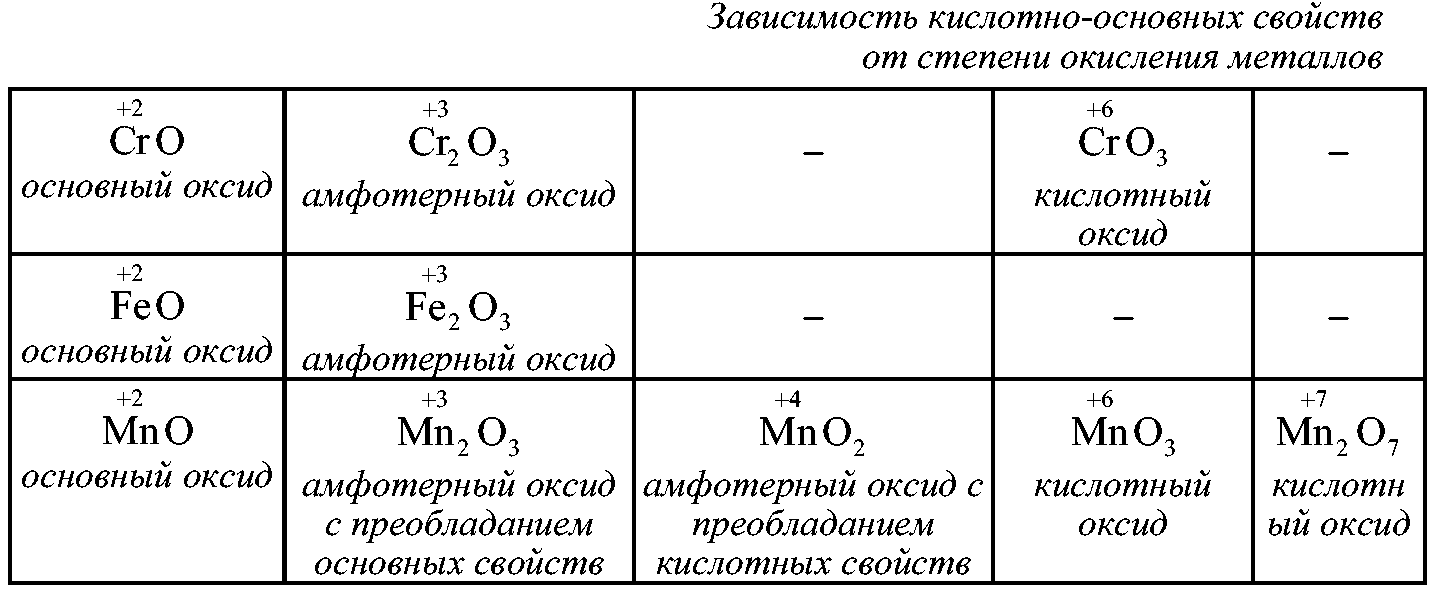
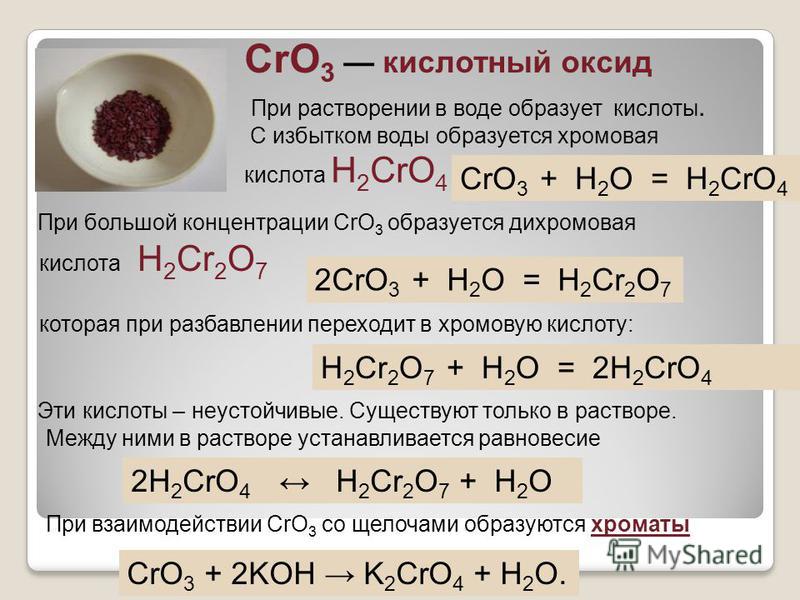
Как и для других d-элементов, для Сг, Мо и W при низких степенях окисления более характерны катионные комплексы, а при высокие — анионные комплексы= . Так, для Сг (III) возможны и катионные и анионные комплексы, тогда как для Сг (VI), Мо (VI) и W (VI) типичны анионные комплексы. В соответствии с этим, в част-ностр, СгО —основной оксид, СгаОз — амфотерный, а СгОз — кислотный.
Граница между металлами и неметаллами в периодической таблице проходит в диагональном направлении, смещаясь направо и вниз приблизительно от Ве и В к Ро и Ас. Оксиды элементов, расположенных на этой границе или вплотную к ней, часто проявляют амфотерные свойства (кислотные в одних условиях и основные в других), к числу оксидов с амфо- [c.456]
Если оксиды элемента побочной подгруппы расположить в ряд по мере возрастания степени окисления центрального атома, то амфотерный оксид разделит все оксиды на две группы. Оксиды, содержащие центральный атом в степени окисления, низшей, чем в амфотер-ном оксиде, будут основными, а в высшей — кислотными. Амфотерные оксиды элементов побочных подгрупп — СГ2О3, МпОг, СиО, ZnO — следует запомнить.
Э — элемент, образующий кислотный или амфотерный оксид. [c.80]
Оксиды — соединения элементов с кислородом.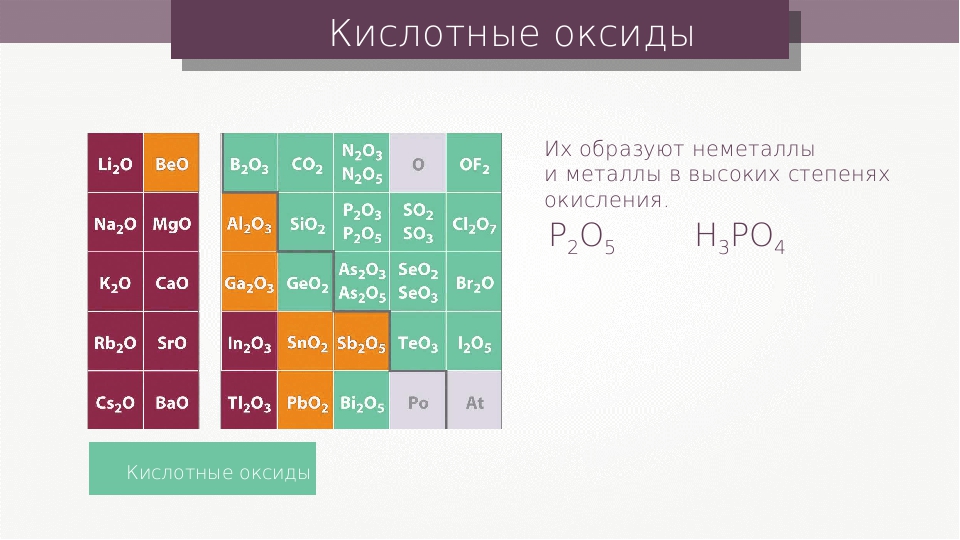 Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами.
Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами.
Элементы, обладающие постоянной валентностыв, образуют оксиды только одной из перечисленных групп (основные, кислотные, амфотерные). Элементы, проявляющие переменную валентность, могут образовывать различные оксиды. Например, марганец образует пять оксидов МпО, МпгОз, МпОг, МпОз и МП2О7. Два первых из них — основные, третий — ам-фотерный, а два последних — кислотные оксиды. [c.28]
Некоторые элементы в сильнокислых средах образуют комплексные ионы, например [ l l4] . Некоторые элементы (Сг, А1, 2п, РЬ) в щелочных растворах присутствуют в виде гидроксокомп-лексов. Эти элементы обладают амфотерными свойствами, т. е. в зависимости от кислотности среды проявляют свойства либо кислоты, либо основания. В кислой среде они ведут себя как основания, образуя при растворении соответствующие катионы, например 8п(ОН)2+2Н+ 8п2+- -2Н20
Для металлов р-элементов характерны амфотерные оксиды. Металлоиды образуют кислотные оксиды. Некоторые их производные—кислородсодержащие анионы (ЗЮз , ВОз -, РО4 , 804 , ОеОз ) образуют полиоксоанионы. Наибольшее разнообразие таких анионов (благодаря прочным —81—О—81—связям) у кремниевой кислоты (81207 -, 81з09 , 814012 -, 81б01б и др.). [c.406]
Оксиды -элементов в низких степенях окисления +2, -f-3 обладают основными свойствами. По мере повышения степени окисления элемента кислотный характер этих соединений усилнваетси. Амфотерными являются все оксиды элементов середин больших периодов в степени окисления +4. [c.500]
Напншите формулы возможных гидроксидов для всех р-элементов IVA группы.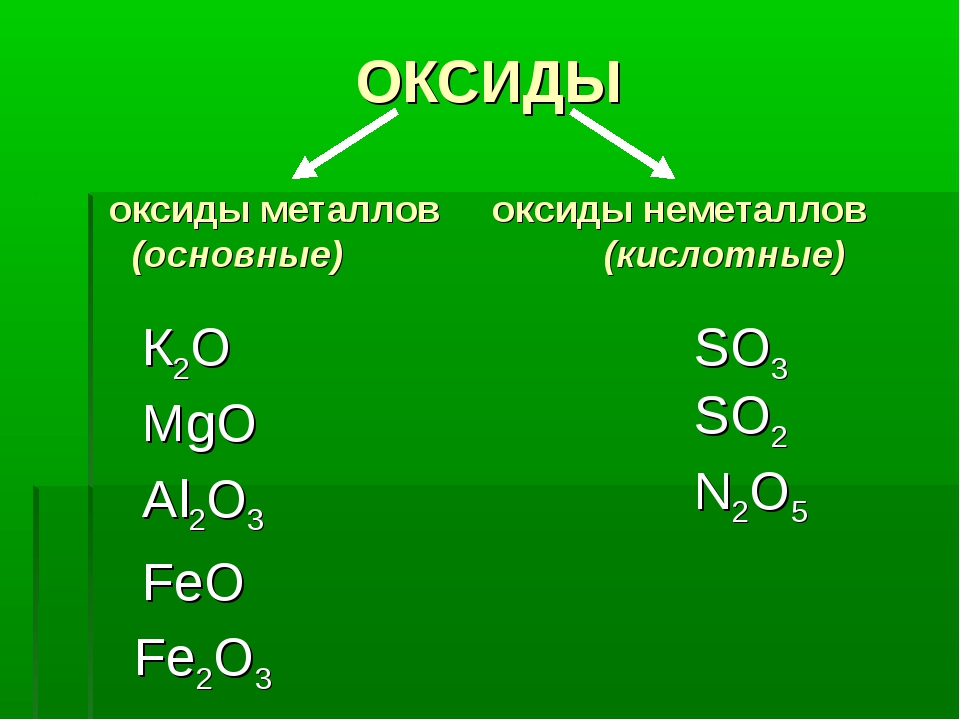 Укажите характер гидроксидов каждого элемента кислотный, основной, амфотерный. [c.169]
Укажите характер гидроксидов каждого элемента кислотный, основной, амфотерный. [c.169]
Деление оксидов на основные н кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотерным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4—1,8 и степенями окисления +2ч-+4. Если при степенях окисления +2, -ЬЗ электроотрицательность менее 1,4, то оксиды (и отвечающие им гидроксиды) обладают основными свойствами. Так, ОЭО 0Э0са(+2) составляет 1,0, ОЭО лантаноидов [Ln (+3)1 равна 1,2—1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С (+4), Si(+4), Ge (+4) равны, соответ- [c.62]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
Классификация анионов, как и катионов, связана с положением соответствующих элементов в периодической системе Д. И. Менделеева. Наиболее типичные и часто встречающиеся анноны образуются элементами II, III, IV и V периодов. В таблице на форзаце отмечены элементы, образующие амфотерные, кислотно-амфотерные, щелочноам-фотерные соединения в IV и V периодах — элементы, образующие анионы, находятся в 4-м и б-м рядах, а также составляющие семейства элементов переходных, побочных подгрупп. [c.42]
Теллур в анодном сплаве находится в виде механической примеси теллурида серебра Ag2Te в чистом серебре. Теллур, как элемент с амфотерными свойствами, в зависимости от рН среды может переходить в раствор как в виде анионов, так и в виде катионов.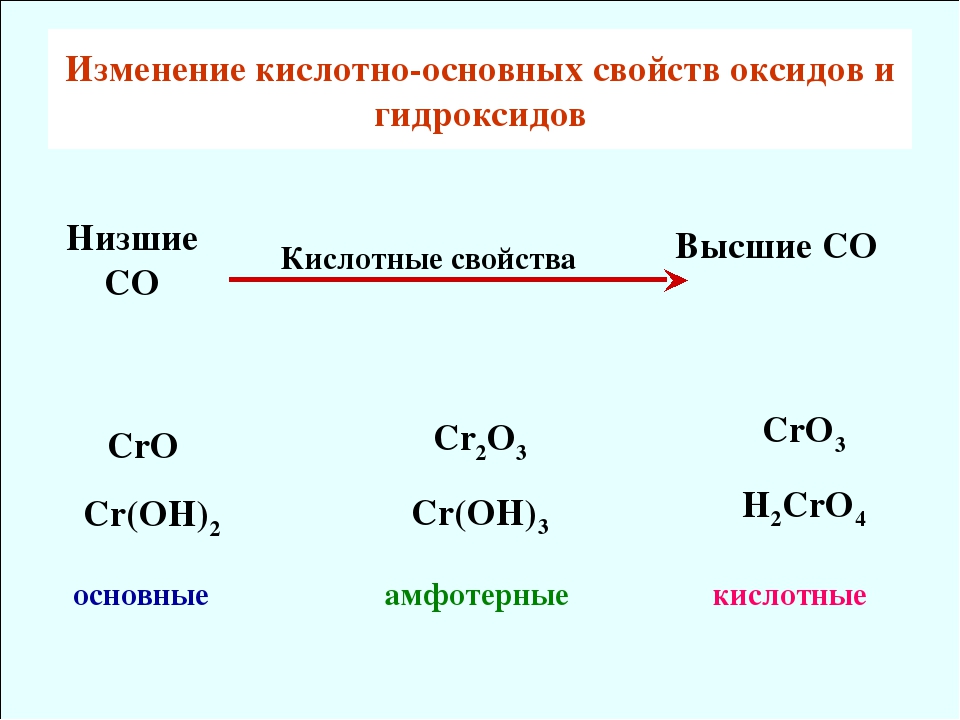 В кислой среде теллур находится в виде катионов Те +, в щелочной — в виде теллурат- и теллурит-ионов ТеО и ТеО [1, 2]. Для того чтобы полностью исключить попадание теллура в катодное пространство при наличии катионитовой мембраны, в анолите необходимо поддерживать щелочную среду (осуществить же это невозможно, так как в этом случае серебро будет выпадать в виде окиси серебра) или по возможности низкую кислотность, достаточную для того, чтобы серебро переходило в раствор в виде AgNOз. Очевидно, на характер перехода в раствор теллура в той или иной форме будет влиять и плотность тока. Как показала практика, до 80% теллура переходит в шлам в виде металлического теллура и Ag2Te, а также в виде теллу-ритов и теллуратов серебра. При использовании фильтрующей тканевой диафрагмы в катодный осадок теллур может попадать также из мелко взмученного шлама при применении ионообменной мембраны это полностью исключается. [c.262]
В кислой среде теллур находится в виде катионов Те +, в щелочной — в виде теллурат- и теллурит-ионов ТеО и ТеО [1, 2]. Для того чтобы полностью исключить попадание теллура в катодное пространство при наличии катионитовой мембраны, в анолите необходимо поддерживать щелочную среду (осуществить же это невозможно, так как в этом случае серебро будет выпадать в виде окиси серебра) или по возможности низкую кислотность, достаточную для того, чтобы серебро переходило в раствор в виде AgNOз. Очевидно, на характер перехода в раствор теллура в той или иной форме будет влиять и плотность тока. Как показала практика, до 80% теллура переходит в шлам в виде металлического теллура и Ag2Te, а также в виде теллу-ритов и теллуратов серебра. При использовании фильтрующей тканевой диафрагмы в катодный осадок теллур может попадать также из мелко взмученного шлама при применении ионообменной мембраны это полностью исключается. [c.262]
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так. в случае оксидов в ряду — ВеО — В2О3 — СО2 — N,05 по мере уменьшения степени полярности связи (уменьшения отрицательного эффективного заряда атома кислорода б) ослабляются основные и нарастают кислотные свойства Ы О — сильно основный оксид, ВеО — амфотерный, а В2О3, СО и ЫзОй — кислотные. [c.250]
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, окснд бора нмеет кислотный характер, оксиды алюминия, галлия и нндия — амфотерны, а оксид тал-лия(1П) имеет основной характер. [c.630]
Подобно оксидам фториды иногда подразделяют на основные, кислотные и амфотерные. Кислотными являются фториды элементов подгрупп IVA—VIIA периодической системы. [c.471]
Для каждого элемента с ростом степени окисления ш усиливается, кислотная активность оксидов.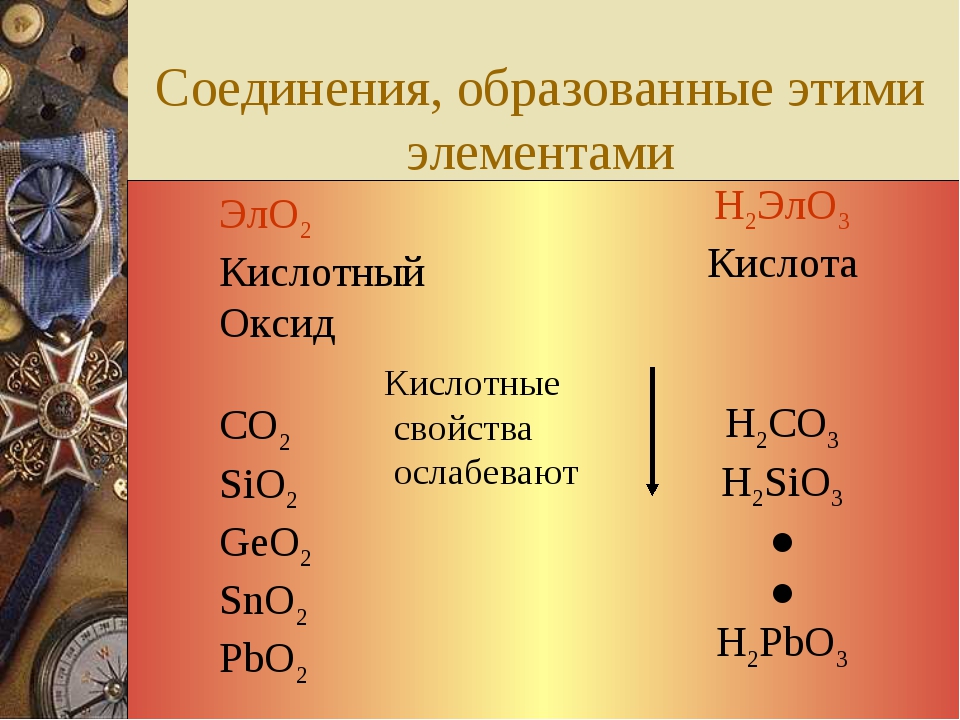 Так, ТГО — основной оксид (растворяется в разбавленных кислотах), ТГОг — амфотерный оксид, с небол эшнм преобладанием кислотных свойств [c.506]
Так, ТГО — основной оксид (растворяется в разбавленных кислотах), ТГОг — амфотерный оксид, с небол эшнм преобладанием кислотных свойств [c.506]
Эти элементы проявляют все степени окисления от О до+5. Рост ш отвечает усилению кислотных свойств и усилению тенденции к образованию комплексных соединений. Так, УО — основной оксид, растворяющийся в разбавленных кислотах (ему соответствует ос-1ювание У(0Н)2], а УаОз амфотерный оксид, малорастворимый в кислотах, у УОз основные свойства еще преобладают над кислотными [У(0Н)4 очень слабое основание], у УгОз, наоборот, преобладают кислотные свойства, это ангидрид слабой кислоты НУОз. [c.516]
Для элементов, проявляющих переменную валентность, влияние величины заряда выражается в следующей закономерности в низшей валентности элемент характеризуется основными свойствами, а в высшей — кислотными. Например, r дает типичное основание Сг ОН)г Сг(ОН)з обладает амфотерными свойствами, а Сг + образует кислоту Н2СГО4. [c.21]
А)кислотный оксид образует элемент, расположенный 1)во втором периоде, в l группе 2)в третьем периоде, в lll группе 3)во втором периоде, в v группе 4) в третьем периоде, в vlll группе б)гидроксиды элементов l группы главной подгруппы проявляют свойства 1) щелочей 2) нерастворимых оснований 3) кислот 4) амфотерных гидроксидов
1) Число протонов, нейтронов и электронов изотопа Sr-90 соответственно равно: ⁹⁰Sr (38p, 52n, 38e, )/ ответ: Б2) В атоме серы число электронов на внешнем электронном слое равно:
число электронов на внешнем слое соответствует номеру группы, т.к. сера в VI группе, то у нее на внеш.слое — 6 е
ответ: В
3) Атомы азота и фтора имеют одинаковое:
радиусы и число заполненных электронных слоев различаются т.к. они в разных периодах, заряды ядер тоже различны, сходны число внешних электронов
ответ: Б
4) В ряду Si → P → S → Cl неметаллические свойства: усиливаются
ответ: А
5) Высший оксид химического элемента № 15 ПСХЭ проявляет свойства:
№15 — это фосфор, его высший оксид P2O5 проявляет кислотные свойства
ответ: Б
6) Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами со следующим распределением электронов у атома со строением 2, 8, 8, 1
ответ: В
7) Химический элемент с распределением электронов 2, 8, 3 — это элемент алюминий, в ПСХЭ находится в 3 малом периоде, в III главной группе
ответ: Г
8) Химический элемент, образующий водородное соединение h5R, в ПСХЭ находится в группе № IV главной группе
ответ: Б
8) В ряду оксидов MgO → CaO → SrO → BaO основные свойства:
ответ: А) усиливаются;
9) Химический элемент, образующий высший оксид R2O7, в ПСХЭ находится в группе №: VII
ответ: Г
Задание 2.
 Дайте краткий ответ на вопрос.
Дайте краткий ответ на вопрос.Химические элементы, атомы которых имеют одинаковое число заполненных электронных слоев, в ПСХ составляют период.
Задание 3.
Установите соответствие между распределением электронов по слоям в атоме химического элемента и формулой его водородного соединения:
1-в,2-г,3-б,4-а
Задание 4.
Дайте развернутый ответ на вопрос.
Составьте электронные схемы строения атомов углерода и кальция.
C +12 ) ) 1s² 2s² 2p²
2 4
Ca +20 ) ) ) ) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s₂
2 8 8 2
Задание 5.
Дайте развернутый ответ на вопрос.
Охарактеризуйте химический элемент № 7 по изученному плану.
#7 — N
V главная группа, 2 малый период, 2 ряд
схема:
N +7 ) ) 1s² 2s² 2p³
2 5
неметалл
летучее водородное соединение: NH₃
высший оксид: N₂O₅
Задание 6.
Дайте развернутый ответ на вопрос.
Составьте формулы высших гидроксидов химических элементов с распределением электронов 2, 8, 1 и 2, 8, 6. Если эти гидроксиды взаимодействуют между собой, напишите уравнение химической реакции, а если не взаимодействуют, объясните причину этого.
NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
1 Химические элементы расположены в порядке возрастания атомных радиусов в ряду
№2.
ТЕСТ 1.
1. Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) B,C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
2. В атоме железа число свободных 3d – орбиталей равно
1) 0 2) 3 3) 1
3.В ряду химических элементов Li—Be—B—C
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4.Наибольшей восстановительной активностью обладает
1) Ca 2) K 3) AI 4) Si
5. У какого элемента наиболее выражены металлические свойства
1) Li 2) Fe 3) Na 4) Mg
ТЕСТ 2.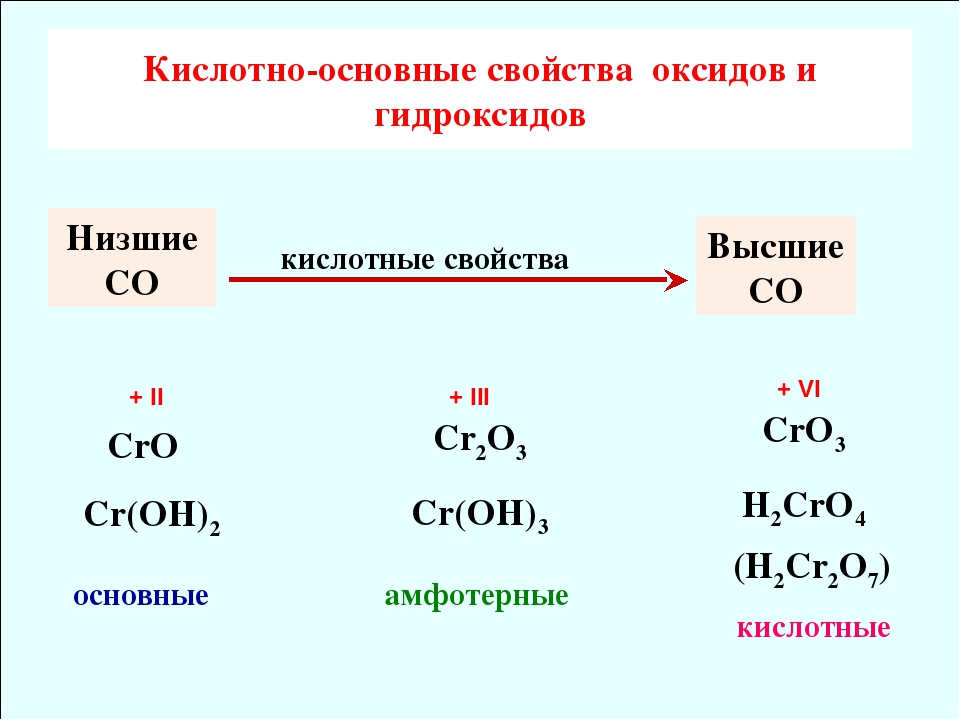
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду.
1) K, Rb, Cs 2) Rb, Sr, In 3) AI, Na, Mg 4) O, S, CI
2.В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением числа нейтронов в ядре
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением радиуса атомов
3.В ряду химических элементов Si—P—S—CI
1) увеличивается число электронных слоев в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) уменьшается радиус атомов
4.Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4)CI
5. Высший оксид состава ЭО образуют все элементы
1) IV A группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 3.
1. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Ga, Ge, As 2) AI, Ga, Ge 3) As, P,Ge 4) Se, As, Ge
2. Водородное соединение, окрашивающее раствор лакмуса в синий цвет, образует
1) углерод 2) азот 3) фтор 4) кислород
3.В ряду химических элементов Be—Mg—Ca—Sr
1) увеличивается число валентных электронов в атомах
2)уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4.Наименьшую энергию ионизации имеет
1) In 2) TI 3) Ga
5.Высший оксид состава ЭО2 образуют все элементы
1) IV Ф группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 4.
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Mn, Fe, Co 2) Mn, Cr, Fe 3) AI, Sc, Ti 4) Ni, Cr, Sc
2. В побочных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением радиуса атомов
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением заряда ядра
3. Соединения состава KH2ЭO4 и K2HЭO4 образует элемент
Соединения состава KH2ЭO4 и K2HЭO4 образует элемент
1) хлор 2) сера 3) азот 4) фосфор
4.Наибольшей восстановительной активностью обладает
1) Br 2) As 3) Ga 4) Ge
5. У какого элемента наиболее выражены металлические свойства
1) K 2) Rb 3) Cs 4) Sr
ТЕСТ 5.
1.Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) Zn, Cd, Ca 2) Br, CI, F 3)In, Sn, Sb 4) Br, Se, As
2. В атоме титана число свободных 3d орбиталей равно
1) о 2) 4 3) 2 4) 3
3.В ряду оксидов SiO2—P2O5—SO3—CI2O7 кислотные свойства 1)возрастают 2) убывают 3) не изменяются 4) сначала уменьшаются, потом увеличиваются
4. Наибольшей восстановительной активностью обладает
1) Mn 2) Ca 3) K 4) Rb
5. Соединение состава H2Э2 образует
1) углерод 2) кремний 3) бор 4) азот
ТЕСТ 6.
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду.
1) Pb, Sn, Ge 2) Ga, In, TI 3) K, Rb, Cs 4) Li, Na, Ca
2. в Главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
1) увеличении числа энергетических уровней 2) увеличении числа протонов в ядре 3) уменьшении радиуса атома 4) увеличении числа валентных электронов.
3.В ряду S—P—Si—AI
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) увеличивается высшая степень окисления элементов
4) ослабевают металлические свойства элементов.
4.Высшая степень окисления в ряду химических элементов
Галлий—германий—мышьяк – селен
1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5.Высший оксид состава Э2О3 образуют все элементы
1) III А группы 2) IV А группы 3) VI А группы 4) VII А группы
ТЕСТ 7.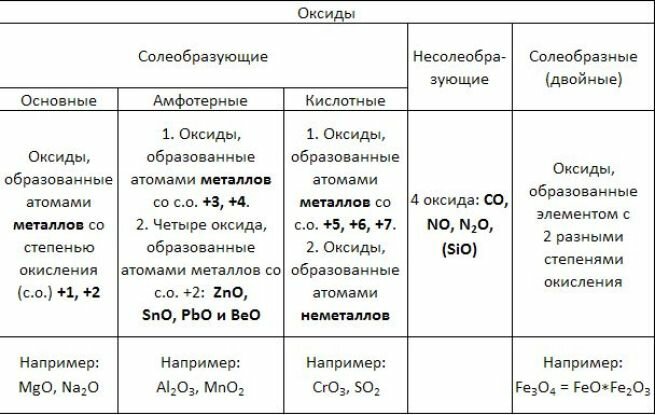
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
1) Ba, Cd, Ra 2) In, Pb, Sb 3) Cs, Na,H 4) Br, Se, As
2.В ряду элементов натрий—магний—алюминий возрастает их
1) атомный радиус 2) восстановительная способность 3) химическая активность 4) электроотрицательность
3.В ряду Mg—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4. Высшая степень окисления в ряду химических элементов
Индий—олово—сурьма—теллур
1) уменьшается 2) не изменяется 3) увеличивается 4) сначала увеличивается, затем уменьшается
5.У какого элемента наиболее выражены металлические свойства
1) Be 2) AI 3) Ca 4)Sr
ТЕСТ 8.
1.Химические элементы расположены в порядке увеличения атомных радиусов в ряду.
1) Zn, Ca, Cd 2) F, CI, Br 3) In, Sn, Sb 4) As, Se, Br
2. Простые вещества расположены в порядке усиления металлических свойств в ряду
1) Ca, K, AI 2) AI, Ga, Sr 3) Ca, Sc, Ti 4) Cr, Mn, Fe
3.В ряду AI—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4.Высшая степень окисления в ряду химических элементов
Титан—ванадий—хром—марганец 1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5. Основные свойства оксидов усиливаются в ряду.
1) Na2O, MgO,AI2O3 2) MgO,AI2O3 3) AI2O3, MgO, Na2O 4) AI2O3, Na2O,MgO
№3. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
ТЕСТ 1.
1.В молекуле CO2 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду представлены вещества только с ионной связью?
1) SiO2, CaO, Na2SO4 2)HCIO4, CO2, NaBr 3) MgO, NaI, CsO2 4) H2O, AICI3, PbI
3. Число σ – связей в молекуле бромбензола равно
1) 8 2) 6 3) 12 4) 7
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе
1) NH3 2) (NH4)2S 3) CCI4 4) SiF4
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) O3 u Na3N 2) O2 u NH3 3) O2 u HBr 4) O2 u S8
ТЕСТ 2.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) NaCI u CI2 2) HCI u O2 3) O3u HF 4) NH3 u H2O
2.Прочность углерод-углеродной связи в ряду
Пропан—пропен—пропин
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле серной кислоты равно
1) 4 2) 2 3) 8 4) 6
4.Химическая связь в молекуле этана и хлориде лития соответственно
1) водородная и ковалентная полярная 2) ковалентная слабополярная и ионная 3) ионная и ковалентная неполярная 4) ковалентная неполярная и ковалентная полярная
5.В оксидах металлов связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) ковалентная слабополярная
ТЕСТ 3.
1.В хлориде натрия химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду записаны вещества с ионной связью?
В каком ряду записаны вещества с ионной связью?
1) TiO2, Ca3N2, Na2S 2) KCIO3, C2H2, NaBr 3)CO, NaIO3, C2H5OH 4) H2S, AICI3, NaHCO3
3. Число σ – связей в молекуле этанола равно
1) 6 2) 8 3) 7
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе
1) OH— 2) SO42- 3) H3O+ 4) CaOH+
5.Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) N2 u O3 2) N2 u NO 3) N2 u NaCI 4) N2 u CaSO4
ТЕСТ 4.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) HI u H2 2) HCI u Ca 3) O3 u PH3 4) P4 u H2Se
2.Прочность углерод — углеродной связи в ряду
Этин- этилен- этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле оксида углерода (4) равно
1)2 2) 4 3) 1 4) 3
4.Химическая связь в молекулах хлористого метила и азота соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ковалентная полярная и ковалентная неполярная
4) ионная и ковалентная неполярная
5.В гидроксосоединениях неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 5.
1.В молекуле NH3 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2.Путем соединения атомов одного и того же химического элемента образуется связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3. Число σ- связей в молекуле этина равно
Число σ- связей в молекуле этина равно
1) 5 2) 4 3) 3
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе.
1) AI(OH)2+ 2) NH4+ 3)FeOH+ 4) CH4+
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) P4 u N2O 2) P4 u SO3 3) P4 u LiCI
ТЕСТ 6.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) I2 u H2Те 2) HBr u N2 3) Fe u HF 4) CO u SO2
2.Прочность углерод- углеродной связи в ряду
Этилен — этин – этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле фосфорной кислоты равно
1) 8 2) 1 3) 6 4) 2
4.Химическая связь в молекулах водорода и этанола соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5.Соединениями с ковалентной неполярной и ионной связью являются соответственно.
1) CO u O3 2) CaO u SO3 3) NH3 u H2 4) S8 u Li4Si
ТЕСТ 7
1.В молекуле HCI химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду записаны вещества только с ионной связью?
1) CH3COONa, AI4C3, Na2SO4,AI4C3, Na2SO4 2) KCI, CaH2, NaCI 3) CO, NaIO3, C2H5OH 4) S8 AI(NO3)3, O3
3. Число σ – связей в молекуле циклогексана равно
1) 12 2) 14 3) 18 4) 16.
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении.
5.В оксидах неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 8.
1.Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) донорно-акцепторная
2.Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
3.Число π – связей в молекуле этена равно
1) 1 2) 4 3) 2 4) 3
4.Химическая связь в хлориде бария и озоне соответственно
1) водородная и ковалентная полярная
2) Ковалентная и слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5. Ковалентная связь образуется за счет
1) неспаренных электронов с противоположными спинами
2) неспаренных электронов с одинаковыми спинами
3) полной передачи электронов внешнего энергетического уровня
4) полной передачи электронов внешнего и предвнешнего энергетических уровней.
№4 Электроотрицательность. Степень и окисления и валентность химических элементов.
ТЕСТ 1.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) S 3) Br 4)O
2. Степень окисления – 3 фосфор проявляет в соединении.
1) P2O3 2) P2O5 3) Ca3P2 4) Ca(H2PO4)2
3. Степень окисления азота в ионе NH4+ равна 1) +5 2) +3 3) -3 4) +1
4.Валентность III характерна для
1) Сф 2) P 3) O 4) Si
5. Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1) Rb, Ca, Li 2) H,Si,F 3) CI, I, Br 4) As, N, Te
ТЕСТ 2
1.Наибольшую степень окисления хром проявляет в соединении
1) K2Cr2O7 2) Cr2O3 3) Cr(OH)2 4) NaCrO2
2. В соединении NH3, N2O3, HNO2 степень окисления азота соответственно равна
1) -3, +3, +3 2) +3,+5,+4 3) +4,+3,+1 4) _3, +5,+3
3.Верны ли следующие утверждения?
А.Высшая валентность элемента определяется номером группы
Б.Высшая валентность элемента определяется номером периода
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов III А группы наиболее электроотрицательным является
1) AI 2) B 3) In 4) Ga
5.Все элементы в каком ряду могут проявлять степень окисления +5?
1) P, N, CI 2) C, Se, F 3) O,B,I 4) Br, As, Sn
ТЕСТ 3.
1.Наибольшую электроотрицательность имеет элемент
1) Na 2) Li 3) Rb 4) K
2. Степень окисления – 3 азот проявляет в соединении
1) N2O3 2) N2O4 3) NaNO3 4) NH4OH
3.Степень окисления азота в ионе NO2— равна
1) +5 2) +3 3) -3 4) +4
4.Валентность III характерна для
1) Be 2) F 3) AI 4) C
5. Все элементы в каком ряду проявлять степени окисления -3 и +5?
1) AI, Ca, Li 2) B, Sb, Bi 3) CI, I, Br 4)As, N, P
ТЕСТ 4.
1.Наибольшую степень окисления сера проявляет в соединении
1) KHSO3 2)Na2S 3) H2SO4 4) S8
2. В соединениях (NH4)2HPO4, (NH4)3PO3, Ca3P2 степень окисления фосфора соответственно равна
1) -5, +3, -3 2)+3,+5,-3 3) +5, +3,-3 4)-3,+5,+3
3. Верны ли следующие утверждения?
Верны ли следующие утверждения?
А.Высшая валентность элемента определяется числом неспаренных электронов в возбужденном состоянии и способностью элемента образовать связь по донорно- экцепторному механизму.
Б.Высшая валентность элемента определяется числом неспаренных электронов.
1) верно только А 2) Верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов IV группы наиболее электроотрицательным является
1) Si 2) Ge 3) C 4)Sn
5. Все элементы в каком ряду могут проявлять степень окисления -3? 1) Ga, AI, Be 2) C, Se, F 3) S, Br, In 4) P,N,Sb
ТЕСТ 5.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) P 3) As 4)Sb
2.Наибольшую степень окисления железо проявляет в соединении
1) K4[Fe (CN)6] 2) K3[Fe(CN)6] 3)FeO 4) Fe (OH)2
3. Степень окисления – 3 мышьяк проявляет в соединении
1) As2O3 2) Na3AsO4 3) CaAs2 4) As2O5
4. Степень окисления хрома в ионе CrO42- равна
1)+3 2) +4 3) -2 4) +6
5.Валентность III характерна для
1) O 2)In 3) Mg 4) Se
ТЕСТ 6.
1.Наибольшую степень окисления азот проявляет в соединении
1) HNO3 2) Na3N 3)N2O 4) N2H4
2. В соединениях NH4CI, LiCIO4, CI2O степень окисления хлора соответственна равна
1) -1, +7, +3 2) +3,+7,-1 3) -1, +5,-3 4) -1,+7,+1
3.Верны ли следующие утверждения?
А.Высшая валентность элемента определяется его порядковым номером
Б.Высшая валентность элемента определяется числом электронов на внешнем электроном уровне.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +7?
1) Sb,AI,Be 2) Sn , Te, F 3) CI,Br,I 4) P,N,O
5. Все элементы, в каком ряду могут проявлять степень окисления -2 +6?
Все элементы, в каком ряду могут проявлять степень окисления -2 +6?
TI, Ca, Sn 2) S, Se, Te 3) Si, Sb,Te 4)C,O,P
ТЕСТ 7.
1.Наибольшую электроотрицательность имеет элемент
1) Ca 2) As 3) Se 4) Br
2. Степень окисления – 2 сера проявляет в соединении
1) S8 2) Na2S 3) CaSO4 4) SO2
3/Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. количество валентных состояний и степеней окисления элемента определяется его природой и положением в периодической системе
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны.
4.Среди элементов 6 А группы наиболее электроотрицательным является
1) O 2) S 3) Se 4) Te
5.Валентность IV характерна для
1) Сa 2) P 3) O 4)Si
ТЕСТ 8.
1.Наибольшую степень окисления фосфор проявляет в соединении
1) KH2PO3 2) Na3P 3) H3PO4 4) P4
2. Степень окисления фосфора в ионе PO3-3 равна
1) +5 2) +3 3) -3 4) -5
3.Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. Число валентных состояний и степеней окисления элемент может быть разным
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +2?
1) С, Mg, Be 2) Ga, AI, Fe, 3) CI, Br, S 4) P, N, O
5. Какую валентность имеет железо в соединении, которое образуется при взаимодействии с соляной кислотой?
1) 1 2)2 3)3 4) 8
№5 Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки.
ТЕСТ 1.
1.Молекулярную кристаллическую решетку имеет соединение
1) H2S 2) NaCI 3)SiO2 4)Cu
2. Молекулярное строение имеет каждое из соединений:
Молекулярное строение имеет каждое из соединений:
1) C2H5OH, H2S 2) CaBr2, NO2 3) Ca (OH)2, NH3 4) KNO3, Na2S
3. Наиболее высокую температуру плавления имеет вещество
1) NaCI 2) H2O 3) C2H5OH 4) Cu
4.Вода имеет кристаллическую решетку
1) атомную 2) ионную 3) металлическую 4) молекулярную
5.Термин «молекула» применим к веществам, имеющими кристаллическую решетку
1) ионную 2) атомную 3)молекулярную 4) металлическую
ТЕСТ 2.
1.Молекулярную кристаллическую решетку имеет соединение
1) Na2SO3 2) CaO 3) S8 4)Mg2Si
2. Молекулярное строение имеет имеет каждое из соединений:
1) С6H5ONa, H2Se 2) CH4, NO2 3)BaCI2, NH3 4) NH2CH2COOH, Na2S
3. Наиболее высокую температуру плавления имеет вещество
1) NaOH 2) H2S 3) W 4) C2H5ONa
4.Фенол имеет кристаллическую решетку
1) атомную 2) металлическую 3) ионную 4) молекулярную
5.Вещества молекулярного строения характеризуются
1) низкой температурой плавления и кипения
2) непостоянством состава
3) высокой твердостью
4) электропроводностью
ТЕСТ 3
1.Молекулярную кристаллическую решетку имеет соединение
1) (NH4)2SO4 2) NiZn3 3) NO2 4)A4C3
2. Молекулярное строение имеет каждое из соединений: 1) C2H6, K2SO4 2) HBr, KNO2 3) C2H2, N2H4 4) BaO, Na2CO3
3. Наиболее высокую температуру плавления имеет вещество
1) HCI 2)NaOH 3) O2 4) C6H6
4. Иод имеет кристаллическую решетку
Иод имеет кристаллическую решетку
1) ионную 2) атомную 3) молекулярную 4) металлическую
5.Вещества молекулярного строения характеризуются
1) Высокой температурой плавления 2) постоянством состава 3) высокой твердостью 4) электропроводностью
ТЕСТ 4.
1.Молекулярную кристаллическую решетку имеет соединение
1) оксид фосфора (V) 2) хлорид бария 3) алмаз 4) гидроксид калия
2.Молекулярное строение имеет каждое из соединений:
1) H2O, K2SO4 2) C6H12O6, NH3 3) HCI, KNO3 4) BaO, Na2CO3
3.Наиболее высокую температуру плавления имеет вещество
1) HI 2) C12H22O4 3) N2 4) NaOH
4.Стеариновая кислота имеет кристаллическую решетку
А) атомную 2) ионную 3) металлическую 4) молекулярную
5.Вещества молекулярного строения характеризуются
1) высокой температурой плавления 2) низкой температурой кипения 3) твердостью 4) электропроводностью
ТЕСТ 5
1.Молекулярную кристаллическую решетку имеет соединение
1) хлорат калия 2) сульфид натрия 3) сухой лед 4) челийская селитра
2.Немолекулярное строение имеют все неметаллы группы
1) углерод,бор, кремний 2) фтор, бром, йод 3) кислород, сера, азот 4) хлор, фосфор, селен
3.Металлы имеют кристаллическую решетку
1) ионную 2) металлическую 3) молекулярную 4) атомную
4.Термин «молекула» применим к веществу
1) H2O 2) NaCI 3) Na2O2 4) AI4C
5. Вещества молекулярного строения не характеризуются
1) низкой температурой плавления и кипения
2) постоянством состава
3) твердостью
4) невысокой электропроводностью
ТЕСТ 6
1.Молекулярную кристаллическую решетку имеет каждое из соединений
1) фтор и иод 2) оксид углерода (4) и золото 3) бром и железо 4) латунь и сульфат натрия
2. Немолекулярное строение имеет каждое из соединений:
Немолекулярное строение имеет каждое из соединений:
1) H2O, H2SO4 2) I2, CO 3) CaO,AI4C3 4) KNO3, O2
3. Кристаллическая сера, имеет кристаллическую решетку
1)атомную 2) ионную 3) молекулярную 4) атомно-ионную
4.Термин «молекула» применим к веществу
1) С6H5ONa 2) CH3COONa 3) CH2O 4) NH2CH2COOK
5.Ионную решетку имеет каждое из двух веществ:
1) NaCI, H2S 2) KF, H2O 3) HNO3, Cs2S 4) Na2CO3, K2S
ТЕСТ 7.
1.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) хлорид натрия и алмаз
2) оксид углерода (4) и кремний
3) алмаз и графит
4) оксид кремния (4) и белый фосфор
2.Немолекулярное строение имеет каждое из соединений:
1) Cu, H2S 2) Ag, CO2 3) LiCIO3, N2O 4) CsCI, K3PO3
3. Кварц имеет, кристаллическую решетку
1) ионную 2) молекулярную 3) атомную 4) металлическую
4.Термин «молекула» не применим к веществу
1) Na3N 2) SO2 3) O3 4) P4
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) O2, BaSO3 2) CO2, Na2S 3) O3, Cs2S 4) KF, K2O
ТЕСТ 8.
1.К веществам с атомной кристаллической решеткой относятся
1) натрий, фтор, оксид серы (4)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4) хлорид калия, белый фосфор, иод
2. Какие из утверждений верны?
А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность
Б.Вещества с атомной решеткой пластичны и обладают электрической проводимостью.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) оксид кремния (4) и оксид углерода (4) 2) графит и оксид кремния (4)
3) хлор и иод 4) хлорид калия и фторид натрия
4.Термин «молекула» неприменим к веществу
1) H2O2 2) KCI 3) CH3OH 4) C2H6
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) S8, KNO3 2) Na2S, KF 3)NaNO2, H2S 4) F2, H2O2
№6. Классификация неорганических веществ.
Классификация и номенклатура органических веществ
ТЕСТ 1.
1.В перечне веществ
А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е.CO2
Кислотными оксидами являются
1) АБВ 2) ВГД 3)ГДЕ 4)БГЕ
2.В перечне веществ А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е.CO2
Основными оксидами являются
1)АБВ 2) ВГД 3)ГДЕ 4)БГЕ
3.В перечне веществ
А) ZnO Б)CuO В)FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Амфотерными оксидами являются
1) АБВ 2)ВГД 3) АГД 4) БГЕ
4.В перечне веществ
А) Fe(OH)3 Б. NaHCO3 В.H2O Г.H2O2 Д.Ca(OH)2 Е. NaOH
Гидроксидами являются
1) АБГ 2)АДЕ 3) БГД 4) ВДЕ
5.В перечне кислот
А) азотистая Б) ортофосфорная В) серная Г) бромоводородная д) азотная Е) сероводородная сильными кислотами являются
1) ВГД 2) АДЕ 3) АБД г) БГЕ
6.В перечне веществ
А) NH4CI Б)KH2PO4 В)[Zn(NH3)4]SO4 Г)NaHS Д)Ca(HCO3)2 Е)CH3NH3CI
Кислыми солями являются
1) АБВ 2) АБД 3) БГД 4) БГЕ
7. Только соли расположены в ряду
Только соли расположены в ряду
1) HCOOH, (C2H5)NH2Br, NaAI(SO4)3 2) NaH2PO3, NaNO3, KCIO3 3)SrBr2, AIOHCI2, HI 4) CaCO3, H2SO4, KHS
8.Основным оксидом и основной солью соответственно являются 1) СaO u CaOHCI 2)ZnO u NaHCO3 3)SO2 u FeOHCI2 4) BaO u Na2S
9. Основанием и кислой солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2S u NaNO3 3) H2SO3 u CaOHCI 4)KOH u KHCO3
10.Аллотропные модификации кислорода не отличаются
1) физическими свойствами 2) типом химической связи между атомами 3) химическими свойствами 4) числом атомов, входящих в состав молекул
ТЕСТ 2
1.В перечне веществ
А)MgO Б)Na2O В)CO2 Г)CI2O7 Д)CaO Е)CrO3
Кислотными оксидами являются
1) АБВ 2)ВГД 3)АБД 4)ВГЕ
2.В перечне веществ
А) ZnO Б)CuO В) FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Основными оксидами являются
1)А БВ 2)ВГД 3)ГДЕ 4) БВЕ
3.В перечне веществ
1) ВеО 2) Сr2O3 3) SO2 4) CrO3 5)Fe2O3 6) NO2
Амфотерными оксидами являются
1) АБВ 2) АБД 3)ГДЕ 4)БГЕ
4.В перечне веществ
А) Mg(OH)2 Б)RbOH В)Be(OH)2 Г)Zn(OH)2 Д)Ba(OH)2 Е)AI(OH)3
Основаниями являются
1) АБГ 2)АДЕ 3)АБД 4)БГЕ
5.В перечне кислот
А) угольная Б) ортофосфорная В) серная Г) хлорная Д) уксусная Е) сероводородная
Слабыми кислотами являются
1) ВГД 2) АДЕ 3)АБД 4) БГЕ
6.В перечне веществ
А) NH4CI Б)CuOHNO3 В)[Cu(NH3)4]SO4 Г)MgOHCI Д)(FeOH)2SO4 Е)CH3NH3CI
Основными солями являются
1) АБВ 2) АБД 3) БГД 4) БГЕ
7. Только соли расположены в ряду
Только соли расположены в ряду
1) СH3COOC2H5, C2H5NH3 · CI, C6H5ONa
2) NH2CH2COONa, CH3OH, CH3OH
3) (C2H5)3NHCI, (HCOO)2Ca, C6H5ONa
4) CH3COOK, (HCOO)2Ca, (CH3)2NH
8. Основным оксидом и основной солью соответственно являются
1)MgO u ZnOHCI 2) SiO2u FeOHCI2 3)BeO u KHCO3 4) CaO u K2S
9.Основанием и кислой солью соответственно являются
1) Ba(OH)2 u NH4AI(SO4)2
2) NaHS u LiOH
3) CaOHCI u NaHSO3
4) KOH u KHCO3
10.Аллотропной модификацией серы не является
1) пластическая 2) коллоидная 3) ромбическая 4) моноклинная
ТЕСТ 3.
1. В перечне веществ
А) NO2 Б)N2O В)CO Г)NO Д)CrO3 Е) SiO2
Кислотными оксидами являются
1) АБВ 2) АДЕ 3) АБД
2.В перечне веществ
А) MgO Б)Na2O В)CO Г)CI2O7 Д)CaO Е)CrO3
Основными оксидами являются
1) АБВ 2)ВГД 3)АБД
3.В перечне веществ
А) BaO Б)ZnO В)AI2O3 Г) K2O Д)Cr2O3 Е)FeO
Амфотерными оксидами являются
1) АГЕ 2) АДЕ 3) БВД 4) БГЕ
4. В перечне веществ
А) CH4 Б)H2S В)CH3COOH Г)NH3 Д)H5IO6 Е)K2HPO4
Кислотами являются
1) АБВ 2) БВД 3) БЕД 4) ВДБ
5.В перечне кислот
А)HNO2 Б)H3PO4 В)H2SO4 Г)HBr Д)HNO3 Е)H2S
Сильными кислотами расположены в ряду
1) H2CO3, H3PO4, HAsO4, HNO3
2) HCIO4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO3, H2SO4, H2CrO4
4) HMnO4, H3AsO4, H2BeO2, H2ZnO
7.Химические соединения CaCO3, Ca(HCO3)2, CH3COONa относится к
1) кислотам 2) основаниям 3) солям 4) оксидам
8.Амфотерным и основными оксидами соответственно являются
1) BaO, K2O 2) AI2O3, CaO 3) SO2, Na2O 4) Cr2O3, ZnO
9. Средней и основной солями соответственно являются
1) KNO3 u NH4CI 2)K2SO3 u FeOHCI2 3) (NH4)2S u NaNO3 4) MnSO4 u KHCO3
10.Высший оксид химического элемента с порядковым номером 16 относится к оксидам
1) основным 2) кислотным 3) амфотерным 4) несолеобразующим
ТЕСТ 4.
1.В перечне вещество
А) SiO2 Б) Fe2O3 В) BeO Г)ZnO Д) P2O5 Е)SO2
Кислотными оксидами являются
1) АГЕ 2) АДЕ 3)АБД 4) БГЕ
2.В перечне вещество
А) BaO Б)ZnO В)AI2O3 Г)K2O Д)Cr2O3 Е)FeO
Основными оксидами является
1) АГЕ 2) АДЕ 3) АБД 4)БГЕ
3.В перечне веществ
А) SiO2 Б) Fe2O3 В)BeO Г)ZnO Д)P2O5 Е)SO2
Амфотерными оксидами являются
1) АГЕ 2) АДЕ 3)АБД 4)БВГ
4.В перечне веществ
А) Mg(OH)2 RbOH Be(OH)2 Zn(OH)2 Ba(OH)2 AI(OH)3
Амфотерными гидроксидами являются
1) АБГ 2)АДЕ 3) АБД 4)ВГЕ
5.В перечне кислот
А) H2CO3 Б)H3PO4 В)H2SO3 Г)HCIO4 Д)CH3COOH Е)HCN
Слабыми кислотами являются
1)ВГД 2)АДЕ 3)АБД 4)БГЕ
6.Только кислоты расположены в ряду
1)HNO3, Ca(NO3)2, NO2
2) KHCO3, Ba(HSO4)2, ZnOHCI
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
7.Оксиды металлов со степенью окисления +6 и выше являя\ются
1) несолеобразующими 2) основными 3) амфотерными 4) кислотными
8.Амфотерным и основным оксидами соответственно являются
1) P2O5, Li2O 2) AI2O3,SrO 3) NO2, N2O 4) CrO, ZnO
9.Кислотой и двойной солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2SO3 u CaOHCI 3) H2S u NaNO3 4) H2SO4 u KHCO3
10.Аллотропные модификации углерода отличаются
1) типом гибридизации атома углерода
2) типом химической связи между атомами
3)химическими свойствами
4) числом атомов, входящих в состав молекул
ТЕСТ 5.
1.Только кислоты расположены в ряду
1) KCI, HCI,NaOH 2) NaHCO3, H2SO3, HNO2 3) H2SO4,HI, CH3COOH 4) HCN, KH2PO4, Na2SO4
2. В перечне веществ
А) FeO Б)Rb2O В)N2O5 Г)Ag2O Д)SO3 Е)MnO3
Основными оксидами являются
1)АБГ 2) АДЕ 3) АБД 4) БГЕ
3.В перечне веществ
А) NO2 Б) N2O В)CO Г)NO Д)CrO3 Е)SiO2
Несолеобразующими оксидами являются
1)АБВ Б) АДЕ В) АБД Г)БВГ
4. В перечне веществ
А) Сr(OH)3 Б)Fe(OH)2 В)KOH Г)Ca(OH)2 Д)Ba(OH)2 Е)Fe(OH)3
Щелочами являются
1) ВГД 2) АДЕ 3) АБД 4)БГЕ
5.В перечне кислот
А) сернистая Б) хлорная В) азотистая Г) хлорноватистая Д) соляная Е) йодоводородная
Сильными кислотами являются
1) ВГД 2) АДЕ 3) БДЕ 4) БГЕ
6.В перечне веществ
А) (NH4)2HPO4 Б)Ba(OH)2 В)CuCI2 Г)[Cu(NH4)2](OH)2 Д)CaOHCI Е)CH3CONH2
Солями являются
1) АБВ 2)АБД 3)АВД 4)ВДЕ
7.Кислотой и двойной солью соответственно являются
1) HNO3 u KNaCI2 2) H2S u NaNO3 3)H2SO3 u CaOHCI 4)H2SO4 u KHCO3
8. Амфотерным и основным оксидами соответственно являются
1) ZnO, Na2O 2) SO3, CaO 3) P2O5 Na2O 4) CI2O3, ZnO
9. Кислосодержащей кислотой и щелочью соответственно являются
1) HNO3 u NH4OH 2) H2SO3 u KOH 3) H2CO3 u Cu(OH)2 4) H2SO4 u KHCO3
10. Безкислородной кислотой и кислой солью соответственно являются
1) HBr u AIOHBr2 2) H2S u Ca(HSO4)2 3) H2S u NaNO3 4) H2SO4 u KHCO3
ТЕСТ 6.
1.Только кислотные оксиды указаны в ряду
1) ZnO, CO2, N2O 2) CO, SiO2, SnO2 3)CrO3, N2O3,SiO2 4) N2O5, P2O3, Cs2O
2. К основным гидроксидам относится каждое из двух веществ.
1) Fe(OH)3 u Cu(OH)2 2) Fe(OH)3 u Cr(OH)2 3) Fe(OH)2 u Ca(OH)2 4) Fe(OH)2 u Cr(OH)3
3. Какие из приведенных утверждений верны?
А.Основным оксидам соответствуют основания
Б. Основные оксиды образуют только металлы
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.В перечне веществ
А) Cr(OH)3 Б) Zn(OH)2 B) KOH Г)Ca(OH)2 Д) Ba(OH)2 Е)Fe(OH)3
Амфотерными гидроксидами являются
1) ВГД 2) АБЕ 3) АБД 4)БГЕ
5.В перечне кислот
А) сернистая Б) кремниевая В) фтороводородная Г) азотная
Сильными кислотами не являются
1) АБВ 2)АДЕ 3)АБД 4) БГЕ
6.Какие из приведенных утверждений верны?
А.Кислотным оксидам соответствуют кислоты.
Б. Кислотные оксиды образуют только неметаллы
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
7.Формулы только основных солей указаны в ряду
1) (CuOH)2SO4 , KHCO3, Na2CrO7
2) CuCI2, NaHSO4, (AIOH)CI2
3) Ca(HCO3)2, ZnS, (FeOH)CI
4) (FeOH)NO3, (CuOH)2CO3, MgOHCI
8.Амфотерным и кислотными оксидами соответственно являются
1) ZnO, BaO 2) AI2O3,SO3 3) AI2O3, Na2O 4) Cr2O3,ZnO
9.Кислосодержащей кислотой и щелочью соответственно являются
1) HNO3 u Fe(OH)2 2) (HO)2 SO2 u AI(OH)3 3) HOCI u KOH 4) H2SO4 u KHCO3
10. В перечне кислот
А) HNO2 Б)HCOOH В)HCIO3 Г)HI Д) HNO3 Е) H2SO3
Сильными кислотами являются
1) ВГД 2) АДЕ 3)АБД 4)БГЕ
ТЕСТ 7.
1.В перечне кислот
А) H2SO3 Б)H2SiO3 В)HF Г) HNO3 Д)HCIO3 Е) HI
Сильными кислотами не являются
1) АБВ 2)АДЕ 3) АБД 4)БГЕ
2.Только соли расположены в ряду
1) HCOONa, C2H5NH2, Na2SiO3
2) K2CO3, HCOOH, K2SiO3
3) CaBr, AI(OH)2CI, NaI
4) H2SO3, Ba(HSO4)2, LiHS
3. Какие из приведенных утверждений верны?
А.Основным оксидам соответствуют основания Б.Основные оксиды образуют металлы и неметаллы.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.основным оксидом и основной солью являются
1) FeO u FeSO4 2) CaO u CaCI2 3) BaO u Ba(NO3)2 4) CaO u (CuOH)2CO3
5.Только соли расположены в ряду
1) СH3COOC2H5, C2H5NH3• CI, C6H5ONa
2) NH2CH2COONa, CH3COH, CH3OH,
3) C2H5COONa, (HCOO)2Ca, C6H5ONa
4) CH3COOK, C6H3(OH)3, (CH3)2NH
6. Кислотным и основными оксидами соответственно являются
1) СO2 u K2O 2)SO3 u AI2O3 3) ZnO u Fe2O3 4) CaO u BaO
7. Основанием и кислой солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2SO3 u CaOHCI 3) H2S u NaNO3 4) KOH u K2HPO4
8. Средней и основной солями соответственно являются
1) КNO3 u NH4CI 2) (NH4)2S u K[AI(OH)4 3) K2 4) MnSO4 u KHCO3
9.Основанием и комплексной солью соответственно являются
1) Сa(OH)2 u KAI(SO4)2 2) CuOHCI u Na[ AI(OH)4] 3) KOH u K4[Fe (CN)6]
4) NH4CI u NH4OH
10. Только кислотные оксиды указаны в ряду
1)BeO, CO2, N2O 2) CO, SiO2, SO2 3) Mn2O7, P2O3, SiO2 4) N2O5, P2O3, Cs2O
ТЕСТ 8.
1. Из перечисленных ниже веществ:
А) Бутаналь Б) глицерин В) метилформиат Г) фенол Д) этилпропианат Е) метаналь
Альдегидами являются
1) ГЕ 2)ВД 3)АЕ 4)БВ
2.Из перечисленных ниже веществ
А) анилин Б) глицерин В) глицин Г) гуанин Д) аланин Е) стеарин
Аминокислотами являются
1)ГЕ 2)ВД 3)АЕ 4)БВ
3. Из перечисленных ниже веществ
А) бензол Б) гегсин в) циклогексан Г) дивинил Д) пентан Е) пентен
4.Из перечисленных ниже веществ
А) изопропен Б) пропилен В) циклопентан Г) стирол Д) циклогексан
Е) ксилол
Общую формулу CnH2n—2n имеют
1)АВ 2)ВЕ 3)АД 4)БВ
5.Из перечисленных ниже соединений:
А) рибоза Б) манноза В) лактоза Г) Глюкоза Д) целлюлоза Е) гликоген
6.Из перечисленных соединений предельным двухатомным спиртом является
1) пропанол-2 2) этилбензол 3) метилэтаноат 4) 1,2-этандиол
7.Из перечисленных соединений альдегидом является
1) этаналь 2) метилэтаноат 3) этилацетат 4) диметиламин
8.Этиленгликоль и 1,2- пропандиол являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9.2,2 – диметилпропан и пентан являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
10.Название вещества CH3 –C(CH3)2 – COOH по систематической номенклатуре
1) 2,2 – диметилпропановая кислота 2) 2- метилпропановая кислота 3) бутановая кислота 4) 2,2 диметилпропаналь
ТЕСТ 9
1.из перечисленных ниже веществ:
А) Бутанон Б) глицерин В) бутилформиат г) фенол д) этилацетат е) метаналь
Сложными эфирами являются
1) ГЕ 2) ВД 3)АЕ 4)БВ
2.Из перечисленных ниже веществ:
А) нитроглицерин Б) глицерин В) нитробензол Г) толуидин Д) аланин Е)нитрометан
Нитросоединениями являются
1) АВ 2)АГ 3)ВЕ 4) БВ
2.Из перечисленных ниже веществ:
А) нитроглицерин Б) глицерин В) нитробензол Г) толуидин Д) аланин Е) нитрометан
Нитросоединениями являются
1)АВ 2)АГ 3)ВЕ 4) ВД
3.Из перечисленных ниже веществ:
А) бензол Б) гексин В) циклогексан Г) дивинил Д) пентан Е)пентен
Общую формулу CnH2n-2 имеют
1)АВ 2)ВЕ 3)АД 4)БГ
4.Из перечисленных ниже веществ
А) толуол Б) фенол В) циклопентанол Г) стирол Д) циклогексен Е) ксилол
Общую формулу CnH2n-6 имеют
1) АВ 2) ВЕ 3) АД 4) БВ
5.Алканами являются все соединения в ряду
1) C3H8, CH4, C5H12
2) C2H5CH3, C2H4, C5H8
3) CH3CH3, C2H5NH2, (C2H5)3CH
4) C3H8,(CH3)2CHNO2, (C2H5)2CH2
6. Из перечисленных соединений предельным двухатомным спиртом является
1) бутанол-2 2) пропиленгликоль 3) этилэтаноат 4) этилбензол
7.Из перечисленных соединений предельным двухатомным спиртом является
1) пропанол-2 2) 1,2 – этандиол 3) бутилацетат 4) ксилол
8. Бутановая и метановые кислоты являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9. 2,3- диметилбутан и гексан являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
10. Название вещества CH3-CH2-C(CH3)H- C (C2H5)H по систематической номенклатуре
1) 3-метил-2-этилпентанол-1 2) 2-этил-3-метилпентанол 3) 3-метил-2-этилпентанол-2 4) 3-метил-4-этилпентанол-5
ТЕСТ 10
1.Из перечисленных ниже веществ:
А) СH3OCH3 Б)CH3COCH3 В)C6H5NO2 Г)C3H5(ONO2)3 Д)CH3CH2COOCH3 Е) СH3CH2CHO
Сложными эфирами являются
1)ГД 2)ВД 3)АЕ 4)БВ
2) Из перечисленных ниже веществ:
А) триолеин Б) глицерин В) тринитроглицерин Г) анилин Д) тристеарин Е) формалин
Жирами являются
1)АВ 2)ВЕ 3)АД 4)БВ
3. Из перечисленных ниже веществ:
А) изопрен Б) пропилен В)циклопентан Г)стирол Д) циклогексен Е) ксилол
Общую формулу CnH2n имеют
1) АВ 2)ВЕ 3)АД 4)БВ
4.Аминами являются все соединения в ряду
1) C3H7COONO2, CH3NH2, HCOONa
2) C2H5OCH3, CH3OC2H5, C5H11OH
3) CH3NHC6H5, CH3NH2, (C6H5)2NCH3
4) CH3NH3CI, (CH3)2NH, (C2H5)2NH2Br
5.Из перечисленных ниже веществ
А) пропилен Б) трипинолеин В) полиэтилен Г) бутен Д) ацетилен Е) аллен
Алкенами являются
1) АЕ 2) ВД 3) АГ 4)БЕ
6. Из перечисленных соединений предельным одноатомным спиртом является
1) бутанол-2 2) этилэтаноат 3) 1,2-пропандиол 4) этилбензол
7. Циклогексан и гексен-2 являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
8.Этилацетата и этиловый эфир уксусной кислоты являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9.орто-Ксилол и 1,2 диметилбензол являются
1) структурными изомерами 2) геометрическими изомерами 3) одним и тем же веществом 4) гомологами
10. Соединения, в состав которых входит функциональная группа -NH2, относятся к классу
1) аминов 2) карбоновых кислот 3) альдегидов 4) нитросоединений
№7. Общая характеристика металлов главных подгрупп I-III групп в связи с положением в периодической системе химических элементов Д.И. Менделеева особенностями строения их атомов.
Тест 1.
1.Наиболее легко отдают электроны атомы
1) магния 2) кальция 3) стронция 4) бария
2.При взаимодействии железа с горячей концентрированной кислотой образуются
1) Fe2(SO4)3 u H2 2) Fe2(SO4)3 u SO2 3) FeSO4 u H2 4) FeSO4 u SO2
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) AI, Zn, Ni 2) AI, Na, K 3) Ni, Zn, Mg 4) Ni, Zn, AI
4.Верны ли следующие суждения о щелочных металлах?
А.Щелочные металлы проявляют степень окисления +1
Б.С неметаллами образуют немолекулярные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.В возбужденном состоянии алюминий имеет электронную конфигурацию
1)…3s13p2 2)…3s23p1 3)…3s23p2 4) …3s13p2
Тест 2
1.Железо реагирует к каждым из набора веществ:
1) азот и хлорид магния
2) углерод и соляная кислота
3) водород и гидроксид натрия
4) аргон и разбавленная серная кислота
2.при взаимодействии железа с соляной кислотой образуются
1) FeCI3 u H2 2) FeCI2 u H2O 3) FeCI3 u H2O 4) FeCI2 u H2
3. В порядке уменьшения восстановительных свойств металлов расположены в ряду
1) Li, Zn, Mg 2) AI, Na, Li 3) Na, AI, Cr 4)Cr, Li, AI
4. Верны ли следующие суждения о щелочных металлах?
А.Щелочные металлы проявляют не только восстановительные свойства
Б.Их гидроксиды являются сильным основаниями
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.Степень окисления +3 железо проявляет за счет расположенных на
1) 4s u 3d — подуровнях 2) 4s u 3p-подуровнях 3) 4s u 4p подуровнях 4) 4s u 3s- подуровнях
Тест 3
1.Наиболее легко отдают электроны атомы
1) рубидия 2) кальция 3) стронция 4)цезия
2.Верны ли следующие утверждения о гидроксиде цинка?
А. Гидроксид цинка проявляет только кислотные свойства.
Б.Гидроксид цинка проявляет только основные свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) Zn, Cr, AI 2) AI, Cr, Zn 3) Na, Zn, CO 4) Cr, Zn, AI
4. Верны ли следующие суждения о щелочных металлах?
А.При взаимодействии с кислородом преимущественно образуют пероксиды
Б.Их гидроксиды являются щелочами
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5. Наиболее устойчивыми степенями окисления хрома являются
1) +1, +2 2) +2, +6 3) +3, +6 4) +4,+6
Тест 4
1.Медь реагирует с каждым из набора веществ:
1) азот и хлорид меди 2) кислород и азотная 3) водород и гидроксид натрия 4) аргон и разбавленная серная кислота
2.Алюминий реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и концентрированная азотная кислота (о.у) 3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
3.Верны ли следующие суждения о меди?
А.Для меди характерны степени окисления +1 и 2
Б. Медь растворяется в разбавленном водном растворе азотной кислоты.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
4.При взаимодействии железа с горячей концентрированной азотной кислотой образуются
1) Fe(NO3)3 u NH4NO3 2) Fe(NO3)3 u NO2 3) Fe(NO3)2 u NO 4) Fe(NO3)2 u NO2
5.При взаимодействии хрома с соляной кислотой образуются
1) CrCI3 u H2 2) CrCI2 u H2O 3) CrCI3 u H2O 4) CrCI2 u H2
ТЕСТ 5
1.Наиболее легко отдают электроны атомы
1) олова 2) индия 3) алюминия 4) сурьмы
2. Верны ли следующие утверждения об оксиде хрома (6)?
А. Оксид хрома (6) является кислотным оксидом
Б. Оксид хрома (6) является основным оксидом
1) верно только А 2)верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств расположены в ряду
1) Mg, Zn, Au 2) AI, Fe, Zn 3) Na, Zn, Mg 4) Ni, AI, Zn
4. Верны ли следующие суждения о щелочных металлах?
А.Проявляет восстановительные и окислительные свойства.
Б.Их соли не подвергаются гидролизу по катиону.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.Наиболее устойчивой степенью окисления меди являются
1) +1 2) +2 3) +3 4)+4
ТЕСТ 6
1.Цинк реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и оксид магния 3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
2.Верны ли следующие утверждения об оксиде цинка?
А. Оксид цинка является несолеобразующим оксидом
Б. Оксид цинка является амфотерным оксидом
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) AI, Zn, Ni 2) AI, Na, K 3) Ni, Zn, Mg 4) Ni,Zn, AI
4. Амфотерный гидроксид не образует
1) алюминий 2) железо 3) медь 4) хром
5.Верны ли следующие суждения о металлах 2 а группы?
А.Проявляют степень окисления +2
Б.С неметаллами образуют ионные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
ТЕСТ 7
1.Наиболее легко отдают электроны атомы
1) магния 2) кальция 3) натрия 4) лития
2.Верны ли следующие утверждения о гидроксиде магния?
А. Гидроксид магния проявляет кислотные свойства
Б. Гидроксид магния проявляет основные свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке увеличения восстановительных свойств металлы расположены в ряду
1) Li, Zn, Mg 2) AI, Ca, Na 3) Na, AI, Cr 4) Cr, Li, AI
4.Амфотерный гидроксид образует
1) натрий 2) магний 3) калий 4) бериллий
5.Верны ли следующие суждения 2 а группы
А.Катионы металлов проявляют только окислительные свойства
Б. Их соли не подвергаются гидролизу по катиону.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
ТЕСТ 8
1.Медь не взаимодействует с
1) разбавленной серной кислотой 2) концентрированной азотной кислотой 3) концентрированной серной кислотой 4) разбавленной азотной кислотой
2.Верны ли следующие утверждения о гидроксиде хрома (3)?
А.Гидроксид хрома (3) проявляет только кислотные свойства
Б. Гидроксид хрома (3) проявляет как основные, так и кислотные свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.Гидроксид железа (3) образуется при действии растворов щелочей на
1) оксид железа (2) 2) соли железа (2) 3) оксид железа (3) 4) соли железа (3)
4. Амфотерный гидроксид образует
1) медь 2) кальций 3) цинк 4) стронций
5.Верны ли следующие суждения о щелочных металлах?
А. Имеют на внешнем энергетическом уровне один электрон
Б.Образуют при взаимодействии с водородом ионные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
№8 Общая характеристика неметаллов главных подгрупп 4-7 групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов
ТЕСТ 1.
1.Верны ли следующие суждения о неметаллах?
А.Проявляют только окислительные свойства
Б. Их водородные соединения являются кислотами
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба суждения неверны
2.Хлор является окислителем и восстановителем в реакции с
1) H2O 2) Fe 3) C2H4 4) C4H6
3. не проявляет степень окисления, равную номеру группы
1) кислород 2) сера 3) селен 4) теллур
4.Окислительные свойства элементов увеличиваются в ряду
1) азот, углерод 2) углерод, кремний 3) кислород, азот 4) хлор, фтор
5.Способность водородных соединений неметаллов образовать межмолекулярную водородную связь по периоду слева направо
5.Способность водородных соединений неметаллов образовывать межмолекулярную водородную связь по периоду слева направо
1) уменьшается 2) не изменяется 3) увеличивается 4) не проявляется
ТЕСТ 2.
1.Верны ли следующие суждения о неметаллах?
А.Проявляют и восстановительные, и окислительные свойства
Б. Сила бескислородных кислот растет по группе сверху вниз
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Азот не является окислителем в реакции с
1) H2 2) Li 3) O2 4) Ca
3. Не проявляет степень окисления, равную номеру группы
1) хлор 2) фтор 3) бром 4) йод
4.Окислительные свойства элементов увеличиваются в ряду
А) азот, фтор б) фтор, хлор в) азот,фосфор г) хлор, бром
5.Восстановительные свойства элементов увеличиваются в ряду
1) B, O, N 2) Se, O, P 3) C,O,S 4) CI, S, Se
ТЕСТ 3
1.Верны ли следующие суждения о свойствах элемента, электронная конфигурация атома которого 1s22s22p63s23p5?
А. Гидроксид, в котором этот элемент имеет высшую степень окисления, обладает ярко выраженными кислотными свойствами
Б.Степень окисления этого элемента в высшем гидроксиде +5
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Кислород проявляет степени окисления
1) -2, -1, 0, +4, + 6 2) -2, -1,0 3) -2,-1, 0,+6 4) -2,-1,0,+2
3.Не проявляет высшую валентность равную номеру группы
1) теллур 2) сера 3) селен 4) кислород
4.Водородное соединение с ярко выраженными основными свойствами образует
1) кремний 2) азот 3) фтор 4) кислород
5.Способность водородных соединений неметаллов образовывать межмолекулярную водородную связь по группе сверхувниз
1) не проявляется 2) не изменяется 3) увеличивается 4) уменьшается
ТЕСТ 4
1.Фосфор является восстановителем в реакции с
1) O2 2) Li 3) Mg 4) Ca
2.Не проявляет высшую валентность, равную номеру группы
1) хлор 2) йод 3) бром 4) фтор
3.У атомов химических элементов в ряду P—S—CI увеличивается (ются)
1) радиус 2) окислительные свойства 3)восстановительные свойства 4) число неспаренных электронов в основном состоянии
4.Восстановительные свойства элементов увеличиваются в ряду.
1) F,CI,I 2) P,CI, I 3) Se, S, O 4) P,S,CI
5. Кислотные свойства кислородосодержащих кислот по периоду слева направо
1) не проявляются 2) не изменяются 3) увеличиваются 4) уменьшаются
ТЕСТ 5
1.Фосфор является окислителем в реакции с
1) O2 2) Li 3) KCIO3 4) H2SO4
2. Не проявляет высшую ковалентность, равную номеру группы
1) фосфор 2) мышьяк 3) сурьма 4) азот
3.Окислительные свойства элементов увеличиваются в ряду
1) бром, теллур 2) бром, хлор 3) сурьма 4) азот
4.Восстановительные свойства элементов увеличиваются в ряду
1) Ne , Se, S 2) CI, Br, I 3) Se, Br, I 4) CI, S,O
5. Кислотные свойства кислородосодержащих кислот по группе сверху вниз
1) уменьшаются 2) не изменяются 3) увеличиваются 4) не проявляются
ТЕСТ 6
1. Сера является окислителем в реакции с
1) Fe, H2, O2 2) Zn,H2,C 3) F2, Ca, H2 4) H2SO4(конц), HNO3, Ni
2. Окислительные свойства элементов уменьшаются в ряду
1) C,O, N 2) F, O,N 3) O, P, CI 4) CI, P, F
3. Хлор проявляет степени окисления
1) -1,0 2) -1,0,+7 3) -1,0,+1,+3,+5,+7 4) -1,+5,+7
4.Водородное соединение йода проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
5.С ростом степени окисления элемента сила кислородосодержащих кислот
1) уменьшается 2) не изменяется 3) увеличивается 4) не проявляется
ТЕСТ 7
1.Сера является восстановителем в реакции с
1) Fe, H2, O2 3) F2, Ca, H2
2) Zn, H2, C 4) H2SO4 (Конц ) HNO3, O2
2. Окислительные свойства элементов уменьшаются в ряду
1) I, O, N 2) F, CI, I 3) I, Te, S 4) Br, CI, N
3. Фтор проявляет степени окисления
1) -1, 0, +1, +3, +5, +7 2) -1, 0,+7 3) -1,0 4) -1, +5, +7
4.Восстановительные свойства элементов увеличиваются в ряду
1) В, C, N 2) N, O, P 3) F, O, P 4) CI, S, F
5. Водородное соединение селена проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
ТЕСТ 8
1.Верны ли следующие суждения о неметаллах?
А.При взаимодействии с металлами проявляют окислительные свойства.
Б. Имеют большую по сравнению с металлами электроотрицательность
1) Верно только А 2)верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Вещество сера является и окислителем, и восстановителем в реакции с
1) H2SO4 2) HNO3 3) KOH 4) O2
3. Окислительные свойства элементов уменьшаются в ряду
1) Si, O, CI 2) CI, P, O 3) I, Te, S 4) Br, Se, As
4. Бром проявляет степени окисления
1) -1, 0,7 2) -1, 0, +1,+3, +5, +7 3) -1,0 4) -1,+5,+7
5.Водородные соединения фосфора проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
№9 Характерные химические свойства простых веществ металлов: щелочных, щелочноземельных, алюминия, переходных металлов – меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов:
Тест 1.
1.Кальций взаимодействует с каждым из двух веществ:
1) вода, кислород 2) серная кислота, аргон 3) гидроксид натрия, хлор 4) оксид лития, азот
2.При взаимодействии серы с металлами образуются соединения, в которых ее степень окисления равна
1)+2 2) -2 3)+4 4)+6
3.Реакции разбавленной азотной кислоты с медью соответствует уравнение
1) 3 Сu +8HNO3=3Cu (NO3)2+2NO+4H2O
2) Cu+2HNO3=Cu (NO3)2 +H2
3) Cu +4 HNO3=Cu (NO3)2 + 2NO2+ 2H2O
4) Cu + 10 HNO3=4Cu (NO3)2+NH4NO3+3H2O
4.При взаимодействии элементов II А группы с водородом образуются гидриды общей формулы
1)ЭН4 2) ЭН 3) ЭН2 4)ЭН3
5.Хлор не взаимодействует с каждым из веществ в ряду
1) O2 , P, H2O 2) CH4, FeCI2, CO 3) NaOH, Ca, S 4) SO2, C6H6, CH3COOH
ТЕСТ 2.
1.Химическая реакция возможна между
1) Fe + K3PO4 2) Fe + CuCI2 3) Mg + NaCI 4) Ag + Cu(NO3)2
2. Хлорид меди (2) получают реакцией
1) Сu + CI2 2) Cu + NaCI 3) Cu +HCI 4) CuO + CI2
3.Элементы YА группы с кислородом образуют оксиды общей формулы
1) Э2О5, Э2О3 2) Э2О4, ЭО5 3) Э2О5, Э2О7 4) Э2 О, Э2О3
4.Пара веществ, между которыми происходит химическая реакция, это
1) серебро и сульфат калия (р-р) 2) цинк и хлорид калия (р-р) 3) магний и хлорид олова (р-р) 4) серебро и сульфат меди (р-р)
5.Непосредственно не взаимодействуют
1) углерод и сера 2) железо и углерод 3) кислород и хлор 4) литий и фтор
Тест 3
1.Натрий взаимодействует с каждым из двух веществ:
1)аммиак, неон 2) вода кислород 3) гидроксид натрия, бром 4) оксид калия, азот
2.При взаимодействии азота с активными металлами образуются соединения, в которых его степень окисления равна
1) +2 2) -3 3) +4 4) +5
3. Реакции разбавленной азотной кислоты с магнием соответствует уравнение
1) 3 Mg + 8 HNO3=3Mg (NO3)2+2NO+4H2O
2) Mg +2 HNO3=4Mg (NO3)2+N2O+5H2O
3) 4Mg+10HNO3=4Mg (NO3)2 +N2O +5 H2O
4) 4Mg + 10 HNO3=4Mg (NO3)2+NH4NO3+3H2O
4.При взаимодействии элементов I А группы с водородом образуются гидриды общей формулы
1) ЭН4 2)ЭН 3) ЭН2 4) ЭН3
5.Фосфор не взаимодействует с каждым из веществ в ряду
1) O2, CO, H2 2) KCIO3, HNO3, H2SO4 3) NaOH, Ca, O2 4) Mg, S, F2
ТЕСТ 4.
1. Химическая реакция возможна между
1) Cr +Na3PO4 2) Fe + ZnCI2 3) Na + MgCI2 4) Ag +Hg(NO3)2
2.Хлорид железа (2) получают реакцией
1) Fe+CI 2) Fe + HCIO3 3) Fe + HCI 4) FeO + CI2
3. Элементы YI группы образуют оксиды общей формулы
1) Э2О3 и ЭО3 2) ЭО3 и ЭО 3) Э2О5 и Э2О 4) ЭО2 и ЭО3
4.Реакции концентрированной серной кислоты с медью соответствует уравнение
1) Cu + 2H2SO4=CuSO4 +SO2 + 2H2O
2) Cu + H2SO4= CuSO4 + H2
3) 3Cu + 5 H2SO4= 3CuSO4 + 2 S+5H2O
4) 4Cu + 5 H2SO4= 4CuSO4 + H2S+ 4H2O
5. Непосредственно не взаимодействуют
1) углерод и кремний 2) золото и соляная кислота 3) кислород и сера 4) литий и вода
ТЕСТ 5.
1.Железо взаимодействует с каждым из двух веществ:
1) аммиак, водород 2) соляная кислота, кислород 3) гидроксид натрия, бром 4) оксид серы(6), азот
2.При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна
1) +3 2) 0 3) -3 4) +5
3.Реакции разбавленной азотной кислоты с железом соответствует уравнение преимущественно протекающей реакции
1) 3 Fe +8HNO3=3Fe(NO3)2+2NO+4H2O
2) 2 Fe + 6 HNO3 = 2Fe(NO3)3 + 3H2
3) Fe + 4HNO3=Fe(NO3)3 +NO+2H2O
4) Fe + 6HNO3=Fe(NO3)3+3 NO2 + 3H2O
4.При взаимодействии элементов YII А группы с водородом образуются водородные соединения общей формулы
1) ЭН4 2) ЭН 3) ЭН2 4) ЭН3
5.Азот взаимодействует с каждым из веществ в ряду.
1) O2, CO2, H2 2) KCIO3, HNO3, H2SO4 3) NaOH, Ca, O2 4) Mg, H2, O2
ТЕСТ 6
1.Химическая реакция возможна между
1) Сa + ZnCI2 2) Zn + CaCI2 3) Fe + LiCI 4) Pb + Zn(NO3)2
2. Хлорид железа (3) получают реакцией
1) Fe +CI2 2) Fe + HCIO3 3) Fe +HCI 4) FeO+ CI2
3/При взаимодействии элементов II A группы с кислородом образуются оксиды общей формулы
1) Э2О3 2) ЭО 3) ЭО2 4) Э2О
4.Реакции концентрированной серной кислоты с алюминием при (о.у.) соответствует уравнение
1) 2AI + 6 H2SO4= AI2(SO4)3+ 3 SO2 + 6 H2O
2) AI + H2SO4#
3) 2AI + 5 H2SO4=AI2(SO4)3 + 2S + 5 H2O
4) 2AI + 3 H2SO4= AI2(SO4)3 + 3H2
5.Непосредственно не взаимодействуют
1) углерод и вода 2) цинк и соляная кислота 3) кислород и вода 4) литий и сера
ТЕСТ 7.
1.Железо не взаимодействует с каждым из двух веществ:
1) кислород, водород
2) соляная кислота, оксид кальция
3) гидроксид натрия, никель
4) оксид серы(6), углерод
2.При взаимодействии серы с фтором образуется соединение, в котором ее степень окисления равна
1) 0 2)-2 3) +4 4) +6
3.Реакции разбавленной азотной кислоты с цинком соответствует уравнение
1) 3Zn + 8 HNO3=3Zn (NO3)2 + 2 NO+4H2O
2) 5 Zn +12 HNO3= 5 Zn (NO3)2 + N2+6H2O
3) 4Zn + 10 HNO3= 4 Zn (NO3)2 + N2O+5H2O
4) Zn +4HNO3 = Zn
(NO3)2 + 2NO2+2H2O
4.При взаимодействии элементов VI А группы с водородом образуются водородные соединения общей формулы
1)ЭН4 2) ЭН 3)ЭН2 4) ЭН3
5.Кремний не взаимодействует с каждым из веществ в ряду
1) O2, C, Ca 2) NaOH, Mg, F2 3) HCIO4, HNO3, H2SO4 4) Mg, P, O2
ТЕСТ 8.
1. Химическая реакция в растворе возможна между
1) Cu u HCI 2) AI u Mg(NO3)2 3) Fe u K3PO4 4) Zn u FeCI2
2. При сплавлении алюминия с гидроксидом натрия образуется
1) NaAIO2 2) AIH3 3) Na[AI(OH)4] 4) AI2O3
3.В результате реакции кальция с водой образуются
1) CaO u H2 2) Ca(OH)2 u H2 3) CaH2 u O2 4) Ca(OH)2 u O2
4. Реакции концентрированной серной кислоты с железом (при о.у) соответствует уравнение
1) 2Fe + 6 H2SO4=Fe2(SO4)3 + 3 SO2 + 6H2O
2) 2 Fe + 6 H2SO4=Fe2(SO4)3 + 3H2
3) 3Fe +5H2SO4= 3 FeSO4+2S+5 H2O
4) Fe + H2SO4 (КОНЦ) #
5. Верны ли следующие суждения о свойствах кислорода и серы?
А.Максимальная валентность этих элементов в соединениях равна номеру группы
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
№10 Характерные химические свойства оксидов: основных, амфотерных, кислотных.
ТЕСТ 1.
1.Оксид серы (6) не взаимодействует с каждым из веществ в ряду:
1) N2O5, H3PO4 2) CaO, AI2O3 3) H2O, NaOH 4) H2S, K2O
2. С кислотами не реагирует
1) SiO2 2) CaO 3) FeO 4) NiO
3/ C кислотными оксидами реагируют все вещества в группе
1) СaO, Na2O, ZnO 2) Li2O,SO3, BaO 3) SrO, Fe2O3, CO2 4) SiO2, N2O5, AI2O3
4. Амфотерный оксид образуется в реакции
1) 2AI (OH)3=AI2O3+3H2O 2) NH4NO3=N2O+2H2O 3) CaCO3=CaO+CO2 4) S+O2=SO2
5.При взаимодействии с водой образует щелочь
1) Li2O 2) SO3 3) CO2 4) FeO
ТЕСТ 2.
1.Кислотные свойства оксидов увеличиваются в ряду
1) SO2, CO2, NO2 2) CI2O7, SiO2, CO2 3) CI2O7, P2O5,SO3 4) AI2O3, N2O3, N2O5
2/C основаниями не реагирует
1)SiO2 2) SO2 3) Fe2O3 4) BaO
3.Кислотный оксид образуется в реакции
1) Сa(OH)2= CaO+H2O 2) NH4NO3=N2O+2H2O 3) H2SO4=SO3+H2O 4) 2Mg+O2=2MgO
4. Основный оксид образуется в реакции
1) 2AI(OH)=AI2O3+3H2O 2) NH4NO3=N2O+2H2O 3) CaCO3=CaO+CO2 4) S+O2=SO2
5.При взаимодействии с водой образует кислоту
1)Li2O 2)SrO 3) CO2 4)FeO
ТЕСТ 3.
1.Оксид серы (6) взаимодействует с каждым из веществ в ряду
1) N2O5, H3PO4 2) H2O, NaOH 3) N2O5, AI2O3 4) H2SO4, CO
2. С кислотами не реагирует
1) SrO 2)SO3 3) Na2O 4) Fe2O3
3. С кислотными оксидами реагируют все вещества в группе
1) AI2O3, Rb2O, ZnO 2) MgO, SO3,CO 3) SO2, P2O3, CO2 4) K2O, FeO, CrO3
4.Амфотерный оксид образуется в реакции
1) Cu(OH)2=CuO+H2O 2) 2Cu(NO3)2=2 CuO+4NO2+O2
3)AI2(SO4)3=3SO3+2AI2O3
4) 4P+5O2=2P2O5
5.При взаимодействии с водой образует щелочь
1) SO2 2) P2O3 3) NO2 4) BaO
ТЕСТ 4.
1.Кислотные свойства оксидов увеличиваются в ряду
1) СO2, SO2, N2O5 2) CI2O, NO2, CO2 3) SO3, CO2, P2O5 4) P2O, SO2, N2O5
2. С основаниями не реагирует
1) SrO 2) SO3 3) N2O3 4) P2O3
3. Кислотный, оксид образуется в реакции
1) Сu(OH)2=CuO + H2O 2) NH4NO3=N2O+2H2O 3) AI2(SO4)3=3SO3+AI2O3 4) 2Zn+O2=2ZnO
4. Основной оксид, образуется в реакции
1) Сu(OH)2=CuO +H2O 2) 2Zn(NO3)2=2ZnO+4NO2+O2 3) AI2(SO4)3=3SO3 + AI2O3
4) 4P +5O2=2P2O5
5. При взаимодействии с водой образует кислоту
1) KO2 2) P2O3 3) N2O 4) CO
ТЕСТ 5.
1.Оксид кальция не взаимодействует с каждым из веществ в ряду
1) N2O5, H3PO4 2) N2O5, AI2O3 3) K2O, NaOH 4) H2SO4, K2O
2. С кислотами не реагирует
1) ZnO 2) CO 3) K2O 4) Cr2O3
3. С кислотными оксидами реагируют все вещества в группе
1)СrO, CI2O7, Bi2O3 2) MgO, BeO,CaO 3) P2O5, Cr2O3, CO2 4) N2O3, Pb2O, ZnO
4. Амфотерный оксид образуется в реакции
1) S + O2=SO2 2) (NH4)2Cr2O7=Cr2O3+N2+4H2O
3) 4Li + O2=2Li2O 4) Fe(OH)2=FeO + H2O
5. При взаимодействии с водой образует щелочь
1) Na2O 2) SO3 3) CO2 4) Fe2O3
ТЕСТ 6.
1.Основные свойства оксидов увеличиваются в ряду
1) СaO, K2O, AI2O3 2) ZnO, Na2O, Fe2O3 3) Li2O, Na2O, K2O 4) K2O, SrO, MgO
2.С основаниями не реагирует
1)AI2O3 2) K2O 3)NO2 4) P2O5
3.Кислотный оксид образуется в реакции
1)S + O2=SO2 2) 2 Na +O2=Na2O2 3) (NH4)2Cr2O7=Cr2O3+N2+4 H2O 4) 2AI(OH)3=AI2O3+3H2O
4. Основный оксид образуется в реакции
1) S + O2=SO2 2) 4Li + O2= 2Li2O 3) (NH4)2Cr2O7=Cr2O3+N2+4H2O 4) Zn(OH)2=ZnO+H2O
5. При взаимодействии с водой образует кислоту
1) Na2O 2) SO3 3)SnO2 4) Fe2O3
ТЕСТ 7.
1.Оксид алюминия не взаимодействует с каждым из веществ в ряду
1) N2O, Cu 2)N2O5, K2CO3 3) K2O, NaOH 4) H2SO4, Na2O
2. С кислотами не реагирует
1) Ag2O 2) CuO 3) SO3 4) CrO
3/C кислотными оксидами реагируют все вещества в группе
1) Сr2O3, MnO, Bi2O3 2) NO2, BeO, CaO 3) P2O5, Cr2O3, CO2 4) N2O3, Pb2O, ZnO
4.Амфотерный оксид образуется в реакции
1) 2Fe(OH)3=Fe2O3+ 3H2O 2) Na2CO3+SiO2=Na2SiO3+CO2
3) H2CO3=CO2+H2O
4) 4HNO3=2NO2+O2+H2O
5. При взаимодействии с водой образует кислоту
1) SO2 2) K2O 3) NO 4) CaO
№11. Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот
ТЕСТ 1.
1.При нагревании гидроксида меди (2) образуются
1) Сu u H2O 2) CuO u H2 3) CuO u H2O 4) Cu2O u H2O
2. Гидроксид кальция не взаимодействует с
1) HCI 2) CO2 3) ZnS 4) HNO3
3. Соляная кислота реагирует с каждым из двух веществ:
1) Zn u Ca(OH)2 2) KOH u CO2 3) AgNO3 u Au 4) NaOH u Ag
4. Концентрированная азотная кислота при обычных условиях взаимодействует с
1) магнием 2) гидроксидом натрия 3) железом 4) оксидом магния
5. Гидроксид алюминия реагирует с каждым из двух веществ
1) HCI u Zn 2) NO u H2S 3) KCI u NH3 4) NaOH u HCI
6. Гидроксид цинка реагирует с каждым веществом пары
1) сульфат кальция и оксид серы (6)
2) гидроксид натрия (р-р) и соляная кислота
3) вода и хлорид натрия
4) сульфат бария и гидроксид железа (3)
ТЕСТ 2
1. При нагревании гидроксида алюминия образуются
1) AI2O3 u H2O 2) AI u H2 3) AI u H2O 4) AI2O3 u H2
2.Гидроксид натрия не реагирует с
1) AI(OH)3 2)ZnO 3) H2SO4 4) Ba(OH)2
3, Гидроксид бария не взаимодействует с
1) HNO3 2) SO2 3) FeS 4) H2SO4
4. В результате реакции железа с концентрированной серной кислотой образуется
1) хлор 2) хлорид железа (2) 3) вода 4) хлорид железа (3)
5.Амфотерными являются гидроксиды в ряду
1) NH4OH, Zn(OH)2, Cr(OH)3 2) Fe(OH)3, AI(OH)3, Zn(OH)2 3) Pb(OH)2, Cr(OH)2, NH4(OH) 4) Ca(OH)2, Zn(OH)2, AI(OH)3
6. Химическая реакция невозможна между веществами
1) NaOH u HCI 2) SO2 u H2S 3) CO2 u P2O5 4) NO u CI2
ТЕСТ 3.
1.При нагревании гидроксида железа (3) образуются
1) FeO u H2O 2) Fe2O3 u H2O 3) Fe u H2O 4) Fe u H2
2. Гидроксид натрия взаимодействует с
1) SO3 2) Na2O 3) Mg(OH)2 4) N2O
3. При комнатной температуре концентрированная серная кислота реагирует с каждым из двух веществ:
1) железом и гидроксидом меди (2)
2) магнием и карбонатом калия
3) алюминием и хлоридом натрия
4) оксидом кремния и гидроксидом натрия
4.Хлороводородная (соляная кислота) реагирует с
1) Cu 2)Hg 3) Ag 4) Zn
5. Гидроксид цинка проявляет амфотерные свойства при взаимодействии с
1) HCI u CO2 2) H2SO4 u KOH 3) NaOH u CaO 4) NaOH u KCI
6. Гидроксид калия не реагирует с
1) AI(OH)3 2) ZnO 3) H2SO4 4) Mg(OH)2
ТЕСТ 4
1.При нагревании гидроксида цинка образуются
1) Zn u H2O 2) ZnO u H2 3) Zn, O2 u H2 4) ZnO u H2O
2.Химическая реакция невозможна между веществами
1) Ca(OH)2 u CO2 2) NO2 u H2S 3) CaO u Ba(OH)2 4) SiO2 u KOH
3.Фосфорная кислота не взаимодействует с
1) гидроксидом меди 2) медью 3) оксидом калия 4) гидроксидом кальция
4. Кислота образуется при растворении в воде оксида
1) P2O5 2)K2O 3)SiO2 4) N2O
5.Гидроксид хрома (3) проявляет амфотерные свойства при взаимодействии с
1) HCI u KOH 2) KOH u Na2O 3) HCI u NaCI 4) KOH u Cs2SO4
6. Со всеми перечисленными веществами H2, NaOH, H3PO4 будет реагировать
1) CO2 2) Cr2O3 3) BaO 4) NO
ТЕСТ 5
1.При нагревании гидроксида магния образуются
1) Mg u H2O 2) MgO u H2O 3) Mg u H2 4) MgO u H2
2. Раствор гидроксида натрия реагирует с каждым из веществ, указанных попарно
1)хлоридом железа (3) и углекислым газом
2) оксидом железа (2) и соляной кислотой
3) серной кислотой и карбонатом кальция
4) оксидом цинка и хлоридом калия
3. Ортофосфорная кислота может взаимодействовать с
1) HCI 2) S 3) Cu 4) CaCI2
4. Разбавленная серная кислота реагирует с каждым из двух веществ:
1) Na2SiO3 u HNO3 2) CuS u KNO2 3) Ag u Cu(OH)2 4) Fe u AI2O3
5. Гидроксид цинка проявляет амфотерные свойства при взаимодействии с
1) NaOH u Cs2SO4 2) KOH u Na2O 3) H2SO4 u KOH 4) HCI u CaCI2
6. Со всеми перечисленными веществами H2, KOH, H2SO4 будет реагировать
1) CO2 2) CrO3 3) BaO 4) NO
ТЕСТ 6
1.Гидроксид алюминия реагирует с каждым из веществ ряда
1) NaOH, H2SO4, HNO3 2) SO3, HCI, KNO3 3) K2O, H2SO4, ZnO 4) NaOH, H2SO4, CaCO3
2. При действии избытка гидроксида натрия на раствор нитрата цинка образуется
1) N
Оксиды. Определение: оксиды соединение образованное двумя элементами, в составе которых есть кислород в степени окисления минус 2.
Вариант Оксиды это…
1. Оксиды это… Вариант 1 г) сложные вещества, в состав которых входит атом металла и кислотный остаток.. Как классифицируют оксиды? Привести примеры. NaPO 4, МgО, A1( OH ), HS, Li O, CaCl, КОН, НI, ВаS,
ПодробнееА. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ…
Оксиды А. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ… Определение валентности… Определение типа оксида… Взаимодействие оксидов… 3 Б. КОНТРОЛЬНЫЕ ЗАДАНИЯ… 5 ЧАСТЬ A… 5 ЧАСТЬ B… 6 ЧАСТЬ C… 11 ЧАСТЬ D… 1
ПодробнееОБОБЩАЮЩИЕ ТАБЛИЦЫ И СХЕМЫ
ОБОБЩАЮЩИЕ ТАБЛИЦЫ И СХЕМЫ МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ ОРИЕНТИРЫ В. И. Сомик Продолжение. Начало в (14). СТРОЕНИЕ АТОМА Атом ядро «нуклеус» (+) электроны e ( m = ) 0 z = 1 протоны p ( m = ) Нуклоны частицы
Подробнее5. Классификация неорганических веществ
5. Классификация неорганических веществ Оксиды сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды получаются обычно при взаимодействии простых
ПодробнееЛабораторная работа 1
Общая химия Студент: Группа: Дата выполнения работы: 1 Цель работы: Лабораторная работа 1 ВАЖНЕЙШИЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ Основные понятия: Классы неорганических веществ: 1. оксиды осно вные (Na
ПодробнееДомашнее задание от Домашнее задание
Домашнее задание от 12.03.2018 Предмет Русский язык Химия Английский язык (для обеих групп) География Алгебра Домашнее задание Стр. 137-138 (прочитать теоретический материал), упр.291(выписать только предложения
ПодробнееДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
Подробнее5. В соединениях Nh4, N2O3 и HNO3 азот имеет степени окисления, соответственно равные а) +3, +3, +5 ; б) 3, 3, +5; в) 3, +3, +5; г) 3, +3, 5.
Вариант 1 Выберите правильный вариант ответа. Возможен только один вариант правильного ответа. 1. Чем определяется место химического элемента в периодической системе? а) количеством электронов на внешнем
ПодробнееПрактическое занятие 1, 2
Практическое занятие 1, 2 Основные классы неорганических соединений Преподаватель: асс. каф. ОХХТ к.х.н. Абрамова Полина Владимировна еmail: [email protected] ПЛАН ЗАНЯТИЯ I. Классификация неорганических
ПодробнееКЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
ПодробнееИнструкция по выполнению работы
Тренировочная работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 m00090 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс Фамилия. Имя. Отчество 24 октября 2012 года 11 класс Вариант
ПодробнееТЕМА 1. Щелочные металлы и их соединения
ТЕМА 1. Щелочные металлы Тренировочные задания 1. Верны ли следующие суждения? А. Семейство щелочных металлов расположено в IА группе Периодической системы химических элементов Д.И. Менделеева. Б. Максимальная
ПодробнееУЧИСЬ САМОСТОЯТЕЛЬНОСТИ
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: — химические уравнения; Вам необходимо
ПодробнееКлассификация неорганических веществ
Классификация неорганических веществ Сазонов В.В., учитель химии МКОУ средней общеобразовательной школы д. Васькино Нижнесергинского района Свердловской области Цель урока Повторить классификацию неорганических
Подробнее1) 19,2 % 2) 36,4 % 3) 43,7 % 4) 100 % 2)
Контрольная работа 1 Вариант I 1. В левом столбце под номерами 1 4 записаны известные вам понятия, в правом столбце буквами А Г обозначены их характеристики. Выпишите номер, которым обозначено понятие,
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееВХОДНЫЕ ТЕСТЫ ПО ХИМИИ
Вариант 1 1. Укажите символ элемента Водород (поставьте знак ): О Н N 2. Вещество это (поставьте знак ): железо стакан стекло 3. Заполните таблицу, используйте такие слова: вода, кислород, соль, железо.
ПодробнееИнструкция по выполнению работы
Диагностическая работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс. Фамилия Имя Отчество 6 декабря 2012 года 11 класс Вариант 1
ПодробнееКислотный характер — оксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Кислотный характер — оксид
Cтраница 1
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N2Os — наиболее кислотный оксид, Bi2Os обладает основным характером. [1]
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N205 — наиболее кислотный оксид, Bi2Os обладает основным характером. [2]
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N2O5 — наиболее кислотный оксид, Bi2Os обладает основным характером. [3]
Кислотный характер оксидов уменьшается с увеличением атомной массы. [4]
В раду SOi-SeOr-TeOj-PoOi кислотный характер оксидов ослабляется. [5]
С возрастанием степени окисления уменьшается основной и усиливается кислотный характер оксидов. Например, оксид СгО — основной, Сг2О3 — амфотерный и СгО3 — кислотный. [6]
В ряду SO2 — SeO2 — TeO2 — PoO2 кислотный характер оксидов ослабляется. [7]
В ряду SCb — — SeO2 — Те02 — РоСЬ кислотный характер оксидов ослабляется. При взаимодействии SeOj и ТеО2 с водой образуются селенистая h3SeO3 и теллуристая Н2ТеО3 кислоты. [8]
В ряду SOz — — SeO2 — ТеО2 — РоО2 кислотный характер оксидов ослабляется. При взаимодействии SeO2 и ТеСЬ с водой образуются селенистая Н25еОз и теллуристая Н2ТеО3 кислоты. [9]
Здесь имеет место общая для всех периодов закономерность, согласно которой кислотный характер оксидов тем выше, чем выше степень окисления элемента. В принципе можно сказать, что чем правее элемент расположен в данном периоде, тем более сильные кислотные свойства можно ожидать от его высшего оксида. [10]
Из этих данных видно, как повышение окислительного числа металла в оксидах приводит к снижению теплоты образования и температуры плавления, что соответствует усилению кислотного характера оксидов. [11]
С другой стороны, различие между металлами и неметаллами проявляется и в химических свойствах: для первых характерны основные свойства оксидов и гидроксидов и восстановительное действие, для вторых — кислотный характер оксидов и гидроксидов и окислительная активность. Ориентируясь на физические свойства, к типичным металлам следует отнести, например, медь, серебро и золото, обладающие наиболее высокой проводимостью и пластичностью. Однако по химическим свойствам эти вещества вовсе не относятся к типичным металлам, поскольку стоят в ряду напряжений правее водорода. В то же время для элементов IA-группы, являющихся по химическим свойствам самыми активными металлами, некоторые физические характеристики ( например, электрическая проводимость) выражены не так ярко. [12]
В зависимости от степени окисления химический характер оксидов может быть различным. С повышением окислительного числа возрастает кислотный характер оксидов, а с понижением — основной. [13]
При сопоставлении элементов подгруппы ванадия с фосфором и азотом наблюдается резкое расхождение свойств производных низших валентностей и закономерный ход изменения характера высших оксидов. Действительно, в ряду N2Os, Р2Ов, V2O5, Nb2Os, Ta20s кислотный характер оксида весьма последовательно ослабляется. [14]
В отличие от марганца орбитали их внешнего и предвнешнего уров пей сближены и внутренние подуровни вносят значительный вклад в образование химических связей. По мере роста степеней окисления возрастает стремление к образованию сложных анионов и усиливается кислотный характер оксидов. Нужно отметить, что, несмотря на большие молекулярные массы гептоксидов Тс207 и Re2O7, они являются летучими соединениями и возгоняются еще до температуры плавления. В этом сказывается характер ковалентных связей в молекулах. [15]
Страницы: 1 2
Химическая реактивность | Grandinetti Group
Водород
В отличие от остальных элементов Группы 1А, которые существуют в виде металлов, элементарный водород существует в виде газообразных молекул H 2 . Соединения, образующиеся между водородом и неметаллами, являются скорее молекулярными, чем ионными. (, то есть , водород образует ковалентные связи с неметаллами). Например, водород реагирует с галогенами (группа VIIA) согласно:
. где X может быть любым галогеном, таким как F, Cl, Br или I. Водород в этих соединениях имеет степень окисления +1, а галогены — -1.Точно так же водород предсказуемо реагирует на другие элементарные неметаллы:2 H 2 (г) + O 2 (г) → 2 H 2 O (г)
8 H 2 (г) + С 8 (с) → 8 H 2 S (г)
3 H 2 (г) + N 2 (г) → 2 NH 3 (г)
Водород может также образовывать соединения с более активными металлами с образованием ионных гидридов . Например, гидрид лития образуется в соответствии с:
2 Li (т) + H 2 (г) → 2 LiH (т)
Металл (в данном случае Li) теряет электрон, чтобы стать катионом, а H приобретает электрон, чтобы стать H — (гидрид-анион), который имеет заряд -1.Вот еще один пример:
Mg (т) + H 2 (г) → MgH 2 (т)
Получая электрон, ион гидрида получает стабильную электронную конфигурацию замкнутой n = 1 оболочки, то есть конфигурацию благородного газа He.
Кислород
Кислород — это элемент группы 6А. Элементарный кислород присутствует в двух формах: газообразный кислород (O 2 ) и газообразный озон (O 3 ). Различные формы элемента в одном и том же состоянии называются Аллотропами .
Реакции кислорода с металлами
Когда кислород реагирует с большинством металлов, образуется оксид металла, где кислород имеет степень окисления -2. Например, оксид цинка образуется, когда металлический цинк реагирует с газообразным кислородом:
2 Zn (т) + O 2 (г) → 2 ZnO (т)
и оксид алюминия образуется, когда металлический алюминий реагирует с газообразным кислородом:
4 Al (т) + 3 O 2 (г) → 2 Al 2 O 3 (с)
Однако есть некоторые исключения, которые мы рассмотрим далее.
Группа IA Металлы — Щелочные металлы
Поскольку щелочные металлы настолько активны, продукт их реакции с газообразным кислородом — это не то, чего можно было ожидать. Хотя металлический литий реагирует с газообразным кислородом с образованием оксида лития, как и следовало ожидать:
4 Li (т) + O 2 (г) → 2 Li 2 O (т) ,
когда металлический натрий реагирует с газообразным кислородом в тех же условиях, он образует пероксид натрия:2 Na (т) + O 2 (г) → Na 2 O 2 (с)
а очень активные щелочные металлы, калий, рубидий и цезий, реагируют с газообразным кислородом с образованием супероксидов:Металлы группы IIA — щелочноземельные металлы
Кислород реагирует с большинством щелочноземельных металлов с образованием оксида металла:
2 М (т) + O 2 (г) → 2 МО (т)
Например,
Однако кислород соединяется с металлическим барием, наиболее активным из этой группы, с образованием пероксида:
Ba (т) + O 2 (г) → BaO 2 (т)
Реакции между кислородом и неметаллами (кроме групп 7A и 8A)
Когда кислород соединяется с неметаллами в их элементарной форме, продукт представляет собой оксид неметалла.Например, кислород реагирует с твердым углеродом с образованием моноксида углерода или диоксида углерода соответственно, как показано ниже (реакция не сбалансирована):
C (т) + O 2 (г) → CO (г) или же CO 2 (г)
Аналогичным образом кислород реагирует с твердым фосфором с образованием гептоксида тетрафорфора или декоксида тетрафорфора соответственно, как показано ниже (реакция не сбалансирована):
П 4 (т) + O 2 (г) → P 4 O 6 (г) или же P 4 O 10 (г)
При взаимодействии с твердой серой кислород образует газообразный диоксид серы:
S 8 (т) + 8 O 2 (г) → 8 SO 2 (г)
Оксидные реакции
Реакции с неметаллическими оксидами
Оксиды неметаллов кислые.Если оксид неметалла растворяется в воде, он образует кислоту.
Оксид неметалла + Вода → Кислота
Например,
SO 3 (г) + H 2 O (л) → H 2 SO 4 (водн.)
N 2 O 3 (г) + H 2 O (л) → HNO 2 (водн.)
Оксиды неметаллов могут быть нейтрализованы основанием с образованием соли и воды.
Оксид неметалла + Основание → Соль + Вода
Например,
SO 3 (г) + Ba (OH) 2 (водн.) → BaSO 4 (водн.) + H 2 O (л)
P 4 O 10 (с) + 12 NaOH (водн.) → 4 Na 3 PO 4 (водн.) + 6 H 2 O (л)
Реакции оксидов металлов
Оксиды металлов основные.Если оксид металла растворяется в воде, он образует гидроксид металла.
Оксид металла + Вода → Гидроксид металла
Например,
BaO (т) + H 2 O (л) → Ba (OH) 2 (водн.)
К 2 O (т) + H 2 O (л) → 2 КОН (водн.)
Как любое основание, эти основания можно нейтрализовать кислотой с образованием соли и воды.
Оксид металла + Кислота → Соль + Вода
Примеры:
CuO (т) + 2 HNO 3 (водн.) → Cu (NO 3 ) 2 (водн.) + H 2 O (л)
Al 2 O 3 (с) + 6 HCl (водн.) → 2 AlCl 3 (водн.) + 3 H 2 O (л)
Как правило, чем более металлический характер имеет элемент, тем более основным будет его оксид.Точно так же, чем более неметаллический характер имеет элемент, тем более кислым будет его оксид. Металлический характер элемента можно определить по его положению в таблице Менделеева:
Наконец, отметим, что соль также может быть образована в результате прямой реакции металла и неметалла.
Металл + Неметалл → Соль
Например,
2 Al (т) + 3 Br 2 (л) → 2 AlBr 3 (т)
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
7,53, 7,55, 7,57, 7,59, 7,61, 7,65, 7,67, 7,69, 7,71, 7,73, 7,77
КИСЛОТНО-ОСНОВНОЕ ПОВЕДЕНИЕ ОКСИДОВ ПЕРИОДА 3 На этой странице рассматриваются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо. Очевидно, что аргон не используется, поскольку он не образует оксид. Краткое описание тенденции Оксиды Мы будем рассматривать следующие оксиды:
| |||||||||||||||
Примечание: Если вы еще не были там, возможно, вам будет интересно просмотреть страницу о структурах и физических свойствах оксидов Периода 3 в качестве полезного введения, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже, если вы решите перейти по этой ссылке. | |||||||||||||||
Тенденция кислотно-щелочного поведения Тенденция кислотно-основного поведения показана в различных реакциях, но в виде простого обобщения:
Для этой простой тенденции вы должны смотреть только на самые высокие оксиды отдельных элементов. Это те, которые находятся в верхнем ряду выше, и там, где элемент находится в максимально возможной степени окисления. Картина не так проста, если вы включите и другие оксиды. Для оксидов неметаллов их кислотность обычно рассматривается в терминах кислотных растворов, образующихся при их реакции с водой — например, триоксид серы реагирует с образованием серной кислоты.Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия. Все эти реакции подробно рассматриваются на оставшейся части этой страницы. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много деталей о различных оксидах. Не упускайте из виду общую тенденцию в отношении самых высоких оксидов за этот период, когда смотрите на все эти детали. Важно знать, что ваша программа говорит по этой теме, а также изучать прошлые работы и схемы отметок — иначе вы в конечном итоге увязнете в массе деталей, о которых вам действительно не нужно знать.Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет ничего из этого, перейдите по этой ссылке, прежде чем идти дальше, чтобы узнать, как их получить. | |||||||||||||||
Химия индивидуальных оксидов Оксид натрия Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к соединению с ионами водорода. Реакция с водой Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. В зависимости от концентрации он будет иметь pH около 14. Реакция с кислотами Оксид натрия, как сильное основание, также вступает в реакцию с кислотами. Например, он будет реагировать с разбавленной соляной кислотой с образованием раствора хлорида натрия. Оксид магния Оксид магния также является простым основным оксидом, поскольку он также содержит ионы оксида.Однако он не так сильно щелочной, как оксид натрия, потому что ионы оксида не так свободны. В случае оксида натрия твердое тело удерживается вместе за счет притяжения между ионами 1+ и 2-. В случае оксида магния притяжение составляет от 2+ до 2-. Чтобы их сломать, требуется больше энергии. Даже с учетом других факторов (таких как энергия, выделяемая, когда положительные ионы притягиваются к воде в образовавшемся растворе), общий эффект этого заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия. Реакция с водой Если встряхнуть немного белого порошка оксида магния с водой, ничего не произойдет — похоже, он не отреагирует. Однако, если вы проверите уровень pH жидкости, вы обнаружите, что он находится где-то около 9, что свидетельствует о слабощелочной активности. Должна быть какая-то небольшая реакция с водой с образованием гидроксид-ионов в растворе. В реакции образуется некоторое количество гидроксида магния, но он почти нерастворим, поэтому не так много гидроксид-ионов действительно попадает в раствор. Реакция с кислотами Оксид магния реагирует с кислотами так же, как и любой простой оксид металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния. оксид алюминия Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах. Одна из этих форм очень инертна.Химически он известен как альфа-Al 2 O 3 и производится при высоких температурах. Далее мы предполагаем одну из наиболее реактивных форм. Оксид алюминия амфотерный . Он вступает в реакцию как с основанием, так и с кислотой. Реакция с водой Оксид алюминия не реагирует с водой простым образом в том смысле, в каком реагируют оксид натрия и оксид магния, и не растворяется в ней.Хотя он все еще содержит ионы оксида, они слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой. | |||||||||||||||
Примечание: Однако некоторые формы оксида алюминия действительно очень эффективно поглощают воду. Я не смог установить, связано ли это поглощение только с такими вещами, как водородные связи, или происходит настоящая химическая реакция с образованием какого-то гидроксида. Если у вас есть надежная информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. | |||||||||||||||
Реакция с кислотами Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Это означает, например, что оксид алюминия будет реагировать с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия. В этой (и подобных реакциях с другими кислотами) оксид алюминия демонстрирует основную сторону своей амфотерной природы. Реакция с основаниями Оксид алюминия также имеет кислотную сторону в своей природе, и это проявляется в реакции с основаниями, такими как раствор гидроксида натрия. Образуются различные алюминаты — соединения, в которых алюминий находится в отрицательном ионе. Это возможно, потому что алюминий обладает способностью образовывать ковалентные связи с кислородом. В случае натрия разница электроотрицательностей между натрием и кислородом слишком велика для образования чего-либо, кроме ионной связи.Но электроотрицательность увеличивается по мере прохождения периода, а разница электроотрицательностей между алюминием и кислородом меньше. Это позволяет образовывать ковалентные связи между ними. | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете ее объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | |||||||||||||||
С горячим концентрированным раствором гидроксида натрия оксид алюминия реагирует с образованием бесцветного раствора тетрагидроксоалюмината натрия. | |||||||||||||||
Примечание: Вы можете найти множество других формул, приведенных для продукта этой реакции. Они варьируются от NaAlO 2 (который является дегидратированной формой той, что указан в уравнении) до Na 3 Al (OH) 6 (который представляет собой совершенно другой продукт). То, что вы действительно получите, будет зависеть от таких вещей, как температура и концентрация раствора гидроксида натрия. В любом случае, правда почти наверняка намного сложнее, чем что-либо из вышеперечисленного.Это тот случай, когда было бы неплохо узнать, что ваши экзаменаторы цитируют в своих вспомогательных материалах или схемах выставления оценок, и придерживаться этого. При необходимости получите такую информацию от экзаменаторов (если вы изучаете курс в Великобритании), перейдя по ссылкам на странице учебных программ. | |||||||||||||||
Диоксид кремния (оксид кремния (IV)) К тому времени, когда вы дойдете до кремния в течение периода, электроотрицательность увеличится настолько, что уже не будет достаточной разницы в электроотрицательности между кремнием и кислородом для образования ионных связей. Диоксид кремния не имеет основных свойств — не содержит оксидных ионов и не вступает в реакцию с кислотами. Вместо этого он очень слабокислый, реагируя с сильными основаниями. Реакция с водой Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры. Реакция с основаниями Диоксид кремния реагирует с раствором гидроксида натрия, но только если он горячий и концентрированный.Образуется бесцветный раствор силиката натрия. Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием. Важно! Что касается остальных оксидов, мы в основном будем рассматривать результаты их реакции с водой с образованием растворов различных кислот. Когда мы говорим о повышении кислотности оксидов по мере перехода, скажем, от оксида фосфора (V) к триоксиду серы к оксиду хлора (VII), то обычно мы говорим о возрастающей силе кислот, образующихся при их реакции. с водой. Оксиды фосфора Мы собираемся рассмотреть два оксида фосфора, оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора (III) Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты H 3 PO 3 , известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота. Его реакция с горячей водой намного сложнее. | |||||||||||||||
Примечание: Обратите внимание на окончание «-ous» в первых двух именах. Это не орфографическая ошибка — это правда! Его используют, чтобы отличить его от фосфорной кислоты, которая совершенно иная (см. Ниже). Названия фосфорсодержащих кислот просто кошмар! (На самом деле, насколько я понимаю, фосфорные кислоты в целом всегда были и продолжают быть полным кошмаром!) Не беспокойтесь об этих названиях на этом уровне. Просто убедитесь, что вы можете написать формулы, если вам это нужно — и будьте благодарны за то, что вам больше не нужно о них знать! | |||||||||||||||
Чистая неионизированная кислота имеет структуру: Водороды не выделяются в виде ионов до тех пор, пока вы не добавите в кислоту воду, и даже в этом случае выделяется немного, потому что фосфористая кислота — это всего лишь слабая кислота. Фосфорная кислота имеет pK a , равное 2,00, что делает ее более сильной, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76). | |||||||||||||||
Примечание: Если вы знаете о pK a , но не очень уверены, вы можете перейти по этой ссылке, но это, вероятно, займет у вас много времени. Все, что вам действительно нужно знать по этой теме, — это то, что чем ниже значение pK на , тем сильнее кислота. | |||||||||||||||
Маловероятно, что вы когда-нибудь прореагируете напрямую оксидом фосфора (III) с основанием, но вам может потребоваться знать, что произойдет, если вы прореагируете образовавшуюся фосфористую кислоту с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а другой — нет. Это означает, что вы можете получить две возможные реакции, например, с раствором гидроксида натрия в зависимости от используемых пропорций. В первом случае только один из кислых атомов водорода прореагировал с гидроксид-ионами основания. Во втором случае (с использованием вдвое большего количества гидроксида натрия) прореагировали оба. Если бы вы взаимодействовали оксид фосфора (III) непосредственно с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. | |||||||||||||||
Примечание: Проверьте свой учебный план, прошлые работы и схемы отметок, прежде чем вы слишком увязнете в этом! Перейдите по этой ссылке, чтобы узнать, как получить их, если у вас их еще нет (только для учебных программ в Великобритании). | |||||||||||||||
Оксид фосфора (V) Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий.Обычно мы просто рассматриваем одну из них, фосфорную (V) кислоту, H 3 PO 4 , также известную как фосфорная кислота или ортофосфорная кислота. На этот раз чистая неионизированная кислота имеет структуру: Фосфорная (V) кислота также является слабой кислотой с pK a , равным 2,15. Это делает его на слабее фосфористой кислоты. Растворы обеих этих кислот с концентрацией около 1 моль дм -3 будут иметь pH около 1. Еще раз, вы вряд ли когда-нибудь прореагируете этот оксид с основанием, но вполне можно ожидать, что вы узнаете, как фосфорная (V) кислота реагирует с чем-то вроде раствора гидроксида натрия. Если вы посмотрите на структуру, вы увидите, что она имеет три группы -ОН, и каждая из них имеет кислый атом водорода. Вы можете провести реакцию с гидроксидом натрия в три стадии, причем один за другим эти атомы водорода вступают в реакцию с ионами гидроксида. Опять же, если бы вы реагировали непосредственно оксидом фосфора (V) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. Это становится смешным, поэтому я приведу только один пример из возможных уравнений: | |||||||||||||||
Примечание: Если на экзамене вам задают вопрос, в котором вам просто нужно написать уравнение реакции гидроксида натрия с фосфорной (V) кислотой, какое уравнение вам следует написать? Это не имеет особого значения — все они совершенно верны. В каждом случае это просто зависит от пропорций двух используемых вами реагентов. Если вы действительно хотите быть уверенным, проверьте прошлые документы и отметьте схемы. Я нашел один вопрос о реакции между оксидом натрия и фосфорной (V) кислотой, где схема маркировки принимала любое из возможных уравнений — чего я и ожидал. (Я знаю, что не давал вам этот конкретный набор уравнений, но их нетрудно решить, если вы понимаете принцип, и я не могу дать каждое отдельное кислотно-основное уравнение. Это уже давно страница будет длиться вечно, и все в отчаянии сдадутся задолго до конца! Вот почему вы пытаетесь понять химию, а не изучать ее как попугай.) Пожалуйста, не тратьте время на изучение уравнений — или, по крайней мере, до тех пор, пока вы не узнаете и не поймете всю остальную химию, которую вам нужно знать и понимать! У любого уравнения очень мало шансов пройти экзамен, даже если оно входит в вашу конкретную программу. Жизнь слишком коротка, чтобы тратить время на изучение уравнений. Знайте, как их решить, если вам нужно. | |||||||||||||||
Оксиды серы Мы собираемся рассмотреть диоксид серы, SO 2 , и триоксид серы, SO 3 . Диоксид серы Диоксид серы хорошо растворяется в воде, реагируя с ней с образованием раствора, известного как сернистая кислота, который традиционно имеет формулу H 2 SO 3 . Однако основным веществом в растворе является просто гидратированный диоксид серы — SO 2 , xH 2 O. Спорный вопрос, существует ли вообще в растворе какая-либо H 2 SO 3 как таковая. Сернистая кислота также является слабой кислотой с pK a около 1.8 — немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты снова будет иметь pH около 1. . | |||||||||||||||
Примечание: Существует некоторая изменчивость pK и значения для серной кислоты, указанного различными источниками для серной кислоты — от 1,77 до 1,92. У меня нет возможности узнать, что из этого правильное. Ионизация «серной кислоты» включает ионизацию гидратированного комплекса, и вам не нужно беспокоиться об этом на этом уровне. | |||||||||||||||
Диоксид серы также будет напрямую реагировать с основаниями, такими как раствор гидроксида натрия. Если диоксид серы барботируют через раствор гидроксида натрия, сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, когда диоксид серы оказывается в избытке. | |||||||||||||||
Примечание: Сульфит натрия также называют сульфатом натрия (IV).Гидросульфит натрия также является гидросульфатом натрия (IV) или бисульфитом натрия. Обратите внимание, что уравнения для этих реакций отличаются от примеров фосфора. В этом случае мы реагируем непосредственно оксид с гидроксидом натрия, потому что мы, скорее всего, будем это делать именно так. | |||||||||||||||
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (сульфата кальция (IV)).Это лежит в основе одного из методов удаления диоксида серы из дымовых газов на электростанциях. Трехокись серы Триоксид серы бурно реагирует с водой с образованием тумана из концентрированных капель серной кислоты. | |||||||||||||||
Примечание: Если вы знаете о контактном процессе производства серной кислоты, вы знаете, что триоксид серы всегда преобразуется в серную кислоту циклическим способом, чтобы избежать проблемы сернокислотного тумана. Если вам интересно, вы можете найти подробную информацию о процессе обращения в другом месте на этом сайте, но это не относится к текущей теме. | |||||||||||||||
Чистая неионизированная серная кислота имеет структуру: Серная кислота — сильная кислота, и растворы обычно имеют pH около 0. Кислота реагирует с водой, давая ион гидроксония (ион водорода в растворе, если хотите) и ион сероводорода.Эта реакция проходит практически на 100%. Второй водород удалить труднее. На самом деле ион сероводорода является относительно слабой кислотой, по силе сходной с кислотами, которые мы уже обсуждали на этой странице. На этот раз вы получите равновесие: Серная кислота, конечно, имеет все реакции сильной кислоты, с которыми вы знакомы из вводных курсов химии. Например, нормальная реакция с раствором гидроксида натрия заключается в образовании раствора сульфата натрия, в котором оба кислых водорода реагируют с ионами гидроксида. В принципе, вы также можете получить раствор гидросульфата натрия, используя вдвое меньше гидроксида натрия и просто взаимодействуя с одним из двух кислых водородов в кислоте. На практике лично я никогда этого не делал — на данный момент не вижу особого смысла! Сам по себе триоксид серы также вступает в непосредственную реакцию с основаниями с образованием сульфатов. Например, он будет реагировать с оксидом кальция с образованием сульфата кальция. Это похоже на реакцию с диоксидом серы, описанную выше. Оксиды хлора Хлор образует несколько оксидов, но единственные два, упомянутые в любой из учебных программ уровня A Великобритании, — это оксид хлора (VII), Cl 2 O 7 , и оксид хлора (I), Cl 2 O. Хлор ( VII) оксид также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора. Оксид хлора (VII) Оксид хлора (VII) — это высший оксид хлора — хлор находится в максимальной степени окисления +7.Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорноватой (VII) кислоты, также известной как хлорная кислота. PH типичных растворов, как и серной кислоты, будет около 0, .Неионизированная хлорная (VII) кислота имеет структуру: Вероятно, вам это не понадобится для целей UK A level (или его эквивалентов), но это полезно, если вы понимаете причину, по которой хлорная (VII) кислота является более сильной кислотой, чем хлорная (I) кислота (см. Ниже) .Вы можете применить те же рассуждения к другим кислотам на этой странице. Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери иона водорода (например, когда он реагирует с водой), заряд может быть делокализован по каждому атому кислорода в ионе. Это делает его очень стабильным и означает, что хлорная (VII) кислота очень сильна. | |||||||||||||||
Примечание: Это похоже на делокализацию, которая происходит в этаноат-ионе, образующемся, когда этановая кислота ведет себя как слабая кислота.Вы найдете это более подробно на странице, посвященной органическим кислотам. Используйте кнопку НАЗАД в браузере, если вы решите перейти по этой ссылке. | |||||||||||||||
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII). Сам оксид хлора (VII) также реагирует с раствором гидроксида натрия с образованием того же продукта. Оксид хлора (I) Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).Он до некоторой степени реагирует с водой с образованием хлорноватистой (I) кислоты HOCl, также известной как хлорноватистая кислота. | |||||||||||||||
Примечание: Вы также можете найти хлорную (I) кислоту, записанную как HClO. Форма, которую я использовал, более точно отражает способ соединения атомов. | |||||||||||||||
Структура хлорноватой (I) кислоты в точности такая, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образовавшемуся в результате потери водорода. Это означает, что образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой водород, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43). Хлорная (I) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия). Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта.
В меню «Период 3».. . В меню «Неорганическая химия». . . В главное меню. . . © Джим Кларк 2005 (последнее изменение — ноябрь 2015 г.) | |||||||||||||||
Свойства металлических и неметаллических элементов — Металлы и неметаллы — Eduqas — Объединенная научная редакция GCSE — Eduqas
Металлы расположены в левой части периодической таблицы, а неметаллы — в правой.
Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | Неметаллы | |
|---|---|---|
| Блестящий | Тусклый | |
| Высокие точки плавления | Низкие точки плавления | |
| Хорошие проводники тепла | Плохие проводники тепла | |
| Высокая плотность | Низкая плотность | |
| Ковкий и пластичный | Хрупкий |
Некоторые элементы обладают нетипичными свойствами.Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- графит, форма углерода (неметалл), имеет высокую температуру кипения и также является хорошим проводником. электричества
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.
Тягучие вещества можно сгибать или придавать им форму без разрушения, в то время как хрупкие вещества разбиваются при сгибании или ударе.
Дуктильный означает, что вещество можно растянуть в длинную проволоку без разрывов и разрывов.
Химические свойства
Металлы и неметаллы также можно отличить по некоторым химическим свойствам.
Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Некоторые оксиды не растворяются в воде, поэтому они не влияют на цвет индикатора, добавляемого в воду.
- Вопрос
Элемент таллий образует оксид Tl 2 O. Оксид таллия не растворяется в воде, но реагирует с кислотами с образованием солей таллия. Таллий — это металл или неметалл? Поясните свой ответ.
- Показать ответ
Таллий — это металл. Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, которые являются основаниями.
Металлы подвержены коррозии чаще, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы.
| СЧ5С
Лаборатория №4 — Оксиды металлов и неметаллов | ||||||||||||||||||||||||||
| Введение: когда элементы при сжигании в кислороде они образуют соединения, называемые оксидами.В этом эксперименте вы будете сжигать несколько металлов и неметаллов в кислороде и наблюдать за оксидами произведено. Оксиды ряда элементов растворяются в вода с образованием кислых или основных растворов. Вы можете определить, раствор является кислым или щелочным по результатам тестирования кислотно-щелочным индикатором. Разве оксиды металлов ведут себя в воде иначе, чем оксиды неметаллов? В этом упражнении вы будете искать взаимосвязь между типами элемент (металл или неметалл) сгорел и тип раствора (кислотный или основной) образованный оксидом. | ||||||||||||||||||||||||||
| Задача: Есть ли растворы оксидов металлов отличаются от оксидов неметаллов? | ||||||||||||||||||||||||||
| Аппарат: щипцы для тигля, дефлагрирующие ложка, горелка Бунзена, подставка под горячее, газовые баллоны и стеклянные тарелки | ||||||||||||||||||||||||||
| Материалы: лакмусовая бумага или бромтимол синий индикатор, кислородный баллон, древесный уголь, стальная вата, сера, лента магния, металлический натрий, вода дистиллированная, фосфор красный. | ||||||||||||||||||||||||||
| Процедура: Вопросы безопасности: Носите защитные очки, Не смотрите прямо на жгучий магний. Не превышайте указанное количество элементов. в процедуре.
| ||||||||||||||||||||||||||
Заключительные вопросы
|
Оксиды элементов третьего ряда и их классификация
Наука> Химия> Элементы третьего ряда> Оксиды элементов третьего рядаБинарное соединение элемента с кислородом, в котором атом кислорода является электроотрицательным, называется оксидом.например MgO, Al 2 O 3, и т. Д. Оксид, в котором кислород имеет нормальную степень окисления -2, называется нормальным оксидом. В этой статье мы изучим оксиды элементов третьего ряда.
Классификация оксидов:
В зависимости от химического поведения оксиды элементов третьего ряда подразделяются на три типа, а именно: i) кислотные оксиды Na 2 O, MgO ii) основные оксиды SiO 2 , SO 3 , Cl 2 O 7, P 2 O 5 и iii) амфотерные оксиды Al 2 O 3 .
Основные оксиды:
Оксиды, которые вступают в реакцию с водой с образованием щелочи и могут нейтрализовать кислоты с образованием соли и воды, называются основными оксидами.
Na 2 O натрия и MgO магния третьего ряда являются основными оксидами. Поскольку оба оксида образуют щелочь при обработке водой и могут нейтрализовать кислоту, выделяющую соль и воду.
Na 2 O + H 2 O → 2 NaOH (сильное основание)
Na 2 O + 2 HCl → 2 NaCl + h3O
MgO + 2 H 2 O → Mg (OH) 2 (основание)
MgO + 2 HCl → MgCl 2 + H 2 O
Na и Mg имеют больший атомный размер.1 и 2 валентных электрона соответственно и очень низкое значение потенциала ионизации.
Амфотерный оксид:
Оксид, который действует как кислота, а также как основание и нейтрализует кислоту, а также основание с образованием соли и воды, называется амфотерным оксидом.
Al 2 O 3 алюминия представляет собой амфотерный оксид. Он нейтрализует кислоты, такие как HCl, а также основания, такие как NaOH.
Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды.
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 (алюминат натрия) + H 2 O
Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды.
Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Алюминий имеет более высокие I.P. чем натрий, и его электроотрицательность больше, чем у металлов Mg и Na. Таким образом, связь Al-O в Al 2 O 3 имеет амфотерную природу.
Кислые оксиды:
Оксиды электроотрицательных элементов, которые при обработке водой дают кислоту и могут нейтрализовать основания с образованием соли и воды, называемых кислотными оксидами.
Оксиды фосфора, серы, хлора являются кислыми.
SiO 2 + 2 NaOH → Na 2 SiO 3 + H 2 O
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
SO 3 + H 2 O → H 2 SO 4
SO 3 + 2 Na OH → Na 2 SO 4 + H 2 O
Класс 2 O 7 + H 2 O → 2 HClO 4 (хлорная кислота)
Класс 2 O 7 + 2 Na OH → 2 NaClO 4 + H 2 O
Si, P, S и Cl имеют больший потенциал ионизации, электроотрицательность, склонность к притяжению электронов.У них меньше атомный размер и больше валентных электронов.
Тенденция кислотных и основных характеристик:
Тренд:
Обычно оксиды металлов имеют основную природу, а оксиды неметаллов — кислые. По мере продвижения от Na к Cl в третьем периоде кислотный характер элементов постепенно увеличивается, в то время как основной характер продолжает уменьшаться.
Причины:- В элементах третьего ряда те элементы, которые имеют низкий потенциал ионизации, больший размер атома, меньшую электроотрицательность, меньшее количество валентных электронов, образуют основные оксиды, поскольку их оксиды при обработке водой дают щелочи.
- С другой стороны, те элементы, которые имеют больший потенциал ионизации, меньший размер атома, большую электроотрицательность, больше валентных электронов, образуют кислые оксиды. Такие оксиды дают кислоты при обработке водой.
- Тенденция такова, потому что от Na к Cl во время третьего периода потенциал ионизации постепенно увеличивается, размер атома уменьшается, количество валентных электронов увеличивается.
Na 2 O и MgO Na и Mg, соответственно, имеют очень щелочную природу.При обработке водой они выделяют щелочи. Они нейтрализуют кислоты. Na и Mg имеют очень низкий потенциал ионизации среди элементов третьего ряда.
Na 2 O + H 2 O → 2 NaOH (сильное основание)
Na 2 O + 2 HCl → 2 NaCl + h3O
MgO + 2 H 2 O → Mg (OH) 2 (основание)
MgO + 2 HCl → MgCl 2 + H 2 O
Оксиды электроотрицательных элементов, таких как Si, P, S.и Cl имеют кислую природу. Их оксиды дают кислоты, когда их обрабатывают водой, они могут нейтрализовать основание, производящее соль и воду. Элементы Si, P, S и Cl имеют больший потенциал ионизации, больше валентных электронов, большую электроотрицательность.
SiO 2 + 2 NaOH → Na 2 SiO 3 + H 2 O
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
SO 3 + H 2 O → H 2 SO 4
SO 3 + 2 Na OH → Na 2 SO 4 + H 2 O
Класс 2 O 7 + H 2 O → 2 HClO 4 (хлорная кислота)
Cl 2 O 7 + 2 NaOH → 2 NaClO 4 + H 2 O
Al 2 O 2 алюминия является амфотерным, поскольку он нейтрализует кислоту, а также соли, образующие основание, и воды.Из-за двойственности его называют амфотерным.
Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды.
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 (алюминат натрия) + H 2 O
Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды.
Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Оксиды элементов третьего ряда приведены в следующей таблице.
| Элемент | Na | Mg | Al | Si | P | S | Cl | |||||||||||||||||||||||||||||||||||||||||
| Гидрокси-соединение | NaOH | Mg | Si (OH) 3 | P (OH) 3 PO (OH) 3 | SO (OH) 2 SO2 (OH) 2 | ClO 3 (OH) ) ClO 2 (OH) | ||||||||||||||||||||||||||||||||||||||||||
| Природа | очень сильное основание | сильное основание | Амфотерное | очень слабое Кислотное | слабое Кислотное | сильнокислотное | очень сильное кислотное Причины: Оксид натрия более щелочной, чем оксид магния. Бинарное соединение элемента с кислородом, в котором атом кислорода является электроотрицательным, называется оксидом. Оксиды, которые реагируют с водой и образуют щелочь и могут нейтрализовать кислоты, образуя соль и воду, называются основными оксидами. Na 2 O, MgO — основные оксиды. Эти оксиды образуют щелочь при обработке водой и могут нейтрализовать кислотообразующие соли и воду. Натрий является более электроположительным элементом, чем магний. Натрий имеет более низкий потенциал ионизации и меньшую электроотрицательность, чем магний. По вышеуказанным причинам натрий очень легко теряет свои электроны по отношению к кислороду, чем магний, и действует как более основной, чем магний. Наука> Химия> Элементы третьего ряда> Оксиды элементов третьего рядаОпределенный элемент представляет собой металлоид, который образует кислый оксид с формулой R 2 O 5. Определите элемент.Рассмотрим реакцию между газообразным кислородом (O2) и металлическим магнием с образованием оксида магния. Используя стат. Окисления… Химия: первый подход к атомам В рамках научного проекта вы изучаете схемы дорожного движения в вашем городе на перекрестке в центре спада … Вводная химия: основа Для реакцииh3 ( g) + I2 (g) 2HI (g), рассмотрите две возможности: (a) вы смешиваете 0,5 моля каждого реагента. разрешить … Химия . Стул стоматолога с человеком в нем весит 1900 Н. Выходной плунжер гидросистемы запускает подъем… Исследование физики Автомобильная шина рассчитана на 50 000 миль. Оцените количество оборотов, которые шина сделает за … College Physics Разделитесь на две группы. Одна группа будет выступать в поддержку использования суперпродуктов, а одна группа будет возражать против … Nutrition РИСУНОК 10.8 Недавно извергнувшаяся базальтовая лава на острове Гавайи. Расплавленный базальт обычно извергается при очень высокой … Основы физической географии Каждая позиция кодона может быть занята одним из четырех нуклеотидов.Какое минимальное количество нуклеотидов … Биология: единство и разнообразие жизни (список курсов MindTap) Что лучше — есть обработанные продукты, обогащенные фитохимическими веществами, или есть натуральные … Понимание питания (список курсов MindTap) Оценить и синтезировать 15. ИНТЕРПРЕТНЫЕ ДАННЫЕ Согласно кладограмме на рис. 27-5, какие растения развились первыми … Биология (список курсов MindTap) Что из следующего является примером обработанной пищи? а.морковь б. хлеб c. орехи d. арбуз Питание: концепции и противоречия — отдельная книга (список курсов MindTap) Астрология, эта маловероятная и туманная псевдонаука, во многом определяет положение планет на момент изучения … College Physics 29. Рассчитайте формулу массы для каждого соединения: Chemistry In Focus Автомобильные аккумуляторы заправлены водным раствором серной кислоты. Какая масса кислоты (в грамм… Химия и химическая реактивность Вылетает ли объект вертикально вверх при свободном падении? Объяснять. Введение в физику Объясните разницу между молекулярной формулой и эмпирической формулой. Химия для студентов инженерных специальностей Ответы на все задачи находятся в конце этой книги. Подробные решения доступны в Решениях для студентов … Биохимия Бактерия __________ выберите все подходящие варианты.а. организм c. животное c. одноклеточные d. эукариот БИОЛОГИЯ: КОНЦЕПЦИИ + ПРИМЕНЕНИЕ (СВОБОДНЫЙ) ______ являются барьерами для патогенов на поверхности тела. а. Неповрежденная кожа и слизистые оболочки b. Слезы, слюна и … Биология человека (список курсов MindTap) Джозиа, 22-месячный мальчик, живет со своей матерью и бабушкой. Он находится в центре дошкольного … Питание на протяжении жизненного цикла Что такое ядрышко и какова его функция? Биология: динамическая наука (список курсов MindTap) -116 Если вы хотели амплифицировать ДНК с помощью метода, аналогичного ПЦР, но у вас не было источника термостойкой ДНК… Введение в общую, органическую и биохимию Какие три астрономических объекта представлены на рисунке UN 4-5? Какие два кольца? Горизонты: исследование Вселенной (Список курсов MindTap) Дочь Шона и Мишель Молли, 6 лет, страдала от повторяющихся бактериальных инфекций легких с тех пор, как … Человеческая наследственность: принципы и проблемы (Список курсов MindTap) RECALL Какое качество цвиттерионов делает их желательными буферами? Биохимия Случай 2 4.Если бикарбонат натрия изначально вводился для коррекции низкого уровня pH пациента, pH a … Сердечно-легочная анатомия и физиология Измените уравнение Клаузиуса-Клапейрона, уравнение 6.14 в терминах давления p2 материала. Постройте график va … Physical Chemistry Используйте подъемную сетку, чтобы найти процент легирующей примеси для коммерчески доступного полупроводника p-типа. Представьте себе, что … Химия для студентов инженерных специальностей Выполните следующие преобразования метрической системы, изменив только степень 10.Например, преобразовать 2,5 л в мл: 2 … Химия сегодня: общие, органические и биохимические Энтальпия реакции Сколько энергии в килокалориях выделяется при полном сгорании 386 г изооктана … Chemistry In Focus Воздух на 21% состоит из кислорода по объему. Кислород имеет плотность 1,31 г / л. Каков объем в литрах комнаты, в которой находится … Химия: принципы и реакции Пиридин представляет собой плоскую гексагональную молекулу с валентным углом 120 °.Он подвергается замене, а не добавлению … Органическая химия Рассмотрим исходную смесь газов N2 и h3, которую можно представить следующим образом: Газы реагируют с образованием боеприпасов … Химия Предположим, вы заметили, что все рыбы в пруду исчезли. Как вы могли бы использовать научный процесс? … Наука об окружающей среде (Список курсов MindTap) При горизонтальном расстоянии 45 м от низа дерева угол подъема к вершине дерева равен 26… College Physics Что вам нужно сделать, чтобы соответствовать Руководству по физической активности для американцев? Каковы преимущества, если вы это сделаете? … Питание на протяжении всего жизненного цикла (Список курсов MindTap) Простой акселерометр создается внутри автомобиля путем подвешивания объекта массы m на веревке длиной L … Физика для ученых и инженеров Опишите угрозы для многих видов земноводных в мире и объясните, почему мы не должны торопиться с экстазом… Наука об окружающей среде (список курсов MindTap) На следующих диаграммах представлена реакция A2 (красные сферы) с B2 (синие сферы) с образованием конкретного продукта … Общая, органическая и биологическая химия Белки представляют собой неразветвленные полимеры природного происхождения, в которых мономеры представляют собой a. монокарбоновые кислоты b. dicar … Органическая и биологическая химия Сопоставьте каждому термину наиболее подходящее описание. _____ двуокись углерода a.содержит тройную связь _____ нитрат … Биология: единство и разнообразие жизни (список курсов MindTap) Обзор. Самая большая чучела в мире — змея длиной 420 м, сконструированная норвежскими детьми. Suppo … Физика для ученых и инженеров, Обновление технологий (коды доступа не включены) Железный пирит (золото дураков, стр. 11) имеет блестящий золотистый металлический вид. Кристаллы часто имеют форму пе … Химия и химическая реакционная способность Если 1.62 м3 воздуха при 120 ° C и 738 торр сжимается в резервуар емкостью 0,140 м3, а температура повышается до 280 … Введение в химию: подход активного обучения Напишите уравнения реакции каждого соединения с h3SO4, a сильная протонная кислота. (a) Ch4OCh4 (b) Ch4Ch3SCh3C … Organic Chemistry Выведите выражение для работы, необходимой для перемещения спутника Земли массы m с круговой орбиты радиуса … Physics for Science and Engineers with Modern Физика Чем раствор отличается от смеси? Океанография: приглашение в морскую науку, свободная версия, версия Два иона ускоряются из состояния покоя в масс-спектрометре, работающем с разностью потенциалов V.Первый ион, … Физика для ученых и инженеров: основы и связи Каким должен быть внутренний состав Титана, если его плотность составляет 1,9 г / см3? Откуда вы знаете? Основы астрономии (Список курсов MindTap) Реакции элементов периода 3 и их оксидовТретий период в периодической таблице представляет интересную химию в форме элементов и их оксидов, которые претерпевают множество реакций. Период 3 Периодической таблицы показан ниже: Стол — 1
Тенденция электроотрицательности низкая → → → → высокая Электроотрицательность — это химическое свойство, количественная мера того, насколько сильно атом удерживает свои электроны.Тип связи в оксидах может быть определен путем оценки разницы в электроотрицательности между кислородом и элементом. Электроотрицательность кислорода 3,5. Электроотрицательность элементов периода 3 (с использованием шкалы электроотрицательности атомов Полинга) и различия в электроотрицательности каждого элемента и кислорода показаны в таблице 1. За период, когда мы переходим от левой стороны к правой, то есть от Na к Ar, электроотрицательность увеличивается из-за увеличения количества зарядов на ядре. В оксидах кислород притягивает электроны к себе в гораздо большей степени, чем металлы (Na, Mg и Al), поэтому атом кислорода оттягивает электроны от атома металла, в результате чего образуются два иона: анион кислорода, O 2- ; катион металла, Na + , Mg 2+ , Al 3+ и ионные связи. Это твердые оксиды, а силы электростатического притяжения удерживают ионы кислорода и металлов в упорядоченных трехмерных структурах, решетках. Оксиды металлов состоят из гигантских структур с сильным притяжением между ионами.Для разрушения этих аттракционов требуется много тепловой энергии, поэтому эти оксиды твердые и имеют высокие температуры плавления. Другие элементы периода 3: Si, P, S и Cl больше похожи на кислород по электроотрицательности, поэтому электроны, составляющие связь между атомами, больше разделяются, чем притягиваются одним из них. Таким образом, эти элементы образуют ковалентную связь в своих оксидах. SiO 2 образует твердую трехмерную сетку, называемую кремнеземом, аналогичную структуре алмаза.Кремнезем очень твердое вещество при комнатной температуре с высокой температурой плавления. Оксиды фосфора P 4 O 10 а сера SO 2 и SO 3 и хлор — все это небольшие дискретные ковалентные молекулы. Некоторые из этих молекул индивидуальны, а некоторые — полимеры. Между этими молекулами действуют межмолекулярные силы типа дисперсионных сил Ван-дер-Ваальса или диполь-дипольных взаимодействий, и они определяют низкую температуру плавления этого типа оксидов, намного более низкую, чем у оксидов металлов. При взаимодействии элементов с кислородом образуются продукты — оксиды. Оксиды всех элементов периода 3, кроме Cl и Ar, могут быть получены одним и тем же методом: сжиганием элемента в воздухе в реакции горения, когда элемент вступает в реакцию с кислородом воздуха с образованием оксида элемента. Ar является благородным газом и не образует оксидов, а Cl — оксидов (Cl 2 O, ClO 2 , Cl 2 O 7 ), которые нестабильны и не могут быть получены этим способом. Наблюдая период 3 Периодической таблицы слева направо, мы можем прийти к некоторым выводам:
Вода, хотя и очень слабый окислитель, но очень легко и быстро окисляет натрий.Полученный раствор является сильно щелочным и имеет pH 14: .2Na (с) + 2H 2 O → 2Na + + 2OH — + H 2 (г) Магний медленно реагирует с холодной водой, но очень экзотермически с горячей водой и паром и дает оксид: Mg (т) + H 2 O (г) → MgO (т) + H 2 (г) Реакции окисления:
Реакция трех периодических оксидов с водой будет следующей:
Гидроксиды этого металла: NaOH и Mg (OH) 2 оба являются основаниями.
P 4 O 10 (с) + 6 H 2 O (л) → 4H 3 PO4 (л)
SO 2 (г) + H 2 O (л) → H 2 SO 3 (л) SO 3 (с) + H 2 O (л) → H 2 SO 4 (л) Итак, растворы оксидов металлов в воде проявляют свойства оснований, в то время как водные растворы оксидов неметаллов проявляют свойства кислот. Реакция оксидов периода 3 с кислотами и основаниями и их основной, амфотерный и кислотный характер Общая тенденция изменения кислотности в оксидах элементов 3-го периода при переходе от левого края (группа 1) к правому (группа 17): основных оксидов (Группа 1, 2) → амфотерный оксид (Al 2 O 3 ) → кислые оксиды (оксикислоты) Такой же тренд можно увидеть в каждом периоде Периодической таблицы, и мы имеем: Основания реагируют с кислотами, например HCl:
Na 2 O (с) + 2HCl (водн.) → 2NaCl (водн.) + H 2 O (л)
MgO (т.) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 O (л)
Al 2 O 3 + 6HCl (водн.) → 2AlCl 3 + 3H 2 O (л) Оксид алюминия также реагирует с основаниями. Когда к оксиду алюминия добавляют концентрированный раствор гидроксида натрия, образуются комплексные ионы, такие как ион тетрагидроксоалюмината: Al 2 O 3 (с) + 2NaOH (водн.) + 3H 2 O (л) → 2NaAl (OH) 4 (водн.) В этой реакции Al 2 O 3 действует как кислота. Заключение: Al 2 O 3 имеет амфотерный характер.
SiO 2 (т) + 2NaOH (л) → Na 2 SiO 3 (л) + H 2 O (г) Поскольку все неметаллические оксиды Периода 3 являются кислотными, они реагируют с основаниями e.грамм. водный раствор гидроксида натрия в качестве основания. Оксиды фосфора реагируют с водой с образованием кислот, как мы видели, и эти кислоты могут реагировать с гидроксидом натрия в реакции нейтрализации.
H 3 PO 3 (водн.) + 3NaOH (водн.) → Na 3 PO 3 (водн.) + 3H 2 O (л) H 3 PO 4 (водн.) + 3NaOH (водн.) → Na 3 PO4 (водн.) + 3H 2 O (l)
сульфит) и вода.Триоксид серы бурно реагирует с водой с образованием серной кислоты, которая вступает в реакцию с гидроксидом натрия с образованием соли. |

Leave A Comment