Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических веществ.
Задание №5
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических веществ.
1. Кислотному оксиду и кислоте соответствуют формулы веществ
1) Na2O и NaOH
2) N2O и NaNO3
3) NO и h4N
4) N2O5 и HNO3
2. Кислотному оксиду и кислоте соответствуют формулы веществ
1) CO и NaНCO3
2) CO2 и h3CO3
3) CO и K2CO3
4) CO2 и h5C
3. Основному оксиду и основанию соответствуют формулы веществ
1) FeO и Fe(OH)2
2) Fe2O3 и Fe(OH)3
3) FeO и Fe(OH)3
4) Fe2O3 и Fe(OH)2
4. Кислотному и амфотерному оксидам соответствуют формулы
1) N2O и BaO
2) NO и B2O3
3) N2O5 и BeO
4) N2O3 и Br2O7
5. Основному и кислотному оксидам соответствуют формулы
1) CaO и CO
2) CaCl2 и h3SiO3
3) Ca(OH)2 и CO2
4) CaO и SiO2
 Кислотному оксиду и кислоте соответствуют формулы
Кислотному оксиду и кислоте соответствуют формулы1) SO2 и h3S
2) N2O и HNO3
3) CO2 и Ch5
4) BeO и Be(OH)2
7. Вещества, формулы которых ZnO и Na2SO4, являются соответственно
1) основным оксидом и кислотой
2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью
4) основным оксидом и основанием
8. Вещества, формулы которых CO и Zn(OH)2, соответственно являются
1) кислотным оксидом и основанием
2) несолеобразующим оксидом и амфотерным гидроксидом
3) кислотным оксидом и солью
4) несолеобразующим оксидом и основанием
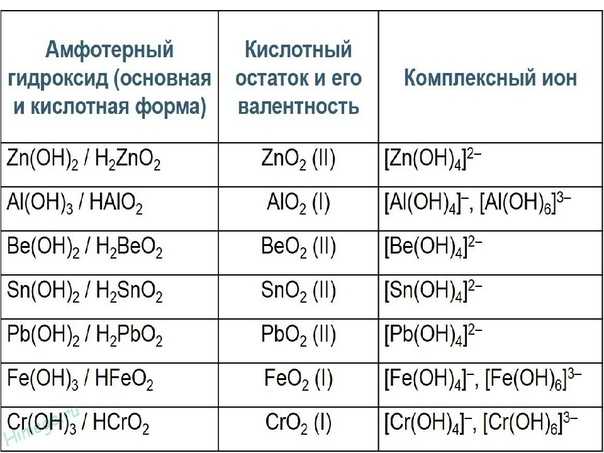
9. Амфотерным оксидом и кислотой соответственно являются
1) ZnO и h3S
2) BaO и h4N
3) P2O3 и HClO
4) BeO и NaOH
10. Простым и сложным веществами соответственно являются
1) аммиак и гидроксид кальция
2) графит и ромбическая сера
3) красный фосфор и метан
4) сероводород и сода
11. Простым и сложным веществами соответственно являются
Простым и сложным веществами соответственно являются
1) угарный газ и медный купорос
2) озон и хлороводород
3) железо и кислород
4) вода и гипс
12. Высшему оксиду и кислоте соответствуют формулы веществ
1) CO и h3CO3
2) CuO и Cu(OH)2
3) SO3 и h3SO4
4) N2O3 и HNO2
13. Высшему оксиду и гидроксиду фосфора соответствуют формулы
1) P2O5 и h4P
2) P2O3 и h4PO3
3) P2O5 и h4PO4
4) P2O3 и h4PO4
14. Высшему кислотному оксиду и соли соответствуют формулы
1) Al2O3 и Ba(ОН)2
2) B2O3 и h4PO3
3) CO и MgS
4) Cl2O7 и NaCl
15. Амфотерным оксиду и гидроксиду соответствуют формулы веществ
1) BeO и AlCl3
2) B2O3 и Zn(OH)2
3) Al2O3 и Fe(OH)3
4) ZnO и Ba(NO3)2
16. Амфотерному гидроксиду и cоли соответствуют формулы
1) Ca(OH)2 и NaHCO3
2) Mg(OH)2 и CuCl2
3) Al(OH)3 и Na3PO4
4) Zn(OH)2 и HNO3
17. Вещества, формулы которых СaO и KOH, являются соответственно
Вещества, формулы которых СaO и KOH, являются соответственно
1) оснóвным оксидом и щёлочью
2) кислотным оксидом и щёлочью
3) амфотерным оксидом и кислотой
4) оснóвным оксидом и амфотерным гидроксидом
18. Вещества, формулы которых Ca(NO3)2 и FeCl3, называются соответственно
1) нитрат кальция и хлорид железа(II)
2) нитрат кальция и хлорид железа(III)
3) нитрит кальция и хлорид железа(II)
4) нитрит кальция и хлорид железа(III)
19. Вещества, формулы которых MgCl2 и CO2, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и кислотным оксидом
3) солью и кислотным оксидом
4) основанием и кислотой
20. Фтор и бром являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
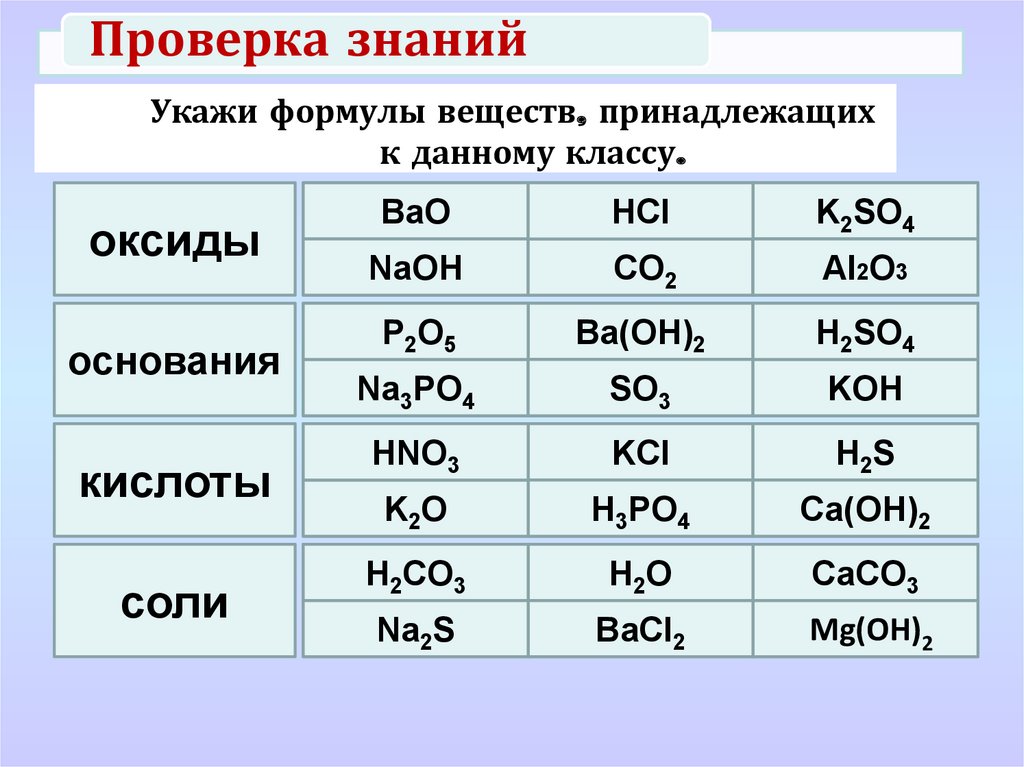
21. Вещества, формулы которых Ca3(PO4)2 и Na2O, являются соответственно
1) основанием и кислотным оксидом
2) солью и основанием
3) солью и оснóвным оксидом
4) кислотой и амфотерным оксидом
22. Вещества, формулы которых Ba(OH)2 и Al2O3, являются соответственно
Вещества, формулы которых Ba(OH)2 и Al2O3, являются соответственно
1) основанием и амфотерным оксидом
2) амфотерным гидроксидом и оснóвным оксидом
3) солью и основанием
4) солью и амфотерным оксидом
23. Вещества, формулы которых K2O и Fe2(SO4)3, называются соответственно
1) оксид кальция и сульфат железа(III)
2) оксид калия и сульфат железа(II)
3) оксид калия и сульфат железа(III)
4) гидроксид калия и сульфат железа(II)
24. Какой из приведённых элементов образует кислотный оксид?
1) литий 2) кремний 3) магний 4) кальций
25. Вещества, формулы которых SO2 и Na2SO3, называются соответственно
1) оксид серы(IV) и сульфит натрия
2) оксид серы(VI) и сульфат натрия
3) оксид серы(IV) и сульфид натрия
4) оксид серы(VI) и сульфит натрия
26. Азот и аммиак являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
27. К кислотным оксидам относят каждое из двух веществ:
К кислотным оксидам относят каждое из двух веществ:
1) h3O и Al2O3
2) SO2 и P2O5
3) Na2O и Fe2O3
4) ZnO и N2O5
28. Вещества, формулы которых HCl и N2O5, являются соответственно
1) солью и оснóвным оксидом
2) кислотой и амфотерным оксидом
3) кислотой и кислотным оксидом
4) солью и кислотой
29. Вещества, формулы которых СaCO3 и Na2SiO3, называются соответственно
1) карбонат кальция и силикат натрия
2) силикат кальция и карбонат натрия
3) карбонат калия и силикат натрия
4) силикат кальция и сульфат натрия
30. Вещества, формулы которых Al2S3 и Са(ОН)2, являются соответственно
1) амфотерным гидроксидом и солью
2) солью и оснóвным оксидом
3) кислотой и основанием
4) солью и основанием
31. Вещества, формулы которых Al(OH)3 и CO2, являются соответственно
1) основанием и амфотерным оксидом
2) амфотерным гидроксидом и оснóвным оксидом
3) основанием и кислотным оксидом
4) амфотерным гидроксидом и кислотным оксидом
32. Вещества, формулы которых CuSO4 и HCl, являются соответственно
Вещества, формулы которых CuSO4 и HCl, являются соответственно
1) оснóвным оксидом и солью
2) солью и кислотой
3) основанием и кислотой
4) солью и основанием
33. К оснóвным оксидам относят каждое из двух веществ :
1) h3O и Al2O3
2) SO2 и P2O5
3) Na2O и CaO
4) ZnO и CuO
34. Какой из приведённых элементов образует оснóвный оксид?
- натрий 2) углерод 3) алюминий 4) фосфор
35. Карбонат кальция и оксид калия являются соответственно
1) простыми веществами
2) сложными веществами
3) простым и сложным веществами
4) сложным и простым веществами
36. Вещества, формулы которых BaO и HCl, являются соответственно
1) основным оксидом и солью
2) амфотерным оксидом и солью
3) кислотным оксидом и кислотой
4) основным оксидом и кислотой
37. Высшим является оксид, формула которого
1) CaO 2) NO2 3) P2O3 4) Cl2O
38. Даны вещества: вода, кислород и аммиак. Среди них к сложным веществам относится(-ятся):
Даны вещества: вода, кислород и аммиак. Среди них к сложным веществам относится(-ятся):
1) только вода
2) только кислород
3) кислород и аммиак
4) вода и аммиак
39. Названия только простых веществ записаны в ряду:
1) алмаз, графит
2) углекислый газ, угарный газ
3) железо, аммиак
4) оксид магния, оксид серы(IV)
40. Солью кремниевой кислоты и щёлочью соответственно являются
1) Na2SiO3 и Cа(OH)2
2) h3SiO3 и Cu(OH)2
3) SiO2 и Na2SO4
4) Na2SO3 и NaOH
41. Оксиду меди(I) и гидроксиду меди(I) соответствуют формулы
1) CuO и CuOH
2) CuO и Cu(OH)2
3) Cu2O и Cu(OH)2
4) Cu2O и CuOH
42. Гидроксид бария и фосфат калия соответственно являются
1) основанием и средней солью
2) амфотерным гидроксидом и средней солью
3) основным оксидом и кислотой
4) основанием и основным оксидом
43. Вещества, формулы которых Al(OH)3 и SO3, являются соответственно
1) основанием и основным оксидом
2) солью и амфотерным оксидом
3) амфотерным гидроксидом и кислотным оксидом
4) основанием и кислотным оксидом
44. Вещества, формулы которых SiO2 и HNO3, являются соответственно
Вещества, формулы которых SiO2 и HNO3, являются соответственно
1) основным оксидом и кислотой
2) амфотерным оксидом и кислотой
3) кислотным оксидом и кислотой
4) кислотным оксидом и солью
45. Вещества, формулы которых Nh5NO3 и NaOH, являются соответственно
1) солью и основанием
2) кислотой и основанием
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным гидроксидом
46. Оснóвным оксидом является каждое из двух веществ:
1) Al2O3, K2O
2) CaO, Na2O
3) CO, BaO
4) NO2, Li2O
47 . Вещества, формулы которых Fe2O3 и FeCl2, являются соответственно
1) основным оксидом и основанием
2) амфотерным оксидом и солью
3) кислотой и амфотерным гидроксидом
4) амфотерным оксидом и кислотой
48. Кислотным оксидом и основанием соответственно являются
1) SiO2 и Ва(OH)2
2) CaO и Cu(OH)2
3) CO2 и Аl(OH)3
4) NO2 и Fe(OH)3
49. Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
1) только сера
2) только белый фосфор
3) белый фосфор и азотная кислота
4) сера и белый фосфор
50. Кислотой и основным оксидом соответственно являются
1) Nh4 и CO2
2) h3SO4 и K2O
3) Nh5Cl и N2O
4) HCl и Al2O3
51. Вещества, формулы которых CaCO3 и Ca(OH)2, являются соответственно
1) солью и основным оксидом
2) амфотерным оксидом и основанием
3) кислотой и амфотерным гидроксидом
4) солью и основанием
52. Сульфидом натрия и оксидом хрома(III) соответственно являются
1) Na2S и Cr(OH)3
2) Na2SO4 и CrO3
3) Na2S и Cr2O3
4) Na2SO3 и Cr2O3
53. К сложным веществам относится
1) иод 2) сода 3) воздух 4) графит
54. Вещества, формулы которых h4PO4 и SiO2, являются соответственно
1) солью и оснвным оксидом
2) кислотой и кислотным оксидом
3) кислотой и амфотерным гидроксидом
4) солью и амфотерным оксидом
55. Амфотерным гидроксидом и кислотой соответственно являются
Амфотерным гидроксидом и кислотой соответственно являются
1) Mg(OH)2 и h3S
2) Ca(OH)2 и HCl
3) Fe(OH)2 и CO2
4) Al(OH)3 и h3SiO3
56. Фосфорной кислоте соответствует формула
1) Ph4
2) Na3PO4
3) h4PO4
4) P2O5
57. Оксиду железа(III) соответствует формула
1) Fe3O4
2) Fe2O3
3) FeO
4) Fe(OH)3
58. Вещество, формула которого Cr2S3, имеет название
1) сульфат хрома(II)
2) сульфит хрома(III)
3) сульфид хрома(II)
4) сульфид хрома(III)
59. Азотной кислоте и хлориду кальция соответствуют формулы
1) HNO3 и CaCO3
2) HNO3 и CaCl2
3) Nh4 и Ca(NO3)2
4) Nh4 и CaCl2
60. Формула сульфата натрия
- Na2S
2) Na2SO3
3) Na2SO4
4) Na2SiO3
61. Кислотным оксидом является
1) оксид углерода(II)
2) оксид хлора(VII)
3) оксид алюминия
4) оксид калия
62.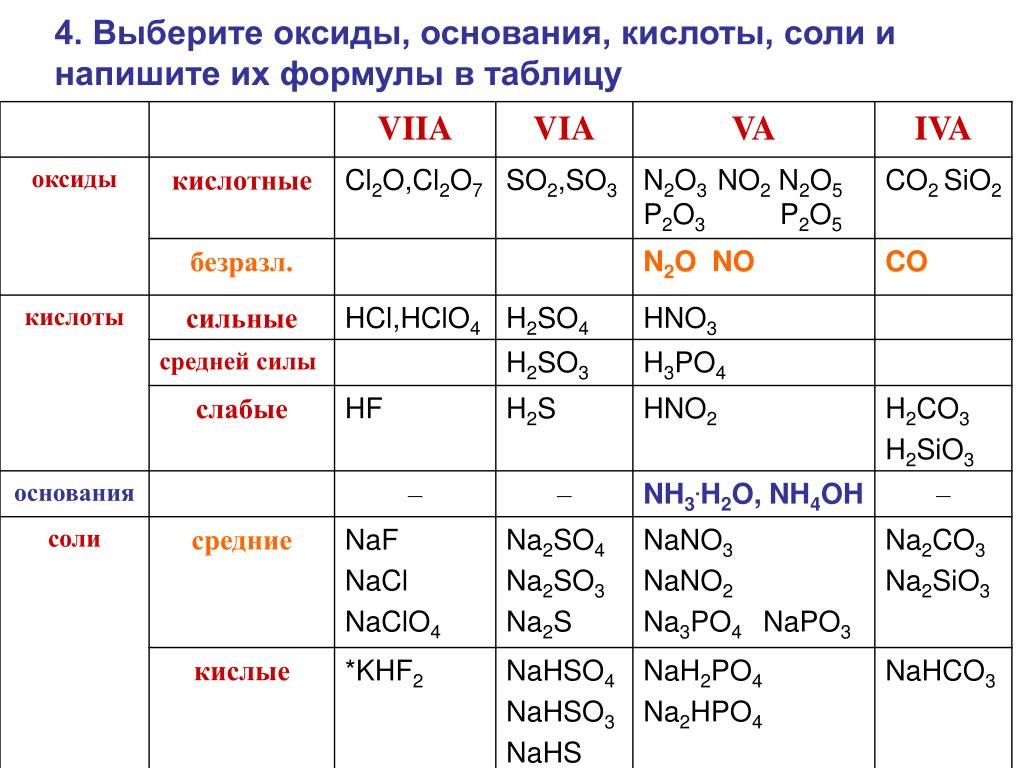 К оснóвным оксидам относится
К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
63. Серной кислоте соответствует формула
1) h3S 2) h3SO3 3) h3SO4 4) SO3
64. Кислотным оксидом является
- SO2 2) CO 3) ZnO 4) Na2O
65. Какое из перечисленных веществ является простым?
1) хлорид натрия
2) вода
3) кислород
4) оксид кальция
66. Кислотным оксидом и кислотой соответственно являются
1) NO и h3SO4
2) ZnO и NaOH
3) CO2 и h4N
4) SO2 и HNO3
67. Какой кислоте соответствуют характеристики: трёхосновная, кислородсодержащая?
1) серной
2) соляной
3) кремниевой
4) Ортофосфорной
68. Названия только сложных веществ записаны в ряду
1) аммиак, серная кислота
2) медь, гидроксид натрия
3) сульфат бария, водород
4) вода, алмаз
69. К оснoвным оксидам относится
- ZnO 2) CrO3 3) BaO 4) SO3
70.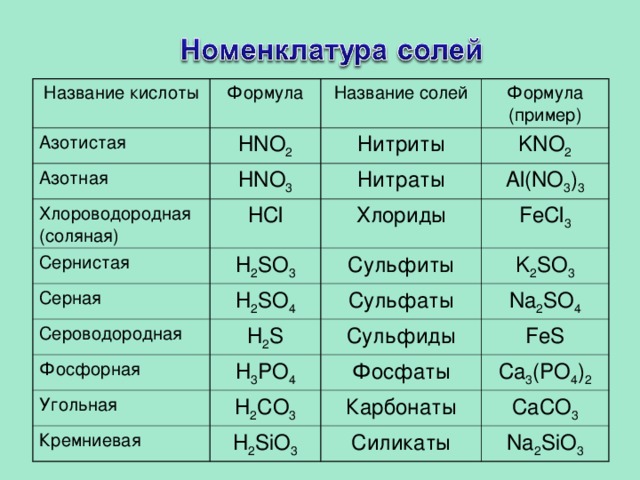 Кислотным оксидом и основанием соответственно являются
Кислотным оксидом и основанием соответственно являются
1) CO и Al(OH)3
2) SO2 и Mg(OH)2
3) CuO и NaOH
4) SiO2 и Fe(OH)3
71. К сложным веществам относится
1) азот 2) вода 3) кислород 4) магний
72. Вещество, химическая формула которого Fe2(SO4)3, имеет название
1) сульфат железа (III)
2) сульфит железа (III)
3) сульфат железа (II)
4) сульфит железа (II)
73. Какое из перечисленных веществ является простым?
1) аммиак
2) красный фосфор
3) азотная кислота
4) хлорид натрия
74. Гидроксиду бария соответствует формула
1) Ba(NO3)2 2) BaO 3) BaSO4 4) Ва(OН)2
75. К оснóвным оксидам относится
1) оксид железа (II)
2) оксид серы (VI)
3) оксид углерода (IV)
4) оксид фосфора (V)
76. Амфотерным оксидом и солью являются соответственно
1) Al2O3 и MgCO3
2) ZnCl2 и Na2SO4
3) BaO и h3S
4) K2O и Zn(OH)2
77 .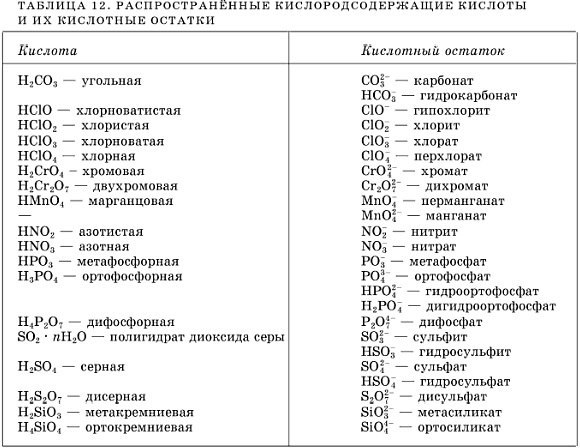 Формулой соли является
Формулой соли является
- NaOH
2) Na2CO3
3) h3CO3
4) Na2O
78. К кислотным оксидам относится
1) оксид натрия
2) оксид серебра
3) оксид меди (II)
4) оксид фосфора (V)
79. Сернистой кислоте и оксиду азота(II) соответствуют формулы
1) h3SO4 и N2O4
2) h3SO3 и NO
3) h3S и NO2
4) (Nh5)2S и N2O
80. Вещества, формулы которых CaO и NaHCO3, являются соответственно
1) основным оксидом и кислотой
2) амфотерным оксидом и солью
3) основанием и кислотой
4) основным оксидом и солью
81. Оснóвным оксидом и основанием соответственно являются
1) Al2O3 и HBr
2) CO и NaOH
3) MgO и Ca(OH)2
4) CaO и NaBr
82. Кислотным оксидом является каждое из двух веществ:
1) SO2 и P2O5
2) SO2 и CO
3) BaO и CO2
4) P2O5 и Al2O3
83. К кислотным оксидам относится
1) оксид натрия
2) оксид цинка
3) оксид углерода(II)
4) оксид серы(VI)
84. Приведены формулы веществ: А CuSO4 ; Б CuO ; В Cu(OH)2 . Среди них к солям
Приведены формулы веществ: А CuSO4 ; Б CuO ; В Cu(OH)2 . Среди них к солям
относят
- только А 2) А и В 3) только В 4) Б и В
85. Кислотой является каждое из двух веществ:
1) HNO3 и NaOH
2) h3CO3 и h4PO4
3) Ba(OH)2 и Al(OH)3
4) h3S и NaOH
86. К оснóвным оксидам относят каждое из двух веществ, формулы которых
1) FeO и BaO
2) K2O и Al2O3
3) MgO и NO
4) MnO2 и CrO3
87. Кислотному оксиду и кислоте соответствуют формулы
1) СО и СН4
2) P2O3 и h4P
3) SO2 и h3S
4) N2O и Nh4
88. Кислотным оксидом является каждое из двух веществ:
1) SO3 и ZnO
2) CaO и CO
3) P2O5 и MgO
4) Cl2O7 и SO2
89. Основному оксиду и кислоте соответствуют формулы
1) Al2O3 и Nh4
2) MgO и h3S
3) Ca(OH)2 и HCl
4) NaOCl и h3SiO3
90. Вещество, химическая формула которого Ca3(PO4)2, называется
1) фосфат кальция
2) гидроксид кальция
3) сульфат кальция
4) карбонат кальция
91.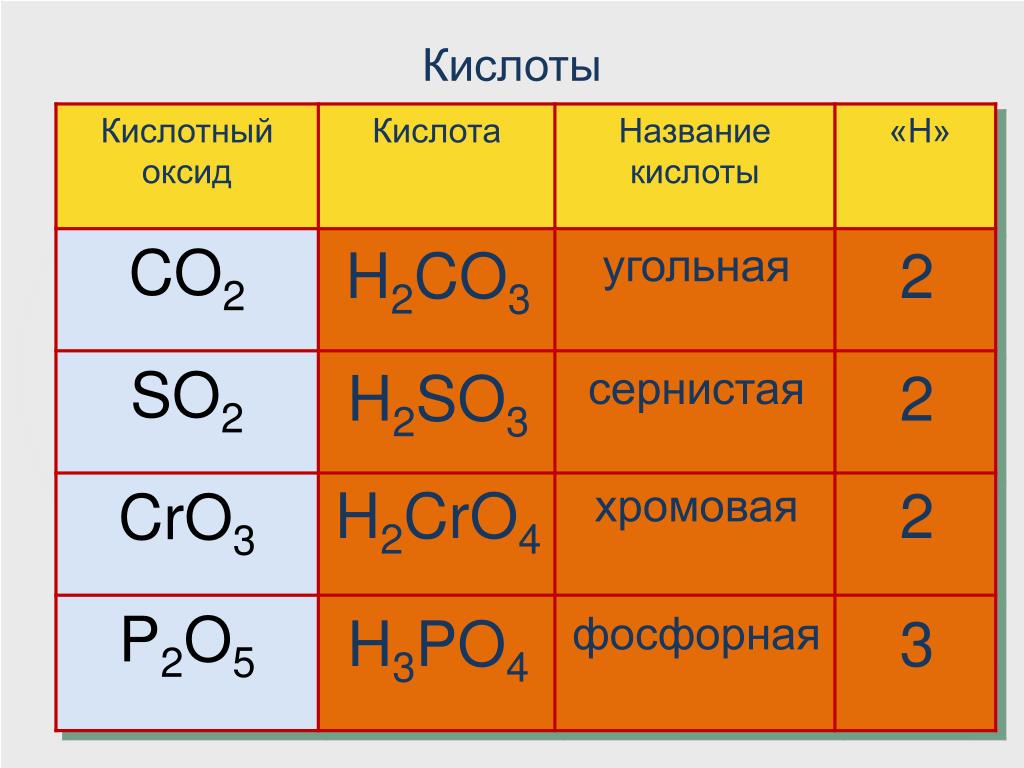 Сложным является каждое из двух веществ
Сложным является каждое из двух веществ
1) аммиак и серная кислота
2) медь и гидроксид натрия
3) сульфат бария и водород
4) вода и алмаз
92. Щёлочью является каждое из двух веществ:
1) Al(OH)3 и Ca(OH)2
2) KOH и Ba(OH)2
3) Cu(OH)2 и K2SO4
4) NaOH и Na2O
93. Кислотой является каждое из двух веществ:
1) NaОН и h3SO4
2) HCl и HNO3
3) h3S и h4N
4) NaCl и NaOH
94. Гидроксиду алюминия соответствует химическая формула:
1) Al(NO3)3
2) Al2O3
3) AlCl3
4) Al(OН)3
95. К сложным веществам относится
1) медь
2) белый фосфор
3) аммиак
4) бром
96. Сложным и простым веществами соответственно являются
1) метан и алмаз
2) озон и азот
3) серная кислота и аммиак
4) красный фосфор и цинк
97. Высшему оксиду неметалла и его высшему гидроксиду соответствуют формулы:
1) оксид серы(IV) и сернистая кислота
2) оксид углерода(II) и угольная кислота
3) оксид азота(V) и азотная кислота
4) оксид хлора(VII) и хлороводородная кислота
98. Простым является каждое из двух веществ:
Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
99. Кислотой является вещество, формула которого
1) h4РО4 2) NaOH 3) Na3РО4 4) h4N
100. Оснoвным оксидом и кислотой, соответственно, являются
1) FeO, Ba(OН)2
2) K2O, (Nh5)2S
3) MgO, h3SO4
4) SO2, HNO3
101. Солью является каждое из двух веществ:
1) AgCl и Al(OH)3
2) NaCl и Al2(SO4)3
3) NaOH и MgCl2
4) Zn(NO3)2 и HCl
102. Сложным является каждое из двух веществ:
1) нитрат калия и хлор
2) белый фосфор и озон
3) гидроксид калия и аргон
4) угарный газ и аммиак
103. К оснóвным оксидам относится
1) оксид магния
2) оксид хлора (VII)
3) оксид алюминия
4) оксид фосфора (V)
104. Простым и сложным веществами соответственно являются:
1) аммиак и метан
2) озон и вода
3) метан и сероводород
4) цинк и азот
105. Даны оксиды: А оксид натрия, Б оксид кальция, В оксид цинка. Среди них к оснóвным оксидам относят
Даны оксиды: А оксид натрия, Б оксид кальция, В оксид цинка. Среди них к оснóвным оксидам относят
- только А 2) только Б 3) А и Б 4) А, Б и В
106. Какое из перечисленных веществ является простым?
1) серная кислота
2) вода
3) водород
4) оксид бария
107. Оксиду серы(IV) и сернистой кислоте соответствуют формулы
1) SO3 и h3S
2) SO2 и h3SO3
3) SO3 и h3SO4
4) SO2 и h3SO4
108. К нерастворимым в воде основаниям относится
1) NaOH 2) LiOH 3) Cu(OH)2 4) Ba(OH)2
109. Кислоте и оснóвному оксиду соответствуют формулы
1) HClO и Nа2O
2) h3S и CO
3) h4Р и Al2O3
4) Nh5Cl и BaO
110. Основным оксидом и кислотой соответственно являются
1) Na2O и h4N
2) ZnO и h3S
3) BaO и h3SiO3
4) Cl2O7 и NaHS
111. Только несолеобразующие оксиды представлены в ряду
1) FeO, Fe2O3
2) CO, CO2
3) N2O3, NO2
4) N2O, NO
112. Оксиду серы(VI) соответствует кислота
Оксиду серы(VI) соответствует кислота
1) h3S
2) h3SO3
3) h3SO4
4) Na2SO4
113. Амфотерным гидроксидом является каждое из двух веществ.
1) Zn(OH)2 и Al(OH)3
2) Be(OH)2 и Ba(OH)2
3) LiOH и KOH
4) Cu(OH)2 и Fe(OH)3
114. Одной и той же кислотой образована каждая из двух солей
1) NaNO2, NaNO3
2) K2CO3, KHCO3
3) BaSO3, BaSO4
4) CuS, CuSO4
115. Амфотерным оксидом и кислотой соответственно являются
1) MgO и HCl
2) ZnO и HNO3
3) Al2O3 и KOH
4) SO2 и h3SO4
116. Кислоте HClO4 соответствует оксид
- Cl2O
2) Cl2O3
3) Cl2O7
4) ClO2
117. Оксиду P2O3 соответствует кислота
1) Ph4
2) h4PO3
3) HPO3
4) h4PO4
118. Кислотным оксидом является каждое из двух веществ
1) Mn2O7 и SO3
2) NO и Р2О5
3) СаО и SO2
4) ZnO и N2O5
119. Формулы высшего оксида серы и соответствующей ему кислоты:
Формулы высшего оксида серы и соответствующей ему кислоты:
1) SO3, h3SO4
2) SO3, h3SO3
3) SO2, h3SO3
4) h3S, h3SO4
120. Формулы высшего оксида хлора и соответствующей ему кислоты:
1) Cl2O, HClO
2) Cl2O7, HClO4
3) Cl2O7, HClO3
4) Cl2O3, HClO3
121. Только амфотерные оксиды представлены в ряду
1) ZnO, Al2O3
2) CaO, Fe2O3
3) Li2O, N2O
4) BeO, SO3
122. Основным является каждый из двух оксидов
1) MgO и Al2O3
2) CO2 и SO2
3) CO и NO
4) Na2O и CaO
123. О железе как о простом веществе говорится в следующем предложении .
1) В кожуре яблок содержится железо.
2) Для получения железа оксид железа(III) нагревают с углем.
3) Железо входит в состав хлорида железа(III) .
4) При малокровии употребляют лекарства, содержащие железо.
124. Только основные оксиды расположены в ряду
1) СаO, ZnO, BaO
2) Na2O, CuO, SrO
3) CO2, K2O, NO
4) CrO3, K2O, CaO
125. Кислоте HClO4 соответствует оксид
Кислоте HClO4 соответствует оксид
- Cl2O
2) Cl2O3
3) ClO2
4) Cl2O7
126. Кислотным является каждый из двух оксидов
1) N2O и N2O5
2) CO2 и SO2
3) Al2O3 и SO3
4) CaO и BaO
127. Кислотой и щелочью соответственно являются
1) HCl и Cu(OH)2
2) HNO3 и Ba(OH)2
3) NaCl и KOH
4) HBr и Zn(OH)2
128. Только основные оксиды представлены в ряду
1) Na2O, MgO
2) Li2O, BeO
3) B2O3, Al2O3
4) CO, CuO
129. Щёлочью является каждое из двух веществ
1) NaOH и Ba(OH)2
2) Nh5OH и Cu(OH)2
3) LiOH и Al(OH)3
4) Be(OH)2 и Mg(OH)2
130. Только кислотные оксиды представлены в ряду
1) CaO, P2O5
2) Al2O3, N2O3
3) NO, NO2
4) SO2, SO3
131. Кислотному оксиду N2O5 соответствует кислота
1) HNO3
2) HNO2
3) Nh4
4) Nh5Cl
132. Одной и той же кислотой образована соль:
1) KCl и KClO3
2) Ba(NO2)2 и Ba(NO3)2
3) FeS и Fe2(SO4)3
4) Na2SO3 и NaHSO3
8 класс.
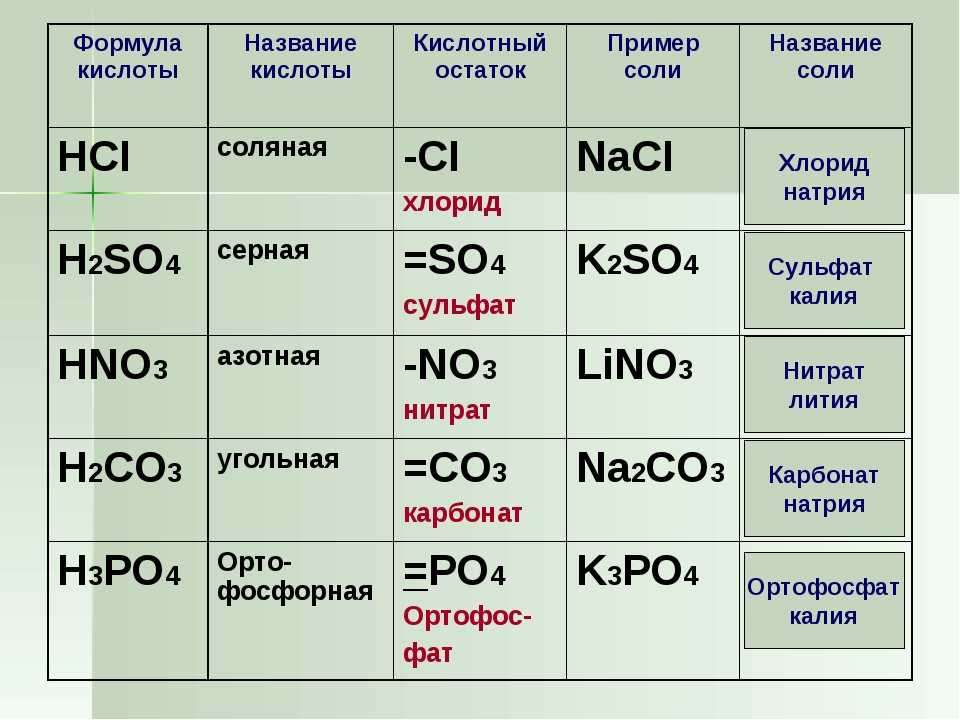
 Химия. Кислотные оксиды — Кислотные оксидыКомментарии преподавателя
Химия. Кислотные оксиды — Кислотные оксидыКомментарии преподавателяОксиды неметаллов
Вы уже знаете, что все вещества делят на две большие группы – органические и неорганические вещества. В 8 классе изучается классификация неорганических веществ. Вам уже знакомы некоторые группы неорганических веществ – оксиды, хлориды, сульфиды, кислоты и т.д.
Изучение классов неорганических веществ мы начнем с группы веществ, которую называют кислотными оксидами. Многие простые вещества – неметаллы при взаимодействии с кислородом образуют оксиды.
Уголь сгорает в атмосфере кислорода с образованием оксида углерода (IV):
С+О2 = СО2
Фосфор тоже горит в кислороде, при этом образуется оксид фосфора (V):
4P + 5O2 = 2P2O5
Рис. 1. Горение фосфора в кислороде
При растворении полученных оксидов в воде образуются растворы, обладающие общими свойствами. Эти растворы кислые на вкус. В ходе растворения оксида углерода (IV) и оксида фосфора (V) в воде образуются кислоты. Запишем уравнения этих реакций.
Запишем уравнения этих реакций.
При растворении в воде оксида углерода (IV) образуется угольная кислота – Н2СО3:
СO2 + h3O ↔h3CO3
Угольная кислота – нестойкое вещество, она разлагается на исходные вещества. Поэтому правильнее вместо знака равенства поставить знак обратимости в уравнении этой реакции.
Оксид фосфора (V) хорошо растворяется в воде с образованием ортофосфорной кислоты h4PO4:
P2O5+3h3O=2h4PO4
Данные реакции являются реакциями соединения.
Теперь мы можем объяснить происхождение названия химического элемента кислорода. «кислород» — «рождающий кислоты»: при взаимодействии некоторых неметаллов с кислородом образуются оксиды, растворение которых в воде позволяет получить кислоты.
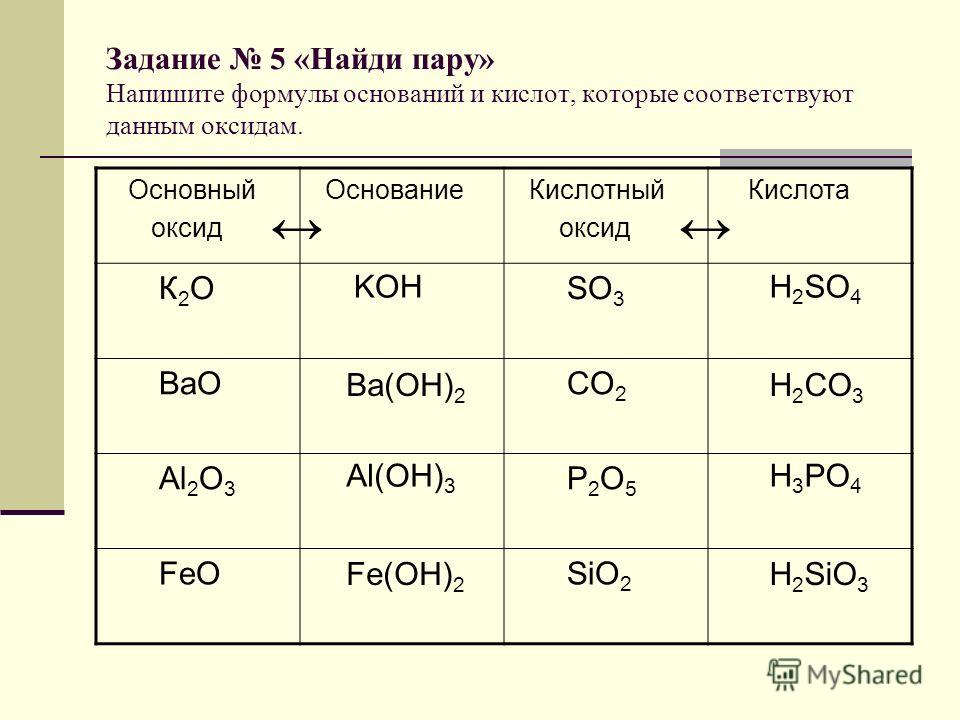
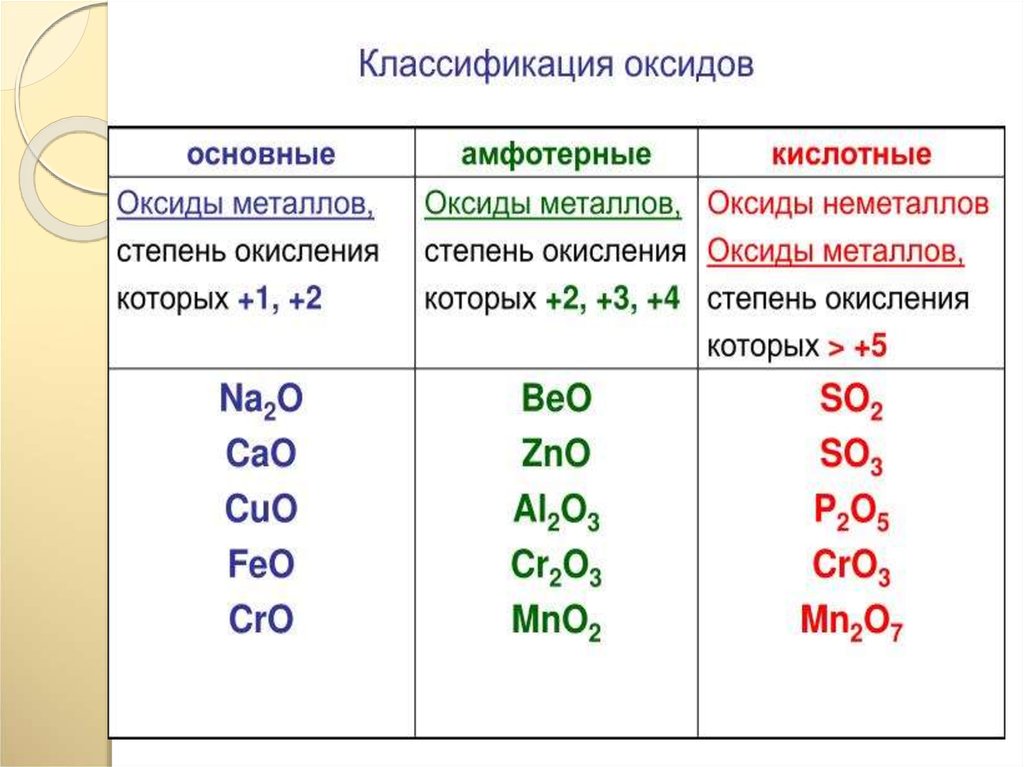
Оксиды, которым соответствуют кислоты, называют кислотными оксидами.
Например, оксид углерода (IV) и оксид фосфора (V) – кислотные оксиды.
Но не все оксиды неметаллов являются кислотными. Есть оксиды неметаллов, которым не соответствуют кислоты. Среди них, оксид углерода (II) или угарный газ — СО, оксиды азота (I) и (II) – N2O, NO. Этим оксидам кислоты не соответствуют.
Среди них, оксид углерода (II) или угарный газ — СО, оксиды азота (I) и (II) – N2O, NO. Этим оксидам кислоты не соответствуют.
Есть еще один интересный факт – не все кислотные оксиды взаимодействуют с водой. Например, оксид кремния (IV) не растворяется в воде. Это вещество составляет основу кварца и белого речного песка. Но оксид кремния является кислотным оксидом, т.к. ему соответствует кремниевая кислота h3SiO3. Это стало известно благодаря тому, что кремниевая кислота разлагается на оксид кремния и воду:
h3SiO3 = SiO2 + h3O
К классу кислотных оксидов относятся не только оксиды неметаллов. Кислотные оксиды могут образовать и некоторые металлы с валентностью более III.
Например оксид хрома (VI) является кислотным оксидом, т.к. ем соответствует хромовая кислота h3CrO4. Эту кислоту можно получить при взаимодействии оксида хрома (VI) с водой:
CrO3+h3O=h3CrO4
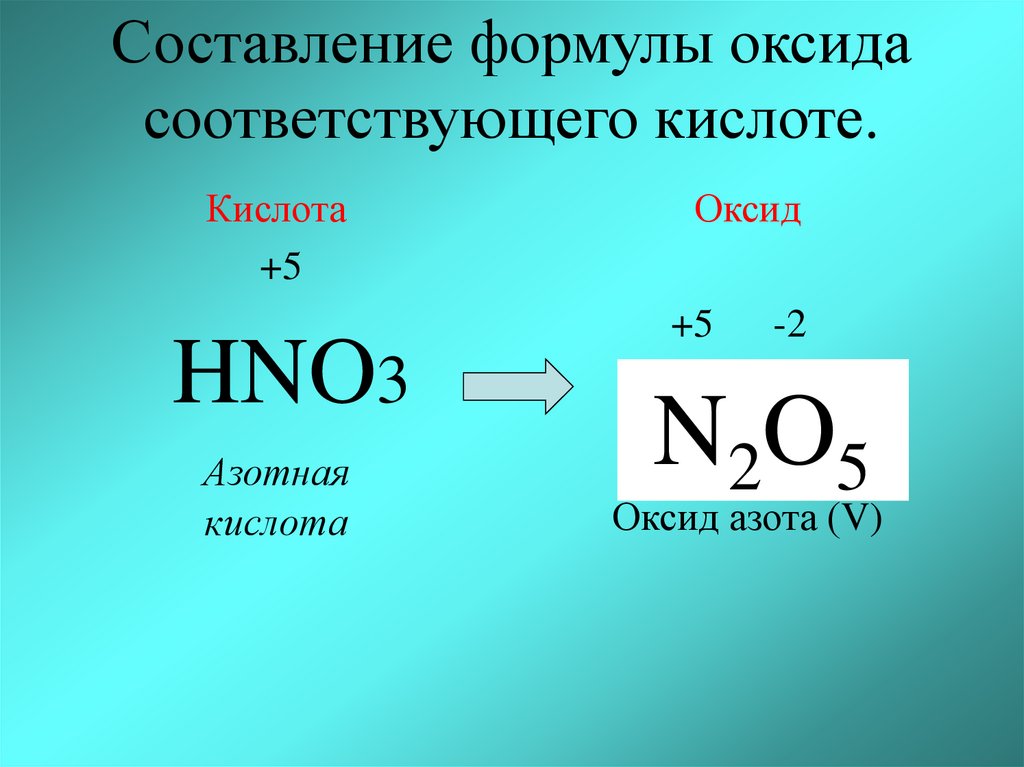
[00:04:35/Составление формул кислот, соответствующих оксидам]
Не надо заучивать какая кислота какому оксиду соответствует.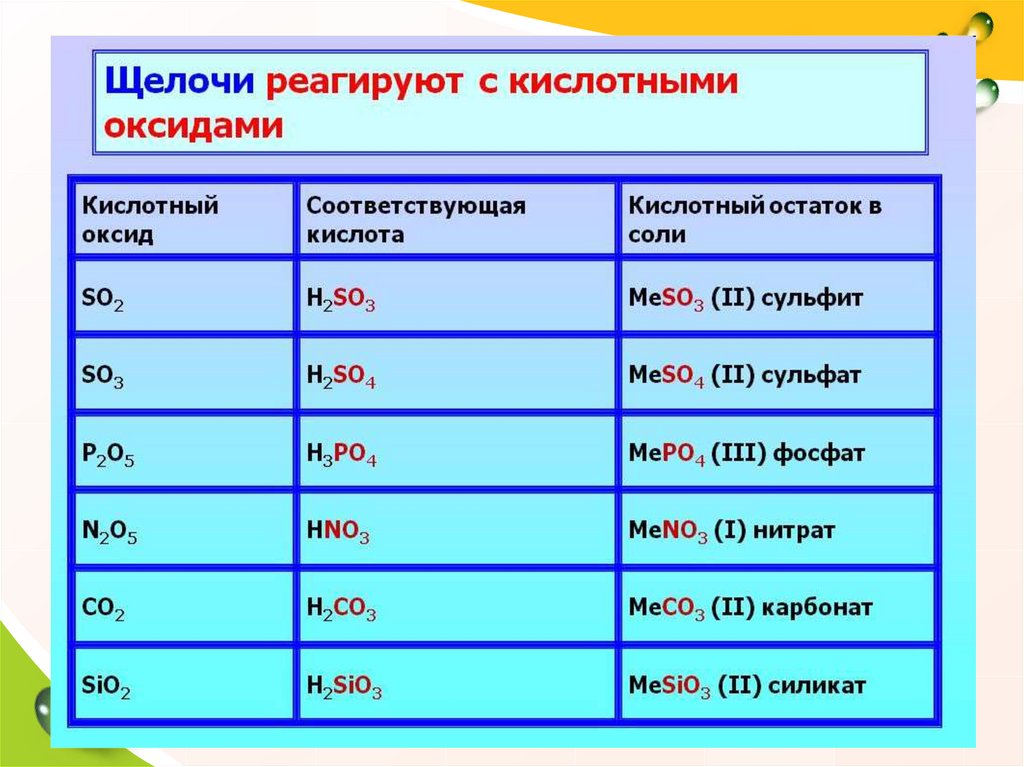 Чтобы составить формулу кислоты, соответствующей оксиду, надо запомнить несколько правил. Во-первых, валентность химического элемента в оксиде и соответствующей ему кислоте должна быть одинакова.
Чтобы составить формулу кислоты, соответствующей оксиду, надо запомнить несколько правил. Во-первых, валентность химического элемента в оксиде и соответствующей ему кислоте должна быть одинакова.
Валентности элементов в оксиде вы уже умеете определять. Например, в оксиде азота N2O5 валентность азота равна V. Валентности элементов в кислоте, состоящей из трех химических элементов, определить также несложно. Определим валентности элементов в азотной кислоте HNO3.Валентность водорода в кислотах равна I, валентность кислорода равна II. Чтобы найти валентность азота, нужно из общего числа валентностей кислорода вычесть общее число валентностей водорода, т.е. из 6 вычесть 1.
Рис. 2. Валентность азота в N2O5 и HNO3 одинакова и равна V
Формулу кислоты, соответствующей оксиду можно составить, используя реакцию соединения кислотного оксида с водой. Если суммировать атомы одной молекулы оксида и одной молекулы воды, то в большинстве случаев получится формула искомой кислоты.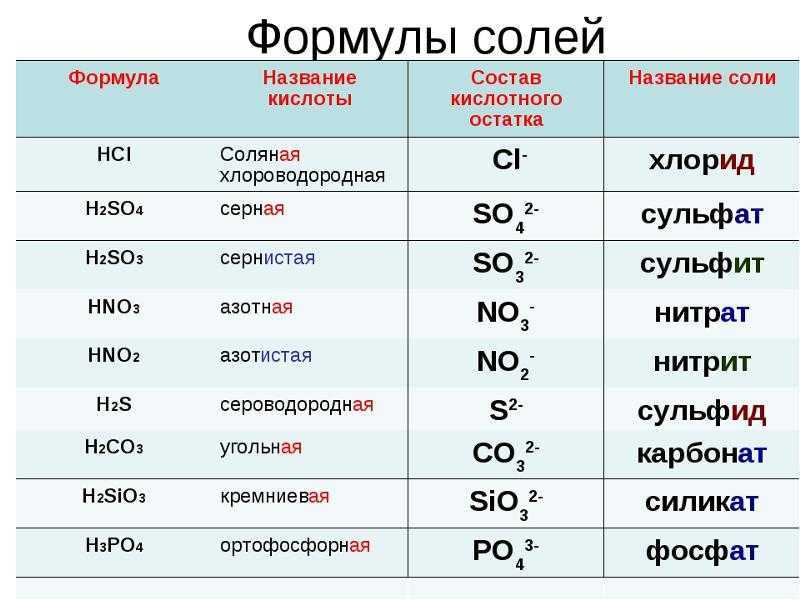
Рассмотрим два примера. Составим формулы кислот, соответствующих оксиду углерода (IV) и оксиду азота (III). Просуммируем атомы одной молекулы углекислого газа и одной молекулы воды. Получилась формула угольной кислоты h3CO3.
То же проделаем с одной молекулой N2O3 и одной молекулой Н2О. Получили Н2N2O4. В получившейся формуле можно сократить индексы на 2. Получим HNO2 – азотистую кислоту (Рис. 3).
Рис. 3. Составление формул кислот, соответствующих оксидам
Этим правилом нельзя воспользоваться для составления формулы ортофосфорной кислоты. Чтобы ее получить к молекуле оксида фосфора (V) надо прибавить 3 молекулы воды.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bklassy-neorganicheskih-vewestv-b/kislotnye-oksidy
исчтонки видео — http://www.youtube.com/watch?v=8rRoZ1UiPrQ
источник видео — http://www.youtube.com/watch?v=YLxqe0Dc130
источник презентации — http://ppt4web.ru/khimija/oksidy1.html
источник презентации — http://www. myshared.ru/slide/1002808/
myshared.ru/slide/1002808/
http://www.youtube.com/watch?v=bT0Olh2Cn1c
Кислоты и основания
Термины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно. Кислые вещи имеют кислый вкус. Основные или щелочные вещи имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания едкие; оба могут вызвать серьезное повреждение кожи, похожее на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислотным или основным? Следующее уравнение является хорошим местом для начала:
Мы начинаем с двух молекул воды и перемещаем несколько атомов водорода. Одна молекула воды получает водород и поэтому приобретает положительный заряд, а другая молекула воды теряет атом водорода и поэтому становится отрицательно заряженной. H 3 O + называется ионом гидроксония, и он делает вещества кислыми. OH – называется гидроксильным ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; это нейтрально.
H 3 O + называется ионом гидроксония, и он делает вещества кислыми. OH – называется гидроксильным ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; это нейтрально.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксония и гидроксилы не сбалансированы. Если положительно заряженных гидроксоний больше, чем отрицательно заряженных гидроксилов, то вещество кислое. Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксоний, то вещество становится основным. На самом деле pH означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + в качестве сокращения для H 3 O + и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они на самом деле имеют в виду только H + , а не H 3 O + . Обратите на это внимание и попросите разъяснений!
Обратите на это внимание и попросите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония. Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 СООН. При растворении в воде становится CH 3 COO — и H + . Ионы H + объединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым. Теперь давайте посмотрим на щелочь, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, она диссоциирует на Na + и OH — . Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания так вредны? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы восстановить равновесие, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы вернуться к равновесию. Это делает их очень реактивными со всем, с чем они контактируют. Когда положительные и отрицательные стороны находятся в равном количестве, они нейтрализуют друг друга.
Это делает их очень реактивными со всем, с чем они контактируют. Когда положительные и отрицательные стороны находятся в равном количестве, они нейтрализуют друг друга.
Что такое pH?: pH – это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и примерно равен логарифму 10 по основанию молярной концентрации ионов водорода, поэтому pH = -log 10 [H + ]
Шкала pH — это мера кислотности по 14-бальной шкале, где 7 — нейтральная середина. pH представляет собой логарифмическую шкалу (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6. Вы можете купить электронные pH-метры или pH-индикаторы. бумага от любой компании-поставщика биологических или лабораторных материалов, которую можно использовать для точного измерения кислотного или основного качества веществ, которые вы хотите протестировать. Попробуйте эту симуляцию, чтобы определить рН некоторых распространенных веществ.
Необязательный мини-эксперимент : сделайте свой собственный индикатор pH, используя сок краснокочанной капусты. Смешайте 2 стакана нарезанных листьев краснокочанной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными. Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость меняет цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капель капустного сока примерно к 1 столовой ложке испытуемого вещества. Какой цвет окрашивает капустный сок в кислоте, такой как белый уксус? Какой цвет окрашивает капустный сок в растворе пищевой соды и воды?
Проверка pH различных веществ и разработка соответствующей цветовой шкалы pH. Сравните свои результаты с таблицей здесь.
Вы также можете сделать индикаторную бумагу, окунув полоски белой бумажной салфетки, фильтры для кофе или белую плотную бумагу в капустный сок, пока они не станут фиолетовыми. Когда фиолетовые полоски высохнут, зубочисткой, соломинкой или пипеткой нанесите на полоски каплю тестируемого раствора. Как результаты соотносятся с вашей диаграммой pH?
Когда фиолетовые полоски высохнут, зубочисткой, соломинкой или пипеткой нанесите на полоски каплю тестируемого раствора. Как результаты соотносятся с вашей диаграммой pH?
Основы номенклатуры
Основы номенклатурыОсновы номенклатуры
© 1998 B.E. Арни-младший
Химический факультет
Государственный университет Сэма Хьюстона
Элементы и одноатомные ионы :
Основой правильного понимания и применения правил номенклатуры является понимание смысла и значения используемого символизма. Химики используют форму стенографии для обозначения элементов, ионов и соединений, которые мы исследуем. Это сокращение является систематическим и для большинства материалов простым. Однако следует помнить, что даже очень простое может быть очень сложным, если не поняты основы. Имея это в виду, уместно сначала рассмотреть простейший случай. Элементы представлены, как показано на рисунке ниже:
Элементы представлены, как показано на рисунке ниже:
Показанный пример относится к элементу кислорода. Атомные массовые числа и атомные номера элементов здесь обсуждаться не будут, но их положение показано для подкрепления. Каждому элементу присвоено имя и символ , которые в данном случае являются кислородом и O соответственно. Все символы состоят из одной или двух букв, причем первая буква ВСЕГДА БУДЕТ ЗАГЛАВНОЙ , а вторая буква , если требуется, всегда строчная . Некоторые примеры:
H = водород Ca = кальций
He = гелий Ne = неон
O = кислород P = фосфор
C = углерод N = азот
Символ не всегда является аббревиатурой английского имени элемента: иногда символ представляет собой аббревиатуру имени элемента на другом языке, например на латыни. Некоторые примеры:
Na = натрий (лат. Natrium ) Ag = серебро (лат. Аргентум )
K = калий (лат. Kalium ) Pb = свинец (лат. Plumbum )
Kalium ) Pb = свинец (лат. Plumbum )
W = вольфрам (нем. Wolfram ) Sb = сурьма (лат. Stibnum )
Sn = олово (лат. Stannum ) Cu = медь (лат. Cuperum )
Изучение названий и символов для обычных элементов очень похоже на изучение имен ваших соседей: вы должны запомнить их путем повторения. Они также будут часто появляться в чтениях, лекциях и задачах, так что, приложив некоторые усилия и настойчивость, мы надеемся, что они станут более знакомыми, чем ваши соседи.
Важным аспектом элементов, который может быть неочевидным, является то, что символ представляет собой один атом элемента. Однако при представлении элемента в уравнении необходимо использовать формулу, которая представляет элемент в том виде, в котором он встречается в природе. К счастью, для подавляющего большинства элементов одноатомное ( одноатомное ) представление подходит, но для горстки важных общих элементов это не так. Для настоящего обсуждения необходимо рассмотреть только двухатомные ( двухатомные ) элементы. Эти элементы состоят из молекул, каждая из которых состоит из двух атомов. Число атомов определенного элемента в молекуле обозначается индексом , индексом справа внизу от атома.
Эти элементы состоят из молекул, каждая из которых состоит из двух атомов. Число атомов определенного элемента в молекуле обозначается индексом , индексом справа внизу от атома.
Двухатомные элементы :
H 2 = газообразный водород N 2 = газообразный азот
O 2 = газообразный кислород F 2 = газообразный фтор
Cl 2 = газообразный хлор Br 2 = бром жидкий (и пары)
I 2 = йод твердый (и пар)
Ионы : Заряженные вещества
Ions доступны в двух вариантах; анионы и катионы . Анионы — это атомы или группы атомов, которые имеют больше электронов, чем пришли с их атомами, и поэтому имеют общий отрицательный заряд. Катионы — это атомы или группы атомов, которые имеют меньше электронов, чем пришли с их атомами, и имеют соответствующий положительный заряд. Кроме того, оба типа ионов бывают одноатомными (одноатомными) и многоатомными (многоатомными).
Кроме того, оба типа ионов бывают одноатомными (одноатомными) и многоатомными (многоатомными).
Заряд иона определяется количеством электронов, полученных или потерянных данным видом. Если атом теряет электроны, его заряд увеличивается на +1 за каждый потерянный электрон или уменьшается на +1 за каждый полученный электрон.
Пример:
Al 0 Æ Al 3+ + 3 e — Атом алюминия потерял три электрона и приобрел заряд +3.
S 0 + 2 e — Æ S 2- Атом серы принимает два дополнительных электрона и приобретает заряд -2.
Обратите внимание, , что нулевой заряд, показанный в приведенном выше примере, обычно не показан, а отсутствие указанного заряда означает, что вид является нейтральным.
Одноатомные катионы:
Одноатомные катионы делятся на две группы; те, которые всегда возникают с определенным зарядом, и те, которые могут иметь более одного заряда. Первый тип назван просто путем использования имени элемента, за которым следует отдельное слово ion.
Первый тип назван просто путем использования имени элемента, за которым следует отдельное слово ion.
одноатомных катиона с одним возможным зарядом.
H + = ион водорода Mg 2+ = ион магния Al 3+ = ион алюминия
Li + = ион лития Ca 2+ = ион кальция
Na + = ион натрия Sr 2+ = ион стронция
K + = ион калия Ba 2+ = ион бария
Ag + = ион серебра Zn 2+ = ион цинка
Эти ионы ограничены группой IA (щелочные металлы, +1), группой IIA (щелочные металлы, +2), цинком (Zn 2+ ), алюминием (Al 3+ ) и серебро (Ag + ). Другие одноатомные катионы могут иметь более одного возможного заряда, и заряд должен быть обозначен римской цифрой в скобках после названия элемента.
Одноатомные катионы с более чем одним возможным зарядом
Fe 2+ = ион железа(II) Fe 3+ = ион железа(III)
Cu + = ион меди(I) Cu 2+ = ион меди(II)
Sn 2+ = ион олова (II) Sn 4+ = ион олова(IV)
Cr 2+ = ион хрома(II) Cr 3+ = ион хрома(III)
Ni 2+ = ион никеля(II) Ni 3+ = ион никеля(III)
Mn 2+ = ион марганца(II) Mn 3+ = ион марганца(III)
Pb 2+ = ион свинца(II) Pb 4+ = ион свинца(IV)
- Hg 2+ = ион ртути(II)
Многоатомные катионы :
Распространены лишь очень немногие многоатомные катионы, перечисленные ниже.
NH 4 + = ион аммония Hg 2 2+ = ртуть(I) H 3 O + = гидроксоний
Одноатомные анионы :
Это неметаллические элементы, которые приняли дополнительные электроны. Эти ионы относительно немногочисленны и перечислены ниже. Одноатомные анионы называются, беря корень имени элемента и применяя окончание -ide.
Пример:
F — фтор ин фтор и ид фторид
N 3- нитр ген нитр и ид нитрид
O 2- ox ygen ox & ide oxide
Другие важные простые анионы.
H — = гидрид Cl — = хлорид Br — = бромид
I — = йодид S 2- = сульфид P 3- = фосфид
Одноатомные анионы не встречаются с несколькими зарядами, поэтому каждый неметалл может образовывать только один одноатомный анион, в отличие от некоторых металлов, которые могут иметь несколько одноатомных катионов.
ПРИМЕЧАНИЕ: окончание -ide для имени аниона зарезервировано для одноатомных анионов с несколькими чрезвычайно важными исключениями.
HO — = гидроксид O 2 2- = пероксид CN — = цианид
Многоатомные анионы:
Хотя это последняя большая группа ионов, которую мы будем рассматривать, она также наименее легко осваивается. Анионы этой группы, содержащие кислород, обозначаются как оксианионы , и все они имеют окончание -ate или -ite. Наиболее распространенный оксианион элемента дает окончание -ate.
Пример:
NO 3 — нитр ate SO 4 2- сульф ели
CO 3 2- углерод ate PO 4 3- фосф ate
ClO 3 — хлор ate BrO 3 — бром ate
Элемент может иметь два или более встречающихся в природе оксианиона, и система префиксов и суффиксов используется для обозначения количества атомов кислорода, содержащихся в оксианионе, относительно ссылки -ат оксианион элемента.
- Если оксианион имеет такой же заряд и на один кислород больше, чем ион -ate , то он называется путем добавления префикса per- к названию иона — ate 6 .
- Если оксианион имеет такой же заряд и на один атом кислорода меньше, чем ион — ate , то ему присваивается окончание — ite вместо — ели окончание.
- Если оксианион имеет такой же заряд и на один атом кислорода меньше, чем ион -ite , то он называется путем добавления префикса гипо- к названию иона — ite .
Пример:
IO 4 — = на иод
IO 3 — = иод
IO 2 — = iod ite
ИО — = гипо иод ите
Важные оксианионы:
C 2 H 3 O 2 — = ацетат CO 3 2- = карбонат HCO 3 09017 — = карбонат
CrO 4 2- = хромат ClO 3 — = хлорат ClO 2 — = хлорит
Cr 2 O 7 2- = дихромат ClO — = гипохлорит ClO 4 — = перхлорат
C 2 O 4 2- = оксалат NO 2 — = нитрит NO 3 — = нитрат
SO 3 2- = сульфит SO 4 2- = сульфат MnO 4 — = перманганат
PO 4 3- = фосфат HSO 3 — = гидросульфит HSO 4 — = гидросульфат
- S 2 O 3 2- = тиосульфат PO 3 3- = фосфит HPO 4 7 5 3 2- = гидрофосфат
- SCN — = тиоцианат H 2 PO 4 — = дигидрофосфат
Наименование ионных соединений :
Ионные соединения состоят из катионов и анионов, которые притягиваются друг к другу, образуя за счет ассоциации соединение, имеющее в целом нейтральный заряд.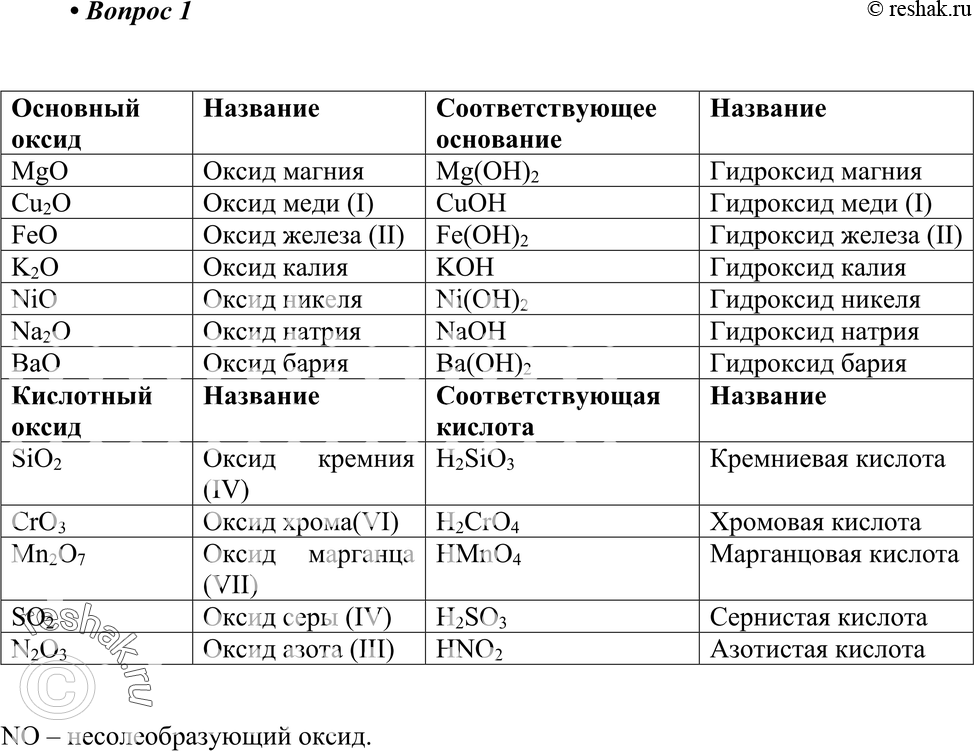 Ионы в ионном соединении представляют собой отдельные отдельные виды, что важно для их поведения и их химического состава. Подобно раздельной и отличной природе ионов, составляющих ионное соединение, мы называем ионными соединениями, просто называя катион (ы), а затем называя анион (анионы). Никакой ссылки или указания номера любого типа иона в названии не требуется, поскольку используется наименьшее целое число каждого иона, необходимое для образования нейтрального вещества.
Ионы в ионном соединении представляют собой отдельные отдельные виды, что важно для их поведения и их химического состава. Подобно раздельной и отличной природе ионов, составляющих ионное соединение, мы называем ионными соединениями, просто называя катион (ы), а затем называя анион (анионы). Никакой ссылки или указания номера любого типа иона в названии не требуется, поскольку используется наименьшее целое число каждого иона, необходимое для образования нейтрального вещества.
Пример:
Ca(NO 3 ) 2 Ca 2+ и 2 NO 3 —
нитрат кальция ион кальция нитрат-ион
0 = +2 + 2(-1)
Al 2 S 3 2 Al 3+ и 3 S 2-
сульфид алюминия ион алюминия сульфид-ион
0 2(+3) + 3(-2)
При наименовании ионных соединений становится ясно, что знание зарядов анионов чрезвычайно важно для распознавания заряда тех ионов металлов, которые могут иметь более одной возможности.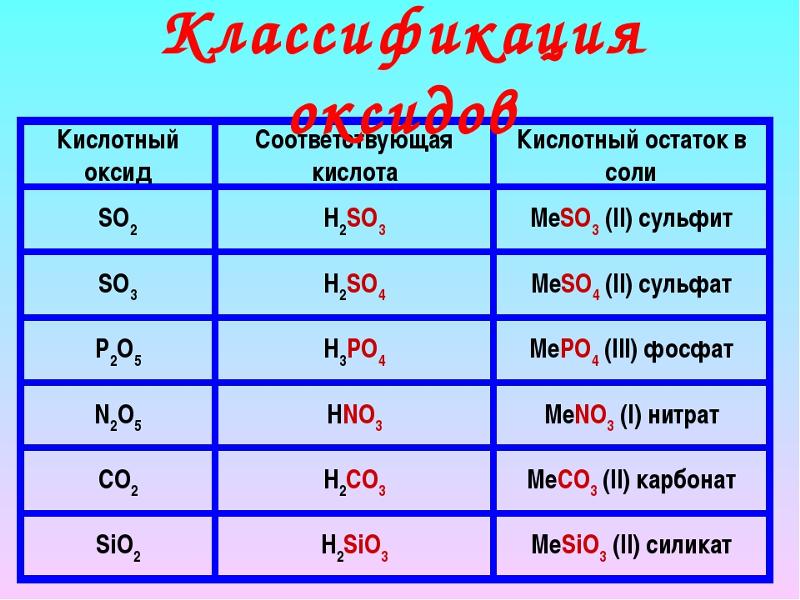
Пример:
Sn(C 2 O 4 ) 2 Sn ? и 2 С 2 О 4 2-
Оксалат-ион олова (?)
Общее количество зарядов 0 зарядов = X зарядов + 2x(-2) зарядов
должен равняться нулю.
0 = Х + -4
X = +4, поэтому имеем Sn 4+ , олово (IV)
Помните, что состав должен быть нейтральным. Два (2) иона оксалата имеют общий заряд -4, что означает, что олово (Sn) должно иметь заряд +4, чтобы довести общий заряд до нуля. Таким образом,
Sn(C 2 O 4 ) 2 Sn 4+ и 2 C 2 O 4 2-
оксалат олова (IV) оксалат-ион олова (IV)
Иногда соединение может быть так называемой двойной солью. Это ионное соединение, в котором присутствуют два разных катиона. Эти двойные соли не редкость, поэтому полезно знать их названия. Обычными двойными солями являются соли гидрокарбоната, гидросульфата, гидрофосфата и дигидрофосфата.
Пример:
KHSO 4 = гидросульфат калия
NaH 2 PO 4 = дигидрофосфат натрия
Бинарные кислоты и оксикислоты:
Анионы можно считать производными кислот, которые представляют собой ковалентные (молекулярные) соединения, которые в воде разделяются на ионы водорода и соответствующие анионы. Формулу исходной кислоты легко найти, добавив достаточное количество ионов водорода к аниону для получения нейтрального соединения. Простейшие анионы, одноатомные анионы, с -ide окончания являются производными от гидро- корень -ic кислоты . Обратите внимание, что цианид — единственный неодноатомный анион, соответствующая кислота которого попадает в эту категорию.
Пример:
H 2 S Æ 2 H + + S 2-
гидро сера ледяная кислота сульф ide
HCl Æ H + + Cl —
гидро хлор ледяная кислота хлор иде
HCN Æ H + + CN —
гидро голубой ледяная кислота голубой иде
Оксианионы с окончанием -ate получены из -овых кислот .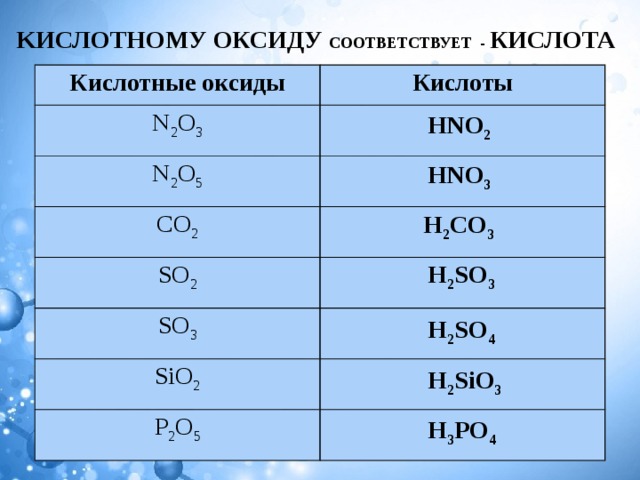
Пример:
CO 3 2- + 2 H + Æ H 2 CO 3
уголь ат уголь ледяная кислота
NO 3 — + H + Æ HNO 3
нитр ат нитр кислота ic
БрО 4 — + Н + → HBrO 4
пербром ат пербром ледяная кислота
Кроме того, оксианионы с окончанием — ite являются производными — кислот .
Пример:
SO 3 2- + 2 H + Æ H 2 SO 3
сульф ит сера усистая кислота
ClO — + H + → HClO
гипохлор ит гипохлор ушная кислота
Важно отметить, что корни для серы и фосфора различны для ионов и кислот.
Ионы: сульф- кислоты: сера-
фосф- фосфор-
В случае оксианионов
Ковалентные соединения — неметаллы — соединения неметаллов: бинарные соединения.
Эти имена состоят из 2 частей. Имя наименее электроотрицательного элемента дается первым без окончания. Основное название наиболее электроотрицательного элемента дается последним с окончанием -ид, например, оксид, нитрид, хлорид. Других окончаний для ковалентных соединений нет. Количество атомов каждого типа указывается префиксами:
моно = 1 пента = 5
ди = 2 гекс = 6
три = 3 гепта = 7
тетра = 4 окта = 8
Всегда используйте префиксы, за исключением случаев, когда есть только один элемент с именем первым, и в этом случае префикс моно не используется. Второй элемент всегда имеет префикс, за исключением случаев, когда существует только одна известная комбинация элементов, как в случае с HF. Когда префикс заканчивается на a или o, а название второго элемента начинается с гласной, a или o часто опускается.

Leave A Comment