ДАЮ 20 БАЛЛОВ ПОЖАЛУЙСТАА Определите массу 2,4,6 – триброманилина, который может быть получен при взаимодействии анилина массой 18,6 г с бромной водой … массой 208 г и массовой долей брома 50 %.
2-метил-123-пропантріол формула
какой это спирт Ch4-ch-ch-ch3-ch4 Ch4 oh
Докажите опытным путём состав: а)серной кислоты б) хлорида железа3
Помогите прошу очень срочно
ВЫБЕРИТЕ ИЗ ПРЕДЛОЖЕННЫХ!!! Пж пж
ПОЖАЛУЙСТА!! Выберите из предложенных в фото
Смешали два раствора. Первый раствор содержал 1 моль хлорида аммония, а другой — 2 моль нитрата серебра. Найдите массу (в граммах) выпавшего осадка и
… запишите.
Первый раствор содержал 1 моль хлорида аммония, а другой — 2 моль нитрата серебра. Найдите массу (в граммах) выпавшего осадка и
… запишите.
Самостоятельная работа по теме «Электрические явления» (8 класс)
МБОУ «Очерская СОШ № 3» г. Очер Пермский край
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
12. Частица, имеющая наименьший заряд, называется …
13. Единица измерения заряда — это …
2.Карточка №1
1. Объясните процесс электризации стеклянной палочки о шёлковую ткань.
2. Как изменяется сила, действующая на заряженную гильзу со стороны электрического поля заряженного тела, при увеличении расстояния между гильзой и телом?
1) увеличивается 2) уменьшается 3) не меняется
3. Как можно обнаружить электрическое поле?
4. В ядре атома меди содержатся 63 частицы. Сколько из них нейтронов?
1) 29 2) 34 3) 63
5. Можно ли при трении стеклянной палочкой о шёлк сообщить заряд только стеклянной палочке?
3.Тест на составление схем атомов различных элементов.
Вариант № 1
1. Каков заряд ядра атома цинка?
1) 30 2) 35 3) 65 4) 95
2. Сколько нейтронов содержится в ядре урана с 238-ью частицами?
Сколько нейтронов содержится в ядре урана с 238-ью частицами?
1) 92 2) 146 3) 184 4) 238
3. Чему равен заряд иона, образовавшегося из атома кислорода, после отделения от него двух электронов?
1) заряду электрона 2) суммарному заряду двух электронов 3) заряду протона
4) суммарному заряду двух протонов
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
12. Частица, имеющая наименьший заряд, называется …
13. Единица измерения заряда — это …
2.Карточка № 2
1. Что произойдёт, если наэлектризованной эбонитовой палочкой прикоснуться к небольшому металлическому шарику?
2. Существует ли поле вокруг тела, заряд которого равен нулю?
1) да 2) нет 3) однозначно сказать нельзя
3. Какая частица обладает наименьшим зарядом?
1) электрон 2) нейтрон 3) атом
4. Чему станет равен заряд атома хрома при потере одного электрона?
5. Почему ворсинки и пыль прилипают к экрану телевизора во время его работы?
3.Тест на составление схем атомов различных элементов.
Вариант № 2
1. Сколько нейтронов содержится в ядре атома цинка?
1) 30 2) 65 3) 35 4) 95
2. Определите с помощью таблицы Менделеева количество протонов в ядре хлора.
1) 17 2) 35 3) 36 4) 18
3. Нейтральный атом при облучении его ультрафиолетовым светом потерял 2 электрона. При этом
Нейтральный атом при облучении его ультрафиолетовым светом потерял 2 электрона. При этом
1) заряд атома не изменился 2) у атома появился положительный заряд +2е
3) у атома появился отрицательный заряд -2е
4) у атома появился положительный заряд +4е
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
13. Единица измерения заряда — это …
2.Карточка № 3
1. Объясните принцип действия электрометра.
2. Будут ли взаимодействовать два электрона, если их из воздуха перенести в безвоздушное пространство?
1) да 2) нет 3) однозначно сказать нельзя
3. Объясните, в чём состояли опыты Иоффе и Милликена.
4. В ядре атома германия содержатся 72 частицы. Сколько из них протонов?
1) 32 2) 40 3) 72
5. Почему нельзя наэлектризовать металлическое тело, если его держать в руке?
3.Тест на составление схем атомов различных элементов.
Вариант № 3
1. У нейтрального атома вокруг ядра вращается 15 электронов. Определите заряд ядра и название атома. 1) + 15, фосфор 2) -15, фосфор 3) +30, цинк 4) -30, цинк
2. Чему равен суммарный заряд всех электронов нейтрального атома CI?
1) +17 2) -17 3) +35 4) -35
3. Электроскопу сообщили заряд -4,8* 10-5 Кл. Что при этом произошло с электроскопом?
Электроскопу сообщили заряд -4,8* 10-5 Кл. Что при этом произошло с электроскопом?
1) ему было сообщено 3* 1014 нейтронов
2) ему было сообщено 3· 1014 протонов
3) ему было сообщено 3 ·1014 электронов
4) ему было сообщено 3* 1014 ионов
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
12. Частица, имеющая наименьший заряд, называется …
13. Единица измерения заряда — это …
2.Карточка № 4
1. Приведите примеры взаимодействия одноимённо заряженных тел.
2. Что позволяет определить изменение угла расхождения листочков электроскопа?
1) знак заряда 2) величину заряда 3) количество заряженных частиц
3. Что представляет собой ядро магния, вокруг которого вращается 11 электронов?
1) атом 2) положительно заряженный ион
3) отрицательно заряженный ион
4. Металлическая гильза отталкивается от эбонитовой палочки. Как она будет взаимодействовать со стеклянной?
5. Почему отклонится стрелка электроскопа, даже если поднесенным заряженным предметом не касаться его?
3.Тест на составление схем атомов различных элементов.
Вариант № 4
1. Определите с помощью таблицы Менделеева количество протонов в атоме германия.
1) 139 2) 32 3) 82 4) 24
2. Из атома хлора вылетели два электрона. Как при этом изменился заряд ядра атома?
1) не изменился 2) уменьшился 3) увеличился
4) результат зависит от способа удаления электронов из атома
3. От атома Na оторван электрон. К атому Сl присоединен электрон. Эти два иона объединились и образовали молекулу поваренной соли. Каков заряд этой молекулы?
1) нейтрален 2) положителен 3) отрицателен
4) по приведенным данным определить это невозможно
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
12. Частица, имеющая наименьший заряд, называется …
13. Единица измерения заряда — это …
2.Карточка № 5
1. Приведите примеры взаимодействия разноимённо заряженных тел.
2. Какое из приведённых веществ является проводником?
1) фарфор 2) воздух 3) медь 4) резина
3. В ядре атома алюминия содержится 26 частиц. Сколько электронов вращается вокруг ядра?
1) 9 2) 13 3) 26 4) 39
4. Объясните механизм электризации.
5. Почему к заряженным телам притягиваются незаряженные?
3.Тест на составление схем атомов различных элементов.
1. Сколько нейтронов содержится в ядре атома цинка?
1) 30 2) 65 3) 35 4) 95
2. Определите с помощью таблицы Менделеева количество протонов в ядре хлора.
1) 17 2) 35 3) 36 4) 18
3. Нейтральный атом при облучении его ультрафиолетовым светом потерял 2 электрона. При этом
1) заряд атома не изменился 2) у атома появился положительный заряд +2е
3) у атома появился отрицательный заряд -2е
4) у атома появился положительный заряд +4е
Самостоятельная работа по теме «Электрические явления»
1.Физический диктант по теме «Электрические явления»
1. Электризацией тела называется …
2. Наэлектризованные тела могут притягиваться и …
3. Существуют два вида зарядов: …
4. Электризация может осуществляться следующими способами: …
5. Действие электроскопа основано на явлении …
б. По способности передавать электрические заряды вещества делятся на …
7. Проводники — это …
8. Диэлектрики — это …
9. Изоляторы — это …
10. Особый вид материи, окружающий заряженное тело, называется …
11. Электрическая сила — это …
12. Частица, имеющая наименьший заряд, называется …
13. Единица измерения заряда — это …
2.Карточка № 6
1. Как можно обнаружить электрическое поле вокруг заряженного тела?
2. Какое из приведённых веществ является диэлектриком?
1) алюминий 2) раствор поваренной соли 3) янтарь 4) графит
3. Что представляет собой ядро фтора, вокруг которого движутся 10 электронов?
1) атом фтора 2) положительно заряженный ион
3) отрицательно заряженный ион
4. К положительно заряженному электроскопу подносят заряженное тело. Листочки электроскопа расходятся на ещё больший угол. Каков по знаку заряд тела?
5. Если в двух ядрах атомов содержится одинаковое число частиц, можно ли утверждать, что это атомы одного и того же химического элемента?
3.Тест на составление схем атомов различных элементов.
Вариант № 3
1. У нейтрального атома вокруг ядра вращается 15 электронов. Определите заряд ядра и название атома. 1) + 15, фосфор 2) -15, фосфор 3) +30, цинк 4) -30, цинк
У нейтрального атома вокруг ядра вращается 15 электронов. Определите заряд ядра и название атома. 1) + 15, фосфор 2) -15, фосфор 3) +30, цинк 4) -30, цинк
2. Чему равен суммарный заряд всех электронов нейтрального атома CI?
1) +17 2) -17 3) +35 4) -35
3. Электроскопу сообщили заряд -4,8*10-5 Кл. Что при этом произошло с электроскопом?
1) ему было сообщено 3 . 1014 нейтронов
2) ему было сообщено 3· 1014 протонов
3) ему было сообщено 3 ·1014 электронов
4) ему было сообщено 3* 1014 ионов
Тест «Строение атома. Химическая связь» | Тест по химии (8 класс) на тему:
Строение атома. Химическая связь.
Вариант – I
А1. Каков заряд ядра атома магния?
А) +24 Б) +36 В) +12 Г) -12
А2. Определите элемент, если в его атоме 40 электронов
А) алюминий Б) цирконий В) германий Г) галлий
А3. Чему равняется количество протонов, нейтронов и электронов в атоме фосфора?
А) р=31, n=16, е=31 Б) р=15, n=15, е=15 В) р=15, n=31, е=15 Г) р=15, n=16, е=15
А4. Каков физический смысл порядкового номера элемента
А) это число энергетических уровней в атоме Б) это заряд ядра атома В) это относительная атомная масса Г) это число нейтронов в ядре
А5. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) это заряд ядра атома Б) это число электронов на внешнем энергетическом уровне В) это число электронов в атоме Г) это число энергетических уровней в атоме
А6. Чему равно число электронов на внешнем энергетическом уровне атома
А) порядковому номеру Б) номеру периода
В) номеру группы Г) числу нейтронов в ядре
А7. Укажите количество электронов на внешнем энергетическом уровне в атоме хлора
А) 2 Б) 5 В) 7 Г) 17
А8. Укажите пару химических элементов, между которыми может возникнуть ковалентная неполярная связь
Укажите пару химических элементов, между которыми может возникнуть ковалентная неполярная связь
А) водород и фосфор Б) натрий и фтор В) кислород и натрий Г) азот и азот
А9. Укажите формулу соединения с ковалентной полярной связью
А) O2 Б) CF4 В) KBr Г) P4
А10. Атому, какого химического элемента соответствует электронная формула 1S22S22P2
А) углерод Б) сера В) магний Г) гелий
А11. В ядре атома, какого химического элемента 7 протонов и 8 нейтронов
А) фтор Б) азот В) фосфор Г) кислород
А12. Молекулярная масса вещества с химической формулой h3SO4
А) 100 Б) 98 В) 56 Г) 124
В1. Установите соответствие между типом химической связи и формулой соединения
Вид химической связи
А) Ковалентная неполярная
Б) Ионная
В) Ковалентная полярная
Г) Металлическая
Химическое соединение
1) N2O5 2) CaCl2
3) Zn 4) O3
5) K3P 6) HF
С1. Найдите массовую долю натрия в составе соды Na2CO3
Строение атома. Химическая связь.
Вариант – II
А1. Каков заряд ядра атома цинка?
А) -30 Б) +35 В) +65 Г) +30
А2. Определите элемент, если в его атоме 25 электронов
А) титан Б) хром В) марганец Г) бром
А3. Чему равняется количество протонов, нейтронов и электронов в атоме кальция?
А) р=20, n=40, е=20 Б) р=40, n=20, е=40 В) р=20, n=20, е=20 Г) р=40, n=40, е=40
А4. Каков физический смысл порядкового номера элемента
А) это число нейтронов в ядре Б) это число протонов в ядре атома В) это число энергетических уровней в атоме Г) это относительная атомная масса
А5. Каков физический смысл номера периода таблицы Д. И.Менделеева?
И.Менделеева?
А) это заряд ядра атома Б) это число электронов на внешнем энергетическом уровне В) это число электронов в атоме Г) это число энергетических уровней в атоме
А6. Чему равно общее число электронов атома
А) порядковому номеру Б) номеру периода
В) номеру группы Г) числу нейтронов в ядре
А7. Укажите количество электронов на внешнем энергетическом уровне в атоме азота
А) 2 Б) 5 В) 7 Г) 17
А8. Укажите пару химических элементов, между которыми может возникнуть ионная связь
А) водород и кислород Б) фтор и углерод В) литий и хлор Г) хлор и хлор
А9. Укажите формулу соединения с ковалентной неполярной связью
А) O2 Б) CF4 В) KBr Г) P4
А10. Атому, какого химического элемента соответствует электронная формула 1S22S22P63S1
А) литий Б) натрий В) калий Г) кремний
А11. В ядре атома, какого химического элемента 8 протонов и 8 нейтронов
А) фтор Б) азот В) фосфор Г) кислород
А12. Молекулярная масса вещества с химической формулой P2O5
А) 142 Б) 64 В) 150 Г) 124
В1. Установите соответствие между типом химической связи и формулой соединения
Вид химической связи
А) Ковалентная неполярная
Б) Ионная
В) Ковалентная полярная
Г) Металлическая
Химическое соединение
1) MgCl2 2) Br2
3) Zn 4) h3
5) Ca 6) HCl
С1. Найдите массовую долю алюминия в составе глинозема Al2O3
Определение заряда ядра атома — Справочник химика 21
Поскольку атом в целом нейтрален, суммарный заряд электронов должен быть равен заряду ядра. Последний удалось вычислить по доле а-частиц, рассеиваемых под определенным углом. Оказалось, что число элементарных положительных зарядов ядра атома равно порядковому (атомному) номеру элемента в периодической системе Д. И. Менделеева. Таким образом, [c.29]
Оказалось, что число элементарных положительных зарядов ядра атома равно порядковому (атомному) номеру элемента в периодической системе Д. И. Менделеева. Таким образом, [c.29]Естественно, что фундаментальный закон химии, открытый Д. И. Менделеевым, — периодический закон—должен найти себе объяснение в закономерности строения атоМов, вскрываемой квантовой механикой. Периодичность в изменении химических свойств элементов при возрастании заряда ядра определяется периодическим повторением у определенных атомов строения внешних электронных оболочек. Легко заметить, что число электронов в последовательности от 5 до ближайшей конфигурации (первый период) или (остальные периоды) равно 2, 8, 8, 18, 32 (табл. 3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60]
Еслн расчет методом конфигурационного взаимодействия проводится при различных значениях R и если он сопровождается вариационным определением эффективного заряда ядра, то для Нг получается равновесное межъядерное расстояние 1,45 ат. ед. Полная энергия при таком межъядерном расстоянии равна [c.218]
Атомом называют мельчайшую частицу элемента, сохраняющую все его свойства, С точки зрения теории строения атомом является устойчивая динамическая система из положительно заряженного ядра и определенного числа электронов. Если число электронов равно числу единиц заряда ядра, атом яв. тяется электронейтральной системой, к которой и относится химическое определение атома, в противном же случае мы имеем дело с положительным или отрицательным ионом. В теории строения такие системы описывают теми же методами, что и электронейтральные атомы, поэтому второе определение обобщает понятие атома и на ионы. Говоря об устойчивости атома, понимают, что энергия атома ниже, чем энергия невзаимодействующих ядра и электронов, т. е. при образовании атома из ядра и электронов энергия выделяется. Обычно за начало отсчета энергии, т, е. за нуль, принимается энергия невзаимодействующих ядра и электронов. Тогда энергия устойчивой системы — атоМа — оказывается отрицательной. [c.16]
тяется электронейтральной системой, к которой и относится химическое определение атома, в противном же случае мы имеем дело с положительным или отрицательным ионом. В теории строения такие системы описывают теми же методами, что и электронейтральные атомы, поэтому второе определение обобщает понятие атома и на ионы. Говоря об устойчивости атома, понимают, что энергия атома ниже, чем энергия невзаимодействующих ядра и электронов, т. е. при образовании атома из ядра и электронов энергия выделяется. Обычно за начало отсчета энергии, т, е. за нуль, принимается энергия невзаимодействующих ядра и электронов. Тогда энергия устойчивой системы — атоМа — оказывается отрицательной. [c.16]
Однако к моменту открытия периодического закона только лишь стали утверждаться представления о молекулах и атомах. Причем атом считался не только наименьшей, но и элементарной (т. е. неделимой) частицей. Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 г. французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газы, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой способностью обладает не только уран. Титанические усилия, связанные с переработкой огромных масс урановой смоляной руды, позволили П. Кюри и М. Склодовской открыть два новых радиоактивных элемента полоний и радий. Последовавшее за этим установление природы а-, (5- н у-лучей, образующихся при радиоактивном распаде (Э. Резерфорд, 1899 —1903 гг.), обнаружение ядер атомов диаметром 10 нм, занимающих незначительную долю объема атома (диаметр 10 нм) (Э. Резерфорд, 1909— 1911 гг.), определение заряда электрона (Р. М и л л и к е н, 1909— 1914 гг.) и доказательство дискретности его энергии в атоме (Дж. Ф р а н к, Г. Г е р ц, 1912 г.), установление заряда ядра, равного номеру элемента (Г. Мозли, 1913 г.), и, наконец, открытие протона (Э. Резерфорд, 1920 г.) и нейтрона (Дж. Чедвик, 1932 г.) позво или предложить следующую модель строения атома [c.23]
Резерфорд, 1920 г.) и нейтрона (Дж. Чедвик, 1932 г.) позво или предложить следующую модель строения атома [c.23]
Атом удобно представлять состоящим из остова и определенного числа валентных электронов. Под остовом понимается ядро плюс электроны на низших энергетических уровнях, не принимающие участия в химических превращениях. Элементы одной группы отличаются друг от друга своими остовами, но имеют одинаковое число валентных электронов. На размеры атома и его способность терять или приобретать электроны оказывают влияние число заполненных энергетических уровней остова и заряд ядра, но основным фактором, определяющим химические свойства элемента, является строение валентной электронной оболочки его атомов. [c.92]
Согласно современным данным, атомы всех элементов состоят из положительно заряженного ядра и определенного (для атомов различных элементов—различного) количества электронов. Положительный заряд ядра атома и количество планетарных электронов по мере укрупнения атома непрерывно возрастают, причем атом в целом остается электронейтральным общее количество электронов в атоме всех элементов всегда численно равно положительному заряду ядра атома. Например, заряд ядра атома кальция равен -j-20. Атом кальция содержит 20 электронов, из которых каждый имеет заряд, равный —1. Суммарный заряд всех электронов —1-20 = —20. Суммарный заряд атома кальция в целом равен [c.90]
Основополагающим понятием современной химии является понятие о химическом элементе , т. е. виде атомов с определенной совокупностью свойств. Под свойствами изолированных атомов подразумеваются заряд ядра и атомная масса, особенности электронного строения, потенциалы ионизации, сродство к электрону и электроотрицательность, атомные, орбитальные и ионные радиусы н т. д. Однако необходимо иметь в виду, что изолированные атомы как форма организации вещества могут существовать в природе лишь при достаточно высоких температурах в виде моноатомного пара. Единственным исключением являются благородные газы, для которых при любых условиях и в любом агрегатном состоянии структурной единицей является атом. Все остальные элементы существуют в природе в виде более сложных агрегатов молекул и кристаллов. Таким образом, следует строго различать понятия элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Следует особо подчеркнуть нетождественность этих понятий хотя бы потому, что один элемент может существовать в виде нескольких простых веществ (аллотропия) . [c.26]
Единственным исключением являются благородные газы, для которых при любых условиях и в любом агрегатном состоянии структурной единицей является атом. Все остальные элементы существуют в природе в виде более сложных агрегатов молекул и кристаллов. Таким образом, следует строго различать понятия элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Следует особо подчеркнуть нетождественность этих понятий хотя бы потому, что один элемент может существовать в виде нескольких простых веществ (аллотропия) . [c.26]
Укажите в определении Химический элемент — это вид атомов с одинаковым зарядом ядра определяемое и определяющее понятия, род объектов, видовое отличие. Аналогично разберите определение Сложное вещество — это вещество, состоящее из разных атомов . Предложите определения понятий следующих объектов протон, изотоп, атом. [c.11]
Таким образом, общие и специфические свойства определяются схожестью электронного строения атомов ( в свободном или связанном состоянии), проявляемой в близости радиусов, величин электроотрицательности атомов, в изоморфизме соединений, равенстве и однотипности валентных возможностей атомов и т. д. Индивидуальные свойства — это свойства, присущие только данному атому это результат проявления всех особенностей его электронной структуры, его заряда ядра и всех вытекающих особенностей (энергии, геометрии атомных орбиталей). Электронная структура атома в свободном состоянии индивидуальна, неповторима. Атом занимает определенное место в непрерывном ряду элементов и обладает физической индивидуальностью спектром, атомной массой, набором изотопов и т. д. и т. п. [c.48]
Из определения следует, что химический элемент — это не один какой-либо атом, а определенный вид атомов с одинаковым зарядом ядра. Так, например, элемент хлор состоит из двух видов атомов, отличающихся по массе,— из атомов С1 и из атомов 7С1. Понятие же элемент хлор мыслится как совокупность этих изотопов, так же как понятия элемент водород , элемент кислород и т. д. [c.55]
д. [c.55]
Рассмотрим для примера с этой точки зрения атом гелия в основном состоянии. Если бы в нем совсем не было межэлектронного взаимодействия, то оба электрона находились бы на орбитали с п = 1 в поле заряда 2 = -1-2 и по формуле (2) имели бы энергию Е = = -13,6 4 = -54,4 эВ, равную экспериментально определенному потенциалу ионизации одноэлектронного иона Не . Другой крайний вариант — идеальное экранирование заряда ядра одним электроном по отношению к другому, который тогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т. е. ядра с [c.34]
Результаты расчета методом валентных связей тоже можно улучшить, проводя вариационное определение эффективного заряда ядра при каждом межъядерном расстоянии. Таким способом находят, что минимум энергии соответствует значению R = 1,44 ат. ед., а полная энергия прн этом оказывается равной — 1,1389 ат. ед. (энергия диссоциации 0,1389 ат. ед.). Зна- [c.215]
Весьма привлекательна перспектива определения момента неподеленной пары, основанная на сопоставлении атомных координат, получаемых в результате рентгенографических и нейтронографических измерений [18]. В последнем случае измерения дают положения атомных ядер, в первом — центры тяжести электронных облаков атомов. Для атома с гибридной неподеленной электронной парой центр тяжести электронного облака смещен, как показано выше (рис. 9, стр. 40) на расстояние х от ядра. Определив X как разность векторов, соответствующих атому с неподеленной электронной парой, найденных рентгено- и нейтронографическими измерениями, нетрудно вычислить момент неподеленной пары электронов как 11а=гех, где г — заряд ядра нейтрального атома. [c.71]
Различные виды атомов. Во избежание недоразумений необходимо точно сформулировать понятие определенный вид атома, используемое в вышеприведенном определении элемента. Под этим выражением мы понимаем атом, ядро которого имеет определенный электрический заряд. Все ядра имеют положительные электрические заряды, равные заряду электрона или превышающие его в целое число раз (знак заряда ядра противоположен знаку заряда электрона). Число, выражающее это отношение, называется атомным номером. Обычно атомный номер обозначается символом 2 электрический заряд ядра с атомным номером Z равен Хе при заряде электрона —е. Следовательно, простейший атом, каковым является атом водорода, имеет атомный номер 1 это значит, что для атома водорода 2=1, а заряд его ядра равен — -е. [c.69]
Все ядра имеют положительные электрические заряды, равные заряду электрона или превышающие его в целое число раз (знак заряда ядра противоположен знаку заряда электрона). Число, выражающее это отношение, называется атомным номером. Обычно атомный номер обозначается символом 2 электрический заряд ядра с атомным номером Z равен Хе при заряде электрона —е. Следовательно, простейший атом, каковым является атом водорода, имеет атомный номер 1 это значит, что для атома водорода 2=1, а заряд его ядра равен — -е. [c.69]
Величина энергии отдачи, Рис. 4-8. Схема распада Вг «. приобретаемой ядром в результате испускания -кванта и электрона внутренней конверсии, составляет лишь 0,34 эв, что значительно меньше энергии химической связи. Так как атом брома входит в состав сложной молекулы, то его заряд, появляющийся вследствие испускания конверсионных электронов, вероятно, распределяется среди различных атомов, вызывая электростатическое отталкивание. При этом связь разрушается и образуются сильно реакционноспособные ионы брома, что подтверждается определением заряда брома, возникающего в результате изомерного перехода в бромистом этиле. Доли Вг , несущие положительный, нейтральный [c.307]
Атом, превращаясь в элементарный анион, выделяет энергию, равную сродству к электрону. Следовательно, у аниона запас энергии меньше, чем у атома. Обратное превраш ение такого иона в атом требует затраты энергии, равной сродству к электрону. Анионы могут в определенных условиях проявлять свойства восстановителей. Восстановительные свойства анионов выражены тем сильнее, чем меньше сродство элемента к электрону. А так как сродство к электрону у элементов одной подгруппы уменьшается с ростом заряда ядра, то восстановительные свойства элементарных анионов усиливаются с ростом заряда ядра атома. Из ионов гало-генидов F», С1 , Вг , J наиболее активный восстановитель — ион J . Поэтому J может быть окислен атомом любого другого галогена. [c.152]
Известно, что атомы состоят из положительно заряженного ядра, вокруг которого по очень сложным орбитам вращаются отрицательно заряженные электроны. В атомах с зарядом ядра больше двух электроны группируются в оболочки, находящиеся на разных расстояниях от ядра. Химическая связь зависит от движения электронов в самой внешней оболочке. Согласно законам движения частиц в атоме, каждая оболочка не может содержать больше определенного числа электронов, от которого и зависит стабильность оболочки. В качестве меры стабильности мы можем рассматривать энергию, необходимую для вырывания электрона из его оболочки (вследствие чего нейтральный атом превращается в положительно заряженный ион). Наиболее стабильны атомы гелия (в его единственной оболочке движутся два электрона), неона, аргона, криптона и ксе- [c.50]
В атомах с зарядом ядра больше двух электроны группируются в оболочки, находящиеся на разных расстояниях от ядра. Химическая связь зависит от движения электронов в самой внешней оболочке. Согласно законам движения частиц в атоме, каждая оболочка не может содержать больше определенного числа электронов, от которого и зависит стабильность оболочки. В качестве меры стабильности мы можем рассматривать энергию, необходимую для вырывания электрона из его оболочки (вследствие чего нейтральный атом превращается в положительно заряженный ион). Наиболее стабильны атомы гелия (в его единственной оболочке движутся два электрона), неона, аргона, криптона и ксе- [c.50]
К этому же выводу, т. е. что величина положительного заряда ядра атома данного элемента равна порядковому номеру этого элемента в периодической системе Д. И. Менделеева, пришли ученые и на основании опытов совершенно другого характера. Таким образом выяснилось, что порядковые номера элементов в периодической системе не только регистрируют их места в этой системе, но и отражают определенные свойства элементов — величины зарядов их ядер. Величина же заряда ядра, как мы увидим, является наиболее важным свойством элемента. Так как атом в целом электронейтрален, то, следовательно, числу положительных зарядов его ядра должно соответствовать равное число электронов (отрицательных зарядов) вокруг ядра. Таким образом, порядковый номер элемента в периодической системе Д. И. Менделеева показывает не только число положительных зарядов ядра атома, но и число электронов вокруг ядра. Например, порядковый номер элемента натрия в периодической системе равен 11. Это значит, что ядро атома натрия имеет И положительных электрических зарядов и что вокруг этого ядра имеется 11 электронов. [c.210]
Было установлено, что заряд ядра атома в указанных условных единицах равен порядковому номеру элемента в периодической системе. Так как атом в целом электронейтрален, то из этого следует, что число электронов в атоме равно порядковому номеру, или заряду, атомного ядра. Следовательно, порядковый номер указывает определенное место элемента в периодической системе. [c.31]
Следовательно, порядковый номер указывает определенное место элемента в периодической системе. [c.31]
Понятие эффективного заряда ядра вводится в квантовой химии для изображения равнодействующего поля ядра и среднего распределения электронов в атоме, которое действует на валентный электрон. По определению Z = Z — 0, где Z — эффективный, а Z — формальный заряды ядра и а — постоянная (число) экранирования. Таким образом, с помощью эффективного заряда ядра любой сложный атом превращается в во- [c.23]
В обычных условиях атом электрически нейтрален положительный заряд ядра равен сумме зарядов окружающих ядро электронов. Однако в определенных условиях атом может присоединить (отдать) один или несколько электронов и приобрести при этом соответственно отрицательный (положительный) заряд, т. е. может превратиться в ион того или иного знака заряда. Процесс отрыва электрона от атомного ядра называют ионизацией. Степень связи электронов с ядром в атоме неодинакова для валентных (внешних) электронов энергия связи минимальна. [c.9]
Таким образом, все химические элементы состоят из атомов, ядра которых содержат определенное число протонов и, следовательно, имеют определенный положительный заряд. Число протонов в ядре называется порядковым атомным) номером элемента. Разумеется, все порядковые номера — целые числа. Так, порядковый номер кислорода 8 означает, что в ядре атома кислорода находится восемь протонов (заряд ядра 8+). Нейтральный атом кислорода должен иметь также восемь электронов (заряд каждого электрона 1—). [c.132]
Число электронов, окружающих атомное ядро, не остается неизменным. При определенных условиях атом может присоединять или отдавать их. Если атом принимает электроны, то образуется избыточный отрицательный заряд и атом превращается в отрицательный ион, который называется анионом. Если атом отдает электроны, то преобладает положительный заряд ядра и возникает положительно заряженный ион — катион. [c.14]
[c.14]
Для испускания квантов света определенной частоты, т. е. ДЛЯ появления в спектре элемента каждой спектральной линии, атому необходима совершенно определенная энергия, которую называют потенциалом возбуждения данной линии. Величина лотенциала возбуждения (для каждого данного атома) определяет-гя энергетическим уровнем, с которого совершается переход. Величины потенциалов возбуждения различны для разных уровней, а следовательно, и для разных спектральных линий каждого элемента. Величины потенциалов возбуждения зависят от строения атома массы и заряда ядра, числа электронов и др. [c.148]
В этой формуле постоянные величины, обозначенные знаком функциональной зависимости г) перед скобкой, характеризуют простой атом (заряд ядра, заряд электрона, массу электрона) и расстояние от ядра точки хуг для которой определяется ф-функция. Формула (24) подчеркивает, что г )-функция зависит от трех переменных величин п, I я т. Переменная величина л — это главное квантовое число. Оно же определяет энергию электрона. Как указывалось, п принимает любое значение натурального ряда чисел 1, 2, 3, 4,. .. Остальные две переменные величины I и т тоже могут принимать лишь строго определенные значения и поэтому, так же как и п, называются квантовыми числами. [c.28]
Так как атом в целом электронейтрален, то число отрицательно заряженных электронов равно числу положительно заряженныл протонов. Для определения количества протонов и нейтронов в ядре атома необходимо знать массу атома и положительный заряд ядра или число электронов в атоме. Например, атом фтора имеет [c.34]
Некоторое дополнительное обсуждение требуется для определения места водорода в системе. При формальном подходе к структуре его атома водород был бы аналогом лития. Но характер внешней электронной оболочки определяет аналогию элементов не сам по себе, а лишь в свете общей закономерности развития структур. Согласно последней переход в периодах 2 1 сопровождается у аналогичных элементов уменьшением положительного заряда ядра и числа внешних электроноз на восемь единиц (Ме- -Не). Поэтому в действительности нейтральный атом водорода является аналогом атома фтора. При отрицательной валентности водород так же относится к фтору, как Не к Ые, Ь к Ыа и т. д., а при положительной (бу-д чк голым протоном) вообще не может иметь аналогов среди других элементов и [c.235]
Поэтому в действительности нейтральный атом водорода является аналогом атома фтора. При отрицательной валентности водород так же относится к фтору, как Не к Ые, Ь к Ыа и т. д., а при положительной (бу-д чк голым протоном) вообще не может иметь аналогов среди других элементов и [c.235]
Как известно, атом состоит из положительно заряженного ядра н отрицательно заряженных электронов, образующих электронную оболочку. Главной характеристпкой атома является не атомная масса, как гюлагали ранее, а положительный заряд ядра атома. Он служит отличительным признаком различных видов атомов, что позволяет дать современное определение понятия элемента [c.12]
Однако в те времена многих клавишей не хватало. Было известно 63 элемента из 92 естественно существующих. Многие клавиши издавали фальшивые звуки . Так, Д. И. Менделееву пришлось изменить атомные массы урана и тория, которые тогда принимали равными 116 и 120 (вместо 232 и 240) и атомную массу циркония, принимавшуюся в то время равной 138 (вместо 91). Д. И. Менделеев сумел увидеть (вернее, предвидеть) основной закон, согласно которому многие свойства элементов (валентность, атомные объемы, коэффициенты расширения и др.) изменяются периодически с возрастанием атомной массы элементов. Открытие периодического закона затруднялось из-за его сложности. Размеры периодов не одинаковы. Если в первом периоде (Н, Не) содержится всего два элемента, то во втором (Е1—Ые) — восемь, в третьем (Ма—Аг) — снова восемь, в четвертом (К—Кг)—восемнадцать, в пятом (КЬ—Хе)—тоже восемнадцать, в шестом (Сз—Кп)—тридцать два и, наконец, седьмой период оказывается недостроенным. Отметим, что числа элементов в периодах (2, 8, 8, 18, 18, 32) подчиняются общему закону 2п . При п = это выражение дает 2 при л = 2—8, при я=3—18 и при =4— 32. Кроме того, в середине периодической таблицы элементов находится 14 редкоземельных элементов, многие свойства которых (например, валентность) практически не изменяются, несмотря на увеличение атомной массы Трудность открытия периодического закона заключа лась и в том, что истинной независимой переменной, оп ределяющей свойства элементов, должна быть не масса а число электронов в атоме, т.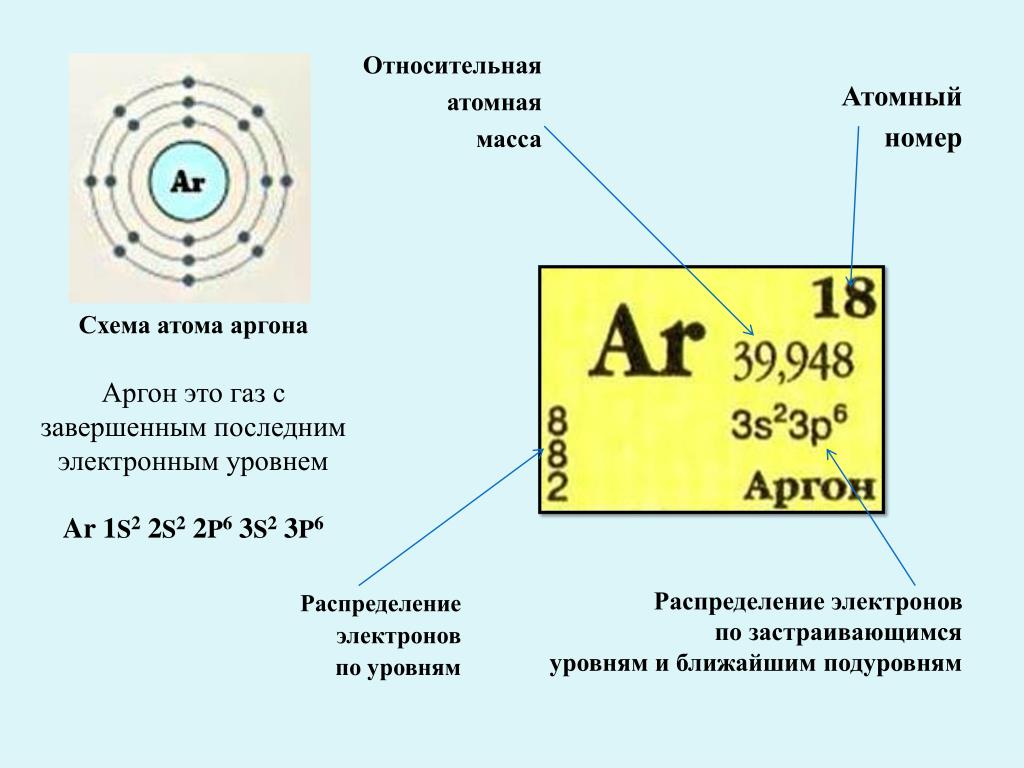 е. заряд ядра. Д. И. Мен делеев, естественно, принял массу за такую переменную так как в механике она в значительной степени опреде ляет движение частиц. Атом был электрифицирован много позднее. Если бы были известны изотопы (атомы с одинаковым зарядом ядра и разными массами, например, водород и тяжелый водород), то, располагая их в ряд по величине массы, вряд ли можно было бы открыть периодический закон. Это удалось потому, что между массовым числом и зарядом ядра имеется определенная связь. Так, в начале таблицы элементов массовое число приблизительно в два раза больше заряда ядра. Атомная масса элемента определяется также его изотопным составом. При расположении элементов по их массовым числам Д. И. Менделееву при составлении таблицы при- [c.312]
е. заряд ядра. Д. И. Мен делеев, естественно, принял массу за такую переменную так как в механике она в значительной степени опреде ляет движение частиц. Атом был электрифицирован много позднее. Если бы были известны изотопы (атомы с одинаковым зарядом ядра и разными массами, например, водород и тяжелый водород), то, располагая их в ряд по величине массы, вряд ли можно было бы открыть периодический закон. Это удалось потому, что между массовым числом и зарядом ядра имеется определенная связь. Так, в начале таблицы элементов массовое число приблизительно в два раза больше заряда ядра. Атомная масса элемента определяется также его изотопным составом. При расположении элементов по их массовым числам Д. И. Менделееву при составлении таблицы при- [c.312]
Атом имеет сложное строение (см. 23). Он состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Положительный заряд ядра, равный порядковому номеру элемента, является важнейшей характеристикой атома (см. 25). Он служит отличительным признаком различных видов атомов, что позволяет дать более полное определение элемента химический элемент — это вид атомов с одинаковым положительным зарядо.и ядра. [c.13]
Вследствие волнового характера движения электрона атом не имеет строго определенных границ. Поэтому измерить абсолютные размеры атомов невозможно. За радиус свободного атома можно принять теорё тически рассчитанное положение главного максимума плотности внешних электронных облаков (рис. 14). Это так называемый орбит.альный радиус. Как видно на рис. 14, в ряду элементов данного периода (Ь1 — Ке) орбитальные радиусы атомов с ростом заряда ядра в целом уменьшаются. Поэтому изменение атомных и ионных радиусов в периодической системе носит периодический характер (рис. 15). В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов малы Г периодов, так как у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств (/-и /элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно 3,- и /сжатием. В подгруппах элементов радиусы атомов и однотипных ионов В общем увеличиваются. [c.43]
В больших периодах в пределах семейств (/-и /элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно 3,- и /сжатием. В подгруппах элементов радиусы атомов и однотипных ионов В общем увеличиваются. [c.43]
Атом — наименьшая электронейтральная частица химического элемента, являющаяся носителем епз свойств. Каждому химическому элементу соответствует определенный вид атомов. А. состоит из ядра и электронной оболочки. Масса А. сосредоточена в ядре, которое характеризуется положительным зарядом, численно равным порядковому номеру (атомному номеру). См. Ядро апюшюв. А. в целом электронейтра-лен, поскольку положительный заряд ядра компенсируетт я таким же числом электронов. См. Электрон. Электроны могут занимать в атоме положения, которым отвечают определенные (квантовые) энергетические состояния, называемые энергетическими уровнями. Число энергетических уровней определяется номером периода, в котором находится данный элемент. Число электронов, которые могут заселять данный энергетический уровень, определяется ло формуле N = 2п , щеп — номер уровня, считая от ядра. т.е. главное квантовое число. Согласно квантовой теории невозможно одновременно и абсолютно точно определить энергию и местоположение электрона. Можно лишь говорить о нахождении электрона в определенном объеме пространства, что собственно и представляет собой атомную орбиталь (АО). Электрон заполняет пространство вокруг атомного ядра в форме стоячей волны, которую можно представить как электронное облако. Плотность электронного облака, понимаемого как облако электрического заряда электрона, — электронная плотность, различна и зависит от того, насколько электрон удален от ядра. [c.38]
Информацию о поверхностном составе металлов получают с помощью ряда методов. Так, например, можно полностью удалять из образца атомы и идентифицировать их масс-спектрометрически. Процесс рассеяния ионов тоже чувствителен к составу поверхности.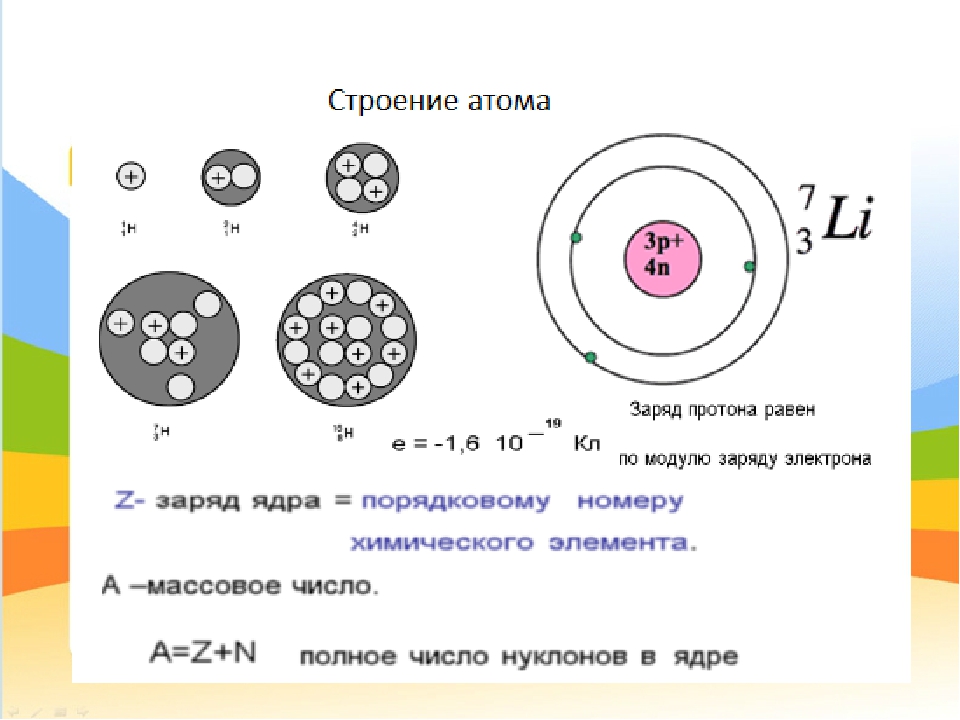 Данные по адсорбции газов можно объяснить, исходя из состава поверхности, по крайней мере в благоприятных случаях полезны и измерения спектроскопических или термодинамических свойств, характеризующих взаимодействие адсорбат—адсорбент. Идентифицировать поверхностный атом можно, основываясь на его электронной структуре (определяемой зарядом ядра) щироко применяется микрозондовый анализ (электронно- и фотонно-зондовый в принципе можно также использовать ионно-зондовый анализ, но для аналитических целей он применяется редко и далее не рассматривается). Химическое окружение поверхностного атома в определенных обстоятельствах можно исследовать методом мёссбауэровской спектроскопии. [c.412]
Данные по адсорбции газов можно объяснить, исходя из состава поверхности, по крайней мере в благоприятных случаях полезны и измерения спектроскопических или термодинамических свойств, характеризующих взаимодействие адсорбат—адсорбент. Идентифицировать поверхностный атом можно, основываясь на его электронной структуре (определяемой зарядом ядра) щироко применяется микрозондовый анализ (электронно- и фотонно-зондовый в принципе можно также использовать ионно-зондовый анализ, но для аналитических целей он применяется редко и далее не рассматривается). Химическое окружение поверхностного атома в определенных обстоятельствах можно исследовать методом мёссбауэровской спектроскопии. [c.412]
Мельчайшей частицей простого вещества, сохраняющей его свойства, является молекула. Она состоит из атомов одного элемента, а молекула сложного включает в себя атомы разных элементов. Сложные вещества не могут быть разделены на простые без разрушения молекулы, в результате чего она распадается на атомы. Атом — мельчайшая частица элемента. Каждому элементу соответствует определенный вид атомов, обусловливающих его химическую ь ндивидуальность. Природная совокупность атомов, обладающих одинаковыми химическими свойствами, имеющих одинаковый заряд ядра и определенное среднее значение атомной массы, называется элементом. [c.7]
Некоторое дополнительное обсуждение требуется для определения места водорода в системе. При формальном подходе к структуре его атома водород был бы аналогом лития. Но характер внешней электронной оболочки определяет аналогию элементов не сам по себе, а лишь в свете обшей закономерности развитии структур. Согласно последней переход в периодах 2->-1 сопровождается у аналогичных эчементов уменьшением положительного заряда ядра и числа внео1них электронов на восемь единиц (Ые- Не). Поэтому в действительности нейтральный атом водорода является аналогом атома фтора. При отрицательной валентности водород совершенно так же относится к фтору, как Не к Ые, 1+ к Ыа+ и т, д. , а при положительной (будучи голым- протном) вообще не может и eть аналогов среди других элементов и стоит совершенно особняком. В общем, следовательно, водород является неполным аналогом фтора. Близость к семейству галоидов согласуется со всей совокупностью физических свойств водорода, а структурная однотипность его агома с атомами элементов первой группы имеет такой же формальный характер, как однотипность атома гелия с атомами элементов второй группы. [c.171]
, а при положительной (будучи голым- протном) вообще не может и eть аналогов среди других элементов и стоит совершенно особняком. В общем, следовательно, водород является неполным аналогом фтора. Близость к семейству галоидов согласуется со всей совокупностью физических свойств водорода, а структурная однотипность его агома с атомами элементов первой группы имеет такой же формальный характер, как однотипность атома гелия с атомами элементов второй группы. [c.171]
Датский физик Нильс Бор, ставший вскоре ведущим теоретиком в области атомного учения, подхватил мысли английского коллеги и в 1913 году в нескольких работах Оп the onstitution of Atomes and Mole ules высказал свои представления о новой модели атома. Атом состоит из положительно заряженного ядра, сосредоточившего в себе всю массу ядро окружено электронами, число которых компенсирует заряд ядра и которым предписаны вполне определенные орбиты. Теперь представление об атоме становилось четким. Конечно, должно было пройти некоторое время, прежде чем появились конкретные данные о строении атомного ядра. Однако уже сейчас можно было сделать ценные выводы. Источником радиоактивного излучения и местонахождением таинственной энергии атома могло быть только ядро. Напротив, за поглощение и излучение световых и рентгеновских лучей, а также за реакционную способность атомов ответственны электронные оболочки, находящиеся вокруг этого ядра. Ученые получили теперь отчетливые представления и о размерах атома измерив диаметр атома, его оценили в 10 см, то есть стомиллионной частью сантиметра. Неизмеримо крошечным было ядро, которое оказалось в десять тысяч раз меньше, чем весь атом. [c.79]
Электрон представляет собой элементарный и определенный заряд электричества. Один или несколько электронов, вращающихся вокруг ядра с эквивалентным положительным зарядом, являются составной частью любого атома. Электроны вращаются по орбитам, определяемым энергетическими соотнощениями. Электроны, находящиеся на внещней орбите, играют очень важную роль в электрохимических процессах. До тех пор, пока атом имеет нормальное число электронов, он электрически нейтрален, но если он потеряет один или несколько электронов, то превращается в ион с полоннесколько электронов, атом превращается в отрицательно заряженный ион. Щелочные металлы характеризуются наличием одного электрона на внещней орбите. Атомы этих металлов легко отдают электрон и превращаются в ионы. Такая реакция одновалентна. Цинк и кадмий имеют два электрона на внещней орбите. Теряя их, атомы цинка и кадмия превращаются в ионы с двумя положительными зарядами. Реакция — двyxJ валентная. Галоиды имеют семь электронов на внещней орбите. Но в отличие от упомянутых вьше металлов они с трудом отдают эти электроны. Более охотно галоиды принимают электроны, превращаясь ионы с отрицательным зарядом. Заряды, переносимые всеми ионами, представляют собой заряды, кратные единичному заряду. Мы можем написать уравнение для ионизации такого вещества, как цинковый купорос, следующим образом [c.187]
Рассмотрим сначала гелиоподобный атом с зарядом ядра, равным Z, причем расположим это ядро в начале координат. Электронный гамильтониан, определенный в разд. 1.1, имеет для рассматриваемой задачи следующий вид [c.15]
ВАРИАНТ 1
ВАРИАНТ 2
ВАРИАНТ 3
|
Проверочная работа по теме «Строение атома»
Проверочная работа № 9 по теме «Строение атома».
Пояснительная записка:
Цель работы: проверить знания учащихся строения атома, умения пользоваться таблицей Менделеева для определения состава атома химического элемента, применять полученные знания для объяснения конкретных процессов.
Самостоятельная работа состоит из 6 вариантов, каждый вариант содержит 5 заданий различного уровня сложности (1задание — начальный уровень, 2 – средний уровень, 3 и 4–достаточный, 5 — высокий)
Работу можно проводить как в конце урока изучения темы «Строение атома», с целью закрепления знаний, так и вначале следующего урока. Работа рассчитана на 10-15 минут, в зависимости от уровня усвоения знаний класса.
Оценивание: при верном выполнении начального и среднего уровня оценка «3», начального, среднего и достаточного уровня оценка «4», при верном выполнении всех заданий оценка «5».
Вариант 1
1.Из каких частиц состоят атомы вещества?
2.Может ли атом химического элемента лишиться заряда, равного 1,5 заряда электрона? Поясните.
3.В ядре химического элемента 24 протона. Какой это химический элемент?
4.Определите состав ядра атома серебра.
5.В каком из перечисленных ниже случаев можно утверждать, что мы имеем дело с двумя атомами одного и того же химического элемента: в ядрах атомов одинаковое число частиц; в ядрах атомов одинаковое число протонов; в ядрах атомов одинаковое число нейтронов.
Вариант 2
1.Каков знак электрического заряда ядра атома?
2.В каком случае атом превращается в положительный ион?
3.Вокруг ядра вращается 24 электрона. Какой это химический элемент?
4.Определите состав атома цинка.
5.Ядро атома и электрон имеет разные знаки зарядов и, следовательно, притягиваются друг к другу. Почему же электроны не падают на ядро?
Вариант 3
1.Какую частицу называют протоном?
2.Существуют ли атомные ядра с зарядом меньшим, чем у протона? Поясните.
3. В ядре химического элемента 23 нейтрона. Какой это химический элемент?
4.Определите состав ядра атома урана.
5.Используя знания о строении атома, объясните, в чём состоит основное отличие проводников электрического заряда от диэлектриков.
Вариант 4
1.Какую частицу называют нейтроном?
2.В каком случае атом превращается в отрицательный ион?
3. В ядре химического элемента 34протона. Какой это химический элемент?
4. Определите состав атома германия.
5.Почему масса протона ненамного отличается от массы атома водорода?
Вариант 5
1. Какую частицу называют электроном?
2.Является ли нейтральным атом гелия, если вокруг его ядра вращается один электрон? Поясните.
3.Вокруг ядра вращается 34 электрона. Какой это химический элемент?
4.Определите состав ядра атома азота.
5.В результате трения о шёлк стеклянной палочке был сообщён положительный заряд. Объясните, все ли атомы, из которых состоит заряженная стеклянная палочка, нейтральны. Почему?
Вариант 6
1. Какую частицу называют ионом?
2.Какой заряд приобретает атом железа, если он потеряет один электрон? Поясните.
3. В ядре химического элемента 35нейтрона. Какой это химический элемент?
4. Определите состав атома кальция
5. В результате трения о шёлк стеклянной палочке был сообщён положительный заряд. Изменилась ли после этого масса стеклянной палочки? Как? Почему?
Строение атома | 8 класс
Вариант 1
1. Какое строение имеют атомы химических элементов?
В центре атома находится положительно-заряженное ядро, которое состоит из протонов и нейтронов, а вокруг ядра перемещаются электроны в соответствии с определенными законами.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах бора (массовое число 11), меди (массовое число 63) и олова (массовое число 118).
3. Напишите электронные формулы атомов азота и алюминия.
4. Напишите не менее трех символов химических элементов, у которых не внешнем энергетическом уровне находится четыре электрона. Изобразите схему строения атома и электронную формулу одного из них.
Вариант 2
1. Укажите различия в строении атомов типичных металлов и типичных неметаллов.
Атомы типичных металлов имеют на валентном уровне 1-2 электрона (элементы I и II А групп, кроме H и He), а типичных неметаллов – более 4 электронов.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах кальция (массовое число 40), кислорода (массовое число 16) и серебра (массовое число 107).
3. Напишите электронные формулы атомов фтора и кремния.
4. Электронная формула атома элемента 1s2 2s2 2p6 3s1. Какой это элемент? Напишите формулы оксида и гидроксида данного элемента.
Na. Na2O – оксид натрия, NaOH – гидроксид натрия.
Вариант 3
1. Что общего в строении атомов химических элементов, расположенных в одной А-группе?
Одинаковое количество электронов на внешнем энергетическом уровне.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах углерода (массовое число 12), цинка (массовое число 64) и брома (массовое число 79).
3. Напишите электронные формулы атомов лития и хлора.
4. Напишите не менее трех символов химических элементов, у которых на внешнем энергетическом уровне находятся пять электронов. Изобразите схему строения атома и электронную формулу одного из них.
Вариант 4
1. Что общего в строении атомов химических элементов, расположенных в одном периоде?
У атомов, расположенных в одном периоде одинаковое число энергетических уровней.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах фтора (массовое число 19), калия (массовое число 39) и золота (массовое число 197).
3. Напишите электронные формулы атомов магния и кислорода.
4. Электронная формула атома элемента 1s2 2s2 2p6 3s2 3p4. Какой это элемент? Напишите для данного элементы формулы высшего оксида и летучего соединения с водородом.
S. SO3 – оксид серы (VI), H₂S – сероводород.
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы просмотреть полную информацию о цитировании для этой записи)
Allred, A. L. «Значения электроотрицательности из термохимических данных». Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр. 215–221. DOI: 10.1016 /
Allred, A. L., and E. G. Rochow. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии, том 5, номер 4, 1958 г., стр.264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 / -X
Андерсен Т., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III». Справочный журнал физических и химических данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Бацанов, С.С. «Ван-дер-Ваальсовые радиусы элементов». Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии». Обзоры современной физики, том 39, номер 1, 1967, стр. 125–142. DOI: 10.1103 /
Бедфорд, Р. Э., Дж. Боннье, Х. Маас и Ф. Павезе. «Рекомендуемые значения температуры по международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек.»Metrologia, volume 33, number 2, 1996, pp. 133–154. Doi: 10.1088 /
Bondi, A.» Van der Waals Volumes and Радиусы металлов в ковалентных соединениях «Журнал физической химии, том 70, номер 9, 1966 г., стр. 3006–3007. Doi: 10.1021 /
Бонди, А.» Ван-дер-Ваальсовы объемы и радиусы. » Журнал физической химии, том 68, номер 3, 1964, стр. 441–451. doi: 10.1021 /
Bowen, H.Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Братч, Стивен Г. «Пересмотренные значения электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга». Журнал химического образования, том 65, номер 1, 1988 г., стр. 34–41. DOI: 10.1021 /
Cardarelli, François. Справочник по материалам: Краткий настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Кардона, М. и Л. Лей, редакторы. Фотоэмиссия в твердых телах I: общие принципы.Берлин: Springer-Verlag, 1978.
Клементи, Э. и Д. Л. Раймонди. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр. 2686–2689. DOI: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г.Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверриа, Эдуард Кремадес, Флавия Барраган и Сантьяго Альварес. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Кронан Д. С. «Базальные металлические отложения восточной части Тихого океана». Бюллетень Геологического общества Америки, том 87, номер 6, 1976 г., стр. 928–934. DOI: 10.1130 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Десаи П. Д., Т. К. Чу, Х. М. Джеймс и К. Ю. Хо. «Удельное электрическое сопротивление отдельных элементов». Справочный журнал физических и химических данных, том 13, номер 4, 1984 г., стр. 1069–1096.
Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д., и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли с помощниками редакторов Корал М. Бэглин, С. Ю. Фрэнк Чу и Джин Зипкин.Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел. Oxford: Pergamon Press, 1970.
Ghosh, Dulal C., and Kartick Gupta. «Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5,
№ 4, 2006, с. 895–911. DOI: 10.1142 /
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание.Оксфорд: Баттерворт-Хайнеманн, 1997.
. Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Höhne, G. W. H., W. F. Hemminger, H.-J. Фламмерсхайм. Дифференциальная сканирующая калориметрия, 2-е издание.Берлин: Springer – Verlag, 2003.
Хорват А. Л. «Критическая температура элементов и периодическая система». Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. DOI: 10.1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College Publishers, 1993.
Международная организация труда (МОТ). Международная карта химической безопасности цинка.http: //
Международная организация труда (МОТ). Международный
Карта химической безопасности цинка (порошка). http: //
Дженсен, Дж. Э., Р. Б. Стюарт, В. А. Таттл, Х. Брехна и А. Г. Проделл, редакторы. Записная книжка избранных криогенных данных Брукхейвенской национальной лаборатории. BNL 10200-Р, т. 1, Брукхейвенская национальная лаборатория, август 1980 г.
Каксирас, Эфтимиос. Атомная и электронная структура твердых тел. Кембридж: Издательство Кембриджского университета, 2003.
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc, 2005.
Киттель, Чарльз. Введение в физику твердого тела, 5-е издание. Нью-Йорк: John Wiley & Sons, Inc, 1976.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K- и L-оболочек». Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327.
Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия морских отложений». С. 1–36 в Отложения, диагенез и осадочные породы. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор. CRC Справочник по химии и Физика, 88 издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б., Терри Л. Мик и Лиланд К. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 /
Манн, Джозеф Б., Терри Л. Мик, Юджин Т. Найт, Джозеф Ф. Капитани и Лиланд К. Аллен. «Энергии конфигурации элементов d-блока». Журнал Американского химического общества, том 122, номер 21, 2000 г., стр. 5132–5137. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Мартин, В. К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля,
том 15, номер 1–4, 2000 г., стр.78–79. DOI: 10.1007 /
Mechtly, Eugene A. «Свойства материалов». стр. 4–1–4–33 в Справочных данных
Для инженеров: радио, электроника, компьютер, связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л. и Дональд А. Тарр. Неорганический Химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Национальный институт охраны труда и здоровья (NIOSH). Международная карта химической безопасности цинка. http: //
Национальный институт безопасности и гигиены труда (NIOSH).Международная карта химической безопасности цинка (порошка). http: //
Национальный институт безопасности и гигиены труда (NIOSH). Регистр токсического действия химических веществ на цинк. http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». стр.8–41 в Измерение термодинамических свойств одиночных фаз. Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марша. Амстердам: Elsevier Science, 2003.
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Пальме, Х. и Х. Бир. «Метеориты и состав солнечной фотосферы». стр. 204–206 в книге Ландольта – Бернштейна — Группа VI: Астрономия и астрофизика. Под редакцией
Х. Х. Фойгт. Нью-Йорк: Springer – Verlag, 1993. doi: 10.1007 /
Палм, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
.Полинг, Линус. Природа химической связи, 3-е издание.Итака, Нью-Йорк: издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение в неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 /
Pekka Pyykkö. Самосогласованные ковалентные радиусы 2009 г. http: //
Престон-Томас, Х. «Международная температурная шкала 1990 г. (ITS-90).»Metrologia, volume 27, number 1, 1990, pp. 3–10. Doi: 10.1088 /
Pyykkö, Pekka, and Michiko Atsumi.» Molecular. Ковалентные радиусы с двойной связью для элементов Li-E112. «Chemistry — A European Journal, volume 15, number 46, 2009, pp. 12770–12779. Doi: 10.1002 /
Pyykkö, Pekka, and Michiko Atsumi . «Ковалентные радиусы молекулярных одинарных связей для элементов 1-118». Химия — Европейский журнал, том 15, номер 1, 2009 г., стр.186–197. DOI: 10.1002 /
Рингнес, Виви. «Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г., стр. 731–738. DOI: 10.1021 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Cambridge University Press, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон Р. Т. Простые неорганические вещества. Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. DOI: 10.1021 /
Сандерсон, Р. Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Sansonetti, J. E., and W. C. Martin. «Справочник по основным данным атомной спектроскопии». Журнал физических и
Химические справочные данные, том 34, номер 4, 2005 г., стр.1559–2259. DOI: 10.1063 /
Шеннон Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta
Crystallographica Section A, volume 32, number 5, 1976, pp. 751–767. DOI: 10.1107 /
Силби, Роберт Дж., Роберт А. Алберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: Джон Уайли и Sons, Inc., 2005.
Сингман, Чарльз Н.«Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал химической физики, том 41, номер 10, 1964, стр. 3199–3204. DOI: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и
Разрешение парадокса Пирсона-Полинга ». Журнал химического образования, том 67, номер 11, 1990, стр.911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к Изучение описательной неорганической химии. Кембридж: Издательство Кембриджского университета, 1990.
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Review of Scientific Instruments, том 54, номер 1, 1983 г., стр.1–11. DOI: 10.1063 /
Шугар, Джек и Арлин Масгроув. «Уровни энергии цинка, от Zn I до Zn XXX». Справочный журнал физических и химических данных, том 24, номер 6, 1995 г., стр. 1803–1872.
Тари А. Удельная теплоемкость вещества при низких температурах. Лондон: Imperial College Press, 2003.
Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME).2008 Чрезвычайная ситуация Руководство по реагированию.
Вайнштейн, Борис К., Владимир М. Фридкин, Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
. Waber, J. T. и Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965 г., стр.4116–4123. DOI: 10.1063 /
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021 /
Weeks, Мэри Эльвира и Генри М. Лестер. Открытие Стихий, 7-е издание. Истон, Пенсильвания: Журнал химического образования, 1968.
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 /
Yaws, Карл Л. «Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005.
Зефиров Ю.V. «Сравнительный анализ систем радиусов Ван-дер-Ваальса». Кристаллографические отчеты, том 42, номер 1, 1997 г., С. 111–116.
Цинк — Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: цинк
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
На этой неделе химический лосьон с каламином для зудящей кожи, шампунь против перхоти для шелушащейся кожи головы и дезодорант для подмышек — ну, я думаю, мы все стоял рядом с кем-то, кто, как нам хотелось бы, знал немного больше о химии цинка. Вот Брайан Клегг.
Брайан Клегг
Не так много элементов со звукоподражательными названиями. Скажите «кислород» или «йод», и в звучании слова нет ключа к природе элемента.Но с цинком все иначе. Цинк — цинк — цинк — вы почти можете услышать, как набор монет падает в старомодную ванну. Это просто должен быть твердый металл.
При использовании цинк часто спрятан, почти скрыт. Он предотвращает ржавление железа, успокаивает солнечные ожоги, защищает от перхоти, соединяется с медью, образуя очень знакомый сплав золотого цвета и сохраняет нам жизнь, но мы почти не замечаем этого. Этот сине-серый металл, известный под коммерческим названием Spelter, совсем не кричащий и привлекающий внимание. Даже происхождение этого вызывающего воспоминания имени неясно.
Словарь говорит нам, что слово цинк происходит от немецкого языка (с буквой K в конце вместо C), но как это название возникло, неизвестно. Самое раннее упоминание о цинке относится к 1651 году. Вещество было известно и раньше — предметы с цинком в них датируются более чем 2500 лет назад, и римляне использовали этот сплав золотого цвета, — но цинк не был идентифицирован как отдельный материал на западе до тех пор, пока семнадцатый век.
Цинк, представленный в периодической таблице как Zn, является переходным металлом, сгруппированным с кадмием и ртутью.Со средним атомным номером 30 он имеет пять стабильных изотопов с атомной массой от доминирующего цинка 64 до цинка 70, плюс еще 25 радиоизотопов.
Из-за туманного происхождения трудно определить одного человека как первооткрывателя стихии. Хотя кажется, что он был очищен в Индии еще в двенадцатом веке, первое конкретное заявление о том, что он произвел этот металл, относится к 1668 году, а процесс извлечения цинка из его оксида был запатентован в Великобритании в 1738 году торговцем металлами Уильямом. Чемпион.Но обычно именно немецкий химик Андреас Маргграф получает лавры как «первооткрыватель» за свой эксперимент 1746 года по выделению цинка.
Хотя история цинка более чем туманна, нет никаких сомнений в его полезности. Достаточно взглянуть на оцинкованную металлическую крышу или ведро, чтобы увидеть, как работает цинк. Гальванизация названа в честь Луиджи Гальвани, человека, который заставил лягушачьи лапки подергиваться электрическим током, но гальванизация не имеет ничего общего с электрическим зрелищем. На самом деле роль электричества удивительно тонка.
Наиболее распространенной формой цинкования является горячее цинкование, когда железо или сталь пропускают через ванну с жидким цинком при температуре около 460 градусов Цельсия, что на 40 градусов выше его точки плавления. Покрытие предохраняет обрабатываемый объект от ржавления. Первоначально цинк просто препятствует попаданию воздуха в железо, но позже цинк подвергается коррозии, а не железу, в электрохимическом процессе, действуя как так называемый жертвенный анод. Здесь и появляется «гальваническая» часть названия. Некоторая гальванизация является более буквально электрической — например, автомобильные кузова покрываются гальваническим покрытием цинком, чтобы нанести тонкий ровный слой.
Электрические возможности цинка распространяются также на самые популярные батареи. Традиционный сухой элемент имеет внешний цинковый кожух, действующий как анод (что сбивает с толку, анод, который обычно считается положительным, является отрицательным концом батареи), в то время как углеродный стержень обеспечивает катод, положительный электрод. В щелочных батареях с более длительным сроком службы анод образован из порошкообразного цинка (что дает большую площадь поверхности для реакции), а катод — из сложного диоксида марганца.
Но самый видимый пример цинка в действии не дает никаких указаний на этот сероватый металл — вместо этого он находится в сплаве, который смешивает блеск золота с обычным оттенком.Когда расплавленный цинк и медь смешиваются вместе, результат становится жирным, как латунь. На самом деле это латунь. Из этого гибкого сплава изготовлено все, от дверных креплений до декоративных наклеек для конских ошейников. Любой оркестр был бы намного беднее без медных духовых инструментов. Он даже может застегнуть молнию на вашей одежде.
Хорошо отполированная латунь имеет приятное сияние, но наиболее тесный контакт с цинком, а точнее оксидом цинка, часто возникает, когда мы имеем дело с нежелательным сиянием солнечных ожогов.Когда я был молод, и солнцезащитных кремов было мало, загорелая кожа обильно покрывалась успокаивающим розовым лосьоном с каламином. Основным ингредиентом этого вещества является оксид цинка, который имеет белый цвет — это небольшое количество оксида железа, которое придает ему этот цвет. Даже сейчас, когда мы можем избежать потребности в каламине, оксид цинка играет свою роль. Оксид цинка, называемый китайским белым, когда его используют в красках, является хорошим поглотителем ультрафиолетового света, поэтому солнцезащитный крем часто содержит суспензию крошечных частиц оксида цинка, как и большинство косметических средств на минеральной основе.
И это только начало для этого универсального оксида. Вы найдете его в антипирене и пищевых продуктах, где он обогащает сухие завтраки, в стекле и керамике, в клеях и резине. Это неожиданное появление на столе для завтрака отражает еще одну важную сторону цинка. Он нужен нам, чтобы оставаться здоровыми. Это один из микроэлементов, питательных веществ, которые в небольших количествах необходимы нашему организму для нормальной работы. Он часто присутствует в витаминных добавках, хотя большинство из нас получает много из мяса и яиц.Цинк попадает в различные белки, особенно в ферменты, участвующие в развитии организма, пищеварении и фертильности. Недостаток цинка в рационе может привести к замедленному заживлению, раздражению кожи и потере вкусовых ощущений, а также к развитию многих хронических заболеваний.
Поскольку цинк также присутствует в шампунях от перхоти в виде пиритиона цинка и в дезодорантах для подмышек в виде хлорида цинка, этот элемент даже делает нас более привлекательными для противоположного пола. Цинк — скрытая звезда.Мы редко осознаем это, в отличие от более ярких соседей в таблице периодов, но цинк — это элемент рабочей лошадки, который помогает всем нам.
Крис Смит
Научный писатель из Бристоля Брайан Клегг со звукоподражательным элементом, цинком. На следующей неделе, что таится в твоем подвале.
Кэтрин Холт
Первые сообщения о проблемах, связанных с газообразным радоном в жилых домах, были в Соединенных Штатах в 1984 году, когда служащий на атомной электростанции начал подавать сигнал тревоги детектора излучения по пути на работу .В конечном итоге проблема была обнаружена в его доме, где уровень радона в подвале оказался аномально высоким.
Крис Смит
Но откуда это взялось и каков был риск для его здоровья. Кэтрин Холт будет здесь со всеми ответами и остальной частью рассказа Радона о химии в ее элементе на следующей неделе. Я действительно надеюсь, что вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
3.5. Атомное ядро - Chemistry LibreTexts
Цели обучения
- Перечислите свойства трех основных субатомных частиц.
- Определите атомную единицу массы (а.е.м.).
- Определите атомный номер и массовое число.
- Определите изотопы.
- Определите количество протонов, нейтронов и электронов в атоме с заданным массовым числом.
Историческое развитие различных моделей структуры атома показано на рисунке \ (\ PageIndex {1} \).J.J. Томсон и Роберт Милликен провели эксперименты по изучению свойств электронов . Резерфорд установил, что ядро атома водорода было положительно заряженной частицей, для которой в 1920 году он придумал название протон . Он также предположил, что ядра других элементов, кроме водорода, должны содержать электрически нейтральные частицы с примерно такой же массой, как и протон. Однако нейтрон не был открыт до 1932 года, когда его открыл Джеймс Чедвик (1891–1974, студент Резерфорда; лауреат Нобелевской премии по физике 1935 года).В результате работы Резерфорда стало ясно, что α-частица содержит два протона и нейтрон и, следовательно, является ядром атома гелия.
Рисунок \ (\ PageIndex {1} \) Краткое изложение исторического развития моделей компонентов и структуры атома. Даты в скобках — годы, в которые проводились ключевые эксперименты. (CC BY-SA-NC).
Модель атома Резерфорда по сути такая же, как и современная модель, за исключением того, что теперь известно, что электроны неравномерно распределены по объему атома.Вместо этого они распределяются в соответствии с набором принципов, описанных квантовой механикой.
Рисунок \ (\ PageIndex {2} \) показывает, как модель атома со временем эволюционировала от неделимой единицы Дальтона до современного представления, которому учат сегодня.
Рисунок \ (\ PageIndex {2} \) Эволюция атомной теории на примере моделей атома кислорода. Модель Бора и текущая модель описаны в главе 6 «Строение атомов». Изображение, используемое с разрешением (CC BY-SA-NC).
Ядро (во множественном числе) — положительно заряженная область в центре атома. Он состоит из плотно упакованных субатомных частиц двух типов. Частицы — это протоны с положительным электрическим зарядом и нейтроны с нейтральным электрическим зарядом. Вне ядра атом — это в основном пустое пространство, в котором вращаются отрицательные частицы, называемые электронами. На рисунке \ (\ PageIndex {3} \) ниже показаны эти части атома.
Рисунок \ (\ PageIndex {3} \) Ядерный атом
Ядро атома очень маленькое. Его радиус составляет всего около 1/100 000 от общего радиуса атома. Если бы атом был размером с футбольный стадион, ядро было бы размером с горошину! Электроны практически не имеют массы, но протоны и нейтроны имеют большую массу для своего размера. В результате ядро имеет практически всю массу атома. Учитывая его большую массу и крошечные размеры, ядро очень плотное.Если бы объект размером с пенни имел ту же плотность, что и ядро атома, его масса была бы больше 30 миллионов тонн!
Держим все вместе
Частицы с противоположными электрическими зарядами притягиваются друг к другу. Это объясняет, почему отрицательные электроны вращаются вокруг положительного ядра. Частицы с одинаковым электрическим зарядом отталкиваются друг от друга. Это означает, что положительные протоны в ядре отталкиваются друг от друга. Так почему же ядро не разлетается? Еще более сильная сила, называемая сильной ядерной силой , удерживает протоны и нейтроны вместе в ядре.
Таблица \ (\ PageIndex {1} \) дает свойства и расположение электронов, протонов и нейтронов. В третьем столбце показаны массы трех субатомных частиц в «атомных единицах массы». Атомная единица массы (\ (\ text {amu} \)) определяется как одна двенадцатая массы атома углерода-12. Атомные единицы массы (\ (\ text {amu} \)) полезны, потому что, как вы можете видеть, масса протона и масса нейтрона почти точно равны \ (1 \) в этой системе единиц.
| Частица | Символ | Масса (а.е.м.) | Относительная масса (протон = 1) | Относительный заряд | Расположение |
|---|---|---|---|---|---|
| протон | п. + | 1 | 1 | +1 | внутри ядра |
| электрон | e — | 5.45 × 10 −4 | 0,00055 | -1 | вне ядра |
| нейтрон | n 0 | 1 | 1 | 0 | внутри ядра |
а.е.м. в граммах и килограммах
1 а.е.м. = 1,6605 × 10 −24 г = 1,6605 × 10 −27 кг
Атомный номер
Отрицательный и положительный заряды равной величины нейтрализуют друг друга.Это означает, что отрицательный заряд электрона идеально уравновешивает положительный заряд протона. Другими словами, нейтральный атом должен иметь ровно один электрон на каждый протон. Если у нейтрального атома 1 протон, у него должен быть 1 электрон. Если у нейтрального атома 2 протона, у него должно быть 2 электрона. Если у нейтрального атома 10 протонов, у него должно быть 10 электронов. Вы уловили идею. Чтобы быть нейтральным, атом должен иметь одинаковое количество электронов и протонов.
Ученые различают разные элементы, подсчитывая количество протонов в ядре (Таблица \ (\ PageIndex {2} \)).Если в атоме есть только один протон, мы знаем, что это атом водорода. Атом с двумя протонами всегда является атомом гелия. Если ученые считают четыре протона в атоме, они знают, что это атом бериллия. Атом с тремя протонами — это атом лития, атом с пятью протонами — это атом бора, атом с шестью протонами — это атом углерода. . . список продолжается.
Поскольку атом одного элемента можно отличить от атома другого элемента по количеству протонов в его ядре, ученых всегда интересует это число и то, как это число отличается между разными элементами.Число протонов в атоме называется атомным номером (\ (Z \)). Это число очень важно, потому что оно уникально для атомов данного элемента. Все атомы элемента имеют одинаковое количество протонов, и каждый элемент имеет разное количество протонов в своих атомах. Например, у всех атомов гелия есть два протона, и ни у каких других элементов нет атомов с двумя протонами.
| Имя | Протоны | Нейтроны | Электроны | Атомный номер (Z) | Массовое число (A) |
|---|---|---|---|---|---|
| Водород | 1 | 0 | 1 | 1 | 1 |
| Гелий | 2 | 2 | 2 | 2 | 4 |
| Литий | 3 | 4 | 3 | 3 | 7 |
| Бериллий | 4 | 5 | 4 | 4 | 9 |
| Бор | 5 | 6 | 5 | 5 | 11 |
| Углерод | 6 | 6 | 6 | 6 | 12 |
Конечно, поскольку нейтральные атомы должны иметь по одному электрону на каждый протон, атомный номер элемента также говорит вам, сколько электронов находится в нейтральном атоме этого элемента.Например, атомный номер водорода равен 1. Это означает, что у атома водорода есть один протон и, если он нейтрален, еще один электрон. Золото, с другой стороны, имеет атомный номер 79, что означает, что в атоме золота 79 протонов и, если он нейтрален, 79 электронов.
Нейтральные атомы
Атомы нейтральны по электрическому заряду, потому что у них такое же количество отрицательных электронов, как и положительных протонов (Таблица \ (\ PageIndex {2} \)). Следовательно, атомный номер атома также говорит вам, сколько электронов имеет атом.{-27} \) килограмм, что является чрезвычайно малой массой. Нейтрон имеет немного большую массу, чем протон, но его масса также часто принимается равной одной атомной единице массы. Поскольку электроны практически не имеют массы, почти вся масса атома состоит из его протонов и нейтронов. Следовательно, общее количество протонов и нейтронов в атоме определяет его массу в атомных единицах массы (Таблица \ (\ PageIndex {2} \)).
Снова рассмотрим гелий. У большинства атомов гелия есть два нейтрона в дополнение к двум протонам.Следовательно, масса большинства атомов гелия равна 4 атомным единицам массы (\ (2 \: \ text {amu} \) для протонов + \ (2 \: \ text {amu} \) для нейтронов). Однако у некоторых атомов гелия больше или меньше двух нейтронов. Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами. Поскольку количество нейтронов может различаться для данного элемента, массовые числа различных атомов элемента также могут различаться. Например, у некоторых атомов гелия есть три нейтрона вместо двух (они называются изотопами и подробно обсуждаются позже)
Как вы думаете, почему «массовое число» включает протоны и нейтроны, но не электроны? Вы знаете, что большая часть массы атома сосредоточена в его ядре.Масса атома зависит от количества протонов и нейтронов. Вы уже знаете, что масса электрона очень и очень мала по сравнению с массой протона или нейтрона (например, масса пенни по сравнению с массой шара для боулинга). Подсчет количества протонов и нейтронов говорит ученым об общей массе атома. Массовое число атома очень легко вычислить, если вы знаете количество протонов и нейтронов в атоме. Массовое число атома углерода с 6 протонами и 7 нейтронами рассчитывается и отображается следующим образом:
\ [\ text {массовое число} \: A = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \]
\ [\ text {массовое число} = \ text {6} + \ text {6} = \ text {12} \]
Пример 4.5,1
Каково массовое число атома гелия, содержащего 2 нейтрона?
Раствор
\ (\ left (\ text {число протонов} \ right) = 2 \) (Помните, что атом гелия всегда имеет 2 протона.)
\ (\ left (\ text {количество нейтронов} \ right) = 2 \)
\ (\ text {массовое число} = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \)
\ (\ text {массовое число} = 2 + 2 = 4 \)
Изотопы
Все атомы одного элемента имеют одинаковое количество протонов, но у некоторых может быть разное количество нейтронов.Например, у всех атомов углерода есть шесть протонов, и у большинства также шесть нейтронов. Но некоторые атомы углерода имеют семь или восемь нейтронов вместо обычных шести. Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства. Это потому, что у них одинаковое количество протонов и электронов.
Пример: изотопы водорода
Водород — это пример элемента, который имеет изотопы. Три изотопа водорода смоделированы на рисунке \ (\ PageIndex {4} \). Большинство атомов водорода имеют только один протон и один электрон и не имеют нейтрона. Эти атомы просто называются водородом. Некоторые атомы водорода также имеют один нейтрон. Эти атомы представляют собой изотоп под названием дейтерий. У других атомов водорода есть два нейтрона. Эти атомы представляют собой изотоп под названием тритий.
Рисунок \ (\ PageIndex {4} \): Три самых стабильных изотопа водорода: протий (A = 1), дейтерий (A = 2) и тритий (A = 3).(CC SA-BY 3.0; Баладжиджагадеш).
Для большинства элементов, кроме водорода, изотопы названы по их массовому числу. Например, атомы углерода с обычными 6 нейтронами имеют массовое число 12 (6 протонов + 6 нейтронов = 12), поэтому их называют углеродом-12. Атомы углерода с 7 нейтронами имеют атомную массу 13 (6 протонов + 7 нейтронов = 13). Эти атомы представляют собой изотоп под названием углерод-13.
Пример \ (\ PageIndex {1} \): изотопы лития
- Какой атомный номер и массовое число изотопа лития, содержащего 3 нейтрона.
- Какой атомный номер и массовое число у изотопа лития, содержащего 4 нейтрона?
Решение
Атом лития содержит в своем ядре 3 протона независимо от количества нейтронов или электронов.
а.
\ [\ begin {align} \ text {атомный номер} = \ left (\ text {количество протонов} \ right) & = 3 \ nonumber \\ \ left (\ text {количество нейтронов} \ right ») & = 3 \ nonumber \ end {align} \ nonumber \]
\ [\ begin {align} \ text {массовое число} & = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \ nonumber \\ \ text { массовое число} & = 3 + 3 \ nonumber \\ & = 6 \ nonumber \ end {align} \ nonumber \]
г.
\ [\ begin {align} \ text {атомный номер} = \ left (\ text {количество протонов} \ right) & = 3 \ nonumber \\ \ left (\ text {количество нейтронов} \ right ») & = 4 \ nonumber \ end {align} \ nonumber \]
\ [\ begin {align} \ text {массовое число} & = \ left (\ text {количество протонов} \ right) + \ left (\ text {количество нейтронов} \ right) \ nonumber \\ \ text { массовое число} & = 3 + 4 \ nonumber \\ & = 7 \ nonumber \ end {align} \ nonumber \]
Обратите внимание, что поскольку атом лития всегда имеет 3 протона, атомный номер лития всегда равен 3.Однако массовое число равно 6 в изотопе с 3 нейтронами и 7 в изотопе с 4 нейтронами. В природе существуют только определенные изотопы. Например, литий существует как изотоп с 3 нейтронами и как изотоп с 4 нейтронами, но он не существует как изотоп с 2 нейтронами или как изотоп с 5 нейтронами.
Символы для изотопов
Есть два основных способа, которыми ученые часто показывают массовое число интересующего их атома. Важно отметить, что массовое число составляет , а не , указанное в периодической таблице.Эти два способа включают запись символа ядра или указание имени элемента с записанным массовым числом.
Чтобы записать ядерный символ , массовое число помещается в верхнем левом углу (надстрочный индекс) химического символа, а атомный номер помещается в нижний левый (подстрочный индекс) символа. Полный ядерный символ гелия-4 показан ниже:
.Следующие символы ядер относятся к ядру никеля с 31 нейтроном и ядру урана с 146 нейтронами.{238} _ {92} U} \]
В представленном выше ядре никеля атомный номер 28 означает, что ядро содержит 28 протонов, и, следовательно, оно должно содержать 31 нейтрон, чтобы иметь массовое число 59. Ядро урана имеет 92 протона, как и все ядра урана, и это конкретное ядро урана имеет 146 нейтронов.
Другой способ представления изотопов — добавление дефиса и массового числа к химическому названию или символу. Таким образом, двумя ядрами будут никель-59 или Ni-59 и уран-238 или U-238, где 59 и 238 — массовые числа двух атомов, соответственно.{40} _ {19} \ ce {K} \)?
Раствор
\ [\ text {атомный номер} = \ left (\ text {количество протонов} \ right) = 19 \]
Для всех атомов без заряда количество электронов равно количеству протонов.
\ [\ text {количество электронов} = 19 \]
Массовое число 40 — это сумма протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.
\ [\ text {количество нейтронов} = 40 — 19 = 21.\]
Пример \ (\ PageIndex {3} \): Zinc-65
Сколько протонов, электронов и нейтронов содержится в атоме цинка-65?
Раствор
\ [\ text {число протонов} = 30 \]
Для всех атомов без заряда количество электронов равно количеству протонов.
\ [\ text {количество электронов} = 30 \]
Массовое число 65 — это сумма протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.{45} _ {20} \ ce {Ca} \)
- Ответ:
- 27 протонов, 27 электронов, 33 нейтрона
- Ответ б:
- 11 протонов, 11 электронов, 13 нейтронов
- Ответ c:
- 20 протонов, 20 электронов, 25 нейтронов
- Ответ d:
- 38 протонов, 38 электронов, 52 нейтрона
Свойства изотопов водорода, гелия, лития, беррилия, бора и углерода приведены в таблице \ (\ PageIndex {3} \).
| 1 | 0 | 1.{14} _6C} \) | 6 | 6 | 8 | 14.0032 | — (след) |
Резюме
- Атом состоит из дискретных частиц, которые определяют его химическое и физическое поведение.
- Каждый атом элемента содержит одинаковое количество протонов, которое является атомным номером ( Z ).
- Нейтральные атомы имеют одинаковое количество электронов и протонов.
- Атомы элемента, содержащие разное количество нейтронов, называются изотопами.
- Каждый изотоп данного элемента имеет один и тот же атомный номер, но разное массовое число ( A ), которое является суммой количества протонов и нейтронов.
- Относительные массы атомов выражаются в атомной единице массы (а.е.м.), которая определяется как одна двенадцатая массы одного атома углерода-12, состоящего из 6 протонов, 6 нейтронов и 6 электронов. Ядерная модель атома состоит из небольшой и плотной положительно заряженной внутренней части, окруженной облаком электронов.
Авторы и авторство
| также на далекие планеты, звезды и галактики. Следовательно, физические эксперименты привели к «стандартной модели» природы материи и сил во Вселенной. Основными составляющими вещества в этой стандартной модели являются не протоны или нейтроны, а кварки (стр. 75) , причудливо названные пятнышки, впервые предложенные в 1964 году американскими физиками Мюрреем Гелл-Манном и Джорджем Цвейгом.В конце концов, кварки не могут оказаться основными строительными блоками природы, но пока они объясняют все свойства материи, которые мы наблюдали. Большинство физиков думают, что всеобъемлющая теория заменит стандартную модель, точно так же, как теория относительности заменила законы движения Ньютона. Такая теория объединила бы все известные силы и частицы в один элегантный рецепт космоса. Любая хорошая теория природы должна учитывать свойства элементов, фундаментальных веществ, которые нельзя разложить на что-то более простое.Древние греки думали, что существует четыре элемента: огонь, воздух, вода и земля. Они также предложили пятый элемент: сущность небес, называемую «квинтэссенцией». Сегодня нам известно более 115 элементов, около 90 из которых существуют в природе. (Ученые выковывают остальные в своих лабораториях, но большинство из них существует лишь доли секунды, прежде чем они радиоактивно распадутся на другие элементы.) Вспомните свое детство, когда вы, возможно, играли с игрушечными игрушками или другими наборами взаимосвязанных элементов.Вы создали, казалось бы, бесконечное множество хитростей, используя, возможно, дюжину строительных блоков различных форм и размеров. А теперь представьте себе такую игру с 90 разновидностями фигур. Это та гибкость, которой располагает природа, чтобы построить нашу вселенную. Однако природа не может смешивать элементы случайным образом. Определенные правила определяют, какие элементы можно комбинировать. Например, «благородные газы», такие как гелий и неон, почти никогда ни с чем не вступают в реакцию, точно так же, как благородный лорд может игнорировать простых людей в своих владениях.С другой стороны, фтор и хлор захватывают практически все (продолжение) |
Атомный Строение
A. Атомный номер равен электронам или протонам
У каждого элемента есть атомный номер. Атомные номера перечислены вместе с названиями и символами элементов на внутренней стороне обложки текста. Атомный номер равен заряду ядра. Следовательно, он также равен количеству протонов в ядре, а также численно равен количеству электронов в нейтральном атоме.Атомный номер имеет символ Z.
У разных элементов разные атомные номера; следовательно, атомы разных элементов содержат разное количество протонов (и электронов). Кислород имеет атомный номер 8; его атомы содержат 8 протонов и 8 электронов. Уран имеет атомный номер 92; его атомы содержат 92 протона и 92 электрона.
Связь между атомным номером и числом протонов или электронов можно сформулировать следующим образом:
| Атомный номер | = количество протонов на атом |
| = количество электронов на нейтральный атом |
Б.Массовое число равно протонам и нейтронам
У каждого атома также есть массовое число, обозначаемое символом A. Массовое число атома равно количеству протонов плюс количество нейтронов, которые он содержит. Другими словами, количество нейтронов в любом атоме — это его массовое число за вычетом атомного номера.
Количество нейтронов = массовое число — атомный номер
или
Массовое число = количество протонов + количество нейтронов
Атомный номер и массовое число атома элемента можно указать, написав перед символом элемента массовое число в качестве верхнего индекса и атомное число в качестве нижнего индекса:
| массовое число атомный номер | Обозначение элемента | или же | A Z | х |
Например, атом золота (символ Au) с атомным номером 79 и массовым числом 196 обозначается как:
С.Изотопы
Хотя все атомы данного элемента должны иметь один и тот же атомный номер, не обязательно, чтобы все они имели одно и то же массовое число. Например, некоторые атомы углерода (атомный номер 6) имеют массовое число 12, другие имеют массовое число 13, а третьи имеют массовое число 14. Эти разные виды одного и того же элемента называются изотопами.
Изотопы — это атомы, которые имеют одинаковый атомный номер (и, следовательно, принадлежат к одному элементу), но разные массовые числа.Состав атомов встречающихся в природе изотопов углерода показан в Таблице 4.2.
| ТАБЛИЦА 4.2 Встречающиеся в природе изотопы углерода | |||
| Изотоп | Протонов | Электронов | Нейтроны |
|---|---|---|---|
| 6 | 6 | 6 | |
| 6 | 6 | 7 | |
| 6 | 6 | 8 | |
Различные изотопы элемента могут быть обозначены с помощью верхних и нижних индексов, чтобы показать массовое число и атомный номер.Их также можно идентифицировать по названию элемента с массовым числом конкретного изотопа. Например, как альтернатива
мы можем писать углерод-12, углерод-13 и углерод-14.
Около 350 изотопов встречаются на Земле в естественных условиях, а еще 1500 изотопов были произведены искусственно. Изотопы данного элемента ни в коем случае не одинаково многочисленны. Например, 98,89% всего углерода, встречающегося в природе, составляет углерод-12, 1,11% — углерод-13, и только следовые количества — углерод-14.Некоторые элементы содержат только один изотоп природного происхождения. В таблице 4.3 перечислены встречающиеся в природе изотопы нескольких общих элементов, а также их относительное содержание.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
D. Внутренняя структура атома
До сих пор мы обсуждали электроны, протоны и нейтроны, а также способы определения
сколько каждого конкретного атома содержит.Остается вопрос: это
частицы, хаотично распределенные внутри атома, как черника в булочке,
или у атома есть какая-то организованная внутренняя структура? В начале
ХХ века ученые пытались ответить на этот вопрос. Различные теории
было предложено, но ни одно не было подтверждено экспериментально. В нашем обсуждении
истории науки мы предположили, что на различных этапах ее развития
наука отметила время, пока кто-нибудь не проведет ключевой эксперимент, который обеспечил
новые идеи.В истории изучения атомов был проведен ключевой эксперимент.
в 1911 году Эрнестом Резерфордом и его коллегами.
1. Силы между телами
Наше понимание выводов, сделанных из эксперимента Резерфорда, зависит от знания сил, действующих между телами. Поэтому, прежде чем обсуждать его эксперимент, необходимо сделать краткий обзор этих сил. Во-первых, сила
гравитация, существующая между всеми телами. Его величина зависит от соответствующих масс и расстояния между центрами тяжести двух взаимодействующих тел.Вы знакомы с гравитацией; он действует, чтобы держать ваши ноги на земле, а луну на орбите.
Электрические силы также существуют между заряженными частицами. Величина электрической силы между двумя заряженными телами зависит от заряда каждого тела и от расстояния между их центрами. Если заряды одного знака (положительные или отрицательные), тела отталкиваются друг от друга; если заряды противоположного знака, тела притягиваются друг к другу.
Магнитные силы, третий тип, подобны электрическим силам.У каждого магнита два полюса — северный и южный. Когда два магнита сводятся вместе, возникает сила отталкивания между одинаковыми полюсами и сила притяжения между противоположными полюсами. В заряженном теле могут взаимодействовать магнитные и электрические силы. Эти три силы были известны в конце девятнадцатого века, когда структура атома стала предметом интенсивного изучения.
2. Эксперимент Резерфорда
Опишем эксперимент Резерфорда:
В 1911 году было общепризнано, что атом содержит электроны и протоны, но, вероятно, они не расположены в каком-либо определенном порядке.Резерфорд хотел установить, существует ли закономерность. Он надеялся получить эту информацию, изучая, как протоны в атоме отклоняют путь другой заряженной частицы, проходящей через атом. Для своей второй частицы он выбрал альфа
() частицы. Альфа-частица содержит два протона и два нейтрона, что дает ей относительную массу 4 а.е.м. и заряд +2. Альфа-частица достаточно близка по массе и заряду к протону, поэтому ее путь изменится, если она пройдет близко к протону.В эксперименте луч альфа-частиц направлялся на кусок золотой фольги, такой тонкий, чтобы быть прозрачным и, что более важно для Резерфорда, толщиной всего в несколько атомов. Фольга была окружена экраном из сульфида цинка, который вспыхивал при каждом ударе альфа-частицы. Построив местоположение вспышек, можно было бы определить, как путь альфа-частиц через атом был изменен протонами в атоме.
Три пути, показанные на рисунке 4.2 (пути A, B и C) представляют наблюдаемые. Большинство альфа-частиц следовали по пути A; они проходили прямо через фольгу, как будто ее и не было. Некоторые были слегка отклонены от их первоначального пути, как на пути B; и еще меньшее количество отскочило от фольги, как если бы они ударились о твердую стену (путь C).
| РИСУНОК 4.2 (a) Поперечное сечение аппарата Резерфорда. |
| РИСУНОК 4.2 (b) Увеличенное поперечное сечение золотой фольги в приборе, показывающее отклонение альфа-частиц ядрами атомов золота. |
Хотя вы можете быть удивлены, что через золотую фольгу прошли какие-либо альфа-частицы, Резерфорд — нет. Он ожидал, что многие пройдут прямо (путь А). Он также ожидал, что из-за присутствия в атоме положительно заряженных протонов некоторые альфа-частицы будут следовать по слегка отклоненному пути (путь B).Тот факт, что некоторые альфа-частицы отскакивают назад (путь C), поразил Резерфорда и его сотрудников. Путь C предполагал, что частицы врезались в область плотной массы и отскочили обратно. Если использовать аналогию Резерфорда, возможность такого отскока была столь же маловероятна, как отскок пушечного ядра о кусок папиросной бумаги.
3. Результаты эксперимента.
Тщательное рассмотрение результатов, и особенно пути C, убедило Резерфорда (и научное сообщество) в том, что атом содержит очень маленькое плотное ядро и большой объем внеядерного пространства.Согласно теории Резерфорда, ядро атома содержит всю массу атома и, следовательно, все протоны. Протоны придают ядру положительный заряд. Поскольку одинаковые заряды отталкиваются друг от друга, положительно заряженные альфа-частицы, проходящие близко к ядру, отклоняются (путь B). Ядро, содержащее все протоны и нейтроны, массивнее альфа-частицы; следовательно, альфа-частица, ударяющаяся о ядро атома золота, отскакивает от столкновения, как и те, которые следовали по пути C.
Вне ядра, в относительно огромном внеядерном пространстве атома, находятся крошечные электроны. Поскольку электроны настолько малы по сравнению с пространством, которое они занимают, внеядерное пространство атома по существу пусто. В эксперименте Резерфорда альфа-частицы, встречаясь с этой частью атомов в золотой фольге, проходили через фольгу без отклонения (путь A).
Если ядро содержит практически всю массу атома, оно должно быть чрезвычайно плотным.Его диаметр составляет примерно 10 -12 см, что составляет примерно 1/10 000 диаметра всего атома. Согласно этой модели, если бы ядро было размером с мрамор, атом с его внеядерными электронами имел бы 300 м в диаметре. Если бы мрамор имел ту же плотность, что и ядро атома, он бы весил 3,3 X 10 10 кг.
Эта модель ядра требует введения силы, отличной от обсуждаемой ранее, такой силы, которая позволит протонам с их взаимно отталкивающими положительными зарядами плотно упаковываться в ядре, разделенных только незаряженными нейтронами.Эти ядерные силы, кажется, зависят от взаимодействий между протонами и нейтронами. Некоторые из них слабые, а некоторые очень сильные. Вместе они удерживают ядро, но они еще не поняты.
Модель атома, основанная на работе Резерфорда, конечно, не более чем модель; мы не можем видеть эти субатомные частицы или их расположение внутри атома. Однако эта модель действительно дает нам представление об атоме, которое совпадает с наблюдениями, сделанными относительно его свойств.Теперь мы можем определить не только, какие субатомные частицы содержат конкретный атом, но и находятся ли они в его ядре. Например, атом углерода-12
содержит 6 протонов и 6 нейтронов в ядре и 6 электронов вне ядра.
У нас есть две отдельные части атома — ядро и внеядерное пространство. Ядро атома не играет никакой роли в химических реакциях, но участвует в радиоактивных реакциях.(Такие реакции обсуждаются позже в этой главе.) Химический состав атома зависит от его электронов — их количества и того, как они расположены во внеядерном пространстве.
Назад & nbsp Домой & nbsp Далее
| |
Эрнест Резерфорд и его знаменитый эксперимент
Эрнест Резерфорд (1871-1937) был физиком из Новой Зеландии, которого часто называют отцом ядерной физики.Так что, по сути, он очень важен.
На протяжении своей карьеры Резерфорд способствовал мировому пониманию ядерной физики способом, которого с тех пор никто не видел, но его наиболее запоминающимся вкладом, скорее всего, является его метко названный эксперимент Резерфорда 1909 года, в котором альфа-частицы стреляли в тонкие частицы. золотая фольга, чтобы продемонстрировать, что большая часть массы сосредоточена в центре атома.
Фактически эксперимент был проведен Гейгером и Марсденом, но именно Резерфорд, следовательно, объяснил, почему подавляющее большинство альфа-частиц лишь незначительно отклоняется от своего пути.Это привело к модели атома Резерфорда с плотным положительно заряженным ядром в центре и отрицательно заряженными электронами, вращающимися вокруг него.
Хотя Эрнест Резерфорд был из Новой Зеландии, некоторые из его самых известных работ были выполнены в Великобритании, в Университете Виктории в Манчестере (ныне Манчестерский университет). Сказав это, он получил Нобелевскую премию по химии за открытие концепции радиоактивного полураспада, которую он открыл во время работы в Университете Макгилла в Канаде.
Но вернемся к эксперименту Резерфорда! Поскольку большинство частиц проходили прямо через фольгу или были лишь слегка отклонены, это означало, что атомы были в основном пустым пространством, а не сливовым пудингом, как Дж. Дж. Раньше думал Томсон (хотя он не называл это сливовым пудингом).
Это означало, что должно быть центральное ядро, в котором были сосредоточены все положительно заряженные частицы, что и было причиной отклонений, затем много пустого пространства перед облаком отрицательно заряженных электронов, вращающимся вокруг ядра.
В эксперименте Резерфорда, когда альфа-частица попадает в экран из сульфида цинка, экран излучает свет. Это связано с тем, что экран из сульфида цинка или сцинтиллятор действовал как детектор альфа-частиц, прошедших через кусок золотой фольги. Как только они попадут на экран, испускается свет, указывающий на то, что была обнаружена альфа-частица.

Leave A Comment