Задание 29
Задание 29.1
Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода. (Запишите число с точностью до десятых.)
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
Приведем уравнение протекающей реакции:
2H2S + 3O2 = 2SO2 + 2H2O
Из уравнения следует, что на 2 моль реагирующего сероводорода H2S приходится 3 моль кислорода O2.
Находим количество вещества сжигаемого сероводорода:
n(H2S) = V(H2S) / Vm = 6,72 л / 22,4 л/моль = 0,3 моль.
Составим пропорцию:
2 моль H2S – 3 моль O2
0,3 моль H2S – x моль O2
Из пропорции следует, что x = 0,3 * 3 / 2 = 0,45 моль.
Находим массу кислорода:
m(O2) = n(O2) * M(O2) = 0,45 моль * 32 г/моль = 14,4 г.
Ответ: 14,4
Задание 29.2
При взаимодействии кальция с водой образовалось 0,4 моль гидроксида кальция. Какой объем водорода (в л при н.у.) при этом выделился? (Запишите число с точностью до сотых.)
Решение
Приведем уравнение протекающей реакции:
Ca + 2H2O = Ca(OH)2 + H2
Из уравнения следует, что на 1 моль образующегося водорода H2 приходится 1 моль гидроксида кальция Ca(OH)2.
Следовательно, n(H2) = n(Ca(OH)2) = 0,4 моль
Находим объем выделяющегося водорода:
V(H2) = n(H2) * Vm
Ответ: 8,96
Задание 29.3
Какая масса кислорода (в граммах) необходима для полного сжигания 13,44 л (н.у.) этана? (Запишите число с точностью до десятых.)
Решение
Приведем уравнение протекающей реакции:
2C2H6 + 7O2 = 4CO2 + 6H2O
Из уравнения следует, что на 2 моль этана C2H6 приходится 7 моль кислорода O2.
Находим количество вещества взаимодействующего этана:
n(C2H6) = V(C2H
Составим пропорцию:
2 моль C2H6 – 7 моль O2
0,6 моль C2H6 – x моль O2
Из пропорции следует, что x = 0,6 * 7 / 2 = 2,1 моль.
Находим массу кислорода:
m(O2) = n(O2) * M(O2) = 2,1 моль * 32 г/моль = 67,2 г.
Ответ: 67,2
Задание 29.4
При разложении карбоната кальция образовалось 15,68 л (н.у.) углекислого газа. Определите массу разложенного карбоната кальция (в граммах). (Запишите число с точностью до целых.)
Решение
CaCO3 = CaO + CO2
Из уравнения следует, что на 1 моль карбоната кальция CaCO3 приходится 1 моль углекислого газа CO2.
Следовательно, n(CO2) = n(CaCO3)
Находим количество вещества образовавшегося углекислого газа:
n(CO2) = V(CO2) / Vm = 15,68 л / 22,4 л/моль = 0,7 моль.
Находим массу карбоната кальция:
m(CaCO3) = n(CaCO3) * M(CaCO3) = 0,7 моль * 100 г/моль = 70 г.
Ответ: 70
Задание 29.5
Какой объем (в литрах при н.у.) углекислого газа выделится при растворении 25,2 г карбоната магния в избытке соляной кислоты? (Запишите число с точностью до десятых.)
Решение
Приведем уравнение протекающей реакции:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
Из уравнения следует, что на 1 моль карбоната магния MgCO3 приходится 1 моль углекислого газа CO2.
Следовательно, n(MgCO3) = n(CO2)
Находим количество вещества растворившегося карбоната магния:
n(MgCO3) = m(MgCO3) / M(MgCO3) = 25,2 г / 84 г/моль = 0,3 моль.
Находим объем образовавшегося углекислого газа:
V(CO2) = n(CO2) * Vm = 0,3 моль * 22,4 л/моль = 6,7 л.
Ответ: 6,7
Задание 29.6
Какова масса осадка (в граммах), образующегося при взаимодействии избытка раствора хлорида бария с раствором, содержащим 6,86 г серной кислоты? (Запишите число с точностью до десятых.)
Решение
Приведем уравнение протекающей реакции:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Из уравнения следует, что на 1 моль серной кислоты H2SO4 приходится 1 моль сульфата бария BaSO
Следовательно, n(H2SO4) = n(BaSO4)
Находим количество вещества прореагировавшей серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 6,86 г / 98 г/моль = 0,07 моль.
Находим массу осадка сульфата бария:
m(BaSO4) = n(BaSO4) * M(BaSO4) = 0,07 моль * 233 г/моль = 16,3 г.
Ответ: 16,3
Задание 29.7
Определите объем водорода (в л при н.у.), который вступит в реакцию с азотом для получения 6,8 г аммиака? (Запишите число с точностью до десятых.)
Решение
Представим уравнение реакции получения аммиака:
N2 + 3H2 = 2NH3
Из уравнения следует, что на 3 моль водорода H2 приходится 2 моль аммиака NH3.
Определим количество вещества образующегося аммиака:
n(NH3) = m(NH3) / M(NH3) = 6,8 г / 17 г/моль = 0,4 моль
Составим пропорцию:
3 моль H2 — 2 моль NH3
x моль H2 – 0,4 моль NH3
Из пропорции следует, что x = 0,4 * 3 / 2 = 0,6 моль.
Находим объем прореагировавшего водорода при н.у.:
V(H2) = n(H2) * Vm = 0,6 моль * 22,4 л/моль = 13,4 л.
Ответ: 13,4
Задание 29.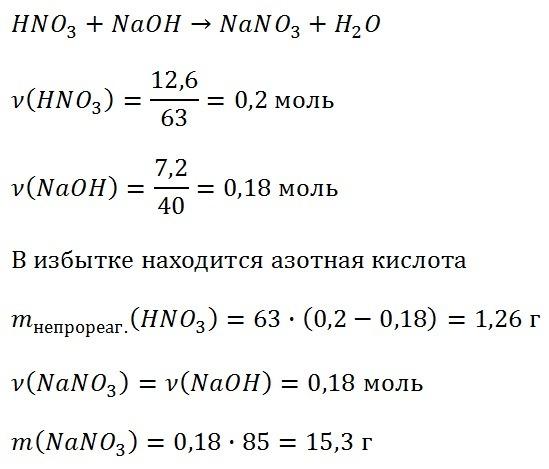 8
8
Определите массу кислорода (в граммах), который необходим для окисления 13,44 л (при н.у.) оксида серы (IV). (Запишите число с точностью до десятых.)
Решение
Представим уравнение протекающей реакции:
2SO2 + O2 = 2SO3
Из уравнения следует, что на 2 моль оксида серы (IV) SO2 приходится 1 моль кислорода O
Определим количество вещества окисляющегося оксида серы (IV):
n(SO2) = V(SO2) / Vm = 13,44 л / 22,4 л/моль = 0,6 моль
Составим пропорцию:
2 моль SO2 — 1 моль O2
0,6 моль SO2 – x моль O2
Из пропорции следует, что x = 0,6 * 1 / 2 = 0,3 моль.
Находим массу прореагировавшего кислорода:
m(O2) = n(O2) * M(O2) = 0,3 моль * 32 г/моль = 9,6 г.
Ответ: 9,6
Задание 29.9
Определите массу соли (в граммах), которая образовалась при поглощении 11,2 л (н.
Решение
Представим уравнение протекающей реакции:
2NaOH + CO2 = Na2CO3 + H2O
Из уравнения следует, что на 1 моль углекислого газа CO2 приходится 1 моль карбоната натрия Na2CO3.
Определим количество вещества поглотившегося углекислого газа:
n(CO2) = V(CO2) / Vm = 11,2 л / 22,4 л/моль = 0,5 моль
Составим пропорцию:
1 моль CO2 — 1 моль Na2CO3
0,5 моль CO2 — x моль Na
Из пропорции следует, что x = 0,5 * 1 / 1 = 0,5 моль.
Находим массу образовавшейся соли — карбоната натрия:
m(Na2CO3) = n(Na2CO3) * M(Na2CO3) = 0,5 моль * 106 г/моль = 53,0 г.
Ответ: 53,0
Задание 29. 10
10
Определите массу оксида кальция (в граммах), образовавшегося при разложении 15 г карбоната кальция. (Запишите число с точностью до десятых.)
Решение
Приведем уравнение протекающей реакции:
CaCO3
Из уравнения следует, что на 1 моль карбоната кальция CaCO3 приходится 1 моль оксида кальция CaO.
Следовательно, n(CaO) = n(CaCO3)
Находим количество вещества растворившегося карбоната кальция:
n(CaCO3) = m(CaCO3) / M(CaCO3) = 15 г / 100 г/моль = 0,15 моль.
Находим массу оксида кальция:
m(CaO) = n(CaO) * M(CaO) = 0,15 моль * 56 г/моль = 8,4 г.
Ответ: 8,4
Задание 29.11
Определите массу карбоната магния, растворившегося в избытке соляной кислоты, если при этом выделилось 4,48 л (н.у.) углекислого газа. (Запишите число с точностью до целых.)
Решение
Приведем уравнение протекающей реакции:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
Из уравнения следует, что на 1 моль карбоната магния MgCO3 приходится 1 моль углекислого газа CO2.
Следовательно, n(MgCO3) = n(CO2)
Находим количество вещества выделившегося углекислого газа при н.у.:
n(CO2) = V(CO2) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль.
Находим массу растворившегося карбоната магния:
m(MgCO3) = n(MgCO3) * M(MgCO3) = 0,2 моль * 84 г/моль = 16,8 г.
Ответ: 17
Решутест. Продвинутый тренажёр тестов
Решил заданий
Не решил заданий
Осталось заданий
История решения
2033 — не приступал 2121 — не приступал 3385 — не приступал 5451 — не приступал 1484 — не приступал 5505 — не приступал 3405 — не приступал 1306 — не приступал 2779 — не приступал 3838 — не приступал 1165 — не приступал 1614 — не приступал 7692 — не приступал 8553 — не приступал 4630 — не приступал 4677 — не приступал 5920 — не приступал 3637 — не приступал 2215 — не приступал 9827 — не приступал 9934 — не приступал 9589 — не приступал 7642 — не приступал 7937 — не приступал 9340 — не приступал 1369 — не приступал 4100 — не приступал 1458 — не приступал 7107 — не приступал 2714 — не приступал 6814 — не приступал 3050 — не приступал 8228 — не приступал 4874 — не приступал 9732 — не приступал 9811 — не приступал 7497 — не приступал 3306 — не приступалФормат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть Скрыть
№1Какая масса азотной кислоты содержится в 1 л её 20%-ного раствора с плотностью 1,05 г/мл?
№2Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой ___ г. Запишите число с точностью до целых.
№3Масса 92%-ного раствора этанола, необходимого для получения 1,12 л этилена (н.у.), равна ___ г. Ответ округлите до целых.
№4Через раствор, содержащий 44,1 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н.у.) прореагировавшего газа составил ___ л. Запишите число с точностью до сотых.
№5Через раствор, содержащий 29,4 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н.у.) прореагировавшего газа составил ___ л. Запишите число с точностью до сотых.
Объём (н.у.) прореагировавшего газа составил ___ л. Запишите число с точностью до сотых.
Объем воздуха (н.у.), необходимый для полного сжигания 50 л метана (н.у.), равен ___ л. Запишите число с точностью до целых.
№7Объем воздуха (н.у.), необходимый для сжигания 32 л (н.у.) угарного газа, равен ___ л. Запишите число с точностью до целых.
№8Объем воздуха (н.у.), необходимый для полного сгорания 60 л (н.у.) этилена, равен ___ л. Запишите число с точностью до целых.
№9Объем газа (н.у.), который образуется при горении 40 л метана в 40 л кислорода, равен ___ л. Запишите число с точностью до целых.
№10Какая масса кислорода затратится на сжигание 16 г водорода? Запишите число с точностью до целых.
№11Какая масса осадка образуется при взаимодействии 4 г гидроксида натрия с достаточным количеством хлорида железа (II)? (Ответ округлите до десятых)
№12Какой объём кислорода (н. у.) требуется для окисления 7,8 г калия? Запишите число с точностью до целых.
у.) требуется для окисления 7,8 г калия? Запишите число с точностью до целых.
Какой объём (н.у.) углекислого газа выделится при взаимодействии 0,25 моль карбоната натрия с избытком соляной кислоты? Запишите число с точностью до десятых.
№14Какой объём (н.у.) газа выделится при растворении 42 г карбоната магния в избытке соляной кислоты? Запишите число с точностью до десятых.
№15Какую массу йода можно получить при взаимодействии 0,5 моль йодида кальция с необходимым количеством хлора? Запишите число с точностью до целых.
№16Какой объём (н.у.) газа выделится при растворении 25 г карбоната кальция в избытке уксусной кислоты? Запишите число с точностью до десятых.
№17Какой объём хлороводорода может вступить в реакцию с 186 г анилина? Запишите число с точностью до десятых.
№18При растворении оксида меди(II) в серной кислоте образовалась безводная соль массой 40 г. Рассчитайте массу оксида меди, вступившего в реакцию. Запишите число с точностью до целых.
Рассчитайте массу оксида меди, вступившего в реакцию. Запишите число с точностью до целых.
Какой объём аммиака (н.у.) вступил в реакцию с раствором серной кислоты, если при этом образовался сульфат аммония количеством вещества 0,3 моль? Запишите число с точностью до сотых.
№20Какой объём (н.у.) водорода выделится при взаимодействии 0,75 моль магния с избытком соляной кислоты? Запишите число с точностью до десятых.
№21При сливании раствора нитрата серебра с избытком раствора бромида натрия образовался осадок массой 37,6 г. Вычислите массу нитрата серебра в исходном растворе. Запишите число с точностью до целых.
№22211,2 г гидрофосфата аммония (80% от теоретического количества) были получены при взаимодействии необходимого количества ортофосфорной кислоты и аммиака. Вычислите, какой объём (н.у.) газа был использован. Запишите число с точностью до десятых.
№23Какой объём (н. у.) газа выделится при взаимодействии 128 г меди с концентрированной азотной кислотой? Запишите число с точностью до десятых.
у.) газа выделится при взаимодействии 128 г меди с концентрированной азотной кислотой? Запишите число с точностью до десятых.
Рассчитайте максимальный объём (н.у.) хлороводорода, который может присоединиться к 0,25 моль ацетилена. Запишите число с точностью до десятых.
№25Какой объём (н.у.) оксида серы(IV) выделяется при взаимодействии 0,4 моль сульфита натрия с избытком раствора серной кислоты? Запишите число с точностью до сотых.
№26Рассчитайте массу газа, выделяющегося при взаимодействии избытка воды на 1,5 моль карбида кальция. Запишите число с точностью до целых.
№27При растворении карбоната калия в избытке азотной кислоты выделилось 4,48 л (н.у.) газа. Сколько граммов карбоната калия вступило в реакцию. Запишите число с точностью до десятых.
№28Какая масса брома может выделиться при взаимодействии 0,3 моль бромида натрия с хлором? Запишите число с точностью до целых.
Какой объём хлороводорода (н.у.) необходим для получения 17,7 г. хлоропрена при взаимодействии с необходимым количеством винилацетилена? Запишите число с точностью до сотых.
№30Рассчитайте массу серной кислоты, необходимой для полной нейтрализации 120 г гидроксида натрия? Запишите число с точностью до целых.
№31Какой объём (н.у.) водорода выделится при взаимодействии 0,4 моль калия с избытком воды? Запишите число с точностью до сотых.
№32Вычислите массу осадка, который образуется при взаимодействии 9,4 г фенола с 40 г 20%-ного раствора брома в воде. Запишите число с точностью до десятых.
№33Какая масса алюминия потребуется для восстановления 0,6 моль железной окалины? Запишите число с точностью до десятых.
№34Какой объём ацетилена (н.у.) теоретически необходим для получения 376 г 1,1-дибромэтана? Запишите число с точностью до десятых.
№35Рассчитайте массу гидроксида натрия, необходимого для нейтрализации 300 г уксусной кислоты. Запишите число с точностью до целых.
Запишите число с точностью до целых.
При сливании раствора нитрата серебра с избытком раствора хлорида натрия образовался осадок массой 28,7 г. Рассчитайте массу нитрата серебра в исходном растворе. Запишите число с точностью до целых.
№37При растворении карбоната натрия в избытке соляной кислоты выделилось 4,48 л (н.у.) газа. Вычислите массу прореагировавшего карбоната натрия. Запишите число с точностью до десятых.
№38Какой объём газа (н.у.) выделится при полном разложении 183,75 г хлората калия в присутствии диоксида марганца? Запишите число с точностью до десятых.
5.5: Применение закона идеального газа – молярный объем, плотность и молярная масса газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37998
Цели обучения
- Чтобы связать количество газа, потребленного или выделившегося в химической реакции, со стехиометрией реакции.

- Чтобы понять, как можно использовать уравнение идеального газа и стехиометрию реакции для расчета объема газа, образующегося или потребляемого в ходе реакции.
С помощью закона идеального газа мы можем использовать соотношение между количествами газов (в молях) и их объемами (в литрах) для расчета стехиометрии реакций с участием газов, если известны давление и температура. Это важно по нескольким причинам. Многие реакции, которые проводятся в лаборатории, связаны с образованием или реакцией газа, поэтому химики должны уметь количественно обрабатывать газообразные продукты и реагенты так же легко, как они количественно обрабатывают твердые вещества или растворы. Кроме того, многие, если не большинство, важных для промышленности реакций проводятся в газовой фазе по практическим соображениям. Газы легко смешиваются, легко нагреваются или охлаждаются и могут перемещаться из одного места в другое на производственном предприятии с помощью простых насосов и водопровода.
Плотность и молярная масса газа
Уравнение идеального газа можно использовать для решения различных типов задач. Например, плотность \(\rho\) газа зависит от числа молекул газа в постоянном объеме. Чтобы определить это значение, мы преобразуем уравнение идеального газа в
\[\dfrac{n}{V}=\dfrac{P}{RT}\label{10.5.1} \]
Плотность газа обычно выражается в г/л (масса по объему). Умножение левой и правой частей уравнения \ref{10.5.1} на молярную массу газа в г/моль (\(M\)) дает
\[\rho= \dfrac{g}{L}=\dfrac{PM}{RT} \label{10.5.2} \]
Это позволяет нам определить плотность газа, когда мы знаем молярную массы или наоборот.
Плотность газа ПОВЫШАЕТСЯ с увеличением давления и УМЕНЬШАЕТСЯ с повышением температуры
Пример \(\PageIndex{1}\)
Какова плотность газообразного азота (\(\ce{N_2}\)) при 248,0 Торр и 18º C?
Решение 9oC + 273 = 291 K\nonumber \]
Шаг 3: Это сложно.
 Нам нужно манипулировать уравнением идеального газа, чтобы включить плотность в уравнение.
Нам нужно манипулировать уравнением идеального газа, чтобы включить плотность в уравнение.Запишите все известные уравнения:
\[PV = nRT \nonumber \]
\[\rho=\dfrac{m}{V} \nonumber \]
где \(\rho\) — плотность, \(m\) — масса, а \(V\) — объем.
\[m=M \times n \nonumber \]
где \(M\) — молярная масса, а \(n\) — количество молей.
Теперь возьмите определение плотности (Уравнение \ref{10.5.1})
\[\rho=\dfrac{m}{V} \nonumber \]
Имея в виду \(m=M \times n\)… замените \((M \times n)\) на \ (масса\) в формуле плотности.
\[\begin{align*} \rho &=\dfrac{M \times n}{V} \\[4pt] \dfrac{\rho}{M} &= \dfrac{n}{V} \ end{align*} \nonumber \]
Теперь измените уравнение идеального газа
\[ \begin{align*} PV &= nRT \\[4pt] \dfrac{n}{V} &= \dfrac{P {RT} \end{align*} \nonumber \]
\((n/V)\) присутствует в обоих уравнениях.
\[ \begin{align*} \dfrac{n}{V} &= \dfrac{\rho}{M} \\[4pt] &= \dfrac{P}{RT} \end{align*} \nonumber \]
Теперь объедините их, пожалуйста.
\[\dfrac{\rho}{M} = \dfrac{P}{RT}\nonumber \]
Плотность изолята.
\[\rho = \dfrac{PM}{RT} \nonumber \]
Шаг 4: Теперь введите имеющуюся у вас информацию.
\[ \begin{align*} \rho &= \dfrac{PM}{RT} \\[4pt] &= \dfrac{(0,3263\; \rm{атм})(2*14,01 \; \rm {г/моль})}{(0,08206\, л\, атм/К моль)(291 \; \rm{K})} \\[4pt] &= 0,3828 \; г/л \end{align*} \nonumber \]
Примером различной плотности для полезных целей является воздушный шар, который состоит из мешка (называемого конвертом), способного содержать нагретый воздух. Поскольку воздух в оболочке нагревается, он становится менее плотным, чем окружающий более холодный воздух (уравнение \(\ref{10.5.2}\)), который имеет достаточную подъемную силу (из-за плавучести), чтобы воздушный шар плавал. и подняться в воздух. Для поддержания воздушного шара в воздухе требуется постоянный подогрев воздуха. По мере того как воздух в воздушном шаре охлаждается, он сжимается, позволяя проникать снаружи прохладному воздуху, и плотность увеличивается. Когда это тщательно контролируется пилотом, воздушный шар может приземлиться так же мягко, как и поднялся.
Когда это тщательно контролируется пилотом, воздушный шар может приземлиться так же мягко, как и поднялся.
Определение объемов газа в химических реакциях
Закон идеального газа можно использовать для расчета объема потребляемых или образующихся газов. Уравнение идеального газа часто используется для взаимного преобразования объемов и молярных количеств в химических уравнениях.
Пример \(\PageIndex{2A}\)
Какой объем углекислого газа образуется в 9 часов0140 STP путем разложения 0,150 г \(\ce{CaCO_3}\) по уравнению:
\[ \ce{CaCO3(s) \rightarrow CaO(s) + CO2(g)} \nonumber \]
Решение
Начните с преобразования массы карбоната кальция в моли.
\[ \dfrac{0,150\;г}{100,1\;г/моль} = 0,00150\; моль \номер \]
Стехиометрия реакции диктует, что количество молей \(\ce{CaCO_3}\) разлагается, равно количеству молей \(\ce{CO2}\) образующихся. Используйте уравнение идеального газа, чтобы преобразовать моли \(\ce{CO2}\) в объем.
\[ \begin{align*} V &= \dfrac{nRT}{PR} \\[4pt] &= \dfrac{(0,00150\;моль)\left( 0,08206\; \frac{L \cdot atm }{моль \cdot K} \right) ( 273,15\;K)}{1\;atm} \\[4pt] &= 0,0336\;L \; или \; 33,6\;мл \end{align*} \nonumber \]
Пример \(\PageIndex{2B}\)
Контейнер объемом 3,00 л наполнен \(\ce{Ne(g)}\) при 770 мм рт.ст. при 27 o °С. Затем добавляют \(0,633\;\rm{g}\) образец паров \(\ce{CO2}\).
- Каково парциальное давление \(\ce{CO2}\) и \(\ce{Ne}\) в атм? 9o C \стрелка вправо 300\; К\)
Другие неизвестные: \(n_{\ce{CO2}}\)= ?
\[n_{CO_2} = 0,633\; \rm{g} \;CO_2 \times \dfrac{1 \; \rm{mol}}{44\; \rm{г}} = 0,0144\; \гм{моль} \; CO_2 \nonumber \]
Шаг 2: Записав всю предоставленную информацию, найдите неизвестные родинки \(\ce{Ne}\).
\[ \begin{align*} n_{Ne} &= \dfrac{PV}{RT} \\[4pt] &= \dfrac{(1.01\; \rm{atm})(3.00\; \ rm{L})}{(0,08206\;атм\;л/моль\;K)(300\; \rm{K})} \\[4pt] &= 0,123 \; \rm{mol} \end{align*} \nonumber \]
Поскольку давление в контейнере перед добавлением \(\ce{CO2}\) содержало только \(\ce{Ne}\), это и есть ваше парциальное давление \(Ne\). После конвертации в атм вы уже ответили на часть вопроса!
\[P_{Ne} = 1,01\; \rm{atm} \nonumber \]
Шаг 3: Теперь, когда у вас есть давление для \(\ce{Ne}\), вы должны найти парциальное давление для \(CO_2\). Используйте уравнение идеального газа.
\[ \dfrac{P_{Ne}\cancel{V}}{n_{Ne}\cancel{RT}} = \dfrac{P_{CO_2}\cancel{V}}{n_{CO_2}\cancel{ RT}} \номер\]
, но поскольку оба газа имеют одинаковый объем (\(V\)) и температуру (\(T\)) и поскольку газовая постоянная (\(R\)) постоянна, все три члена сокращаются.
\[ \begin{align*} \dfrac{P}{n_{Ne}} &= \dfrac{P}{n_{CO_2}} \\[4pt] \dfrac{1.01 \; \rm{атм}}{0,123\; \rm{mol} \;Ne} &= \dfrac{P_{CO_2}}{0,0144\; \rm{mol} \;CO_2} \\[4pt] P_{CO_2} &= 0,118 \; \rm{atm} \end{align*} \nonumber \]
Это парциальное давление \(\ce{CO_2}\).
Шаг 4: Найдите общее давление.
\[\begin{align*} P_{total} &= P_{Ne} + P_{CO_2} \\[4pt] &= 1.01 \; \rm{атм} + 0,118\; \rm{атм} \\[4pt] &= 1.128\; \rm{атм} \\[4pt] &\примерно 1,13\; \rm{атм} \; \text{(с соответствующими значащими цифрами)} \end{align*} \nonumber \]
Пример \(\PageIndex{2C}\): Серная кислота
Серная кислота, промышленный химикат, производимый в наибольшем количестве (почти 45 миллионов тонн в год только в Соединенных Штатах), получают путем сжигания серы на воздухе с образованием \(\ce{SO2}\) с последующей реакцией \(\ce{SO2}\) с \(\ ce{O2}\) в присутствии катализатора с образованием \(\ce{SO3}\), который реагирует с водой с образованием \(\ce{h3SO4}\). Общее химическое уравнение выглядит следующим образом:
\[\ce {2S(s) + 3O2(g) + 2h3O(l) \rightarrow 2h3SO4(aq)} \nonumber \]
Какой объем O 2 (в литрах) при 22°C и Для производства 1,00 тонны (907,18 кг) H 2 SO 4 ?
Дано: реакция, температура, давление и масса одного продукта. 0218 2 SO 4 в 1,00 тонне. Из стехиометрических коэффициентов в сбалансированном химическом уравнении рассчитайте необходимое количество молей \(\ce{O2}\).
0218 2 SO 4 в 1,00 тонне. Из стехиометрических коэффициентов в сбалансированном химическом уравнении рассчитайте необходимое количество молей \(\ce{O2}\).
B Используйте закон идеального газа, чтобы определить объем \(\ce{O2}\), требуемый при данных условиях. Убедитесь, что все величины выражены в соответствующих единицах.
Решение:
масса \(\ce{h3SO4}\) → моли \(\ce{h3SO4}\) → моли \(\ce{O2}\) → литры \(\ce{O2}\)
А 95\;L \end{align*} \nonumber \]
Ответ означает, что для производства 1 тонны серной кислоты необходимо более 300 000 литров газообразного кислорода. Эти цифры могут дать вам некоторое представление о масштабах инженерных и сантехнических проблем, с которыми сталкивается промышленная химия.
Упражнение \(\PageIndex{2}\)
Чарльз использовал воздушный шар, содержащий примерно 31 150 л \(\ce{h3}\) для своего первого полета в 1783 году. Газообразный водород был получен в результате реакции металлического железа с разбавленной соляной кислотой в соответствии со следующим сбалансированным химическим уравнением:
\[\ce{ Fe(s) + 2 HCl(aq) \rightarrow h3(g) + FeCl2(aq)} \nonumber \]
Сколько железа (в килограммах) потребовалось для производства этого объема \ (\ce{h3}\) при температуре 30°C и атмосферном давлении 745 мм рт. ст.?
ст.?
- Ответить
68,6 кг Fe (примерно 150 фунтов)
Пример \(\PageIndex{3}\): Аварийные подушки безопасности
Азид натрия (\(\ce{NaN_3}\)) разлагается с образованием металлического натрия и газообразного азота в соответствии со следующим сбалансированным химическим уравнением:
\[\ce{ 2NaN3 \rightarrow 2Na(s) + 3N2(g)} \nonumber \]
Эта реакция используется для надувания подушек безопасности, которые защищают пассажиров во время автомобильных столкновений. Реакция инициируется в подушках безопасности электрическим импульсом и приводит к быстрому выделению газа. Если бы газ \(\ce{N_2}\), образующийся при разложении 5,00 г образца \(\ce{NaN_3}\), можно было бы собрать, вытеснив воду из перевернутой колбы, какой объем газа получится? при 21°C и 762 мм рт.ст.?
Дано: реакция, масса соединения, температура и давление
Запрошено: объем полученного газообразного азота _2} \) произведенный газ. По данным таблицы S3 определите парциальное давление \(\ce{N_2}\) газа в колбе.
По данным таблицы S3 определите парциальное давление \(\ce{N_2}\) газа в колбе.
B Используйте закон идеального газа, чтобы найти объем произведенного \(\ce{N_2}\) газа.
Решение:
А Поскольку мы знаем массу реагента и стехиометрию реакции, нашим первым шагом будет вычисление количества молей образующегося газа \(\ce{N_2}\):
\[\rm\dfrac{5.00\ ;г\;NaN_3}{(22,99+3\times14,01)\;г/моль}\times\dfrac{3моль\;N_2}{2моль\;NaN_3}=0,115\;моль\; N_2 \nonumber \]
Приведенное давление (762 мм рт. ст.) представляет собой общее давление в колбе, которое представляет собой сумму давлений газа N 2 и водяного пара. Таблица S3 говорит нам, что давление паров воды составляет 18,65 мм рт.ст. при 21°C (294 К), поэтому парциальное давление газа \(\ce{N_2}\) в колбе составляет всего
\[\begin{align*} \rm(762 − 18,65)\;мм рт.ст. \times\dfrac{ 1\;атм}{760\;мм рт.ст.} &= 743,4\; \cancel{mmHg} \times\dfrac{1\;atm}{760\;\cancel{mmHg}} \\[4pt] &= 0. 978\; банкомат \end{align*} \nonumber \]
978\; банкомат \end{align*} \nonumber \]
B Решая закон идеального газа для V и подставляя другие величины (в соответствующих единицах), получаем
\[V=\dfrac{nRT}{ P}=\rm\dfrac{0,115\;моль\times0,08206\dfrac{атм\cdot L}{моль\cdot K}\times294\;K}{0,978\;атм}=2,84\;L \номер \]
Упражнение\(\PageIndex{3}\)
Образец металлического цинка массой 1,00 г добавляют к раствору разбавленной соляной кислоты. . Он растворяется с образованием газа \(\ce{h3}\) в соответствии с уравнением
\[\ce{ Zn(s) + 2 HCl(aq) → h3(g) + ZnCl2(aq)}. \номер\]
Полученный газ H 2 собирают в заполненную водой бутыль при температуре 30°C и атмосферном давлении 760 мм рт.ст. Какой объем он занимает?
- Ответ
0,397 л
Резюме
Соотношение между количествами продуктов и реагентов в химической реакции может быть выражено в молях или массах чистых веществ, объемов растворов или объемов газообразных веществ. Закон идеального газа можно использовать для расчета объема газообразных продуктов или реагентов по мере необходимости. В лаборатории газы, образующиеся в результате реакции, часто собирают путем вытеснения воды из наполненных сосудов; тогда количество газа можно рассчитать по объему вытесненной воды и атмосферному давлению. Собранный таким образом газ, однако, не является чистым, а содержит значительное количество водяного пара. Поэтому измеренное давление должно быть скорректировано с учетом давления паров воды, которое сильно зависит от температуры.
Закон идеального газа можно использовать для расчета объема газообразных продуктов или реагентов по мере необходимости. В лаборатории газы, образующиеся в результате реакции, часто собирают путем вытеснения воды из наполненных сосудов; тогда количество газа можно рассчитать по объему вытесненной воды и атмосферному давлению. Собранный таким образом газ, однако, не является чистым, а содержит значительное количество водяного пара. Поэтому измеренное давление должно быть скорректировано с учетом давления паров воды, которое сильно зависит от температуры.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
ChemTeam: Титрование до точки эквивалентности: с использованием масс (задачи №11
ChemTeam: Титрование до точки эквивалентности: с использованием масс (задачи №11–25)Титрование до точки эквивалентности с использованием масс: определение неизвестной молярности при титровании сильной кислоты (основания) сильным основанием (кислотой)
Проблемы №11 — 25
Десять примеров
Проблемы №1-10
Вернуться в меню Acid Base
Задача №11: К 145 мл 1,00 М HCl добавили немного чистого карбоната магния. Когда реакция закончилась, раствор был кислым. Для нейтрализации избытка кислоты требовалось 25,0 мл 0,500 М раствора Na 2 CO 3 . Какая масса карбоната магния была первоначально использована?
Решение:
1) Сколько присутствовало избытка кислоты?
(0,500 моль/л) (0,0250 л) = 0,0125 моль Na 2 CO 32HCl(водн.
) + Na 2 CO 3 (водн.) —> 2NaCl(водн.) + CO 2 (г) + H 2 O(ℓ)
молярное отношение HCl к Na 2 CO 3 составляет 2 к 1.
(0,0125 моль) (2) = 0,0250 моль HCl титровали.
2) Остаток титруют HCl твердый MgCO 3 . Сколько HCl было задействовано?
общее количество добавленной HCl —> (1,00 моль/л) (0,145 л) = 0,145 мольHCl, прореагировавший с MgCO 3 —> 0,145 моль минус 0,0250 моль = 0,120 моль
3) Стехиометрия:
2HCl(водн.) + MgCO 3 (т) —> MgCl 2 (водн.) + CO 2 (водн.) + H 2 O(л)HCl к MgCO 3 молярное соотношение 2 к 1
2 к 1 как 0,120 моль к х
x = 0,0600 моль MgCO 3 прореагировал
(0,0600 моль) (84,313 г/моль) = 5,06 г (до трех цифр)
Задача №12: Химик измерил количество CaCO 3 , присутствующего в таблетке антацида. Таблетку массой 0,743 г растворяли в 25,0 мл 0,500 М HCl и кипятили для удаления газа СО 2 . Химическая реакция такова:
Таблетку массой 0,743 г растворяли в 25,0 мл 0,500 М HCl и кипятили для удаления газа СО 2 . Химическая реакция такова:
CaCO 3 (т) + 2HCl (водн.) —> CaCl 2 (водн.) + CO 2 (г) + H 2 O(л)
Количество добавленной HCl было более чем достаточным для реакции со всем карбонатом кальция, присутствующим в таблетке.
Избыток HCl подвергали обратному титрованию 0,1500 М раствором NaOH, для достижения конечной точки потребовалось 16,07 мл раствора NaOH.
Какова массовая доля CaCO 3 в таблетке антацида?
Решение:
Добавленомолей HCl —> (0,500 моль/л) (0,0250 л) = 0,0125 мольмоль непрореагировавшей HCl —> (0,1500 моль/л) (0,01607 л) = 0,0024105
Обратите внимание, что использованные моли NaOH = использованные моли HCl из-за молярного соотношения между NaOH и HCl, когда они реагируют, 1:1.
моль HCl прореагировала с CaCO 3 —> 0,0125 — 0,0024105 = 0,0100895 моль
Из рассматриваемого уравнения следует, что на каждый 1 моль прореагировавшего CaCO 3 требуется 2 моля HCl.
моль CaCO 3 вступивших в реакцию —> 0,0100895 моль разделить на 2 = 0,00504475 моль
масса CaCO 3 присутствует —> (0,00504475 моль) (100,086 г/моль) = 0,505 г (до трех сиг)
массовый процент CaCO 3 —> (0,505 г / 0,743 г) * 100 = 68,0% (до трех знаков)
Задача №13: В реакции нейтрализации образуется 5,00 г нитрата калия после полного израсходования кислотного и основного реагентов. Сколько молей кислоты и основания использовали?
Решение:
моль KNO 3 —> 5,00 г / 101,102 г/моль = 0,049455 мольКНО 3 производится следующим образом:
HNO 3 (водн.) + KOH (водн.) —> KNO 3 (водн.) + H 2 O (л)
Стехиометрия один к одному означает, что 0,049455 моль HNO 3 прореагировали с 0,049455 моль KOH с образованием 0,049455 моль моль KNO 3 .
Задача №14: Органическая кислота имеет формулу HOOC(CH 2 ) n COOH. Для полной нейтрализации 5,20 г этой кислоты требуется 40,0 мл 2,50 М гидроксида натрия. Чему равно число n в формуле этой кислоты?
Для полной нейтрализации 5,20 г этой кислоты требуется 40,0 мл 2,50 М гидроксида натрия. Чему равно число n в формуле этой кислоты?
Решение №1:
моль израсходованного NaOH —> (2,50 моль/л) (0,0400 л) = 0,100 мольВам нужно два моля NaOH, чтобы нейтрализовать один моль кислоты.
моль нейтрализованной кислоты —> 0,100 моль разделить на 2 = 0,0500 моль
Молярная масса кислоты —> 5,20 г/0,0500 моль = 104 г/моль
Молярная масса кислоты может быть выражена следующим образом:
104 = 2 MM(COOH) + n MM(CH 2 )
104 = (2) (12 + 32 + 1) + (н) (14)
104 = 90 + 14н
n = (104 — 90) / 14 = 1
Формула HOOCCH 2 СООН
Решение №2:
Комментарий: довольно сжатое решение проблемы.
n(H + ) => 2n(OH — )0,05 = 5,2/(90 + 14n)
4,5 + 0,7n = 5,2
n = 1
таким образом:
HOOC(CH 2 )COOH
Проблема № 15: 25,00 мл образца HCl (водн. ) добавляли к 0,1996 г образца CaCO 3 . Все CaCO 3 прореагировал, оставив некоторый избыток HCl (водн.).
) добавляли к 0,1996 г образца CaCO 3 . Все CaCO 3 прореагировал, оставив некоторый избыток HCl (водн.).
CaCO 3 (т) + 2HCl(водн.) —> CaCl 2 (водн.) + H 2 O(л) + CO 2 (г)
Для полной нейтрализации избытка HCl (водн.) потребовалось 48,96 мл 0,01044 М раствора гидроксида бария.
2HCl(водн.) + Ba(OH) 2 (водн.) —> BaCl 2 (водн.) + 2H 2 O(л)
Какова была молярность исходной HCl(водн.)?
Решение:
1) Сколько HCl осталось?
моль Ba(OH) 2 —> (0,01044 моль/л) (0,04896 л) = 0,0005111424 мольНа каждый моль Ba(OH) требуется два моля HCl 2
моль HCl —> (0,0005111424 моль) (2) = 0,0010222848 моль
2) Сколько молей HCl необходимо для реакции с CaCO 3 ?
моль CaCO 3 —> 0,1996 г / 100,086 г/моль = 0,001994285 мольНа каждый моль CaCO требуется два моля HCl 3
(0,001994285 моль) (2) = 0,00398857 моль
3) Общее количество молей HCl:
0,00398857 моль + 0,0010222848 моль = 0,0050108548 моль
4) Молярность HCl:
0,0050108548 моль/0,02500 л = 0,2004 М (до четырех знаков фиг.)
Задача №16: 4,65 г Co(OH) 2 растворяют в 500,0 мл раствора. В 250,0 мл раствора растворяют 3,64 г неизвестной кислоты. 18,115 мл Co(OH) 2 (основание) используют для титрования 25,0 мл неизвестной кислоты до конечной точки.
а) Рассчитайте концентрацию основного раствора.
б) Рассчитайте молярную массу кислоты и определите ее.
Решение:
1) Молярность основания:
MV = граммы / молярная масса(x) (0,5000 л) = 4,65 г / 92,9468 г/моль
х = 0,100057 моль/л
2) Моль используемого основания:
(0,100057 моль/л) (0,018115 л) = 0,00181253 моль
3) Теперь мы должны предположить, что кислота является моноосновной, потому что следующим шагом является определение количества молей кислоты, которая вступила в реакцию. При таком предположении имеем следующее:
2HX + Co(OH) 2 —> CoX 2 + 2H 2 OНа каждый прореагировавший Co(OH) 2 расходуется два HX.
4) Моли кислоты:
(0,00181253 моль) (2) = 0,00362506 моль
5) Кислоты в граммах на 0,025 л:
4,65 г соответствует 0,5000 л, а x соответствует 0,0250 лх = 0,2325 г
6) Молярная масса кислоты:
0,2325 г / 0,00362506 моль = 64,13687 г/мольНа три знака инжира это 64,1 г/моль.
HNO 3 весит 63,0 г/моль (до трех знаков)
Задача №17: Образец дипротонной кислоты массой 0,3017 г (молярная масса = 126,07 г/моль) растворяли в воде и титровали пробой гидроксида натрия объемом 37,26 мл. Образец этого гидроксида натрия объемом 24,05 мл затем использовали для реакции с 0,2506 г неизвестной кислоты, которая, как было установлено, является монопротонной. Какова молярная масса неизвестной кислоты?
Решение:
1) молей дипротоновой кислоты:
0,3017 г / 126,07 г/моль = 0,002393115 моль
2) необходимое количество молей NaOH:
H 2 A + 2NaOH —> Na 2 A + 2H 2 Oмолярное соотношение 1 : 2
(0,002393115 моль кислоты) (2) = 0,004786230 моль основания
Обратите внимание, что мы использовали соотношение 1:2 для определения молей основания из молей кислоты.
3) молярность раствора NaOH:
0,004786230 моль / 0,03726 л = 0,128455 М (пока не буду сильно округлять.)
4) молярная масса моноосновной кислоты:
(0,128455 моль/л) (0,02405 л) = 0,00308934275 моль NaOHHA + NaOH —> NaA + H 2 O
HA и NaOH реагируют в молярном соотношении 1:1
0,00308934275 моль ГК прореагировал
0,2506 г / 0,00308934275 моль = 81,1 г/моль
Задача №18: 11,96 мл 0,102 М NaOH использовали для титрования 0,0927 г образца неизвестной кислоты до конечной точки с использованием фенолфталеина в качестве индикатора. Какова молекулярная масса кислоты, если она моноосновная? Если он двупроходный?
Решение:
1) моль NaOH:
(0,102 моль/л) (0,01196 л) = 0,00121992 моль
2) однокомпонентные:
HA + NaOH —> NaA + H 2 Oмолярное соотношение 1:1
0,0927 г / 0,00121992 моль = 76 г/моль
3) двуосновный:
H 2 A + 2NaOH —> Na 2 A + 2H 2 Oмолярное соотношение 1 : 2
0,00121992 моль основания / 2 = 0,00060996 моль кислоты
0,0927 г / 0,00060996 моль = 152 г/моль
Обратите внимание, что мы использовали соотношение 1:2 для определения молей кислоты из молей основания.
Задача № 19: Сколько граммов аспирина (C 9 H 8 O 4 , моноосновная кислота) требуется для реакции ровно с 29,4 мл 0,2400%-ного раствора по массе NaOH ?
Решение: :
1) Предположим, что плотность NaOH составляет 1,00 г/мл.
0,2400% масс./масс. означает 0,2400 г NaOH на 100,0 г раствора. По плотности мы знаем, что наши 100,0 г раствора занимают 100,0 мл
2) Сколько NaOH содержится в 29,4 мл раствора?
0,2400 г на 100 мл равно x на 29,4 млх = 0,07056 г NaOH
3) Сколько это молей?
0,07056 г / 40,0 г/моль = 0,001764 моль
4) Сколько молей аспирина вступает в реакцию?
Благодаря молярному соотношению 1:1 (одноосновная кислота + NaOH) мы знаем, что в реакцию вступает 0,001764 моль аспирина.(0,001764 моль) (180,1582 г/моль) = 0,318 г (до трех цифр)
Задача №20: У нас есть 500 мг обычного желудочного антацида. Сколько мл 0,100 М HCl можно нейтрализовать? Предположим, что антацид представляет собой 40% карбоната кальция по массе.
Сколько мл 0,100 М HCl можно нейтрализовать? Предположим, что антацид представляет собой 40% карбоната кальция по массе.
Решение:
500 мг * 0,40 = 200 мг = 0,200 гCaCO 3 + 2HCl —> CaCl 2 + CO 2 + H 2 O
на каждый моль CaCO 3 нам потребуется два моля HCl
0,200 г / 100,086 г/моль = 0,0019983 моль (оставьте пару дополнительных цифр до конца)
0,0019983 моль x 2 = 0,0039966 моль 0,0039966 моль разделить на 0,100 моль/л = 0,039966 л
Округление и перевод в мл дает ответ 40,0 мл (до трех цифр)
Задача №21: 32,00 г гидроксида натрия растворяли в 250,0 мл раствора для приготовления титранта. 25,00 мл серной кислоты титровали вышеуказанным титрантом. Для титрования до конечной точки потребовалось 16,00 мл раствора гидроксида натрия. Какова молярность серной кислоты?
Решение:
1) Определить молярность NaOH:
MV = граммы, деленные на молярную массу(x) (0,2500 л) = 32,00 г / 40,00 г/моль
х = 3,200 М
2) Определить количество молей NaOH в 16,00 мл 3,200 М раствора:
моль NaOH ⇒ (3,200 моль/л) (0,01600 л) = 0,05120 моль
3) Определить количество молей H 2 SO 4 , которые реагируют:
2NaOH + H 2 SO 4 —> Na 2 SO 4 + 2H 2 OМолярное соотношение между NaOH и H 2 SO 4 составляет 2:1.
Следовательно, 0,05120 моль NaOH нейтрализует 0,02560 моль H 2 SO 4
4) Рассчитайте молярность раствора H 2 SO 4 :
0,02560 моль/0,02500 л = 1,024 М
Задача № 22: Рассмотрим реакцию:
2HCl + Ba(OH) 2 —> BaCl 2 + 2Н 2 О
Сколько мл 0,7000 М раствора HCl может просто прореагировать с 8,000 г Ba(OH) 2 ?
Решение:
1) Расчет молей Ba(OH) 2 :
8,000 г / 171,3438 г/моль = 0,04669 моль
2) Определите количество молей HCl, необходимое для нейтрализации:
Молярное соотношение между HCl и Ba(OH) 2 составляет 2:1.Следовательно, для нейтрализации 0,04669моль Ba(OH) 2
3) Определить требуемый объем HCl:
0,7000 моль/л = 0,09338 моль/хх = 0,1334 л = 133,4 мл
Задача № 23: Сколько мл 1,65 М серной кислоты потребуется для полной реакции с 1,50 г гидроксида алюминия?
Решение:
1) Химическая реакция такова:
2Al(OH) 3 + 3H 2 SO 4 —> Al 2 (СО 4 ) 3 + 6Н 2 ОКлючевым моментом является молярное соотношение, в котором реагируют Al(OH) 3 и H 2 SO 4 .
Это соотношение 2:3.
2) Нам нужно знать количество молей Al(OH) 3 :
1,50 г / 78,0027 г/моль = 0,01923 моль3) Определить необходимое количество молей H 2 SO 4 :
2 к 3 как 0,01923 моль к хх = 0,028845 моль
4) Определить объем H 2 СО 4 :
0,028845 моль разделить на 1,65 моль/л = 0,01748 лЗамена на мл и округление до трех цифр дает 17,5 мл для окончательного ответа.
Задача № 24: Сколько безводного CaO потребуется для нейтрализации 0,900 л 5,00 M H 2 SO 4 ?
Решение:
1) CaO реагирует с водой следующим образом:
CaO + H 2 O —> Ca(OH) 22) Гидроксид кальция реагирует с серной кислотой следующим образом:
Ca(OH) 2 + H 2 SO 4 —> CaSO 4 + 2H 2 O3) Их объединение дает:
CaO + H 2 SO 4 —> CaSO 4 + H 2 OВажным моментом является то, что существует молярное соотношение между CaO и H 1:1 2 SO 4
4) Определить количество молей H 2 СО 4 :
(0,900 л) (5,00 моль/л) = 4,50 мольИз-за молярного соотношения 1:1 между серной кислотой и оксидом кальция количество потребленных молей серной кислоты равно количеству потребленных молей CaO.
5) Определить необходимое количество CaO в граммах:
(4,50 моль) (56,077 г/моль) = 252 г (до трех знаков фиг.)Задача №25: Сколько миллилитров 0,105 М HCl потребуется для нейтрализации 125,0 мл раствора, содержащего 1,35 г NaOH на литр.
Раствор (с использованием метода растворения, характерного для соотношений 1:1):
1) Определите молярность раствора NaOH:
MV = масса / молярная масса(x) (1,00 л) = 1,35 г / 40,00 г/моль
х = 0,03375 М (округлю окончательный ответ на задачу.)
2) Напишите химическое уравнение и укажите ключевое молярное соотношение:
HCl + NaOH —> NaCl + H 2 O1:1 (отношение HCl к NaOH)
3) Определить требуемый объем HCl:
M 1 V 1 = M 2 V 2(0,03375 моль/л) (125,0 мл) = (0,105 моль/л) (x)
x = 40,18 мл (до трех цифр, это 40,2 мл)
Бонусная задача №1: Для определения прочности образца H 2 SO 4 было взято 100,0 г и помещено в него кусок мрамора весом 7,00 г.
Когда реакция прекратилась, кусок мрамора извлекли, высушили, и было обнаружено, что он весит 2,20 г. Какова процентная концентрация раствора серной кислоты?
Решение:
1) Предположим, что мрамор на 100% состоит из CaCO 3 Сколько молей его прореагировало?
7,00 г минус 2,20 г = 4,80 г4,80 г / 100,09 г/моль = 0,0479568 моль
2) Химическая реакция выглядит следующим образом:
H 2 SO 4 + CaCO 3 —> CaSO 4 + CO 2 + H 2 OКлючом является молярное соотношение между H 2 SO 4 и CaCO 3 . Это 1 к 1.
3) Определите моли, затем граммы H 2 SO 4 прореагировали:
Из молярного соотношения 1:1 известно, что прореагировало 0,0479568 моль H 2 SO 4 .(0,0479568 моль) (98,081 г/моль) = 4,70365 г
4) Процентная концентрация (в пересчете на массу) раствора:
(4,70365 г / 100,0 г) * 100 = 4,70%Дополнительная задача №2: Найдите молярную массу соединения X (монопротовой кислоты) по следующей информации:
Масса титруемого X: 0,1260 г
Молярность используемого NaOH: 0,08810 М
Объем используемого раствора NaOH: 9,490 млОднако есть одна особенность: ваш инструктор НАСТАИВАЕТ, чтобы решение выполнялось в стиле размерного анализа.
Решение: первые несколько шагов — это обсуждение, ведущее к DA.
1) Уравнение для решения этой задачи:
масса МВ = ––––––––– молярная масса 2) Переставьте это так:
масса молярная масса = –––––– МВ 3) Затем переверните его, чтобы привести в соответствие со стилем DA (ответ появится в конце вычислений):
масса –––––– = молярная масса МВ 4) Массу необходимо разделить как на молярность, так и на объем, чтобы получить молярную массу.



 ) + Na 2 CO 3 (водн.) —> 2NaCl(водн.) + CO 2 (г) + H 2 O(ℓ)
) + Na 2 CO 3 (водн.) —> 2NaCl(водн.) + CO 2 (г) + H 2 O(ℓ)
 )
)
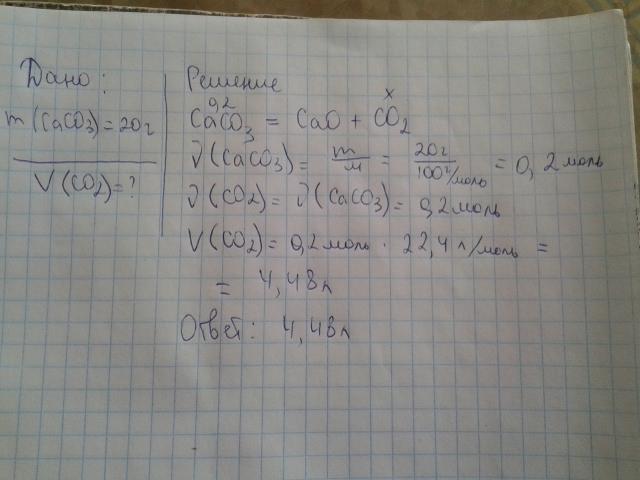
 Это соотношение 2:3.
Это соотношение 2:3.
 Когда реакция прекратилась, кусок мрамора извлекли, высушили, и было обнаружено, что он весит 2,20 г. Какова процентная концентрация раствора серной кислоты?
Когда реакция прекратилась, кусок мрамора извлекли, высушили, и было обнаружено, что он весит 2,20 г. Какова процентная концентрация раствора серной кислоты?

Leave A Comment