Наиболее ярко выраженные металлические свойства… § 21, вопрос 4. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Наиболее ярко выраженные металлические свойства… § 21, вопрос 4. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Привет. Оч. рассчитываю на помощь тех, у кого задание решено уже.
Оч. рассчитываю на помощь тех, у кого задание решено уже.
1) 2, 3 3) 2, 8, 18, 3
2) 2, 8, 3 4) 2, 8, 18, 18, 3
Лучший ответ
Согласно логике, внешний энергетический уровень у всех веществ одинаковый, значит будем оценивать их радиусы атомов. Чем больше количество электронных слоев, тем больше радиус атома, а чем больше радиус атома, тем более выражены металлические свойства (электроны легче отдаются, внутренние электронные слои экранируют от сил притяжения ядра внешние электроны). Из всего сказанного можно дать ответ, наиболее ярко выраженные металлические свойства проявляет простое вещество, образованное атомами, строение электронной оболочки которых 2, 8, 18, 18, 3 (4 вариант ответа) — это индий (In).
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.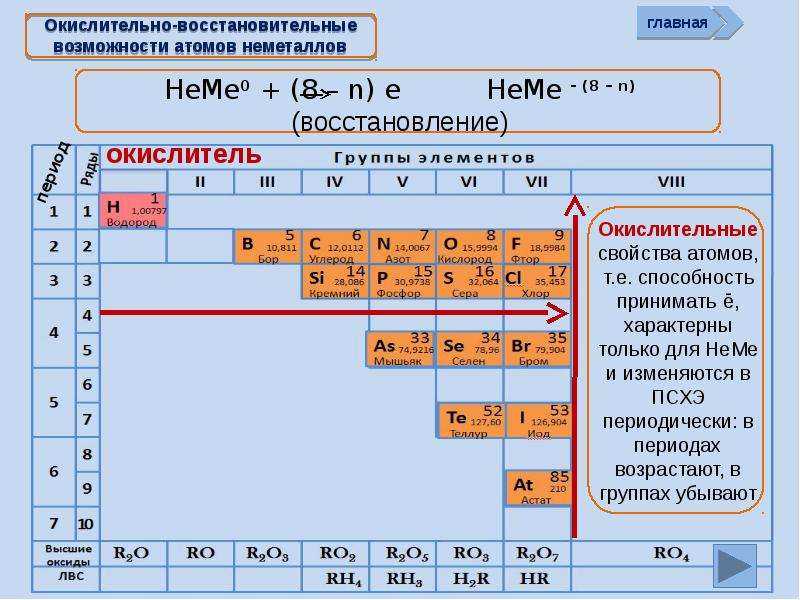
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее…)
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые).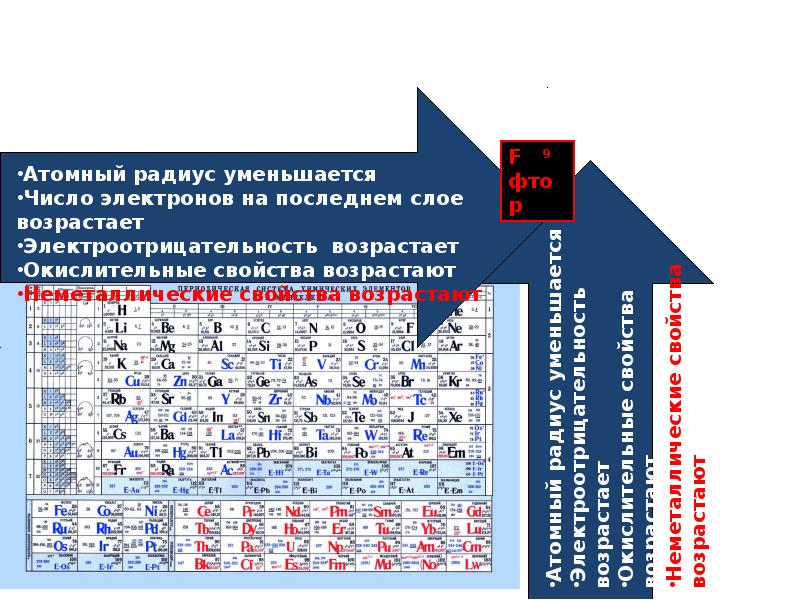 (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Задания №2 с решениями
Главная \ Подготовка к ЕГЭ \ Химия \ Разбор по заданиям \ Задания №2 с решениями
Рассмотрим задания №2 из вариантов ЕГЭ за 2016 год.
Перед решением рекомендуем повторить темы:
1. Строение атома
2. Металлы и неметаллы
Задания с решением
Задание №1.
В каком ряду химические элементы расположены в порядке возрастания радиуса их атомов:
1. Mg → Al → Si → P
2. At → I → Br → Cl
3. Si → P → S → Cl
4. O → S → Se → Te
Объяснение: радиус атома возрастает в группе сверху вниз (с увеличением количества электронных слоев), то есть правильный ответ — 4.
Задание №2.
Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы
Б.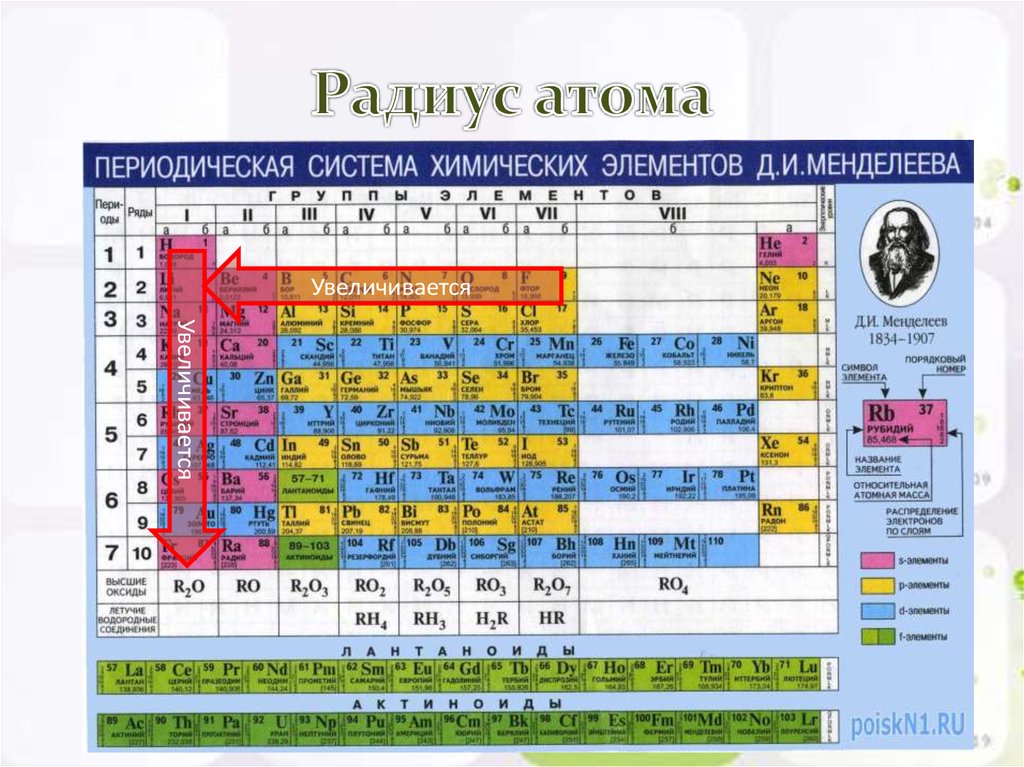 При взаимодействии с водородом кислород и сера проявляют окислительные свойства
При взаимодействии с водородом кислород и сера проявляют окислительные свойства
1. Верно только А
2. Верно только Б
3. Оба суждения верны
4. Оба суждения неверны
Объяснение: перво утверждение неверно — у кислорода постоянная валентность — 2, а у серы максимальная валентность -6. А вот второе утверждение верно: водород, как неметалл намного слабее, чем сера и кислород, и водород в таких соединениях проявляет восстановительные свойства. Правильный ответ — 2.
Задание №3.
В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1. C → B → Be
2. P → S → Cl
3. Si → Al → Mg
4. F → O → N
Объяснение: радиус атома уменьшается в группе снизу вверх и в периоде слева направо. Во втором положении у нас находится только один вариант ответа. Правильный ответ — 2.
Задание №4.
Оксиды состава ЭО и Э2О3 образует каждый из двух элементов:
1. Азот и железо
2. Сера и селен
3. Углерод и кремний
4. Медь и хром
Объяснение: оба элемента должны иметь степени окисления +2 и +3. То есть, правильный ответ — 1.
Задание №5.
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1. Na → Mg → Al
2. Ca → Mg → Be
3. Na → K → Cs
4. Mg → Al → Si
Объяснение: для определения зависимости изменения металлических свойств, нужно посмотреть периодическую систему и рад напряжения металлов. В периодической системе металлические свойства усиливаются в группе сверху вниз и в периоде справа налево. Под данную закономерность попадает ответ 4. Правильный ответ — 4.
Задание №6.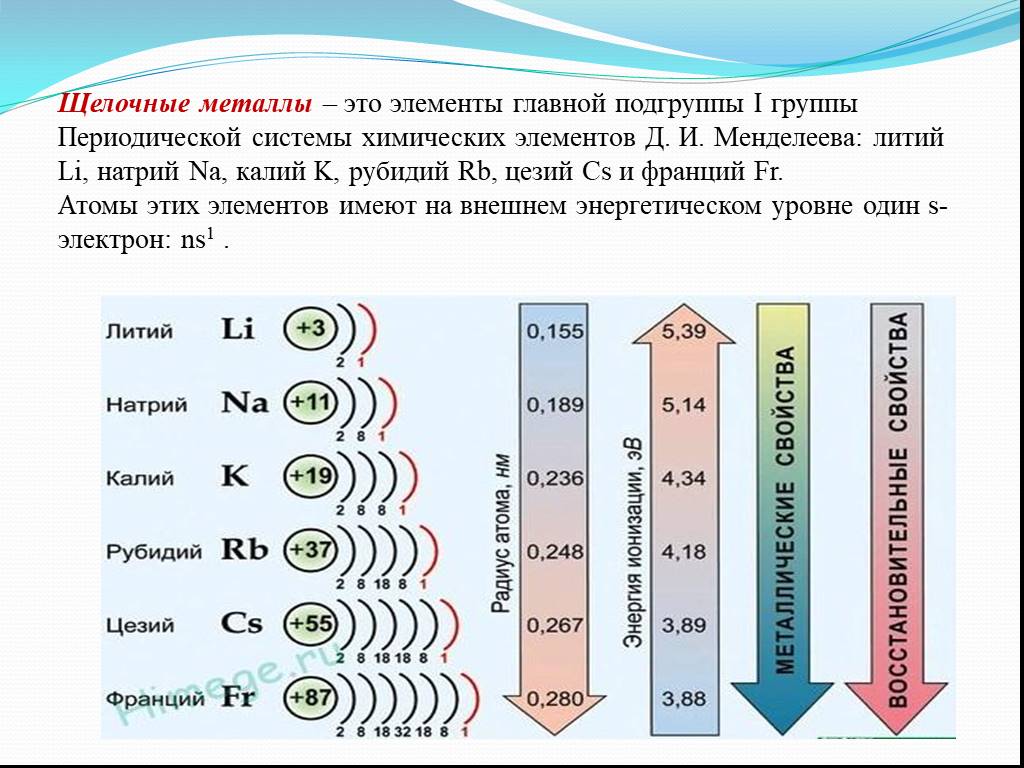
В ряду химических элементов Mg → Ca → Ba
1. Уменьшается число энергетических уровней в атомах
2. Возрастает число внешних электронов атомов
3. Уменьшается число протонов в ядрах атомов
4. Увеличиваются радиусы атомов
Объяснение: элементы расположены в периодической системе сверху вниз, а значит увеличиваются радиусы атомов. Правильный ответ — 4.
Задание №7.
Верны ли следующие суждения об элементах VA-группы?
А. С возрастанием заряда ядра электроотрицательность увеличивается
Б. Общая формула летучего водородного соединения Rh4
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как с возрастанием заряда ядра в группе электроотрицательность уменьшается (так как неметаллические свойства в гурппе сверху вниз ослабевают). А второе утверждение верно, так как атомы элементов пятой А группы имеют по 3 неспаренных электрона и могут образовывать молекулы с тремя атомами водорода (например, аммиак). Правильный ответ- 2.
А второе утверждение верно, так как атомы элементов пятой А группы имеют по 3 неспаренных электрона и могут образовывать молекулы с тремя атомами водорода (например, аммиак). Правильный ответ- 2.
Задание №8.
В порядке возрастания неметаллических свойств элементы расположены в ряду:
1. B → C → N → O
2. Cl → S → P → Si
3. O → S → Se → Te
4. N → P → As → Sb
Объяснение: неметаллические свойства усиливаются в группе снизу вверх и в периоде слева направо. В периоде слева направо расположены элементы в варианте ответа 1. Правильный ответ -1.
Задание №9.
Верны ли следующие суждения о галогенах?
А. Хлор в соединениях проявляет как положительную, так и отрицательную степени окисления
Б. При нормальных условиях йод является жидкостью
1. Верно только А
2. Верно только Б
Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: у хлора на внешнем уровне 7 валентных электронов. Он может отдать все или несколько, либо принять один электрон. Следовательно, А — верно, а вот йод при нормальных условиях является кристаллами фиолетового цвета. Правильный ответ — 1.
Задание №10.
Оксиды состава Э2О3 и Э2О5 образуют
1. Азот и йод
2. Сера и селен
3. Углерод и кремний
4. Бром и бор
Объяснение: атомы искомых элементов должны проявлять степени окисления +3 и +5, то есть должны находиться минимум в пятой группе (или в седьмой, как йод). Правильный ответ — 1.
Автор решения — Лунькова Е.Ю.
Задания для самостоятельной работы.
1. Неметаллические свойства элементов усиливаются в ряду:
1. Cl → S → P → Si
2. N → P → As → Se
N → P → As → Se
3. B → C → N → O
4. C → Si → P → N
2. В ряду элементов Be → B → C → N
1. Уменьшается число электронных слове в атомах
2. Увеличивается число электронов на внешнем энергетическом уровне атома
3. Возрастают радиусы атомов
4. Усиливаются металлические свойства
3. Кислотные свойства водородных соединений усиливаются в ряду
1. HF → HCl → HBr → HI
2. HI → HBr → HCl → HF
3. HF → h3O → Nh4 → Ch5
4. HCl → h3S → Ph4 → Sih5
4. Высший оксид состава ЭО2 образуют все элементы
1. 4 периода
2. IIА-группы
3. IVА-группы
4. 2 периода
5. Неметаллические свойства наиболее выражены у
1. Кремния 2. Углерода 3. Кислорода 4. Фосфора
6. Характер оксидов в ряду Na2O → MgO → Al2O3
изменяется от
1. Основного к кислотному
2. Основного к амфотерному
3. Амфотерного к кислотному
4. Кислотного к амфотерному
7. Наиболее ярко выраженные неметаллические свойства проявляет
Наиболее ярко выраженные неметаллические свойства проявляет
1. Хлор 2. Бор 3. Фосфор 4. Бром
8. Верны ли следующие суждения о магнии и его соединениях?
А. Высшая степень окисления магния в соединениях равна +2
Б Гидроксид магния проявляет основные свойства
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
9. Соединения состава КЭО2 и КЭО3 образует элемент
1. Азот 2. Фосфор 3. Сера 4. Марганец
10. Соединения состава Na2ЭО4 образует каждый из двух элементов
1. Сера и хлор
2. Сера и хром
3. Хром и азот
4. Фосфор и хлор
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
Какой элемент имеет самый металлический характер?
Последняя обновленная дата: 01 -го апреля 2023
•
Общее представление: 193,5K
•
Просмотры сегодня: 2,67K
Ответ
Проверено
193. 5K+ виды
5K+ виды
HINT: 9003 содержит все химические элементы, сгруппированные в группы (вертикальные столбцы) и периоды (горизонтальные строки) в соответствии с их атомными номерами. Такое расположение приводит к ряду тенденций в химических свойствах элементов, что упрощает сравнение.
Полный ответ:
Элементы, размещенные в современной таблице Менделеева, показывают периодичность появления определенных свойств.
Большинство элементов периодической таблицы представляют собой металлы (мягкие или твердые) и занимают левую часть таблицы. Справа мы находим металлоиды, за которыми следуют неметаллы.
Металлы можно сравнивать друг с другом по их способности проявлять реакции. Некоторые металлы вступают в бурные реакции с воздухом, водой и кислотами. Некоторые металлы демонстрируют эндотермические реакции, которые кинетически очень медленны. Такие наблюдения основаны на реакционной способности металлов, которая определяется их металлическим характером.
Металлический характер – это способность металла легко вступать в реакцию, т.е. легко терять электроны. Металл должен быть сильно электроположительным по своей природе, должен иметь большой размер, низкую энтальпию ионизации и менее эффективный ядерный заряд. Все эти факторы вместе взятые делают металл очень реакционноспособным.
Энтальпия ионизации уменьшается при движении вниз по группе и увеличивается слева направо в периоде, размер увеличивается вниз по группе и уменьшается по периоду. Таким образом, общий металлический характер находится высоко в крайнем левом нижнем углу периодической таблицы. Первая группа щелочных металлов представляет собой наиболее металлические элементы, причем франций имеет самый высокий металлический характер, поскольку он находится в самом низу.
Следовательно, франций \[Fr\] является наиболее металлическим элементом, за которым следует цезий \[Cs\] .
Примечание:
Тенденция уменьшения эффективного заряда ядра соответствует той же тенденции, что и энтальпии ионизации, а тенденция энтальпии ионизации является следствием уменьшения эффективного заряда ядра.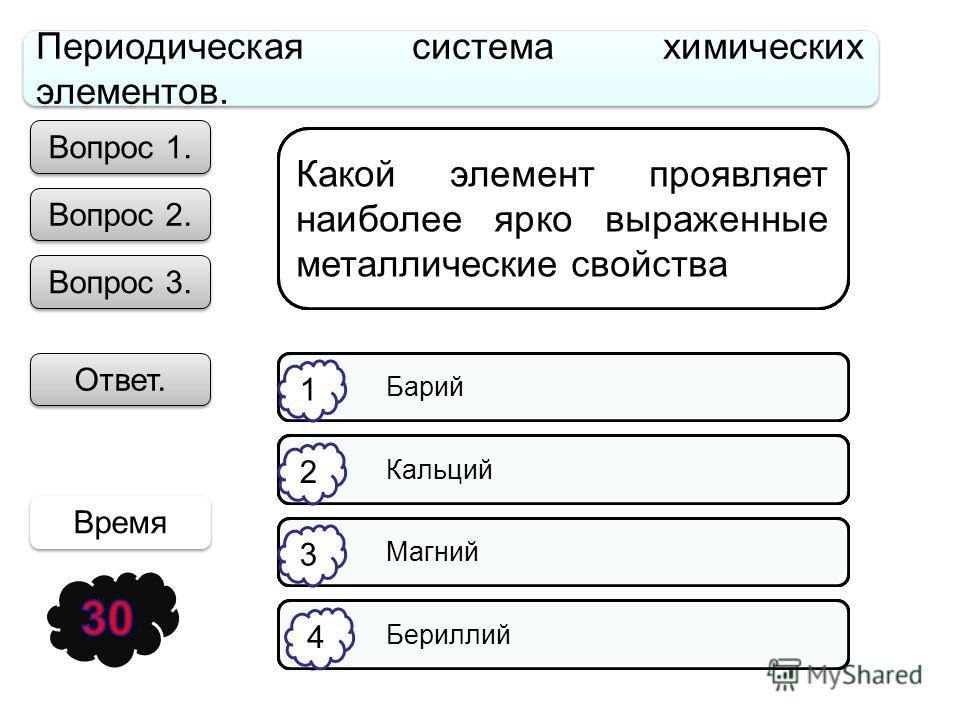 Электроположительность зависит как от размера, так и от энтальпии ионизации.
Электроположительность зависит как от размера, так и от энтальпии ионизации.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Элемент группы азота | Свойства, использование и список
- Связанные темы:
- азот фосфор мышьяк висмут сурьма
См. все связанные материалы →
все связанные материалы →
элемент группы азота , любой из химических элементов, составляющих группу 15 (Va) периодической таблицы. Группа состоит из азота (N), фосфора (P), мышьяка (As), сурьмы (Sb), висмута (Bi) и московия (Mc). Элементы имеют определенное общее сходство в химическом поведении, хотя химически они четко отличаются друг от друга, и это сходство отражает общие черты электронной структуры их атомов.
Наверное, никакая другая группа элементов не знакома неспециалисту так, как эта группа. Хотя шесть элементов вместе составляют менее 0,2 процента веса земной коры, их значение далеко не соответствует их изобилию. Особенно это относится к элементам азоту и фосфору, которые составляют соответственно 2,4 и 0,9 процента от общей массы тела человека.
Элементы азота имеют, пожалуй, самый широкий диапазон физического состояния среди всех групп периодической таблицы. Азот, например, представляет собой газ, который сжижается при температуре около -200 °C и замерзает при температуре около -210 °C, тогда как висмут представляет собой твердое вещество, плавящееся при 271 °C и кипящее при температуре около 1560 °C.
Вместе с углеродом, водородом, кислородом и серой первые два члена этой группы, азот и фосфор, являются основными химическими элементами, включенными в живые системы. Азот и фосфор легко удаляются из почвы при росте растений и поэтому являются чрезвычайно важными компонентами растительной пищи. Такие обозначения, как «5–10–5» на коммерческих удобрениях, представляют собой соответствующий массовый процентный состав материала с точки зрения азота, оксида фосфора и оксида калия (калий является третьим основным элементом, необходимым для здорового роста растений). Азот в удобрениях может быть в виде нитратов натрия или калия, аммиака, солей аммония или различных органических соединений. Фосфор поставляется главным образом в виде неорганического фосфата.
Азот и фосфор легко удаляются из почвы при росте растений и поэтому являются чрезвычайно важными компонентами растительной пищи. Такие обозначения, как «5–10–5» на коммерческих удобрениях, представляют собой соответствующий массовый процентный состав материала с точки зрения азота, оксида фосфора и оксида калия (калий является третьим основным элементом, необходимым для здорового роста растений). Азот в удобрениях может быть в виде нитратов натрия или калия, аммиака, солей аммония или различных органических соединений. Фосфор поставляется главным образом в виде неорганического фосфата.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Те же самые элементы, азот и фосфор, могут быть использованы менее полезными для человека способами. Взрывчатые вещества в обычной войне сильно зависят от содержания в них соединений азота, а смертоносные нервно-паралитические газы состоят из органических соединений фосфора.
С другой стороны, мышьяк, известный своей токсичностью, наиболее полезен в сельском хозяйстве, где его соединения помогают бороться с вредными насекомыми-вредителями. Сурьма и висмут используются в основном в металлических сплавах, потому что они придают этим сплавам уникальные и желаемые свойства.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Сравнительная химия
Электронные конфигурации
Сходства в орбитальном расположении
В периодической таблице каждый из элементов группы азота занимает пятую позицию среди основных элементов группы своего периода, позицию, обозначенную 15. Что касается электронной конфигурации его атомов, каждый элемент группы азота обладает внешней оболочкой из пяти электроны. В каждом случае они занимают внешние s орбиталь полностью (с двумя электронами) и вносит по одному электрону на каждую из трех внешних p орбиталей (орбитали представляют собой электронные области внутри атома и буквенные обозначения, s, p, d и f , используемый для обозначения различных классов орбиталей).
Другое сходство между азотистыми элементами заключается в существовании неподеленной, или одинокой, пары электронов, которая остается после образования трех ковалентных связей или их эквивалента. Эта неподеленная пара позволяет молекуле действовать как донор электронной пары при образовании молекулярных аддитивных соединений и комплексов. Доступность неподеленной пары зависит от различных факторов, таких как относительный размер атома, его частичный заряд в молекуле, пространственные характеристики других групп в молекуле и еще плохо изученное явление, называемое «инертной парой».

Leave A Comment