Тест 3. Строение атома
Инструкция
— Выберите один из вариантов в каждом из 24 вопросов;
— Нажмите на кнопку «Показать результат»;
— Посмотрите на задание. Если ответ правильный, то цвет вопроса остался прежним. Если Вы ошиблись, то цвет вопроса изменился;
— За каждый правильный ответ начисляется 1 балл;
— Оценки: менее 12 баллов — НЕУДОВЛЕТВОРИТЕЛЬНО, от 12 но менее 18 — УДОВЛЕТВОРИТЕЛЬНО, 18 и менее 24 — ХОРОШО, 24 — ОТЛИЧНО;
— Чтобы сбросить результат тестирования, нажмите кнопку «Сбросить ответы».
Тест 3. Строение атома
-
возрастают
убывают
не изменяются
сначала уменьшаются, потом увеличиваются -
2s22p4
2s22p2
2s22p6
3s23p4 -
1s22s22p63s2
1s22s22p6
1s22s22p63s23p3
1s22s22p63s23p5 -
Na, Mg, Al
K, Ca, Fe
Mg, Ca, Ba
Sc, Ca, Mg -
Na, Mg, Al, Si
Li, Be, B, C
F, O, N, C
P, S, Cl, Ar -
число валентных электронов в атомах
атомный радиус элементов
электроотрицательность элементов
кислотные свойства гидроксидов -
Be, B, C, N
Rb, K, Na, Li
Mg, Al, Si, P
O, S, Se, Te -
Cl, S, P, Si
B, C, O, F
C, Si, Ge, Sn -
C, N, O
Si, Al, Mg
Mg, Ca, Ba
P, S, Si -
возрастает
ослабевает
не изменяется
изменяется периодически -
ослабевает
не изменяется
изменяется периодически
возрастает -
не изменяются
ослабевают
изменяются периодически
усиливаются -
уменьшается число электронных слоев в атомах
уменьшается число протонов в ядрах атомов
увеличивается число валентных электронов в атомах
увеличиваются радиусы атомов -
ослабевают
не изменяются
изменяются периодически
усиливаются -
низшая степень окисления
высшая степень окисления
радиус атома -
N
As
Bi
P -
числом нейтронов
числом электронов
числом протонов
зарядом ядра -
1s22s22p1
1s22s2
1s22s22p63s23p1
1s22s22p63s1 -
серы
хлора
селена
брома -
железа
кальция
углерода
серы -
Na+ и Ar
F— и Ne
S2- и Ar
Mg2+ и S -
Н2О
H2S
NH
PH3 -
Li
Be
B
S -
брома
мышьяка
олова
бария
Ответы на контрольную работу по теме «Галогены» (Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме фтора:
В. 2е, 7е.
2. Из перечисленных химических элементов наименьший атомный радиус у атома:
В. Фтора.
3. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает атом:
В. Фтора.
4. Положение элемента брома в Периодической системе:
В. 4-й период, главная подгруппа VII группы.
5. Из перечисленных веществ наиболее ярко выраженные окислительные свойства имеет:
Б.Фтор.
6. Агрегатное состояние хлора при обычных условиях:
А. Газообразное.
7. Химическая связь в молекуле фтора:
Б. Ковалентная неполярная.
8. Пара формул веществ, в каждом из которых связь только ковалентная неполярная:
В.С12, Н2.
9. Раствор фтора в воде приготовить нельзя, так как:
Г. Фтор взаимодействует с водой.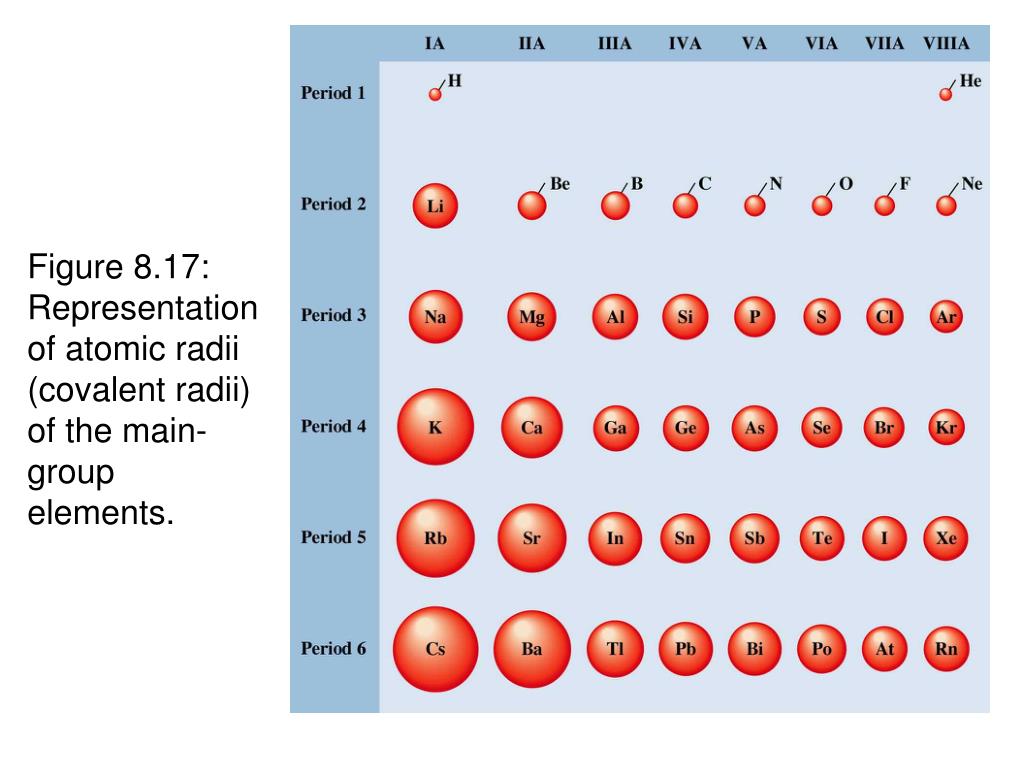
10. Хлор взаимодействует с раствором вещества, формула которого:
Б. NaBr.
ЧАСТЬ Б. Задания со свободным ответом
11. Приведите примеры соединений иода, в которых он образует ковалентную неполярную, ковалентную полярную и ионную связь. Ответ иллюстрируйте схемами образования химических связей.
I2 :Ï̤: Ï̤:
HI H: Ï̤:
KI K-[ I ]+
12. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cl2 -> НС1 -> NaCl ->AgCl.
Реакцию 1 рассмотрите с точки зрения ОВР.
Cl20 + h30 = 2H+Cl-
Cl02 + 2*1e = 2Cl- окислитель
h30 – 2*1e = 2H+ восстановитель
HCl + NaOH = NaCl + h3O
NaCl + AgNO3 = AgCl↓ + NaNO3
13. Как распознать растворы хлорида калия и нитрата калия? Запишите молекулярное, полное и сокращенное ионные уравнения.
Добавить нитрат серебра, в пробирке с хлоридом калия выпадет белый осадок.
КCl + AgNO3 = AgCl↓ + КNO3
К+ +Cl- + Ag+ +NO3- = AgCl↓ + К+ +NO3-
Cl- + Ag+ = AgCl↓
14. Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов.
Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов.
По схеме реакции
NaF(T) + h3S04(KOh5) —> NaHS04 + HF↑
рассчитайте массу галогеноводорода, полученного из 2 моль фторида натрия.
n (HF) = n (NaF) = 2 моль
m (НF) = 2моль*20 г/моль = 40 г
15. Запишите название и формулу вещества, которое применяют для обеззараживания воды, отбеливания ткани и бумаги.
хлор (Cl2)и его соединения.
Хлорная известь, хлорка: Ca(OCl)2•CaCl2•Ca(OH)2•2h3O
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме хлора:
Г. 2е, 8е, 7е.
2. Из перечисленных химических элементов наибольший атомный радиус у атома:
Б. Иода.
3. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает атом:
Б. Иода.
4. Положение элемента хлора в Периодической системе:
Б. 3-й период, главная подгруппа VII группы.
3-й период, главная подгруппа VII группы.
5. Из перечисленных веществ наиболее ярко выраженные восстановительные свойства имеет:
Б. Иод.
6. Агрегатное состояние фтора при обычных условиях:
А. Газообразное.
7. Химическая связь в молекуле иода:
Б. Ковалентная неполярная.
8. Пара формул веществ, в каждом из которых связь только ковалентная полярная:
Б. НС1, НВг.
9. Название галогена, который был применен в боевых условиях как отравляющее вещество:
Г. Хлор.
10. Бром не взаимодействует с веществом, формула которого:
А. NaCl(p-p).
ЧАСТЬ Б. Задания со свободным ответом
11. Приведите примеры соединений хлора, в которых он образует ковалентную неполярную, ковалентную полярную и ионную связь. Ответ иллюстрируйте схемами образования химической связи.
12. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaCl -> Cl2 -> CuCl2 ->AgCl.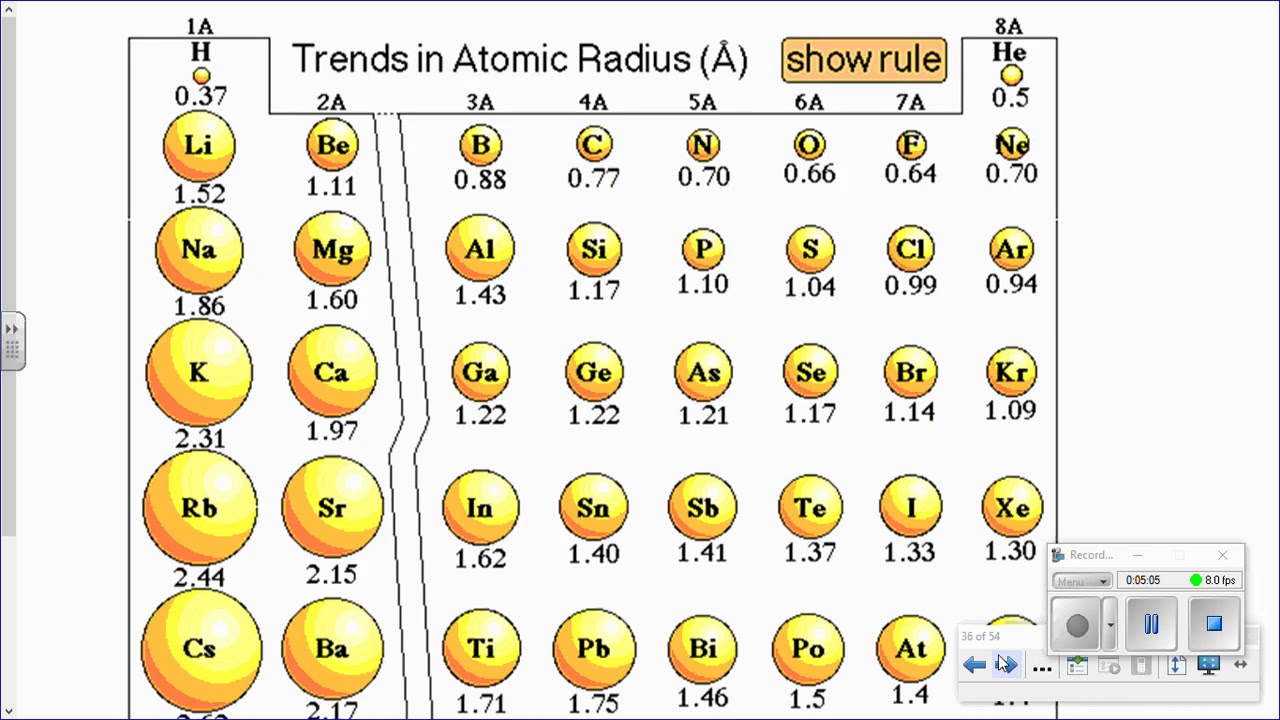
Реакцию 1 рассмотрите с точки зрения ОВР.
1. 2NaCl + 2h3О –> h3 + Cl2 + 2NaOH
Анод: 2Cl(-) — 2е (-) –> Cl2(0)
Катод: 2h3O + 2e(-) –> h3 + 2OH(-)
2. Cl2 + Cu = CuCl2
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
13. Как распознать растворы бромида натрия и нитрата натрия? Запишите молекулярное, полное и сокращенное ионные уравнения.
Реакция с нитратом серебра. В пробирке с бромидом выпадет осадок.
NaBr + AgNO3 = AgBr↓ + NaNO3
Na+ +Br- + Ag++NO3- = AgBr↓ + Na+ + NO3-
Ag+ + Br-= AgBr↓
14. Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов.
По схеме
NaI(T) + h3S04(KOHЦ) —► NaHS04 + Hl↑
рассчитайте массу галогеноводорода, полученного из 1,5 моль иодида натрия.
n (HI) = n (NaI) = 1,5 моль
m (HI) = 1,5моль*127 г/моль = 190,5 г
15. Запишите название и символ галогена, соединения которого используют для успокоения нервной системы.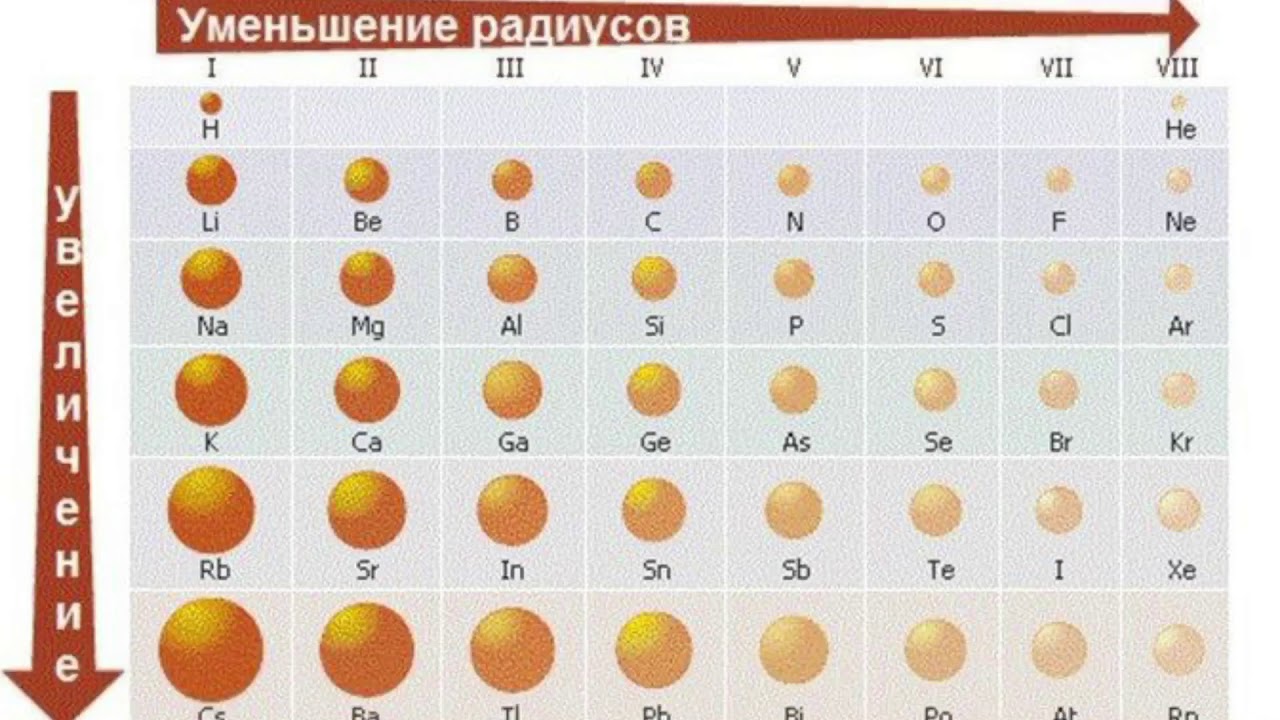
бром, Br2
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме брома:
В. 2е, 8е, 18е, 7е.
2. Из перечисленных химических элементов наибольший радиус у атома:
Б. Иода.
3. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает атом:
Б. Иода.
4. Положение элемента фтора в Периодической системе:
А. 2-й период, главная подгруппа VII группы.
5. Из перечисленных веществ наименее выраженные окислительные свойства имеет:
Б. Иод.
6. Агрегатное состояние иода при обычных условиях:
В. Твердое.
7. Химическая связь в молекуле брома:
Б. Ковалентная неполярная.
8. Пара формул веществ, в каждом из которых связь в молекулах только ионная:
В. NaCl, KBr.
9. Свойство, не характерное для фтора:
В. Самый пассивный.
Самый пассивный.
10. Хлор взаимодействует с веществом, формула которого:
Г. Н2.
ЧАСТЬ Б. Задания со свободным ответом
11. Приведите примеры соединений брома, в которых он образует ковалентную неполярную, ковалентную полярную и ионную связь. Ответ иллюстрируйте схемами образования химической связи.
12. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:
HBr -> КВг -> Вг2 -> СаВг2.
Реакцию 2 рассмотрите с точки зрения ОВР.
1. 2HBr + 2K = 2KBr + h3
2. 2KBr- + Cl02 = KCl- + Br02
Cl2(0) + 2е (-) –> 2Cl (-)
2Br(-) — 2е (-) –> Br2(0)
3.
13. Как распознать растворы иодида натрия и нитрата натрия? Запишите молекулярное, полное и сокращенное ионные уравнения.
Реакция с нитратом серебра – качественная реакция на хлорид-, бромид- и иодид-ионы. Осадок иодида серебра – желтого цвета.
NaI + AgNO3 = AgI↓+ NaNO3
Na+I- + Ag+NO3- = AgI↓+ Na+NO3-
I- + Ag+ = AgI↓
14. Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов.
Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов.
По схеме
NaBr(T) + h3S04(KOHЦ) > NaHS04 + HBr↑
рассчитайте массу галогеноводорода, полученного из 0,5 моль бромида натрия.
n (HBr) = n (NaBr) = 0,5 моль
m (HBr) = 0,5моль*80 г/моль = 40 г
15. Запишите название и символ галогена, соединения которого добавляют в зубную пасту для предупреждения кариеса зубов.
F2 фтор
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме иода:
В. 2е, 8е, 18ё, 18е, 7е.
2. Из перечисленных химических элементов наибольший радиус у атома:
Б. Иода.
3. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает атом:
Б. Иода.
4. Положение элемента иода в Периодической системе:
Г. 5-Й период, главная подгруппа VII группы.
5. Из перечисленных веществ наиболее выраженные восстановительные свойства имеет:
Б. Иод.
6. Агрегатное состояние брома при обычных условиях:
Б. Жидкое.
7. Химическая связь в молекуле хлора:
Б. ковалентная неполярная.
8. Пара формул веществ, в каждом из которых связь только ковалентная полярная:
Б. HI, S02.
9. Спиртовой раствор этого галогена применяют для обработки ран:
Б. Иод.
10. Бром взаимодействует с веществом, формула которого:
В. Н2.
ЧАСТЬ Б. Задания со свободным ответом
11. Приведите примеры соединений фтора, в которых он образует ковалентную неполярную, ковалентную полярную и ионную связь. Ответ иллюстрируйте схемами образования химической связи.
12. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить превращения:
HI -> KI -> I2 ->АLI3.
Реакцию 2 рассмотрите с точки зрения ОВР.
1. HI + KOH = KI + h3O
2. 2KI- + Cl02 = 2KCl- + I02
2KI- + Cl02 = 2KCl- + I02
2I(-) — 2е (-) –> I2(0)
Cl2(0) + 2е (-) –> 2Cl (-)
3. 3I2 + 2Al = 2AlI3
13. Как распознать растворы бромида натрия и нитрата натрия? Запишите молекулярное, полное и сокращенное ионные уравнения.
Реакция с нитратом серебра – качественная реакция на хлорид-, бромид- и иодид-ионы. Осадок бромида серебра -бледно-желтого цвета.
NaBr + AgNO3 = AgBr↓+ NaNO3
Na+ +Br- + Ag++NO3- = AgBr↓ + Na+ + NO3-
Ag+ + Br-= AgBr↓
14. Галогеноводороды в лаборатории получают путем взаимодействия концентрированной серной кислоты с галогенидами металлов. По схеме
NaCl(T) + h3S04(KOHЦ) —► NaHS04 + HCl↑
рассчитайте массу галогеноводорода, полученного из 3 моль хлорида натрия.
n (HCl) = n (NaCl) = 3 моль
m (HCl) = 3моль*36,5 г/моль = 109,5 г
15. Запишите название и символ галогена, соединения которого добавляют в поваренную соль для профилактики заболеваний щитовидной железы.
Йод I2
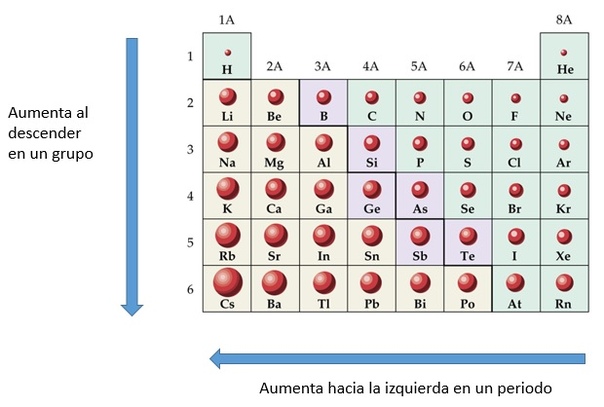
Видео с вопросом: Выбор элемента с наибольшим атомным радиусом
Стенограмма видео
Какой из следующих элементов имеет
наибольший атомный радиус в периодической таблице? (А) Медь, (Б) цезий, (В)
литий, (D) неон или (E) магний.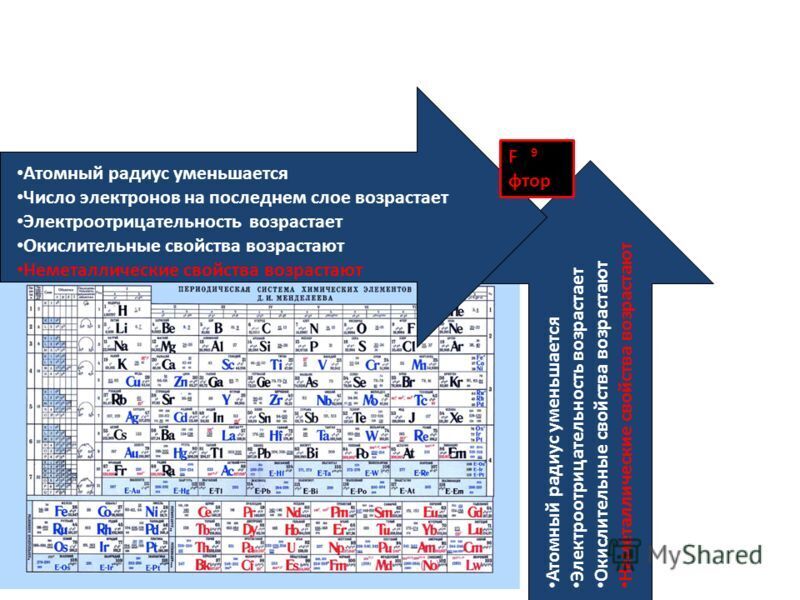
Атомный радиус – это величина, которая определяет размер атома. Ковалентный атомный радиус может быть определяется по длине ковалентной связи между двумя атомами. Но нам не нужно знать значение ковалентного атомного радиуса, чтобы ответить на этот вопрос. Вместо этого мы можем использовать периодический таблица для предсказания относительного атомного радиуса атомов каждого элемента. Сравним атом лития и атом неона, два элемента, обнаруженные в один и тот же период на периодической стол.
Атом лития имеет три
протоны и три электрона. Протоны находятся в
ядро атома лития. Два электрона находятся в
первая электронная оболочка. И один электрон находится во втором
электронная оболочка. Атом неона имеет 10 протонов и
10 электронов. 10 протонов находятся в
ядро атома неона. Два электрона находятся в
первая электронная оболочка.
Глядя на две диаграммы, мы
можно подумать, что атом неона больше атома лития, потому что атом
у неона больше электронов. Мы также видим, что оба атома имеют
одинаковое количество электронных оболочек. Таким образом, мы могли бы подумать, что атомы
имеют одинаковый размер. Но давайте рассмотрим самые внешние
электроны. Самые внешние электроны в каждом
атом будет испытывать аналогичную силу отталкивания от внутренних электронов. Однако внешний электрон неона
испытывает большую силу притяжения к 10-положительному ядру, чем внешнее
электрон лития, который притягивается к трехположительному ядру. Таким образом, атом неона меньше
чем атом лития, потому что внешние электроны неона притягиваются ближе к
ядра, чем внешние электроны лития. В общем, мы находим, что атомный
радиус увеличивается по мере того, как мы движемся справа налево по таблице Менделеева.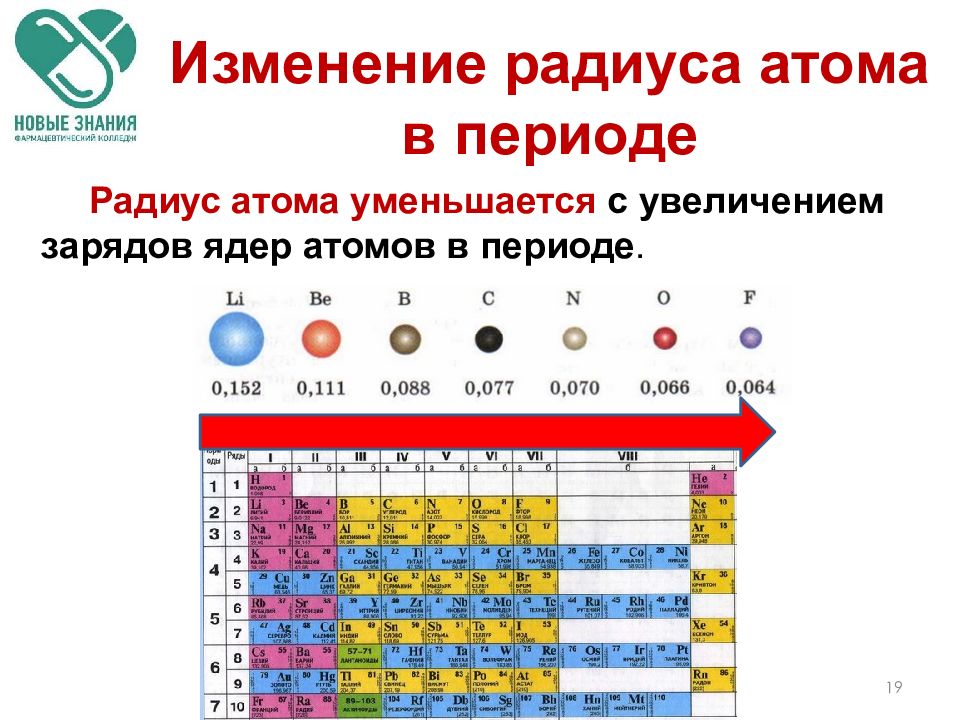
Теперь давайте сравним атом литий к атому калия, два элемента, которые находятся в одной группе на периодическая таблица. Атом калия имеет 19 протонов и 19 электронов. 19 протонов находятся в ядро атома калия. Два электрона находятся в первая электронная оболочка. Восемь электронов находятся в вторая и третья электронные оболочки. И один электрон находится в четвертом электронная оболочка.
Основываясь на наших предыдущих рассуждениях, мы
можно предположить, что поскольку ядерный заряд в атоме калия больше заряда
ядерный заряд в атоме лития, что атомы калия должны быть меньше. Но у атома калия больше
электронных оболочек, чем у атома лития. Это означает, что крайняя
электрон в атоме калия находится дальше от ядра и их больше
электронов между внешним электроном и ядром.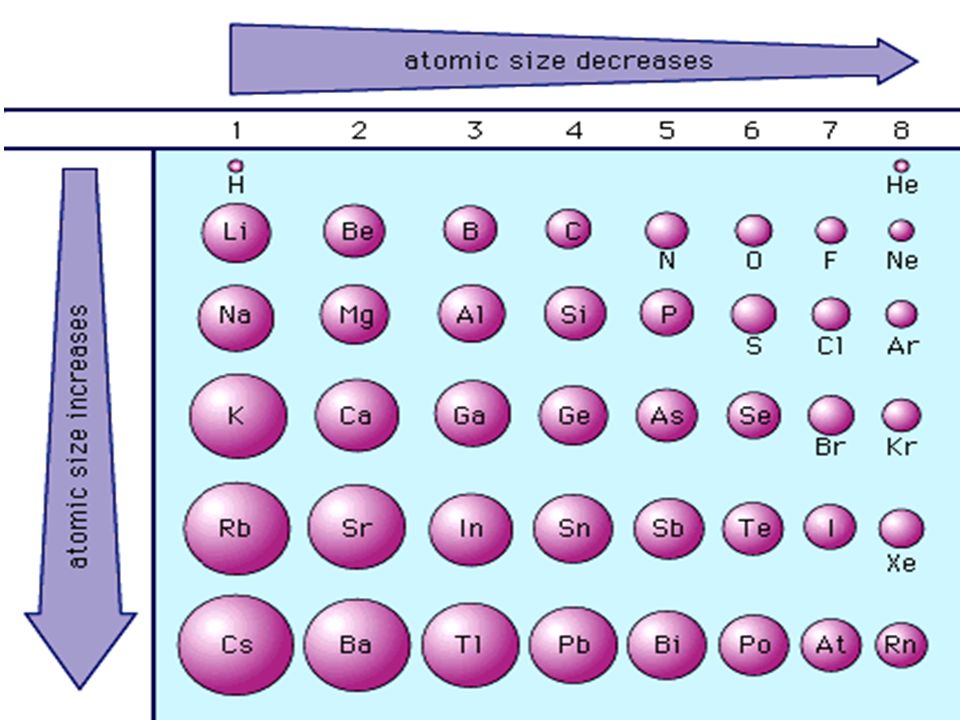
Увеличенное расстояние и электронное экранирование от внутренних электронов перевешивает увеличение ядерной заряжать. Таким образом, атом калия больше, чем атом лития. В общем, мы находим, что атомный радиус увеличивается по мере продвижения вниз по группе. Теперь мы можем использовать периодическую таблицу определить, какой из перечисленных элементов имеет наибольший атомный радиус. Осталось найти, какой из элементов находится дальше всех влево и вниз в периодической таблице.
Мы видим, что данный ответ варианты, цезий, химический символ CS, самый левый и нижний на периодическая таблица. Таким образом, вариант ответа, имеющий наибольший атомный радиус в периодической таблице имеет (B) цезий.
Предметный тест GRE: Справка по химии
Учащиеся, нуждающиеся в помощи по предметному тесту GRE: химия, получат большую пользу от нашей интерактивной программы.
При поступлении в аспирантуру в качестве студента-химика от вас могут потребовать сдать предметный тест GRE по химии в дополнение к общему экзамену GRE. Предметный тест GRE по химии состоит из очень специализированного предмета, охватываемого более чем 130 вопросами с несколькими вариантами ответов. Этот сложный экзамен фокусируется на четырех традиционных областях изучения химии, включая аналитическую химию, неорганическую химию, органическую химию и физическую химию. Студенты обычно проводят много часов в библиотеке, изучая книги и учебные материалы, чтобы подготовиться к предметному тесту GRE по химии.
Инструмент Learn by Concept предлагает вам настраиваемый учебный процесс, включая тестовую практику с конкретным концептуальным изучением в четырех традиционных областях, указанных ранее. Идя еще дальше, у вас есть возможность изучать еще более узкие понятия в подтемах в рамках каждого из этих четырех предметов. Например, в рамках предмета аналитической химии есть шесть подтем, включая концепции анализа данных, реакций или твердых веществ, концепции хроматографии, концепции спектроскопии и концепции электрохимического, экологического и других анализов.
Каждый раздел учебного пособия представляет собой интерактивную программу GRE Chemistry Subject Test. В рамках каждого предмета и подтемы есть примеры контрольных вопросов. Примеры вопросов по химии представлены в формате с несколькими вариантами ответов и имитируют фактический предметный тест GRE по химии. За вопросами следуют несколько ответов возможных ответов, а затем следует правильный ответ. Также включено подробное объяснение того, почему этот ответ был выбран как лучший. Порядок ответов с несколькими вариантами ответов меняется каждый раз, когда вы возвращаетесь к практике, дополнительно предоставляя обзор предметного теста GRE по химии, который проверяет ваш уровень знаний материала.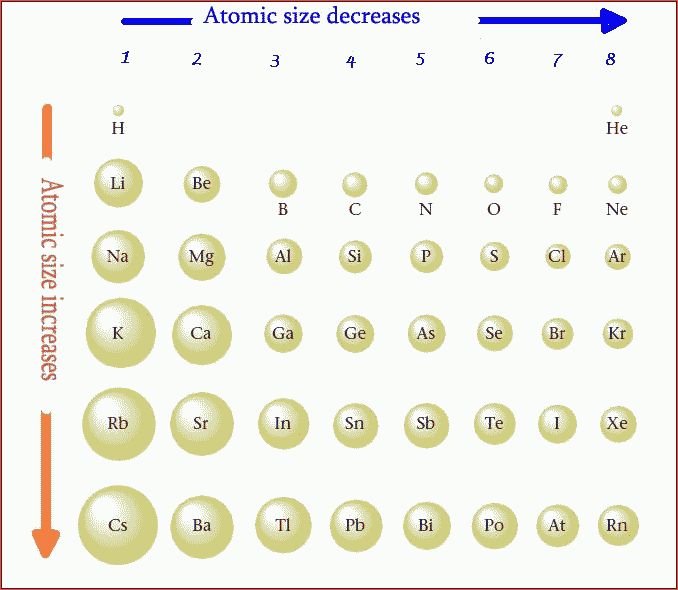

Leave A Comment